A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
שילוב של הכלאה פלואורסצנטית באתרו עם אימונוהיסטוכימיה פלואורסצנטית על חלקי מוח טריים של עכברים קפואים או קבועים
In This Article
Summary
פרוטוקול זה מתאר שיטה לשילוב הכלאה פלואורסצנטית באתרו (FISH) ואימונוהיסטוכימיה פלואורסצנטית (IHC) באזורי מוח עכבר טריים קפואים וקבועים, במטרה להשיג FISH רב-תוויות ואות IHC פלואורסצנטי. IHC התמקד בחלבונים ציטופלזמיים וחלבונים המחוברים לממברנה.
Abstract
הכלאה פלואורסצנטית באתרו (באנגלית: Fluorescent in situ hybridization, בקיצור FISH) היא טכניקה מולקולרית המזהה נוכחות והתפלגות מרחבית של תעתיקי רנ"א ספציפיים בתוך תאים. פנוטיפ נוירוכימי של נוירונים המזוהים פונקציונלית דורש בדרך כלל תיוג מקביל עם נוגדנים מרובים (חלבון מטרה) באמצעות אימונוהיסטוכימיה (IHC) ואופטימיזציה של הכלאה באתרו (RNA ממוקד), במקביל. ניתן להשיג "חתימה נוירוכימית" כדי לאפיין נוירונים מסוימים, אולם גורמים מסובכים כוללים את הצורך לאמת מטרות FISH ו-IHC לפני שילוב השיטות, והמספר המוגבל של רנ"א וחלבונים שניתן לכוון בו זמנית באותו מקטע רקמה.
כאן אנו מתארים פרוטוקול, המשתמש הן בתכשירים טריים קפואים והן בתכשירי מוח קבועים של עכברים, אשר מזהה מספר mRNA וחלבונים באותו אזור במוח באמצעות RNAscope FISH ואחריו פלואורסצנטיות immunostaining, בהתאמה. אנו משתמשים בשיטה המשולבת כדי לתאר את דפוס הביטוי של mRNA בשפע נמוך (למשל, קולטן גלנין 1) ו-mRNA בשפע גבוה (למשל, טרנספורטר גליצין 2), בגרעיני גזע המוח המזוהים אימונוהיסטוכימית.
שיקולים מרכזיים לסימון חלבונים במורד הזרם של בדיקת FISH מתרחבים מעבר להכנת רקמות ואופטימיזציה של תיוג בדיקת FISH. לדוגמה, מצאנו כי קשירת נוגדנים וספציפיות התיוג יכולים להיות מושפעים לרעה על ידי שלב פרוטאז בתוך בדיקת FISH. פרוטאזות מזרזות פיצול הידרוליטי של קשרים פפטידיים, ומקלות על כניסת גשושיות FISH לתאים, אולם הן עשויות גם לעכל את החלבון הממוקד על ידי בדיקת IHC שלאחר מכן, ולייצר קשירת מטרה. המיקום התת-תאי של חלבון המטרה הוא גורם נוסף התורם להצלחת IHC לאחר בדיקת FISH. ראינו שספציפיות IHC נשמרת כאשר חלבון המטרה קשור לממברנה, בעוד שהתמקדות IHC בחלבון ציטופלזמי דרשה פתרון בעיות נרחב. לבסוף, מצאנו שהטיפול ברקמה קפואה קבועה המותקנת במגלשה מאתגר יותר מרקמה קפואה טרייה, אולם איכות IHC הייתה בסך הכל טובה יותר עם רקמה קפואה קבועה, בשילוב עם RNAscope.
Introduction
חלבונים ו-mRNA המגדירים באופן נוירוכימי תת-אוכלוסיות של תאי עצב מזוהים בדרך כלל עם שילוב של אימונוהיסטוכימיה (IHC) ו/או הכלאה באתרו (ISH), בהתאמה. שילוב ISH עם טכניקות IHC מאפשר אפיון של דפוסי קולוקליזציה ייחודיים לנוירונים פונקציונליים (קידוד נוירוכימי) על ידי מקסום יכולת התיוג המרובה.
שיטות ISH פלואורסצנטיות (FISH), כולל RNAscope, הן בעלות רגישות וספציפיות גבוהות יותר בהשוואה לשיטות גילוי RNA מוקדמות יותר כגון ISH רדיואקטיבי ו- ISH כרומוגני לא רדיואקטיבי. FISH מאפשר הדמיה של תעתיקי mRNA בודדים ככתמים מוכתמים מנוקבים1. יתר על כן, בדיקת RNAscope מאפשרת לסמן מספר גדל יותר של מטרות RNA בכל פעם, באמצעות תגי פלואורופור שונים. למרות יתרונות אלה, מגבלות טכניות עשויות להשפיע על מספר הפלואורופורים/כרומוגנים שניתן להשתמש בהם בניסוי יחיד. אלה כוללים זמינות של ערכות מסנני מיקרוסקופ; שיקולים אלה מתעצמים כאשר זיהוי נוירוכימי משתמש בשילוב FISH ו-IHC, בהשוואה לשימוש בכל טכניקה בנפרד, שכן צעדים אינהרנטיים אופטימליים לשיטה אחת עלולים להזיק לאחרת.
יישום קודם של FISH בשילוב עם IHC הדגים ביטוי של מטרות תאיות ספציפיות בלימפומות של תאי B אנושיים2, עוברי אפרוחים3, עוברי דגי זברה4, רשתית עכבר5 ותאי אוזן פנימיתשל עכבר 6. במחקרים אלה, הכנת רקמות הייתה או פרפין קבוע פורמלין משובץ (FFPE) 2,3,5 או הר שלם טרי 4,6. מחקרים אחרים יישמו רנ"א כרומוגני על תכשירי מוח קבועיםשל עכברים וחולדות 7,8,9. בפרט, Baleriola et al.8 תיאר שתי תכשירי רקמות שונים עבור ISH-IHC משולב; קטעי מוח קבועים של עכבר ומקטעי מוח אנושיים מסוג FFPE. בפרסום שפורסם לאחרונה, שילבנו FISH ו-IHC פלואורסצנטי על מקטעים קפואים טריים, כדי להמחיש בו זמנית mRNA בשפע נמוך (קולטן גלנין 1, GalR1), mRNA בשפע גבוה (גליצין טרנספורטר 2, GlyT2) וחלבון טרנספורטר אצטילכולין שלפוחית (vAChT)10 במבנה הרשתית של גזע המוח.
גרעין מערכת הבידוד (באנגלית: Nucleus of the Solitary tract או NTS) הוא אזור מרכזי במוח המעורב בתפקוד אוטונומי. אוכלוסייה הטרוגנית זו של תאי עצב, הממוקמת במוח האחורי, מקבלת ומשלבת מספר עצום של אותות אוטונומיים, כולל אלה המווסתים את הנשימה. ה-NTS מכיל מספר אוכלוסיות נוירונים, אשר עשויות להיות מאופיינות פנוטיפית על ידי דפוס הביטוי של מטרות mRNA כולל GalR1 ו-GlyT2 וסמנים חלבוניים עבור האנזים טירוזין הידרוקסילאז (TH) וגורם השעתוק Paired-like homeobox 2b (Phox2b).
הבעלים של RNAscope ממליץ על תכשירים טריים של רקמות קפואות, אך רקמות שהוכנו על ידי קיבוע זילוח טרנסקרדיאלי של בעלי חיים שלמים, יחד עם הגנה קריוגנת לטווח ארוך (אחסון ב -20 מעלות צלזיוס) של חלקי רקמות קפואות קבועות, נפוצים במעבדות רבות. לפיכך, ביקשנו לקבוע פרוטוקולים עבור FISH בשילוב עם IHC באמצעות תכשירי רקמות קפואות טריות וקבועות. כאן, אנו מספקים חלקי מוח קפואים וקבועים טריים: (1) פרוטוקול לשילוב של FISH ו- IHC פלואורסצנטי (2) תיאור של איכות mRNA ותיוג חלבונים המיוצרים, בעת שימוש בכל תכשיר (3) תיאור של ביטוי GalR1 ו- GlyT2 ב- NTS.
המחקר שלנו גילה כי בשילוב עם מתודולוגיית RNAscope, הצלחת IHC השתנתה בתכשירים טריים קפואים וקבועים מוקפאים, והייתה תלויה בלוקליזציה של חלבוני המטרה בתוך התא. בידינו, תיוג חלבונים הקשורים לממברנה היה תמיד מוצלח. לעומת זאת, IHC עבור חלבון ציטופלזמי דרש פתרון בעיות גם במקרים שבהם החלבון הציטופלזמי בא לידי ביטוי יתר בחיה טרנסגנית (Phox2b-GFP)11. לבסוף, בעוד GalR1 מבוטא בנוירונים שאינם קטכולמינרגיים ב-NTS, ביטוי GlyT2 נעדר ב-NTS.
Protocol
סיכום של שלבי קדם-עיבוד רקמות ניתן למצוא באיור 1. כל ההליכים בוצעו בהתאם לוועדת הטיפול והאתיקה בבעלי חיים של אוניברסיטת ניו סאות 'ויילס בהתאם להנחיות לשימוש וטיפול בבעלי חיים למטרות מדעיות (המועצה הלאומית לבריאות ומחקר רפואי באוסטרליה).
1. הכנת דגימה של רקמת מוח קפואה טרייה
- זילוח Transcardial
- הכינו חיץ פוספט 0.1 M (PB) 0.1 M (2500 U/L), pH 7.5. הפוך קרח יבש אתנול slurry על ידי ערבוב קרח יבש עם אתנול. זו תהיה טמפרטורה של כ -72 מעלות צלזיוס ותשמש להקפאה מיידית של הרקמה שנקטפה.
- המתת חסד של עכברים בוגרים C57BL/6 ו- Phox2b-GFP11 (מזהה מסד נתונים של גנום עכבר MGI:5776545) על ידי הרדמה עם נתרן pentobarbital (70 מ"ג / ק"ג, כלומר באמצעות מד מחט 27.5 אינץ '.
זהירות: Pentobarbital הוא barbiturate. הוא רעיל מאוד במינונים גבוהים ועלול לגרום למוות בדום נשימה. יש להיוועץ בהנחיות בטיחות מקומיות, משפטיות וחומריות לפני השימוש. - לחשוף את הלב ו cannulate החדר השמאלי עם מחט ציור (23 אינץ 'מד). בצע זילוח transcardial עם heparinized 0.1 M PB עד הדם לנקות (2-3 דקות) בקצב זרימה של 11-13 מ"ל / דקה. לקבוע את ניקוי הדם על ידי ניטור צבע הכבד ואת effusate מן אטריום ימין12.
- בודדו את המוח מחלל הגולגולת, הטמיעו אותו מיד בתרכובת טמפרטורת חיתוך אופטימלית (OCT) בנייר אלומיניום או קריומולד והניחו אותו על אמבט אתנול קרח יבש. אחסן את הרקמה המוטבעת הקפואה במיכל אטום ב - 80 ° C למשך עד 3 חודשים.
- חתך של רקמה קפואה טרייה
- הגדר את טמפרטורת הקריוסטט ל -20 מעלות צלזיוס. השאירו את הרקמה המשובצת OCT וצ'אק קריוסטט בהקפאה למשך ~30 דקות כדי לאפשר שיווי משקל לטמפרטורה החדשה.
הערה: שמור את הרקמה קפואה בכל עת; להעביר את הרקמה מהמקפיא -80 מעלות צלזיוס להקפאה על קרח יבש. - הצמידו את הרקמה לצ'אק הקריוסטט המצונן מראש באמצעות תרכובת OCT. בפרוטוקול זה, גושי רקמות הותקנו על הצ'אק במישור העטרה.
הערה: יש לחתוך עודפי OCT מהרקמה, באמצעות סכין גילוח, כדי למזער את כמות ה-OCT שנחתכת על ידי ההקפאה ולאחר מכן מועברת למגלשת הזכוכית. - חתכו קטעי קורונל בעובי 14 מיקרומטר והרכיבו אותם על שקופיות מיקרוסקופיית זכוכית טעונה.
- חממו את המגלשות לטמפרטורת החדר לפני הרכבת המקטעים. לאחר התקנת המקטע, שמור את השקופיות בתיבת שקופיות בהקפאה.
- אם יש צורך להרכיב יותר ממקטע אחד בשקופית אחת, חממו את האזור עבור המקטע השני על ידי הנחת אצבע בצד הנגדי של השקופית למשך 5-10 שניות כדי לסייע בהיצמדות המקטע לשקופית. מקטע רקמה קרה לא יתחבר לשקופית קרה. הקטעים צריכים לדבוק בשקופיות שטוחות; קיפול יגרום להם ליפול מהמגלשות במהלך שלבי השטיפה.
- אם סדקים הם שם לב בסעיפים, להגדיל את טמפרטורת cryostat על ידי 1-5 °C (75 °F) כדי למנוע זאת. חשוב במיוחד למקם מקטעי רקמות בסמיכות זה לזה באותה שקופית. זה ימנע בזבוז של בדיקות FISH ריאגנטים במהלך הבדיקה.
- יש לאחסן חלקי רקמות המותקנים על מגלשות זכוכית במיכל אטום לאוויר בטמפרטורה של -80°C למשך עד 6 חודשים.
הערה: יש לשמור את המקטעים קפואים בכל עת ולהימנע ממחזורי הפשרה בהקפאה, כדי למנוע התפרקות RNA. העבירו את קופסת המגלשה מתוך ההקפאה למקפיא בטמפרטורה של -80°C על קרח יבש.
- הגדר את טמפרטורת הקריוסטט ל -20 מעלות צלזיוס. השאירו את הרקמה המשובצת OCT וצ'אק קריוסטט בהקפאה למשך ~30 דקות כדי לאפשר שיווי משקל לטמפרטורה החדשה.
- קיבוע של רקמה קפואה טרייה
- ביום ביצוע בדיקת FISH, הכינו 4% פרפורמלדהיד (PFA) ב-0.1 M PB, pH 7.5 (תמיסת 4% PFA). סינון על ידי מעבר דרך נייר סינון (דרגה 1: 11 מיקרומטר, רשימת חומרים) במשפך Buchner או כור היתוך.
אזהרה: PFA מזיק ורעיל במגע עם העור או בשאיפה. כל ההליכים עם פתרון PFA צריכים להתבצע בארון מכסה אדים. יש להשליך את פסולת פתרונות PFA בקפידה בהתאם לפרוטוקולי בטיחות מוסדיים. - מצננים את תמיסת ה-4% PFA ל-4°C. העבירו את הרקמה המותקנת במגלשה מהמקפיא בטמפרטורה של -80°C בקרח יבש וטבלו אותה מיד בקיבוע המצונן מראש למשך 15 דקות.
הערה: חשוב ששלב קיבוע זה לא יעלה על 15 דקות מכיוון שקיבוע יתר יגרום לתיוג רקע לא ספציפי.
- ביום ביצוע בדיקת FISH, הכינו 4% פרפורמלדהיד (PFA) ב-0.1 M PB, pH 7.5 (תמיסת 4% PFA). סינון על ידי מעבר דרך נייר סינון (דרגה 1: 11 מיקרומטר, רשימת חומרים) במשפך Buchner או כור היתוך.
- התייבשות של רקמה קפואה טרייה
- יש לייבש את חלקי הרקמה על ידי טבילת השקופיות בריכוזים מדורגים של אתנול. בצנצנת קופלין טובלים תחילה ב-50%, לאחר מכן ב-70% ולבסוף באתנול מוחלט, למשך 5 דקות כל אחד בטמפרטורת החדר. חזור על הדגירה המוחלטת הסופית של אתנול פעם נוספת.
- מגלשות יבשות באוויר ושרטט את קבוצת המקטעים באמצעות עט מחסום הידרופובי, תוך הקפדה על מינימום שמירה על האזור הפנימי.
הערה: ודא שמגלשת הזכוכית יבשה לחלוטין לפני ציור המחסום ההידרופובי. המחסום ההידרופובי צריך להקיף את חלקי הרקמה לחלוטין ללא רווחים וחייב להיות יבש לפני עיבוד נוסף.
2. הכנת דגימה של רקמת מוח קפואה קבועה
- קיבוע זילוח קרום הלב
- המתת חסד עכברים על ידי הרדמה עם נתרן pentobarbital (70 מ"ג / ק"ג, כלומר i.p) ולאחר מכן זילוח transcardial, תחילה עם 0.1 M PB ולאחר מכן 4% PFA פתרון. תקן עם 10 דקות של זילוח ב 11-13 מ"ל / דקה.
- בודדו את המוח מחלל הגולגולת לאחר קיבוע זילוח ושקעו למשך הלילה בתמיסת 4% PFA, בטמפרטורה של 4°C.
- חתך רקמות של רקמה קבועה
- שטפו את המוח במי מלח סטריליים חוצצים פוספט 0.1M (PBS) לפני הסרת שכבות קרום המוח, בעזרת מיקרוסקופ נתיח, באמצעות מלקחיים עדינים.
- חתכו את המוח באופן מדויק לבלוקים (הפרידו את גזע המוח מהמוח הקדמי לפני חיתוך הוויברטום) באמצעות מטריצה מוחית (Table of Materials). באופן ספציפי, חתכו את גזע המוח באופן קאודלי בדיון הפירמידלי ונתחו את המוח הקטן. באופן דומה, לחתוך את המוח הקדמי מיד rostral לכיאזמה אופטית.
- הצמידו את הרקמה לצ'אק מיקרוטום רוטט באמצעות ציאנואקרילט והטמיעו בתמיסת אגר 2%.
- חתכו קטעי רקמה בעובי 30 מיקרומטר באמצעות מיקרוטום רוטט ואחסנו חלקים חתוכים בתמיסה קריופרוטקנטית (30% סוכרוז ללא RNase, 30% אתילן גליקול, 1% פוליוויניל פירולידון (PVP-40), ב-0.1 M PB, pH 7.4). ניתן לאחסן חלקי רקמות בהגנה קריופרוטקטורית בטמפרטורה של -20°C למשך עד 6 חודשים.
- הכנת מקטעים קבועים לפני FISH
- ביום של FISH, לשטוף חלקים צפים חינם שלוש פעמים, במשך 10 דקות לכל שטיפה, כדי להסיר את הפתרון cryoprotectant. כדי לשטוף, מניחים חלקים ב 0.1 M PBS בצלחת תרבית תאים 12 באר ולהתסיס על שייקר פלטפורמה מסתובב (90 - 100 סל"ד).
- לאחר השטיפה, השתמשו במברשת צבע כדי להרכיב חלקים על שקופיות מיקרוסקופ זכוכית וייבשו באוויר למשך שעתיים לפחות.
הערה: החלקים צריכים להיצמד שטוחים לשקופיות מכיוון שכל קיפול בולט יגרום להן להתנתק במהלך הכביסה. - באמצעות עט מחסום הידרופובי, צייר מחסום סביב החלקים כדי להגביל את ריאגנטים FISH לחלקים. שוב, חשוב למזער את השטח הפנימי של קווי המתאר המשורטטים בעט המחסום.
נקודת שבירה אפשרית: ניתן לאחסן את המקטעים בטמפרטורת החדר, למשך הלילה, כדי להמשיך את הבדיקה למחרת.
3. בדיקת דגים
הערה: שאר הפרוטוקול חל הן על רקמות קפואות טריות והן על רקמות קפואות קבועות.
- הכינו את הריאגנטים והמכשירים לשלבי הכלאה והגברה.
- הגדר אינקובטור ספסל ואמבט מים ל -40 מעלות צלזיוס.
- הכינו תא לח ומוגן אור לדגירת שקופיות. לחות מונעת התייבשות של רקמות - שקופיות ממוקמות היטב מעל מאגר לח. באופן אידיאלי, התא עשוי פוליסטירן כבד, הוא עמיד לאור ואטום, כדי לשמור על אווירת אדי מים רוויים. סגירת התא מסתמכת על חיכוך מינימלי כדי למנוע תנועה. השתמשנו בקופסת שקופיות מרופדת במגבוני מעבדה לחים (טבלת חומרים) בתחתית. הניחו את קופסת השקופיות בתוך האינקובטור כדי לחמם אותה מראש ל -40 מעלות צלזיוס.
- חממו את חיץ הכביסה 50x (טבלת חומרים) ואת הבדיקות ל-40°C למשך 10 דקות, באמצעות אמבט המים, ולאחר מכן קררו לטמפרטורת החדר.
- הכינו 1 ליטר של 1x Wash Buffer מריכוז מלאי של 50x.
- הכנת תערובת בדיקה (טבלת חומרים): הגשושית C1 מוכנה לשימוש בריכוז במלאי, בעוד שגשושיות C2 ו-C3 נשלחות בריכוז פי 50 ודורשות דילול עם המדלל המסופק בערכה.
הערה: ניתן לאחסן תערובות בדיקה בטמפרטורה של 4°C למשך עד 6 חודשים.
- טיפול בפרוטאז
- יש לדגור על חלקים עם פרוטאז III (טבלת חומרים) בטמפרטורת החדר למשך 30 דקות.
הערה: ודא כי פרוטאז III וריאגנטים דגירה בתהליכים במורד הזרם (תערובת בדיקה, פתרונות הגברה, חיץ חוסם וסרא נוגדנים) מכסים את החלקים לחלוטין. ניתן להשתמש בקצה פיפט כדי להפיץ את המגיב על החלק כדי לכסות את כל השטח בתוך המחסום ההידרופובי. - שטפו את המגלשות פעמיים עם 0.1 M PBS, למשך 2 דקות בכל פעם, בצלחת פטרי מרובעת גדולה מפלסטיק. כאן נעשה שימוש בצלחת ביו-אסאי מרובעת בגודל 245 מ"מ x 245 מ"מ (טבלת חומרים). מחזיקים מצד אחד של הכלי ומטים בעדינות 3-5 פעמים. לאחר השטיפה, החלק עודף 0.1 M PBS מהשקופית ומיד להוסיף את מגיב הבא. אין לתת לחלקי רקמות להתייבש.
הערה: במהלך כל כביסה, המגלשות שקועות בתמיסה בטמפרטורת החדר. זהו תהליך העבודה עבור כל שלבי הכביסה הבאים. החלקים הקבועים בעובי 30 מיקרומטר נעקרים מהמגלשות בקלות רבה יותר מאשר מקטעים בעובי 14 מיקרומטר, היו עדינים במהלך השטיפות.
- יש לדגור על חלקים עם פרוטאז III (טבלת חומרים) בטמפרטורת החדר למשך 30 דקות.
- הכלאה והגברה
- לאחר שטיפת תמיסת הפרוטאז, הניחו את המגלשות בתא לח שחומם מראש. לדגור חלקים עם תערובת בדיקה (טבלה של חומרים) במשך 2 שעות ב 40 ° C בתוך אינקובטור benchtop.
הערה: ודא שיש לפחות 2 חלקים שהוקצו לבדיקות בקרה חיוביות ושליליות כדי להעריך את איכות הרנ"א הדגימה וחדירה אופטימלית. בדיקות בקרה חיוביות מכוונות לגנים של תחזוקת הבית; כאן, אלה היו קוקטייל של RNA המכוון ליוביקוויטין C (UBC; שפע גבוה), פפטידילפרופיל איזומראז B (PPIB; שפע בינוני) ו-RNA פולימראז 2a (POLR2A; שפע נמוך). בדיקות בקרה שליליות מכוונות לגן החיידק 4-hydroxy-tetrahydrodipicolinate reductase (DapB), אשר בדרך כלל נעדר בדגימות מוח של עכברים. אות DapB חיובי מצביע על אות לא ספציפי ו/או זיהום חיידקי של הדגימה. - לאחר הכלאה עם תערובת הגשושית, שלבי הגברת האות מורכבים מדגירה עם Amp 1-FL (30 דקות), לאחר מכן עם Amp 2-FL (15 דקות), אחריו Amp 3-FL (30 דקות) ולבסוף Amp 4-FL (15 דקות) - כל אחד ב-40°C. באמצעות בקבוקי הטפטפת המסופקים, מכסים את חלקי הרקמה בתמיסת הגברה. המשך לבדיקת IHC לאחר שלב ההגברה האחרון.
- שטפו שקופיות עם Wash Buffer פעמיים במשך 2 דקות בין הכלאת הבדיקה לכל שלב הגברה.
- לאחר שטיפת תמיסת הפרוטאז, הניחו את המגלשות בתא לח שחומם מראש. לדגור חלקים עם תערובת בדיקה (טבלה של חומרים) במשך 2 שעות ב 40 ° C בתוך אינקובטור benchtop.
4. בדיקת IHC
- צעד החסימה של IHC
- כדי למנוע קשירה לא ספציפית של נוגדנים, יש לדגור על המקטעים במשך שעה אחת בטמפרטורת החדר עם תמיסת חסימה המכילה 10% נסיוב סוסים רגיל, 0.3% Tween20 in 1x TBSm (50 mM Tris-Cl, pH 7.5, 150 mM NaCl, 0.05% merthiolate) לאחר בדיקת FISH. הכינו נוגדנים ראשוניים במאגר דילול המכיל 1x TBSm, 5% סרום סוס רגיל ו-0.1% Tween20. ספקי נוגדנים ראשוניים מפורטים בטבלת החומרים.
- אימונוהיסטוכימיה
- הסר את מאגר חסימת העודפים על ידי הזזת המגלשה ודגר על חלקים עם נוגדנים ראשוניים למשך הלילה ב -4 מעלות צלזיוס.
- יש לשטוף את המגלשות 3 פעמים (5 דקות כל אחת) עם 1x TBSm ולדגור עם נוגדן משני בחומר מדלל המכיל 1x TBSm, 1% סרום סוס רגיל ו-0.1% Tween20 למשך שעתיים בטמפרטורת החדר. נוגדנים משניים המשמשים בפרוטוקול זה מפורטים בטבלת החומרים.
- שטפו שקופיות 3 פעמים עם 1x TBSm (5 דקות כל אחת) לפני החלקה באמצעי הרכבה עם או בלי DAPI (Table of Materials).
5. הדמיה
- יש לבחון את הצביעה החיסונית תחת מיקרוסקופ אפיפלואורסצנטי המצויד במצלמה (ראו פירוט בטבלת חומרים ). קבל תמונות מייצגות בהגדלה של 20x ושמור כקובצי TIFF.
- ייצוא תמונות מייצגות לתוכנת עיבוד תמונה (Table of Materials) להתאמת בהירות/ניגודיות כדי להגביר את הבהירות ולשקף עיבוד אמיתי.
6. אופציונלי: ניתוח כמותי של תמלילי היעד
הערה: זהו מאמר שיטות ותוצאות כמותיות אינן מסופקות. שיטת הכימות המוצגת כאן לקוחה מדרלי ואחרים.10.
- קבל תמונות מאזורי העניין כפי שמוסבר ב- 5.1 והחל את אותן הגדרות מיקרוסקופ ומצלמה (כגון זמן חשיפה ועוצמת אור) על כל התמונות של אותו פלואורופור.
- שרטט את הפרופילים העצביים באמצעות תוכנה לניתוח תמונות (Table of Materials).
- יישרו את הקטעים עם התייחסות לרמת ברגמה על פי אטלס מוח סטריאוטקסי13.
- החל את אותה בהירות וניגודיות על כל התמונות של אותו פלואורופור. קחו בחשבון רק את תאי העצב עם גרעינים מוכתמים ב-DAPI.
- ספירה ידנית של מספר mRNA, ביטוי חלבונים, mRNA/mRNA, חלבון/חלבון ותאי mRNA/חלבון המבטאים יחד את האזור המעניין.
- כדי להפחית את ההטיה בתוצאות הניסוי, בקשו מהאדם המכמת את תוצאות הניסוי להיות עיוור לקבוצות הניסוי.
- החל תיקון אברקרומבי14 על ספירת התאים הכוללת באמצעות משוואת אברקומבי הבאה:
ספירת תאים מתוקנת = ספירת תאים ידנית x עובי מקטע / (עובי מקטע + גודל גרעיני)
לדוגמה, עבור חתכים בעובי 14 מיקרומטר, הרוחב הגרעיני הממוצע מחושב להיות 7.7 ± 0.3 מיקרומטר ועובי החתך הממוצע הוא 14 ± 1 מיקרומטר בהתבסס על 30 תאים ו-10 חתכים בהתאמה ב-5 בעלי חיים10. על פי משוואת אברקרומבי, ספירת תאים מתוקנת תהיה ספירת תאים ידנית x 14/(14+7.7).

איור 1: זרימת עבודה מקבילה של שלבי עיבוד מקדים של רקמות הן עבור רקמה קפואה טרייה והן עבור רקמה קבועה פרפורמלדהיד. שלבי עיבוד עבור רקמה טרייה קפואה מוצגים בתיבות המתאר האדומות, ואילו אלה עבור רקמות קבועות של פרפורמלדהיד (PFA) מוצגים בתיבות המתאר הכחולות. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
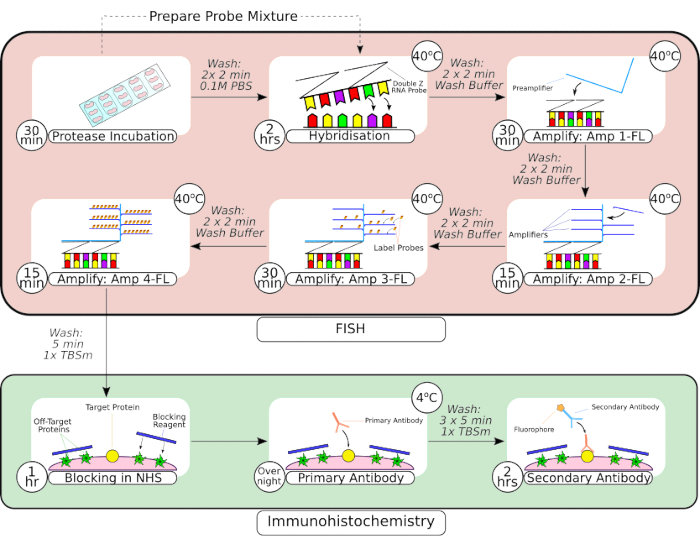
איור 2: סיכום של בדיקה משולבת של FISH והליך אימונוהיסטוכימי. לאחר עיבוד מקדים של הרקמה, הרקמה המותקנת במגלשה מוקפת באמצעות עט מחסום הידרופובי, כפי שניתן לראות בפריים הראשון, ומודגרת בתמיסת פרוטאז בטמפרטורת החדר. לאחר השטיפה, הרקמה מועברת לאינקובטור benchtop להכלאה למשך שעתיים לפני שלבי הגברה עוקבים. מערכת ההכלאה באתרה משתמשת בעיצוב 'Z probe' קנייני, קדם-מגברים ומגברים כפי שניתן לראות במסגרות 3-66. לאחר שהרקמה עברה עיבוד בדיקת FISH, היא נשטפת לפני חסימה עם נסיוב סוס רגיל. הדגירה הראשונית של הנוגדנים מתבצעת במהלך הלילה בטמפרטורה של 4 מעלות צלזיוס כדי למקסם את קשירת הנוגדנים-אנטיגן. דגירה משנית של נוגדנים (שעתיים) בוצעה בטמפרטורת החדר. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
תוצאות
כאן, אנו מתארים שיטה לשילוב FISH מרובה עם IHC פלואורסצנטי כדי למקם ביטוי mRNA עבור GalR1 ו- GlyT2 באמצעות רקמות קבועות קפואות טריות ופרפורמלדהיד בהתאמה ב- NTS של העכבר. צנרת של תהליכי עיבוד הרקמות, FISH ו-IHC המתוארים בשיטות מוצגת באיור 1 ובאיור 2. טבלה 1 מספקת סיכום ?...
Discussion
במדעי המוח, FISH ו-IHC משמשים באופן שגרתי לחקר הארגון המרחבי והמשמעות התפקודית של mRNA או חלבונים בתוך תת-אוכלוסיות עצביות. הפרוטוקול המתואר במחקר זה משפר את היכולת לזיהוי סימולטני של mRNA וחלבונים במקטעי מוח. בדיקת FISH-IHC המשולבת שלנו אפשרה זיהוי פנוטיפי של תת-אוכלוסיות עצביות מובחנות ב-NTS הן בתכש?...
Acknowledgements
עבודה זו מומנה על ידי מענק פרויקט דיסקברי של מועצת המחקר האוסטרלית DP180101890 ומענק פרויקט קרן המחקר הרפואי רבקה ל. קופר PG2018110
Materials
| Name | Company | Catalog Number | Comments |
| ANIMALS | |||
| C57BL/6 mouse | Australian BioResources, Moss Vale | MGI: 2159769 | |
| Phox2b-eGFP mouse | Australian BioResources, Moss Vale | MGI: 5776545 | |
| REAGENTS | |||
| Cyanoacrylate | Loctite | ||
| Ethylene Glycol | Sigma-Aldrich | 324558 | |
| Heparin-Sodium | Clifford Hallam Healthcare | 1070760 | Consult local veterinary supplier or pharmacy. |
| Lethabarb (Sodium Pentabarbitol) Euthanasia Injection | Virbac (Australia) Pty Ltd | N/A | Consult a veterinarian for local pharmaceutical regulations regarding Sodium Pentabarbitol |
| Molecular grade agarose powder | Sigma Aldrich | 5077 | |
| OCT Compound, 118mL | Scigen Ltd | 4586 | |
| Paraformaldehyde, prilled, 95% | Sigma-Aldrich | 441244-1KG | |
| Polyvinylpyrrolidone, average mol wt 40,000 (PVP-40) | Sigma-Aldrich | PVP40 | |
| ProLong Gold Antifade Mountant | Invitrogen | P36930 | With or without DAPI |
| RNAscope Multiplex Fluorescent Reagent Kit (up to 3-plex capability) | Advanced Cell Diagnostics, Inc. (ACD Bio) | ADV320850 | Includes 50x Wash buffer and Protease III |
| RNase Away | Thermo-Fisher Scientific | 7003 | |
| Tris(hydroxymethyl)aminomethane | Sigma-Aldrich | 252859 | |
| Tween-20, for molecular biology | Sigma-Aldrich | P9416 | |
| EQUIPMENT | |||
| Benchtop incubator | Thermoline scientific micro incubator | Model: TEI-13G | |
| Brain Matrix, Mouse, 30g Adult, Coronal, 1mm | Ted Pella | 15050 | |
| Cryostat | Leica | CM1950 | |
| Drawing-up needle (23 inch gauge) | BD | 0288U07 | |
| Hydrophobic Barrier Pen | Vector labs | H-4000 | |
| Kimtech Science Kimwipes Delicate Task Wipes | Kimberley Clark Professional | 34120 | |
| Olympus BX51 | Olympus | BX-51 | |
| Peristaltic pump | Coleparmer Masterflex | L/S Series | |
| Retiga 2000R Digital Camera | QImaging | RET-2000R-F-CLR | colour camera |
| SuperFrost Plus Glass Slides (White) | Thermo-Fisher Scientific | 4951PLUS4 | |
| Vibrating Microtome (Vibratome) | Leica | VT1200S | |
| Whatman qualitative filter paper, Grade 1, 110 mm diameter | Merck | WHA1001110 | |
| SOFTWARES | |||
| CorelDRAW | Corel Corporation | Version 7 | |
| FIJI (ImageJ Distribution) | Open Source/GNU General Public Licence (GPL) | N/A | ImageJ 2.x: Rueden, C. T.; Schindelin, J. & Hiner, M. C. et al. (2017), "ImageJ2: ImageJ for the next generation of scientific image data", BMC Bioinformatics 18:529, PMID 29187165, doi:10.1186/s12859-017-1934-z and Fiji: Schindelin, J.; Arganda-Carreras, I. & Frise, E. et al. (2012), "Fiji: an open-source platform for biological-image analysis", Nature methods 9(7): 676-682, PMID 22743772, doi:10.1038/nmeth.2019 |
| PRIMARY ANTIBODIES | |||
| Anti-Tyrosine Hydroxylase Antibody | Millipore Sigma | AB1542 | Sheep polyclonal (1:1000 dilution), RRID: AB_90755 |
| Anti-Tyrosine Hydroxylase Antibody, clone LNC1 | Millipore Sigma | MAB318 | Mouse monoclonal (1:1000 dilution), RRID: AB_2201528 |
| Anti-Vesicular Acetylcholine Transporter (VAchT) Antibody | Sigma-Aldrich | ABN100 | Goat polyclonal (1:1000 dilution), RRID: AB_2630394 |
| GFP Antibody | Novus Biologicals | NB600-308 | Rabbit polyclonal (1:1000 dilution), RRID: AB_10003058 |
| Phox2b Antibody (B-11) | Santa Cruz Biotechnology | sc-376997 | Mouse monoclonal (1:1000 dilution), RRID: AB_2813765 |
| SECONDARY ANTIBODIES | |||
| Alexa Fluor 488 AffiniPure Donkey Anti-Rabbit IgG (H+L) (min X Bov, Ck, Gt, GP, Sy Hms, Hrs, Hu, Ms, Rat, Shp Sr Prot) | Jackson ImmunoResearch | 711-545-152 | Donkey anti-Rabbit (1:400 dilution), RRID: AB_2313584 |
| AMCA AffiniPure Donkey Anti-Sheep IgG (H+L) (min X Ck, GP, Sy Hms, Hrs, Hu, Ms, Rb, Rat Sr Prot) | Jackson ImmunoResearch | 713-155-147 | Donkey anti-Sheep (1:400 dilution), RRID: AB_AB_2340725 |
| Cy5 AffiniPure Donkey Anti-Goat IgG (H+L) (min X Ck, GP, Sy Hms, Hrs, Hu, Ms, Rb, Rat Sr Prot) | Jackson ImmunoResearch | 705-175-147 | Donkey anti-Goat (1:400 dilution), RRID: AB_2340415 |
| Cy5 AffiniPure Donkey Anti-Mouse IgG (H+L) (min X Bov, Ck, Gt, GP, Sy Hms, Hrs, Hu, Rb, Rat, Shp Sr Prot) | Jackson ImmunoResearch | 715-175-151 | Donkey anti-Mouse (1:400 dilution), RRID: AB_2619678 |
| Cy5 AffiniPure Donkey Anti-Sheep IgG (H+L) (min X Ck, GP, Sy Hms, Hrs, Hu, Ms, Rb, Rat Sr Prot) | Jackson ImmunoResearch | 713-175-147 | Donkey anti-Sheep (1:400 dilution), RRID: AB_2340730 |
| RNASCOPE PROBES | |||
| Galanin Receptor 1 oligonucleotide probe | ACDBio | 448821-C1 | targets bp 482 - 1669 (Genebank ref: NM_008082.2) |
| Glycine transporter 2 oligonucleotide probe | ACDBio | 409741-C3 | targets bp 925 - 2153 (Genebank ref: NM_148931.3) |
| Phox2b oligonucleotide probe | ACDBio | 407861-C2 | targets bp 1617 - 2790 (Genebank ref: NM_008888.3) |
References
- Wang, F., et al. RNAscope: a novel in situ RNA analysis platform for formalin-fixed, paraffin-embedded tissues. Journal of Molecular Diagnostics. 14 (1), 22-29 (2012).
- Annese, T., et al. RNAscope dual ISH-IHC technology to study angiogenesis in diffuse large B-cell lymphomas. Histochemistry and Cell Biology. 153 (3), 185-192 (2020).
- Morrison, J. A., McKinney, M. C., Kulesa, P. M. Resolving in vivo gene expression during collective cell migration using an integrated RNAscope, immunohistochemistry and tissue clearing method. Mechanisms of Development. 148, 100-106 (2017).
- Gross-Thebing, T., Paksa, A., Raz, E. Simultaneous high-resolution detection of multiple transcripts combined with localization of proteins in whole-mount embryos. BMC Biology. 12, 55 (2014).
- Stempel, A. J., Morgans, C. W., Stout, J. T., Appukuttan, B. Simultaneous visualization and cell-specific confirmation of RNA and protein in the mouse retina. Molecular Vision. 20, 1366-1373 (2014).
- Kersigo, J., et al. A RNAscope whole mount approach that can be combined with immunofluorescence to quantify differential distribution of mRNA. Cell and Tissue Research. 374 (2), 251-262 (2018).
- Grabinski, T. M., Kneynsberg, A., Manfredsson, F. P., Kanaan, N. M. A method for combining RNAscope in situ hybridization with immunohistochemistry in thick free-floating brain sections and primary neuronal cultures. PLoS One. 10 (3), 0120120 (2015).
- Baleriola, J., Jean, Y., Troy, C., Hengst, U. Detection of axonally localized mRNAs in brain sections using high-resolution in situ hybridization. Journal of Visualized Experiments. (100), e52799 (2015).
- Fe Lanfranco, M., Loane, D. J., Mocchetti, I., Burns, M. P., Villapol, S. Combination of fluorescent in situ hybridization (FISH) and immunofluorescence imaging for detection of cytokine expression in microglia/macrophage cells. Bio-Protocol. 7 (22), (2017).
- Dereli, A. S., Yaseen, Z., Carrive, P., Kumar, N. N. Adaptation of respiratory-related brain regions to long-term hypercapnia: focus on neuropeptides in the RTN. Frontiers in Neuroscience. 13, 1343 (2019).
- Lazarenko, R. M., et al. Acid sensitivity and ultrastructure of the retrotrapezoid nucleus in Phox2b-EGFP transgenic mice. Journal of Comparative Neurology. 517 (1), 69-86 (2009).
- Gage, G. J., Kipke, D. R., Shain, W. Whole animal perfusion fixation for rodents. Journal of Visualized Experiments. (65), e3564 (2012).
- Paxinos, G., Franklin, K. B. . The mouse brain in stereotaxic coordinates. , (2004).
- Abercrombie, M. Estimation of nuclear population from microtome sections. Anatomical Records. 94, 239-247 (1946).
- Kerr, N., et al. The generation of knock-in mice expressing fluorescently tagged galanin receptors 1 and 2. Molecular and Cellular Neurosciences. 68, 258-271 (2015).
- Kachidian, P., Pickel, V. M. Localization of tyrosine hydroxylase in neuronal targets and efferents of the area postrema in the nucleus tractus solitarii of the rat. Journal of Comparative Neurology. 329 (3), 337-353 (1993).
- Stornetta, R. L., et al. Expression of Phox2b by brainstem neurons involved in chemosensory integration in the adult rat. Journal of Neuroscience. 26 (40), 10305-10314 (2006).
- Gilmor, M. L., et al. Expression of the putative vesicular acetylcholine transporter in rat brain and localization in cholinergic synaptic vesicles. Journal of Neuroscience. 16 (7), 2179-2190 (1996).
- Fisher, J. M., Sossin, W., Newcomb, R., Scheller, R. H. Multiple neuropeptides derived from a common precursor are differentially packaged and transported. Cell. 54 (6), 813-822 (1988).
- Towle, A. C., Lauder, J. M., Joh, T. H. Optimization of tyrosine-hydroxylase immunocytochemistry in paraffin sections using pretreatment with proteolytic-enzymes. Journal of Histochemistry and Cytochemistry. 32 (7), 766-770 (1984).
- Biancardi, V., et al. Mapping of the excitatory, inhibitory, and modulatory afferent projections to the anatomically defined active expiratory oscillator in adult male rats. Journal of Comparative Neurology. 529 (4), 853-884 (2021).
- Matthews, D. W., et al. Feedback in the brainstem: an excitatory disynaptic pathway for control of whisking. Journal of Comparative Neurology. 523 (6), 921-942 (2015).
- Ramos-Vara, J. A. Principles and methods of immunohistochemistry. Methods in Molecular Biology. 1641, 115-128 (2017).
- Shi, S. R., Key, M. E., Kalra, K. L. Antigen retrieval in formalin-fixed, paraffin-embedded tissues: an enhancement method for immunohistochemical staining based on microwave oven heating of tissue sections. Journal of Histochemistry and Cytochemistry. 39 (6), 741-748 (1991).
- Yamashita, S., Katsumata, O. Heat-induced antigen retrieval in immunohistochemistry: mechanisms and applications. Methods in Molecular Biology. 1560, 147-161 (2017).
- Yamashita, S., Okada, Y. Mechanisms of heat-induced antigen retrieval: analyses in vitro employing SDS-PAGE and immunohistochemistry. Journal of Histochemistry and Cytochemistry. 53 (1), 13-21 (2005).
- Yamashita, S. Heat-induced antigen retrieval: mechanisms and application to histochemistry. Progress in Histochemistry and Cytochemistry. 41 (3), 141-200 (2007).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved