A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
استخراج اللجنين فائق السرعة من بقايا ليغنوسيلولوسيك البحر الأبيض المتوسط غير عادية
In This Article
Summary
المعالجة المسبقة العميقة القائمة على المذيبات eutectic ، بمساعدة الميكروويف هي عملية خضراء وسريعة وفعالة للكسر الليجنسيلوزي واستعادة اللجنين عالية النقاء.
Abstract
المعالجة المسبقة لا تزال الخطوة الأكثر تكلفة في عمليات التحلل الحيوي lignocellulosic. ويجب أن تكون فعالة من حيث التكلفة عن طريق تقليل الاحتياجات الكيميائية وكذلك استهلاك الطاقة والحرارة واستخدام المذيبات الصديقة للبيئة. المذيبات eutectic العميق (DESs) هي المذيبات الرئيسية والخضراء ومنخفضة التكلفة في المقومات الحيوية المستدامة. وهي خليط شفاف يتميز بانخفاض نقاط التجمد الناتجة عن مانح واحد على الأقل لسندات الهيدروجين ومقبول واحد لسندات الهيدروجين. على الرغم من أن DESs تعد المذيبات، فمن الضروري الجمع بينها مع تكنولوجيا التدفئة الاقتصادية، مثل إشعاع الميكروويف، لتحقيق ربحية تنافسية. إشعاع الميكروويف هو استراتيجية واعدة لتقصير وقت التدفئة وزيادة الكسر لأنه يمكن أن يحقق بسرعة درجة الحرارة المناسبة. وكان الهدف من هذه الدراسة هو تطوير خطوة واحدة، وطريقة سريعة لتفتيت الكتلة الحيوية واستخراج اللجنين باستخدام مذيب منخفض التكلفة وقابل للتحلل الحيوي.
في هذه الدراسة، تم إجراء المعالجة المسبقة DES بمساعدة الميكروويف لمدة 60 s في 800 W، وذلك باستخدام ثلاثة أنواع من DESs. تم إعداد مخاليط DES بسهولة من كلوريد الكولين (ChCl) وثلاثة متبرعين بسندات الهيدروجين (HBDs): حمض أحادي الكاربوكسيليك (حمض اللاكتيك) وحمض ديكاربوكسيليك (حمض الأوكسيليك) واليوريا. وقد استخدم هذا المعالجة المسبقة كتجزئة الكتلة الحيوية واستعادة اللجنين من المخلفات البحرية (أوراق بوسيدونيا وأيغاغروبيل)، ونواتج الأغذية الزراعية الثانوية (قذائف اللوز وبوماس الزيتون)، ومخلفات الغابات (الصنوبر)، والأعشاب الليجنوسيلولوسية المعمرة(ستيبا تيناسيما). وأجريت تحليلات أخرى لتحديد الغلة والنقاء وتوزيع الوزن الجزيئي لللجنين المسترد. بالإضافة إلى ذلك ، تم تحديد تأثير DESs على المجموعات الوظيفية الكيميائية في اللجنين المستخرج من خلال التحليل الطيفي للأشعة تحت الحمراء (FTIR) لتحويل فورييه. وتشير النتائج إلى أن خليط حمض ChCl-oxalic يوفر أعلى نقاء اللجنين وأقل عائد. وتبين هذه الدراسة أن عملية الميكروويف DES هي تكنولوجيا فائقة السرعة والكفاءة وتنافسية من حيث التكلفة لعملية تجزئة الكتلة الحيوية الليجنوسيلولوسية.
Introduction
عمليات التجقيم البيولوجي المستدامة تدمج معالجة الكتلة الحيوية، وتجزئةها في جزيئات ذات أهمية، وتحويلها إلى منتجات ذات قيمة مضافة1. في الجيل الثاني من إعادة اكتشاف الحيوانات، يعتبر المعالجة المسبقة ضرورية يجزئ الكتلة الحيوية إلى مكوناتها الرئيسية2. وقد طبقت على نطاق واسع طرق المعالجة المسبقة التقليدية التي تستخدم الاستراتيجيات الكيميائية أو الفيزيائية أو البيولوجية3. ومع ذلك ، يعتبر هذا المعالجة المسبقة الخطوة الأغلى في التجريب الحيوي ولها عيوب أخرى مثل وقت المعالجة الطويل ، وارتفاع الحرارة واستهلاك الطاقة ، والشوائب المذيبات4. في الآونة الأخيرة ، ظهرت DESS ، التي تشبه خصائصها تلك السوائل الأيونية3، كمذيبات خضراء بسبب مزايا مثل التحلل الحيوي ، والملاءمة للبيئة ، وسهولة التركيب ، والتعافي بعد العلاج5.
DESs هي خليط من واحد على الأقل HBD، مثل حمض اللبنيك، حمض ماليك، أو حمض الأوكسيليك، ومقبول السندات الهيدروجين (HBA) مثل البيتين أو كلوريد الكولين (ChCl)6. تمكن تفاعلات HBA-HBD من آلية تحفيزية تسمح بانشقاق الروابط الكيميائية ، مما يسبب تجزئة الكتلة الحيوية وفصل اللجنين. وقد أبلغ العديد من الباحثين عن المعالجة المسبقة المستندة إلى DES ل المواد الأولية الليجنوسيلولوسية مثل ChCl-glycerol على كوب الذرة وstover7،8، ChCl-urea ، وحمض ChCl-oxalic على قش القمح9، حمض ChCl-lactic على نشارة الخشب الأوكالبتوس 10، وحمض ChCl-الخليك11 و ChCl-الإيثيلين غليكول على الخشب11. لتحسين كفاءة DES ، يجب الجمع بين المعالجة المسبقة ومعالجة الميكروويف لتسريع تجزئة الكتلة الحيوية5. وقد أبلغ العديد من الباحثين مثل هذا المعالجة المسبقة مجتمعة (DES والميكروويف) من الخشب8 وstover الذرة, switchgrass, وMiscanthus5, الذي يوفر نظرة جديدة في قدرة DESs للكسر lignocellulosic واستخراج اللجنين في خطوة واحدة سهلة على مدى فترة قصيرة.
اللجنين هو جزيء فينولي يسمر كمادة خام لإنتاج البوليمرات الحيوية ويقدم بديلا لإنتاج المواد الكيميائية مثل مونومرات العطرية وoligomers12. بالإضافة إلى ذلك ، اللجنين لديه أنشطة امتصاص مضادات الأكسدة والأشعة فوق البنفسجية13. وقد ذكرت العديد من الدراسات تطبيقات اللجنين في مستحضرات التجميل14،15. وقد أدى دمجها في منتجات واقية من الشمس التجارية إلى تحسين عامل الحماية من الشمس (SPF) للمنتج من SPF 15 إلى SPF 30 مع إضافة 2 wt ٪ فقط من اللجنين وحتى SPF 50 مع إضافة 10 wt ٪ lignin16. تصف هذه الورقة نهجا فائق السرعة لانشقاق اللجنين والكربوهيدرات ، بمساعدة المعالجة المسبقة المشتركة ل DES-microwave للكتلة الحيوية المتوسطية. وتتألف هذه الكتلة الحيوية من منتجات ثانوية للأغذية الزراعية، ولا سيما بوماس الزيتون وقذائف اللوز. وكانت الكتلة الأحيائية الأخرى التي تم التحقيق فيها هي تلك التي من أصل بحري (أوراق بوسيدونيا وأيغاغروبيل) وتلك التي نشأت من غابة (الصنوبر والأعشاب البرية). كان تركيز هذه الدراسة على اختبار المذيبات الخضراء منخفضة التكلفة لتقييم آثار هذا المعالجة المسبقة المشتركة على تجزئة المواد الخام ، والتحقيق في تأثيرها على نقاء اللجنين والغلة ، ودراسة آثاره على الأوزان الجزيئية والمجموعات الوظيفية الكيميائية في اللجنين المستخرج.
Protocol
1. إعداد الكتلة الحيوية
- تجفيف الكتلة الحيوية
- وضع أوراق بوسيدونيا وكرات aegagropile (Posidonia oceanica), حصادها من شواطئ البحر الأبيض المتوسط, في فرن في 40 درجة مئوية لمدة 72 ساعة.
- ضع قذائف اللوز(Prunus dulcis)،ولدت من الصناعات الغذائية، والزيتون pomace(Olea europaea L.)، التي تم الحصول عليها من مصانع زيت الزيتون، في فرن في 40 درجة مئوية لمدة 72 ساعة.
- وضع الصنوبر (بينوس halepensis), جمعت من غابة, وأوراق ألفا (ستيبا tenacissima), جمعت من حوض جنوب البحر الأبيض المتوسط, في فرن في 40 درجة مئوية ل 72 ح.
ملاحظة: إذا كانت الكتلة الحيوية تحتوي على الرمل، يجب شطفه بالماء المقطر قبل وضعه في الفرن. تظهر الكتلة الحيوية في الشكل 1A-F.
- طحن الكتلة الحيوية
- ضع 20 غرام من كل كتلة حيوية في قاطع مطرقة مجهز بغربال 1 ملم. جمع مسحوق الناتجة في كوب 0.25 لتر وإطعامه إلى قاطع مطرقة مجهزة منخل 0.5 ملم. جمع مسحوق في كوب 0.25 لتر.
2. الميكروويف بمساعدة، استخراج اللجنين فائق السرعة
- إعداد المذيبات eutectic العميق (DES)
- إعداد DES1 (حمض ChCl-oxalic) في نسبة الضرس من 1:1 عن طريق خلط 174 غرام من ChCl مع 126 غرام من حمض الأوكسيليك ديهيدرات في قارورة 500 مل ذهابا وإيابا وذوبانها في حمام في 70 درجة مئوية لمدة 4 ساعة حتى يتم تشكيل سائل متجانس وشفاف.
- إعداد DES2 (حمض ChCl-lactic) في نسبة الضرس من 1:1 عن طريق خلط 174 غرام من ChCl مع 90 غرام من حمض اللبنيك في قارورة 500 مل ذهابا وإيابا وذوبانها في حمام في 70 درجة مئوية لمدة 4 ساعة حتى يتم تشكيل سائل متجانس وشفاف.
- إعداد DES3 (ChCl-urea) في نسبة الضرس من 1:12 عن طريق خلط 174 غرام من ChCl مع 120 غرام من اليوريا في قارورة 500 مل ذهابا وإيابا وذوبانها في حمام في 70 درجة مئوية لمدة 4 ساعة حتى يتم تشكيل سائل متجانس وشفاف.
ملاحظة: يحرك هذه الخلائط باستمرار مع شريط تحريك في 500 دورة في الدقيقة.
- العلاج المدمج بالميكروويف-DES
- ضع 5 غرام من المواد الخام في ميكروويف في مفاعل البوليتيترافلوروإيثيلين المغلق. إضافة 50 مل من DES، ووضع شريط اثارة في العينة. أغلق حاوية الميكروويف بغطاء مناسب، واربط غطاء درجة الحرارة.
- ضع حاوية الميكروويف على حافة القرص الدوار، وتأكد من أنها مهتاجة باستمرار. ضبط طاقة الميكروويف في 800 واط لمدة دقيقة واحدة. باستخدام قفازات مناسبة، أخرج الحاوية من الميكروويف، ودع الخليط يبرد. كرر هذا العلاج باستخدام DESs الثلاثة لكل عينة من عينات الكتلة الحيوية.
ملاحظة: تحقق وتأكد من أن درجة الحرارة المسبار هو وضع صحيح، وحاوية الميكروويف لديه درجة حرارة متجانسة.
- عزلة اللجنين
- إعداد المحلول المتجانسة المذيبات عن طريق خلط الإيثانول: الماء في نسبة 50:50 (v:v). إضافة 50 مل من المحلول المضاد للمذيبات إلى المواد الخام المعالجة، ووضع الخليط في حاوية الطرد المركزي (250 مل)، والطرد المركزي لمدة 5 دقائق في 3000 × ز.
- بعد الطرد المركزي، فلتر الناموست (الكسر الغني باللجنين) باستخدام بوتقة فلتر زجاجي (المسامية 4، 10-16 ميكرومتر، قطر 10 ملم). غسل بقايا السليلوز المتبقية التي تم جمعها بعد الطرد المركزي مع 25 مل من المحلول المضاد للمذيبات.
- جهاز الطرد المركزي في 3000 × غرام لمدة 5 دقائق بعد كل غسل. كرر يغسل 4x، وجمع وتصفية يغسل من خلال بوتقة فلتر الزجاج (المسامية N 4، 10-16 ميكرومتر، قطر 10 ملم).
- أضف الكسر الغني باللجنين المصفى من الخطوة 2.3.2 إلى الغسالات المصفاة من الخطوة 2.3.3 في قارورة قاع مستديرة سعة 500 مل. تبخر الإيثانول باستخدام المبخر الدوار عند 50 درجة مئوية و 110 مببار.
- أضف 150 مل من الماء المتأين إلى الخمور المركزة (جزء غني باللجنين) ، وعجل باللجنين عن طريق الطرد المركزي. جمع اللجنين كبيليه، وغسله مع 25 مل من الماء المقطر. كرر يغسل 4x. الليوفليزي اللجنين، أو يجفف في فرن في 40 درجة مئوية.
ملاحظة: إذا لزم الأمر، وغسل اللجنين >4x لإزالة الأملاح من المذيبات. - استخدم الصيغة التالية لتحديد العائد:
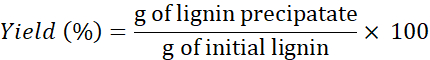
ملاحظة: كما تم تنفيذ استخراج اللجنين مع اثنين من DESs أخرى: كلوريد الكولين + ريسورسينول وكلوريد الكولين + حمض بوتيريك في 1 دقيقة. ومع ذلك، كانت كميات اللجنين المستردة باستخدام هذه DESs صغيرة للغاية (وغير قابلة للاسترداد) مقارنة بالمبالغ التي تم الحصول عليها باستخدام DESs الثلاثة الأخرى.
3. تحديد نقاء اللجنين المستخرج من قبل كلاسون
- إعداد عينة لتحلل كلاسون المائي
- ضع عامل التصفية البوتقة (المسامية 4، القطر 4.5 مم) في فرن كاتم في 550 درجة مئوية لمدة 4 ساعة (2 ساعة منحدر، من 25 درجة مئوية). أزيلي البوتقة عندما يبرد الفرن إلى 150 درجة مئوية، وضعيه في مجفف ليبرد، ويزن.
- إضافة ما يقرب من 30 ملغ من اللجنين في أنبوب زجاجي borosilicate (انظر جدول المواد)،ونلاحظ وزن العينة. أضف 1 مل من حمض الكبريتيك بنسبة 72٪ (H2SO4)إلى العينة، وضع العينة في حمام 30 درجة مئوية لمدة 60 دقيقة، واخلط كل 10 دقائق عن طريق الدوامة.
- إزالة العينة، ونقلها إلى زجاجة 100 مل، وإضافة 28 مل من الماء المقطر لتخفيف حمض إلى تركيز 4٪. ضع الزجاجة في الأوتوكلاف عند 121 درجة مئوية لمدة 60 دقيقة. إزالة زجاجة، والسماح لها لتبرد.
- تحليل اللجنين غير القابل للذوبان في الحمض
- تصفية التحلل المائي باستخدام بوتقة تحت فراغ. جمع جميع المواد الصلبة في زجاجة تحتوي على المياه deionized. شطف بوتقة مع 50 مل من الماء deionized.
- جفف البوتقة التي تحتوي على المواد الصلبة عن طريق وضعها في الفرن عند 105 درجة مئوية لمدة 16 ساعة. إزالة بوتقة من الفرن، ووضعها في مجفف، والسماح لها لتبرد. وزن العينة.
- ضع البوتقة في فرن كاتم عند 550 درجة مئوية لمدة 4 ساعة (2 ساعة منحدر). إزالته ووضعه في مجفف. وزن العينة.
- استخدم الصيغة التالية لحساب النسبة المئوية للبقايا غير القابلة للذوبان في الحمض (AIR):
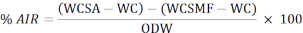
WCSA: وزن البوتقة + عينة بعد إزالتها من الفرن
مرحاض: وزن بوتقة
WCSMF: وزن بوتقة بعد إزالته من فرن كاتم الصوت
ODW: الفرن الجاف وزن العينة
- تحليل اللجنين القابل للذوبان في الحمض
- قياس امتصاص الخيوط التي تم الحصول عليها في الخطوة 3.2.1 مع مطياف في 205 نانومتر باستخدام كوفيتس الكوارتز. استخدام الماء المقطر كما فارغة.
- استخدم الصيغة التالية لحساب النسبة المئوية للبقايا القابلة للذوبان في الحمض (ASL):
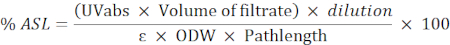
ملاحظة: يجب أن يكون الامتصاص بين 0.2 و 0.7. تمييع العينة إذا لزم الأمر.
UVabs: الامتصاص في 205 نانومتر
Pathlength: مسار الضوء لخلية القياس (بالسم)
ε: امتصاص الكتلة الحيوية على طول موجي محدد
4. محتوى النيتروجين في اللجنين المستخرج
- إعداد محلول القلويات
- في قارورة حجمية 2.5 لتر، تزن 1 كجم من هيدروكسيد الصوديوم (NaOH) وإضافة الماء المؤين حتى العلامة. ضع شريط مغناطيسي في القارورة، وحرك حتى يذوب NaOH تماما.
- إعداد محلول حمض الكبريتيك
- خذ 0.1 N H2SO4 (انظر جدول المواد)في قارورة حجمية 5 L، وأضف الماء المؤين حتى علامة 5 لتر، وضع شريط مغناطيسي، وحرك حتى تذوب المحتويات.
- إعداد الحل المتلقي
- في قارورة حجمية 5 لتر، حل 100 غرام من H3BO3 (حمض البوريك) في الماء deionized، وإحضار حجم إلى العلامة.
- وزن 100 ملغ من بروموبريسول الأخضر في قارورة الحجم 100 مل، وإضافة الميثانول التقنية تصل إلى العلامة.
- وزن 100 ملغ من الميثيل الأحمر في قارورة الحجم 100 مل، وإضافة الميثانول التقنية تصل إلى العلامة.
- صب 5 لتر من H3BO3 الحل من الخطوة 4.3.1، 100 مل من الحل الأخضر بروموبريسول من الخطوة 4.3.2، 70 مل من محلول أحمر الميثيل من الخطوة 4.3.3، و 5 لتر من المياه deionized في حاوية. هز الحل المتلقي جيدا لمدة 30 دقيقة.
ملاحظة: يجب أن يكون اللون النهائي للحل أخضر. إذا كان اللون غير أخضر، أضف 50 مل من محلول N NaOH واحد.
- إعداد العينة
- في أنبوب Kjeldahl، ضع 100 ملغ من اللجنين وزنها على ورقة خالية من النيتروجين، إضافة قرص من Kjeldhal (1.5 غرام كبريتات البوتاسيوم (K2SO4) + 0.045 غرام من النحاس كبريتات pentahydrate (CuSO4.5H2O) + 0.045 غرام ثاني أكسيد التيتانيوم (TiO2))،وإضافة 7.2 مل من تركيز H2SO4.
ملاحظة: استخدم أربعة أنابيب مع ورق خالي من النيتروجين فقط (بدون العينات) كفراغات.
- في أنبوب Kjeldahl، ضع 100 ملغ من اللجنين وزنها على ورقة خالية من النيتروجين، إضافة قرص من Kjeldhal (1.5 غرام كبريتات البوتاسيوم (K2SO4) + 0.045 غرام من النحاس كبريتات pentahydrate (CuSO4.5H2O) + 0.045 غرام ثاني أكسيد التيتانيوم (TiO2))،وإضافة 7.2 مل من تركيز H2SO4.
- عينة الهضم
- قم بتشغيل منظم الحرارة على هاضم 1 ساعة مقدما عند 360 درجة مئوية.
- ضع أنابيب العينة على رف، وضع أربعة أنابيب فارغة في الزوايا الأربع للرف، وملء الثقوب (إن وجدت) من الرف مع أنابيب فارغة.
- ضع الحامل في هاضم مسخن مسبقا، وتغطية نظام الشفط، وفتح مضخة المياه.
ملاحظة: الحرص على تجنب الأبخرة; زيادة تدفق المياه إذا ظهرت الأبخرة. - بعد 2 ساعة، إيقاف التدفئة، وإزالة العينات، ووضعها على دعم معدني. السماح للرف لتبرد لمدة 40 دقيقة تقريبا مع نظام الشفط على.
- إجراء التقطير في كيلدال
- قم بتشغيل تقطير Kjeldahl. السماح بتشغيل الاختبارات الذاتية حتى يظهر التحديد على الشاشة. قم بالتبديل إلى الوضع اليدوي، وأدخل أنبوبا فارغا، واغلق الباب المنزلق.
- تطهير بوريت titrant (0.02 N H2SO4)(رفع الغطاء) عن طريق الضغط عليه في الجزء السفلي والعازل عدة مرات، والقضاء على فقاعات الهواء من الأنابيب عن طريق الضغط على أنبوب من H2SO4 زجاجة. أغلق غطاء محرك السيارة.
- قم بتطهير H3BO3 تلقي الحل 3x.
- أضف الماء 3x، والتبديل إلى البخار النشط (10 دقيقة). انتقل إلى برنامج تحليل Kjeldahl 1. أدخل بلانكو باستخدام الأسهم على مستوى خط النتيجة.
- أدخل الأنبوب. ابدأ بالفراغات الأربعة، واحسب متوسطاتها. أدخل القيمة في سطر بلانكو.
ملاحظة: بعد إدخال الأنبوب، يضيف الجهاز تلقائيا وتتابعا 30 مل من H2O و30 مل من H3BO3و40 مل من 10 N NaOH. - التبديل إلى مل من titrant عند خط النتيجة. أدخل الأنبوب، ولاحظ مقدار H2SO4 المستخدم.
ملاحظة: لاختبار تقطير Kjeldahl, النظر في أن 50 ملغ من الجلسرين تتوافق مع 18.60٪ ± 5٪ N. في نهاية كل عملية تحديد، يقوم الجهاز تلقائيا بإفراغ الأنبوب وتنظيفه. - حساب النسبة المئوية ل N.

V s.a : حجم حمض الكبريتيك
T S.A : 0.02 N H2SO4
S: عينة كتلة
5. محتوى الرماد في اللجنين المستخرج
- جفف البوتقة الخزفية لمدة ساعة واحدة عند 105 درجة مئوية. اتركها لتبرد في مجفف.
- وزن بوتقة، ونلاحظ رقمه. إضافة ما يقرب من 1 غرام من مسحوق العينة. ضع البوتقة في فرن الكتومة مع البرنامج التالي: منحدر 2 ساعة حتى 575 درجة مئوية؛ هضبة من 4 ساعة في 575 درجة مئوية.
- اتركي الفرن ليبرد إلى 100 درجة مئوية. إزالة البوتقة، ووضعها في المجفف، ووزنها.
6. محتوى الكربوهيدرات
- إعداد بوروهيدريد الصوديوم (NaBH4)/ ثنائي ميثيل سلف أكسيد (DMSO) الحل
- ضع 2 غرام من NaBH4 في قارورة حجمية سعة 100 مل، واملأ العلامة باستخدام DMSO. الحرارة إلى 100 درجة مئوية في حمام العمدة، ويحرك الحل حتى يذوب تماما.
- إعداد حل MIX
- ضع 20 ملغ كل من الزيلوز، أرابينوس، رهامنوس، الجلوكوز، الجالاكتوز، المانوز، و 2-deoxyglucose في قارورة حجمية 100 مل، وملء ما يصل إلى علامة 100 مل مع الماء التأين.
- التحلل المائي للعينة
- وزن عينة 50 ملغ من اللجنين في أنبوب زجاجي borosilicate, إضافة 3 مل من 1 مH 2SO4,وتسخين الخليط لمدة 3 ح في 100 درجة مئوية.
- قم بتهدئة العينة، وأضف 1 مل من هيدروكسيد الأمونيوم 15 M (NH4OH)، وتحقق من درجة الحموضة للتأكد من أنها محايدة أو قلوية. أضف بالضبط 1 مل من المعيار الداخلي (2-deoxyglucose) إلى كل عينة.
ملاحظة: 2-deoxyglucose المضافة كمعيار داخلي يجعل من الممكن تحديد كمية كل جرعة موجودة في العينة.
- الحد من وخلات السكريات الأحادية في خلات الألديتول
- خذ 400 ميكرولتر من الحل من الخطوة 6.3.2، وضعه في أنابيب خاصة. خذ 400 ميكرولتر من محلول MIX للتحكم، وضعه في أنابيب خاصة.
ملاحظة: استخدام الحل MIX يسهل حساب عوامل الاستجابة (RFs) ونسبة الشاريد الأحادي. - إضافة 2 مل من الحل NaBH4/DMSO المعدة في القسم 6.1. أغلق الأنبوب، واحتضن لمدة 90 دقيقة عند 40 درجة مئوية في حمام مائي. إزالة أنبوب من حمام الماء، وإضافة 0.6 مل من حمض الخليك الجليدي.
ملاحظة: بما أن هذا هو رد فعل طارد للحرارة، ستظهر فقاعات ودخان. - إضافة ما يقرب من 0.4 مل من 1-ميثيليميدازول وحوالي 4 مل من أنهيدريد الخليك. بعد 15 دقيقة، إضافة 10 مل من الماء المقطر، بارد، وإضافة ~ 3 مل من ثنائي كلورو الميثان (CH2Cl2).
- بعد 2 ساعة على الأقل، جمع ~ 1 مل من المرحلة السفلية (العضوية)، وحقنه في كروماتوجراف الغاز مجهزة عمود الشعيرات الدموية كاشف تأين اللهب، HP1-ميثيلسيلوكسيان (30 مترا (طول) × 320 ميكرومتر (القطر الداخلي)، 0.25 ميكرومتر (سمك الفيلم)). تحليل البيانات.
- استخدم الصيغة التالية لحساب عامل الاستجابة (RF).
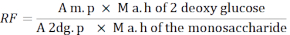
ص م: متوسط مساحة ذروة أحادية السكريد في حل MIX
M. ح من 2 - الجلوكوز ديوكسي: كتلة من 2-deoxyglucose بعد التحلل المائي
2dg. ع: متوسط مساحة ذروة 2-deoxyglucose في حل MIX
م ح من مونوساكريد: كتلة من السكر الأحادي بعد التحلل المائي
ملاحظة: تصحيح أنهيدرو هو 0.8 للرهامنوس، 0.88 للأرابينوز والزيلوز، و 0.9 للمانوز والجلوكوز والجالاكتوز. كتلة بعد التحلل المائي = تصحيح أنهيدرو x كتلة (ز) من مونوساكريد المستخدمة في حل MIX. - استخدم الصيغة التالية لحساب كتلة الشاريد الأحادي.
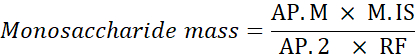
ا ف ب. م: منطقة ذروة أحادية الشاريد في العينة التي تم تحليلها
م. هو: كتلة من المعايير الداخلية المضافة؛ هنا، سي سي = 1 ملغم/مل
AP.2: منطقة الذروة من 2-deoxyglucose في العينة
RF: عامل الاستجابة - حساب النسبة المئوية لكل أحادية الشاريد باستخدام الصيغة التالية.

- خذ 400 ميكرولتر من الحل من الخطوة 6.3.2، وضعه في أنابيب خاصة. خذ 400 ميكرولتر من محلول MIX للتحكم، وضعه في أنابيب خاصة.
7. وظائف الكيميائية في استخراج اللجنين (فورييه تحول الأشعة تحت الحمراء)
- لتحديد المجموعات الوظيفية الكيميائية في اللجنين المستخرج، استخدم مطياف FT-IR مجهزا بوحدة عاكسة إجمالية مخففة (ATR). فتح برنامج التحليل الطيفي، وضبط المعلمات: القرار 4 سم-1،عينة المسح الضوئي الوقت 32، وقت مسح الخلفية 16، حفظ البيانات من 4000 إلى 400 سم-1،نتيجة الإرسال الطيف.
- لا تقم بإضافة أي نموذج; الصحافة الخلفية قناة واحدة. الآن ضع 1 ملغ من العينة على الكريستال، واضغط عينة قناة واحدة. معالجة الأطياف التي تم الحصول عليها.
8. الوزن الجزيئي لللجنين المستخرج (كروماتوغرافيا تتغلغل هلام)
- إعداد حل ثنائي ميثيلفورماميد (DMF) مع كلوريد الليثيوم 0.5٪ (LiCl). خذ 5 غرام من LiCl في قارورة حجمية 1 L ، وأضف DMF إلى خط القياس ، واخلط المحتويات حتى يتم الحصول على سائل متجانس.
- حل 3 ملغ من عينة اللجنين في 3 مل من DMF مع 0.5٪ LiCl. جهاز طرد مركزي في أنبوب طرد مركزي سعة 10 مل، وفصل الكسر القابل للذوبان إلى قارورة.
- حل 3 ملغ من البوليسترين القياسية 1 كدا, 2 كدا, 3 كدا, 10 كدا, 20 كدا, و 30 كدا في حل DMF مع 0.5٪ LiCl. الطرد المركزي في 10 مل أنابيب زجاجية borosilicate، ونقل جزء قابل للذوبان إلى قارورة.
- إعداد نظام لوني-فوق بنفسجي سائل عالي الأداء ..
- افتح نظام البيانات، وتحقق من كاشف الأشعة فوق البنفسجية.
- تطهير النظام بالماء المقطر. تثبيت المكبس في eluent (DMF مع 0.5٪ LiCl). افتح صمام التطهير، واطهر الخط بمعدل تدفق يبلغ 1 مل/دقيقة لمدة 15 دقيقة. وقف تدفق وإغلاق صمام التطهير.
- تعيين معدل التدفق إلى 1 مل / دقيقة لمدة 10 دقائق لتنظيف مسار eluent إلى الكاشف. إيقاف معدل التدفق.
- تثبيت العمود مسبوقة عمود حراسة (راجع جدول المواد). قم بتشغيل سخان العمود عند 45 درجة مئوية، ثم قم بتشغيل كاشف الأشعة فوق البنفسجية، وحدد معدل التدفق تدريجيا حتى يتم الوصول إلى معدل تدفق يبلغ 0.6 مل/دقيقة.
- حقن 30 ميكرولتر من كل عينة لمدة 40 دقيقة على طول موجي من 270 نانومتر. معالجة البيانات التي تم الحصول عليها، وحساب التوزيع الشامل باستخدام خط المعايرة.
- حساب متوسط الوزن الجزيئي (Mn) ومتوسط الوزن الوزن الجزيئي (Mw) ومؤشر تعدد التخصصات (PDI).
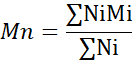
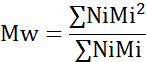
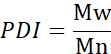
مي: الوزن الجزيئي لسلسلة
Ni: عدد السلاسل لهذا الوزن الجزيئي
9. معالجة البيانات والتحليلات الإحصائية
- إجراء جميع التجارب التحليلية في ثلاثية الطبيعة والتعبير عن النتائج كنسبة مئوية من المادة الجافة.
- إجراء تحليل أحادي الاتجاه للتباين (ANOVA)، ومقارنة الوسائل باستخدام اختبار المقارنة المتعدد ل Tukey.
- إجراء تحليل المكون الرئيسي (PCA).
النتائج
الشكل 2A-C تصور غلة اللجنين لاستخراج من المواد الخام الستة، هو مبين في الشكل 1A-F، بعد المعالجة المسبقة للميكروويف DES مجتمعة. تظهر النتائج أن غلة اللجنين التي تم الحصول عليها مع DES1 (حمض ChCl-oxalic) (الشكل 2A
Discussion
وكان لهذه الدراسة أهداف عديدة؛ وكان أولها إعداد واستخدام المذيبات الخضراء منخفضة التكلفة مع خصائص كل من السوائل الأيونية والمذيبات العضوية. وكان الهدف الثاني هو تجزئة الكتلة الحيوية واستخراج اللجنين في خطوة واحدة، دون الحاجة إلى خطوات أولية مثل استخراج المواد القابلة للاستخراج باستخدا...
Disclosures
ولا يبلغ المؤلفان عن أي تضارب في المصالح.
Acknowledgements
عضو الكنيست والسل يشكر هيثم أيب على التحليلات الإحصائية وإعداد الأرقام، ومنطقة والون (التنمية الإقليمية الأوروبية- VERDIR) ووزير التعليم العالي والبحث العلمي (توفيق بيتهيب) للتمويل.
Materials
| Name | Company | Catalog Number | Comments |
| HPLC Gel Permeation Chromatography | Agilent 1200 series | ||
| 1 methylimadazole | Acros organics | ||
| 2-deoxy-D-glucose (internal standard) | Sigma Aldrich (St. Louis, USA) | ||
| Acetic acid | Sigma Aldrich (St. Louis, USA) | ||
| Acetic anhydride | Sigma Aldrich (St. Louis, USA) | ||
| Adjustables pipettors | |||
| Alkali | alkali-extracted lignin | ||
| Arabinose (99%) | Sigma Aldrich (St. Louis, USA) | ||
| Autoclave | CERTO CLAV (Model CV-22-VAC-Pro) | ||
| Water Bath at 70 °C | |||
| Boric acid | Sigma Aldrich (St. Louis, USA) | ||
| Bromocresol | Sigma Aldrich (St. Louis, USA) | ||
| Catalyst | CTQ (coded A22) (1.5 g K2SO4 + 0.045 g CuSO4.5 H2O + 0.045 g TiO2) | Merck | |
| Centrifugation container | |||
| Centrifuge | BECKMAN COULTER | Avanti J-E centrifuge | |
| Ceramic crucibles | |||
| Choline chloride 99% | Acros organics | ||
| Column | Agilent PLGel Mixed C (alpha 3,000 (4.6 × 250 mm, 5 µm) preceded by a guard column (TSK gel alpha guard column 4.6 mm × 50 mm, 5 µm) | ||
| Column | HP1-methylsisoxane (30 m, 0.32 mm, 0.25 mm) | ||
| Crucible porosity N°4 ( Filtering crucible) | Shott Duran Germany | boro 3.3 | |
| Deonized water | |||
| Dessicator | |||
| Dimethylformamide | VWR BDH Chemicals | ||
| Dimethylsulfoxide | Acros organics | ||
| Erlenmeyer flask | |||
| Ethanol | Merck (Darmstadtt, Germany) | ||
| Filtering crucibles, procelain | |||
| Filtration flasks | |||
| Fourrier Transformed Inra- Red | Vertex 70 Bruker apparatus equipped with an attenuated total reflectance (ATR) module. Spectra were recorded in the 4,000–400 cm−1 range with 32 scans at a resolution of 4.0 cm−1 | ||
| Galactose (98% | Sigma Aldrich (St. Louis, USA) | ||
| Gaz Chromatography | Agilent (7890 series) | ||
| Glass bottle 100 mL | |||
| Glass tubes ( borosilicate) with teflon caps 10 mL | |||
| Glucose (98% | Sigma Aldrich (St. Louis, USA) | ||
| Golves | |||
| Graduated cylinder 50 mL /100 mL | |||
| H2SO4 Titrisol (0.1 N) | Merck (Darmstadtt, Germany) | ||
| H2SO4 (95-98%) | Sigma Aldrich (St. Louis, USA) | BUCHI R-114) | |
| Hummer cutter equiped with 1 mm and 0.5 mm sieve | Mill Ttecator (Sweden) | Cyclotec 1093 | |
| Indulin | Raw lignin control | ||
| Kjeldahl distiller | Kjeltec 2300 (Foss) | ||
| Kjeldahl tube | FOSS | ||
| Kjeldhal rack | |||
| Kjeldhal digester | Kjeltec 2300 (Foss) | ||
| Kjeldhal suction system | |||
| Lab Chem station Software | GC data analysis | ||
| Lactic acid | Merck (Darmstadtt, Germany) | ||
| Lithium chloride LiCl | Sigma Aldrich (St. Louis, USA) | ||
| Mannose (98%) | Sigma Aldrich (St. Louis, USA) | ||
| Methyl red | |||
| Microwave | START SYNTH MILESTONE Microwave laboratory system | ||
| Microwave temperature probe | |||
| Microwave container | |||
| Muffle Furnace | |||
| NaOH | Merck (Darmstadtt, Germany) | ||
| Nitrogen free- paper | |||
| Opus | spectroscopy software | ||
| Oven | GmbH Memmert SNB100 | Memmert SNB100 | |
| Oxalic acid | VWR BDH Chemicals | ||
| P 1000 | Soda-processed lignin | ||
| pH paper | |||
| precision balance | |||
| Infrared spectroscopy | |||
| Quatz cuvette | |||
| Rhamnose (98%) | Sigma Aldrich (St. Louis, USA) | ||
| Rotary vacuum evaporator | Bucher | ||
| Round-bottom flask 500 mL | |||
| sodium borohydride NaBH4 | |||
| Schott bottle | glass bottle | ||
| Sovirel tubes | sovirel | Borosilicate glass tubes | |
| Spatule | |||
| Special tube | |||
| Spectophotometer | UV-1800 Shimadzu | ||
| Sterilization indicator tape | |||
| Stir bar in teflon | |||
| Stirring plate | |||
| Syringes | |||
| Sodium borohydride | Sigma Aldrich (St. Louis, USA) | ||
| Titrisol | Merck | Merck 109984 | 0.1 N H2SO4 |
| Urea | VWR BDH Chemicals | ||
| Vials | |||
| VolumetriC flask 2.5 L /5 L | Bucher | ||
| Vortex | |||
| Xylose (98%) | Sigma Aldrich (St. Louis, USA) |
References
- Kammoun, M., et al. Hydrothermal dehydration of monosaccharides promoted by seawater fundamentals on the catalytic role of inorganic salts. Frontiers in Chemistry. 7, 132 (2019).
- Kammoun, M., Ayeb, H., Bettaieb, T., Richel, A. Chemical characterisation and technical assessment of agri-food residues, marine matrices, and wild grasses in the South Mediterranean area: A considerable inflow for biorefineries. Waste Management. 118, 247-257 (2020).
- Zhang, C. W., Xia, S. Q., Ma, P. Facile pretreatment of lignocellulosic biomass using deep eutectic solvents. Bioresource Technology. 219, 1-5 (2016).
- Mora-Pale, M., Meli, L., Doherty, T. V., Linhardt, R. J., Dordick, J. S. Room temperature ionic liquids as emerging solvents for the pretreatment of lignocellulosic biomass. Biotechnology and Bioengineering. 108 (6), 1229-1245 (2011).
- Chen, Z., Wan, C. Ultrafast fractionation of lignocellulosic biomass by microwave-assisted deep eutectic solvent pretreatment. Bioresource Technologie. 250, 532-537 (2018).
- Francisco, M., Van Den Bruinhorst, A., Kroon, M. C. New natural and renewable low transition temperature mixtures ( LTTMs ): screening as solvents for lignocellulosic biomass processing. Green Chemistry. 14 (8), 2153-2157 (2012).
- Liu, Y. C., et al. Efficient cleavage of lignin - carbohydrate complexes and ultrafast extraction of lignin oligomers from wood biomass by microwave-assisted treatment with deep eutectic solvent. Chem sus chem. 10, 1692-1700 (2017).
- Xu, G. C., Ding, J. C., Han, R. Z., Dong, J. J., Ni, Y. Enhancing cellulose accessibility of corn stover by deep eutectic solvent pretreatment for butanol fermentation. Bioresource Technologie. 203, 364-369 (2016).
- Jablonský, M., Andrea, &. #. 3. 5. 2. ;., Kamenská, L., Vrška, M., Šima, J. Deep eutectic solvents fractionation of wheat straw deep eutectic solvents fractionation of wheat straw. Bioresources. 10 (4), 8039-8047 (2015).
- Shen, X. J., et al. Facile fractionation of lignocelluloses by biomass-derived deep eutectic solvent (DES) pretreatment for cellulose enzymatic hydrolysis and lignin valorization. Green Chemistry. 21, 275-283 (2019).
- Alvarez-Vasco, C., et al. Unique low-molecular-weight lignin with high purity extracted from wood by deep eutectic solvents (DES): a source of lignin for valorization. Green Chemistry. 18, 5133-5141 (2016).
- Banu, J. R., et al. A review on biopolymer production via lignin valorization. Bioresource Technologie. 290, 121790 (2019).
- Gordobil, O., Olaizola, P., Banales, J. M., Labidi, J. Lignins from agroindustrial by-products as natural ingredients for cosmetics chemical structure and in vitro sunscreen and cytotoxic activities. Molecules. 25 (5), 1131 (2020).
- Lee, C. S., Thu Tran, T. M., Weon Choi, J., Won, K. Lignin for white natural sunscreens. International Journal of Biological Macromolecules. 122, 549-554 (2019).
- Widsten, P. Lignin-based sunscreens-state-of-the-art, prospects and challenges. Cosmetics. 7, 85 (2020).
- Qian, Y., Qiu, X., Zhu, S. Lignin: a nature-inspired sun blocker for broad-spectrum sunscreens. Royal Society of Chemistry. 17, 320-324 (2015).
- Zijlstra, D. S., et al. Extraction of lignin with high β-O-4 content by mild ethanol extraction and its effect on the depolymerization yield. Journal of Visualized Experiments. (143), e58575 (2019).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved