Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Extracción ultrarrápida de lignina de residuos lignocelulósicos mediterráneos inusuales
En este artículo
Resumen
El pretratamiento profundo a base de solvente y asistido por microondas eutéctico es un proceso verde, rápido y eficiente para el fraccionamiento lignocelulósico y la recuperación de lignina de alta pureza.
Resumen
El pretratamiento sigue siendo el paso más costoso en los procesos de biorrefinería lignocelulósica. Debe hacerse rentable minimizando los requisitos químicos, así como el consumo de energía y calor, y utilizando disolventes respetuosos con el medio ambiente. Los disolventes eutécticos profundos (DES) son disolventes clave, ecológicos y de bajo costo en las biorrefinerías sostenibles. Son mezclas transparentes caracterizadas por puntos de congelación bajos resultantes de al menos un donante de enlace de hidrógeno y un aceptor de enlace de hidrógeno. Aunque los DES son disolventes prometedores, es necesario combinarlos con una tecnología de calefacción económica, como la irradiación por microondas, para una rentabilidad competitiva. La irradiación por microondas es una estrategia prometedora para acortar el tiempo de calentamiento y aumentar el fraccionamiento porque puede alcanzar rápidamente la temperatura adecuada. El objetivo de este estudio fue desarrollar un método rápido y de un solo paso para el fraccionamiento de biomasa y la extracción de lignina utilizando un disolvente biodegradable y de bajo costo.
En este estudio, un tratamiento previo microonda-asistido del DES fue conducido para 60 s en 800 W, usando tres clases de DESs. Las mezclas del DES fueron preparadas facilely del cloruro de colina (ChCl) y de tres donantes del hidrógeno-enlace (HBDs): un ácido monocarboxílico (ácido láctico), un ácido dicarboxílico (ácido oxálico), y urea. Este pretratamiento se utilizó para el fraccionamiento de biomasa y la recuperación de lignina a partir de residuos marinos (hojas de posidonia y aegagropilo), subproductos agroalimentarios (cáscaras de almendras y orujo de oliva), residuos forestales (piñas) y gramíneas lignocelulósicas perennes(Stipa tenacissima). Otros análisis fueron conducidos para determinar la producción, la pureza, y la distribución del peso molecular de la lignina recuperada. Además, el efecto de los DESs sobre los grupos funcionales químicos en la lignina extraída se determinó mediante espectroscopia infrarroja de transformada de Fourier (FTIR). Los resultados indican que la mezcla de ácido chcl-oxálico ofrece la mayor pureza de lignina y el menor rendimiento. El actual estudio demuestra que el proceso de la DES-microonda es una tecnología ultrarrápida, eficiente, y coste-competitiva para el fraccionamiento lignocellulosic de la biomasa.
Introducción
Los procesos sostenibles de biorrefinería integran el procesamiento de la biomasa, su fraccionamiento en moléculas de interés y su conversión en productos de valor añadido1. En la biorrefinación de segunda generación, el pretratamiento se considera esencial para el fraccionamiento de la biomasa en sus componentes principales2. Los métodos tradicionales de pretratamiento que utilizan estrategias químicas, físicas o biológicas se han aplicado ampliamente3. Sin embargo, dicho pretratamiento se considera el paso más costoso en la biorrefinación y tiene otras desventajas como el largo tiempo de procesamiento, el alto consumo de calor y energía, y las impurezas del disolvente4. Recientemente, los DES, cuyas propiedades son similares a las de los líquidos iónicos3,han surgido como disolventes verdes debido a ventajas como la biodegradabilidad, el respeto al medio ambiente, la facilidad de síntesis y la recuperación después del tratamiento5.
Los DES son mezclas de al menos un HBD, como el ácido láctico, el ácido málico o el ácido oxálico, y un aceptor de enlaces de hidrógeno (HBA) como la betaína o el cloruro de colina (ChCl)6. Las interacciones HBA-HBD permiten un mecanismo catalítico que permite la escisión de enlaces químicos, causando el fraccionamiento de biomasa y la separación de lignina. Muchos investigadores han reportado el pretratamiento a base de DES de materias primas lignocelulósicas como ChCl-glicerol en la mazorca de maíz y estufa7,8,ChCl-urea y ácido ChCl-oxálico en paja de trigo9,Ácido chCl-láctico en aserrín de eucalipto 10,y Ácido chCl-acético11 y ChCl-etilenglicol en madera11. Para mejorar la eficiencia del DES, el pretratamiento debe combinarse con el tratamiento por microondas para acelerar el fraccionamiento de biomasa5. Muchos investigadores han reportado un pretratamiento combinado (DES y microondas) de madera8 y de maíz stover, switchgrass, y Miscanthus5,que proporciona una nueva visión de la capacidad de los DES para el fraccionamiento lignocelulósico y la extracción de lignina en un solo paso fácil durante un corto período.
La lignina es una macromolécula fenólica valorizada como materia prima para la producción de biopolímeros y presenta una alternativa para la producción de productos químicos como monómeros aromáticos y oligómeros12. Además, la lignina tiene actividades de absorción antioxidante y ultravioleta13. Varios estudios han reportado aplicaciones de lignina en productos cosméticos14,15. Su integración en productos de protección solar comercial ha mejorado el factor de protección solar (SPF) del producto de SPF 15 a SPF 30 con la adición de solo 2 % en peso de lignina y hasta SPF 50 con la adición de 10 % en peso de lignina16. Este papel describe un acercamiento ultrarrápido para la hendidura del lignina-carbohidrato, asistida por el tratamiento previo combinado de la DES-microonda de biomasas mediterráneas. Estas biomasas consisten en subproductos agroalimentarios, particularmente orujo de oliva y cáscaras de almendra. Otras biomasas que se investigaron fueron las de origen marino (hojas de posidonia y aegagropilo) y las procedentes de un bosque (piñas y gramíneas silvestres). El enfoque de este estudio fue probar disolventes verdes de bajo costo para evaluar los efectos de este pretratamiento combinado en el fraccionamiento de materias primas, investigar su influencia en la pureza y el rendimiento de la lignina, y estudiar sus efectos sobre los pesos moleculares y los grupos funcionales químicos en la lignina extraída.
Protocolo
1. Preparación de biomasas
- Secado de biomasa
- Colocar las hojas de Posidonia y las bolas de aegagropile (Posidonia oceanica), cosechadas de las playas mediterráneas, en un horno a 40 ºC durante 72 h.
- Colocar las cáscaras de almendras (Prunus dulcis), generadas a partir de industrias alimentarias, y el orujo de oliva (Olea europaea L.),obtenidas de las almazaras de aceite de oliva, en un horno a 40 ºC durante 72 h.
- Colocar las piñas (Pinus halepensis), recogidas de un bosque, y las hojas alfa (Stipa tenacissima), recogidas de la cuenca sur mediterránea, en un horno a 40 ºC durante 72 h.
NOTA: Si la biomasa contiene arena, debe enjuagarse con agua destilada antes de colocarla en el horno. Las biomasas se muestran en la Figura 1A-F.
- Molienda de biomasa
- Coloque 20 g de cada biomasa en un cortador de martillo equipado con un tamiz de 1 mm. Recoja el polvo resultante en un castor de 0,25 L y alimente a un cortador de martillo equipado con un tamiz de 0,5 mm. Recoger el polvo en un casto de 0,25 L.
2. Extracción de lignina ultrarrápida asistida por microondas
- Preparación de disolvente eutéctico profundo (DES)
- Preparar DES1 (Ácido CloCl-oxálico) en una proporción molar de 1:1 mezclando 174 g de ChCl con 126 g de dihidrato de ácido oxálico en un matraz de fondo redondo de 500 ml y fundiéndolos en un baño a 70 °C durante 4 h hasta que se forme un líquido homogéneo y transparente.
- Preparar DES2 (Ácido ChCl-láctico) en una proporción molar de 1:1 mezclando 174 g de ChCl con 90 g de ácido láctico en un matraz de fondo redondo de 500 ml y fundiéndolos en un baño a 70 °C durante 4 h hasta que se forme un líquido homogéneo y transparente.
- Preparar DES3 (ChCl-urea) en una relación molar de 1:12 mezclando 174 g de ChCl con 120 g de urea en un matraz de fondo redondo de 500 mL y fundiéndolos en un baño a 70 °C durante 4 h hasta que se forme un líquido homogéneo y transparente.
NOTA: Revuelva estas mezclas continuamente con una barra de agitación a 500 rpm.
- Tratamiento combinado de microondas-DES
- Colocar 5 g de la materia prima en un microondas en un reactor de politetrafluoroetileno cerrado. Agregue 50 mL de DES y coloque una barra de agitación en la muestra. Cierre el recipiente de microondas con una tapa apropiada y coloque la tapa de temperatura.
- Coloque el recipiente de microondas en el borde de la plataforma giratoria, asegurándose de que esté constantemente agitado. Establezca la potencia de microondas en 800 W durante 1 min. Con guantes adecuados, saque el recipiente del microondas y deje que la mezcla se enfríe. Repita este tratamiento utilizando los tres DES para cada muestra de biomasa.
NOTA: Compruebe y asegúrese de que la sonda de temperatura está colocada correctamente y que el contenedor de microondas tiene una temperatura homogénea.
- Aislamiento de lignina
- Prepare una solución antidisolvente homogénea mezclando etanol:agua en una proporción de 50:50 (v:v). Añadir 50 mL de la solución antidisolvente a la materia prima tratada, colocar la mezcla en un recipiente de centrifugación (250 mL) y centrífuga durante 5 min a 3.000 × g.
- Después de la centrifugación, filtre el sobrenadante (fracción rica en lignina) utilizando un crisol de filtro de vidrio (porosidad 4, 10-16 μm, diámetro 10 mm). Lavar el residuo de celulosa restante recogido después de la centrifugación con 25 mL de la solución antidisolvente.
- Centrífuga a 3.000 × g durante 5 min después de cada lavado. Repita los lavados 4x, y recoja y filtre los lavados a través del crisol del filtro de vidrio (porosidad N 4, 10-16 μm, diámetro 10 mm).
- Añadir la fracción filtrada rica en lignina del paso 2.3.2 a los lavados filtrados del paso 2.3.3 en un matraz inferior redondo de 500 ml. Evaporar etanol usando un evaporador rotatorio a 50 °C y 110 mbar.
- Añadir 150 mL de agua desionizada al licor concentrado (fracción rica en lignina) y precipitar la lignina por centrifugación. Recoger la lignina como pellet, y lavarla con 25 mL de agua destilada; repetir los lavados 4x. Liofilizar la lignina, o secarla en un horno a 40 °C.
NOTA: Si es necesario, lave la lignina >4x para eliminar las sales de los disolventes. - Utilice la siguiente fórmula para determinar el rendimiento:
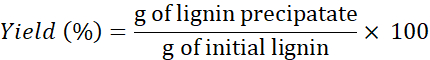
NOTA: La extracción de lignina también se realizó con otros dos DES: cloruro de colina + resorcinol y cloruro de colina + ácido butírico a 1 min. Sin embargo, las cantidades de lignina recuperadas usando estos DESs eran extremadamente pequeñas (e irrecuperables) comparadas con las cantidades obtenidas usando los otros tres DESs.
3. Determinación de la pureza de la lignina extraída por Klason
- Preparación de la muestra para la hidrólisis de Klason
- Colocar el crisol del filtro (porosidad 4, diámetro 4,5 mm) en un horno de mufla a 550 °C durante 4 h (rampa de 2 h, desde 25 °C). Retire el crisol cuando el horno se enfríe a 150 °C, colóquelo en un desecador para enfriarlo y pese.
- Agregue aproximadamente 30 mg de lignina en un tubo de vidrio de borosilicato (consulte la Tabla de materiales)y observe el peso de la muestra. Añadir 1 mL de ácido sulfúrico al 72%(H2SO4)a la muestra, colocar la muestra en un baño de 30 °C durante 60 min, y mezclar cada 10 min por vórtice.
- Retire la muestra, transfiérrela a una botella de vidrio de 100 ml y agregue 28 ml de agua destilada para diluir el ácido a una concentración del 4%. Coloque la botella de vidrio en un autoclave a 121 °C durante 60 min. Retire la botella de vidrio y deje que se enfríe.
- Análisis de lignina insoluble en ácido
- Filtre el hidrolizados usando un crisol al vacío. Recoja todos los sólidos en una botella de vidrio que contenga agua desionizada. Enjuague el crisol con 50 mL de agua desionizada.
- Secar el crisol que contiene los sólidos colocándolo en un horno a 105 °C durante 16 h. Retire el crisol del horno, colóquelo en un desecador y deje que se enfríe. Pesar la muestra.
- Coloque el crisol en un horno de mufla a 550 °C durante 4 h (rampa de 2 h). Retíralo y colócalo en un desecador. Pesar la muestra.
- Utilice la siguiente fórmula para calcular el porcentaje del residuo insoluble en ácido (AIR):
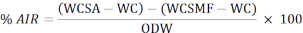
WCSA: peso del crisol + muestra después de retirarlos del horno
WC: peso del crisol
WCSMF: peso del crisol después de retirarlo del horno de la mufla
ODW: horno peso seco de la muestra
- Análisis de lignina soluble en ácido
- Medir la absorbancia del filtrado obtenido en el paso 3.2.1 con un espectrofotómetro a 205 nm utilizando cubetas de cuarzo. Use agua destilada como en blanco.
- Utilice la siguiente fórmula para calcular el porcentaje del residuo soluble en ácido (ASL):
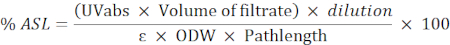
NOTA: La absorbancia debe estar entre 0,2 y 0,7. Diluya la muestra si es necesario.
UVabs: absorbancia a 205 nm
Longitud de la trayectoria: trayectoria de la luz de la celda de medición (en cm)
ε: absorbencia de biomasa en una longitud de onda específica
4. Contenido de nitrógeno en la lignina extraída
- Preparación de solución alcalina
- En un matraz a volumetrátrico de 2,5 L, pesar 1 kg de hidróxido de sodio (NaOH) y añadir agua desionizada hasta la marca. Coloque una barra magnética en el matraz y revuelva hasta que el NaOH se disuelva por completo.
- Preparación de solución de ácido sulfúrico
- Tomar 0,1 N H2SO4 (ver la Tabla de Materiales)en un matraz a volumetúrico de 5 L, añadir agua desionizada hasta la marca de 5 L, colocar una barra magnética y remover hasta que el contenido se disuelva.
- Preparación de la solución receptora
- En un matraz a volumer de 5 L, disolver 100 g de H3BO3 (ácido bórico) en agua desionizada y elevar el volumen hasta la marca.
- Pesar 100 mg de bromocresol verde en un matraz volumétrico de 100 ml y añadir metanol técnico hasta la marca.
- Pesar 100 mg de rojo metilo en un matraz a volumetórico de 100 ml y añadir metanol técnico hasta la marca.
- Verter en un recipiente los 5 L de solución H3BO3 de la etapa 4.3.1, 100 mL de solución verde de bromocresol de la etapa 4.3.2, 70 mL de la solución de rojo metilo de la etapa 4.3.3 y 5 L de agua desionizada. Agite bien la solución receptora durante 30 min.
Nota: El color final de la solución debe ser verde. Si el color no es verde, agregue 50 mL de solución de NaOH de 1 N.
- Preparación de la muestra
- En un tubo de Kjeldahl, colocar 100 mg de lignina pesada sobre un papel libre de nitrógeno, añadir un comprimido de Kjeldhal (1,5 g de sulfato de potasio(K2SO4)+ 0,045 g de sulfato de cobre pentahidratado (CuSO4.5H2O) + 0,045 g de dióxido de titanio (TiO2)),y añadir 7,2 mL de H concentrado2SO4.
NOTA: Utilice cuatro tubos con sólo papel libre de nitrógeno (sin las muestras) como espacios en blanco.
- En un tubo de Kjeldahl, colocar 100 mg de lignina pesada sobre un papel libre de nitrógeno, añadir un comprimido de Kjeldhal (1,5 g de sulfato de potasio(K2SO4)+ 0,045 g de sulfato de cobre pentahidratado (CuSO4.5H2O) + 0,045 g de dióxido de titanio (TiO2)),y añadir 7,2 mL de H concentrado2SO4.
- Digestión de la muestra
- Encienda el termostato del digestor con 1 h de antelación a 360 °C.
- Coloque los tubos de muestra en un rack, coloque los cuatro tubos en blanco en las cuatro esquinas del rack y llene los orificios (si los hay) del rack con tubos vacíos.
- Coloque el bastidor en el digestor precalentado, cubra el sistema de succión y abra la bomba de agua.
NOTA: Tenga cuidado de evitar los humos; aumentar el flujo de agua si aparecen humos. - Después de 2 h, apague el calentamiento, retire las muestras y colótelas en un soporte metálico. Deje que el rack se enfríe durante aproximadamente 40 minutos con el sistema de succión encendido.
- Procedimiento de destilación de Kjeldhal
- Encienda el destilador Kjeldahl. Permitir que se ejecuten autocristaciones hasta que Selection aparezca en la pantalla. Cambie al modo Manual, inserte un tubo vacío y cierre la puerta corredera.
- Purgar la bureta del valorante (0.02 N H2SO4)(levantar la cubierta) presionándola en la parte inferior y superior varias veces, y eliminar las burbujas de aire de las tuberías exprimiendo el tubo de la botella H2SO4. Cierre el capó.
- Purgar la soluciónreceptoraH3 BO3 3x.
- Agregue agua 3x y cambie a Vapor activo (10 min). Cambie al programa de análisis Kjeldahl 1. Ingrese Blanco usando las flechas en el nivel de línea de resultado.
- Inserte el tubo. Comience con los cuatro espacios en blanco y calcule sus promedios. Introduzca el valor en la línea Blanco.
NOTA: Después de insertar el tubo, el dispositivo agrega automática y sucesivamente 30 mL deH2O, 30 mL deH3BO3,y 40 mL de 10 N NaOH. - Cambie a mL de valorante en la línea de resultado. Inserte el tubo y observe la cantidad deH2SO4 utilizada.
NOTA: Para probar el destilador Kjeldahl, considere que 50 mg de glicerina corresponden a 18.60% ± 5% de % N. Al final de cada titulación, el dispositivo vacía y limpia automáticamente el tubo. - Calcular el porcentaje de N.

V s.a : Volumen de ácido sulfúrico
T s.a : 0,02 N H2SO4
S: masa de la muestra
5. Contenido de cenizas en la lignina extraída
- Secar los crisoles cerámicos durante 1 h a 105 °C. Déjalos enfriar en un desecador.
- Pesar un crisol, y tenga en cuenta su número. Añadir aproximadamente 1 g de la muestra en polvo. Coloque el crisol en el horno de mufla con el siguiente programa: una rampa de 2 h hasta 575 °C; una meseta de 4 h a 575 °C.
- Deje que el horno se enfríe a 100 °C. Retire los crisoles, colóquelos en el desecador y pese.
6. Contenido de carbohidratos
- Preparación de solución de borohidruro de sodio (NaBH 4)/dimetilsulfóxido (DMSO)
- Colocar 2 g de NaBH4 en un matraz a volumer de 100 ml y rellenar hasta la marca con DMSO. Calentar a 100 °C en un baño de alcalde, y remover la solución hasta que se disuelva por completo.
- Preparación de la solución MIX
- Colocar 20 mg cada uno de xilosa, arabinosa, colnosa, glucosa, galactosa, manosa y 2-desoxiglucosa en un matraz a volumetrátrico de 100 ml, y rellenar hasta la marca de 100 ml con agua desionizada.
- Hidrólisis de la muestra
- Pesar una muestra de 50 mg de lignina en un tubo de vidrio de borosilicato, añadir 3 mL de 1 M H2SO4, y calentar la mezcla durante 3 h a 100 °C.
- Enfriar la muestra, añadir 1 mL de hidróxido de amonio de 15 M (NH4OH) y comprobar el pH para asegurarse de que es neutro o alcalino. Añadir exactamente 1 mL de estándar interno (2-desoxiglucosa) a cada muestra.
NOTA: La 2-desoxiglucosa añadida como estándar interno permite cuantificar la cantidad de cada dosis presente en la muestra.
- Reducción y acetilación de monosacáridos en acetato de alditol
- Tomar 400 μL de la solución de la etapa 6.3.2 y colocarla en tubos especiales. Tome 400 μL de la solución MIX de control y colóquela en tubos especiales.
NOTA: El uso de la solución MIX facilita el cálculo de factores de respuesta (FR) y porcentajes de monosacárido. - Añadir 2 mL de la solución NaBH4/DMSO preparada en la sección 6.1. Cierre el tubo e incube durante 90 minutos a 40 °C en un baño de agua. Retire el tubo del baño de agua y agregue 0,6 mL de ácido acético glacial.
NOTA: Como se trata de una reacción exotérmica, aparecerán burbujas y humo. - Añadir aproximadamente 0,4 mL de 1-metilimidazol y aproximadamente 4 mL de anhídrido acético. Después de 15 min, añadir 10 mL de agua destilada, enfriar, y añadir ~3 mL de diclorometano(CH2Cl2).
- Después de al menos 2 h, recoger ~ 1 mL de la fase inferior (orgánica) e inyectarlo en un cromatógrafo de gases equipado con una columna capilar detector de ionización de llama, HP1-metilsiloxano (30 m (longitud) x 320 μm (diámetro interno), 0,25 μm (espesor de la película)). Analizar los datos.
- Utilice la siguiente fórmula para calcular el factor de respuesta (RF).
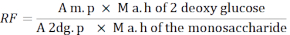
A m. p: Promedio del área del pico de monosacárido en la solución MIX
M a. h de 2 - glucosa desoxi: Masa de 2-desoxiglucosa después de la hidrólisis
Un 2dg. p: Promedio del área del pico de 2-desoxiglucosa en la solución MIX
M a. h del monosacárido: Masa del monosacárido después de la hidrólisis
NOTA: La corrección del anhidro es 0,8 para la rhamnose, 0,88 para la arabinosa y la xilosa, y 0,9 para la manosa, la glucosa, y la galactosa. Masa después de la hidrólisis = corrección del anhidro x masa (g) del monosacárido utilizado en la solución MIX. - Utilice la siguiente fórmula para calcular la masa del monosacárido.
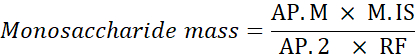
Ap. M: Área pico de monosacárido en la muestra analizada
M. ES: Masa del estándar interno agregado; aquí, C SI=1 mg/mL
AP.2: Área máxima de 2-desoxiglucosa en la muestra
RF: factor de respuesta - Calcule el porcentaje de cada monosacárido utilizando la siguiente fórmula.

- Tomar 400 μL de la solución de la etapa 6.3.2 y colocarla en tubos especiales. Tome 400 μL de la solución MIX de control y colóquela en tubos especiales.
7. Funciones químicas en la lignina extraída (infrarrojo transformada en Fourier)
- Para identificar los grupos funcionales químicos en la lignina extraída, utilice un espectrómetro FT-IR equipado con un módulo de reflectancia total atenuada (ATR). Abra el software de espectroscopia y ajuste los parámetros: resolución 4 cm-1,tiempo de escaneo de la muestra 32, tiempo de escaneo de fondo 16, guarde los datos de 4000 a 400 cm-1,transmitancia del espectro del resultado.
- No agregue ningún ejemplo; pulse fondo de un solo canal. Ahora coloque 1 mg de la muestra en el cristal, y presione la muestra de un solo canal. Procesar los espectros obtenidos.
8. Peso molecular de la lignina extraída (cromatografía de permeación en gel)
- Preparar una solución de dimetilformamida (DMF) con cloruro de litio al 0,5% (LiCl). Tomar 5 g de LiCl en un matraz a volumetúrico de 1 L, añadir DMF hasta la línea de calibre y mezclar el contenido hasta que se obtenga un líquido homogéneo.
- Disolver 3 mg de la muestra de lignina en 3 mL de DMF con LiCl al 0,5%. Centrífuga en un tubo de centrífuga de 10 ml y separe la fracción soluble en un vial.
- Disolver 3 mg de poliestireno estándar 1 kDa, 2 kDa, 3 kDa, 10 kDa, 20 kDa y 30 kDa en la solución de DMF con LiCl al 0,5%. Centrífuga en tubos de vidrio de borosilicato de 10 ml, y transferir la fracción soluble a un vial.
- Prepare un sistema de cromatografía líquida-ultravioleta (UV) de alto rendimiento.
- Abra el sistema de datos y compruebe el detector UV.
- Purgar el sistema con agua destilada. Instale el émbolo en el eluente (DMF con 0.5% LiCl). Abra la válvula de purga y purgue la línea con un caudal de 1 mL/min durante 15 min. Detenga el flujo y cierre la válvula de purga.
- Establezca el caudal en 1 mL/min durante 10 min para limpiar la ruta eluente al detector. Detenga el caudal.
- Instale la columna precedida por una columna de protección (consulte la Tabla de materiales). Encienda el calentador de columna a 45 °C, encienda el detector UV y establezca el caudal gradualmente hasta que se alcance un caudal de 0,6 mL/min.
- Inyecte 30 μL de cada muestra durante 40 min a una longitud de onda de 270 nm. Procesar los datos obtenidos y calcular la distribución de masa utilizando la línea de calibración.
- Calcule el número de peso molecular promedio (Mn), el peso molecular promedio de peso (Mw) y el índice de polidispersidad (PDI).
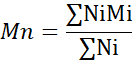
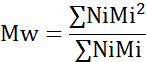
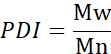
Mi: peso molecular de una cadena
Ni: número de cadenas para ese peso molecular
9. Tratamiento de datos y análisis estadísticos
- Realizar todos los experimentos analíticos por triplicado y expresar los resultados en % de materia seca.
- Realice un análisis unidireccional de varianza (ANOVA) y compare las medias utilizando la prueba de comparación múltiple de Tukey.
- Realizar análisis de componentes principales (PCA).
Resultados
La Figura 2A-C representa el rendimiento de lignina de la extracción de las seis materias primas, que se muestra en la Figura 1A-F,después del pretratamiento combinado de microondas-DES. Los resultados muestran que el rendimiento de lignina obtenido con DES1 (ChCl-ácido oxálico)(Figura 2A)fue inferior a los rendimientos obtenidos con DES2 (ChCl-...
Discusión
Este estudio tenía muchos objetivos; el primero de los cuales fue preparar y utilizar disolventes verdes de bajo costo con las características tanto de líquidos iónicos como de disolventes orgánicos. El segundo objetivo fue fraccionar la biomasa y extraer lignina en un solo paso, sin requerir pasos preliminares como la extracción de extraíbles utilizando Soxhlet o hemicelulosa utilizando disolventes alcalinos, técnicas básicas o termofísicas. El tercer objetivo era recuperar lignina mediante una simple filtraci...
Divulgaciones
Los autores no reportan ningún conflicto de intereses.
Agradecimientos
MK y TB agradecen a Haitham Ayeb por los análisis estadísticos y la preparación de cifras, a la Región Valona (Desarrollo Regional Europeo-VERDIR) y al Ministro de Educación Superior e Investigación Científica (Taoufik Bettaieb) por la financiación.
Materiales
| Name | Company | Catalog Number | Comments |
| HPLC Gel Permeation Chromatography | Agilent 1200 series | ||
| 1 methylimadazole | Acros organics | ||
| 2-deoxy-D-glucose (internal standard) | Sigma Aldrich (St. Louis, USA) | ||
| Acetic acid | Sigma Aldrich (St. Louis, USA) | ||
| Acetic anhydride | Sigma Aldrich (St. Louis, USA) | ||
| Adjustables pipettors | |||
| Alkali | alkali-extracted lignin | ||
| Arabinose (99%) | Sigma Aldrich (St. Louis, USA) | ||
| Autoclave | CERTO CLAV (Model CV-22-VAC-Pro) | ||
| Water Bath at 70 °C | |||
| Boric acid | Sigma Aldrich (St. Louis, USA) | ||
| Bromocresol | Sigma Aldrich (St. Louis, USA) | ||
| Catalyst | CTQ (coded A22) (1.5 g K2SO4 + 0.045 g CuSO4.5 H2O + 0.045 g TiO2) | Merck | |
| Centrifugation container | |||
| Centrifuge | BECKMAN COULTER | Avanti J-E centrifuge | |
| Ceramic crucibles | |||
| Choline chloride 99% | Acros organics | ||
| Column | Agilent PLGel Mixed C (alpha 3,000 (4.6 × 250 mm, 5 µm) preceded by a guard column (TSK gel alpha guard column 4.6 mm × 50 mm, 5 µm) | ||
| Column | HP1-methylsisoxane (30 m, 0.32 mm, 0.25 mm) | ||
| Crucible porosity N°4 ( Filtering crucible) | Shott Duran Germany | boro 3.3 | |
| Deonized water | |||
| Dessicator | |||
| Dimethylformamide | VWR BDH Chemicals | ||
| Dimethylsulfoxide | Acros organics | ||
| Erlenmeyer flask | |||
| Ethanol | Merck (Darmstadtt, Germany) | ||
| Filtering crucibles, procelain | |||
| Filtration flasks | |||
| Fourrier Transformed Inra- Red | Vertex 70 Bruker apparatus equipped with an attenuated total reflectance (ATR) module. Spectra were recorded in the 4,000–400 cm−1 range with 32 scans at a resolution of 4.0 cm−1 | ||
| Galactose (98% | Sigma Aldrich (St. Louis, USA) | ||
| Gaz Chromatography | Agilent (7890 series) | ||
| Glass bottle 100 mL | |||
| Glass tubes ( borosilicate) with teflon caps 10 mL | |||
| Glucose (98% | Sigma Aldrich (St. Louis, USA) | ||
| Golves | |||
| Graduated cylinder 50 mL /100 mL | |||
| H2SO4 Titrisol (0.1 N) | Merck (Darmstadtt, Germany) | ||
| H2SO4 (95-98%) | Sigma Aldrich (St. Louis, USA) | BUCHI R-114) | |
| Hummer cutter equiped with 1 mm and 0.5 mm sieve | Mill Ttecator (Sweden) | Cyclotec 1093 | |
| Indulin | Raw lignin control | ||
| Kjeldahl distiller | Kjeltec 2300 (Foss) | ||
| Kjeldahl tube | FOSS | ||
| Kjeldhal rack | |||
| Kjeldhal digester | Kjeltec 2300 (Foss) | ||
| Kjeldhal suction system | |||
| Lab Chem station Software | GC data analysis | ||
| Lactic acid | Merck (Darmstadtt, Germany) | ||
| Lithium chloride LiCl | Sigma Aldrich (St. Louis, USA) | ||
| Mannose (98%) | Sigma Aldrich (St. Louis, USA) | ||
| Methyl red | |||
| Microwave | START SYNTH MILESTONE Microwave laboratory system | ||
| Microwave temperature probe | |||
| Microwave container | |||
| Muffle Furnace | |||
| NaOH | Merck (Darmstadtt, Germany) | ||
| Nitrogen free- paper | |||
| Opus | spectroscopy software | ||
| Oven | GmbH Memmert SNB100 | Memmert SNB100 | |
| Oxalic acid | VWR BDH Chemicals | ||
| P 1000 | Soda-processed lignin | ||
| pH paper | |||
| precision balance | |||
| Infrared spectroscopy | |||
| Quatz cuvette | |||
| Rhamnose (98%) | Sigma Aldrich (St. Louis, USA) | ||
| Rotary vacuum evaporator | Bucher | ||
| Round-bottom flask 500 mL | |||
| sodium borohydride NaBH4 | |||
| Schott bottle | glass bottle | ||
| Sovirel tubes | sovirel | Borosilicate glass tubes | |
| Spatule | |||
| Special tube | |||
| Spectophotometer | UV-1800 Shimadzu | ||
| Sterilization indicator tape | |||
| Stir bar in teflon | |||
| Stirring plate | |||
| Syringes | |||
| Sodium borohydride | Sigma Aldrich (St. Louis, USA) | ||
| Titrisol | Merck | Merck 109984 | 0.1 N H2SO4 |
| Urea | VWR BDH Chemicals | ||
| Vials | |||
| VolumetriC flask 2.5 L /5 L | Bucher | ||
| Vortex | |||
| Xylose (98%) | Sigma Aldrich (St. Louis, USA) |
Referencias
- Kammoun, M., et al. Hydrothermal dehydration of monosaccharides promoted by seawater fundamentals on the catalytic role of inorganic salts. Frontiers in Chemistry. 7, 132 (2019).
- Kammoun, M., Ayeb, H., Bettaieb, T., Richel, A. Chemical characterisation and technical assessment of agri-food residues, marine matrices, and wild grasses in the South Mediterranean area: A considerable inflow for biorefineries. Waste Management. 118, 247-257 (2020).
- Zhang, C. W., Xia, S. Q., Ma, P. Facile pretreatment of lignocellulosic biomass using deep eutectic solvents. Bioresource Technology. 219, 1-5 (2016).
- Mora-Pale, M., Meli, L., Doherty, T. V., Linhardt, R. J., Dordick, J. S. Room temperature ionic liquids as emerging solvents for the pretreatment of lignocellulosic biomass. Biotechnology and Bioengineering. 108 (6), 1229-1245 (2011).
- Chen, Z., Wan, C. Ultrafast fractionation of lignocellulosic biomass by microwave-assisted deep eutectic solvent pretreatment. Bioresource Technologie. 250, 532-537 (2018).
- Francisco, M., Van Den Bruinhorst, A., Kroon, M. C. New natural and renewable low transition temperature mixtures ( LTTMs ): screening as solvents for lignocellulosic biomass processing. Green Chemistry. 14 (8), 2153-2157 (2012).
- Liu, Y. C., et al. Efficient cleavage of lignin - carbohydrate complexes and ultrafast extraction of lignin oligomers from wood biomass by microwave-assisted treatment with deep eutectic solvent. Chem sus chem. 10, 1692-1700 (2017).
- Xu, G. C., Ding, J. C., Han, R. Z., Dong, J. J., Ni, Y. Enhancing cellulose accessibility of corn stover by deep eutectic solvent pretreatment for butanol fermentation. Bioresource Technologie. 203, 364-369 (2016).
- Jablonský, M., Andrea, &. #. 3. 5. 2. ;., Kamenská, L., Vrška, M., Šima, J. Deep eutectic solvents fractionation of wheat straw deep eutectic solvents fractionation of wheat straw. Bioresources. 10 (4), 8039-8047 (2015).
- Shen, X. J., et al. Facile fractionation of lignocelluloses by biomass-derived deep eutectic solvent (DES) pretreatment for cellulose enzymatic hydrolysis and lignin valorization. Green Chemistry. 21, 275-283 (2019).
- Alvarez-Vasco, C., et al. Unique low-molecular-weight lignin with high purity extracted from wood by deep eutectic solvents (DES): a source of lignin for valorization. Green Chemistry. 18, 5133-5141 (2016).
- Banu, J. R., et al. A review on biopolymer production via lignin valorization. Bioresource Technologie. 290, 121790 (2019).
- Gordobil, O., Olaizola, P., Banales, J. M., Labidi, J. Lignins from agroindustrial by-products as natural ingredients for cosmetics chemical structure and in vitro sunscreen and cytotoxic activities. Molecules. 25 (5), 1131 (2020).
- Lee, C. S., Thu Tran, T. M., Weon Choi, J., Won, K. Lignin for white natural sunscreens. International Journal of Biological Macromolecules. 122, 549-554 (2019).
- Widsten, P. Lignin-based sunscreens-state-of-the-art, prospects and challenges. Cosmetics. 7, 85 (2020).
- Qian, Y., Qiu, X., Zhu, S. Lignin: a nature-inspired sun blocker for broad-spectrum sunscreens. Royal Society of Chemistry. 17, 320-324 (2015).
- Zijlstra, D. S., et al. Extraction of lignin with high β-O-4 content by mild ethanol extraction and its effect on the depolymerization yield. Journal of Visualized Experiments. (143), e58575 (2019).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados