Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Olağandışı Akdeniz Lignoselülozik Kalıntılarından Ultra Hızlı Lignin Ekstraksiyonu
Bu Makalede
Özet
Derin ötektik solvent bazlı, mikrodalga destekli ön işlem, lignoselülozik fraksiyonasyon ve yüksek saflıkta lignin geri kazanımı için yeşil, hızlı ve verimli bir süreçtir.
Özet
Ön işlem hala lignoselülozik biyorefinery proseslerinde en pahalı adımdır. Kimyasal gereksinimlerin yanı sıra güç ve ısı tüketimi en aza indirilerek ve çevre dostu çözücüler kullanılarak uygun maliyetli hale getirilmelidir. Derin ötektik çözücüler (DESs), sürdürülebilir biyorefineries'te anahtar, yeşil ve düşük maliyetli çözücülerdir. Bunlar, en az bir hidrojen bağı donörü ve bir hidrojen bağı alıcısından kaynaklanan düşük donma noktaları ile karakterize şeffaf karışımlardır. DES'ler çözücü vaat etse de, rekabetçi karlılık için mikrodalga ışınlama gibi ekonomik bir ısıtma teknolojisiyle birleştirmek gerekir. Mikrodalga ışınlama, ısıtma süresini kısaltmak ve fraksiyonasyonu artırmak için umut verici bir stratejidir, çünkü uygun sıcaklığa hızla ulaşılabilir. Bu çalışmanın amacı, düşük maliyetli ve biyobozunur bir çözücü kullanarak biyokütle fraksiyonasyonu ve lignin ekstraksiyonu için tek adımlı, hızlı bir yöntem geliştirmekti.
Bu çalışmada, 800 W'da 60 sn boyunca mikrodalga destekli bir DES ön işlem yapıldı ve üç çeşit DES kullanılmıştır. DES karışımları kolin klorür (ChCl) ve üç hidrojen-bağ donöründen (HBD) facile olarak hazırlandı: monokarboksilik asit (laktik asit), diyarboksilik asit (oksalik asit) ve üre. Bu ön işlem, deniz kalıntılarından (Posidonia yaprakları ve aegagropile), tarım-gıda yan ürünlerinden (badem kabukları ve zeytin pomace), orman kalıntılarından (çam kozalağı) ve çok yıllık lignoselülozik otlardan(Stipa tenacissima)biyokütle fraksiyonasyonu ve lignin geri kazanımı için kullanılmıştır. Geri kazanılan lignin verim, saflık ve moleküler ağırlık dağılımını belirlemek için daha fazla analiz yapıldı. Ayrıca çıkarılan lignin kimyasal fonksiyonel gruplar üzerindeki DES'lerin etkisi Fourier-transform kızılötesi (FTIR) spektroskopisi ile belirlendi. Sonuçlar, ChCl-oksalik asit karışımının en yüksek lignin saflığını ve en düşük verimi sağladığını göstermektedir. Bu çalışma, DES-mikrodalga işleminin lignoselülozik biyokütle fraksiyonasyonu için ultra hızlı, verimli ve uygun maliyetli bir teknoloji olduğunu göstermektedir.
Giriş
Sürdürülebilir biyorefinery prosesleri biyokütle işlemeyi, fraksiyonasyonunu ilgi moleküllerine entegre eder ve katma değerli ürünlere dönüştürülmesi1. İkinci nesil biyorefiningde, biyokütlenin ana bileşenlerine fraksiyone edilmesi için ön işlem şart olarak kabul edilir2. Kimyasal, fiziksel veya biyolojik stratejiler kullanan geleneksel ön işlem yöntemleri yaygın olarak uygulanmıştır3. Bununla birlikte, bu tür ön işlem biyorefiningde en pahalı adım olarak kabul edilir ve uzun işlem süresi, yüksek ısı ve güç tüketimi ve solvent safsızlıkları4gibi başka dezavantajları vardır. Son zamanlarda, özellikleri iyonik sıvılarınkine benzeyen DESS3, biyobozunurluk, çevre dostu olma, sentez kolaylığı ve tedaviden sonra iyileşme gibi avantajlar nedeniyle yeşil çözücüler olarak ortaya çıkmıştır5.
DESs, laktik asit, malik asit veya oksalik asit gibi en az bir HBD ve betain veya kolin klorür (ChCl) gibi bir hidrojen-bağ kabul edici (HBA)karışımlarıdır 6. HBA-HBD etkileşimleri, kimyasal bağların bölünmesine izin veren, biyokütle fraksiyonasyonuna ve lignin ayrılmasına neden olan katalitik bir mekanizma sağlar. Birçok araştırmacı, mısır koçanı ve stover 7,8, ChCl-urea üzerinde ChCl-gliserol gibi lignoselülozik hammaddelerin DES tabanlı ön işlemden önce rapor olduğunu bildirmektedir. ve buğday samanı üzerinde ChCl-oksalik asit9, Okaliptüs talaş10üzerinde ChCl-laktik asit ve ahşap üzerinde ChCl-asetik asit11 ve ChCl-etilen glikol11. DES verimliliğini artırmak için, ön işlem biyokütle fraksiyonasyonunu hızlandırmak için mikrodalga tedavisi ile birleştirilmelidir5. Birçok araştırmacı, kısa bir süre içinde kolay bir adımda lignoselülozik fraksiyonasyon ve lignin ekstraksiyonu için DES'lerin kapasitesi hakkında yeni bir fikir sağlayan odun8 ve mısır sobası, switchgrass ve Miscanthus5'inböyle bir kombine ön işlemi (DES ve mikrodalga) bildirmektedir.
Lignin, biyopolimerlerin üretimi için hammadde olarak değerlenen fenolik bir makromoleküldür ve aromatik monomerler ve oligomerler gibi kimyasalların üretimi için bir alternatif sunar12. Ek olarak, lignin antioksidan ve ultraviyole emilim faaliyetleri vardır13. Çeşitli çalışmalar kozmetik ürünlerde lignin uygulamalarıbildirmiştir 14,15. Ticari güneş koruyucu ürünlere entegrasyonu, ürünün güneşten korunma faktörünü (SPF) SPF 15'ten SPF 30'a sadece 2 wt % lignin ilavesiyle ve SPF 50'ye kadar % 10 wt lignin16ilavesiyle iyileştirdi. Bu makalede, Akdeniz biyomasseslerinin kombine DES-mikrodalga ön işlem ile desteklenen lignin-karbonhidrat bölünmesi için ultra hızlı bir yaklaşım açıklanmaktadır. Bu biyomasses, özellikle zeytin pomace ve badem kabukları olmak üzere tarım-gıda yan ürünlerinden oluşur. Araştırılan diğer biyomasses deniz kökenli olanlar (Posidonia yaprakları ve aegagropile) ve bir ormandan (çam kozalağı ve yabani otlar) kaynaklananlardı. Bu çalışmanın odak noktası, bu kombine ön işlemden elde edilenin hammadde fraksiyonasyonu üzerindeki etkilerini değerlendirmek, lignin saflığı ve verimi üzerindeki etkisini araştırmak ve çıkarılan lignindeki moleküler ağırlıklar ve kimyasal fonksiyonel gruplar üzerindeki etkilerini incelemek için düşük maliyetli yeşil çözücüleri test etmekti.
Protokol
1. Biyomasses hazırlanması
- Biyokütle kurutma
- Akdeniz plajlarından hasat edilen Posidonia yapraklarını ve aegagropile toplarını(Posidonia oceanica)72 saat boyunca 40 °C'de bir fırına yerleştirin.
- Gıda endüstrilerinden üretilen badem kabuklarını (Prunus dulcis) ve zeytinyağı fabrikalarından elde edilen zeytin pomacesini(Olea europaea L.)72 saat boyunca 40 °C'de bir fırına yerleştirin.
- Bir ormandan toplanan çamkozalağını ( Pinus halepensis) ve güney Akdeniz havzasından toplanan alfa yapraklarını (Stipa tenacissima), 72 saat boyunca 40 ° C'de bir fırına yerleştirin.
NOT: Biyokütle kum içeriyorsa, fırına yerlenmeden önce damıtılmış su ile durulanmalıdır. Biyomasses Şekil 1A-F'degösterilmiştir.
- Biyokütle taşlama
- Her biyokütleden 20 g'ını 1 mm elek ile donatılmış bir çekiç kesiciye yerleştirin. Elde eden tozu 0,25 L beherde toplayın ve 0,5 mm elek ile donatılmış bir çekiç kesiciye besleyin. Tozu 0.25 L beherde toplayın.
2. Mikrodalga destekli, ultra hızlı lignin ekstraksiyonu
- Derin ötektik çözücü (DES) hazırlama
- DES1'i (ChCl-oksalik asit) 1:1 molar oranında, 174 g ChCl'yi 500 mL yuvarlak tabanlı bir şişede 126 g oksalik asit dihidrat ile karıştırarak ve homojen ve şeffaf bir sıvı oluşana kadar 70 °C'de bir banyoda 4 saat eriterek hazırlayın.
- DES2'yi (ChCl-laktik asit) 500 mL yuvarlak tabanlı bir şişede 90 g laktik asitle 174 g ChCl karıştırarak ve homojen ve şeffaf bir sıvı oluşana kadar 70 °C'de bir banyoda 4 saat eriterek 1:1 molar oranında hazırlayın.
- DES3'ü (ChCl-üre) 500 mL yuvarlak tabanlı bir şişede 120 g üre ile 174 g ChCl karıştırarak ve homojen ve şeffaf bir sıvı oluşana kadar 70 °C'de bir banyoda 4 saat eriterek 1:12 molar oranında hazırlayın.
NOT: Bu karışımları 500 rpm'de bir karıştırma çubuğu ile sürekli karıştırın.
- Kombine mikrodalga-DES tedavisi
- 5 g hammaddeyi kapalı bir politetrafloroetilen reaktöründe mikrodalga fırına yerleştirin. 50 mL DES ekleyin ve numuneye bir karıştırma çubuğu yerleştirin. Mikrodalga kabı uygun bir kapakla kapatın ve sıcaklık kapağını takın.
- Mikrodalga kabı pikap kenarına yerleştirin ve sürekli tedirgin olmasını sağlayın. Mikrodalga gücünü 1 dakika boyunca 800 W'a ayarlayın. Uygun eldivenler kullanarak kabı mikrodalga fırından çıkar ve karışımı soğumaya bırakın. Her biyokütle örneği için üç DES kullanarak bu tedaviyi tekrarlayın.
NOT: Sıcaklık probinin doğru yerleştirildiklerden ve mikrodalga kabın homojen bir sıcaklığa sahip olduğundan emin olun.
- Lignin izolasyonu
- Etanol:suyu 50:50 (v:v) oranında karıştırarak homojen bir antisolvent çözeltisi hazırlayın. İşlenmiş hammaddeye 50 mL antisolvent çözeltisi ekleyin, karışımı bir santrifüj kabına (250 mL) yerleştirin ve 3.000 × g'da5 dakika santrifüj.
- Santrifüjlemeden sonra, süpernatantı (lignin bakımından zengin fraksiyon) bir cam filtre potası (gözeneklilik 4, 10-16 μm, çap 10 mm) kullanarak filtreleyin. Santrifüjlemeden sonra toplanan kalan selüloz kalıntılarını antisolvent çözeltisinin 25 mL'si ile yıkayın.
- Her yıkamadan sonra 5 dakika boyunca 3.000 × g'da santrifüj. Tekrar yıkamalar 4x ve cam filtre potasından (gözeneklilik N 4, 10-16 μm, çap 10 mm) yıkamaları toplayın ve filtreleyin.
- Filtrelenmiş lignin bakımından zengin fraksiyonu 2.3.2 adımından filtrelenmiş yıkamalara 500 mL yuvarlak alt şişede 2.3.3 adımından ekleyin. 50 °C ve 110 mbar'da döner evaporatör kullanarak etanol buharlaştır.
- Konsantre liköre (lignin bakımından zengin fraksiyon) 150 mL deiyonize su ekleyin ve lignin santrifüjleme ile çökeltin. Lignin'i bir pelet olarak toplayın ve 25 mL damıtılmış su ile yıkayın; yıkamaları 4x tekrarlayın. Lignin'i liyofilize edin veya 40 °C'de bir fırında kurutun.
NOT: Gerekirse, tuzları çözücülerden çıkarmak için lignin >4x yıkayın. - Verimi belirlemek için aşağıdaki formülü kullanın:
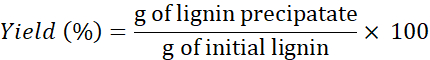
NOT: Lignin ekstraksiyonu diğer iki DES ile de gerçekleştirildi: kolin klorür + resorsinol ve kolin klorür + bütirik asit 1 dk. Bununla birlikte, bu DES'ler kullanılarak kurtarılan lignin miktarları, diğer üç DES kullanılarak elde edilen miktarlara kıyasla son derece küçüktü (ve kurtarılanın dışındaydı).
3. Klason tarafından çıkarılan lignin saflık tayini
- Klason hidrolizi için numune hazırlama
- Filtre potasını (gözeneklilik 4, çapı 4,5 mm) 4 saat (2 saat rampası, 25°C'den itibaren) için 550 °C'de bir susturucu fırınına yerleştirin. Fırın 150 °C'ye kadar soğuduğunda potayı çıkarın, soğuması için bir kurutucuya yerleştirin ve tartın.
- Bir borosilikat cam tüpe yaklaşık 30 mg lignin ekleyin (Malzeme Tablosunabakın) ve numunenin ağırlığına dikkat edin. Numuneye 1 mL% 72 sülfürik asit (H2SO4)ekleyin, numuneyi 60 dakika boyunca 30 ° C'lik bir banyoya yerleştirin ve her 10 dakikada bir girdapla karıştırın.
- Numuneyi çıkarın, 100 mL'lik bir cam şişeye aktarın ve asidi% 4 konsantrasyona seyreltmek için 28 mL damıtılmış su ekleyin. Cam şişeyi 60 dakika boyunca 121 °C'de bir otoklav içine yerleştirin. Cam şişeyi çıkarın ve soğumasını bekleyin.
- Asit çözünmeyen lignin analizi
- Hidrolizatı vakum altında bir pota kullanarak filtreleyin. Tüm katıları deiyonize su içeren bir cam şişede toplayın. Potayı 50 mL deiyonize su ile durulayın.
- Katıları içeren potayı 105 °C'de 16 saat fırına koyarak kurulayın. Potayı fırından çıkarın, bir kurutucuya yerleştirin ve soğumasını bekleyin. Örneği tartın.
- Potayı 4 saat (2 saat rampa) için 550 °C'de bir susturucu fırınına yerleştirin. Çıkarın ve bir kurutucuya yerleştirin. Örneği tartın.
- Asit çözünmeyen kalıntının (AIR) yüzdesini hesaplamak için aşağıdaki formülü kullanın:
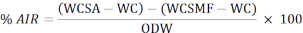
WCSA: pota ağırlığı + fırından çıkardıktan sonra numune
WC: pota ağırlığı
WCSMF: muşta fırınından çıkarıldıktan sonra pota ağırlığı
ODW: numunenin fırın kuru ağırlığı
- Asitle çözünür lignin analizi
- Adım 3.2.1'de elde edilen filtratın emiciliğini kuvars cuvettes kullanarak 205 nm'de bir spektrofotometre ile ölçün. Damıtılmış suyu boş olarak kullanın.
- Asitle çözünen kalıntının (ASL) yüzdesini hesaplamak için aşağıdaki formülü kullanın:
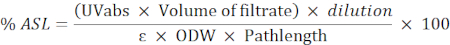
NOT: Absorbans 0.2 ile 0.7 arasında olmalıdır. Gerekirse numuneyi seyreltin.
UVabs: 205 nm'de emicilik
Pathlength: ölçüm hücresinin ışık yolu (cm olarak)
ε: belirli bir dalga boyunda biyokütle emiciliği
4. Çıkarılan lignin azot içeriği
- Alkali çözeltisinin hazırlanması
- 2,5 L hacimsel şişede, 1 kg sodyum hidroksit (NaOH) ağırlığında ve işarete kadar deiyonize su ekleyin. Şişeye manyetik bir çubuk yerleştirin ve NaOH tamamen çözünene kadar karıştırın.
- Sülfürik asit çözeltisi hazırlama
- 5 L hacimsel şişeye0,1 N H2SO 4 alın (Malzeme Tablosunabakın), 5 L işaretine kadar deiyonize su ekleyin, manyetik bir çubuk yerleştirin ve içindekiler çözünene kadar karıştırın.
- Alıcı çözümün hazırlanması
- 5 L hacimsel şişede, 100 g H3BO3 'ü (borik asit) deiyonize suda çözün ve hacmi işarete getirin.
- 100 mL hacimsel şişede 100 mg bromocresol yeşili tartın ve işarete kadar teknik metanol ekleyin.
- 100 mL hacimsel şişede 100 mg metil kırmızısı tartın ve işarete kadar teknik metanol ekleyin.
- Adım4.3.1'den 5L H 3 BO3 çözeltisini, adım 4.3.2'den 100 mL bromocresol yeşil çözeltisini, 4.3.3 adımından metil kırmızı çözeltinin 70 mL'sini ve 5 L deiyonize suyu bir kaba dökün. Alıcı çözeltiyi 30 dakika boyunca iyi çalkalayın.
NOT: Çözeltinin son rengi yeşil olmalıdır. Renk yeşil değilse, 50 mL 1 N NaOH çözeltisi ekleyin.
- Numune hazırlama
- Bir Kjeldahl tüpüne, azotsuz bir kağıda tartılmış 100 mg lignin yerleştirin, bir tablet Kjeldhal (1,5 g potasyum sülfat (K2SO4) + 0,045 g bakır sülfat pentahydrat (CuSO4,5H2O) + 0,045 g titanyum dioksit (TiO2))ekleyin ve 7,2 mL konsantre H2SO4ekleyin.
NOT: Boşluk olarak sadece azotsuz kağıtlı (numunesiz) dört tüp kullanın.
- Bir Kjeldahl tüpüne, azotsuz bir kağıda tartılmış 100 mg lignin yerleştirin, bir tablet Kjeldhal (1,5 g potasyum sülfat (K2SO4) + 0,045 g bakır sülfat pentahydrat (CuSO4,5H2O) + 0,045 g titanyum dioksit (TiO2))ekleyin ve 7,2 mL konsantre H2SO4ekleyin.
- Örnek sindirim
- 360 °C'de haznedeki termostatı 1 saat önceden kapatın.
- Numune tüplerini bir rafa yerleştirin, dört boş tüpü rafın dört köşesine yerleştirin ve rafın deliklerini (varsa) boş tüplerle doldurun.
- Rafı önceden ısıtılmış hazneye yerleştirin, emme sistemini örtün ve su pompasını açın.
NOT: Dumandan kaçınmaya özenin; dumanlar ortaya çıkarsa su akışını artırın. - 2 saat sonra, ısıtmayı kapatın, numuneleri çıkarın ve metal bir desteğe yerleştirin. Emme sistemi açıkken rafın yaklaşık 40 dakika soğumasını bekleyin.
- Kjeldhal damıtma prosedürü
- Kjeldahl damıtıcısını aç. Seçim ekranda görünene kadar Kendi kendine testlerin çalışmasına izin ver. Manuel moda geçin, boş bir tüp takın ve süryen kapıyı kapatın.
- Titrant burette (0.02 N H2SO4)(kapağı) alta ve üste birkaç kez bastırarak temizleyin ve H2SO4 şişesinin tüpünü sıkarak borulardaki hava kabarcıklarını ortadan kaldırın. Kaputu kapatın.
- H3BO3 alıcı çözeltisini 3x arındırın.
- 3x su ekleyin ve Aktif buhara (10 dk) geçin. Kjeldahl 1 analiz programına geçin. Sonuç çizgisi düzeyindeki okları kullanarak Blanco girin.
- Tüpü takın. Dört boşlukla başlayın ve ortalamalarını hesaplayın. Değeri Blanco satırına girin.
NOT: Tüp takıldıktan sonra, cihaz otomatik olarak ve art arda 30 mL H2O, 30 mL H3BO3ve 40 mL 10 N NaOH ekler. - Sonuç satırında titrant mL'ye geçin. Tüpü takın ve kullanılan H2SO4 miktarını not edin.
NOT: Kjeldahl damıtıcıyı test etmek için, 50 mg gliserin% 18.60'a ± % 5 N'ye karşılık geldiğini düşünün. Her titrasyonun sonunda, cihaz tüpü otomatik olarak boşaltır ve temizler. - N yüzdesini hesapla

V s.a: Sülfürik asit hacmi
T s.a : 0.02 N H2SO4
S: örnek kütle
5. Çıkarılan lignin kül içeriği
- Seramik potaları 105 °C'de 1 saat kurutun. Onları bir kurutucuda soğumaya bırakın.
- Bir potayı tartın ve numarasını not edin. Numune tozunun yaklaşık 1 g'ını ekleyin. Potayı aşağıdaki programla susturucu fırınına yerleştirin: 575 °C'ye kadar 2 saat rampası; 575 °C'de 4 saat plato.
- Fırının 100 °C'ye kadar soğumasını bekleyin. Potaları çıkarın, kurutucuya yerleştirin ve tartın.
6. Karbonhidrat içeriği
- Sodyum borohidrit (NaBH 4)/dimetilsüllfoksit (DMSO) çözeltisinin hazırlanması
- 100 mL hacimsel şişeye 2 g NaBH4 yerleştirin ve DMSO ile işarete doldurun. Bir Belediye Başkanının banyosunda 100 ° C'ye ısıtın ve çözeltiyi tamamen çözünene kadar karıştırın.
- MIX çözeltisinin hazırlanması
- 100 mL hacimsel bir şişeye ksiloz, arabinoz, rhamnoz, glikoz, galaktoz, mannoz ve 2-deoksiglucose'un her birini 20 mg yerleştirin ve deiyonize su ile 100 mL işaretine kadar doldurun.
- Numunenin hidrolizi
- Bir borosilikat cam tüpte 50 mg'lık bir lignin örneğini tartın, 1 M H2SO4'ün 3mL'si ekleyin ve karışımı 100 ° C'de 3 saat ısıtın.
- Numuneyi soğutun, 1 mL 15 M amonyum hidroksit (NH4OH) ekleyin ve pH'ı kontrol ederek nötr veya alkali olduğundan emin olun. Her numuneye tam olarak 1 mL iç standart (2-deoksiglucose) ekleyin.
NOT: dahili standart olarak eklenen 2-deoksiglucose, numunede bulunan her doz miktarını ölçmeyi mümkün kılar.
- Monosaccharides'in alditol asetat içine azaltılması ve asetilasyonu
- 6.3.2 adımından çözeltinin 400 μL'sini alın ve özel tüplere yerleştirin. Kontrol MIX çözeltisinin 400 μL'sini alın ve özel tüplere yerleştirin.
NOT: MIX çözeltisinin kullanılması, yanıt faktörlerinin (RF' ler) ve monoakkarit yüzdelerinin hesaplanmasını kolaylaştırır. - Bölüm 6.1'de hazırlanan NaBH4/DMSO çözümünün 2 mL'lik kısmını ekleyin. Tüpü kapatın ve bir su banyosunda 40 ° C'de 90 dakika kuluçkaya yatırın. Tüpü su banyosundan çıkarın ve 0,6 mL buzul asetik asit ekleyin.
NOT: Bu eksotermik bir reaksiyon olduğu için kabarcıklar ve duman görünecektir. - Yaklaşık 0,4 mL 1-metlimidazol ve yaklaşık 4 mL asetik anhidrit ekleyin. 15 dakika sonra, 10 mL damıtılmış su ekleyin, soğutun ve ~3 mL diklorometan ekleyin (CH2Cl2).
- En az 2 saat sonra, alt (organik) fazın ~1 mL'sini toplayın ve alev iyonizasyon dedektörü kılcal sütun, HP1-metilsiloksamın (30 m (uzunluk) x 320 μm (iç çap), 0,25 μm (film kalınlığı) ile donatılmış bir gaz kromatografına enjekte edin. Verileri analiz edin.
- Yanıt faktörünü (RF) hesaplamak için aşağıdaki formülü kullanın.
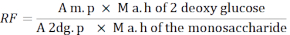
A m. p: MIX çözeltisinde monoakkarit zirvesinin alanının ortalaması
M a. h of 2 - deoksi glikoz: Hidrolizden sonra 2-deoksiglucose kütlesi
Bir 2dg. p: MIX çözeltisinde 2-deoksiglucose tepe alanının ortalaması
Monoakkarit M a. h: Hidroliz sonrası monoakkarit kütlesi
NOT: Anhidro düzeltmesi rhamnoz için 0.8, arabinoz ve ksilose için 0.88 ve mannoz, glikoz ve galaktoz için 0.9'dur. Hidroliz sonrası kütle = MIX çözeltisinde kullanılan monoakkaritin anhidro düzeltmesi x kütlesi (g). - Monoakkarit kütlesini hesaplamak için aşağıdaki formülü kullanın.
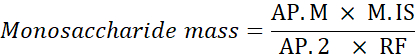
Ap. M: Analiz edilen numunede monosakkarit tepe alanı
M. IS: İç standart kütlesi eklendi; burada, C SI=1 mg/mL
AP.2: Numunedeki 2-deoksiglucose'un tepe alanı
RF: yanıt faktörü - Aşağıdaki formülü kullanarak her monoakkarit yüzdesini hesaplayın.

- 6.3.2 adımından çözeltinin 400 μL'sini alın ve özel tüplere yerleştirin. Kontrol MIX çözeltisinin 400 μL'sini alın ve özel tüplere yerleştirin.
7. Çıkarılan lignin kimyasal fonksiyonlar (Fourier dönüştürülmüş kızılötesi)
- Çıkarılan lignin kimyasal fonksiyonel gruplarını tanımlamak için, zayıflatılmış toplam yansıtıcı (ATR) modülü ile donatılmış bir FT-IR spektrometresi kullanın. Spektroskopi yazılımını açın ve parametreleri ayarlayın: çözünürlük 4 cm-1, örnek tarama süresi 32, arka plan tarama süresi 16, verileri 4000 ila 400 cm-1arasında kaydedin, sonuç spektrumu geçirgenliği.
- Herhangi bir örnek eklemeyin; arka plana tek kanalabasın. Şimdi kristal üzerine numunenin 1 mg'ını yerleştirin ve numune tek kanalabasın. Elde edilen spektrumları işleyin.
8. Çıkarılan lignin moleküler ağırlığı (jel geçirgenlik kromatografisi)
- %0,5 lityum klorür (LiCl) ile bir dimetilformamid (DMF) çözeltisi hazırlayın. 1 L hacimsel şişeye 5 g LiCl alın, gösterge çizgisine kadar DMF ekleyin ve homojen bir sıvı elde edilene kadar içeriği karıştırın.
- Lignin örneğinin 3 mg'ını% 0.5 LiCl ile 3 mL DMF'de çözün. 10 mL santrifüj tüpünde santrifüj ve çözünür fraksiyonu bir şişeye ayırın.
- %0,5 LiCl ile DMF çözeltisinde 3 mg polistiren standardı 1 kDa, 2 kDa, 3 kDa, 10 kDa, 20 kDa ve 30 kDa çözün. 10 mL borosilikat cam tüplerde santrifüj ve çözünür fraksiyonu bir şişeye aktarın.
- Yüksek performanslı bir sıvı kromatografisi-ultraviyole (UV) sistemi hazırlayın.
- Veri sistemini açın ve UV dedektörünü kontrol edin.
- Sistemi damıtılmış suyla temizle. Pistonu sıvıya takın (%0,5 LiCl'li DMF). Temizleme vanasını açın ve hattı 15 dakika boyunca 1 mL/dk akış hızıyla arındırın. Akışı durdurun ve temizleme vanasını kapatın.
- Dedektöre giden elüent yolunu temizlemek için akış hızını 10 dakika boyunca 1 mL/dk olarak ayarlayın. Akış hızını durdurun.
- Bir koruma sütunundan önceki sütunu yükleyin (Bkz. Malzeme Tablosu). Kolon ısıtıcısını 45 °C'de aç, UV dedektörünü aç ve 0,6 mL/dk'lık bir akış hızına ulaşılana kadar akış hızını kademeli olarak ayarlayın.
- Her numunenin 30 μL'sını 270 nm dalga boyunda 40 dakika boyunca enjekte edin. Elde edilen verileri işleyin ve kalibrasyon hattını kullanarak kütle dağılımını hesaplayın.
- Ortalama moleküler ağırlık (Mn), ağırlık ortalama moleküler ağırlık (Mw) ve polidisperlik indeksini (PDI) hesaplayın.
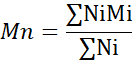
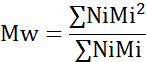
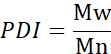
Mi: Bir zincirin moleküler ağırlığı
Ni: bu moleküler ağırlık için zincir sayısı
9. Veri işleme ve istatistiksel analizler
- Tüm analitik deneyleri üç taraflı olarak gerçekleştirin ve sonuçları kuru maddenin % 'si olarak ifade edin.
- Varyansın (ANOVA) tek yönlü analizini yapın ve Tukey'in çoklu karşılaştırma testini kullanarak araçları karşılaştırın.
- Asıl bileşen çözümlemesi (PCA) gerçekleştirin.
Sonuçlar
Şekil 2A-C, kombine mikrodalga-DES ön işleminden sonra Şekil 1A-F'de gösterilen altı hammaddeden ekstraksiyonun lignin verimini tasvireder. Sonuçlar, DES1 (ChCl-oksalik asit) (Şekil 2A) ile elde edilen lignin veriminin DES2 (ChCl-laktik asit) ve DES3 (ChCl-üre) (Şekil 2B,C)ile elde edilen ver...
Tartışmalar
Bu çalışmanın birçok amacı vardı; bunlardan ilki, hem iyonik sıvıların hem de organik çözücülerin özelliklerine sahip düşük maliyetli yeşil çözücüler hazırlamak ve kullanmaktı. İkinci amaç, alkali çözücüler, temel veya termofizik teknikler kullanılarak Soxhlet veya hemiselüloz kullanılarak çıkarılabilirlerin çıkarılması gibi ön adımlar gerektirmeden biyokütleyi fraksiyone etmek ve lignin'i tek bir adımda çıkarmaktı. Üçüncü amaç, işlemden sonra basit filtrasyonla, pH a...
Açıklamalar
Yazarlar çıkar çatışması olmadığını bildiriyor.
Teşekkürler
MK ve TB, istatistiksel analizler ve rakam hazırlama için Haitham Ayeb'e, Walloon Bölgesi'ne (Avrupa Bölgesel Kalkınma-VERDIR) ve Yükseköğretim ve Bilimsel Araştırma Bakanı'na (Taoufik Bettaieb) finansman için teşekkür ediyor.
Malzemeler
| Name | Company | Catalog Number | Comments |
| HPLC Gel Permeation Chromatography | Agilent 1200 series | ||
| 1 methylimadazole | Acros organics | ||
| 2-deoxy-D-glucose (internal standard) | Sigma Aldrich (St. Louis, USA) | ||
| Acetic acid | Sigma Aldrich (St. Louis, USA) | ||
| Acetic anhydride | Sigma Aldrich (St. Louis, USA) | ||
| Adjustables pipettors | |||
| Alkali | alkali-extracted lignin | ||
| Arabinose (99%) | Sigma Aldrich (St. Louis, USA) | ||
| Autoclave | CERTO CLAV (Model CV-22-VAC-Pro) | ||
| Water Bath at 70 °C | |||
| Boric acid | Sigma Aldrich (St. Louis, USA) | ||
| Bromocresol | Sigma Aldrich (St. Louis, USA) | ||
| Catalyst | CTQ (coded A22) (1.5 g K2SO4 + 0.045 g CuSO4.5 H2O + 0.045 g TiO2) | Merck | |
| Centrifugation container | |||
| Centrifuge | BECKMAN COULTER | Avanti J-E centrifuge | |
| Ceramic crucibles | |||
| Choline chloride 99% | Acros organics | ||
| Column | Agilent PLGel Mixed C (alpha 3,000 (4.6 × 250 mm, 5 µm) preceded by a guard column (TSK gel alpha guard column 4.6 mm × 50 mm, 5 µm) | ||
| Column | HP1-methylsisoxane (30 m, 0.32 mm, 0.25 mm) | ||
| Crucible porosity N°4 ( Filtering crucible) | Shott Duran Germany | boro 3.3 | |
| Deonized water | |||
| Dessicator | |||
| Dimethylformamide | VWR BDH Chemicals | ||
| Dimethylsulfoxide | Acros organics | ||
| Erlenmeyer flask | |||
| Ethanol | Merck (Darmstadtt, Germany) | ||
| Filtering crucibles, procelain | |||
| Filtration flasks | |||
| Fourrier Transformed Inra- Red | Vertex 70 Bruker apparatus equipped with an attenuated total reflectance (ATR) module. Spectra were recorded in the 4,000–400 cm−1 range with 32 scans at a resolution of 4.0 cm−1 | ||
| Galactose (98% | Sigma Aldrich (St. Louis, USA) | ||
| Gaz Chromatography | Agilent (7890 series) | ||
| Glass bottle 100 mL | |||
| Glass tubes ( borosilicate) with teflon caps 10 mL | |||
| Glucose (98% | Sigma Aldrich (St. Louis, USA) | ||
| Golves | |||
| Graduated cylinder 50 mL /100 mL | |||
| H2SO4 Titrisol (0.1 N) | Merck (Darmstadtt, Germany) | ||
| H2SO4 (95-98%) | Sigma Aldrich (St. Louis, USA) | BUCHI R-114) | |
| Hummer cutter equiped with 1 mm and 0.5 mm sieve | Mill Ttecator (Sweden) | Cyclotec 1093 | |
| Indulin | Raw lignin control | ||
| Kjeldahl distiller | Kjeltec 2300 (Foss) | ||
| Kjeldahl tube | FOSS | ||
| Kjeldhal rack | |||
| Kjeldhal digester | Kjeltec 2300 (Foss) | ||
| Kjeldhal suction system | |||
| Lab Chem station Software | GC data analysis | ||
| Lactic acid | Merck (Darmstadtt, Germany) | ||
| Lithium chloride LiCl | Sigma Aldrich (St. Louis, USA) | ||
| Mannose (98%) | Sigma Aldrich (St. Louis, USA) | ||
| Methyl red | |||
| Microwave | START SYNTH MILESTONE Microwave laboratory system | ||
| Microwave temperature probe | |||
| Microwave container | |||
| Muffle Furnace | |||
| NaOH | Merck (Darmstadtt, Germany) | ||
| Nitrogen free- paper | |||
| Opus | spectroscopy software | ||
| Oven | GmbH Memmert SNB100 | Memmert SNB100 | |
| Oxalic acid | VWR BDH Chemicals | ||
| P 1000 | Soda-processed lignin | ||
| pH paper | |||
| precision balance | |||
| Infrared spectroscopy | |||
| Quatz cuvette | |||
| Rhamnose (98%) | Sigma Aldrich (St. Louis, USA) | ||
| Rotary vacuum evaporator | Bucher | ||
| Round-bottom flask 500 mL | |||
| sodium borohydride NaBH4 | |||
| Schott bottle | glass bottle | ||
| Sovirel tubes | sovirel | Borosilicate glass tubes | |
| Spatule | |||
| Special tube | |||
| Spectophotometer | UV-1800 Shimadzu | ||
| Sterilization indicator tape | |||
| Stir bar in teflon | |||
| Stirring plate | |||
| Syringes | |||
| Sodium borohydride | Sigma Aldrich (St. Louis, USA) | ||
| Titrisol | Merck | Merck 109984 | 0.1 N H2SO4 |
| Urea | VWR BDH Chemicals | ||
| Vials | |||
| VolumetriC flask 2.5 L /5 L | Bucher | ||
| Vortex | |||
| Xylose (98%) | Sigma Aldrich (St. Louis, USA) |
Referanslar
- Kammoun, M., et al. Hydrothermal dehydration of monosaccharides promoted by seawater fundamentals on the catalytic role of inorganic salts. Frontiers in Chemistry. 7, 132 (2019).
- Kammoun, M., Ayeb, H., Bettaieb, T., Richel, A. Chemical characterisation and technical assessment of agri-food residues, marine matrices, and wild grasses in the South Mediterranean area: A considerable inflow for biorefineries. Waste Management. 118, 247-257 (2020).
- Zhang, C. W., Xia, S. Q., Ma, P. Facile pretreatment of lignocellulosic biomass using deep eutectic solvents. Bioresource Technology. 219, 1-5 (2016).
- Mora-Pale, M., Meli, L., Doherty, T. V., Linhardt, R. J., Dordick, J. S. Room temperature ionic liquids as emerging solvents for the pretreatment of lignocellulosic biomass. Biotechnology and Bioengineering. 108 (6), 1229-1245 (2011).
- Chen, Z., Wan, C. Ultrafast fractionation of lignocellulosic biomass by microwave-assisted deep eutectic solvent pretreatment. Bioresource Technologie. 250, 532-537 (2018).
- Francisco, M., Van Den Bruinhorst, A., Kroon, M. C. New natural and renewable low transition temperature mixtures ( LTTMs ): screening as solvents for lignocellulosic biomass processing. Green Chemistry. 14 (8), 2153-2157 (2012).
- Liu, Y. C., et al. Efficient cleavage of lignin - carbohydrate complexes and ultrafast extraction of lignin oligomers from wood biomass by microwave-assisted treatment with deep eutectic solvent. Chem sus chem. 10, 1692-1700 (2017).
- Xu, G. C., Ding, J. C., Han, R. Z., Dong, J. J., Ni, Y. Enhancing cellulose accessibility of corn stover by deep eutectic solvent pretreatment for butanol fermentation. Bioresource Technologie. 203, 364-369 (2016).
- Jablonský, M., Andrea, &. #. 3. 5. 2. ;., Kamenská, L., Vrška, M., Šima, J. Deep eutectic solvents fractionation of wheat straw deep eutectic solvents fractionation of wheat straw. Bioresources. 10 (4), 8039-8047 (2015).
- Shen, X. J., et al. Facile fractionation of lignocelluloses by biomass-derived deep eutectic solvent (DES) pretreatment for cellulose enzymatic hydrolysis and lignin valorization. Green Chemistry. 21, 275-283 (2019).
- Alvarez-Vasco, C., et al. Unique low-molecular-weight lignin with high purity extracted from wood by deep eutectic solvents (DES): a source of lignin for valorization. Green Chemistry. 18, 5133-5141 (2016).
- Banu, J. R., et al. A review on biopolymer production via lignin valorization. Bioresource Technologie. 290, 121790 (2019).
- Gordobil, O., Olaizola, P., Banales, J. M., Labidi, J. Lignins from agroindustrial by-products as natural ingredients for cosmetics chemical structure and in vitro sunscreen and cytotoxic activities. Molecules. 25 (5), 1131 (2020).
- Lee, C. S., Thu Tran, T. M., Weon Choi, J., Won, K. Lignin for white natural sunscreens. International Journal of Biological Macromolecules. 122, 549-554 (2019).
- Widsten, P. Lignin-based sunscreens-state-of-the-art, prospects and challenges. Cosmetics. 7, 85 (2020).
- Qian, Y., Qiu, X., Zhu, S. Lignin: a nature-inspired sun blocker for broad-spectrum sunscreens. Royal Society of Chemistry. 17, 320-324 (2015).
- Zijlstra, D. S., et al. Extraction of lignin with high β-O-4 content by mild ethanol extraction and its effect on the depolymerization yield. Journal of Visualized Experiments. (143), e58575 (2019).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır