Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Ultraschnelle Ligninextraktion aus ungewöhnlichen mediterranen Lignocellulose-Rückständen
In diesem Artikel
Zusammenfassung
Die tiefen eutektische lösungsmittelbasierte, mikrowellengestützte Vorbehandlung ist ein grünes, schnelles und effizientes Verfahren für die lignozellulosehaltige Fraktionierung und hochreine Ligninrückgewinnung.
Zusammenfassung
Die Vorbehandlung ist nach wie vor der teuerste Schritt in lignozellulosehaltigen Bioraffinerieprozessen. Es muss kostengünstig gemacht werden, indem der chemische Bedarf sowie der Strom- und Wärmeverbrauch minimiert und umweltfreundliche Lösungsmittel verwendet werden. Tiefe eutektische Lösungsmittel (DESs) sind wichtige, grüne und kostengünstige Lösungsmittel in nachhaltigen Bioraffinerien. Es handelt sich um transparente Gemische, die sich durch niedrige Gefrierpunkte aus mindestens einem Wasserstoffbrückendonor und einem Wasserstoffbrückenabnahmer ergeben. Obwohl DES vielversprechende Lösungsmittel sind, ist es notwendig, sie mit einer wirtschaftlichen Heiztechnologie wie Mikrowellenbestrahlung zu kombinieren, um eine wettbewerbsfähige Rentabilität zu erreichen. Mikrowellenbestrahlung ist eine vielversprechende Strategie, um die Aufheizzeit zu verkürzen und die Fraktionierung zu steigern, da sie schnell die entsprechende Temperatur erreichen kann. Ziel dieser Studie war es, eine einstufige, schnelle Methode zur Biomassefraktionierung und Ligninextraktion unter Verwendung eines kostengünstigen und biologisch abbaubaren Lösungsmittels zu entwickeln.
In dieser Studie wurde eine mikrowellengestützte DES-Vorbehandlung für 60 s bei 800 W unter Verwendung von drei Arten von DES durchgeführt. Die DES-Mischungen wurden einfach aus Cholinchlorid (ChCl) und drei Wasserstoffbindungsdonatoren (HBDs) hergestellt: einer Monocarbonsäure (Milchsäure), einer Dicarbonsäure (Oxalsäure) und Harnstoff. Diese Vorbehandlung wurde für die Biomassefraktionierung und Die Rückgewinnung von Lignin aus marinen Rückständen (Posidonia-Blätter und Aegagropile), Agrar- und Lebensmittelnebenprodukten (Mandelschalen und Oliventrester), Waldresten (Tannenzapfen) und mehrjährigen Lignocellulosengräsern(Stipa tenacissima)verwendet. Weitere Analysen wurden durchgeführt, um die Ausbeute, Reinheit und Molekulargewichtsverteilung des zurückgewonnenen Lignins zu bestimmen. Zusätzlich wurde die Wirkung von DESs auf die chemischen funktionellen Gruppen im extrahierten Lignin mittels Fourier-Transformations-Infrarotspektroskopie (FTIR) bestimmt. Die Ergebnisse deuten darauf hin, dass das ChCl-Oxalsäure-Gemisch die höchste Ligninreinheit und die geringste Ausbeute bietet. Die vorliegende Studie zeigt, dass das DES-Mikrowellenverfahren eine ultraschnelle, effiziente und kostengünstige Technologie für die lignozellulosehaltige Biomassefraktionierung ist.
Einleitung
Nachhaltige Bioraffinerieprozesse integrieren die Verarbeitung von Biomasse, ihre Fraktionierung in interessierende Moleküle und ihre Umwandlung in Mehrwertprodukte1. Bei der Bioraffination der zweiten Generation wird die Vorbehandlung als wesentlich für die Fraktionierung von Biomasse in ihre Hauptbestandteile angesehen2. Traditionelle Vorbehandlungsmethoden, die chemische, physikalische oder biologische Strategien verwenden, wurden weit verbreitet3. Eine solche Vorbehandlung gilt jedoch als der teuerste Schritt in der Bioraffinierung und hat weitere Nachteile wie lange Verarbeitungszeit, hohen Wärme- und Stromverbrauch sowie Lösungsmittelverunreinigungen4. In jüngster Zeit haben sich DESs, deren Eigenschaften denen ionischer Flüssigkeiten3ähneln, aufgrund von Vorteilen wie biologischer Abbaubarkeit, Umweltfreundlichkeit, einfacher Synthese und Rückgewinnung nach der Behandlung als grüne Lösungsmittel herauskristallisiert5.
DESs sind Mischungen aus mindestens einem HBD, wie Milchsäure, Apfelsäure oder Oxalsäure, und einem Wasserstoffbrückenakzeptor (HBA) wie Betain oder Cholinchlorid (ChCl)6. HBA-HBD-Wechselwirkungen ermöglichen einen katalytischen Mechanismus, der die Spaltung chemischer Bindungen ermöglicht, was zu Biomassefraktionierung und Lignintrennung führt. Viele Forscher haben über die DES-basierte Vorbehandlung von lignozellulosehaltigen Rohstoffen wie ChCl-Glycerin auf Maiskolben und Stover7,8,ChCl-Harnstoff und ChCl-Oxalsäure auf Weizenstroh9, ChCl-Milchsäure auf Eukalyptussägemehl 10und ChCl-Essigsäure11 und ChCl-Ethylenglykol auf Holz11berichtet. Um die DES-Effizienz zu verbessern, sollte die Vorbehandlung mit einer Mikrowellenbehandlung kombiniert werden, um die Biomassefraktionierung zu beschleunigen5. Viele Forscher haben über eine solche kombinierte Vorbehandlung (DES und Mikrowelle) von Holz 8 und von Maissover, Switchgrass und Miscanthus5berichtet, die neue Einblicke in die Kapazität von DESs für die Lignocellulosic-Fraktionierung und Ligninextraktion ineinem einfachen Schritt über einen kurzen Zeitraum liefert.
Lignin ist ein phenolisches Makromolekül, das als Rohstoff für die Herstellung von Biopolymeren verwertet wird und eine Alternative zur Herstellung von Chemikalien wie aromatischen Monomeren und Oligomerendarstellt 12. Darüber hinaus hat Lignin antioxidative und ultraviolette Absorptionsaktivitäten13. Mehrere Studien haben über Ligninanwendungen in kosmetischen Produktenberichtet 14,15. Seine Integration in kommerzielle Sonnenschutzprodukte hat den Lichtschutzfaktor (LSF) des Produkts von LSF 15 auf LSF 30 mit der Zugabe von nur 2 Gew.-% Lignin und bis zu LSF 50 mit Dem Zusatz von 10 Gew.-% Lignin16verbessert. Dieser Artikel beschreibt einen ultraschnellen Ansatz für die Lignin-Kohlenhydrat-Spaltung, unterstützt durch kombinierte DES-Mikrowellenvorbehandlung mediterraner Biomassen. Diese Biomassen bestehen aus Agrar- und Lebensmittelnebenprodukten, insbesondere Oliventrester und Mandelschalen. Andere Biomassen, die untersucht wurden, waren solche marinen Ursprungs (Posidonia-Blätter und Aegagropile) und solche, die aus einem Wald stammen (Tannenzapfen und Wildgräser). Der Fokus dieser Studie lag darauf, kostengünstige grüne Lösungsmittel zu testen, um die Auswirkungen dieser kombinierten Vorbehandlung auf die Rohstofffraktionierung zu bewerten, ihren Einfluss auf die Reinheit und Ausbeute von Lignin zu untersuchen und ihre Auswirkungen auf die Molekulargewichte und chemischen Funktionsgruppen im extrahierten Lignin zu untersuchen.
Protokoll
1. Aufbereitung von Biomassen
- Biomassetrocknung
- Die Posidonia Blätter und Aegagropile Kugeln (Posidonia oceanica), geerntet von mediterranen Stränden, in einen Ofen bei 40 °C für 72 h stellen.
- Die Mandelschalen (Prunus dulcis), die aus der Lebensmittelindustrie hergestellt werden, und Oliventrester (Olea europaea L.),die aus Olivenölmühlen gewonnen werden, in einem Ofen bei 40 ° C für 72 h stellen.
- Die Tannenzapfen (Pinus halepensis), gesammelt aus einem Wald, und Alfa-Blätter (Stipa tenacissima), gesammelt aus dem südlichen Mittelmeerraum, in einen Ofen bei 40 ° C für 72 h legen.
HINWEIS: Wenn die Biomasse Sand enthält, muss sie mit destilliertem Wasser gespült werden, bevor sie in den Ofen gestellt wird. Die Biomassen sind in Abbildung 1A-F dargestellt.
- Biomassemahlung
- 20 g jeder Biomasse in einen Hammerschneider geben, der mit einem 1-mm-Sieb ausgestattet ist. Sammeln Sie das resultierende Pulver in einem 0,25-l-Becherglas und geben Sie es einem Hammerschneider zu, der mit einem 0,5-mm-Sieb ausgestattet ist. Sammeln Sie das Pulver in einem 0,25 L Becherglas.
2. Mikrowellengestützte, ultraschnelle Ligninextraktion
- Herstellung von tiefen eutektischen Lösungsmitteln (DES)
- DES1 (ChCl-Oxalsäure) in einem molaren Verhältnis von 1:1 herstellen, indem 174 g ChCl mit 126 g Oxalsäuredihydrat in einem 500 ml Rundkolben gemischt und in einem Bad bei 70 °C für 4 h schmelzen, bis eine homogene und transparente Flüssigkeit entsteht.
- DES2 (ChCl-Milchsäure) in einem molaren Verhältnis von 1:1 herstellen, indem 174 g ChCl mit 90 g Milchsäure in einem 500 mL Rundkolben gemischt und in einem Bad bei 70 °C für 4 h eingeschmolzen werden, bis eine homogene und transparente Flüssigkeit entsteht.
- DES3 (ChCl-Harnstoff) in einem molaren Verhältnis von 1:12 vorbereiten, indem 174 g ChCl mit 120 g Harnstoff in einem 500 mL Rundkolben gemischt und in einem Bad bei 70 °C für 4 h schmelzen, bis eine homogene und transparente Flüssigkeit entsteht.
HINWEIS: Rühren Sie diese Mischungen kontinuierlich mit einem Rührstab bei 500 U / min.
- Kombinierte Mikrowellen-DES-Behandlung
- 5 g des Ausgangsmaterials in eine Mikrowelle in einem geschlossenen Polytetrafluorethylenreaktor geben. Fügen Sie 50 ml DES hinzu und legen Sie einen Rührstab in die Probe. Schließen Sie den Mikrowellenbehälter mit einer entsprechenden Kappe und befestigen Sie die Temperaturkappe.
- Stellen Sie den Mikrowellenbehälter auf den Rand des Plattenspielers und stellen Sie sicher, dass er ständig gerührt wird. Stellen Sie die Mikrowellenleistung für 1 min auf 800 W ein. Nehmen Sie mit geeigneten Handschuhen den Behälter aus der Mikrowelle und lassen Sie die Mischung abkühlen. Wiederholen Sie diese Behandlung mit den drei DESs für jede Biomasseprobe.
HINWEIS: Überprüfen und stellen Sie sicher, dass der Temperaturfühler richtig platziert ist und der Mikrowellenbehälter eine homogene Temperatur hat.
- Lignin-Isolierung
- Bereiten Sie eine homogene antisolvente Lösung vor, indem Sie Ethanol: Wasser in einem Verhältnis von 50: 50 (v: v) mischen. 50 ml der antifesten Lösung in das behandelte Ausgangsmaterial geben, die Mischung in einen Zentrifugationsbehälter (250 ml) geben und 5 min bei 3.000 × gzentrifugieren.
- Nach der Zentrifugation wird der Überstand (ligninreiche Fraktion) mit einem Glasfiltertiegel (Porosität 4, 10-16 μm, Durchmesser 10 mm) filtriert. Waschen Sie die nach der Zentrifugation gesammelten Zelluloserückstände mit 25 ml der antifesten Lösung.
- Zentrifuge bei 3.000 × g für 5 min nach jeder Wäsche. Wiederholen Sie die Wäsche 4x und sammeln und filtern Sie die Wäschen durch den Glasfiltertiegel (Porosität N 4, 10-16 μm, Durchmesser 10 mm).
- Die gefilterte ligninreiche Fraktion aus Schritt 2.3.2 wird den gefilterten Waschungen aus Schritt 2.3.3 in einem 500 ml Rundkolben hinzugefügt. Ethanol mit einem Rotationsverdampfer bei 50 °C und 110 mbar verdampfen.
- Fügen Sie der konzentrierten Flüssigkeit (ligninreiche Fraktion) 150 ml entionisiertes Wasser hinzu und fallen Sie das Lignin durch Zentrifugation aus. Sammeln Sie Lignin als Pellet und waschen Sie es mit 25 ml destilliertem Wasser; Wiederholen Sie die Waschungen 4x. Lignin lyophilisieren oder im Ofen bei 40 °C trocknen.
HINWEIS: Falls erforderlich, Lignin >4x waschen, um die Salze aus den Lösungsmitteln zu entfernen. - Verwenden Sie die folgende Formel, um den Ertrag zu bestimmen:
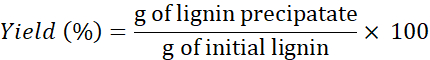
HINWEIS: Die Ligninextraktion wurde auch mit zwei anderen DES durchgeführt: Cholinchlorid + Resorcin und Cholinchlorid + Buttersäure nach 1 min. Die mit diesen DESs gewonnenen Ligninmengen waren jedoch im Vergleich zu den mit den anderen drei DES gewonnenen Mengen extrem gering (und nicht einbringlich).
3. Reinheitsbestimmung von extrahierten Lignin durch Klason
- Probenvorbereitung für klason Hydrolyse
- Den Filtertiegel (Porosität 4, Durchmesser 4,5 mm) für 4 h (2 h Rampe, ab 25°C) in einen Schalldämpferofen bei 550 °C stellen. Entfernen Sie den Tiegel, wenn der Ofen auf 150 °C abgekühlt ist, legen Sie ihn zum Abkühlen in einen Austrocknungsmittel und wiegen Sie ihn.
- Fügen Sie etwa 30 mg Lignin in ein Borosilikatglasröhrchen hinzu (siehe Materialtabelle)und notieren Sie das Gewicht der Probe. 1 ml 72% Schwefelsäure(H2SO4)in die Probe geben, die Probe für 60 min in ein 30 °C-Bad geben und alle 10 min durch Wirbeln mischen.
- Entfernen Sie die Probe, geben Sie sie in eine 100-ml-Glasflasche und fügen Sie 28 ml destilliertes Wasser hinzu, um die Säure auf eine Konzentration von 4% zu verdünnen. Stellen Sie die Glasflasche für 60 min in einen Autoklaven bei 121 °C. Entfernen Sie die Glasflasche und lassen Sie sie abkühlen.
- Analyse von säureunlöslichem Lignin
- Filtern Sie das Hydrolysat mit einem Tiegel unter Vakuum. Sammeln Sie alle Feststoffe in einer Glasflasche, die entionisiertes Wasser enthält. Spülen Sie den Tiegel mit 50 ml entionisiertem Wasser ab.
- Trocknen Sie den Tiegel, der die Feststoffe enthält, indem Sie ihn für 16 h bei 105 °C in einen Ofen stellen. Nehmen Sie den Tiegel aus dem Ofen, legen Sie ihn in einen Austrocknungsmittel und lassen Sie ihn abkühlen. Wiegen Sie die Probe.
- Den Tiegel für 4 h (2 h Rampe) in einen Dumpfofen bei 550 °C stellen. Entfernen Sie es und legen Sie es in einen Trockener. Wiegen Sie die Probe.
- Verwenden Sie die folgende Formel, um den Prozentsatz des säureunlöslichen Rückstands (AIR) zu berechnen:
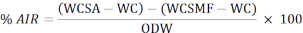
WCSA: Gewicht des Tiegels + Probe nach dem Entfernen aus dem Ofen
WC: Gewicht des Tiegels
WCSMF: Gewicht des Tiegels nach dem Entfernen aus dem Schalldämpferofen
ODW: Ofentrockengewicht der Probe
- Analyse von säurelöslichem Lignin
- Messen Sie die Absorption des in Schritt 3.2.1 erhaltenen Filtrats mit einem Spektralphotometer bei 205 nm unter Verwendung von Quarzküvetten. Verwenden Sie destilliertes Wasser als Rohling.
- Verwenden Sie die folgende Formel, um den Prozentsatz des säurelöslichen Rückstands (ASL) zu berechnen:
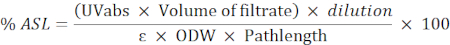
HINWEIS: Die Absorption sollte zwischen 0,2 und 0,7 liegen. Verdünnen Sie die Probe bei Bedarf.
UVabs: Absorption bei 205 nm
Pfadlänge: Lichtweg der Messzelle (in cm)
ε: Absorptionsfähigkeit von Biomasse bei einer bestimmten Wellenlänge
4. Stickstoffgehalt in extrahiertem Lignin
- Herstellung von Alkalilösung
- In einem 2,5-L-Messkolben 1 kg Natriumhydroxid (NaOH) wiegen und entionisiertes Wasser bis zur Markierung hinzufügen. Legen Sie einen Magnetstab in den Kolben und rühren Sie, bis der NaOH vollständig aufgelöst ist.
- Zubereitung von Schwefelsäurelösungen
- Nehmen Sie 0,1 N H2SO4 (siehe Materialtabelle)in einen 5-L-Messkolben, fügen Sie entionisiertes Wasser bis zur 5-L-Marke hinzu, legen Sie einen Magnetstab und rühren Sie um, bis sich der Inhalt auflöst.
- Vorbereitung der Empfangslösung
- In einem 5 L Messkolben 100 gH3BO3 (Borsäure) in entionisiertem Wasser auflösen und das Volumen auf die Marke bringen.
- Wiegen Sie 100 mg Bromocresolgrün in einem 100-ml-Messkolben und fügen Sie technisches Methanol bis zur Markierung hinzu.
- Wiegen Sie 100 mg Methylrot in einem 100-ml-Messkolben und fügen Sie technisches Methanol bis zur Markierung hinzu.
- Gießen Sie die 5 lH3BO3-Lösung aus Schritt 4.3.1, 100 ml Bromocresolgrüne Lösung aus Schritt 4.3.2, 70 ml der Methylrotlösung aus Schritt 4.3.3 und 5 l entionisiertes Wasser in einen Behälter. Schütteln Sie die Empfangslösung 30 Minuten lang gut.
HINWEIS: Die endgültige Farbe der Lösung muss grün sein. Wenn die Farbe nicht grün ist, fügen Sie 50 ml 1 N NaOH-Lösung hinzu.
- Probenvorbereitung
- In ein Kjeldahl-Röhrchen 100 mg Lignin auf ein stickstofffreies Papier geben, eine Tablette Kjeldhal (1,5 g Kaliumsulfat(K2SO4)+ 0,045 g Kupfersulfatpentahydrat (CuSO4,5H2O)+ 0,045 g Titandioxid (TiO2) hinzufügen und 7,2 mL konzentriertesH2SO4hinzufügen.
HINWEIS: Verwenden Sie vier Röhrchen mit nur stickstofffreiem Papier (ohne die Proben) als Rohlinge.
- In ein Kjeldahl-Röhrchen 100 mg Lignin auf ein stickstofffreies Papier geben, eine Tablette Kjeldhal (1,5 g Kaliumsulfat(K2SO4)+ 0,045 g Kupfersulfatpentahydrat (CuSO4,5H2O)+ 0,045 g Titandioxid (TiO2) hinzufügen und 7,2 mL konzentriertesH2SO4hinzufügen.
- Probenaufschluss
- Schalten Sie den Thermostat am Fermenter 1 h im Voraus bei 360 °C ein.
- Legen Sie die Probenröhrchen auf ein Rack, legen Sie die vier leeren Röhrchen an die vier Ecken des Racks und füllen Sie die Löcher (falls vorhanden) des Racks mit leeren Röhrchen.
- Legen Sie das Gestell in den vorgewärmten Fermenter, decken Sie das Saugsystem ab und öffnen Sie die Wasserpumpe.
HINWEIS: Achten Sie darauf, Dämpfe zu vermeiden; erhöhen Sie den Wasserfluss, wenn Dämpfe auftreten. - Nach 2 h die Heizung ausschalten, die Proben entfernen und auf eine Metallstütze legen. Lassen Sie das Rack bei eingeschaltetem Saugsystem ca. 40 Minuten abkühlen.
- Kjeldhal Destillationsverfahren
- Schalten Sie den Kjeldahl-Destillateur ein. Lassen Sie die Ausführung von Selbsttests zu, bis Auswahl auf dem Bildschirm angezeigt wird. Wechseln Sie in den manuellen Modus, führen Sie ein leeres Rohr ein und schließen Sie die Schiebetür.
- Reinigen Sie die Titrierkohle (0,02 N H2SO4)(heben Sie die Abdeckung an), indem Sie sie unten und oben mehrmals drücken, und entfernen Sie Luftblasen aus den Rohren, indem Sie das Rohr der H2SO4-Flasche zusammendrücken. Schließen Sie die Haube.
- Reinigen Sie dieH3BO3 Empfangslösung 3x.
- Fügen Sie 3x Wasser hinzu und wechseln Sie zu Aktivdampf (10 min). Wechseln Sie zum Analyseprogramm Kjeldahl 1. Geben Sie Blanco mit den Pfeilen auf der Ergebnislinienebene ein.
- Setzen Sie das Röhrchen ein. Beginnen Sie mit den vier Leerzeichen und berechnen Sie ihre Durchschnittswerte. Geben Sie den Wert in die Blanco-Zeile ein.
HINWEIS: Nachdem das Rohr eingeführt wurde, fügt das Gerät automatisch und sukzessive 30 mlH2O,30 mlH3BO3und 40 ml 10 N NaOH hinzu. - Wechseln Sie in der Ergebniszeilezu ml Titriermittel . Setzen Sie das Röhrchen ein und notieren Sie die Menge des verwendetenH2SO4.
HINWEIS: Um den Kjeldahl-Destillateur zu testen, beachten Sie, dass 50 mg Glycerin 18,60% ± 5% % % N entsprechen. Am Ende jeder Titration entleert und reinigt das Gerät automatisch das Röhrchen. - Berechnen Sie den Prozentsatz von N.

V s.a : Volumen der Schwefelsäure
T s.a : 0,02 N H2SO4
S: Probenmasse
5. Aschegehalt in extrahierten Lignin
- Trocknen Sie die Keramiktiegel 1 h bei 105 °C. Lassen Sie sie in einem Austrocknungsmittel abkühlen.
- Wiegen Sie einen Tiegel und notieren Sie seine Nummer. Fügen Sie etwa 1 g des Probenpulvers hinzu. Legen Sie den Tiegel in den Schalldämpferofen mit folgendem Programm: eine 2 h Rampe bis 575 °C; ein Plateau von 4 h bei 575 °C.
- Den Backofen auf 100 °C abkühlen lassen. Entfernen Sie die Tiegel, legen Sie sie in den Austrocknungser und wiegen Sie sie.
6. Kohlenhydratgehalt
- Herstellung von Natriumborhydrid (NaBH4)/Dimethylsulfoxid (DMSO)-Lösung
- 2 g NaBH4 in einen 100-ml-Messkolben geben und bis zur Marke mit DMSO füllen. In einem Mayor's Bath auf 100 °C erhitzen und die Lösung vollständig auflösen.
- Herstellung der MIX-Lösung
- Geben Sie jeweils 20 mg Xylose, Arabinose, Rhamnose, Glukose, Galactose, Mannose und 2-Desoxyglucose in einen 100-ml-Messkolben und füllen Sie sie bis zu einer Marke von 100 ml mit entionisiertem Wasser.
- Hydrolyse der Probe
- Wiegen Sie eine 50 mg Ligninprobe in einem Borosilikatglasröhrchen, fügen Sie 3 ml 1 MH2SO4hinzu und erhitzen Sie die Mischung für 3 h bei 100 °C.
- Kühlen Sie die Probe, fügen Sie 1 ml 15 M Ammoniumhydroxid (NH4 OH)hinzu und überprüfen Sie den pH-Wert, um sicherzustellen, dass er neutral oder alkalisch ist. Fügen Sie genau 1 ml internen Standard (2-Desoxyglucose) zu jeder Probe hinzu.
HINWEIS: Die als interner Standard zugesetzte 2-Desoxyglucose ermöglicht es, die Menge jeder in der Probe vorhandenen Dosis zu quantifizieren.
- Reduktion und Acetylierung von Monosacchariden zu Alditolacetat
- Nehmen Sie 400 μL der Lösung aus Schritt 6.3.2 und legen Sie sie in spezielle Röhrchen. Nehmen Sie 400 μL der Kontroll-MIX-Lösung und legen Sie sie in spezielle Röhrchen.
HINWEIS: Die Verwendung der MIX-Lösung erleichtert die Berechnung von Antwortfaktoren (RFs) und Monosaccharid-Prozentsätzen. - 2 ml der in Abschnitt6.1vorbereiteten NaBH 4 /DMSO-Lösung werden hinzugefügt. Das Röhrchen schließen und 90 min bei 40 °C in einem Wasserbad inkubieren. Entfernen Sie das Röhrchen aus dem Wasserbad und fügen Sie 0,6 ml Eisessig hinzu.
HINWEIS: Da es sich um eine exotherme Reaktion handelt, treten Blasen und Rauch auf. - Fügen Sie etwa 0,4 ml 1-Methylimidazol und etwa 4 ml Essigsäureanhydrid hinzu. Nach 15 minuten 10 ml destilliertes Wasser hinzufügen, abkühlen und ~3 ml Dichlormethan(CH2Cl2)hinzufügen.
- Nach mindestens 2 h ~1 ml der unteren (organischen) Phase sammeln und in einen Gaschromatographen injizieren, der mit einer Flammenionisationsdetektor-Kapillarsäule, HP1-Methylsiloxan (30 m (Länge) x 320 μm (Innendurchmesser), 0,25 μm (Schichtdicke)) ausgestattet ist. Analysieren Sie die Daten.
- Verwenden Sie die folgende Formel, um den Ansprechfaktor (RF) zu berechnen.
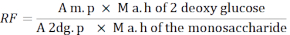
A m. p: Durchschnitt der Fläche des Monosaccharidpeaks in der MIX-Lösung
M a. h von 2 - Desoxyglukose: Masse von 2-Desoxyglucose nach Hydrolyse
Eine 2dg. p: Mittelwert der Fläche des 2-Desoxyglucose-Peaks in der MIX-Lösung
M a. h des Monosaccharids: Masse des Monosaccharids nach Hydrolyse
HINWEIS: Die Anhydrokorrektur beträgt 0,8 für Rhamnose, 0,88 für Arabinose und Xylose und 0,9 für Mannose, Glukose und Galactose. Masse nach Hydrolyse = Wasserkraftkorrektur x Masse (g) des in der MIX-Lösung verwendeten Monosaccharids. - Verwenden Sie die folgende Formel, um die Monosaccharidmasse zu berechnen.
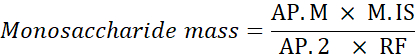
Ld. M: Monosaccharid-Peak-Bereich in der analysierten Probe
M. IS: Masse des internen Standards hinzugefügt; hier C SI=1 mg/ml
AP.2: Peakfläche von 2-Desoxyglucose in der Probe
RF: Ansprechfaktor - Berechnen Sie den Prozentsatz jedes Monosaccharids mit der folgenden Formel.

- Nehmen Sie 400 μL der Lösung aus Schritt 6.3.2 und legen Sie sie in spezielle Röhrchen. Nehmen Sie 400 μL der Kontroll-MIX-Lösung und legen Sie sie in spezielle Röhrchen.
7. Chemische Funktionen in extrahiertem Lignin (Fourier-transformiertes Infrarot)
- Um die chemischen funktionellen Gruppen in extrahiertem Lignin zu identifizieren, verwenden Sie ein FT-IR-Spektrometer, das mit einem attenuierten Totalreflexionsmodul (ATR) ausgestattet ist. Öffnen Sie die Spektroskopie-Software und passen Sie die Parameter an: Auflösung 4 cm-1, Probenscanzeit 32, Hintergrundscanzeit 16, Daten von 4000 bis 400 cm-1speichern, Ergebnisspektrumübertragung.
- Fügen Sie keine Probe hinzu; Drücken Sie den Hintergrund auf Einzelkanal. Legen Sie nun 1 mg der Probe auf den Kristall und drücken Sie die Probe auf einen Kanal. Verarbeiten Sie die erhaltenen Spektren.
8. Molekulargewicht des extrahierten Lignins (Gelpermeationschromatographie)
- Bereiten Sie eine Lösung von Dimethylformamid (DMF) mit 0,5% Lithiumchlorid (LiCl) vor. Nehmen Sie 5 g LiCl in einem 1-L-Messkolben, fügen Sie DMF bis zur Messlinie hinzu und mischen Sie den Inhalt, bis eine homogene Flüssigkeit erhalten ist.
- 3 mg der Ligninprobe werden in 3 mL DMF mit 0,5% LiCl gelöst. Zentrifuge in einem 10-ml-Zentrifugenröhrchen und trenne die lösliche Fraktion in eine Durchstechflasche.
- 3 mg Polystyrol Standard 1 kDa, 2 kDa, 3 kDa, 10 kDa, 20 kDa und 30 kDa werden in der Lösung von DMF mit 0,5% LiCl gelöst. Zentrifugieren Sie in 10 ml Borosilikatglasröhren und übertragen Sie die lösliche Fraktion in eine Durchstechflasche.
- Bereiten Sie ein Hochleistungs-Flüssigkeitschromatographie-Ultraviolett (UV) -System vor.
- Öffnen Sie das Datensystem und überprüfen Sie den UV-Detektor.
- Reinigen Sie das System mit destilliertem Wasser. Installieren Sie den Kolben im Eluenten (DMF mit 0,5% LiCl). Öffnen Sie das Spülventil und spülen Sie die Leitung mit einer Durchflussrate von 1 ml/min für 15 min. Stoppen Sie den Durchfluss und schließen Sie das Spülventil.
- Stellen Sie die Durchflussrate für 10 minuten auf 1 ml/min ein, um den Eluentenweg zum Detektor zu reinigen. Stoppen Sie die Durchflussrate.
- Installieren Sie die Spalte, der eine Schutzsäule vorangestellt ist (siehe Materialtabelle). Schalten Sie die Säulenheizung bei 45 °C ein, schalten Sie den UV-Detektor ein und stellen Sie den Durchfluss schrittweise ein, bis ein Durchfluss von 0,6 ml/min erreicht ist.
- Injizieren Sie 30 μL jeder Probe für 40 min bei einer Wellenlänge von 270 nm. Verarbeiten Sie die erhaltenen Daten und berechnen Sie die Massenverteilung mit der Kalibrierlinie.
- Berechnen Sie die Anzahl des mittleren Molekulargewichts (Mn), des durchschnittlichen Molekulargewichts (Mw) und des Polydispersitätsindex (PDI).
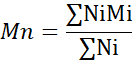
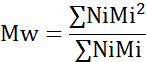
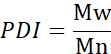
Mi: Molekulargewicht einer Kette
Ni: Anzahl der Ketten für dieses Molekulargewicht
9. Datenverarbeitung und statistische Auswertungen
- Führen Sie alle analytischen Experimente in dreifacher Ausführung durch und drücken Sie die Ergebnisse in % der Trockenmasse aus.
- Führen Sie eine Einweg-Varianzanalyse (ANOVA) durch und vergleichen Sie die Mittelwerte mit dem Mehrfachvergleichstest von Tukey.
- Führen Sie eine Hauptkomponentenanalyse (PCA) durch.
Ergebnisse
Abbildung 2A-C zeigt die Ligninausbeute der Extraktion aus den sechs Rohstoffen, die in Abbildung 1A-Fdargestellt sind, nach der kombinierten Mikrowellen-DES-Vorbehandlung. Die Ergebnisse zeigen, dass die mit DES1 (ChCl-Oxalsäure) erzielte Ligninausbeute (Abbildung 2A) niedriger war als die mit DES2 (ChCl-Milchsäure) und DES3 (ChCl-Harnstoff) erz...
Diskussion
Diese Studie hatte viele Ziele; Die erste bestand darin, kostengünstige grüne Lösungsmittel mit den Eigenschaften sowohl ionischer Flüssigkeiten als auch organischer Lösungsmittel zuzubereiten und zu verwenden. Das zweite Ziel bestand darin, die Biomasse zu fraktionieren und Lignin in einem einzigen Schritt zu extrahieren, ohne dass vorbereitende Schritte wie die Extraktion von Extrahliables mit Soxhlet oder Hemicellulose mit alkalischen Lösungsmitteln, grundlegenden oder thermophysikalischen Techniken erforderlich...
Offenlegungen
Die Autoren berichten von keinem Interessenkonflikt.
Danksagungen
MK und TB danken Haitham Ayeb für statistische Analysen und die Erstellung von Zahlen, Wallonische Region (European Regional Development-VERDIR) und Minister für Hochschulbildung und wissenschaftliche Forschung (Taoufik Bettaieb) für die Finanzierung.
Materialien
| Name | Company | Catalog Number | Comments |
| HPLC Gel Permeation Chromatography | Agilent 1200 series | ||
| 1 methylimadazole | Acros organics | ||
| 2-deoxy-D-glucose (internal standard) | Sigma Aldrich (St. Louis, USA) | ||
| Acetic acid | Sigma Aldrich (St. Louis, USA) | ||
| Acetic anhydride | Sigma Aldrich (St. Louis, USA) | ||
| Adjustables pipettors | |||
| Alkali | alkali-extracted lignin | ||
| Arabinose (99%) | Sigma Aldrich (St. Louis, USA) | ||
| Autoclave | CERTO CLAV (Model CV-22-VAC-Pro) | ||
| Water Bath at 70 °C | |||
| Boric acid | Sigma Aldrich (St. Louis, USA) | ||
| Bromocresol | Sigma Aldrich (St. Louis, USA) | ||
| Catalyst | CTQ (coded A22) (1.5 g K2SO4 + 0.045 g CuSO4.5 H2O + 0.045 g TiO2) | Merck | |
| Centrifugation container | |||
| Centrifuge | BECKMAN COULTER | Avanti J-E centrifuge | |
| Ceramic crucibles | |||
| Choline chloride 99% | Acros organics | ||
| Column | Agilent PLGel Mixed C (alpha 3,000 (4.6 × 250 mm, 5 µm) preceded by a guard column (TSK gel alpha guard column 4.6 mm × 50 mm, 5 µm) | ||
| Column | HP1-methylsisoxane (30 m, 0.32 mm, 0.25 mm) | ||
| Crucible porosity N°4 ( Filtering crucible) | Shott Duran Germany | boro 3.3 | |
| Deonized water | |||
| Dessicator | |||
| Dimethylformamide | VWR BDH Chemicals | ||
| Dimethylsulfoxide | Acros organics | ||
| Erlenmeyer flask | |||
| Ethanol | Merck (Darmstadtt, Germany) | ||
| Filtering crucibles, procelain | |||
| Filtration flasks | |||
| Fourrier Transformed Inra- Red | Vertex 70 Bruker apparatus equipped with an attenuated total reflectance (ATR) module. Spectra were recorded in the 4,000–400 cm−1 range with 32 scans at a resolution of 4.0 cm−1 | ||
| Galactose (98% | Sigma Aldrich (St. Louis, USA) | ||
| Gaz Chromatography | Agilent (7890 series) | ||
| Glass bottle 100 mL | |||
| Glass tubes ( borosilicate) with teflon caps 10 mL | |||
| Glucose (98% | Sigma Aldrich (St. Louis, USA) | ||
| Golves | |||
| Graduated cylinder 50 mL /100 mL | |||
| H2SO4 Titrisol (0.1 N) | Merck (Darmstadtt, Germany) | ||
| H2SO4 (95-98%) | Sigma Aldrich (St. Louis, USA) | BUCHI R-114) | |
| Hummer cutter equiped with 1 mm and 0.5 mm sieve | Mill Ttecator (Sweden) | Cyclotec 1093 | |
| Indulin | Raw lignin control | ||
| Kjeldahl distiller | Kjeltec 2300 (Foss) | ||
| Kjeldahl tube | FOSS | ||
| Kjeldhal rack | |||
| Kjeldhal digester | Kjeltec 2300 (Foss) | ||
| Kjeldhal suction system | |||
| Lab Chem station Software | GC data analysis | ||
| Lactic acid | Merck (Darmstadtt, Germany) | ||
| Lithium chloride LiCl | Sigma Aldrich (St. Louis, USA) | ||
| Mannose (98%) | Sigma Aldrich (St. Louis, USA) | ||
| Methyl red | |||
| Microwave | START SYNTH MILESTONE Microwave laboratory system | ||
| Microwave temperature probe | |||
| Microwave container | |||
| Muffle Furnace | |||
| NaOH | Merck (Darmstadtt, Germany) | ||
| Nitrogen free- paper | |||
| Opus | spectroscopy software | ||
| Oven | GmbH Memmert SNB100 | Memmert SNB100 | |
| Oxalic acid | VWR BDH Chemicals | ||
| P 1000 | Soda-processed lignin | ||
| pH paper | |||
| precision balance | |||
| Infrared spectroscopy | |||
| Quatz cuvette | |||
| Rhamnose (98%) | Sigma Aldrich (St. Louis, USA) | ||
| Rotary vacuum evaporator | Bucher | ||
| Round-bottom flask 500 mL | |||
| sodium borohydride NaBH4 | |||
| Schott bottle | glass bottle | ||
| Sovirel tubes | sovirel | Borosilicate glass tubes | |
| Spatule | |||
| Special tube | |||
| Spectophotometer | UV-1800 Shimadzu | ||
| Sterilization indicator tape | |||
| Stir bar in teflon | |||
| Stirring plate | |||
| Syringes | |||
| Sodium borohydride | Sigma Aldrich (St. Louis, USA) | ||
| Titrisol | Merck | Merck 109984 | 0.1 N H2SO4 |
| Urea | VWR BDH Chemicals | ||
| Vials | |||
| VolumetriC flask 2.5 L /5 L | Bucher | ||
| Vortex | |||
| Xylose (98%) | Sigma Aldrich (St. Louis, USA) |
Referenzen
- Kammoun, M., et al. Hydrothermal dehydration of monosaccharides promoted by seawater fundamentals on the catalytic role of inorganic salts. Frontiers in Chemistry. 7, 132 (2019).
- Kammoun, M., Ayeb, H., Bettaieb, T., Richel, A. Chemical characterisation and technical assessment of agri-food residues, marine matrices, and wild grasses in the South Mediterranean area: A considerable inflow for biorefineries. Waste Management. 118, 247-257 (2020).
- Zhang, C. W., Xia, S. Q., Ma, P. Facile pretreatment of lignocellulosic biomass using deep eutectic solvents. Bioresource Technology. 219, 1-5 (2016).
- Mora-Pale, M., Meli, L., Doherty, T. V., Linhardt, R. J., Dordick, J. S. Room temperature ionic liquids as emerging solvents for the pretreatment of lignocellulosic biomass. Biotechnology and Bioengineering. 108 (6), 1229-1245 (2011).
- Chen, Z., Wan, C. Ultrafast fractionation of lignocellulosic biomass by microwave-assisted deep eutectic solvent pretreatment. Bioresource Technologie. 250, 532-537 (2018).
- Francisco, M., Van Den Bruinhorst, A., Kroon, M. C. New natural and renewable low transition temperature mixtures ( LTTMs ): screening as solvents for lignocellulosic biomass processing. Green Chemistry. 14 (8), 2153-2157 (2012).
- Liu, Y. C., et al. Efficient cleavage of lignin - carbohydrate complexes and ultrafast extraction of lignin oligomers from wood biomass by microwave-assisted treatment with deep eutectic solvent. Chem sus chem. 10, 1692-1700 (2017).
- Xu, G. C., Ding, J. C., Han, R. Z., Dong, J. J., Ni, Y. Enhancing cellulose accessibility of corn stover by deep eutectic solvent pretreatment for butanol fermentation. Bioresource Technologie. 203, 364-369 (2016).
- Jablonský, M., Andrea, &. #. 3. 5. 2. ;., Kamenská, L., Vrška, M., Šima, J. Deep eutectic solvents fractionation of wheat straw deep eutectic solvents fractionation of wheat straw. Bioresources. 10 (4), 8039-8047 (2015).
- Shen, X. J., et al. Facile fractionation of lignocelluloses by biomass-derived deep eutectic solvent (DES) pretreatment for cellulose enzymatic hydrolysis and lignin valorization. Green Chemistry. 21, 275-283 (2019).
- Alvarez-Vasco, C., et al. Unique low-molecular-weight lignin with high purity extracted from wood by deep eutectic solvents (DES): a source of lignin for valorization. Green Chemistry. 18, 5133-5141 (2016).
- Banu, J. R., et al. A review on biopolymer production via lignin valorization. Bioresource Technologie. 290, 121790 (2019).
- Gordobil, O., Olaizola, P., Banales, J. M., Labidi, J. Lignins from agroindustrial by-products as natural ingredients for cosmetics chemical structure and in vitro sunscreen and cytotoxic activities. Molecules. 25 (5), 1131 (2020).
- Lee, C. S., Thu Tran, T. M., Weon Choi, J., Won, K. Lignin for white natural sunscreens. International Journal of Biological Macromolecules. 122, 549-554 (2019).
- Widsten, P. Lignin-based sunscreens-state-of-the-art, prospects and challenges. Cosmetics. 7, 85 (2020).
- Qian, Y., Qiu, X., Zhu, S. Lignin: a nature-inspired sun blocker for broad-spectrum sunscreens. Royal Society of Chemistry. 17, 320-324 (2015).
- Zijlstra, D. S., et al. Extraction of lignin with high β-O-4 content by mild ethanol extraction and its effect on the depolymerization yield. Journal of Visualized Experiments. (143), e58575 (2019).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten