A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
מיצוי ליגנין מהיר במיוחד משאריות ליגנוקלולוסיות ים תיכוניות יוצאות דופן
In This Article
Summary
טיפול מקדים מבוסס אוטקטי עמוק בסיוע מיקרוגל הוא תהליך ירוק, מהיר ויעיל לשברים ליגנוקלוסיים והתאוששות ליגנין בטוהר גבוה.
Abstract
טיפול מקדים הוא עדיין הצעד היקר ביותר בתהליכי ביו-ריטריזנציה ליגנוקלוסיים. זה חייב להיעשות חסכוני על ידי מזעור דרישות כימיות, כמו גם צריכת חשמל וחום ועל ידי שימוש בממסים ידידותיים לסביבה. ממיסים אוטקטיים עמוקים (DESS) הם ממיסים מרכזיים, ירוקים וזולים בביו-ריינסרים בני קיימא. הם תערובות שקופות המאופיינות בנקודות הקפאה נמוכות הנובעות מתורם אג"ח מימן אחד לפחות ומקבל קשר מימן אחד. למרות DESs הם ממיסים מבטיחים, יש צורך לשלב אותם עם טכנולוגיית חימום כלכלית, כגון הקרנת מיקרוגל, לרווחיות תחרותית. הקרנת מיקרוגל היא אסטרטגיה מבטיחה לקצר את זמן החימום ולהגביר את השבר כי זה יכול להגיע במהירות לטמפרטורה המתאימה. מטרת המחקר הייתה לפתח שיטה חד-שלבית ומהירה לשבר ביומסה ומיצוי ליגנין באמצעות ממס זול ומתכלה.
במחקר זה, טיפול קדם DES בסיוע מיקרוגל נערך במשך 60 s ב 800 W, באמצעות שלושה סוגים של DESS. תערובות DES הוכנו באופן קל מ כולין כלוריד (ChCl) ושלושה תורמי אג"ח מימן (HBDs): חומצה מונוקרבוקסילית (חומצה לקטית), חומצה דיקרבוקסילית (חומצה אוקסלית) ואאוריאה. טיפול מקדים זה שימש לשבר ביומסה והתאוששות ליגנין משאריות ימיות (עלי פוסידוניה ואגאגרופילי), תוצרי לוואי של מזון אגרי (קליפות שקדים ופומאס זית), שאריות יער (אצטרובלים) ועשבים ליגנוקלוליים רב שנתיים(Stipa tenacissima). ניתוחים נוספים נערכו כדי לקבוע את התשואה, טוהר, התפלגות משקל מולקולרי של ליגנין התאושש. בנוסף, ההשפעה של DESS על הקבוצות הפונקציונליות הכימיות של ליגנין שחולץ נקבעה על ידי ספקטרוסקופיית אינפרא אדום (FTIR) של פורייה. התוצאות מצביעות על כך שתערובת החומצה ChCl-אוקסלית מעניקה את טוהר הליגנין הגבוה ביותר ואת התשואה הנמוכה ביותר. המחקר הנוכחי מראה כי תהליך DES-מיקרוגל הוא טכנולוגיה אולטרה מהיר, יעיל, ועלות תחרותי עבור שבר ביומסה lignocellulosic.
Introduction
תהליכי ביורפינריה בני קיימא משלבים עיבוד ביומסה, השבר למולקולות מעניינות והמרתם למוצרים בעלי ערך מוסף1. בדור השני של הביו-זיקוק, טיפול מקדים נחשב חיוני לשבר ביומסה למרכיביו העיקריים2. שיטות מסורתיות לטיפול מקדים תוך שימוש באסטרטגיות כימיות, פיזיות או ביולוגיות יושמו באופן נרחב3. עם זאת, טיפול מקדים כזה נחשב הצעד היקר ביותר ב biorefining ויש לו חסרונות אחרים כגון זמן עיבוד ארוך, חום גבוה וצריכת חשמל, וזיהומים ממס4. לאחרונה, DESS, אשר המאפיינים דומים לאלה של נוזלים יוניים3, הופיעו כמו ממיסים ירוקים בשל יתרונות כגון מתכלה, ידידותיות לסביבה, קלות סינתזה, והתאוששות לאחר טיפול5.
DESs הם תערובות של HBD אחד לפחות, כגון חומצה לקטית, חומצה מאלית, או חומצה אוקסלית, ומקבל קשר מימן (HBA) כגון בטאין או כולין כלוריד (ChCl)6. אינטראקציות HBA-HBD מאפשרות מנגנון קטליטי המאפשר מחשוף של קשרים כימיים, דבר הגורם לשבר ביומסה והפרדת ליגנין. חוקרים רבים דיווחו על טיפול מראש מבוסס DES של feedstocks ליגנוקלוסי כגון ChCl-גליצרול על קלח תירס stover7,8, ChCl-אוריאה, וחומצה ChCl-אוקסלית על קש חיטה9, חומצה ChCl-לקטית על נסורת אקליפטוס 10, וחומצה ChCl-אצטית11 ו ChCl-אתילן גליקול עלעץ 11. כדי לשפר את יעילות DES, יש לשלב את הטיפול המקדים עם טיפול במיקרוגל כדי להאיץ את שבר ביומסה5. חוקרים רבים דיווחו על טיפול מקדים משולב כזה (DES ומיקרוגל) שלעץ 8 ושל stover תירס, switchgrass, ו Miscanthus 5 , אשר מספקתובנהחדשה לתוך היכולת של DESS עבור שבר ליגנוקלוסי מיצוי ליגנין בצעד קל אחד על פני תקופה קצרה.
ליגנין הוא מקרומולקולה פנולית המוערכת כחומר גלם לייצור ביופולימרים ומציגה חלופה לייצור כימיקלים כגון מונומרים ארומטיים ואוליגומרים12. בנוסף, ליגנין יש נוגד חמצון ופעילויות ספיגה אולטרה סגול13. מספר מחקרים דיווחו על יישומי ליגנין במוצרי קוסמטיקה14,15. שילובה במוצרי קרם הגנה מסחריים שיפר את גורם ההגנה מפני השמש (SPF) של המוצר מ- SPF 15 ל- SPF 30 עם תוספת של 2 wt % ליגנין בלבד ועד SPF 50 בתוספת של 10 wt % ליגנין16. מאמר זה מתאר גישה אולטרה-מהיר עבור מחשוף ליגנין-פחמימות, בסיוע משולב DES-מיקרוגל pretreatment של ביומסות ים תיכוניות. ביומסות אלה מורכבות מתוצרי לוואי של מזון אגרי, במיוחד פומס זית וקליפות שקדים. ביומסות אחרות שנחקרו היו אלה ממוצא ימי (עלי פוסידוניה ו aegagropile) ואלה שמקורם ביער (אצטרובלים ועשבי בר). המוקד של מחקר זה היה לבדוק ממיסים ירוקים בעלות נמוכה כדי להעריך את ההשפעות של טיפול משולב זה על שבר feedstock, כדי לחקור את השפעתה על טוהר ליגנין ותשואה, וללמוד את השפעותיו על משקולות מולקולריות וקבוצות תפקודיות כימיות ב lignin שחולצו.
Protocol
1. הכנת ביומסות
- ייבוש ביומסה
- מניחים את עלי Posidonia וכדורי aegagropile(Posidonia oceanica),שנקטפו מחופי הים התיכון, בתנור ב 40 מעלות צלזיוס במשך 72 שעות.
- מניחים את קליפות השקדים (Prunus dulcis), המופקות מתעשיות המזון, ואת פומס זית(Olea europaea L.),המתקבל מטחנות שמן זית, בתנור ב 40 מעלות צלזיוס למשך 72 שעות.
- מניחים את האצטרובלים(Pinus halepensis),שנאספו מיער, ועלי אלפא(Stipa tenacissima),שנאספו מדרום אגן הים התיכון, בתנור ב 40 מעלות צלזיוס במשך 72 שעות.
הערה: אם הביומסה מכילה חול, יש לשטוף אותה במים מזוקקים לפני שהיא מוכנסת לתנור. הביומסות מוצגות באיור 1A-F.
- שחיקת ביומסה
- מניחים 20 גרם של כל ביומסה חותך פטיש מצויד מסננת 1 מ"מ. לאסוף את האבקה וכתוצאה מכך 0.25 L beaker ולהאכיל אותו חותך פטיש מצויד מסננת 0.5 מ"מ. לאסוף את האבקה ב 0.25 L הכף.
2. מיצוי ליגנין אולטרה מהיר בסיוע מיקרוגל
- הכנת ממס אוקטקטי עמוק (DES)
- הכן DES1 (חומצה אוקסלית ChCl) ביחס טוחן של 1:1 על ידי ערבוב 174 גרם של ChCl עם 126 גרם של חומצה אוקסלית dihydrate בבקבוק 500 מ"ל עגול למטה וממיס אותם באמבטיה ב 70 °C (70 °F) במשך 4 שעות עד נוזל הומוגני ושקוף נוצר.
- הכן DES2 (חומצה לקטית ChCl) ביחס טוחן של 1:1 על ידי ערבוב 174 גרם של ChCl עם 90 גרם של חומצה לקטית בבקבוק 500 מ"ל עגול התחתון וממיס אותם באמבטיה ב 70 מעלות צלזיוס במשך 4 שעות עד נוזל הומוגני ושקוף נוצר.
- הכן DES3 (ChCl-urea) ביחס טוחן של 1:12 על ידי ערבוב 174 גרם של ChCl עם 120 גרם של אוריאה בבקבוקון עגול 500 מ"ל למטה וממיס אותם באמבטיה ב 70 מעלות צלזיוס במשך 4 שעות עד נוזל הומוגני ושקוף נוצר.
הערה: מערבבים תערובות אלה ברציפות עם בר ערבוב ב 500 סל"ד.
- טיפול משולב במיקרוגל-DES
- מניחים 5 גרם של ההזנה במיקרוגל בכור פוליטרפלואורותילן סגור. הוסיפו 50 מ"ל של DES, והניחו פס ערבוב במדגם. סגרו את מיכל המיקרוגל עם מכסה מתאים וחברו את מכסה הטמפרטורה.
- מניחים את מיכל המיקרוגל על קצה הפטיפון, ומבטיחים שהוא נסער כל הזמן. הגדר את עוצמת המיקרוגל ב- 800 W למשך דקה. בעזרת כפפות מתאימות מוציאים את המיכל מהמיקרוגל ומניחים לתערובת להתקרר. חזור על טיפול זה באמצעות שלוש DESs עבור כל מדגם ביומסה.
הערה: בדוק וודא כי בדיקת הטמפרטורה ממוקמת כראוי, ואת מיכל המיקרוגל יש טמפרטורה הומוגנית.
- בידוד ליגנין
- הכן פתרון נוגד תרסיס הומוגני על ידי ערבוב אתנול:מים ביחס של 50:50 (v:v). הוסף 50 מ"ל של פתרון antisolvent כדי feedstock מטופלים, למקם את התערובת במיכל צנטריפוגה (250 מ"ל), וצנטריפוגה במשך 5 דקות ב 3,000 × גרם.
- לאחר צנטריפוגה, לסנן את supernatant (שבר עשיר lignin) באמצעות כור היתוך מסנן זכוכית (נקבוביות 4, 10-16 מיקרומטר, קוטר 10 מ"מ). לשטוף את שאריות תאית הנותרים שנאספו לאחר צנטריפוגה עם 25 מ"ל של פתרון antisolvent.
- צנטריפוגה ב 3,000 × גרם במשך 5 דקות לאחר כל לשטוף. חוזר שוטף 4x, ולאסוף ולסנן את הכביסה דרך כור ההיתוך מסנן זכוכית (נקבוביות N 4, 10-16 מיקרומטר, קוטר 10 מ"מ).
- הוסף את השבר העשיר בignin מסונן משלב 2.3.2 לשטיפות מסוננות משלב 2.3.3 בבקבוקון תחתון עגול של 500 מ"ל. לאדות אתנול באמצעות מאייד סיבובי ב 50 מעלות צלזיוס ו 110 mbar.
- מוסיפים 150 מ"ל של מים שעברו דה-יון למשקאות חריפים מרוכזים (שבר עשיר במינין), ומזרזים את הלינין על ידי צנטריפוגה. לאסוף ליגנין כמו גלולה, ולשטוף אותו עם 25 מ"ל של מים מזוקקים; חזור על הכביסה 4x. Lyophilize ליגנין, או לייבש אותו בתנור ב 40 מעלות צלזיוס.
הערה: במידת הצורך, לשטוף ליגנין >4x כדי להסיר את המלחים מן הממיסים. - השתמש בנוסחה הבאה כדי לקבוע את התשואה:
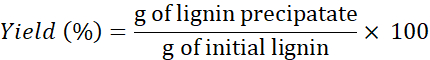
הערה: מיצוי ליגנין בוצע גם עם שני DESs אחרים: כולין כלוריד + resorcinol ו כולין כלוריד + חומצה בוטירית ב 1 דקות. עם זאת, כמויות של ליגנין התאושש באמצעות DESs אלה היו קטנים מאוד (ובלתי הפיך) לעומת הסכומים שהושגו באמצעות שלושת DESs האחרים.
3. קביעת טוהר של ליגנין שחולץ על ידי קלסון
- הכנה לדוגמה לקלסון הידרוליזה
- מניחים את כור ההיתוך מסנן (נקבוביות 4, קוטר 4.5 מ"מ) בתנור עמום ב 550 מעלות צלזיוס עבור 4 שעות (2 h רמפה, מ 25 מעלות צלזיוס). מוציאים את כור ההיתוך כשהתנור מתקרר ל-150 מעלות צלזיוס, מניחים אותו במייבש כדי להתקרר, ומשקלם.
- מוסיפים כ-30 מ"ג ליגנין לצינור זכוכית בורוסיליקט (ראו טבלת החומרים),ושימו לב למשקל המדגם. מוסיפים 1 מ"ל של 72% חומצה גופרתית (H2SO4)לדגימה, מניחים את המדגם באמבטיה של 30 מעלות צלזיוס במשך 60 דקות, ומערבבים כל 10 דקות על ידי מערבולת.
- מוציאים את הדגימה, מעבירים אותה לבקבוק זכוכית של 100 מ"ל ומוסיפים 28 מ"ל מים מזוקקים כדי לדלל את החומצה לריכוז של 4%. מניחים את בקבוק הזכוכית במובלעת אוטומטית ב 121 מעלות צלזיוס במשך 60 דקות. הסר את בקבוק הזכוכית, ולאפשר לו להתקרר.
- ניתוח של ליגנין מסיס בחומצה
- לסנן את הידרוליסטים באמצעות כור היתוך תחת ואקום. לאסוף את כל המוצקים בבקבוק זכוכית המכיל מים deionized. לשטוף את כור ההיתוך עם 50 מ"ל של מים deionized.
- יבש את כור ההיתוך המכיל את המוצקים על ידי הצבתו בתנור ב 105 מעלות צלזיוס במשך 16 שעות. מוציאים את כור ההיתוך מהתנור, מניחים אותו במייבש ומאפשרים לו להתקרר. שקל את הדגימה.
- מניחים את כור ההיתוך בתנור עמום ב 550 מעלות צלזיוס עבור 4 שעות (2 h רמפה). מוציאים אותו ומניחים במייבש. שקל את הדגימה.
- השתמש בנוסחה הבאה כדי לחשב את אחוז השאריות מסיסות חומצה (AIR):
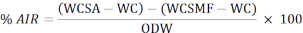
WCSA: משקל כור ההיתוך + מדגם לאחר הסרתם מהתנור
WC: משקל כור ההיתוך
WCSMF: משקל כור ההיתוך לאחר הסרתו מתנור עמום
ODW: משקל יבש בתנור של המדגם
- ניתוח של ליגנין מסיס בחומצה
- למדוד את ספיגת הסינון המתקבל בשלב 3.2.1 עם ספקטרופוטומטר ב 205 ננומטר באמצעות קוובט קוורץ. השתמש במים מזוקקים כריקים.
- השתמש בנוסחה הבאה כדי לחשב את אחוז השאריות מסיסות בחומצה (ASL):
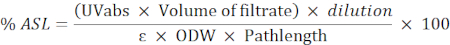
הערה: הספיגה צריכה להיות בין 0.2 ל-0.7. לדלל את המדגם במידת הצורך.
UVabs: ספיגה ב 205 ננומטר
אורך פתיל: נתיב אור של תא המדידה (בס"מ)
ε: ספיגת ביומסה באורך גל מסוים
4. תוכן חנקן ליגנין שחולץ
- הכנת פתרון אלקלי
- בבקבוק נפחי של 2.5 ליטר, שוקלים 1 ק"ג נתרן הידרוקסידי (NaOH) ומוסיפים מים שעברו דה-אוניזציה עד לסימן. מניחים מוט מגנטי בבקבוקון, ומערבבים עד שה-NaOH מתמוסס לחלוטין.
- הכנת פתרון חומצה גופרתית
- קח 0.1 N H2SO4 (ראה את תוכן החומרים)בבקבוק 5 L נפחי, להוסיף מים deionized עד סימן 5 L, למקם מוט מגנטי, ומערבבים עד התוכן להתמוסס.
- הכנת פתרון קבלה
- בבקבוקון נפחי 5 L, להמיס 100 גרם של H3BO3 (חומצה בורית) במים deionized, ולהעלות את עוצמת הקול לסימן.
- שוקלים 100 מ"ג של ירוק ברומוקרסול בבקבוק נפחי של 100 מ"ל, ומוסיפים מתנול טכני עד לסימן.
- שוקלים 100 מ"ג של אדום מתיל בבקבוק נפחי של 100 מ"ל, ומוסיפים מתנול טכני עד לסימן.
- יוצקים את 5 L של H3BO3 פתרון משלב 4.3.1, 100 מ"ל של פתרון ירוק bromocresol משלב 4.3.2, 70 מ"ל של הפתרון אדום מתיל משלב 4.3.3, ו 5 L של מים deionized לתוך מיכל. לנער את הפתרון המקבל היטב במשך 30 דקות.
הערה: הצבע הסופי של הפתרון חייב להיות ירוק. אם הצבע אינו ירוק, להוסיף 50 מ"ל של 1 N NaOH פתרון.
- הכנה לדוגמה
- בצינור Kjeldahl, מקום 100 מ"ג של ליגנין שקל על נייר ללא חנקן, להוסיף טבליה של Kjeldhal (1.5 גרם אשלגן גופרתי (K2SO4) + 0.045 גרם נחושת סולפט pentahydrate (CuSO4.5H2O) + 0.045 גרם טיטניום דו חמצני (TiO2)), ולהוסיף 7.2 מ"ל של מרוכז H2SO4.
הערה: השתמש בארבעה צינורות עם נייר ללא חנקן בלבד (ללא הדגימות) כתעלות ריקות.
- בצינור Kjeldahl, מקום 100 מ"ג של ליגנין שקל על נייר ללא חנקן, להוסיף טבליה של Kjeldhal (1.5 גרם אשלגן גופרתי (K2SO4) + 0.045 גרם נחושת סולפט pentahydrate (CuSO4.5H2O) + 0.045 גרם טיטניום דו חמצני (TiO2)), ולהוסיף 7.2 מ"ל של מרוכז H2SO4.
- עיכול לדוגמה
- הפעל את התרמוסטט על המעכל 1 שעות מראש ב 360 מעלות צלזיוס.
- מניחים את צינורות הדגימה על מתלה, מניחים את ארבעת הצינורות הריקים בארבע פינות המדף, וממלאים את החורים (אם בכלל) של המדף בצינורות ריקים.
- מניחים את המדף בעיכול שחומם מראש, מכסים את מערכת היניקה ופותחים את משאבת המים.
הערה: יש להקפיד להימנע מאדים; להגדיל את זרימת המים אם אדים מופיעים. - לאחר 2 שעות, לכבות את החימום, להסיר את הדגימות, ומניחים אותם על תמיכה מתכת. אפשר למתלה להתקרר במשך כ-40 דקות כשמערכת היניקה מופעלת.
- הליך זיקוק Kjeldhal
- תדליק את מזקקת קיידל. אפשר הפעלה של בדיקות עצמיות עד להופעת הקטע הנבחר על המסך. עבור למצב ידני, הכנס צינור ריק וסגור את דלת ההזזה.
- לטהר את burette titrant (0.02 N H2SO4) (להרים את המכסה) על ידי לחיצה עליו בחלק התחתון והחלק העליון מספר פעמים, ולחסל בועות אוויר מן הצינורות על ידי סחיטת הצינור של H2SO4 בקבוק. סגור את מכסה המנוע.
- לטהר את H3BO3 קבלת פתרון 3x.
- מוסיפים מים 3x, ולעבור קיטור פעיל (10 דקות). עבור לתוכנית הניתוח Kjeldahl 1. הזן בלאנקו באמצעות החצים ברמת קו התוצאה.
- הכנס את הצינור. התחל עם ארבעת החסרים וחשב את הממוצעים שלהם. הזן את הערך בשורה בלאנקו.
הערה: לאחר הצינור מוכנס, המכשיר באופן אוטומטי ברציפות מוסיף 30 מ"ל של H2O, 30 מ"ל של H3BO3, ו 40 מ"ל של 10 N NaOH. - עבור ל- mL של רודן בשורת התוצאה. הכנס את הצינור, וציין את כמות H2SO4 בשימוש.
הערה: כדי לבדוק את מזקקת Kjeldahl, שקול כי 50 מ"ג גליצרין תואמים 18.60% ± 5% של % N. בסוף כל טיטרציה, המכשיר מתרוקן ומנקה את הצינור באופן אוטומטי. - חשב את האחוז של N.

V s.a : נפח של חומצה גופרתית
T s.a : 0.02 N H2SO4
S: מסה לדוגמה
5. תכולת אפר במינין שחולץ
- יבש את כור ההיתוך הקרמי במשך שעה ב 105 מעלות צלזיוס. השאירו אותם להתקרר במתייבש.
- שוקל כור היתוך, ושים לב למספרו. מוסיפים כ 1 גרם של אבקת המדגם. מניחים את כור ההיתוך בתנור עמום עם התוכנית הבאה: רמפה 2 שעות עד 575 מעלות צלזיוס; רמה של 4 שעות ב 575 מעלות צלזיוס.
- אפשר לתנור להתקרר עד 100 מעלות צלזיוס. מוציאים את כור ההיתוך, מניחים אותם במתייבש, ומשקללים אותם.
6. תכולת פחמימות
- הכנת נתרן בורוחידריד (NaBH4) /פתרון דימתילסולפוקסיד (DMSO)
- מניחים 2 גרם של NaBH4 בבקבוק נפחי של 100 מ"ל, וממלאים לסימן עם DMSO. מחממים עד 100 מעלות צלזיוס באמבטיה של ראש העיר, ומערבבים את הפתרון עד להמסה מוחלטת.
- הכנת פתרון MIX
- מניחים 20 מ"ג כל אחד xylose, arabinose, rhamnose, גלוקוז, גלקטוז, מנוז, ו 2-deoxyglucose בבקבוק נפחי 100 מ"ל, ולמלא עד לסימן של 100 מ"ל עם מים deionized.
- הידרוליזה של המדגם
- שוקלים דגימה של 50 מ"ג של ליגנין בצינור זכוכית בורוסיליקט, מוסיפים 3 מ"ל של 1 M H2SO4, ומחממים את התערובת במשך 3 שעות ב 100 מעלות צלזיוס.
- מצננים את הדגימה, מוסיפים 1 מ"ל של אמוניום הידרוקסיד 15 מ' (NH4OH), ובדקו את רמת ה-pH כדי לוודא שהיא נייטרלית או אלקליין. הוסף בדיוק 1 מ"ל של תקן פנימי (2-deoxyglucose) לכל מדגם.
הערה: 2-deoxyglucose הוסיף כסטנדרט פנימי מאפשר לכמת את הכמות של כל מנה נוכח המדגם.
- הפחתה ואצטילציה של מונו-סכרידים לאצטט אלדיטול
- קח 400 μL של הפתרון משלב 6.3.2, ומניחים אותו בצינורות מיוחדים. קח 400 μL של פתרון MIX הבקרה, ומניחים אותו בצינורות מיוחדים.
הערה: השימוש בתמיסת MIX מקל על חישוב גורמי תגובה (RFs) ואחוזים חד-סכרידים. - הוסף 2 מ"ל של פתרון NaBH4/DMSO שהוכן בסעיף 6.1. סגור את הצינור, ודגר במשך 90 דקות ב 40 מעלות צלזיוס באמבט מים. מוציאים את הצינור מאמבט המים ומוסיפים 0.6 מ"ל של חומצה אצטית קרחונית.
הערה: מכיוון שזו תגובה אקסותרמית, יופיעו בועות ועשן. - יש להוסיף כ-0.4 מ"ל של מתילימידזול אחד וכ-4 מ"ל של אנהידריד אצטי. לאחר 15 דקות, להוסיף 10 מ"ל של מים מזוקקים, מגניב, ולהוסיף ~ 3 מ"ל של dichloromethane (CH2Cl2).
- לאחר 2 שעות לפחות, לאסוף ~ 1 מ"ל של השלב התחתון (אורגני), ולהזריק אותו לתוך כרומטוגרף גז מצויד בעמודה נימי גלאי יינון להבה, HP1-מתילסילוקסן (30 מטר (אורך) x 320 מיקרומטר (קוטר פנימי), 0.25 מיקרומטר (עובי הסרט)). נתח את הנתונים.
- השתמש בנוסחה הבאה כדי לחשב את פקטור התגובה (RF).
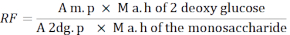
מ.פ: ממוצע השטח של פסגת המונו-סכריד בתמיסת MIX
M a. h של 2 - גלוקוז deoxy: מסה של 2-deoxyglucose לאחר הידרוליזה
2dg. p: ממוצע השטח של שיא 2-deoxyglucose בתמיסת MIX
M a. h של המונו-סכריד: המסה של המונו-סכריד לאחר הידרוליזה
הערה: תיקון Anhydro הוא 0.8 עבור rhamnose, 0.88 עבור arabinose ו xylose, ו 0.9 עבור מנוז, גלוקוז, וגלקטוז. מסה לאחר הידרוליזה = תיקון anhydro x מסה (g) של monosaccharide המשמש בתמיסת MIX. - השתמש בנוסחה הבאה כדי לחשב את מסת המונו-סכריד.
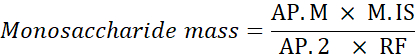
AP. M: אזור שיא מונו-סכריד במדגם המנותח
M. IS: מסה של תקן פנימי הוסיף; כאן, C SI = 1 מ"ג / מ"ל
AP.2: אזור שיא של 2-deoxyglucose במדגם
RF: גורם תגובה - חשב את האחוז של כל מונו-סכריד באמצעות הנוסחה הבאה.

- קח 400 μL של הפתרון משלב 6.3.2, ומניחים אותו בצינורות מיוחדים. קח 400 μL של פתרון MIX הבקרה, ומניחים אותו בצינורות מיוחדים.
7. פונקציות כימיות ליגנין שחולצו (פורייה-טרנספורמציה אינפרא אדום)
- כדי לזהות את הקבוצות הפונקציונליות הכימיות במינין שחולץ, השתמש בספקטרומטר FT-IR המצויד במודול רפלקטיביות כוללת מוחלש (ATR). פתח את תוכנת הספקטרוסקופיה, והתאם את הפרמטרים: רזולוציה 4 ס"מ-1, זמן סריקה לדוגמה 32, זמן סריקת רקע 16, שמירת נתונים מ 4000 עד 400 ס"מ-1, שידור ספקטרום התוצאות.
- אל תוסיף דגימה; הקש על רקע ערוץ יחיד. עכשיו למקם 1 מ"ג של המדגם על הגביש, ולחץ על מדגם ערוץ אחד. לעבד את הספקטרום המתקבל.
8. משקל מולקולרי של ליגנין מופק (כרומטוגרפיה חדירת ג'ל)
- הכינו פתרון של דימתילפורממיד (DMF) עם ליתיום כלוריד (LiCl) של 0.5%. קח 5 גרם של LiCl בבקבוק נפחי 1 L, להוסיף DMF עד לקו מד, ומערבבים את התוכן עד נוזל הומוגני מתקבל.
- ממיסים 3 מ"ג של דגימת ליגינין ב 3 מ"ל של DMF עם 0.5% LiCl. צנטריפוגה בצינור צנטריפוגה של 10 מ"ל, והפרדת השבר המסיס לבקבוקון.
- להמיס 3 מ"ג של פוליסטירן רגיל 1 kDa, 2 kDa, 3 kDa, 10 kDa, 20 kDa, ו 30 kDa בתמיסה של DMF עם 0.5% LiCl. צנטריפוגה בצינורות זכוכית בורוסיליקט 10 מ"ל, ולהעביר את השבר מסיס בקבוקון.
- הכינו מערכת כרומטוגרפיה נוזלית אולטרה סגולה (UV) בעלת ביצועים גבוהים.
- פתח את מערכת הנתונים, ובדוק את גלאי UV.
- לטהר את המערכת עם מים מזוקקים. התקן את הוכנה באלונט (DMF עם 0.5% LiCl). פתח את שסתום הטיהור, ולטהר את הקו עם קצב זרימה של 1 מ"ל / דקה במשך 15 דקות. לעצור את הזרימה ולסגור את שסתום הטיהור.
- הגדר את קצב הזרימה ל 1 מ"ל / דקה במשך 10 דקות כדי לנקות את המסלול האלגנטי לגלאי. עצור את קצב הזרימה.
- התקן את העמודה שלפניה מופיעה עמודת מגן (עיין בטבלת החומרים). הפעל את דוד העמודה ב 45 °C (60 °F), להפעיל את גלאי UV, ולהגדיר את קצב הזרימה בהדרגה עד קצב זרימה של 0.6 מ"ל / דקה הוא הגיע.
- להזריק 30 μL של כל מדגם במשך 40 דקות באורך גל של 270 ננומטר. עבד את הנתונים שהתקבלו וחשב את התפלגות המסה באמצעות שורת הכיול.
- חשב את המשקל המולקולרי הממוצע (Mn), המשקל המולקולרי הממוצע במשקל (Mw) ומדד הפולידיספרסיטי (PDI).
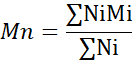
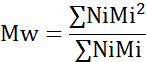
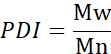
Mi: משקל מולקולרי של שרשרת
Ni: מספר שרשראות למשקל מולקולרי זה
9. טיפול בנתונים וניתוחים סטטיסטיים
- בצע את כל הניסויים האנליטיים בטריפל ובטא את התוצאות כאחוז מחומר יבש.
- בצע ניתוח חד-כיווני של שונות (ANOVA) והשווה את האמצעים באמצעות מבחן ההשוואה המרובות של Tukey.
- בצע ניתוח רכיב ראשי (PCA).
תוצאות
איור 2A-C מתארים את תפוקת החילוץ של הינין מששת המזון, המוצגת באיור 1A-F, לאחר טיפול מקדים משולב במיקרוגל DES. התוצאות מראות כי תפוקת הליגנין שהושגה עם DES1 (חומצה אוקסלית ChCl)(איור 2A)הייתה נמוכה מהתפוקות...
Discussion
למחקר זה היו מטרות רבות; הראשון שבהם היה להכין ולהשתמש ממיסים ירוקים בעלות נמוכה עם המאפיינים של נוזלים יוניים וממסים אורגניים. המטרה השנייה הייתה לשבר את הביומסה ולחלץ ליגנין בצעד אחד, ללא צורך בצעדים ראשוניים כגון מיצוי של כלי חילוץ באמצעות Soxhlet או hemicellulose באמצעות ממיסים אלקליין, בסיסי, ?...
Disclosures
המחברים מדווחים שאין ניגוד עניינים.
Acknowledgements
ח"כ ושחפת מודים להית'ם אייב על ניתוחים סטטיסטיים והכנת דמות, אזור וואלון (פיתוח אזורי אירופי-VERDIR) ושר ההשכלה הגבוהה והמחקר המדעי (טאופיק בטייב) על המימון.
Materials
| Name | Company | Catalog Number | Comments |
| HPLC Gel Permeation Chromatography | Agilent 1200 series | ||
| 1 methylimadazole | Acros organics | ||
| 2-deoxy-D-glucose (internal standard) | Sigma Aldrich (St. Louis, USA) | ||
| Acetic acid | Sigma Aldrich (St. Louis, USA) | ||
| Acetic anhydride | Sigma Aldrich (St. Louis, USA) | ||
| Adjustables pipettors | |||
| Alkali | alkali-extracted lignin | ||
| Arabinose (99%) | Sigma Aldrich (St. Louis, USA) | ||
| Autoclave | CERTO CLAV (Model CV-22-VAC-Pro) | ||
| Water Bath at 70 °C | |||
| Boric acid | Sigma Aldrich (St. Louis, USA) | ||
| Bromocresol | Sigma Aldrich (St. Louis, USA) | ||
| Catalyst | CTQ (coded A22) (1.5 g K2SO4 + 0.045 g CuSO4.5 H2O + 0.045 g TiO2) | Merck | |
| Centrifugation container | |||
| Centrifuge | BECKMAN COULTER | Avanti J-E centrifuge | |
| Ceramic crucibles | |||
| Choline chloride 99% | Acros organics | ||
| Column | Agilent PLGel Mixed C (alpha 3,000 (4.6 × 250 mm, 5 µm) preceded by a guard column (TSK gel alpha guard column 4.6 mm × 50 mm, 5 µm) | ||
| Column | HP1-methylsisoxane (30 m, 0.32 mm, 0.25 mm) | ||
| Crucible porosity N°4 ( Filtering crucible) | Shott Duran Germany | boro 3.3 | |
| Deonized water | |||
| Dessicator | |||
| Dimethylformamide | VWR BDH Chemicals | ||
| Dimethylsulfoxide | Acros organics | ||
| Erlenmeyer flask | |||
| Ethanol | Merck (Darmstadtt, Germany) | ||
| Filtering crucibles, procelain | |||
| Filtration flasks | |||
| Fourrier Transformed Inra- Red | Vertex 70 Bruker apparatus equipped with an attenuated total reflectance (ATR) module. Spectra were recorded in the 4,000–400 cm−1 range with 32 scans at a resolution of 4.0 cm−1 | ||
| Galactose (98% | Sigma Aldrich (St. Louis, USA) | ||
| Gaz Chromatography | Agilent (7890 series) | ||
| Glass bottle 100 mL | |||
| Glass tubes ( borosilicate) with teflon caps 10 mL | |||
| Glucose (98% | Sigma Aldrich (St. Louis, USA) | ||
| Golves | |||
| Graduated cylinder 50 mL /100 mL | |||
| H2SO4 Titrisol (0.1 N) | Merck (Darmstadtt, Germany) | ||
| H2SO4 (95-98%) | Sigma Aldrich (St. Louis, USA) | BUCHI R-114) | |
| Hummer cutter equiped with 1 mm and 0.5 mm sieve | Mill Ttecator (Sweden) | Cyclotec 1093 | |
| Indulin | Raw lignin control | ||
| Kjeldahl distiller | Kjeltec 2300 (Foss) | ||
| Kjeldahl tube | FOSS | ||
| Kjeldhal rack | |||
| Kjeldhal digester | Kjeltec 2300 (Foss) | ||
| Kjeldhal suction system | |||
| Lab Chem station Software | GC data analysis | ||
| Lactic acid | Merck (Darmstadtt, Germany) | ||
| Lithium chloride LiCl | Sigma Aldrich (St. Louis, USA) | ||
| Mannose (98%) | Sigma Aldrich (St. Louis, USA) | ||
| Methyl red | |||
| Microwave | START SYNTH MILESTONE Microwave laboratory system | ||
| Microwave temperature probe | |||
| Microwave container | |||
| Muffle Furnace | |||
| NaOH | Merck (Darmstadtt, Germany) | ||
| Nitrogen free- paper | |||
| Opus | spectroscopy software | ||
| Oven | GmbH Memmert SNB100 | Memmert SNB100 | |
| Oxalic acid | VWR BDH Chemicals | ||
| P 1000 | Soda-processed lignin | ||
| pH paper | |||
| precision balance | |||
| Infrared spectroscopy | |||
| Quatz cuvette | |||
| Rhamnose (98%) | Sigma Aldrich (St. Louis, USA) | ||
| Rotary vacuum evaporator | Bucher | ||
| Round-bottom flask 500 mL | |||
| sodium borohydride NaBH4 | |||
| Schott bottle | glass bottle | ||
| Sovirel tubes | sovirel | Borosilicate glass tubes | |
| Spatule | |||
| Special tube | |||
| Spectophotometer | UV-1800 Shimadzu | ||
| Sterilization indicator tape | |||
| Stir bar in teflon | |||
| Stirring plate | |||
| Syringes | |||
| Sodium borohydride | Sigma Aldrich (St. Louis, USA) | ||
| Titrisol | Merck | Merck 109984 | 0.1 N H2SO4 |
| Urea | VWR BDH Chemicals | ||
| Vials | |||
| VolumetriC flask 2.5 L /5 L | Bucher | ||
| Vortex | |||
| Xylose (98%) | Sigma Aldrich (St. Louis, USA) |
References
- Kammoun, M., et al. Hydrothermal dehydration of monosaccharides promoted by seawater fundamentals on the catalytic role of inorganic salts. Frontiers in Chemistry. 7, 132 (2019).
- Kammoun, M., Ayeb, H., Bettaieb, T., Richel, A. Chemical characterisation and technical assessment of agri-food residues, marine matrices, and wild grasses in the South Mediterranean area: A considerable inflow for biorefineries. Waste Management. 118, 247-257 (2020).
- Zhang, C. W., Xia, S. Q., Ma, P. Facile pretreatment of lignocellulosic biomass using deep eutectic solvents. Bioresource Technology. 219, 1-5 (2016).
- Mora-Pale, M., Meli, L., Doherty, T. V., Linhardt, R. J., Dordick, J. S. Room temperature ionic liquids as emerging solvents for the pretreatment of lignocellulosic biomass. Biotechnology and Bioengineering. 108 (6), 1229-1245 (2011).
- Chen, Z., Wan, C. Ultrafast fractionation of lignocellulosic biomass by microwave-assisted deep eutectic solvent pretreatment. Bioresource Technologie. 250, 532-537 (2018).
- Francisco, M., Van Den Bruinhorst, A., Kroon, M. C. New natural and renewable low transition temperature mixtures ( LTTMs ): screening as solvents for lignocellulosic biomass processing. Green Chemistry. 14 (8), 2153-2157 (2012).
- Liu, Y. C., et al. Efficient cleavage of lignin - carbohydrate complexes and ultrafast extraction of lignin oligomers from wood biomass by microwave-assisted treatment with deep eutectic solvent. Chem sus chem. 10, 1692-1700 (2017).
- Xu, G. C., Ding, J. C., Han, R. Z., Dong, J. J., Ni, Y. Enhancing cellulose accessibility of corn stover by deep eutectic solvent pretreatment for butanol fermentation. Bioresource Technologie. 203, 364-369 (2016).
- Jablonský, M., Andrea, &. #. 3. 5. 2. ;., Kamenská, L., Vrška, M., Šima, J. Deep eutectic solvents fractionation of wheat straw deep eutectic solvents fractionation of wheat straw. Bioresources. 10 (4), 8039-8047 (2015).
- Shen, X. J., et al. Facile fractionation of lignocelluloses by biomass-derived deep eutectic solvent (DES) pretreatment for cellulose enzymatic hydrolysis and lignin valorization. Green Chemistry. 21, 275-283 (2019).
- Alvarez-Vasco, C., et al. Unique low-molecular-weight lignin with high purity extracted from wood by deep eutectic solvents (DES): a source of lignin for valorization. Green Chemistry. 18, 5133-5141 (2016).
- Banu, J. R., et al. A review on biopolymer production via lignin valorization. Bioresource Technologie. 290, 121790 (2019).
- Gordobil, O., Olaizola, P., Banales, J. M., Labidi, J. Lignins from agroindustrial by-products as natural ingredients for cosmetics chemical structure and in vitro sunscreen and cytotoxic activities. Molecules. 25 (5), 1131 (2020).
- Lee, C. S., Thu Tran, T. M., Weon Choi, J., Won, K. Lignin for white natural sunscreens. International Journal of Biological Macromolecules. 122, 549-554 (2019).
- Widsten, P. Lignin-based sunscreens-state-of-the-art, prospects and challenges. Cosmetics. 7, 85 (2020).
- Qian, Y., Qiu, X., Zhu, S. Lignin: a nature-inspired sun blocker for broad-spectrum sunscreens. Royal Society of Chemistry. 17, 320-324 (2015).
- Zijlstra, D. S., et al. Extraction of lignin with high β-O-4 content by mild ethanol extraction and its effect on the depolymerization yield. Journal of Visualized Experiments. (143), e58575 (2019).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved