Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Extraction ultrarapide de la lignine à partir de résidus lignocellulosiques méditerranéens inhabituels
Dans cet article
Résumé
Le prétraitement assisté par micro-ondes à base de solvant eutectique profond est un processus vert, rapide et efficace pour le fractionnement lignocellulosique et la récupération de la lignine de haute pureté.
Résumé
Le prétraitement reste l’étape la plus coûteuse des processus de bioraffinerie lignocellulosique. Il doit être rendu rentable en minimisant les besoins chimiques ainsi que la consommation d’électricité et de chaleur et en utilisant des solvants respectueux de l’environnement. Les solvants eutectiques profonds (DES) sont des solvants clés, verts et à faible coût dans les bioraffineries durables. Ce sont des mélanges transparents caractérisés par de faibles points de congélation résultant d’au moins un donneur de liaison hydrogène et d’un accepteur de liaison hydrogène. Bien que les DES soient des solvants prometteurs, il est nécessaire de les combiner avec une technologie de chauffage économique, telle que l’irradiation par micro-ondes, pour une rentabilité compétitive. L’irradiation micro-ondes est une stratégie prometteuse pour raccourcir le temps de chauffage et augmenter le fractionnement car elle peut rapidement atteindre la température appropriée. L’objectif de cette étude était de développer une méthode rapide en une étape pour le fractionnement de la biomasse et l’extraction de la lignine à l’aide d’un solvant biodégradable à faible coût.
Dans cette étude, un traitement préparatoire micro-ondes-aidé de DES a été conduit pendant 60 s à 800 W, utilisant trois genres de DESs. Les mélanges de DES ont été facilement préparés à partir du chlorure de choline (ChCl) et de trois donateurs d’hydrogène-liaison (HBDs) : un acide monocarboxylique (acide lactique), un acide dicarboxylique (acide oxalique), et l’urée. Ce prétraitement a été utilisé pour le fractionnement de la biomasse et la récupération de la lignine à partir de résidus marins (feuilles de posidonie et aegagropile), de sous-produits agroalimentaires (coquilles d’amandes et grignons d’olive), de résidus forestiers (pommes de pin) et de graminées lignocellulosiques vivaces(Stipa tenacissima). D’autres analyses ont été effectuées pour déterminer le rendement, la pureté et la distribution du poids moléculaire de la lignine récupérée. En outre, l’effet des DES sur les groupes fonctionnels chimiques dans la lignine extraite a été déterminé par spectroscopie infrarouge à transformée de Fourier (FTIR). Les résultats indiquent que le mélange ChCl-acide oxalique offre la pureté de lignine la plus élevée et le rendement le plus bas. La présente étude démontre que le procédé DES-microwave est une technologie ultrarapide, efficace, et coût-compétitive pour le fractionnement lignocellulosic de biomasse.
Introduction
Les procédés de bioraffinerie durables intègrent le traitement de la biomasse, son fractionnement en molécules d’intérêt et leur conversion en produits à valeur ajoutée1. Dans le bioraffinage de deuxième génération, le prétraitement est considéré comme essentiel pour fractionner la biomasse en ses principaux composants2. Les méthodes traditionnelles de prétraitement utilisant des stratégies chimiques, physiques ou biologiques ont été largement appliquées3. Cependant, un tel prétraitement est considéré comme l’étape la plus coûteuse du bioraffinage et présente d’autres inconvénients tels qu’un long temps de traitement, une consommation élevée de chaleur et d’énergie et des impuretés de solvant4. Récemment, les DES, dont les propriétés sont similaires à celles des liquides ioniques3,sont apparus comme solvants verts en raison d’avantages tels que la biodégradabilité, le respect de l’environnement, la facilité de synthèse et la récupération après traitement5.
Les DES sont des mélanges d’au moins un DBC, tel que l’acide lactique, l’acide malique ou l’acide oxalique, et d’un accepteur de liaison hydrogène (HBA) tel que la bétaïne ou le chlorure de choline (ChCl)6. Les interactions HBA-HBD permettent un mécanisme catalytique qui permet le clivage des liaisons chimiques, provoquant le fractionnement de la biomasse et la séparation de la lignine. De nombreux chercheurs ont rapporté le prétraitement à base de DES de matières premières lignocellulosiques telles que le ChCl-glycérol sur l’épi et le stover7,8,le ChCl-urée et l’acide ChCl-oxalique sur la paille de blé9,l’acide chcl-lactique sur la sciure de bois eucalyptus 10,et l’acide chcl-acétique11 et le chCl-éthylène glycol sur le bois11. Pour améliorer l’efficacité des DES, le prétraitement doit être combiné avec un traitement par micro-ondes pour accélérer le fractionnement de la biomasse5. De nombreux chercheurs ont rapporté un tel prétraitement combiné (DES et micro-ondes) du bois8 et de la tige de maïs, du panic raide et du miscanthus5,qui fournit de nouvelles informations sur la capacité des DES pour le fractionnement lignocellulosique et l’extraction de la lignine en une seule étape facile sur une courte période.
La lignine est une macromolécule phénolique valorisée comme matière première pour la production de biopolymères et présente une alternative pour la production de produits chimiques tels que les monomères aromatiques et les oligomères12. De plus, la lignine a des activités antioxydantes et d’absorption ultraviolette13. Plusieurs études ont rapporté des applications de lignine dans les produits cosmétiques14,15. Son intégration dans les produits de protection solaire commerciaux a amélioré le facteur de protection solaire (FPS) du produit de FPS 15 à FPS 30 avec l’ajout de seulement 2 % en poids de lignine et jusqu’à 50 FPS avec l’ajout de 10 % en poids de lignine16. Cet article décrit une approche ultrarapide pour le fendage de lignine-hydrate de carbone, aidé par le traitement préparatoire combiné de DES-micro-ondes des biomasses méditerranéennes. Ces biomasses sont constituées de sous-produits agroalimentaires, en particulier le grignon d’olive et les coquilles d’amande. Les autres biomasses étudiées sont celles d’origine marine (feuilles de posidonie et aegagropile) et celles provenant d’une forêt (pommes de pin et graminées sauvages). L’objectif de cette étude était de tester des solvants verts à faible coût pour évaluer les effets de ce prétraitement combiné sur le fractionnement des matières premières, d’étudier son influence sur la pureté et le rendement de la lignine, et d’étudier ses effets sur les poids moléculaires et les groupes fonctionnels chimiques dans la lignine extraite.
Protocole
1. Préparation des biomasses
- Séchage de la biomasse
- Placez les feuilles de Posidonie et les boules d’aegagropile(Posidonia oceanica),récoltées sur les plages méditerranéennes, dans un four à 40 °C pendant 72 h.
- Placer les coquilles d’amandes(Prunus dulcis),obtenues par les industries alimentaires, et le grignon d’olive(Olea europaea L.),obtenues à partir de moulins à huile d’olive, dans un four à 40 °C pendant 72 h.
- Placer les pommes de pin(Pinus halepensis),récoltées dans une forêt, et les feuilles d’alfa(Stipa tenacissima),récoltées dans le bassin sud de la Méditerranée, dans un four à 40 °C pendant 72 h.
NOTA : Si la biomasse contient du sable, elle doit être rincée à l’eau distillée avant d’être placée dans le four. Les biomasses sont représentées à la figure 1A-F.
- Broyage de la biomasse
- Placer 20 g de chaque biomasse dans un marteau-piqueur équipé d’un tamis de 1 mm. Recueillir la poudre résultante dans un bécher de 0,25 L et l’alimenter à un marteau-piqueur équipé d’un tamis de 0,5 mm. Recueillir la poudre dans un bécher de 0,25 L.
2. Extraction ultrarapide de la lignine assistée par micro-ondes
- Préparation de solvant eutectique profond (DES)
- Préparer le DES1 (acide ChCl-oxalique) dans un rapport molaire de 1:1 en mélangeant 174 g de ChCl avec 126 g d’acide oxalique dihydraté dans une fiole à fond rond de 500 mL et en les faisant fondre dans un bain à 70 °C pendant 4 h jusqu’à la formation d’un liquide homogène et transparent.
- Préparer le DES2 (acide lactique ChCl) dans un rapport molaire de 1:1 en mélangeant 174 g de ChCl avec 90 g d’acide lactique dans une fiole à fond rond de 500 mL et en les faisant fondre dans un bain à 70 °C pendant 4 h jusqu’à la formation d’un liquide homogène et transparent.
- Préparer le DES3 (ChCl-urée) dans un rapport molaire de 1:12 en mélangeant 174 g de ChCl avec 120 g d’urée dans une fiole à fond rond de 500 mL et en les faisant fondre dans un bain à 70 °C pendant 4 h jusqu’à ce qu’un liquide homogène et transparent se forme.
NOTA : Agiter ces mélanges en continu avec une barre d’agitation à 500 tr/min.
- Traitement combiné micro-ondes-DES
- Placer 5 g de la matière première dans un micro-ondes dans un réacteur fermé en polytétrafluoroéthylène. Ajouter 50 mL de DES et placer une barre d’agitation dans l’échantillon. Fermez le récipient à micro-ondes avec un capuchon approprié et fixez le bouchon de température.
- Placez le récipient à micro-ondes sur le bord de la platine tournante, en vous assurant qu’il est constamment agité. Réglez la puissance micro-ondes à 800 W pendant 1 min. À l’aide de gants appropriés, sortez le récipient du micro-ondes et laissez le mélange refroidir. Répétez ce traitement en utilisant les trois DES pour chaque échantillon de biomasse.
REMARQUE: Vérifiez et assurez-vous que la sonde de température est correctement placée et que le conteneur à micro-ondes a une température homogène.
- Isolement de la lignine
- Préparer une solution antisolvante homogène en mélangeant éthanol:eau dans un rapport de 50:50 (v:v). Ajouter 50 mL de la solution antisolvante à la matière première traitée, placer le mélange dans un récipient de centrifugation (250 mL) et centrifuger pendant 5 min à 3 000 × g.
- Après centrifugation, filtrer le surnageant (fraction riche en lignine) à l’aide d’un creuset filtrant en verre (porosité 4, 10-16 μm, diamètre 10 mm). Laver le résidu de cellulose restant recueilli après centrifugation avec 25 mL de la solution antisolvante.
- Centrifuger à 3 000 × g pendant 5 min après chaque lavage. Répétez les lavages 4x, et collectez et filtrez les lavages à travers le creuset du filtre en verre (porosité N 4, 10-16 μm, diamètre 10 mm).
- Ajouter la fraction filtrée riche en lignine de l’étape 2.3.2 aux lavages filtrés de l’étape 2.3.3 dans une fiole inférieure ronde de 500 mL. Évaporer l’éthanol à l’aide d’un évaporateur rotatif à 50 °C et 110 mbar.
- Ajouter 150 mL d’eau désionisée à la liqueur concentrée (fraction riche en lignine) et précipiter la lignine par centrifugation. Recueillir la lignine sous forme de granulés et la laver avec 25 ml d’eau distillée; répéter les lavages 4x. Lyophiliser la lignine ou la sécher au four à 40 °C.
REMARQUE: Si nécessaire, laver la lignine >4x pour éliminer les sels des solvants. - Utilisez la formule suivante pour déterminer le rendement :
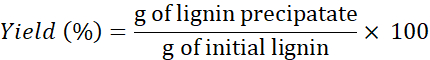
REMARQUE: L’extraction de la lignine a également été effectuée avec deux autres DES: chlorure de choline + résorcinol et chlorure de choline + acide butyrique à 1 min. Cependant, les quantités de lignine récupérées à l’aide de ces DS étaient extrêmement faibles (et irrécupérables) par rapport aux quantités obtenues à l’aide des trois autres DER.
3. Détermination de la pureté de la lignine extraite par Klason
- Préparation de l’échantillon pour l’hydrolyse Klason
- Placer le creuset filtrant (porosité 4, diamètre 4,5 mm) dans un four à moufle à 550 °C pendant 4 h (rampe de 2 h, à partir de 25 °C). Retirez le creuset lorsque le four refroidit à 150 °C, placez-le dans un desséchant pour refroidir et pesez-le.
- Ajouter environ 30 mg de lignine dans un tube de verre borosilicate (voir la table des matériaux)et noter le poids de l’échantillon. Ajouter 1 mL d’acide sulfurique à 72 %(H2SO4)à l’échantillon, placer l’échantillon dans un bain à 30 °C pendant 60 min et mélanger toutes les 10 minutes par vortex.
- Retirez l’échantillon, transférez-le dans une bouteille en verre de 100 mL et ajoutez 28 mL d’eau distillée pour diluer l’acide à une concentration de 4 %. Placer la bouteille en verre dans un autoclave à 121 °C pendant 60 min. Retirez la bouteille en verre et laissez-la refroidir.
- Analyse de la lignine insoluble dans l’acide
- Filtrer l’hydrolysat à l’aide d’un creuset sous vide. Recueillir tous les solides dans une bouteille en verre contenant de l’eau désionisée. Rincer le creuset avec 50 mL d’eau désionisée.
- Sécher le creuset contenant les matières solides en le plaçant dans une étuve à 105 °C pendant 16 h. Retirez le creuset du four, placez-le dans un desséchant et laissez-le refroidir. Peser l’échantillon.
- Placer le creuset dans un four à moufle à 550 °C pendant 4 h (rampe de 2 h). Retirez-le et placez-le dans un desséchant. Peser l’échantillon.
- Utilisez la formule suivante pour calculer le pourcentage du résidu insoluble dans l’acide (DEA) :
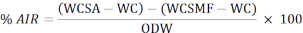
WCSA: poids du creuset + échantillon après les avoir retirés du four
WC : poids du creuset
WCSMF : poids du creuset après l’avoir retiré du four à moufle
ODW: poids sec de l’échantillon
- Analyse de la lignine soluble dans l’acide
- Mesurer l’absorbance du filtrat obtenu à l’étape 3.2.1 avec un spectrophotomètre à 205 nm à l’aide de cuvettes de quartz. Utilisez de l’eau distillée comme blanc.
- Utilisez la formule suivante pour calculer le pourcentage du résidu soluble dans l’acide (DSA) :
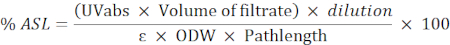
NOTA : L’absorbance doit être comprise entre 0,2 et 0,7. Diluer l’échantillon si nécessaire.
UVabs : absorbance à 205 nm
Longueur du trajet : chemin de lumière de la cellule de mesure (en cm)
ε : absorption de la biomasse à une longueur d’onde spécifique
4. Teneur en azote de la lignine extraite
- Préparation d’une solution alcaline
- Dans une fiole jaugée de 2,5 L, peser 1 kg d’hydroxyde de sodium (NaOH) et ajouter de l’eau désionisée jusqu’au repère. Placer une barre magnétique dans le ballon et agiter jusqu’à ce que le NaOH soit complètement dissous.
- Préparation d’une solution d’acide sulfurique
- Prendre 0,1 NH2SO4 (voir la table des matériaux)dans une fiole jaugée de 5 L, ajouter de l’eau désionisée jusqu’à la marque de 5 L, placer une barre magnétique et agiter jusqu’à dissolution du contenu.
- Préparation de la solution réceptrice
- Dans une fiole jaugée de 5 L, dissoudre 100 g deH3BO3 (acide borique) dans de l’eau désionisée, et porter le volume au repère.
- Peser 100 mg de vert de bromocrésol dans une fiole jaugée de 100 mL et ajouter du méthanol technique jusqu’au repère.
- Peser 100 mg de rouge de méthyle dans une fiole jaugée de 100 mL et ajouter du méthanol technique au marquage.
- Verser la solution 5 L deH3BO3 de l’étape 4.3.1, 100 mL de solution verte de bromocrésol de l’étape 4.3.2, 70 mL de la solution de rouge de méthyle de l’étape 4.3.3, et 5 L d’eau désionisée dans un récipient. Bien agiter la solution réceptrice pendant 30 min.
Remarque : la couleur finale de la solution doit être verte. Si la couleur n’est pas verte, ajouter 50 mL de solution de NaOH 1 N.
- Préparation de l’échantillon
- Dans un tube de Kjeldahl, placer 100 mg de lignine pesée sur un papier sans azote, ajouter un comprimé de Kjeldhal (1,5 g de sulfate de potassium(K2SO4)+ 0,045 g de sulfate de cuivre pentahydraté (CuSO4.5H2O) + 0,045 g de dioxyde de titane (TiO2)), et ajouter 7,2 mL de concentréH2SO4.
REMARQUE: Utilisez quatre tubes avec seulement du papier sans azote (sans les échantillons) comme blancs.
- Dans un tube de Kjeldahl, placer 100 mg de lignine pesée sur un papier sans azote, ajouter un comprimé de Kjeldhal (1,5 g de sulfate de potassium(K2SO4)+ 0,045 g de sulfate de cuivre pentahydraté (CuSO4.5H2O) + 0,045 g de dioxyde de titane (TiO2)), et ajouter 7,2 mL de concentréH2SO4.
- Digestion des échantillons
- Allumez le thermostat du digesteur 1 h à l’avance à 360 °C.
- Placez les tubes d’échantillon sur un rack, placez les quatre tubes à blanc aux quatre coins du rack et remplissez les trous (le cas échéant) du rack avec des tubes vides.
- Placez le rack dans le digesteur préchauffé, couvrez le système d’aspiration et ouvrez la pompe à eau.
REMARQUE: Prenez soin d’éviter les fumées; augmenter le débit d’eau si des fumées apparaissent. - Après 2 h, éteignez le chauffage, retirez les échantillons et placez-les sur un support métallique. Laissez le rack refroidir pendant environ 40 min avec le système d’aspiration allumé.
- Procédure de distillation de Kjeldhal
- Allumez le distillateur Kjeldahl. Autorisez l’exécution des auto-tests jusqu’à ce que Selection apparaisse à l’écran. Passez en mode manuel, insérez un tube vide et fermez la porte coulissante.
- Purger la burette titrante (0,02NH2SO4)(soulever le couvercle) en appuyant plusieurs fois sur le bas et le haut, et éliminer les bulles d’air des tuyaux en pressant le tube de la bouteilleH2SO4. Fermez le capot.
- Purgez la solution de réception H3BO3x.
- Ajoutez de l’eau 3x et passez à la vapeur active (10 min). Passez au programme d’analyse Kjeldahl 1. Entrez Blanco à l’aide des flèches au niveau de la ligne de résultat.
- Insérez le tube. Commencez par les quatre blancs et calculez leurs moyennes. Entrez la valeur dans la ligne Blanco.
NOTA : Après l’insertion du tube, le dispositif ajoute automatiquement et successivement 30 mL deH2O,30 mL deH3BO3et 40 mL de NaOH 10 N. - Passer à mL de titrant à la ligne de résultat. Insérez le tube, et notez la quantité deH2SO4 utilisée.
REMARQUE: Pour tester le distillateur Kjeldahl, considérez que 50 mg de glycérine correspondent à 18,60% ± 5% de% de% N. À la fin de chaque titrage, l’appareil vide et nettoie automatiquement le tube. - Calculer le pourcentage de N.

V s.a : Volume d’acide sulfurique
T s.a : 0,02 NH2SO4
S: masse de l’échantillon
5. Teneur en cendres de la lignine extraite
- Sécher les creusets en céramique pendant 1 h à 105 °C. Laissez-les refroidir dans un dessicateur.
- Peser un creuset et noter son nombre. Ajouter environ 1 g de la poudre de l’échantillon. Placer le creuset dans le four à moufle avec le programme suivant: une rampe de 2 h jusqu’à 575 °C; un plateau de 4 h à 575 °C.
- Laisser refroidir le four à 100 °C. Retirez les creusets, placez-les dans le dessicateur et pesez-les.
6. Teneur en glucides
- Préparation de solution de borohydrure de sodium (NaBH4)/diméthylsulfoxyde (DMSO)
- Placer 2 g de NaBH4 dans une fiole jaugée de 100 mL et remplir au trait avec du DMSO. Chauffer à 100 °C dans un bain de maire et remuer la solution jusqu’à dissolution complète.
- Préparation de la solution MIX
- Placer 20 mg de xylose, d’arabinose, de rhamnose, de glucose, de galactose, de mannose et de 2-désoxyglucose dans une fiole jaugée de 100 mL et remplir jusqu’à la marque de 100 mL avec de l’eau désionisée.
- Hydrolyse de l’échantillon
- Peser un échantillon de 50 mg de lignine dans un tube de verre borosilicate, ajouter 3 mL de 1 MH2SO4et chauffer le mélange pendant 3 h à 100 °C.
- Refroidir l’échantillon, ajouter 1 mL d’hydroxyde d’ammonium 15 M(NH4OH) et vérifier le pH pour s’assurer qu’il est neutre ou alcalin. Ajouter exactement 1 mL d’étalon interne (2-désoxyglucose) à chaque échantillon.
NOTE : Le 2-désoxyglucose ajouté en tant qu’étalon interne permet de quantifier la quantité de chaque dose présente dans l’échantillon.
- Réduction et acétylation des monosaccharides en acétate d’alditol
- Prendre 400 μL de la solution de l’étape 6.3.2 et la placer dans des tubes spéciaux. Prenez 400 μL de la solution de contrôle MIX et placez-la dans des tubes spéciaux.
Remarque : l’utilisation de la solution MIX facilite le calcul des facteurs de réponse (FR) et des pourcentages de monosaccharide. - Ajouter 2 mL dela solution NaBH 4/DMSO préparée au point 6.1. Fermez le tube et incuber pendant 90 min à 40 °C au bain-marie. Retirer le tube du bain-marie et ajouter 0,6 mL d’acide acétique glacial.
REMARQUE: Comme il s’agit d’une réaction exothermique, des bulles et de la fumée apparaîtront. - Ajouter environ 0,4 mL de 1-méthylimidazole et environ 4 mL d’anhydride acétique. Après 15 min, ajouter 10 mL d’eau distillée, refroidir, et ajouter ~3 mL de dichlorométhane(CH2Cl2).
- Après au moins 2 h, prélever ~1 mL de la phase inférieure (organique) et l’injecter dans un chromatographe en phase gazeuse équipé d’une colonne capillaire de détecteur à ionisation de flamme, HP1-méthylsiloxane (30 m (longueur) x 320 μm (diamètre interne), 0,25 μm (épaisseur du film)). Analysez les données.
- Utilisez la formule suivante pour calculer le facteur de réponse (RF).
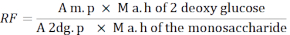
A m. p : Moyenne de la surface du pic de monosaccharide dans la solution MIX
M a. h de 2 - désoxy glucose : Masse de 2-désoxyglucose après hydrolyse
A 2dg. p : Moyenne de l’aire du pic de 2-désoxyglucose dans la solution MIX
M a. h du monosaccharide : Masse du monosaccharide après hydrolyse
REMARQUE: La correction anhydro est de 0,8 pour le rhamnose, de 0,88 pour l’arabinose et le xylose et de 0,9 pour le mannose, le glucose et le galactose. Masse après hydrolyse = anhydro correction x masse (g) du monosaccharide utilisé dans la solution MIX. - Utilisez la formule suivante pour calculer la masse de monosaccharides.
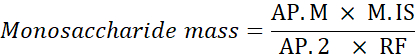
Ap. M: Zone de pic de monosaccharide dans l’échantillon analysé
M. IS: Masse de l’étalon interne ajoutée; ici, C SI = 1 mg/mL
AP.2: Zone de pointe de la 2-désoxyglucose dans l’échantillon
RF : facteur de réponse - Calculez le pourcentage de chaque monosaccharide à l’aide de la formule suivante.

- Prendre 400 μL de la solution de l’étape 6.3.2 et la placer dans des tubes spéciaux. Prenez 400 μL de la solution de contrôle MIX et placez-la dans des tubes spéciaux.
7. Fonctions chimiques dans la lignine extraite (infrarouge transformé par Fourier)
- Pour identifier les groupes fonctionnels chimiques dans la lignine extraite, utilisez un spectromètre FT-IR équipé d’un module de réflectance totale atténuée (ATR). Ouvrez le logiciel de spectroscopie, et ajustez les paramètres: résolution 4 cm-1, temps de balayage de l’échantillon 32, temps de balayage de fond 16, enregistrer les données de 4000 à 400 cm-1, transmission du spectre de résultat.
- N’ajoutez pas d’échantillon; appuyez sur l’arrière-plan monocanal. Maintenant, placez 1 mg de l’échantillon sur le cristal et appuyez sur l’échantillon monocanal. Traiter les spectres obtenus.
8. Poids moléculaire de la lignine extraite (chromatographie par perméation sur gel)
- Préparer une solution de diméthylformamide (DMF) avec 0,5 % de chlorure de lithium (LiCl). Prendre 5 g de LiCl dans une fiole jaugée de 1 L, ajouter du DMF jusqu’à la ligne de jauge et mélanger le contenu jusqu’à l’obtention d’un liquide homogène.
- Dissoudre 3 mg de l’échantillon de lignine dans 3 mL de DMF avec 0,5 % de LiCl. Centrifuger dans un tube centrifuge de 10 mL et séparer la fraction soluble dans un flacon.
- Dissoudre 3 mg de polystyrène standard 1 kDa, 2 kDa, 3 kDa, 10 kDa, 20 kDa et 30 kDa dans la solution de DMF avec 0,5% LiCl. Centrifuger dans des tubes de verre borosilicate de 10 mL et transférer la fraction soluble dans un flacon.
- Préparez un système de chromatographie liquide ultraviolet (UV) à haute performance.
- Ouvrez le système de données et vérifiez le détecteur UV.
- Purgez le système avec de l’eau distillée. Installez le piston dans l’éluant (DMF avec 0,5% LiCl). Ouvrez la vanne de purge et purgez la conduite avec un débit de 1 mL/min pendant 15 min. Arrêtez le débit et fermez la vanne de purge.
- Réglez le débit à 1 mL/min pendant 10 min pour nettoyer la voie de l’éluant jusqu’au détecteur. Arrêtez le débit.
- Installez la colonne précédée d’une colonne de garde (voir le tableau des matériaux). Allumez le réchauffeur à colonnes à 45 °C, allumez le détecteur UV et réglez le débit progressivement jusqu’à ce qu’un débit de 0,6 mL/min soit atteint.
- Injecter 30 μL de chaque échantillon pendant 40 min à une longueur d’onde de 270 nm. Traiter les données obtenues et calculer la distribution de masse à l’aide de la ligne d’étalonnage.
- Calculer le poids moléculaire moyen numérique (Mn), le poids moléculaire moyen (Mw) et l’indice de polydispersité (PDI).
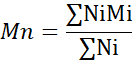
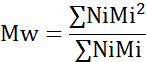
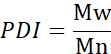
Mi : poids moléculaire d’une chaîne
Ni : nombre de chaînes pour ce poids moléculaire
9. Traitement des données et analyses statistiques
- Effectuer toutes les expériences analytiques en triple exemplaire et exprimer les résultats en % de matière sèche.
- Effectuez une analyse de variance à sens unique (ANOVA) et comparez les moyennes à l’aide du test de comparaison multiple de Tukey.
- Effectuer une analyse en composantes principales (APC).
Résultats
La figure 2A-C représente le rendement en lignine de l’extraction à partir des six matières premières, représenté à la figure 1A-F,après le prétraitement combiné micro-ondes-DES. Les résultats montrent que le rendement en lignine obtenu avec du DES1 (acide chcl-oxalique)(figure 2A)était inférieur aux rendements obtenus avec du DES2 (a...
Discussion
Cette étude avait de nombreux objectifs; le premier était de préparer et d’utiliser des solvants verts à faible coût présentant les caractéristiques des liquides ioniques et des solvants organiques. Le deuxième objectif était de fractionner la biomasse et d’extraire la lignine en une seule étape, sans nécessiter d’étapes préliminaires telles que l’extraction d’extractibles à l’aide de Soxhlet ou d’hémicellulose à l’aide de solvants alcalins, de techniques basiques ou thermophysiques. Le tr...
Déclarations de divulgation
Les auteurs ne signalent aucun conflit d’intérêts.
Remerciements
MK et TB remercie Haitham Ayeb pour les analyses statistiques et la préparation des chiffres, la Région wallonne (Développement régional européen-VERDIR) et le ministre de l’Enseignement supérieur et de la Recherche scientifique (Taoufik Bettaieb) pour leur financement.
matériels
| Name | Company | Catalog Number | Comments |
| HPLC Gel Permeation Chromatography | Agilent 1200 series | ||
| 1 methylimadazole | Acros organics | ||
| 2-deoxy-D-glucose (internal standard) | Sigma Aldrich (St. Louis, USA) | ||
| Acetic acid | Sigma Aldrich (St. Louis, USA) | ||
| Acetic anhydride | Sigma Aldrich (St. Louis, USA) | ||
| Adjustables pipettors | |||
| Alkali | alkali-extracted lignin | ||
| Arabinose (99%) | Sigma Aldrich (St. Louis, USA) | ||
| Autoclave | CERTO CLAV (Model CV-22-VAC-Pro) | ||
| Water Bath at 70 °C | |||
| Boric acid | Sigma Aldrich (St. Louis, USA) | ||
| Bromocresol | Sigma Aldrich (St. Louis, USA) | ||
| Catalyst | CTQ (coded A22) (1.5 g K2SO4 + 0.045 g CuSO4.5 H2O + 0.045 g TiO2) | Merck | |
| Centrifugation container | |||
| Centrifuge | BECKMAN COULTER | Avanti J-E centrifuge | |
| Ceramic crucibles | |||
| Choline chloride 99% | Acros organics | ||
| Column | Agilent PLGel Mixed C (alpha 3,000 (4.6 × 250 mm, 5 µm) preceded by a guard column (TSK gel alpha guard column 4.6 mm × 50 mm, 5 µm) | ||
| Column | HP1-methylsisoxane (30 m, 0.32 mm, 0.25 mm) | ||
| Crucible porosity N°4 ( Filtering crucible) | Shott Duran Germany | boro 3.3 | |
| Deonized water | |||
| Dessicator | |||
| Dimethylformamide | VWR BDH Chemicals | ||
| Dimethylsulfoxide | Acros organics | ||
| Erlenmeyer flask | |||
| Ethanol | Merck (Darmstadtt, Germany) | ||
| Filtering crucibles, procelain | |||
| Filtration flasks | |||
| Fourrier Transformed Inra- Red | Vertex 70 Bruker apparatus equipped with an attenuated total reflectance (ATR) module. Spectra were recorded in the 4,000–400 cm−1 range with 32 scans at a resolution of 4.0 cm−1 | ||
| Galactose (98% | Sigma Aldrich (St. Louis, USA) | ||
| Gaz Chromatography | Agilent (7890 series) | ||
| Glass bottle 100 mL | |||
| Glass tubes ( borosilicate) with teflon caps 10 mL | |||
| Glucose (98% | Sigma Aldrich (St. Louis, USA) | ||
| Golves | |||
| Graduated cylinder 50 mL /100 mL | |||
| H2SO4 Titrisol (0.1 N) | Merck (Darmstadtt, Germany) | ||
| H2SO4 (95-98%) | Sigma Aldrich (St. Louis, USA) | BUCHI R-114) | |
| Hummer cutter equiped with 1 mm and 0.5 mm sieve | Mill Ttecator (Sweden) | Cyclotec 1093 | |
| Indulin | Raw lignin control | ||
| Kjeldahl distiller | Kjeltec 2300 (Foss) | ||
| Kjeldahl tube | FOSS | ||
| Kjeldhal rack | |||
| Kjeldhal digester | Kjeltec 2300 (Foss) | ||
| Kjeldhal suction system | |||
| Lab Chem station Software | GC data analysis | ||
| Lactic acid | Merck (Darmstadtt, Germany) | ||
| Lithium chloride LiCl | Sigma Aldrich (St. Louis, USA) | ||
| Mannose (98%) | Sigma Aldrich (St. Louis, USA) | ||
| Methyl red | |||
| Microwave | START SYNTH MILESTONE Microwave laboratory system | ||
| Microwave temperature probe | |||
| Microwave container | |||
| Muffle Furnace | |||
| NaOH | Merck (Darmstadtt, Germany) | ||
| Nitrogen free- paper | |||
| Opus | spectroscopy software | ||
| Oven | GmbH Memmert SNB100 | Memmert SNB100 | |
| Oxalic acid | VWR BDH Chemicals | ||
| P 1000 | Soda-processed lignin | ||
| pH paper | |||
| precision balance | |||
| Infrared spectroscopy | |||
| Quatz cuvette | |||
| Rhamnose (98%) | Sigma Aldrich (St. Louis, USA) | ||
| Rotary vacuum evaporator | Bucher | ||
| Round-bottom flask 500 mL | |||
| sodium borohydride NaBH4 | |||
| Schott bottle | glass bottle | ||
| Sovirel tubes | sovirel | Borosilicate glass tubes | |
| Spatule | |||
| Special tube | |||
| Spectophotometer | UV-1800 Shimadzu | ||
| Sterilization indicator tape | |||
| Stir bar in teflon | |||
| Stirring plate | |||
| Syringes | |||
| Sodium borohydride | Sigma Aldrich (St. Louis, USA) | ||
| Titrisol | Merck | Merck 109984 | 0.1 N H2SO4 |
| Urea | VWR BDH Chemicals | ||
| Vials | |||
| VolumetriC flask 2.5 L /5 L | Bucher | ||
| Vortex | |||
| Xylose (98%) | Sigma Aldrich (St. Louis, USA) |
Références
- Kammoun, M., et al. Hydrothermal dehydration of monosaccharides promoted by seawater fundamentals on the catalytic role of inorganic salts. Frontiers in Chemistry. 7, 132 (2019).
- Kammoun, M., Ayeb, H., Bettaieb, T., Richel, A. Chemical characterisation and technical assessment of agri-food residues, marine matrices, and wild grasses in the South Mediterranean area: A considerable inflow for biorefineries. Waste Management. 118, 247-257 (2020).
- Zhang, C. W., Xia, S. Q., Ma, P. Facile pretreatment of lignocellulosic biomass using deep eutectic solvents. Bioresource Technology. 219, 1-5 (2016).
- Mora-Pale, M., Meli, L., Doherty, T. V., Linhardt, R. J., Dordick, J. S. Room temperature ionic liquids as emerging solvents for the pretreatment of lignocellulosic biomass. Biotechnology and Bioengineering. 108 (6), 1229-1245 (2011).
- Chen, Z., Wan, C. Ultrafast fractionation of lignocellulosic biomass by microwave-assisted deep eutectic solvent pretreatment. Bioresource Technologie. 250, 532-537 (2018).
- Francisco, M., Van Den Bruinhorst, A., Kroon, M. C. New natural and renewable low transition temperature mixtures ( LTTMs ): screening as solvents for lignocellulosic biomass processing. Green Chemistry. 14 (8), 2153-2157 (2012).
- Liu, Y. C., et al. Efficient cleavage of lignin - carbohydrate complexes and ultrafast extraction of lignin oligomers from wood biomass by microwave-assisted treatment with deep eutectic solvent. Chem sus chem. 10, 1692-1700 (2017).
- Xu, G. C., Ding, J. C., Han, R. Z., Dong, J. J., Ni, Y. Enhancing cellulose accessibility of corn stover by deep eutectic solvent pretreatment for butanol fermentation. Bioresource Technologie. 203, 364-369 (2016).
- Jablonský, M., Andrea, &. #. 3. 5. 2. ;., Kamenská, L., Vrška, M., Šima, J. Deep eutectic solvents fractionation of wheat straw deep eutectic solvents fractionation of wheat straw. Bioresources. 10 (4), 8039-8047 (2015).
- Shen, X. J., et al. Facile fractionation of lignocelluloses by biomass-derived deep eutectic solvent (DES) pretreatment for cellulose enzymatic hydrolysis and lignin valorization. Green Chemistry. 21, 275-283 (2019).
- Alvarez-Vasco, C., et al. Unique low-molecular-weight lignin with high purity extracted from wood by deep eutectic solvents (DES): a source of lignin for valorization. Green Chemistry. 18, 5133-5141 (2016).
- Banu, J. R., et al. A review on biopolymer production via lignin valorization. Bioresource Technologie. 290, 121790 (2019).
- Gordobil, O., Olaizola, P., Banales, J. M., Labidi, J. Lignins from agroindustrial by-products as natural ingredients for cosmetics chemical structure and in vitro sunscreen and cytotoxic activities. Molecules. 25 (5), 1131 (2020).
- Lee, C. S., Thu Tran, T. M., Weon Choi, J., Won, K. Lignin for white natural sunscreens. International Journal of Biological Macromolecules. 122, 549-554 (2019).
- Widsten, P. Lignin-based sunscreens-state-of-the-art, prospects and challenges. Cosmetics. 7, 85 (2020).
- Qian, Y., Qiu, X., Zhu, S. Lignin: a nature-inspired sun blocker for broad-spectrum sunscreens. Royal Society of Chemistry. 17, 320-324 (2015).
- Zijlstra, D. S., et al. Extraction of lignin with high β-O-4 content by mild ethanol extraction and its effect on the depolymerization yield. Journal of Visualized Experiments. (143), e58575 (2019).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon