A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
استخدام نظام GAL4-UAS لعلم الوراثة الوظيفية في أنوفيليس غامبيا
In This Article
Summary
نظام GAL4-UAS ثنائي الأطراف هو أداة متعددة الاستخدامات لتعديل التعبير الجيني بطريقة ندواتية خاضعة للرقابة تسمح بالتحليل الوراثي الوظيفي في أنوفيليس غامبيا. والإجراءات الموصوفة لاستخدام هذا النظام هي استراتيجية استنساخ شبه موحدة، والجنس وفحص الخوادر للكشف عن علامات البروتين الفلورية تثبيت الأجنة.
Abstract
نظام GAL4-UAS ثنائي الأطراف هو أداة متعددة الاستخدامات وقوية للتحليل الجيني الوظيفي. جوهر النظام هو عبور خطوط "السائق" المعدلة وراثيا التي تعبر عن عامل نسخ الخميرة GAL4 بطريقة محددة الأنسجة، مع خطوط "المستجيب" المعدلة وراثيا تحمل الجينات مرشح / الجيش الملكي النيبالي تدخل بناء الذي يتم التحكم في التعبير عن طريق تسلسل التنشيط المنبع (UAS) التي تربط GAL4. في ذرية ما تلا ذلك، يتم التعبير عن بناء الجينات أو إسكات بطريقة محددة الفضة، مما يتيح الأنماط الظاهرية الناتجة أن يتم فحصها واستدلال وظيفة الجينات. يتيح النظام الثنائي المرونة في النهج التجريبية لفحص الأنماط الظاهرية الناتجة عن التعبير المتحول في أنماط متعددة خاصة بالأنسجة ، حتى لو تم تحريض تكاليف اللياقة البدنية الشديدة. وقد قمنا بتكييف هذا النظام مع أنوفيليس غامبيا، الناقل الرئيسي للملاريا في أفريقيا.
في هذه المقالة، نقدم بعض الإجراءات الشائعة المستخدمة أثناء تحليل GAL4-UAS. ونصف خطوط An. gambiae GAL4-UAS التي تم إنشاؤها بالفعل، وكذلك استنساخ البنى المستجيبة الجديدة ل upregulation وRNAi بالضربة القاضية. نحدد دليلا خطوة بخطوة لممارسة الجنس مع جرو البعوض لإنشاء الصلبان الوراثية ، والتي تشمل أيضا فحص ذرية لمتابعة ميراث علامات الجينات الفلورية التي تشير إلى إدخال السائق والمستجيب. كما نقدم بروتوكولا لتطهير أجنة أنغامبيا لدراسة التطور الجنيني. وأخيرا، نقدم التكيفات المحتملة للطريقة لتوليد خطوط السائق من خلال إدراج CRISPR/Cas9 من GAL4 المصب من الجينات المستهدفة.
Introduction
نظام GAL4-UAS ثنائي الأطراف هو العمود الفقري لتوصيف وظيفي للجينات في الكائن الحي نموذج الحشرات Drosophila melanogaster1،2،3. لاستخدام نظام GAL4-UAS ، يتم عبور خطوط السائق المعدلة وراثيا ، والتي تعبر عن عامل نسخ الخميرة GAL4 تحت سيطرة تسلسل تنظيمي ، مع خطوط المستجيب التي تحمل جينا مهما أو بناء تداخل الحمض النووي الريبي (RNAI) الذي يتحكم فيه تسلسل تنشيط المنبع (UAS) المعترف به من قبل GAL4. تعبر ذرية هذا الصليب عن تحويل الاهتمام بنمط ندواتي يمليه المروج الذي يتحكم في تعبير GAL4 (الشكل 1). يمكن تقييم الأنماط الظاهرية التي تظهرها ذرية الصلبان المستجيبة للسائق لتوضيح وظيفة الجينات المرشحة. على الرغم من أن D. melanogaster قد استخدمت لفحص الجينات من الكائنات الحية الأخرى4,5,6,7, وقد تم تكييف نظام GAL4-UAS الآن لاستخدامها في الحشرات ذات الأهمية الطبية والزراعية لتوفير تحليل مباشر في الأنواع ذات الأهمية 8,9,10,11,12,13,14.
وفي بعوضة الملاريا الأفريقية، أنوفيليس غامبيا، تم اختبار نظام GAL4-UAS لأول مرة عن طريق خط الخلية المشترك transfection9. تم فحص العديد من البنى للكفاءة في تركيبات مختلفة ثنائية ووجدت أن 14 UAS المتكررة جنبا إلى جنب تكملها intron اصطناعية صغيرة (UAS-14i) عرض أوسع نطاق من إمكانات التنشيط عند استخدامها مع لوحة من السائقين GAL4. لإثبات في وظائف الجسم الحي، ثم استخدمت هذه البنى لإنشاء خطين منفصلين المعدلة وراثيا An. غامبيا بواسطة PiggyBac transformation8: خط سائق يحمل GAL4 يقودها مروج محدد midgut، وخط المستجيب التي تحتوي على كل من لوسيفيراز وتعزيز الجينات البروتين الفلوري الأصفر (eYFP) تحت تنظيم تسلسل UAS. وأشار نشاط لوسيفيراز محددة الأمعاء والفلورسينس في ذرية أن النظام كان فعالا في Anopheles. ومنذ ذلك الحين، تم إنشاء خطوط للسائق تعبر عن المتحولات في الأنسجة الأخرى الهامة لقدرة النواقل ومقاومة المبيدات الحشرية، بما في ذلك oenocytes15 و hemocytes16، وفي نمط قريب من كل مكان10. كما تم إنشاء العديد من خطوط UAS لتقصي الجينات التي يعتقد أنها تشارك في عملية التمثيل الغذائي وعزل مقاومة المبيدات الحشرية بوساطة ، وتركيب الهيدروكربونات الخصية ووضع علامات فلورية على أنواع مختلفة من الخلايا والأنسجة (الجدول 1). بالنسبة لخطوط المستجيب ، يتم الآن تنفيذ التكامل الموجه من الموقع للمتحول من قبل ΦC31 الكاسيت المحفز 17،18 لإصلاح السياق الجينومي للجينات المنظمة ل UAS. وبهذه الطريقة، يتم تطبيع التعبير المتحول فيما يتعلق بموقع الإدراج الجينومي، مما يسمح بإجراء مقارنة أكثر دقة للآثار الظاهرية للجينات المرشحة المختلفة.
تم تصميم خطوط المستجيب التي تم إنشاؤها حتى الآن إما للتعبير عن المتحول إما عند مستويات مرتفعة أو للحد من التعبير الجيني من خلال تداخل الحمض النووي الريبي (RNAAi). عادة ما يتم دمج استنساخ cDNA في تسلسل UAS لتوليد البلازميدات التعبيرية المناسبة ، ولكن التسلسلات الجينومية الكاملة ممكنة أيضا على افتراض أنها ليست كبيرة جدا للاستنساخ. لتوليد بناء إسكات، استخدمنا ثلاث طرق مختلفة للحصول على تسلسل مقلوب جنبا إلى جنب مناسبة التي تشكل دبوس الشعر dsRNA الذي يحفز RNAI. وشملت هذه PCR الانصهار، PCR غير المتماثلة والتوليف التجاري لبنى دبوس الشعر. ومن الشائع في كل طريقة إدراج تسلسل إنتروني بين التسلسلات المقلوبة لتوفير استقرار الاستنساخ. وقد تم تطوير البلازميدات المستجيبة التي يمكن إدخال جين من الفائدة / بناء RNAi15. هذه البلازميدات تحمل أيضا مواقع ATTB ΦC31 المطلوبة لRMCE (الموصوفة في ورقة أدولفي المصاحبة JoVE التي تصف تقنية RCME بالتفصيل). تتضمن هذه المخطوطة بروتوكولات تغطي الخطوات المهمة المطلوبة عند اختيار التسلسل لإدراجه في إحدى هذه البلازميدات للإفراط في التعبير. بالإضافة إلى ذلك، يتم وصف ويتضح بروتوكولين لإنشاء بناء دبوس الشعر RNAi.
عند إنشاء خطوط جديدة، وتحديد الأفراد المعدلة وراثيا نادرة أمر بالغ الأهمية للتكاثر من لإنشاء وصيانة المستعمرات المعدلة وراثيا. والأهم من ذلك بالنسبة لنظام GAL4-UAS هناك ضرورة للتمييز بين خطوط المستجيب والسائق لإنشاء الصلبان وتحديد ذرية الفردية التي تحمل كلا المتحولين. ويتحقق ذلك باستخدام جينات مختلفة مهيمنة للعلامات القابلة للاختيار مرتبطة بمقايس السائق والمستجيب. الأكثر شيوعا هذه هي الجينات علامة الفلورسنت التي يمكن تمييزها بوضوح باستخدام المرشحات البصرية (على سبيل المثال، eYFP، eCFP، dsRed). من المهم أن يتم التعبير عن العلامات في نمط ندواتي معروف وموثوق به لأن هذا يجعل تحديد التشوهات والتلوث أسهل. يتم تنظيم التعبير الجيني لعلامة الفلورسنت بشكل روتيني من قبل المروج الاصطناعي 3xP3 ، والذي يسبب تعبيرا محددا للعين والبطين في جميع مراحل التنمية الغامبية An. يتم تضمين علامات الفلورسنت التي تسيطر عليها 3xP3 في جميع plasmids التحول الموصوفة في هذه المقالة. يتم تضمين بروتوكول يفصل الأساليب الشائعة المستخدمة لفحص خطوط الفلورسنت An. غامبيا PUPAe GAL4-UAS هنا.
أحد العناصر الرئيسية لنظام GAL4-UAS هو ضرورة عبور خطوط السائق والمستجيب المميزة بشكل متفاوت. للقيام بذلك يجب فصل الذكور والإناث من كل خط قبل التزاوج. الكبار يمكن تمييزها بسهولة عن طريق البصر، ومع ذلك، لإنشاء الصلبان الوراثية فمن المعقول لفصل بين الجنسين قبل ظهور الكبار لضمان أن التزاوج لم يحدث. والفرق العام في الحجم بين الذكور والإناث An. gambiae pupae متغير جدا بحيث لا يمكن أن يكون طريقة فعالة ويمكن الاعتماد عليها لتحديد نوع الجنس20. وبدلا من ذلك، توفر الاختلافات المورفولوجية الواضحة في الأعضاء التناسلية الخارجية أساسا موثوقا به لممارسة الجنس في أن غامبيا. في هذه المقالة، ونحن نصف طريقة يمكن الاعتماد عليها لممارسة الجنس An. الغامبية الخوادر لإعداد الصلبان المناسبة.
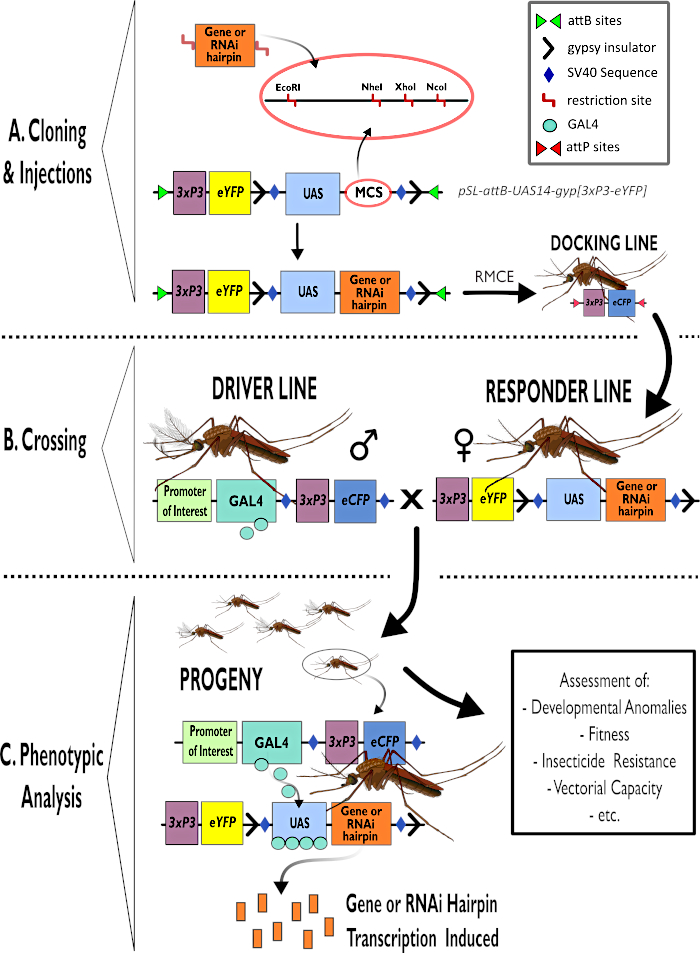
الشكل 1 - التمثيل التخطيطي لعملية استخدام نظام GAL4-UAS ثنائي الأطراف في أنوفيليس غامبيا. (أ) يتم تصوير المكونات الرئيسية لمتجه مثال (pSL-attB-UAS14-gyp [3xp3-eYFP]) ، مع تفصيل مواقع التقييد المتاحة (EcoRI و NheI و XhoI و NcoI) داخل مواقع الاستنساخ المتعددة المناسبة للاستخدام لإدراج بناء دبوس الشعر أو تسلسل الترميز لجين الاهتمام. كما يصور هيكل خط الإرساء. (ب) توضح خطوة العبور استخدام الذكور من خط السائق (تحمل سائق GAL4 من قبل مروج للاهتمام وeCFP يقودها المروج 3xP3) والإناث من خط المستجيب (تحمل جين الاهتمام أو بناء دبوس الشعر التي يسيطر عليها مروج UAS وعلامة eYFP التي يسيطر عليها المروج 3xP3). (ج) تمثيل تخطيطي ل GAL4 يقود التعبير عن جين الاهتمام بذرية الصليب في B وقائمة ببعض الأنماط الظاهرية النموذجية التي يتم تقييمها. الاختصارات: موقع استنساخ متعدد (MCS)، تبادل كاسيت بوساطة إعادة دمج (RMCE)، تسلسل المنشط المنبع (UAS)، البروتين الفلوري الأصفر المعزز (eYFP)، بروتين فلوري سماوي معزز (eCFP). يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
إن استخدام الصلبان هو الذي يوفر الطبيعة الثنائية لنظام GAL4-UAS، الذي له مزايا متميزة على النهج الخطية الأكثر. فعلى سبيل المثال، يمكن تقييم توليفات من خطوط السائق والمستجيب أكثر بكثير مما يمكن أن يكون ممكنا إذا كان لا بد من إنشاء خط جديد معدل وراثيا وصيانته لكل تركيبة من مجموعات المروجين/الجينات. والأهم من ذلك، أنه يسمح بتحليل الجينات التي تنتج الأنماط الظاهرية القاتلة أو العقيمة عندما يكون تعبيرها مضطربا والتي يصعب إنشاؤها / صيانتها في نظام خطي. ويمكن أن تظهر هذه الأنماط الظاهرية الفتاكة في جميع مراحل النمو، اعتمادا على وظيفة الجينات والتعبير الصدغي، ولكن غالبا ما يلاحظ أثناء النمو الجنيني. يتطلب تصور نمو جنين البعوض إزالة المشيمة المبهمة التي تغطي البيض. بعد الأساليب الموصوفة في Trpiš (1970)21 وكايزر وآخرون (2014)22، نقوم بوصف البروتوكولات التي نستخدمها لإصلاح الأجنة، مع الحفاظ على السلامة الهيكلية، والتبييض لمسح الإندوشوريون الذي يسمح بالتصور والتصوير المجهريين.
Protocol
1. تصميم وبناء بنى ال UAS
- تصميم وتجميع النواقل للتعبير الجيني المرشح
- تحديد التسلسل الذي سيتم استخدامه للتنظيم التنظيمي للجين المرشح.
- تسلسل cDNA / gDNA من سلالة الاهتمام ومقارنتها بالتسلسل المنشور للتحقق من هويته وتحديد SNPs المحتملة ومواقع التقييد للهضم التشخيصي.
- تأكد من أن التمهيدي الأمامي المستخدم في تضخيم الجينات يغطي تسلسل كوزاك الأصلي ويبدأ كودون ، عند الاقتضاء. وسوف التمهيدي مع ~ 10 نقطة أساس ملزمة المنبع من كودون البداية تشمل تسلسل كوزاك.
- تضمين كودون التوقف في جزء تضخيمها من التمهيدي العكسي في معظم الظروف. استخدام تسلسل إنهاء 3 'المنصوص عليها في ناقلات البلازميد الموصوفة، أو تضخيم من تسلسل الجينوم الجيني المرشح.
- ترتيب التسلسلات التجارية مع تحيز كودون محددة إذا رغبت في ذلك.
- استخدم إجراءات الغمر الفرعي القياسية لإدخال أشرطة الجينات في ناقلات البلازميد UAS، على سبيل المثال، pSL-attB-UAS14-gyp [3xP3-eYFP]15 (الشكل 1) لكل من التنظيم التنظيمي وبنى RNAi.
- إنتاج البعوض المعدل وراثيا التي تم إنشاؤها باستخدام ΦC31 إعادة دمج تبادل كاسيت بوساطة10,17,18,23.
- تحديد التسلسل الذي سيتم استخدامه للتنظيم التنظيمي للجين المرشح.
- إنشاء RNAi بنيات دبوس الشعر: تضخيم خطوة واحدة باستخدام PCR15،24 غير المتماثلة
- استخراج الحمض النووي الجينومي (gDNA) من أنثى بالغة An. غامبيا تحمل الجين المرشح المطلوب باستخدام طريقة ليفاك25.
- تصميم التمهيدي إلى الأمام لربط لاستهداف exon في 5 'من الجزء المطلوب الموجهة نحو intron المجاورة. تصميم 3 'نهاية التمهيدي جسر لربط إلى نهاية exon السابقة لتضخيم intron. نهاية 5 'مكملة لجزء صغير من exon الهدف مباشرة بعد intron.
- تشغيل تفاعل PCR غير متماثل كما هو موضح في Xiao (2006)24 (الشكل 2).
- استنساخ المنتج PCR المنقى في ناقل مناسب يحمل المروج UAS (على سبيل المثال، pSL-attB-UAS14-gyp[3xP3-eYFP]15).
ملاحظة: الإنزيمات الموجودة في موقع الاستنساخ المتعدد والملائمة لاستنساخ pSL-attB-UAS14-gyp [3xP3-eYFP] والمتصلة بالخطوات التالية المطلوبة يشار إليها في الشكل 1. هضم إنزيم واحد ضروري كما يتم إضافة موقع تقييد واحد فقط. ومن شأنها أن تحسن إزالة الفوسفورية من البلازميد كفاءة الاستنساخ.
- استخراج الحمض النووي الجينومي (gDNA) من أنثى بالغة An. غامبيا تحمل الجين المرشح المطلوب باستخدام طريقة ليفاك25.
- بناء RNAi بنيات دبوس الشعر: فيوجن PCR من cDNA و gDNA15
- استخراج الحمض النووي الجينومي (gDNA) من أنثى بالغة An. غامبيا تحمل الجين المرشح المطلوب باستخدام طريقة ليفاك25.
- تضمين gDNA في تفاعل PCR لتضخيم المنطقة المستهدفة من تسلسل exon و intron معا (الشكل 2).
- تصميم 3 'نهاية التمهيدي إلى الأمام لربط تسلسل exon الهدف العكسي لتضخيم نحو تسلسل intron الهدف ونهاية 5 'لحمل موقع تقييد لتسهيل الاستنساخ.
- تصميم التمهيدي العكسي (1) لربط نهاية 5 'من intron و5 'نهاية تراكم يحمل القواعد الأولى من التسلسل الأمامي للإكسون المجاورة. ويستخدم هذا التراكم في PCR الانصهار.
- تنقية المنتج رد الفعل المطلوب.
- استخراج الحمض النووي الريبي، وإزالة الحمض النووي باستخدام DNase وإعداد cDNA من الإناث البالغات An. غامبي يحمل الجين المرشح المطلوب بعد بروتوكولات الشركة المصنعة.
- استخدام cDNA في تفاعل PCR لتضخيم المنطقة المستهدفة من exon فقط (الشكل 2).
- تصميم التمهيدي الأمامي (2) بحيث نهاية 3 'يربط في نهاية 3 'من تسلسل exon الهدف التكميلي ونهاية 5 'من التمهيدي يحمل موقع تقييد للاستخدام في الاستنساخ.
ملاحظة: يمكن استخدام التمهيدي الأمامي من 1.3.1.2 مرة أخرى في رد الفعل الثاني هذا. ومع ذلك، فإن هذا يعني أن هضم إنزيم واحد ضروري. استخدام التمهيدي الأمامي الثاني مع موقع تقييد مختلف سيسمح لهضم مزدوج مما قد يزيد من كفاءة الاستنساخ. - تصميم التمهيدي العكسي (2) -- نهاية 3 'يربط إلى نهاية 5 'من exon المجاورة تضخيم exon الهدف. نهاية 5 'يربط إلى نهاية 3 'من حبلا إلى الأمام introns. ويستخدم هذا التراكم في PCR الانصهار.
- تنقية المنتج رد الفعل المطلوب.
- تصميم التمهيدي الأمامي (2) بحيث نهاية 3 'يربط في نهاية 3 'من تسلسل exon الهدف التكميلي ونهاية 5 'من التمهيدي يحمل موقع تقييد للاستخدام في الاستنساخ.
- وتشمل المنتجات من الخطوة 1.3.1 و 1.3.2 كنماذج لرد فعل PCR الانصهار باستخدام تركيزات قياسية مع التمهيديات الأمامية 1 و 2. تنقية المنتج المطلوب.
- هضم المنتج المنقى لتوليد تراكمات للاستنساخ. استنساخ في ناقل مناسب المصب من المروج UAS. الإنزيمات المناسبة للاستنساخ pSL-attB-UAS14-gyp [3xP3-eYFP] والخطوات التالية المطلوبة مبينة في الشكل 1.
- استخراج الحمض النووي الجينومي (gDNA) من أنثى بالغة An. غامبيا تحمل الجين المرشح المطلوب باستخدام طريقة ليفاك25.
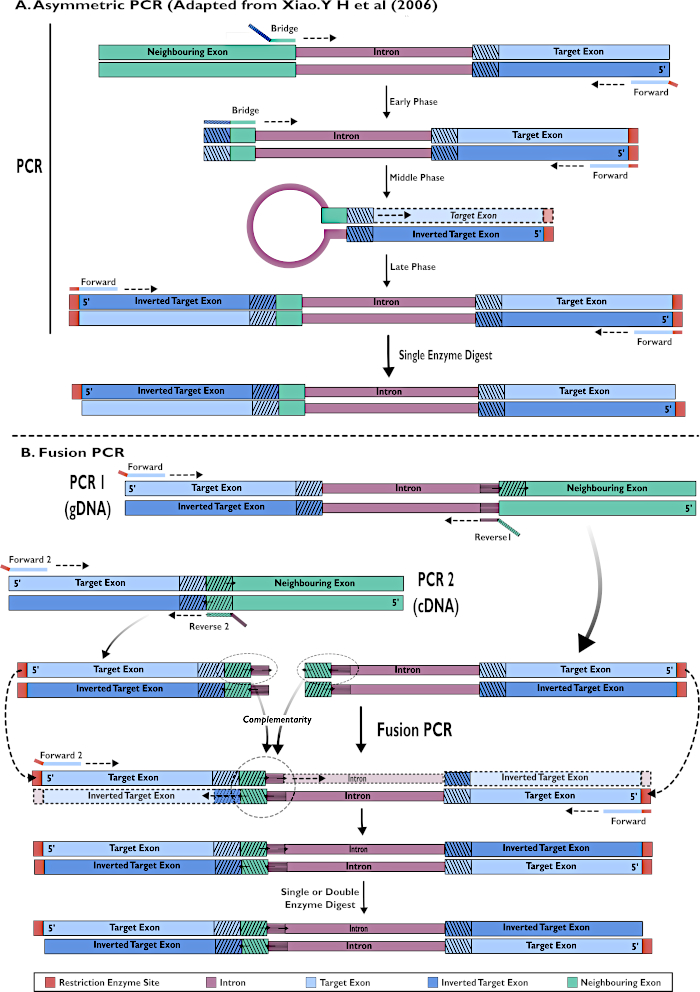
الشكل 2 - التمثيل التخطيطي لإنشاء بنيات RNAi لإدراجها في pSL-attB-UAS14-gyp [3xP3-eYFP] طريقتين: (أ) خطوة واحدة PCR غير متماثل (مقتبس من شياو. Y H وآخرون (2006) و (ب) متعددة خطوة الانصهار PCR. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
2. An. فحص الخوادر الغامبية
- جمع الخوادر لتوصيف المجهرية
ملاحظة: في جميع أنحاء هذه البروتوكولات المياه يشير إلى الماء المقطر تكملها 0.01٪ بركة الملح.- إعادة ظهور البعوض الغامبي باستخدام بروتوكولات قياسية (مثل MR426) إلى مرحلة الجرو.
تنبيه: الحرص على عدم إصابة الخوادر طوال هذه العملية. - جمع الخوخ على طبق مسطح واضح مناسب للاستخدام مع مجسم (على سبيل المثال، طبق بيتري بلاستيكي 100 × 15 ملم، وتجنب الحواف).
ملاحظة: لجمع الخوادر نستخدم ماصة باستور بلاستيكية سعة 3 مل مع قطع حوالي 10 مم من النهاية لتوسيع النهاية ومنع إصابة البعوض. يمكن الانتهاء من الفحص والجنس على الأفراد ، ومع ذلك ، فإن هذا بطيء للغاية. يوصى بإجراء الفحص والجنس على مجموعات من 50-200 جروة (حجم المجموعة الممكنة محدود بحجم الطبق المستخدم ويخضع للتفضيل الشخصي). إذا كان عدد كبير يجري فحصها، يمكن زيادة الكفاءة عن طريق محاذاة الخوادر الأولى حوالي 4 إلى 5 عميقة في خطوط، ونقل الخوادر الهدف للخروج من هذا الخط. - باستخدام ماصة باستور، وإزالة بعناية تقريبا كل الماء من جميع أنحاء الخوادر. ترك ما يكفي من الماء حول الخوخ حتى تكون immotile على نحو فعال ولكن يمكن نقلها بسهولة مع فرشاة غرامة. إذا أصبح من الصعب نقلها، ثم إضافة المزيد من الماء.
ملاحظة: عندما تتم إزالة ما يكفي من الماء، فإن الخوادر تقع على جانبهم، مما يسمح تصور العينين للكشف عن الفلورية وتحديد الأعضاء التناسلية ثنائية الشكل (الشكل 4DE).
تحذير: تأكد من أن الخوادر لا جفف. إذا لم يبق سوى كمية صغيرة جدا من الماء يمكن أن تقلل أكثر مع الحرارة من مصباح المجهر وعندما تنقسم بين برك من الخوخ. يجب أحيانا إضافة مياه إضافية أثناء العملية باستخدام ماصة باستور سعة 3 مل للمجموعة (المجموعات) المرغوبة.
- إعادة ظهور البعوض الغامبي باستخدام بروتوكولات قياسية (مثل MR426) إلى مرحلة الجرو.
- تحديد علامات الفلورسنت في الخوادر
ملاحظة: استخدام مجسم التكبير منخفضة يسمح فحص مجال واسع، يمكن القيام به الفرز على المجهر مركب مقلوب، ولكن يجب أن يتم ذلك بشكل فردي.- عند فحص علامة الفلورسنت من المهم أولا معرفة الأنماط المتوقعة للتعبير والميراث. النظر في ما يلي:
- اللون(الألوان): حدد أي عامل تصفية (عوامل) لتصور التعبير.
- نمط التعبير الصدغي: فهم أين وفي أي مرحلة حياة تتوقع أن ترى التعبير.
- نسبة الأنماط الظاهرية المختلفة: تحديد النسبة المئوية للسكان التي ينبغي أن تحمل علامات الاهتمام.
- إجراء فحص الفلورسنت في الظلام، كما يمكن أن تتداخل حتى ضوء منخفض مع قرار الفلورسينس. ومع ذلك، استخدم مصباح بجانب المجسمة عندما يكون الضوء مطلوبا للتلاعبات الأخرى.
تنبيه: تأكد من أن مساحة العمل حول المجسم الفلوري واضحة قبل إطفاء الأنوار. - تشغيل لمبة الفلورسنت وترك لتدفئة لفترة الشركة المصنعة الموصى بها (عادة 10-15 دقيقة). حدد المرشح المطلوب على مجسم الفلورسنت وتحقق من وجود شعاع ملون من الضوء المرئي موجه إلى وسط لوحة المسرح. إذا كان هذا غير مرئي أو خافت جدا لمبة الفلورسنت قد لا يكون دافئا تماما، يتم إغلاق مصراع الكاميرا، أو البصريات المجهر ليست محاذاة بشكل جيد.
- باستخدام الضوء الأبيض، مركز الخوادر في مجال الرؤية وجعلها في التركيز. قد يحتاج هذا التكبير إلى تغيير عند التبديل بين مرشحات مختلفة اعتمادا على كثافة الفلورسينس.
- باستخدام فرشاة الطلاء غرامة تفاصيل ضمان أن الخوادر فحص لا تتداخل.
- إيقاف الضوء الأبيض من مجسم واستخدام التركيز الدقيق لجعل منطقة الخوخ تحمل النمط الظاهري من الاهتمام في التركيز. يجب أن يكون نمط الفلورسنت مرئيا. وترد أمثلة على الفلورسينس الذي يتحكم فيه المروجون 3xP3 في الشكل 3.
- استخدم أدنى تكبير يمكن عنده تمييز النمط الظاهري الفلوري المتوقع بشكل موثوق عن الأفراد الذين ليسوا مصابين بالفلورسين.
- بالنسبة للسلالات ذات الفلورسنت الساطع استخدم ضوءا ساطعا منخفض الكثافة أيضا أثناء الفحص ، إذا كانت إشارة الفلورسنت لا تزال قابلة للتحديد بوضوح.
- عند الانتهاء من الفحص الأولي، قم بمسح المجموعات السكانية بسرعة تحت مرشحات أخرى للكشف عن التلوث المحتمل.
تنبيه: تأكد من وجود مسافة واضحة بين مجموعات الخوادر المفرزة لمنع التلوث عن طريق حركة الخوادر. كن على علم بأن حجم المجموعات سيتغير مع جنس الخوادر وأن المسافات يمكن أن تظهر أكبر عند النظر تحت التكبير. خذ عناية خاصة عندما لا تكون المسابح ضمن مجال الرؤية.
- عند فحص علامة الفلورسنت من المهم أولا معرفة الأنماط المتوقعة للتعبير والميراث. النظر في ما يلي:
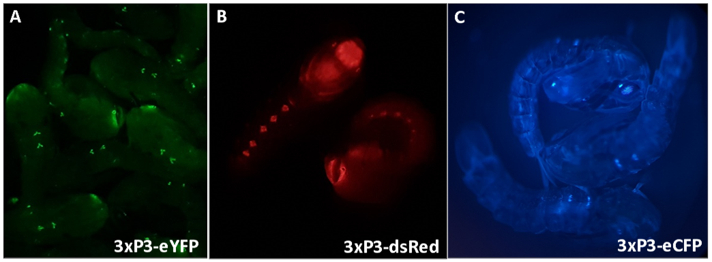
الشكل 3 - أنوفيليس غامبيا الخوخ التعبير عن علامات الفلورسنت مدفوعة من قبل المروج 3xP3 (A) eYFP، (B) dsRed و (C) eCFP. التكبير: A = 16X، B، C = 20X.
-
الجنس بوباي
- جمع الخوخ. إزالة المياه الزائدة، ولكن توفير كافية بحيث المجاذيف الشرجية جزء قليلا من الأعضاء التناسلية للمساعدة في التصور وتوصيف مورفولوجي (الشكل 4D، E).
- إذا لم يكن أي جروة / ه على جانبهم ، استخدم فرشاة طلاء مفصلة دقيقة لتحويل الخوخ بلطف وتحريك المجاذيف الشرجية بحيث يمكن التعرف على الأعضاء التناسلية الخارجية.
- الخوادر منفصلة على أساس الأعضاء التناسلية الخارجية المميزة; الذكور لديهم أنبوب طويل أن ينقذ من الجزء الظهري النهائي ما يقرب من نصف طول المجاذيف الشرجية (الشكل 4B). الأعضاء التناسلية الخارجية للجرو الأنثوي أقصر بكثير وbifurcate (الشكل 4A).
ملاحظة: في بعض الأحيان ، إذا ظل الهيكل الخارجي الرابع ليرقات النجوم متصلا أو تلف الأعضاء التناسلية الخارجية (الشكل 4C) ، فإن تحديد الجنس بثقة أكثر صعوبة. عندما يكون جنس الجرو غير واضح ، فمن أفضل الممارسات التخلص منه. إذا كان الفرد هو أن تبقى، ينبغي السماح للجروة للخروج في عزلة والجنس تحديدها باستخدام ملامح مورفولوجية الكبار. ومن المرجح أنه إذا تضررت أعضائها التناسلية الفرد قد لا تتزاوج بنجاح. - جعل بركة لكل جنس في الطرف الآخر من الطبق إلى حمام السباحة غير مثير، ونقل الخوخ المحدد عبر الطبق باستخدام فرشاة الطلاء غرامة بالتفصيل. تسمية الجانب السفلي من الطبق حيث سيتم جمع برك اثنين للتعرف عليها في وقت لاحق.
- عندما يتطلب الأمر فحص الجنس والفلورسنت ، قم بإجراء فحص الفلورسنت أولا ، لأنه العملية الأسرع بين الاثنين.
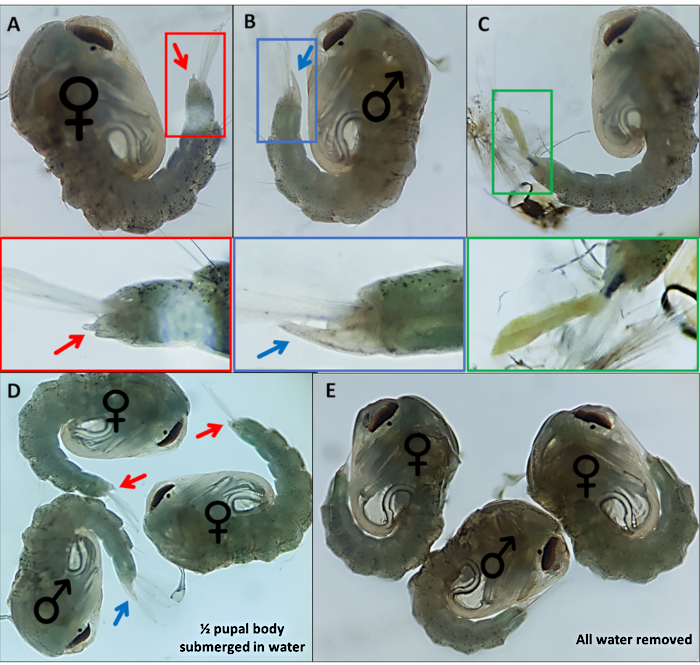
الشكل 4 - ممارسة الجنس مع أنوفيليس غامبيا. الخوادر الفردية التي تشير إلى الأعضاء التناسلية الخارجية لل(أ) أنثى (ب) ذكر و (C) فرد لا يمكن التعرف عليه بسهولة بسبب انفصال غير مكتمل من الهيكل الخارجي لليرقات. صور مكبرة أدناه تسلط الضوء على الأعضاء التناسلية الخارجية. Pupae مع ♀ (أنثى) و ♂ (ذكر) تشير إلى الأعضاء التناسلية الخارجية للجراء مع (D) ~ 50٪ من الخوخ المغمورة في الماء ومع (E) إزالة جميع المياه تسليط الضوء على الفرق في سهولة التصور من الأعضاء التناسلية الخارجية. التكبير: A, B, C = 40x, D, E = 30x. الرجاء الضغط هنا لعرض نسخة أكبر من هذا الرقم.
- تأكيد الجنس كبالغين
- حتى يتم إثبات معدل خطأ منخفض جدا، تأكد من جنس الخوادر من قبل مورفولوجيا البالغين بعد الظهور. فصل الخوادر الجنس في مجموعات من 10 أو أقل في أنبوب واضح 20 مل مع عدد قليل من مل من الماء، وختم مع كرة من القطن والصوف، وصفت مع الجنس المتوقع والسماح للظهور بين عشية وضحاها.
ملاحظة: بما أن البالغين ينقلون في صباح اليوم التالي، فليس من الضروري تزويد البالغين الناشئين بالطعام. - تأكيد جنس البالغين الناشئين باستخدام الميزات المورفولوجية في اليوم التالي.
- إذا كان هناك أي ذكور موجودين في مجموعات الإناث ، فتخلص من الإناث ، في حالة حدوث التزاوج بالفعل.
- إذا كانت هناك أي أنثى موجودة في جمع الذكور، وإزالة الإناث / ثانية والحفاظ على الذكور للعبور.
- حتى يتم إثبات معدل خطأ منخفض جدا، تأكد من جنس الخوادر من قبل مورفولوجيا البالغين بعد الظهور. فصل الخوادر الجنس في مجموعات من 10 أو أقل في أنبوب واضح 20 مل مع عدد قليل من مل من الماء، وختم مع كرة من القطن والصوف، وصفت مع الجنس المتوقع والسماح للظهور بين عشية وضحاها.
- إعداد نظام GAL4-UAS يعبر
- يستنشق العدد المطلوب من البالغين من الذكور والإناث من الأنابيب في الخطوة 2.4 إلى قفص أو دلو صغير تم إعداده بالطريقة القياسية لتربية An. gambiae.
ملاحظة: يجب الحرص على عدم إلحاق الضرر بالبالغين أثناء عملية النقل هذه. - استخدام ما يقرب من 50 الإناث مع عدد متساو من الذكور، عندما يطلب من البالغين ~ 2000 من ذرية.
ملاحظة: حيث يمكن تغذية الصليب عدة مرات لتوليد دفعات متعددة تصل إلى 200 من كل جنس يمكن إعدادها في أقفاص 30cm × 30cm × 30cm. عندما يكون عدد قليل فقط من الإناث (<20) متاحة للصليب، نضيف ~ 4x عدد الذكور لزيادة احتمال التزاوج الناجح. - الدم تغذية الإناث عبرت والذرية الخلفية إلى مرحلة مناسبة، بعد البروتوكولات القياسية26، لإجراء تقييم phenotypic (على سبيل المثال، مقاومة المبيدات الحشرية، والقدرة على ناقلات ويقايس تكلفة اللياقة البدنية).
- حيث تأثير الأم للتعبير transgene من المرجح، إعداد الصلبان المتبادلة من خطوط السائق والمستجيب و المقايسة المتوقعة النمط الظاهري.
ملاحظة: الصلبان باستخدام 'heterozygous' أو مجموعات مختلطة من خطوط السائق والمستجيب، وإنتاج ذرية مع كل من 4 أنماط جينية ممكنة. وهذا يوفر نوع البرية، UAS فقط وGAL4 الضوابط فقط، فضلا عن transheterozygotes GAL4-UAS التي لتحليل النمط الظاهري. إذا تم عبور مجموعات متجانسة، قم بإعداد الصلبان الإضافية لتوفير عناصر تحكم مناسبة لمقارنة الأنماط الظاهرية. وينبغي فحص ذرية كما أعلاه فصل ذرية تحمل كل من أو فقط إما علامة, فضلا عن السلبيات, لتقييم phenotypic.
- يستنشق العدد المطلوب من البالغين من الذكور والإناث من الأنابيب في الخطوة 2.4 إلى قفص أو دلو صغير تم إعداده بالطريقة القياسية لتربية An. gambiae.
- إنشاء مجموعات متجانسة من الخطوط التي تم إنشاؤها من خلال RCME تحمل علامات فلورية بديلة
ملاحظة: من الضروري أن علامة الفلورسنت من كلا الخطين موجودة في نفس الموقع الجينومي وهي مميزة تماما.- إعداد صليب أبوي يضم حوالي 200 شخص بالغ مع أعداد متساوية من الذكور ذوي الخطوط المختلفة والإناث من الخط الآخر بعد الفحص لاختيار الأفراد الذين يظهرون الفلورسينس والجنس الصحيحين، كما هو موضح أعلاه. حوالي أسبوع واحد في وقت لاحق الدم تغذية الصليب باستخدام بروتوكولات المنشأة26.
- الخلفية ذرية F1 إلى pupae باستخدام البروتوكولات القياسية وجمع الخوخ كما هو موضح سابقا.
- شاشة للفلورة اختيار أولئك الذين يحملون كل من علامات الوالدين (transheterozygous). إعداد تقاطع F1 مع هذه الخوخ.
- بعد أسبوع واحد، والدم تغذية الإناث F1 والذرية الخلفية إلى مرحلة pupal اتباع البروتوكولات القياسية.
- شاشة pupae F2 اختيار تلك التي تعرض واحدة فقط من علامات. ستكون هذه متجانسة للإدراج. فقط 25٪ من ذرية سيكون homozygous لكل الإدراج، لذلك تأكد من أن تربى ذرية كافية لتوفير قفص الأسهم (400-500).
ملاحظة: يجب أن يكون اختيار ذرية transheterozygous صارما تماما وإلا تصبح العملية ملوثة ، وقد لا يتحقق التجانس الكامل. تحقق مرة أخرى من جميع ذرية المحددة لF1 intercross.
- إعداد صليب أبوي يضم حوالي 200 شخص بالغ مع أعداد متساوية من الذكور ذوي الخطوط المختلفة والإناث من الخط الآخر بعد الفحص لاختيار الأفراد الذين يظهرون الفلورسينس والجنس الصحيحين، كما هو موضح أعلاه. حوالي أسبوع واحد في وقت لاحق الدم تغذية الصليب باستخدام بروتوكولات المنشأة26.
3. بروتوكول إزالة الأجنة الغامبي
-
تغذية الدم وصيانته
- إعادة ظهور البعوض الغامبي للبالغين باتباع البروتوكولات القياسية (مثل MR4).
- تغذية الدم 5-7 يوم من البالغات البالغات من العمر، وضمان معظم هم محفورة تماما.
تنبيه: في جميع أنحاء هذا البروتوكول العمل بسرعة أمر ضروري لضمان عدم السماح للبيض لجفف.
-
زرع البيض المستحث
- بعد 3 أيام من تغذية الدم جمع البيض عن طريق زرع المستحث.
- تجميع غرفة oviposition.
- ملء وعاء oviposition بالماء إلى عمق 5 ملم تقريبا. إرفاق وعاء إلى نهاية واحدة من أنبوب البولي بروبلين 50 مل, قطع سابقا مع المنشار بحيث كلا طرفي مفتوحة. (نستخدم قرص بلاستيكي لوعاء (الشكل 5)؛ ومع ذلك، يمكن استخدام الغطاء الأصلي للأنبوب بدلا من ذلك).
- تغطية الطرف الآخر من أنبوب البولي بروبلين قطع مع المواد (خرطوم / الجوارب) أو أقسام من قفاز اللاتكس المضمون مع شريط مرن، بحيث يمكن إدخال الكبار ولكن لا يمكن الهروب (الشكل 5). توجد تصاميم غرفة بديلة أخرى ويمكن استخدامها26.
- أدخل بعناية 10-15 الإناث (الدم الذي يتغذى في الخطوة 3.1.2) إلى غرفة oviposition. تغطية غرفة oviposition لإنتاج الظلام وترك لمدة 20 دقيقة.
تنبيه: تجنب تحريك وعاء oviposition بمجرد وضع البيض لمنع تقطعت بهم السبل وجفف البيض. - فصل بعناية أنبوب البولي بروبلين 50 مل من وعاء oviposition، مع ضمان عدم إطلاق البعوض. يجب أن يكون البيض الأبيض مرئيا. تحقق من أنه تم وضع ما يكفي لغرض محظور. كرر إذا لزم الأمر.
- تغطية وعاء (للحماية من الغبار) والسماح للبيض لتنضج إلى مرحلة النمو من الفائدة.
- استخدام فرشاة الطلاء تفاصيل دقيقة لالتقاط البيض من وعاء ووضعها على الماء في كتلة الزجاج حفر 40 mm2.

الشكل 5 - مثال على تفكيك غرفة أوفييشن (أ) لتسليط الضوء على المكونات و (باء) تجميعها. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
-
تحديد الأجنة
تنبيه: تنفيذ جميع خطوات تحديد (الخطوة 3.3) في غطاء الدخان بسبب استخدام الفورمالديهايد.- إعداد حل FAA كما هو موضح في Kaiser et al. (2014)22. وتتألف إدارة الطيران الفيدرالية من 3.6 م فورمالديهايد، و0.87 م من حمض الخليك، و8.5 م من الإيثانول المطلق المصنوع من الحجم بالماء المقطر (dH2O).
- ل10 مل من FAA الجمع بين 2.68 مل من 13.42 M الفورمالديهايد، 4.96 مل من 17.14 M الإيثانول و 0.5 مل من 17.4 M حمض الخليك مع 1.86 مل من H2O المقطر. يمكن الاحتفاظ المثبت لمدة 3 أشهر على الأقل في حاوية زجاجية مختومة بإحكام, أبقى في خزانة الكيميائية المعينة.
- إزالة المياه بعناية من كتلة الزجاج مع micropipette وتغطية البيض في 500 ميكرولتر من FAA ويتذبذب بلطف (~ 25 دورة في الدقيقة) على شاكر المدارية في درجة حرارة الغرفة لمدة 30 دقيقة. لا يوجد تغيير في اللون مرئي في هذه المرحلة.
- شطف البيض جيدا بالماء المقطر. إجراء الشطف 15 مرة لإزالة كافة آثار الفورمالديهايد. باستخدام 1000 ميكروبايت ميكروبايت μL، إضافة ثم إزالة 1 مل من dH2O في وقت واحد ضمان عدم تلف البيض أثناء القيام بذلك.
- تخزين مياه الصرف الصحي من الشطف في حاوية مخصصة الفورمالديهايد التخلص منها وفقا للمبادئ التوجيهية للسلامة.
- عند هذه النقطة، يمكن تخزين البيض الثابت عند 4 درجات مئوية بين عشية وضحاها في الماء للحفاظ على رطوبتها.
- إعداد حل FAA كما هو موضح في Kaiser et al. (2014)22. وتتألف إدارة الطيران الفيدرالية من 3.6 م فورمالديهايد، و0.87 م من حمض الخليك، و8.5 م من الإيثانول المطلق المصنوع من الحجم بالماء المقطر (dH2O).
-
تبييض الجنين
تنبيه: قم بتنفيذ جميع خطوات التبييض (الخطوة 4) في غطاء الدخان بسبب الإطلاق المحتمل لغاز الكلور عند الجمع بين هيبوكلوريت الصوديوم وحمض الخليك.- إعداد محلول التبييض (حل Trpiš - الموصوف في Trpiš (1970)21 وتعديله وفقا ل Kaiser et al. (2014)22). محلول Trpiš هو 0.59 M هيبوكلوريت الصوديوم و 0.35 M حمض الخليك المذاب في H2O المقطر.
- للحصول على 10 مل أوفولومي من محلول Trpiš، اجمع 2.68 مل من 2.2 م هيبوكلوريت الصوديوم و0.2 مل من حمض الخليك 17.4 M مع 7.12 مل من H2O المقطر.
ملاحظة: يمكن تخزين محلول Trpiš لمدة 3 أشهر على الأقل في حاوية زجاجية محكمة الإغلاق والاحتفاظ بها في خزانة كيميائية آمنة. قد تحتاج إلى دوامة الحل بعد التخزين وينبغي دائما أن تفتح في غطاء الدخان في حالة إطلاق غاز الكلور.
- للحصول على 10 مل أوفولومي من محلول Trpiš، اجمع 2.68 مل من 2.2 م هيبوكلوريت الصوديوم و0.2 مل من حمض الخليك 17.4 M مع 7.12 مل من H2O المقطر.
- يغطى البيض الثابت بمحلول 1 مل من محلول Trpiš ويحتضن في درجة حرارة الغرفة لمدة 30 دقيقة. سيبدأ البيض في تطوير بقع شاحبة بعد حوالي 5 دقائق من الحضانة ، ليصل في نهاية المطاف إلى لون أبيض حليبي بمجرد مسحه.
- شطف البيض كما هو الحال في الخطوة 3.3.3 لإزالة محلول Trpiš.
- تخزين مياه الصرف الصحي في حاوية النفايات المعينة والتخلص مع المياه الزائدة أسفل استنزاف.
- إعداد محلول التبييض (حل Trpiš - الموصوف في Trpiš (1970)21 وتعديله وفقا ل Kaiser et al. (2014)22). محلول Trpiš هو 0.59 M هيبوكلوريت الصوديوم و 0.35 M حمض الخليك المذاب في H2O المقطر.
-
خزن
- تخزين في 500 ميكرولتر من dH2O والحفاظ على ما بين 2-8 درجة مئوية لبضعة أيام. إزالة معظم المياه بعناية قبل عرض والتصوير على الكتلة ولكن تجنب الجفاف من البيض عن طريق ترك كمية صغيرة من الماء في الزجاج ووتش. هذا لن يعطل تصوير البيض. يمكن وضع البيض الفردي على شريحة المجهر لتصوير التكبير الأعلى.
النتائج
3xP3 التعبير عن eYFP، dsRed وeCFP يوفر موثوق بها، وتحديد يمكن تمييزها بسهولة من الأفراد الذين يمتلكون الجينات علامة إنتاج التعبير في العيون والعصابات البطنية من الجراء غامبيا (الشكل 3). 100- ويبرز الشكل 4 المورفولوجيا التفاضلية الملاحظة في الأعضاء التناسلي?...
Discussion
إن فهم وظيفة الجينات للبعوض أمر حيوي لتطوير نهج جديدة لمكافحة الأنوفيليس والتأثير على انتقال الملاريا. نظام GAL4-UAS الموصوف هو نظام متعدد الاستخدامات وقوي للتحليل الوظيفي للجينات المرشحة وحتى الآن استخدمنا النظام لدراسة الأساس الوراثي لمقاومة المبيدات الحشرية17 وإنتاج ا?...
Disclosures
وليس لدى صاحبي البلاغ ما يكشفان عنه.
Acknowledgements
ونحن نعترف بامتنان التمويل من LSTM وIVCC (أدريانا أدولفي)، BBSRC (جائزة المحقق الجديد (AL)، MRC (درجة الدكتوراه إلى BCP:MR/P016197/1)، ويلكوم (السير هنري ويلكوم زمالة ما بعد الدكتوراه إلى LG: 215894/Z/19/Z) التي أدرجت تحليل Gal4UAS في المقترحات.
Materials
| Name | Company | Catalog Number | Comments |
| 100 x 15 mm plastic Petri dish | SLS | 2175546 | Pack of 10 |
| 1000 µL Gilson Pipette | Gilson | F144059P | |
| 20/25 mL Universal Tubes | Starlab | E1412-3020 | Pack of 400 |
| 3 mL Pasteur Pipettes | SLS | G612398 | Greiner Pasteur pipette 3 mL sterile individually wrapped |
| 50 mL Falcon Tubes | Fisher Scientific | 11512303 | |
| Absolute Ethanol | Fisher Scientific | BP2818-500 | 500 mL |
| Acetic Acid | SLS | 45726-1L-F | 1 L |
| Cages | SLS | E6099 | 30x30x30 with screen port |
| Fine Paint Brushes | Amazon | UKDPB66 | KOLAMOON 9 Pieces Detail Painting Brush Set Miniture Brushes for Watercolor, Acrylic Painting, Oil Painting (Wine Red) |
| Fish food | Amazon | Tetra Min Fish Food, Complete Food for All Tropical Fish for Health, Colour and Vitality, 10 L | |
| Formaldehyde Solution | Sigma Aldrich | F8775 | |
| Mouth Aspirator | John Hock | 612 | |
| Pond Salt | Amazon | Blagdon Guardian Pond Tonic Salt, for Fish Health, Water Quality, General Tonic, pH Buffer, 9.08 kg, treats 9,092 L | |
| Pupae Pots | Cater4you | SP8OZ | 250 pots with lids |
| Small Plastic Buckets | Amazon | 2.5 L White Plastic Pail Complete with White Lid (Pack of 10) | |
| Sodium Hypochlorite | Fisher Scientific | S25552 |
References
- Brand, A. H., Perimon, N. Targeted gene expression as a means of altering cell fates and generating dominant phenotypes. Development. 118 (2), 401-415 (1993).
- Duffy, J. B. GAL4 system in drosophila: A fly geneticist's swiss army knife. Journal of Genetics and Development. 34 (1-2), 1-15 (2002).
- Dow, J. A. . ELS. , (2012).
- Edi, C. V., et al. CYP6 P450 Enzymes and ACE-1 Duplication Produce Extreme and Multiple Insecticide Resistance in the Malaria Mosquito Anopheles gambiae. PLoS Genetics. 10 (3), 1004236 (2014).
- Daborn, P. J., et al. Using Drosophila melanogaster to validate metabolism-based insecticide resistance from insect pests. Insect Biochemistry and Molecular Biology. 42 (12), 918-924 (2012).
- Riveron, J. M., et al. Genome-wide transcription and functional analyses reveal heterogeneous molecular mechanisms driving pyrethroids resistance in the major malaria vector Anopheles funestus across Africa. Genes Genomes Genetics. 7 (6), 1819-1832 (2017).
- Riveron, J. M., et al. A single mutation in the GSTe2 gene allows tracking of metabolically based insecticide resistance in a major malaria vector. Genome Biology. 15 (2), (2014).
- Lynd, A., Lycett, G. J. Development of the Bi-Partite Gal4-UAS System in the African Malaria Mosquito, Anopheles gambiae. PLoS ONE. 7 (2), 31552 (2012).
- Lynd, A., Lycett, G. J. Optimization of the Gal4-UAS system in an Anopheles gambiae cell line. Insect Molecular Biology. 20 (5), 599-608 (2011).
- Adolfi, A., Pondeville, E., Lynd, A., Bourgouin, C., Lycett, G. J. Multi-tissue GAL4-mediated gene expression in all Anopheles gambiae life stages using an endogenous polyubiquitin promoter. Insect Biochemistry and Molecular Biology. 96, 1-9 (2018).
- Kokoza, V. A., Raikhel, A. A. Targeted gene expression in the transgenic Aedes aegypti using the binary Gal4-UAS system. Insect Biochemistry and Molecular Biology. 41, 637-644 (2011).
- O'Brochta, D. A., Pilitt, K. L., Harrell, R. A., Aluvihare, C., Alford, R. T. Gal4-based Enhancer-Trapping in the Malaria Mosquito Anopheles stephensi. Genes Genomes Genetics. 2, 21305-21315 (2012).
- Zhao, B., et al. Regulation of the Gut-Specific Carboxypeptidase: A Study Using the Binary Gal4/UAS System in the Mosquito Aedes Aegypti. Insect Biochemistry and Molecular Biology. 54, 1-10 (2014).
- Imamura, M., et al. Targeted Gene Expression Using the GAL4/UAS System in the Silkworm Bombyx mori. Genetics. 165 (3), 1329-1340 (2003).
- Lynd, A., et al. Development of a functional genetic tool for Anopheles gambiae oenocyte characterisation: application to cuticular hydrocarbon synthesis. bioRxiv. , (2019).
- Pondeville, E., et al. Hemocyte-targeted gene expression in the female malaria mosquito using the hemolectin promoter from Drosophila. Insect Biochemistry and Molecular Biology. 120, 103339 (2020).
- Adolfi, A., et al. Functional genetic validation of key genes conferring insecticide resistance in the major African malaria vector, Anopheles gambiae. Proceedings of the National Academy of Sciences of the United States of America. 116 (51), 25764-25772 (2019).
- Pondeville, E., et al. Efficient integrase-mediated site-specific germline transformation of Anopheles gambiae. Nature Protocols. 9 (7), 1698-1712 (2014).
- Horn, C., Schmid, B. G. M., Pogoda, F. S., Wimmer, E. A. Fluorescent transformation markers for insect transgenesis. Insect Biochemistry and Molecular Biology. 32, 1221-1235 (2002).
- Clements, A. . A. Biology of Mosquitoes, Volume 1: Development, Nutrition and Reproduction. 1, (1992).
- Trpiš, M. A new bleaching and decalcifying method for general use in zoology. Canadian Journal of Zoology. 48, 892-893 (1970).
- Kaiser, M. L., Duncan, F. D., Brooke, B. D. Embryonic Development and Rates of Metabolic Activity in Early and Late Hatching Eggs of the Major Malaria Vector Anopheles gambiae. PLoS ONE. 9 (12), 114381 (2014).
- Grigoraki, L., Grau-Bové, X., Yates, H. C., Lycett, G. J., Ranson, H. Isolation and transcriptomic analysis of Anopheles gambiae oenocytes enables the delineation of hydrocarbon biosynthesis. eLife. 9, 58019 (2020).
- Xiao, Y. -. H., Yin, M. -. H., Hou, L., Pei, Y. Direct amplification of intron-containing hairpin RNA construct from genomic DNA. BioTechniques. 41 (5), 548-552 (2006).
- Livak, K. J. Organization and Mapping of a Sequence on the Drosophila melanogaster X and Y Chromosomes That Is Transcribed during Spermatogenesis. Genetics. 107 (4), 611-634 (1984).
- MR4, CDC, NEI & beiResources. . The MR4 Methods in Anopheles Research Laboratory Manual. 5th Edition. , (2015).
- Sik Lee, Y., Carthew, R. W. Making a better RNAi vector for Drosophila: use of intron spacers. Methods. 30 (4), 322-329 (2003).
- Cha-aim, K., Hoshida, H., Fukunaga, T., Akada, R., Peccoud, J. . Gene Synthesis: Methods and Protocols. , 97-110 (2012).
- Cavener, D. R. Comparison of the consensus sequence flanking translational start sites in Drosophila and vertebrates. Nucleic Acids Research. 15 (4), 1353-1361 (1987).
- Wang, Y., Wang, F., Wang, R., Zhao, P., Xia, Q. 2A self-cleaving peptide-based multi-gene expression system in the silkworm Bombyx mori. Scientific Reports. 5, (2015).
- Galizi, R., et al. A synthetic sex ratio distortion system for the control of the human malaria mosquito. Nature Communications. 5, 3977 (2014).
- Kondo, S., et al. Neurochemical organisation of the Drosophila Brain Visualised by Endogenously Tagged Neurotransmitter Receptors. Cell Reports. 30 (1), 284-297 (2020).
- Lee, P. -. T., et al. A gene-specific T2A-GAL4 library for Drosophila. eLife. 7, 35574 (2018).
- Marois, E., et al. High-throughput sorting of mosquito larvae for laboratory studies and for future vector control interventions. Malaria Journal. 11, 302 (2012).
- Crawford, J. E., et al. Efficient production of male Wolbachia-infected Aedes aegypti mosquitoes enables large-scale suppression of wild populations. Nature Biotechnology. 38 (4), 482-492 (2020).
- Goltsev, Y., et al. Developmental and evolutionary basis for drought tolerance of the Anopheles gambiae embryo. Developmental Biology. 330 (2), 462-470 (2009).
- Rezende, G. L., et al. Embryonic desiccation resistance in Aedes aegypti: presumptive role of the chitinized Serosal Cuticle. BMC Developmental Biology. 8 (1), 82 (2008).
- Vargas, H. C. M., Farnesi, L. C., Martins, A. J., Valle, D., Rezende, G. L. Serosal cuticle formation and distinct degrees of desiccation resistance in embryos of the mosquito vectors Aedes aegypti, Anopheles aquasalis and Culex quinquefasciatus. Journal of Insect Physiology. 62, 54-60 (2014).
- Chang, C. -. H., et al. The non-canonical Notch signaling is essential for the control of fertility in Aedes aegypti. PLOS Neglected Tropical Diseases. 12 (3), 0006307 (2018).
- Clemons, A., Flannery, E., Kast, K., Severson, D., Duman-Scheel, M. Immunohistochemical Analysis of Protein Expression during Aedes aegypti Development. Spring Harbor Protocols. 10, 1-4 (2010).
- Juhn, J., James, A. A. Hybridization in situ of Salivary Glands, Ovaries and Embryos of Vector Mosquitoes. Journal of Visualized Experiments. , e3709 (2012).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved