Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Использование системы GAL4-UAS для функциональной генетики в Anopheles gambiae
В этой статье
Резюме
Двусторонняя система GAL4-UAS является универсальным инструментом для модификации экспрессии генов контролируемым пространственно-временным способом, который позволяет проводить функциональный генетический анализ в Anopheles gambiae. Процедуры, описанные для использования этой системы, представляют собой полустандартизированную стратегию клонирования, сексинг и скрининг куколок на флуоресцентные белковые маркеры и фиксацию эмбрионов.
Аннотация
Двусторонняя система GAL4-UAS является универсальным и мощным инструментом для функционального генетического анализа. Суть системы заключается в пересечении трансгенных «драйверных» линий, которые экспрессируют фактор транскрипции дрожжей GAL4 тканевым специфическим образом, с трансгенными линиями «ответчика», несущими интерференционную конструкцию гена / РНК, экспрессия которой контролируется восходящими последовательностями активации (UAS), которые связывают GAL4. Таким образом, в последующем потомстве ген или глушительная конструкция экспрессируется предписанным пространственно-временным способом, что позволяет анализировать результирующие фенотипы и выводить функцию гена. Бинарная система обеспечивает гибкость в экспериментальных подходах к скринингу фенотипов, генерируемых экспрессией трансгенов в нескольких тканеспецифических паттернах, даже если вызваны серьезные затраты на приспособленность. Мы адаптировали эту систему для Anopheles gambiae, основного переносчика малярии в Африке.
В этой статье мы приводим некоторые из распространенных процедур, используемых при анализе GAL4-UAS. Мы описываем уже сгенерированные линии An. gambiae GAL4-UAS, а также клонирование новых конструкций ответчиков для повышения регуляции и нокдауна RNAi. Мы указываем пошаговое руководство по половому использованию кукол комаров для установления генетических скрещиваний, которое также включает скрининг потомства для отслеживания наследования флуоресцентных генных маркеров, которые помечают вставки водителя и ответчика. Мы также представляем протокол очистки эмбрионов An. gambiae для изучения эмбрионального развития. Наконец, мы вводим потенциальные адаптации метода для генерации линий драйверов посредством вставки CRISPR/Cas9 GAL4 после генов-мишеней.
Введение
Двусторонняя система GAL4-UAS является рабочей лошадкой функциональной характеристики генов в модельном организме насекомых Drosophila melanogaster1,2,3. Для использования системы GAL4-UAS трансгенные линии драйвера, экспрессирующие фактор транскрипции дрожжей GAL4 под контролем регуляторной последовательности, пересекаются с ответными линиями, несущими интересующий ген или конструкцию РНК-интерференции (RNAi), контролируемую последовательностью активации (UAS), распознаваемой GAL4. Потомство этого креста выражает трансген интереса к пространственно-временному паттерну, продиктованному промотором, контролирующим экспрессию GAL4 (рисунок 1). Фенотипы, отображаемые потомством кроссов драйвер-ответчик, могут быть оценены для выяснения функции генов-кандидатов. Хотя D. melanogaster был использован для изучения генов других организмов4,5,6,7, система GAL4-UAS в настоящее время адаптирована для использования у насекомых медицинского и сельскохозяйственного значения для обеспечения прямого анализа на интересующих видах 8,9,10,11,12,13,14.
У африканского малярийного комара Anopheles gambiae система GAL4-UAS была впервые протестирована путем котрансфекции клеточной линии9. Несколько конструкций были проанализированы на эффективность в различных попарных комбинациях и обнаружили, что 14 тандемно повторяющихся БАС, дополненных небольшим искусственным интроном (UAS-14i), отображали самый широкий диапазон потенциала активации при использовании с панелью драйверов GAL4. Чтобы продемонстрировать функциональность in vivo, эти конструкции затем были использованы для создания двух отдельных трансгенных линий An. gambiae с помощью преобразования PiggyBac8: линии драйвера, несущей GAL4, управляемой специфическим промотором средней кишки, и линии ответчика, содержащей гены люциферазы и усиленного желтого флуоресцентного белка (eYFP) при регуляции последовательностей UAS. Специфическая активность люциферазы кишечника и флуоресценция в потомстве указывали на то, что система была эффективна у Anopheles. С тех пор были созданы драйверные линии, экспрессирующие трансгены в других тканях, важных для векторной емкости и устойчивости к инсектицидам, включая эноциты15 и гемоциты16, и в близкой к повсеместной схеме10. Также были созданы многочисленные линии БАС для анализа генов, которые, как считается, участвуют в метаболизме и секвестрации, опосредованной инсектицидной резистентности, синтезе кутикулярных углеводородов и флуоресцентной маркировке различных типов клеток и тканей (таблица 1). Для линий ответчика интеграция трансгена, направленная на сайт, теперь выполняется катализируемым рекомбинационным кассетным обменом ΦC31111,18 для фиксации геномного контекста генов, регулируемых БАС. Таким образом, экспрессия трансгенов нормализуется в отношении места геномной вставки, что позволяет более точно сравнивать фенотипические эффекты различных генов-кандидатов.
Линии ответчиков, созданные на сегодняшний день, предназначены либо для экспрессии трансгена либо на повышенных уровнях, либо для снижения экспрессии генов посредством РНК-интерференции (РНКи). Обычно клоны кДНК сплавляются с последовательностью БАС для генерации подходящих экспрессионных плазмид, однако полные геномные последовательности также возможны, если предположить, что они не слишком велики для клонирования. Для создания конструкций глушения мы использовали три различных метода для получения подходящих тандемных перевернутых последовательностей, которые образуют шпильку дцРНК, стимулирующую РНК. К ним относятся ПЦР слияния, асимметричная ПЦР и коммерческий синтез конструкций шпильки. Общим для каждого метода является включение интронной последовательности между инвертированными последовательностями для обеспечения стабильности клонирования. Были разработаны плазмиды ответчиков, в которые может быть вставлен интересующий ген/конструкция РНКI15. Эти плазмиды также несут необходимые участки ΦC31 attB для RMCE (описаны в статье Адольфи, сопровождающей JoVE, в которой подробно описывается метод RCME). Протоколы, охватывающие важные этапы, необходимые при выборе последовательности для вставки в одну из этих плазмид для сверхэкспрессии, включены в эту рукопись. Кроме того, описаны и проиллюстрированы два протокола для создания конструкции шпильки RNAi.
При создании новых линий идентификация редких трансгенных особей имеет решающее значение для размножения для создания и поддержания трансгенных колоний. Наиболее важным для системы GAL4-UAS является необходимость различать линии ответчика и водителя для установления пересечений и идентификации отдельных потомков, которые несут оба трансгена. Это достигается за счет использования различных доминантных выбираемых маркерных генов, связанных с кассетами драйвера и ответчика. Чаще всего это гены флуоресцентных маркеров, которые четко различимы с помощью оптических фильтров (например, eYFP, eCFP, dsRed). Важно, чтобы маркеры выражались в известной и надежной пространственно-временной картине, поскольку это облегчает идентификацию аномалий и загрязнения. Экспрессия гена флуоресцентного маркера обычно регулируется синтетическим промотором 3xP3, который вызывает специфическую экспрессию глазных и вентральных ганглиев на всех стадиях развития An. gambiae19. Флуоресцентные маркеры, контролируемые 3xP3, включены во все трансформационные плазмиды, описанные в этой статье. Здесь приведен протокол, подробно описывающий общие методы, используемые для скрининга флуоресцентных линий An. gambiae pupae GAL4-UAS.
Одним из ключевых элементов системы GAL4-UAS является необходимость пересечения дифференциально маркированных линий водителя и ответчика. Для этого самец и самки от каждой линии должны быть отделены перед спариванием. Взрослые особи легко различимы по зрению, однако для установления генетических скрещиваний разумно разделить полы до появления взрослых особей, чтобы гарантировать, что спаривание не произошло. Общая разница в размерах между самцами и самками куколок An. gambiae слишком изменчива, чтобы быть эффективным и надежным методом определения пола20. Вместо этого четкие морфологические различия в наружных гениталиях обеспечивают надежную основу для сексинга у An. gambiae. В этой статье мы опишем надежный метод сексинга Куколок An. gambiae для установки соответствующих крестов.
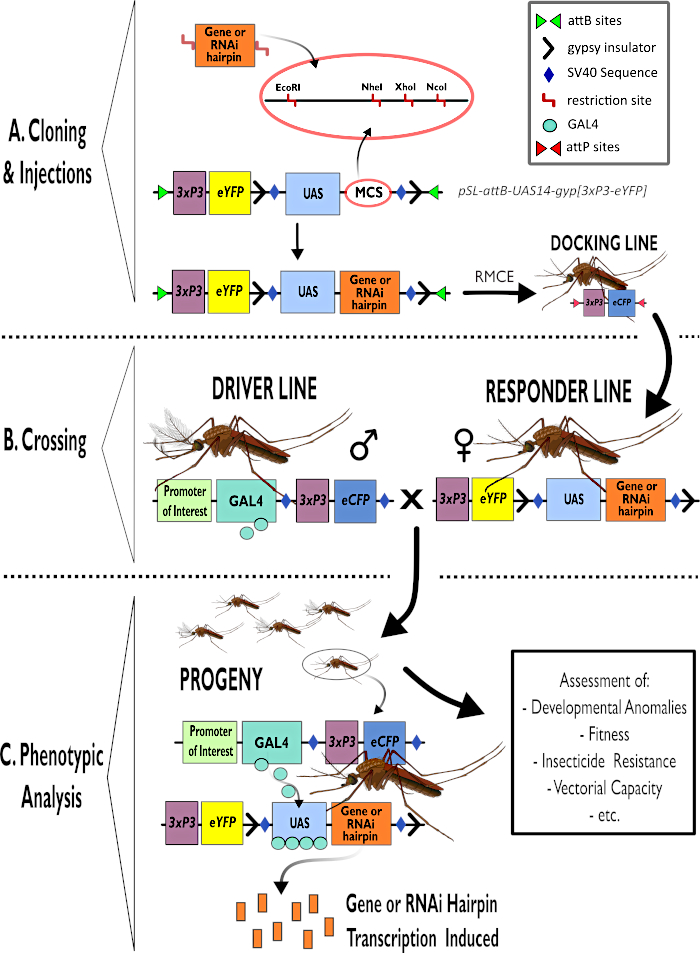
Рисунок 1 - Диаграммное представление процесса использования двусторонней системы GAL4-UAS в Anopheles gambiae. (A) Показаны основные компоненты примера вектора (pSL-attB-UAS14-gyp[3xp3-eYFP]), детализирующие имеющиеся участки ограничения (EcoRI, NheI, XhoI и NcoI) в нескольких участках клонирования, которые пригодны для использования для вставки конструкции шпильки или кодирующей последовательности для интересующего гена. Также изображено строение стыковочной линии. (B) Этап пересечения проиллюстрирован с указанием использования самцов из линии водителя (перевозка драйвера GAL4 заинтересованным промоутером и eCFP, управляемым промоутером 3xP3) и самок из линии ответчика (несущих ген интереса или шпильку, контролируемую промотором БАС и маркером eYFP, контролируемым промоутером 3xP3). (C) Диаграммное представление GAL4, стимулирующее экспрессию гена, представляющего интерес в потомстве креста в B, и список некоторых типичных фенотипов, которые оцениваются. Сокращения: Множественный клонирующий сайт (MCS), опосредованный рекомбиназой кассетный обмен (RMCE), Последовательность активаторов восходящего потока (UAS), улучшенный желтый флуоресцентный белок (eYFP), улучшенный голубой флуоресцентный белок (eCFP). Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Именно использование крестов обеспечивает двусторонний характер системы GAL4-UAS, которая имеет явные преимущества перед более линейными подходами. Например, можно оценить гораздо больше комбинаций линий драйвера и ответчика, чем было бы возможно, если бы для каждой комбинации промотор/ген была создана и поддерживалась новая трансгенная линия. Что еще более важно, он позволяет анализировать гены, которые производят смертельные или стерильные фенотипы, когда их экспрессия нарушена, которые трудно создать / поддерживать в линейной системе. Такие летальные фенотипы могут проявляться на всех стадиях развития, в зависимости от функции гена и пространственно-временной экспрессии, но чаще всего наблюдаются во время эмбрионального развития. Визуализация развития эмбриона комара требует очистки непрозрачного хориона, который покрывает яйца. Следуя методам, описанным в Trpiš (1970)21 и Kaiser et al. (2014)22, мы описываем протоколы, которые мы используем для фиксации эмбрионов, сохраняя при этом структурную целостность и отбеливание для очистки эндохориона, что позволяет микроскопическую визуализацию и визуализацию.
протокол
1. Проектирование и строительство конструкций БАС
- Проектирование и сборка векторов экспрессии генов-кандидатов
- Определите последовательность, которая будет использоваться для повышения регуляции генов-кандидатов.
- Секвенировать кДНК/гДНК с интересующим штаммом и сравнить его с опубликованной последовательностью для проверки его идентичности и выявления потенциальных SNP и рестрикционных сайтов для диагностического дайджеста.
- Убедитесь, что прямой праймер, используемый для амплификации генов, покрывает нативную последовательность Козака и запускает кодон, где это необходимо. Праймер со связыванием ~10 bp перед стартовым кодоном будет охватывать последовательность Козака.
- Включите стоп-кодон в фрагмент, усиленный от обратного праймера в большинстве случаев. Используйте 3' конечные последовательности, представленные в описанных плазмидных векторах, или амплируйте из геномных последовательностей генов-кандидатов.
- При желании заказывайте коммерческие последовательности с определенным уклоном кодонов.
- Используйте стандартные процедуры субклонирования для вставки кассет генов в плазмидные векторы UAS, например, pSL-attB-UAS14-gyp[3xP3-eYFP]15 (Рисунок 1) как для конструкций upregulation, так и для RNAi..
- Производят трансгенных комаров, созданных с использованием рекомбинации ΦC31, опосредованной кассетного обмена10,17,18,23.
- Определите последовательность, которая будет использоваться для повышения регуляции генов-кандидатов.
- Создание конструкций шпильки РНКи: одноступенчатая амплификация с использованием асимметричной ПЦР15,24
- Извлеките геномную ДНК (гДНК) из взрослой самки An. gambiae, несущей желаемый ген-кандидат, используя метод Ливака25.
- Спроектируйте прямую грунтовку для привязки к целевому экзону на 5' нужного фрагмента, направленного в сторону соседнего интрона. Спроектируйте 3'-дюймовый конец мостовой грунтовки для привязки к концу предыдущего экзона для усиления интрона. Конец 5' дополняет небольшой фрагмент целевого экзона сразу после интрона.
- Запустите асимметричную реакцию ПЦР, как описано в Xiao (2006)24 (Рисунок 2).
- Клонируйте очищенный продукт ПЦР в подходящий вектор, несущий промотор БАС (например, pSL-attB-UAS14-gyp[3xP3-eYFP]15).
ПРИМЕЧАНИЕ: Ферменты в множественном месте клонирования, которые подходят для клонирования pSL-attB-UAS14-gyp[3xP3-eYFP]15 и следующие необходимые шаги, указаны на рисунке 1. Один фермент переваривает необходим, так как добавляется только один сайт рестрикции. Дефосфорилирование плазмиды повысит эффективность клонирования.
- Извлеките геномную ДНК (гДНК) из взрослой самки An. gambiae, несущей желаемый ген-кандидат, используя метод Ливака25.
- Построение конструкций шпильки РНКи: Слияние ПЦР кДНК и гДНК15
- Извлеките геномную ДНК (гДНК) из взрослой самки An. gambiae, несущей желаемый ген-кандидат, используя метод Ливака25.
- Включите гДНК в реакцию ПЦР для амплификации целевой области последовательностей экзона и интрона вместе (рисунок 2).
- Спроектируйте 3-футовый конец переднего грунтовки для привязки к обратной последовательности экзонов цели для усиления к целевой последовательности интронов и 5-футовый конец для переноса ограничительного участка для облегчения клонирования.
- Конструкция обратного грунтовки (1) для привязки к 5' концу интрона и 5' торцевому свесу несет первые основания прямой последовательности соседнего экзона. Этот свес используется при слиянии ПЦР.
- Очистите желаемый продукт реакции.
- Извлеките РНК, удалите ДНК с помощью ДНКазы и подготовьте кДНК от взрослой самки An. gambiae, несущей желаемый ген-кандидат в соответствии с протоколами производителя.
- Используйте кДНК в реакции ПЦР для амплификации целевой области только экзона (рисунок 2).
- Сконструируйте прямую грунтовку (2) таким образом, чтобы 3'-дюймовый конец связывался на 3'-конце дополнительной целевой последовательности экзонов, а 5-футовый конец грунтовки имел ограничительный участок для использования в клонировании.
ПРИМЕЧАНИЕ: Прямая грунтовка из раздела 1.3.1.2 может быть вновь использована в этой второй реакции. Тем не менее, это будет означать, что один фермент переваривает необходим. Использование второй прямой грунтовки с другим участком ограничения позволит удвоить дайджест, что может повысить эффективность клонирования. - Конструкция обратной грунтовки (2) - 3' конец связывается с 5' концом соседнего экзона, усиливая целевой экзон. 5' конец связывается с 3' концом передней нити интронов. Этот свес используется при слиянии ПЦР.
- Очистите желаемый продукт реакции.
- Сконструируйте прямую грунтовку (2) таким образом, чтобы 3'-дюймовый конец связывался на 3'-конце дополнительной целевой последовательности экзонов, а 5-футовый конец грунтовки имел ограничительный участок для использования в клонировании.
- Включить продукты стадии 1.3.1 и 1.3.2 в качестве шаблонов для реакции термоядерной ПЦР с использованием стандартных концентраций с прямыми праймерами 1 и 2. Очистите желаемый продукт.
- Переварите очищенный продукт, чтобы создать свесы для клонирования. Клонирование в подходящий вектор вниз по течению от промоутера БАС. Соответствующие ферменты для клонирования pSL-attB-UAS14-gyp[3xP3-eYFP]15 и следующие необходимые шаги указаны на рисунке 1.
- Извлеките геномную ДНК (гДНК) из взрослой самки An. gambiae, несущей желаемый ген-кандидат, используя метод Ливака25.
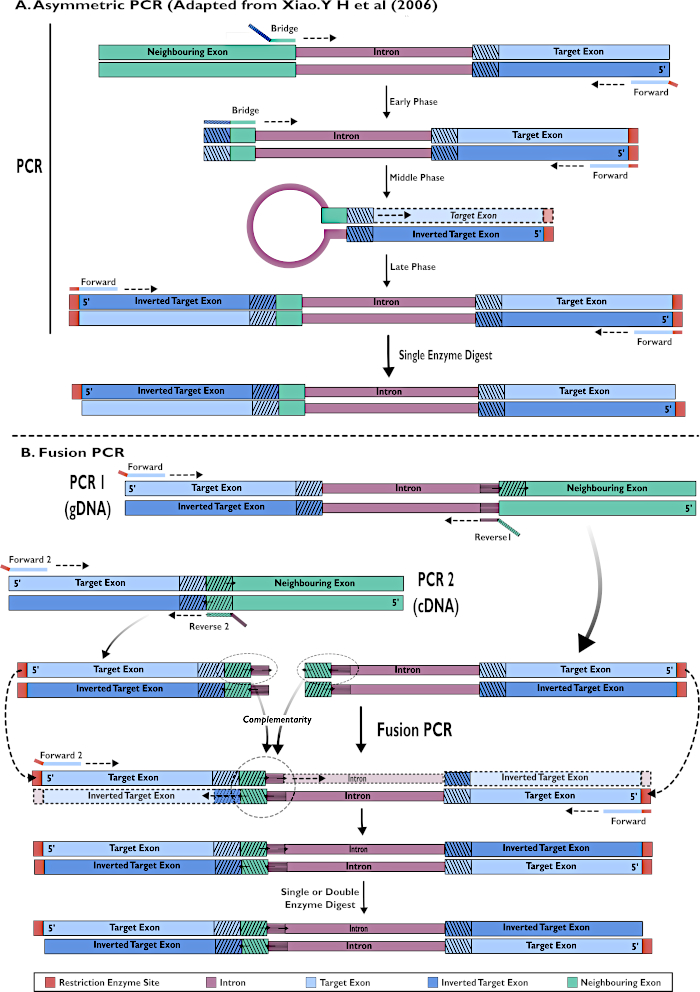
Рисунок 2 - Диаграммное представление создания РНКи-конструкций для вставки в pSL-attB-UAS14-gyp[3xP3-eYFP] двумя методами: (A) Одноступенчатая асимметричная ПЦР (адаптирована из Xiao. Y H et al (2006) и (B) ПЦР с многоступенчатым слиянием. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
2. Скрининг куколок An. gambiae
- Сбор куколок для микроскопической характеристики
ПРИМЕЧАНИЕ: Во всех этих протоколах вода относится к дистиллированной воде, дополненной 0,01% поваренной соли.- Задние комары An. gambiae с использованием стандартных протоколов (например, MR426) до стадии куколки.
ВНИМАНИЕ: Позаботьтесь о том, чтобы не травмировать куколок на протяжении всего этого процесса. - Соберите куколки на прозрачную плоскую тарелку, подходящую для использования со стереомикроскопом (например, пластиковую чашку Петри размером 100 х 15 мм, избегая краев).
ПРИМЕЧАНИЕ: Для сбора куколок мы используем пластиковую пипетку Пастера объемом 3 мл с вырезанным концом около 10 мм, чтобы расширить конец и предотвратить травмирование комаров. Скрининг и сексинг могут быть завершены на людях, однако, это очень медленно. Рекомендуется проводить скрининг и сексинг на группах по 50-200 куколок (размер группы возможен размером используемого блюда и зависит от личных предпочтений). Если проверяется большое количество, эффективность может быть увеличена путем сначала выравнивания куколок на глубине от 4 до 5 в линиях и перемещения целевых куколок из этой линии. - Используя пипетку Пастера, осторожно удалите почти всю воду вокруг куколок. Оставьте достаточно воды вокруг куколок, чтобы они были фактически бессодержательными, но их можно было легко перемещать тонкой щеткой. Если им становится трудно двигаться, то добавьте больше воды.
ПРИМЕЧАНИЕ: Когда удаляется достаточное количество воды, куколки будут лежать на боку, что позволяет визуализировать глаза для обнаружения флуоресценции и идентификации диморфных гениталий (рисунок 4DE).
ВНИМАНИЕ: Убедитесь, что куколки не высыхают. Если оставить только очень небольшой объем воды, она может еще больше уменьшиться с теплом от лампы микроскопа и при разделении между бассейнами куколок. Дополнительная вода иногда должна быть добавлена во время процесса с использованием пипетки Пастера 3 мл в желаемую группу (группы).
- Задние комары An. gambiae с использованием стандартных протоколов (например, MR426) до стадии куколки.
- Идентификация флуоресцентных маркеров в куколках
ПРИМЕЧАНИЕ: Использование стереоскопа с низким увеличением позволяет проводить широкоугольный скрининг, сортировка может быть выполнена на перевернутом составном микроскопе, но должна выполняться индивидуально.- При скрининге флуоресцентного маркера в первую очередь важно знать ожидаемые закономерности экспрессии и наследования. Обратите внимание на следующее:
- Цвет(ы): определите, какие фильтры визуализировать выражение.
- Пространственно-временная экспрессия: поймите, где и на каком жизненном этапе вы ожидаете увидеть выражение.
- Соотношение разных фенотипов: установите, какой процент населения должен нести маркеры интереса.
- Проводят флуоресцентный скрининг в темноте, так как даже низкий свет может помешать разрешению флуоресценции. Тем не менее, используйте лампу рядом со стереоскопом, когда свет требуется для других манипуляций.
ВНИМАНИЕ: Перед выключением света убедитесь, что рабочее пространство вокруг флуоресцентного стереоскопа четкое. - Включите люминесцентную лампу и оставьте согреваться в течение рекомендованного производителем периода (обычно 10-15 мин). Выберите необходимый фильтр на флуоресцентном стереоскопе и убедитесь, что виден цветной луч света, направленный в центр сценической пластины. Если это не видно или очень слабо, люминесцентная лампа, возможно, не полностью нагрелась, затвор закрыт или оптика микроскопа плохо выровнена.
- Используя белый свет, центрируйте куколки в поле зрения и выводите их в фокус. Это увеличение может потребоваться изменить при переключении между различными фильтрами в зависимости от интенсивности флуоресценции.
- Использование кисти для мелкой детализации гарантирует, что исследуемые куколки не перекрываются.
- Выключите белый свет стереоскопа и используйте тонкий фокус, чтобы сфокусировать область куколок, несущих интересующий фенотип. Флуоресцентный рисунок должен быть виден. Примеры флуоресценции 3xP3, контролируемой промотором, приведены на рисунке 3.
- Используйте наименьшее увеличение, при котором ожидаемый флуоресцентный фенотип можно надежно отличить от особей без флуоресцена.
- Для штаммов с яркой флуоресценцией используйте свет низкой интенсивности brightfield, а также при скрининге, если флуоресцентный сигнал все еще четко идентифицируется.
- После завершения первичного скрининга быстро сканируйте популяции под другими фильтрами для обнаружения потенциального загрязнения.
ВНИМАНИЕ: Убедитесь, что между группами отсортированных куколок существует четкое расстояние, чтобы предотвратить загрязнение движением куколок. Имейте в виду, что размер групп будет меняться по мере того, как куколки будут половыми, и что расстояния могут казаться больше при взгляде под увеличением. Будьте особенно осторожны, когда бассейны не находятся в поле зрения.
- При скрининге флуоресцентного маркера в первую очередь важно знать ожидаемые закономерности экспрессии и наследования. Обратите внимание на следующее:
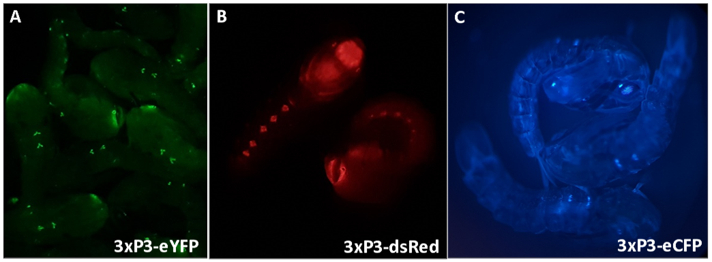
Рисунок 3 - Куколки Anopheles gambiae, экспрессирующие флуоресцентные маркеры, приводимые в действие промотором 3xP3 (A) eYFP, (B) dsRed и (C) eCFP. Увеличение: A=16X, B,C=20X.
-
Сексинг Куколки
- Собирайте куколок. Удалите избыток воды, но обеспечьте достаточное количество, чтобы анальные весла слегка отделились от гениталий, чтобы помочь визуализации и морфологической характеристике (рисунок 4D, E).
- Если какая-либо куколка / е не на боку, используйте кисть с мелкими деталями, чтобы аккуратно повернуть куколку и переместить анальные весла, чтобы можно было идентифицировать внешние гениталии.
- Отдельные куколки на основе отличительных наружных половых органов; самцы имеют длинную трубку, которая выдавливается из конечного дорсального сегмента примерно половины длины анальных весл (рисунок 4B). Наружные половые органы куколок самок значительно короче и раздвоены (рисунок 4А).
ПРИМЕЧАНИЕ: В некоторых случаях, если экзоскелет 4-й звездной личинки остается прикрепленным или наружные гениталии повреждены (рисунок 4C), уверенная идентификация пола затруднена. Когда пол куколки не ясен, лучше всего отказаться от него. Если особь должна быть сохранена, куколке должно быть позволено появиться изолированно, а ее пол определен с использованием взрослых морфологических признаков. Вполне вероятно, что если его гениталии повреждены, человек может не спариваться успешно. - Сделайте бассейн для каждого пола на противоположном конце блюда к несексуальному бассейну, перемещая идентифицированных куколок по блюду с помощью кисти с мелкими деталями. Пометьте нижнюю сторону блюда, где будут собраны два бассейна, чтобы идентифицировать их позже.
- Когда требуется как сексинг, так и флуоресцентный скрининг, сначала выполните флуоресцентный скрининг, так как это более быстрый процесс.
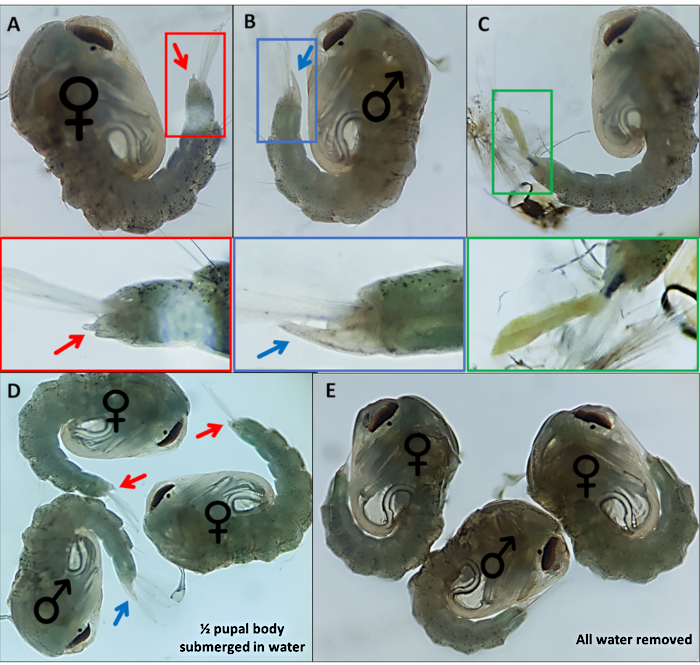
Рисунок 4 - Sexing Anopheles gambiae pupae. Отдельные куколки, указывающие на наружные гениталии (А) самки, (В) самца и (В) особи, которые не могут быть легко идентифицированы из-за неполной отслойки личиночного экзоскелета. Увеличенные изображения ниже, выделяющие наружные половые органы. Куколки с ♀ (женскими) и ♂ (мужскими) с указанием наружных гениталий куколок с (D) ~ 50% куколки погружены в воду и с (E) вся вода удалена, подчеркивая разницу в легкости визуализации наружных гениталий. Увеличение: A,B,C=40x, D,E=30x. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
- Подтверждение пола во взрослом возрасте
- До тех пор, пока не будет продемонстрирована очень низкая частота ошибок, подтвердите пол куколок по морфологии взрослых особей после появления. Разделите половых куколок на группы по 10 и менее в прозрачной трубке объемом 20 мл с несколькими мл воды, запечатав шариком ваты, помеченным ожидаемым полом и дайте выйти на ночь.
ПРИМЕЧАНИЕ: Поскольку взрослые переносятся на следующее утро, нет необходимости снабжать новых взрослых пищей. - Подтвердите пол появившихся взрослых особей с помощью морфологических признаков на следующий день.
- Если в женских коллекциях присутствуют самцы, отбросьте самок, в случае, если спаривание уже произошло.
- Если в мужской коллекции присутствуют самки, удалите самок и сохраните самцов для скрещивания.
- До тех пор, пока не будет продемонстрирована очень низкая частота ошибок, подтвердите пол куколок по морфологии взрослых особей после появления. Разделите половых куколок на группы по 10 и менее в прозрачной трубке объемом 20 мл с несколькими мл воды, запечатав шариком ваты, помеченным ожидаемым полом и дайте выйти на ночь.
- Настройка кроссов системы GAL4-UAS
- Аспирируйте желаемое количество взрослых самцов и самок из трубок на этапе 2.4 в клетку или небольшое ведро, установленное стандартным образом для выращивания An. gambiae.
ПРИМЕЧАНИЕ: Позаботьтесь о том, чтобы не повредить взрослых во время этой передачи. - Используйте примерно 50 самок с равным количеством самцов, когда от потомства требуется ~ 2000 взрослых особей.
ПРИМЕЧАНИЕ: Если крест должен подаваться несколько раз для создания нескольких партий до 200 каждого пола, может быть установлен в клетках размером 30 см х 30 см х 30 см. Когда для скрещивания доступно только небольшое количество самок (<20), мы добавляем ~ 4x количество самцов, чтобы увеличить вероятность успешного спаривания. - Кровь питает скрещенных самок и заднее потомство до соответствующей стадии, следуя стандартным протоколам26, для проведения фенотипической оценки (например, резистентность к инсектицидам, векторная способность и анализы затрат на пригодность).
- Там, где материнский эффект экспрессии трансгенов вероятен, устанавливают взаимные пересечения линий водителя и ответчика и анализируют ожидаемый фенотип.
ПРИМЕЧАНИЕ: Скрещивания, использующие «гетерозиготные» или смешанные популяции линий водителя и ответчика, производят потомство с каждым из 4 возможных генотипов. Это обеспечивает дикий тип, только UAS и только GAL4 контроль, а также трансгетерозиготы GAL4-UAS, с помощью которых можно анализировать фенотип. Если гомозиготные популяции скрещиваются, установите дополнительные скрещивания, чтобы обеспечить соответствующий контроль для сравнения фенотипов. Потомство должно быть просеяно, как указано выше, разделяя потомство, несущее оба или только один маркер, а также отрицательные, для фенотипической оценки.
- Аспирируйте желаемое количество взрослых самцов и самок из трубок на этапе 2.4 в клетку или небольшое ведро, установленное стандартным образом для выращивания An. gambiae.
- Создание гомозиготных популяций из линий, генерируемых с помощью RCME, несущих альтернативные флуоресцентные маркеры
ПРИМЕЧАНИЕ: Важно, чтобы флуоресцентный маркер обеих линий присутствовал в одном и том же геномном месте, и они полностью различимы.- Установите родительский крест из примерно 200 взрослых с равным количеством дифференциально отмеченных самцов одной линии и самок другой линии после скрининга для отбора лиц, демонстрирующих правильную флуоресценцию и пол, как описано выше. Примерно через неделю кровь питает крест, используя установленные протоколы26.
- Вырастите потомство F1 до куколок, используя стандартные протоколы, и собирайте куколок, как описано ранее.
- Экран для флуоресценции отбирают те, которые несут оба родительских маркера (трансгетерозиготные). Настройте интеркросс Формулы-1 с этими куколками.
- Через неделю кровь кормит самок Формулы-1 и заднее потомство до стадии куколки в соответствии со стандартными протоколами.
- Экран куколок F2 выбирает те, которые отображают ТОЛЬКО один из маркеров. Они будут гомозиготными для введения. Только 25% потомства будет гомозиготным для каждой вставки, поэтому убедитесь, что выращено достаточно потомства, чтобы обеспечить клетку (400-500).
ПРИМЕЧАНИЕ: Отбор трансгетерозиготного потомства должен быть полностью строгим, иначе процесс загрязняется, и полная гомозиготность не может быть достигнута. Дважды проверьте все потомство, выбранное для интеркросса Формулы-1.
- Установите родительский крест из примерно 200 взрослых с равным количеством дифференциально отмеченных самцов одной линии и самок другой линии после скрининга для отбора лиц, демонстрирующих правильную флуоресценцию и пол, как описано выше. Примерно через неделю кровь питает крест, используя установленные протоколы26.
3. Протокол удаления эмбрионов An. gambiae
-
Кормление и содержание крови
- Вывоз комаров An. gambiae взрослым в соответствии со стандартными протоколами (например, MR4).
- Кровью кормят 5-7 дневных взрослых самок, гарантируя, что большинство из них полностью набухают.
ВНИМАНИЕ: На протяжении всего этого протокола важна быстрая работа для обеспечения того, чтобы яйца не высыхали.
-
Индуцированная яйцекладка
- Через 3 дня после кровоснабжения собирают яйца путем индуцированной откладки.
- Соберите камеру яйцекладки.
- Наполните яйцекладку водой на глубину примерно 5 мм. Прикрепите горшок к одному концу полипропиленовой трубки объемом 50 мл, предварительно разрезанной ножовкой так, чтобы оба конца были открыты. (Мы используем пластиковый диск для горшка (рисунок 5); однако вместо него можно использовать оригинальную крышку трубки).
- Накройте другой конец разрезанной полипропиленовой трубки материалом (шланг / колготки) или секциями латексной перчатки, закрепленной эластичной лентой, чтобы взрослые могли быть введены, но не могли убежать (рисунок 5). Существуют и другие альтернативные конструкции камер яйцекладки, которые могут быть использованы26.
- Осторожно вводят в камеру яйцекладки 10-15 самок (кормят кровью на этапе 3.1.2). Накройте камеру яйцекладки до темноты и оставьте на 20 минут.
ВНИМАНИЕ: Избегайте перемещения горшка с яйцекладкой после того, как яйца были отложены, чтобы предотвратить выбрасывание и высыхание яиц. - Осторожно отсоедините полипропиленовую трубку объемом 50 мл от горшка для яйцекладки, следя за тем, чтобы комары не выпускались. Белые яйца должны быть видны. Проверьте, что для запрещенных целей было заложено достаточное количество. При необходимости повторите.
- Накройте кастрюлю (для защиты от пыли) и дайте яйцам созреть до интересующей стадии развития.
- Используйте кисть с мелкими деталями, чтобы поднять яйца из горшка и поместить их на воду в выкопанный стеклянный блок толщиной 40 мм2.

Рисунок 5 - Пример камеры яйцекладки (А), демонтированной для выделения компонентов и (В) собранной. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
-
Фиксация эмбрионов
ВНИМАНИЕ: Выполните все шаги фиксации (шаг 3.3) в вытяжном шкафу из-за использования формальдегида.- Приготовьте раствор FAA, как описано в Kaiser et al. (2014)22. FAA содержит 3,6 М формальдегида, 0,87 М уксусной кислоты и 8,5 М абсолютного этанола, полученного в объеме дистиллированной водой (dH2O).
- На 10 мл FAA смешивают 2,68 мл 13,42 М формальдегида, 4,96 мл 17,14 М этанола и 0,5 мл 17,4 мл уксусной кислоты с 1,86 мл дистиллированного H2O. Фиксатор можно хранить не менее 3 месяцев в плотно закрытой стеклянной таре, хранящейся в специально отведенном химическом шкафу.
- Осторожно извлеките воду из стеклянного блока с помощью микропипетки и накройте яйца 500 мкл FAA и осторожно осциллируйте (~ 25 оборотов в минуту) на орбитальном шейкере при комнатной температуре в течение 30 минут. На этом этапе изменение цвета не видно.
- Тщательно промойте яйца дистиллированной водой. Выполните промывку 15 раз, чтобы удалить все следы формальдегида. Используя микропипетку 1000 мкл, добавьте, а затем удалите 1 мл dH2O за один раз, чтобы не повредить яйца при этом.
- Храните сточные воды из ополаскивателей в специально отведенном контейнере для удаления формальдегида для утилизации в соответствии с руководящими принципами безопасности.
- В этот момент фиксированные яйца можно хранить при 4 °C в течение ночи в воде, чтобы сохранить их гидратированными.
- Приготовьте раствор FAA, как описано в Kaiser et al. (2014)22. FAA содержит 3,6 М формальдегида, 0,87 М уксусной кислоты и 8,5 М абсолютного этанола, полученного в объеме дистиллированной водой (dH2O).
-
Отбеливание эмбрионов
ВНИМАНИЕ: Выполните все этапы отбеливания (этап 4) в вытяжном шкафу из-за потенциального высвобождения газообразного хлора при объединении гипохлорита натрия и уксусной кислоты.- Готовят отбеливающий раствор (раствор Trpiš - описан в Trpiš (1970)21 и модифицирован в соответствии с Kaiser et al. (2014)22). Раствор Trpiš представляет собой 0,59 М гипохлорита натрия и 0,35 М уксусной кислоты, растворенной в дистиллированном H2O.
- Для 10 мл оволума раствора Trpiš смешайте 2,68 мл гипохлорита натрия 2,2 М и 0,2 мл уксусной кислоты 17,4 мл с 7,12 мл дистиллированного H2O.
ПРИМЕЧАНИЕ: Раствор Trpiš можно хранить не менее 3 месяцев в плотно закрытой стеклянной таре и хранить в надежном химическом шкафу. Раствор, возможно, потребуется вихрь после хранения и всегда должен быть открыт в вытяжном шкафу в случае выделения газообразного хлора.
- Для 10 мл оволума раствора Trpiš смешайте 2,68 мл гипохлорита натрия 2,2 М и 0,2 мл уксусной кислоты 17,4 мл с 7,12 мл дистиллированного H2O.
- Залейте неподвижные яйца 1 мл раствора Trpiš и инкубируйте при комнатной температуре в течение 30 минут. Яйца начнут развивать бледные пятна примерно через 5 минут инкубации, в конечном итоге достигнув молочно-белого цвета после очистки.
- Смойте яйца, как на шаге 3.3.3, чтобы удалить раствор Trpiš.
- Храните сточные воды в специально отведенном контейнере для отходов и утилизируйте с избытком воды в канализацию.
- Готовят отбеливающий раствор (раствор Trpiš - описан в Trpiš (1970)21 и модифицирован в соответствии с Kaiser et al. (2014)22). Раствор Trpiš представляет собой 0,59 М гипохлорита натрия и 0,35 М уксусной кислоты, растворенной в дистиллированном H2O.
-
Хранение
- Хранить в 500 мкл dH2O и хранить при температуре 2-8 °C в течение нескольких дней. Удалите большую часть воды осторожно перед просмотром и визуализацией по массе, но избегайте высыхания яиц, оставляя небольшой объем воды в стекле часов. Это не помешает фотографировать яйца. Отдельные яйца могут быть помещены на предметное стекло микроскопа для визуализации с более высоким увеличением.
Результаты
Экспрессия 3xP3 eYFP, dsRed и eCFP обеспечивает надежную, легко различимую идентификацию лиц, обладающих маркерными генами, продуцирующими экспрессию в глазах и вентральных ганглиях куколок An. gambiae (рисунок 3). Дифференциальная морфология, наблюдаемая у мужских и женск?...
Обсуждение
Понимание функции генов комаров имеет жизненно важное значение для разработки новых подходов к борьбе с Anopheles и воздействию на передачу малярии. Описанная система GAL4-UAS является универсальной и мощной системой для функционального анализа генов-кандидатов, и на сегодняшний день мы...
Раскрытие информации
Авторам нечего раскрывать.
Благодарности
Мы с благодарностью отмечаем финансирование со стороны LSTM и IVCC (Адриана Адольфи), BBSRC (New Investigator Award (AL), MRC (phD studentship to BCP:MR/P016197/1), Wellcome (sir Henry Wellcome Postdoctoral fellowship to LG: 215894/Z/Z/19/Z), которые включили анализ Gal4UAS в предложения.
Материалы
| Name | Company | Catalog Number | Comments |
| 100 x 15 mm plastic Petri dish | SLS | 2175546 | Pack of 10 |
| 1000 µL Gilson Pipette | Gilson | F144059P | |
| 20/25 mL Universal Tubes | Starlab | E1412-3020 | Pack of 400 |
| 3 mL Pasteur Pipettes | SLS | G612398 | Greiner Pasteur pipette 3 mL sterile individually wrapped |
| 50 mL Falcon Tubes | Fisher Scientific | 11512303 | |
| Absolute Ethanol | Fisher Scientific | BP2818-500 | 500 mL |
| Acetic Acid | SLS | 45726-1L-F | 1 L |
| Cages | SLS | E6099 | 30x30x30 with screen port |
| Fine Paint Brushes | Amazon | UKDPB66 | KOLAMOON 9 Pieces Detail Painting Brush Set Miniture Brushes for Watercolor, Acrylic Painting, Oil Painting (Wine Red) |
| Fish food | Amazon | Tetra Min Fish Food, Complete Food for All Tropical Fish for Health, Colour and Vitality, 10 L | |
| Formaldehyde Solution | Sigma Aldrich | F8775 | |
| Mouth Aspirator | John Hock | 612 | |
| Pond Salt | Amazon | Blagdon Guardian Pond Tonic Salt, for Fish Health, Water Quality, General Tonic, pH Buffer, 9.08 kg, treats 9,092 L | |
| Pupae Pots | Cater4you | SP8OZ | 250 pots with lids |
| Small Plastic Buckets | Amazon | 2.5 L White Plastic Pail Complete with White Lid (Pack of 10) | |
| Sodium Hypochlorite | Fisher Scientific | S25552 |
Ссылки
- Brand, A. H., Perimon, N. Targeted gene expression as a means of altering cell fates and generating dominant phenotypes. Development. 118 (2), 401-415 (1993).
- Duffy, J. B. GAL4 system in drosophila: A fly geneticist's swiss army knife. Journal of Genetics and Development. 34 (1-2), 1-15 (2002).
- Dow, J. A. . ELS. , (2012).
- Edi, C. V., et al. CYP6 P450 Enzymes and ACE-1 Duplication Produce Extreme and Multiple Insecticide Resistance in the Malaria Mosquito Anopheles gambiae. PLoS Genetics. 10 (3), 1004236 (2014).
- Daborn, P. J., et al. Using Drosophila melanogaster to validate metabolism-based insecticide resistance from insect pests. Insect Biochemistry and Molecular Biology. 42 (12), 918-924 (2012).
- Riveron, J. M., et al. Genome-wide transcription and functional analyses reveal heterogeneous molecular mechanisms driving pyrethroids resistance in the major malaria vector Anopheles funestus across Africa. Genes Genomes Genetics. 7 (6), 1819-1832 (2017).
- Riveron, J. M., et al. A single mutation in the GSTe2 gene allows tracking of metabolically based insecticide resistance in a major malaria vector. Genome Biology. 15 (2), (2014).
- Lynd, A., Lycett, G. J. Development of the Bi-Partite Gal4-UAS System in the African Malaria Mosquito, Anopheles gambiae. PLoS ONE. 7 (2), 31552 (2012).
- Lynd, A., Lycett, G. J. Optimization of the Gal4-UAS system in an Anopheles gambiae cell line. Insect Molecular Biology. 20 (5), 599-608 (2011).
- Adolfi, A., Pondeville, E., Lynd, A., Bourgouin, C., Lycett, G. J. Multi-tissue GAL4-mediated gene expression in all Anopheles gambiae life stages using an endogenous polyubiquitin promoter. Insect Biochemistry and Molecular Biology. 96, 1-9 (2018).
- Kokoza, V. A., Raikhel, A. A. Targeted gene expression in the transgenic Aedes aegypti using the binary Gal4-UAS system. Insect Biochemistry and Molecular Biology. 41, 637-644 (2011).
- O'Brochta, D. A., Pilitt, K. L., Harrell, R. A., Aluvihare, C., Alford, R. T. Gal4-based Enhancer-Trapping in the Malaria Mosquito Anopheles stephensi. Genes Genomes Genetics. 2, 21305-21315 (2012).
- Zhao, B., et al. Regulation of the Gut-Specific Carboxypeptidase: A Study Using the Binary Gal4/UAS System in the Mosquito Aedes Aegypti. Insect Biochemistry and Molecular Biology. 54, 1-10 (2014).
- Imamura, M., et al. Targeted Gene Expression Using the GAL4/UAS System in the Silkworm Bombyx mori. Genetics. 165 (3), 1329-1340 (2003).
- Lynd, A., et al. Development of a functional genetic tool for Anopheles gambiae oenocyte characterisation: application to cuticular hydrocarbon synthesis. bioRxiv. , (2019).
- Pondeville, E., et al. Hemocyte-targeted gene expression in the female malaria mosquito using the hemolectin promoter from Drosophila. Insect Biochemistry and Molecular Biology. 120, 103339 (2020).
- Adolfi, A., et al. Functional genetic validation of key genes conferring insecticide resistance in the major African malaria vector, Anopheles gambiae. Proceedings of the National Academy of Sciences of the United States of America. 116 (51), 25764-25772 (2019).
- Pondeville, E., et al. Efficient integrase-mediated site-specific germline transformation of Anopheles gambiae. Nature Protocols. 9 (7), 1698-1712 (2014).
- Horn, C., Schmid, B. G. M., Pogoda, F. S., Wimmer, E. A. Fluorescent transformation markers for insect transgenesis. Insect Biochemistry and Molecular Biology. 32, 1221-1235 (2002).
- Clements, A. . A. Biology of Mosquitoes, Volume 1: Development, Nutrition and Reproduction. 1, (1992).
- Trpiš, M. A new bleaching and decalcifying method for general use in zoology. Canadian Journal of Zoology. 48, 892-893 (1970).
- Kaiser, M. L., Duncan, F. D., Brooke, B. D. Embryonic Development and Rates of Metabolic Activity in Early and Late Hatching Eggs of the Major Malaria Vector Anopheles gambiae. PLoS ONE. 9 (12), 114381 (2014).
- Grigoraki, L., Grau-Bové, X., Yates, H. C., Lycett, G. J., Ranson, H. Isolation and transcriptomic analysis of Anopheles gambiae oenocytes enables the delineation of hydrocarbon biosynthesis. eLife. 9, 58019 (2020).
- Xiao, Y. -. H., Yin, M. -. H., Hou, L., Pei, Y. Direct amplification of intron-containing hairpin RNA construct from genomic DNA. BioTechniques. 41 (5), 548-552 (2006).
- Livak, K. J. Organization and Mapping of a Sequence on the Drosophila melanogaster X and Y Chromosomes That Is Transcribed during Spermatogenesis. Genetics. 107 (4), 611-634 (1984).
- MR4, CDC, NEI & beiResources. . The MR4 Methods in Anopheles Research Laboratory Manual. 5th Edition. , (2015).
- Sik Lee, Y., Carthew, R. W. Making a better RNAi vector for Drosophila: use of intron spacers. Methods. 30 (4), 322-329 (2003).
- Cha-aim, K., Hoshida, H., Fukunaga, T., Akada, R., Peccoud, J. . Gene Synthesis: Methods and Protocols. , 97-110 (2012).
- Cavener, D. R. Comparison of the consensus sequence flanking translational start sites in Drosophila and vertebrates. Nucleic Acids Research. 15 (4), 1353-1361 (1987).
- Wang, Y., Wang, F., Wang, R., Zhao, P., Xia, Q. 2A self-cleaving peptide-based multi-gene expression system in the silkworm Bombyx mori. Scientific Reports. 5, (2015).
- Galizi, R., et al. A synthetic sex ratio distortion system for the control of the human malaria mosquito. Nature Communications. 5, 3977 (2014).
- Kondo, S., et al. Neurochemical organisation of the Drosophila Brain Visualised by Endogenously Tagged Neurotransmitter Receptors. Cell Reports. 30 (1), 284-297 (2020).
- Lee, P. -. T., et al. A gene-specific T2A-GAL4 library for Drosophila. eLife. 7, 35574 (2018).
- Marois, E., et al. High-throughput sorting of mosquito larvae for laboratory studies and for future vector control interventions. Malaria Journal. 11, 302 (2012).
- Crawford, J. E., et al. Efficient production of male Wolbachia-infected Aedes aegypti mosquitoes enables large-scale suppression of wild populations. Nature Biotechnology. 38 (4), 482-492 (2020).
- Goltsev, Y., et al. Developmental and evolutionary basis for drought tolerance of the Anopheles gambiae embryo. Developmental Biology. 330 (2), 462-470 (2009).
- Rezende, G. L., et al. Embryonic desiccation resistance in Aedes aegypti: presumptive role of the chitinized Serosal Cuticle. BMC Developmental Biology. 8 (1), 82 (2008).
- Vargas, H. C. M., Farnesi, L. C., Martins, A. J., Valle, D., Rezende, G. L. Serosal cuticle formation and distinct degrees of desiccation resistance in embryos of the mosquito vectors Aedes aegypti, Anopheles aquasalis and Culex quinquefasciatus. Journal of Insect Physiology. 62, 54-60 (2014).
- Chang, C. -. H., et al. The non-canonical Notch signaling is essential for the control of fertility in Aedes aegypti. PLOS Neglected Tropical Diseases. 12 (3), 0006307 (2018).
- Clemons, A., Flannery, E., Kast, K., Severson, D., Duman-Scheel, M. Immunohistochemical Analysis of Protein Expression during Aedes aegypti Development. Spring Harbor Protocols. 10, 1-4 (2010).
- Juhn, J., James, A. A. Hybridization in situ of Salivary Glands, Ovaries and Embryos of Vector Mosquitoes. Journal of Visualized Experiments. , e3709 (2012).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены