Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Anopheles gambiae'de Fonksiyonel Genetik için GAL4-UAS Sistemini Kullanma
Bu Makalede
Özet
bipartit GAL4-UAS sistemi, Anopheles gambiae'de fonksiyonel genetik analize izin veren kontrollü bir mekansal şekilde gen ekspresyonunun değiştirilmesi için çok yönlü bir araçtır. Bu sistemi kullanmak için açıklanan prosedürler yarı standart bir klonlama stratejisi, floresan protein belirteçleri ve embriyo fiksasyonu için pupaların cinsiyetlenmesi ve taranmasıdır.
Özet
bipartit GAL4-UAS sistemi fonksiyonel genetik analiz için çok yönlü ve güçlü bir araçtır. Sistemin özü, maya transkripsiyon faktörü GAL4'ü dokuya özgü bir şekilde ifade eden transgenik 'sürücü' çizgilerini, ifadesi GAL4'ü bağlayan Yukarı Akış Aktivasyon Dizileri (UAS) tarafından kontrol edilen bir aday gen / RNA girişim yapısı taşıyan transgenik 'yanıtlayıcı' çizgilerle geçmektir. Ortaya çıkan soyda, gen veya susturma yapısı böylece öngörülen bir mekanotemporal şekilde ifade edilir ve ortaya çıkan fenotiplerin test edilmesine ve gen fonksiyonunun ortaya çıkarılmasına olanak tanır. İkili sistem, ciddi fitness maliyetleri indüklseniz bile, dokuya özgü birden fazla desende transgene ekspresyosu tarafından oluşturulan fenotipleri taramak için deneysel yaklaşımlarda esneklik sağlar. Bu sistemi Afrika'daki başlıca sıtma vektörü olan Anopheles gambiae için uyarladık.
Bu makalede, GAL4-UAS analizi sırasında kullanılan yaygın prosedürlerden bazılarını sunuyoruz. An. gambiae GAL4-UAS hatlarının yanı sıra, yeniden nüfusa alma ve RNAi devirme için yeni yanıtlayıcı yapılarının klonlanmasını açıklıyoruz. Genetik haçlar oluşturmak için sivrisinek pupalarının cinsiyeti için adım adım bir kılavuz belirtiyoruz, bu da sürücüyü ve yanıtlayıcı eklemelerini etiketleyen floresan gen belirteçlerinin kalıtımını takip etmek için tarama soyunu da içerir. Ayrıca embriyonik gelişimi incelemek için An. gambiae embriyolarının temizlenmesi için bir protokol sunuyoruz. Son olarak, hedef genlerin GAL4 aşağı akışının CRISPR/Cas9 yerleştirilmesi yoluyla sürücü hatları oluşturmak için yöntemin potansiyel uyarlamalarını sunuyoruz.
Giriş
Bipartit GAL4-UAS sistemi, böcek modeli organizma Drosophila melanogaster1,2,3'teki genlerin fonksiyonel karakterizasyonunun çalışma atıdır. GAL4-UAS sistemini kullanmak için, bir düzenleyici sıranın kontrolü altındaki maya transkripsiyon faktörü GAL4'ü ifade eden transgenik sürücü hatları, GAL4 tarafından tanınan bir Yukarı Akış Aktivasyon Sırası (UAS) tarafından kontrol edilen bir ilgi geni veya RNA paraziti (RNAi) yapısı taşıyan yanıtlayıcı çizgilerle geçilir. Bu haçın soyu, GAL4 ekspresyonunun kontrolüne geçen organizatör tarafından dikte edilen mekansal bir desene olan ilginin transgenesini ifade eder (Şekil 1). Sürücü-yanıtlayıcı haçların soyu tarafından görüntülenen fenotipler, aday genlerin işlevini aydınlatacak şekilde değerlendirilebilir. D. melanogaster diğer organizmalardan gelen genleri incelemek için kullanılmış olmasına rağmen4,5,6,7, GAL4-UAS sistemi şimdi ilgi türlerinde doğrudan analiz sağlamak için tıbbi ve tarımsal öneme sahip böceklerde kullanılmak üzere uyarlanmıştır 8,9,10,11,12,13,14.
Afrika sıtma sivrisinek, Anopheles gambiae, GAL4-UAS sistemi ilk hücre hattı ortak transfection9 tarafından test edildi. Farklı çift yönlü kombinasyonlarda verimlilik için birden fazla yapı test edildi ve küçük bir yapay intron (UAS-14i) ile desteklenmiş 14 tandemly tekrarlanan UAS'ın GAL4 sürücülerinden oluşan bir panelle kullanıldığında en geniş aktivasyon potansiyelini gösterdiği bulundu. In vivo işlevselliğini göstermek için, bu yapılar daha sonra PiggyBac dönüşümü8 tarafından iki ayrı transgenik An. gambiae hattı oluşturmak için kullanıldı: ortagut spesifik bir promotör tarafından sürülen GAL4 taşıyan bir sürücü hattı ve UAS dizilerinin düzenlenmesi altında hem luciferaz hem de gelişmiş sarı floresan protein (eYFP) genlerini içeren bir yanıtlayıcı hattı. Bağırsak spesifik luciferaz aktivitesi ve soydaki floresan, sistemin Anopheles'te verimli olduğunu gösterdi. O zamandan beri, oenositler15 ve hemositler16 da dahil olmak üzere vektörel kapasite ve insektisit direnci için önemli olan diğer dokularda ve her yerde bulunan bir desene yakın bir desende transgenes ifade eden sürücü çizgileri oluşturulmuştur10. Metabolizma ve sequestrasyon aracılı insektisit direnci, kütiküler hidrokarbon sentezi ve farklı hücre ve doku tiplerini floresan olarak etiketlemede rol aldığı düşünülen genleri test etmek için de çok sayıda UAS hattı oluşturulmuştur (Tablo 1). Yanıtlayıcı hatlar için, transjenin raya yönelik entegrasyonu, UAS tarafından düzenlenen genlerin genomik bağlamını düzeltmek için ΦC31 katalze rekombinasyon kaseti değişimi17,18 tarafından gerçekleştirilir. Bu şekilde, transgene ekspresyonu genomik ekleme konumu ile ilgili olarak normalleştirilerek farklı aday genlerin fenotipik etkilerinin daha doğru karşılaştırılmasına olanak sağlar.
Bugüne kadar oluşturulan yanıtlayıcı çizgiler, transjeni yüksek seviyelerde ifade etmek veya RNA paraziti (RNAi) yoluyla gen ekspresyonını azaltmak için tasarlanmıştır. Genellikle cDNA klonları uygun ekspresyon plazmidleri oluşturmak için UAS dizisine kaynaşır, ancak tam genomik diziler klonlama için çok büyük olmadıkları varsayılarak da mümkündür. Susturma yapıları oluşturmak için, RNAi'yi uyaran saç tokası dsRNA'yı oluşturan uygun tandem ters diziler elde etmek için üç farklı yöntem kullandık. Bunlar arasında füzyon PCR, asimetrik PCR ve saç tokası yapılarının ticari sentezi yer alıp almamaktadır. Her yöntem için ortak, klonlama kararlılığı sağlamak için ters diziler arasında bir intron dizisinin dahil edilmesidir. İlgi/RNAi yapısı geninin yerleştirilebileceği yanıtlayıcı plazmidler geliştirilmiştir15. Bu plazmidler ayrıca RMCE için gerekli ΦC31 attB sitelerini de taşır (RCME tekniğini ayrıntılı olarak açıklayan Adolfi eşlik eden JoVE kağıdında açıklanmıştır). Bu makaleye, aşırı ifade için bu plazmidlerden birine ekleme sırası seçilirken gereken önemli adımları kapsayan protokoller yer almaktadır. Ayrıca, RNAi saç tokası yapı oluşturma için iki protokol açıklanmış ve gösterilmiştir.
Yeni çizgiler oluştururken, nadir transgenik bireylerin tanımlanması, transgenik koloniler kurmak ve sürdürmek için üremek için çok önemlidir. Gal4-UAS sistemi için en önemlisi, çaprazlar oluşturmak ve her iki transjeni taşıyan bireysel soyları tanımlamak için yanıtlayıcı ve sürücü hatlarını ayırt etmek bir gerekliliktir. Bu, sürücü ve yanıtlayıcı kasetlere bağlı farklı baskın seçilebilir işaretleyici genleri kullanılarak elde edilir. En yaygın olarak bunlar optik filtreler (örneğin, eYFP, eCFP, dsRed) kullanılarak açıkça ayırt edilebilen floresan işaret genleridir. Anormalliklerin ve kontaminasyonun tanımlanmasının kolay hale getirdiğinden, belirteçlerin bilinen ve güvenilir bir mekansal desende ifade olması önemlidir. Floresan belirteç gen ekspresyumu, An. gambiae gelişiminin tüm aşamalarında göz ve ventral gangliyon spesifik ifadeye neden olan sentetik 3xP3 promotörü tarafından rutin olarak düzenlenir19. 3xP3 tarafından kontrol edilen floresan belirteçler, bu makalede açıklanan tüm dönüşüm plazmidlerine dahildir. Floresan An. gambiae pupa gal4-UAS hatlarını taramak için kullanılan yaygın yöntemleri ayrıntılı olarak açıklayan bir protokol burada yer almaktadır.
GAL4-UAS sisteminin temel unsurlarından biri, farklı şekilde işaretlenmiş sürücü ve yanıtlayıcı hatlarını geçme zorunluluğudur. Bunu yapmak için her satırdan erkek ve dişi çiftleşmeden önce ayrılmalıdır. Yetişkinler göz göre göre kolayca ayırt edilebilir, ancak genetik haçlar oluşturmak için çiftleşmenin gerçekleşmemesini sağlamak için yetişkin ortaya çıkmasından önce cinsiyetleri ayırmak mantıklıdır. Erkek ve dişi An. gambiae pupa arasındaki genel boyut farkı, etkili ve güvenilir bir cinsiyet belirleme yöntemi olamayacak kadar değişkendir20. Bunun yerine dış cinsel organdaki açık morfolojik farklılıklar , An. gambiae'de seks için güvenilir bir temel sağlar. Bu yazıda, uygun haçları kurmak için An. gambiae pupaları seks yapmak için güvenilir bir yöntem açıklıyoruz.
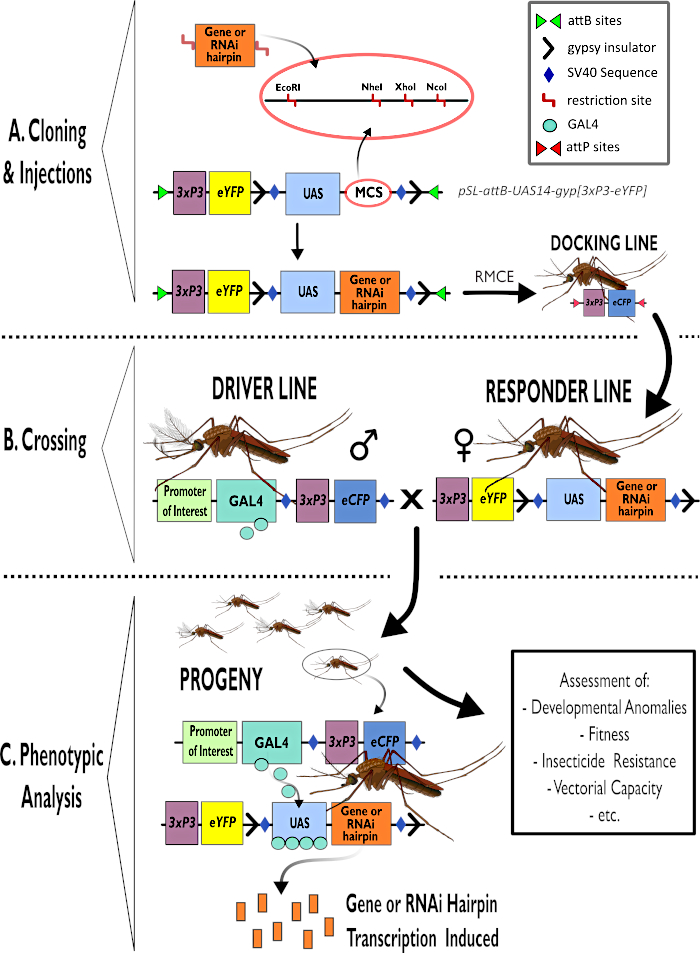
Şekil 1 - Anopheles gambiae'de bipartit GAL4-UAS Sisteminin kullanımına yönelik sürecin şemamatik gösterimi. (A) Örnek bir vektörün ana bileşenleri (pSL-attB-UAS14-gyp[3xp3-eYFP]), ilgi çekici gen için saç tokası yapısı veya kodlama sırası eklemek için kullanıma uygun çoklu klonlama siteleri içindeki mevcut kısıtlama sitelerini (EcoRI, NheI, XhoI ve NcoI) ayrıntılı olarak açıklar. Yanaşma hattının yapısı da tasvir edilir. (B) Geçiş adımı, sürücü hattından erkeklerin (GAL4 sürücüsünü 3xP3 promotörü tarafından yönlendirilen bir ilgi verici ve eCFP tarafından taşıyan) ve yanıtlayıcı çizgiden kadınların (bir UAS promotörü ve 3xP3 promotörü tarafından kontrol edilen bir eYFP işaretleyicisi tarafından kontrol edilen ilgi genini veya saç tokası yapısını taşıyan) kullanımını göstermektedir. (C) GAL4'ün B'deki haçın soyuna ilgi geninin itici ifadesinin diyagramsal bir gösterimi ve değerlendirilen tipik fenotiplerden bazılarının bir listesi. Kısaltmalar: Çoklu Klonlama Bölgesi (MCS), Rekombinoz aracılı kaset değişimi (RMCE), Upstream Aktivatör Sırası (UAS), gelişmiş sarı floresan protein (eYFP), gelişmiş siyan floresan protein (eCFP). Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Daha doğrusal yaklaşımlara göre belirgin avantajlara sahip olan GAL4-UAS sisteminin iki partili doğasını sağlayan haçların kullanılmasıdır. Örneğin, her promotör/gen kombinasyonu için yeni bir transgenik hat oluşturulması ve sürdürülmesi gerekiyorsa, sürücü ve yanıtlayıcı hatlarının birçok kombinasyonu uygulanabilir olacaktır. Daha da önemlisi, doğrusal bir sistemde oluşturulması/sürdürülmesi zor olan ifadeleri bozunduğunda ölümcül veya steril fenotip üreten genlerin analizine izin verir. Bu tür ölümcül fenotipler, gen fonksiyonuna ve mekansal ifadeye bağlı olarak tüm gelişim aşamalarında ortaya çıkabilir, ancak en sık embriyonik gelişim sırasında gözlenir. Sivrisinek embriyo gelişimini görselleştirmek, yumurtaları kaplayan opak koronun temizlenmesini gerektirir. Trpiš (1970)21 ve Kaiser ve ark. (2014)22'de açıklanan yöntemleri izleyerek, yapısal bütünlüğü korurken embriyoları düzeltmek için kullandığımız protokolleri ve mikroskobik görselleştirme ve görüntülemeye izin veren endochorion'u temizlemek için ağartmamızı açıklıyoruz.
Protokol
1. UAS yapılarının tasarımı ve inşası
- Aday gen ekspresyörü için vektörlerin tasarımı ve montajı
- Aday gen yukarıgülasyonu için kullanılacak sırayı belirleyin.
- CDNA/gDNA'yı ilgi gerginliğinden sıralayın ve kimliğini doğrulamak ve tanılama özeti için olası SNP'leri ve kısıtlama sitelerini tanımlamak için yayınlanan sırayla karşılaştırın.
- Gen amplifikasyonu için kullanılan ileri astarın doğal Kozak dizisini kapsadığından emin olun ve uygun olduğunda kodon başlatın. Başlangıç kodonunun yukarı akışını ~10 bp bağlayan bir astar Kozak dizisini kapsayacaktır.
- Stop codon'u çoğu durumda ters astardan güçlendirilmiş parçaya ekleyin. Açıklanan plazmid vektörlerde sağlanan 3' sonlandırma dizilerini kullanın veya aday gen genomik dizilerinden yükseltin.
- İstenirse belirli kodon önyargılı ticari diziler sipariş edin.
- Hem düzenleme hem de RNAi yapıları için pSL-attB-UAS14-gyp[3xP3-eYFP]15 (Şekil 1) gibi UAS plazmid vektörlerine gen kasetleri eklemek için standart alt virgülasyon prosedürlerini kullanın.
- ΦC31 rekombinasyon aracılı kaset değişimi10,17,18,23 kullanılarak oluşturulan transgenik sivrisinekler üretin.
- Aday gen yukarıgülasyonu için kullanılacak sırayı belirleyin.
- RNAi saç tokası yapılarının oluşturulması: asimetrik PCR15,24 kullanılarak tek adımlı amplifikasyon
- Livak yöntemini kullanarak istenen aday geni taşıyan yetişkin dişi An. gambiae'den genomik DNA (gDNA) çıkarın25.
- Komşu introna doğru yönlendirilen istenen parçanın 5' inde hedef eksona bağlanmak için ileri astarı tasarlayın. Bir köprü astarının 3' ucunun, intron'u yükseltmek için önceki eksonun sonuna bağlanacak şekilde tasarlayın. 5' ucu, introndan hemen sonra hedef eksonun küçük bir parçasını tamamlar.
- Xiao (2006)24'te (Şekil 2) açıklandığı gibi bir asimetrik PCR reaksiyon çalıştırma.
- Saflaştırılmış PCR ürününü UAS promotörunu taşıyan uygun bir vektöre klonlama (örneğin, pSL-attB-UAS14-gyp[3xP3-eYFP]15).
NOT: Birden fazla klonlama bölgesinde pSL-attB-UAS14-gyp[3xP3-eYFP] klonlama15 için uygun enzimler ve gerekli sonraki adımlar Şekil 1'de belirtilmiştir. Tek bir kısıtlama bölgesi ekli olduğu için tek enzim sindirimi esastır. Plazmid defosforilasyonu klonlama verimliliğini artıracaktır.
- Livak yöntemini kullanarak istenen aday geni taşıyan yetişkin dişi An. gambiae'den genomik DNA (gDNA) çıkarın25.
- RNAi saç tokası yapılarının yapımı: cDNA ve gDNA15'in fusion PCR'ı
- Livak yöntemini kullanarak istenen aday geni taşıyan yetişkin dişi An. gambiae'den genomik DNA (gDNA) çıkarın25.
- Exon ve intron dizilerinin hedef alanını birlikte yükseltmek için bir PCR reaksiyona gDNA ekleyin (Şekil 2).
- Hedef intron dizisine doğru yükseltmek için ters hedef ekson dizisine bağlanmak için ileri astarın 3' ucını ve klonlamayı kolaylaştırmak için bir kısıtlama bölgesi taşımak için 5' ucını tasarlayın.
- İntronun 5' ucuna bağlanmak için ters astar (1) tasarlayın ve 5' uç çıkınt, komşu eksonun ileri sırasının ilk temellerini taşır. Bu çıkınt füzyon PCR kullanılır.
- İstenilen reaksiyon ürününü arındırın.
- RNA çıkarın, DNase's kullanarak DNA'yı çıkarın ve üreticinin protokollerini takiben istenen aday geni taşıyan yetişkin dişi An. gambiae'den cDNA hazırlayın.
- Yalnızca dıştaki hedef alanı yükseltmek için PCR reaksiyonunda cDNA kullanın (Şekil 2).
- İleri astarı (2) tasarlayın, böylece 3' uç tamamlayıcı hedef ekson sırasının 3' ucunda bağlanır ve astarın 5' ucu klonlamada kullanılmak üzere bir kısıtlama bölgesi taşır.
NOT: 1.3.1.2'den ileri astar bu ikinci reaksiyonda tekrar kullanılabilir. Bununla birlikte, bu tek bir enzim sindirimin gerekli olduğu anlamına gelecektir. Farklı bir kısıtlama bölgesine sahip ikinci bir ileri astar kullanmak, klonlama verimliliğini artırabilecek çift sindirime izin verecektir. - Tasarım ters astarı (2) - 3' uç, hedef akon'u güçlendiren komşu aksonun 5' ucuna bağlanır. 5' ucu, introns ileri telinin 3' ucuna bağlanır. Bu çıkınt füzyon PCR kullanılır.
- İstenilen reaksiyon ürününü arındırın.
- İleri astarı (2) tasarlayın, böylece 3' uç tamamlayıcı hedef ekson sırasının 3' ucunda bağlanır ve astarın 5' ucu klonlamada kullanılmak üzere bir kısıtlama bölgesi taşır.
- İleri astar 1 ve 2 ile standart konsantrasyonları kullanarak füzyon PCR reaksiyonu için şablonlar olarak adım 1.3.1 ve 1.3.2 ürünlerini ekleyin. İstediğiniz ürünü arındırın.
- Klonlama için çıkıntıları oluşturmak için saflaştırılmış ürünü sindirin. UAS organizatörünün aşağı doğru uygun bir vektörüne klonla. pSL-attB-UAS14-gyp[3xP3-eYFP] klonlama15 için uygun enzimler ve gerekli sonraki adımlar Şekil 1'de belirtilmiştir.
- Livak yöntemini kullanarak istenen aday geni taşıyan yetişkin dişi An. gambiae'den genomik DNA (gDNA) çıkarın25.
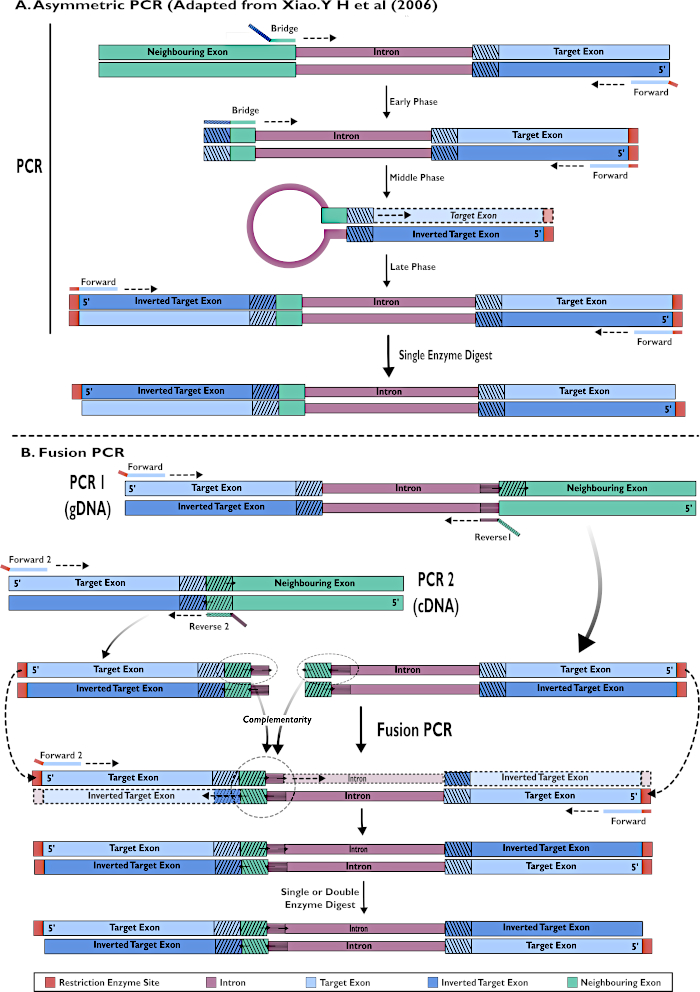
Şekil 2 - pSL-attB-UAS14-gyp[3xP3-eYFP] içine eklemek için RNAi yapılarının oluşturulmasının iki yöntemle şemamatik gösterimi: (A) Tek adımlı asimetrik PCR (Xiao'dan uyarlanmıştır). Y H ve ark (2006) ve (B) çoklu adım füzyon PCR. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
2. An. gambiae pupa gösterimi
- Mikroskobik karakterizasyon için pupa koleksiyonu
NOT: Bu protokoller boyunca su, %0,01 gölet tuzu ile desteklenmiş damıtılmış suyu ifade eder.- Pupal aşamasına standart protokoller (örneğin, MR426) kullanan Arka An. gambiae sivrisinekleri.
DİkKAT: Bu işlem boyunca pupaları yaralamamaya özen edin. - Pupaları stereomikroskopla kullanıma uygun şeffaf bir düz tabağa toplayın (örneğin, kenarlardan kaçınarak 100 x 15 mm plastik Petri kabı).
NOT: Pupa toplamak için ucu genişletmek ve sivrisineklerin yaralanmasını önlemek için ucundan yaklaşık 10 mm kesilmiş 3 mL plastik pastör pipet kullanıyoruz. Tarama ve seks bireyler üzerinde tamamlanabilir, ancak bu çok yavaştır. 50-200 pupalık gruplar üzerinde tarama ve seks yapılması önerilir (mümkün olan grubun büyüklüğü kullanılan yemeğin boyutu ile sınırlıdır ve kişisel tercihe tabidir). Çok sayıda tarama yapılıyorsa, önce pupaları yaklaşık 4 ila 5 derin çizgiye hizalayarak ve hedef pupayı bu çizginin dışına taşıyarak verimlilik artırılabilir. - Pasteur pipet kullanarak, pupaların etrafındaki hemen hemen tüm suyu dikkatlice çıkarın. Pupaların etrafında yeterli su bırakın, böylece etkili bir şekilde immotile olurlar, ancak ince bir fırça ile kolayca hareket ettirilebilirler. Hareket etmeleri zorlaşırsa, daha fazla su ekleyin.
NOT: Yeterli su çıkarıldığında, pupa yan yatacak ve floresan tespiti ve dimorfik cinsel organın tanımlanması için gözlerin görselleştirilmesine izin verecektir (Şekil 4DE).
DİkKAT: Pupaların doymamasını sağlayın. Sadece çok küçük bir su hacmi bırakılırsa, mikroskop lambasından gelen ısı ile ve pupa havuzları arasında bölündüğinde daha da azaltabilir. İşlem sırasında bazen istenen grup(lara) 3 mL Pasteur pipet kullanılarak ilave su eklenmelidir.
- Pupal aşamasına standart protokoller (örneğin, MR426) kullanan Arka An. gambiae sivrisinekleri.
- Pupalarda floresan belirteçlerin tanımlanması
NOT: Düşük büyütme stereoskopu kullanımı geniş alan taramasına izin verir, sıralama ters bileşik mikroskopta yapılabilir, ancak ayrı ayrı yapılmalıdır.- Floresan bir işaretleyici için tarama yaparken, önce beklenen ifade ve kalıtım kalıplarını bilmek çok önemlidir. Aşağıdakileri göz önünde bulundurun:
- Renk(ler): ifadenin görselleştirilirken hangi filtreleri seçeceklerini belirleyin.
- Mekansal ifade deseni: İfadeyi nerede ve hangi yaşam aşamasında görmeyi beklediğinizi anlayın.
- Farklı fenotiplerin oranı: nüfusun yüzde kaçının ilgi çekici işaretleri taşıması gerektiğini belirleyin.
- Düşük ışık bile floresan çözünürlüğünü engelleyebileceğinden, karanlıkta floresan taraması gerçekleştirin. Ancak, diğer manipülasyonlar için ışık gerektiğinde stereoskopun yanında bir lamba kullanın.
DİkKAT: Işıkları kapatmadan önce floresan stereoskopun etrafındaki çalışma alanının açık olduğundan emin olun. - Floresan ampulü açın ve üreticinin önerdiği süre boyunca ısınmaya bırakın (Normalde 10-15 dk). Floresan stereoskopta gerekli filtreyi seçin ve sahne plakasının ortasına yönlendirilmiş renkli bir ışık huzmesi olup olmadığını kontrol edin. Bu görünmüyorsa veya çok silikse, floresan ampul tam olarak ısınmamış olabilir, deklanşör kapalı veya mikroskop optikleri iyi hizalanmamış olabilir.
- Beyaz ışık kullanarak pupaları görüş alanına ortalayın ve odak noktasına getirin. Floresan yoğunluğuna bağlı olarak farklı filtreler arasında geçiş yaparken bu büyütmenin değiştirilmesi gerekebilir.
- İnce detaylı boya fırçası kullanmak, incelenen pupaların üst üste binmemesini sağlar.
- Stereoskopun beyaz ışığını kapatın ve pupaların ilgi fenotipini taşıyan alanını odak noktasına getirmek için ince odağı kullanın. Floresan deseni görünür olmalıdır. Şekil 3'te 3xP3 promotör kontrollü floresan örnekleri verilmiştir.
- Beklenen floresan fenotipin floresan olmayan bireylerden güvenilir bir şekilde ayırt edilebildiği en düşük büyütmeyi kullanın.
- Parlak floresanlı suşlar için, floresan sinyal hala açıkça tanımlanabilirse, tarama yaparken de düşük yoğunluklu bir parlak alan ışığı kullanın.
- Birincil tarama tamamlandığında, olası kontaminasyonu tespit etmek için popülasyonları diğer filtreler altında hızla tarayın.
DİkKAT: Pupa hareketi ile kirlenmeyi önlemek için sıralanmış pupa grupları arasında net bir mesafe olduğundan emin olun. Pupalar cinsiyetlendikçe grupların boyutunun değişeceğini ve büyütme altında bakıldığında mesafelerin daha büyük görünebileceğini unutmayın. Havuzlar görüş alanında olmadığında özellikle dikkatli olun.
- Floresan bir işaretleyici için tarama yaparken, önce beklenen ifade ve kalıtım kalıplarını bilmek çok önemlidir. Aşağıdakileri göz önünde bulundurun:
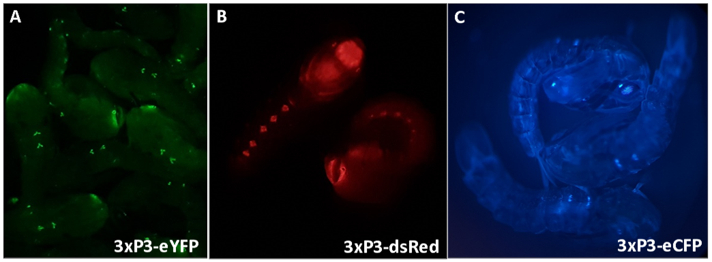
Şekil 3 - 3xP3 promotör (A) eYFP, (B) dsRed ve (C) eCFP tarafından tahrik edilen floresan belirteçleri ifade eden anopheles gambiae pupa. Büyütme: A=16X, B,C=20X.
-
Sexing Pupae
- Pupaları topla. Fazla suyu çıkarın, ancak anal küreklerin görselleştirmeye ve morfolojik karakterizasyona yardımcı olmak için cinsel organdan hafifçe parçalanması için yeterli miktarda sağlayın (Şekil 4D, E).
- Herhangi bir pupa / e onların tarafında değilse, pupayı hafifçe çevirmek ve anal kürekleri hareket ettirmek için ince bir detaylandırma boya fırçası kullanın, böylece dış cinsel organ tanımlanabilir.
- Ayırt edici dış cinsel organa dayalı ayrı pupalar; erkekler, son sırt segmentinden anal küreklerin yaklaşık yarısı kadar ekstrüzyon yapan uzun bir tüpe sahiptir (Şekil 4B). Kadın pupalarının dış cinsel organı oldukça kısadır ve bifurcatedir (Şekil 4A).
NOT: Bazen, 4. instar larva dış iskeleti bağlı kalırsa veya dış cinsel organ hasar görürse (Şekil 4C), cinsiyetin kendinden emin tanımlanması daha zordur. Bir pupanın cinsiyeti net olmadığında, onu atmak en iyi uygulamadır. Birey tutulacaksa, pupanın izole bir şekilde ortaya çıkmasına ve cinsiyetinin yetişkin morfolojik özellikleri kullanılarak belirlenmesine izin verilmelidir. Cinsel organı hasar görürse bireyin başarılı bir şekilde çiftleşmemesi muhtemeldir. - Yemeğin karşı ucundaki her cinsiyet için bir havuz yapın, ince bir boya fırçası kullanarak tanımlanan pupaları çanak boyunca hareket ettirin. İki havuzun toplanacağı yemeğin alt tarafını daha sonra tanımlamak için etiketleyin.
- Hem sexing hem de floresan tarama gerektiğinde, ikisinin daha hızlı süreci olduğu için önce floresan taramayı gerçekleştirin.
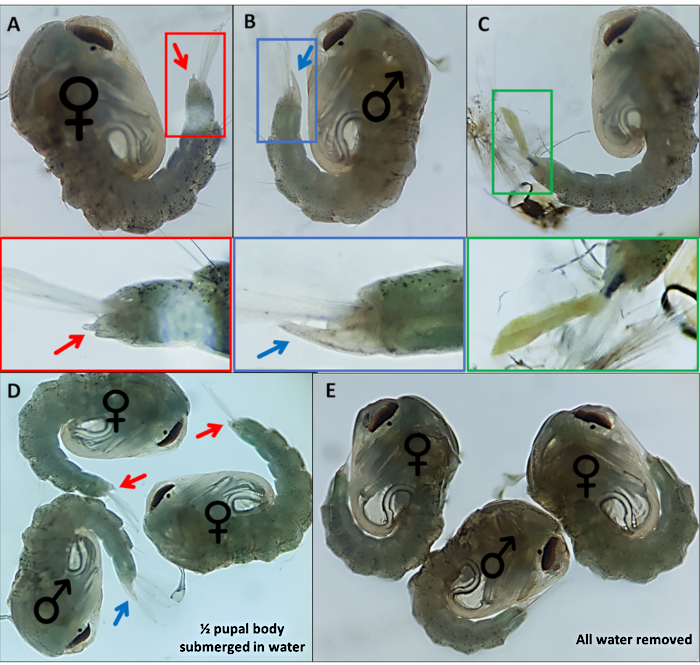
Şekil 4 - Sexing Anopheles gambiae pupae. (A) bir dişinin (B) bir erkeğin ve (C) larva dış iskeletinin eksik ayrışması nedeniyle kolayca tanımlanamayan bir bireyin dış cinsel organını gösteren bireysel pupalar. Dış cinsel organı vurgulayan aşağıdaki genişlemiş görüntüler. Pupanın ♀ dış cinsel organını gösteren (kadın) ve ♂ (erkek) pupaların dış cinsel organını gösteren pupalar suya batırılmış ve (E) ile tüm su dış cinsel organın görselleştirme kolaylığındaki farkı vurgulayarak çıkarılmıştır. Büyütme: A,B,C=40x, D,E=30x. Bu rakamın daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
- Yetişkinler olarak seks onayı
- Çok düşük bir hata oranı ortaya çıkana kadar, ortaya çıktıktan sonra yetişkin morfolojisi ile pupa seksini onaylayın. Cinsiyetli pupaları, birkaç mL su ile net bir 20 mL tüpte 10 veya daha az gruplara ayırın, beklenen cinsiyetle etiketlenmiş bir pamuk yünü topu ile kapatın ve bir gecede ortaya çıkmasına izin verin.
NOT: Yetişkinler ertesi sabah transfer edildiği için, ortaya çıkan yetişkinlere yiyecek sağlamak gerekli değildir. - Ertesi gün morfolojik özellikleri kullanarak ortaya çıkan yetişkinlerin cinsiyetini onaylayın.
- Kadın koleksiyonlarında herhangi bir erkek varsa, çiftleşmenin zaten meydana gelmiş olması durumunda dişileri atın.
- Erkek koleksiyonunda herhangi bir dişi varsa, dişileri / leri çıkarın ve erkekleri geçmek için saklayın.
- Çok düşük bir hata oranı ortaya çıkana kadar, ortaya çıktıktan sonra yetişkin morfolojisi ile pupa seksini onaylayın. Cinsiyetli pupaları, birkaç mL su ile net bir 20 mL tüpte 10 veya daha az gruplara ayırın, beklenen cinsiyetle etiketlenmiş bir pamuk yünü topu ile kapatın ve bir gecede ortaya çıkmasına izin verin.
- GAL4-UAS sistem çaprazlarını ayarlama
- 2.4. adımdaki tüplerden istenen sayıda erkek ve kadın yetişkini, An. gambiya yetiştirme için standart şekilde kurulmuş bir kafese veya küçük bir kovaya apire edin.
NOT: Bu transfer sırasında yetişkinlere zarar vermemeye özen edin. - Soydan ~2000 yetişkin gerektiğinde, eşit sayıda erkek ile yaklaşık 50 dişi kullanın.
NOT: Bir haçın her cinsiyetin 200'üne kadar birden fazla parti oluşturmak için birden çok kez beslendiği durumlarda, 30cm x 30cm x 30cm kafeslerde kurulabilir. Haç için sadece az sayıda dişi (<20) mevcut olduğunda, başarılı çiftleşme olasılığını artırmak için erkek sayısının ~ 4 katını ekleriz. - Kan, çapraz dişileri ve arka soyları, fenotipik değerlendirme yapmak için standart protokoller26'yı izleyerek uygun aşamaya besler (örneğin, insektisit direnci, vektörel kapasite ve fitness maliyeti tahlilleri).
- Transgene ekspresyonunun anne etkisinin muhtemel olduğu durumlarda, sürücü ve yanıtlayıcı çizgilerin karşılıklı haçlarını ayarlayın ve beklenen fenotipi test edin.
NOT: 'Heterozygous' veya sürücü ve yanıtlayıcı hatlarının karışık popülasyonlarını kullanan haçlar, olası 4 genotipin her biriyle soy üretir. Bu, yalnızca vahşi tip, yalnızca UAS ve GAL4 denetimlerinin yanı sıra fenotipin analiz etmek için olduğu gal4-UAS transheterozygotlarını sağlar. Homozigot popülasyonlar kesişirse, fenotipleri karşılaştırmak için uygun denetimleri sağlamak için ek haçlar ayarlayın. Soy, fenotipik değerlendirme için hem veya sadece bir işaretleyiciyi hem de negatifleri taşıyan soyları ayıran yukarıda olarak taranmalıdır.
- 2.4. adımdaki tüplerden istenen sayıda erkek ve kadın yetişkini, An. gambiya yetiştirme için standart şekilde kurulmuş bir kafese veya küçük bir kovaya apire edin.
- Alternatif floresan belirteçler taşıyan RCME aracılığıyla oluşturulan hatlardan homozigöz popülasyonların oluşturulması
NOT: Her iki çizginin floresan işaretleyicisinin aynı genomik konumda bulunması ve tamamen ayırt edilebilir olması esastır.- Yukarıda açıklandığı gibi, doğru floresan ve cinsiyet gösteren bireyleri seçmek için taramadan sonra bir çizginin farklı olarak işaretlenmiş erkek ve diğer çizginin dişilerinin eşit sayıda olduğu yaklaşık 200 yetişkinden oluşan bir ebeveyn haçı kurun. Yaklaşık bir hafta sonra kan, belirlenen protokolleri kullanarak haçı besler26.
- Standart protokolleri kullanarak pupalamak ve daha önce açıklandığı gibi pupa toplamak için F1 soylarını arkalayın.
- Her iki ebeveyn işaretleyicisini (transheterozygous) taşıyanları seçen floresan için ekran. Bu pupalarla bir F1 ara arası kurun.
- Bir hafta sonra, kan F1 kadınlarını ve arka soylarını standart protokolleri izleyerek pupal aşamasına besler.
- İşaretçilerden SADECE birini görüntüleyenleri seçerek F2 pupalarını ekrana tarayın. Bunlar ekleme için homozigous olacaktır. Her ekleme için soyun sadece% 25'i homozigous olacaktır, bu nedenle bir stok kafesi (400-500) sağlamak için yeterli soyun yetiştirilmesini sağlayın.
NOT: Transheterozigöz soy seçimi tamamen titiz olmalıdır, aksi takdirde süreç kirlenir ve tam homozigozite elde edilemeyebilir. F1 ara geçiş için seçilen tüm soyları iki kez kontrol edin.
- Yukarıda açıklandığı gibi, doğru floresan ve cinsiyet gösteren bireyleri seçmek için taramadan sonra bir çizginin farklı olarak işaretlenmiş erkek ve diğer çizginin dişilerinin eşit sayıda olduğu yaklaşık 200 yetişkinden oluşan bir ebeveyn haçı kurun. Yaklaşık bir hafta sonra kan, belirlenen protokolleri kullanarak haçı besler26.
3. An. gambiae embriyo temizleme protokolü
-
Kan besleme ve bakım
- Arka An. gambiae sivrisinekleri yetişkinlere standart protokolleri takip eder (örneğin, MR4).
- Kan besleme 5-7 günlük kadın yetişkinler, çoğu tamamen engorged sağlar.
DİkKAT: Bu protokol boyunca hızlı bir şekilde çalışmak, yumurtaların bozulmasına izin verilmemesini sağlamak için gereklidir.
-
İndüklenmiş yumurtlama
- Kan beslemeden 3 gün sonra indüklenmiş yumurtlama yoluyla yumurta toplayın.
- Yumurtlama odasını monte edin.
- Yumurtlama kabını yaklaşık 5 mm derinliğe kadar suyla doldurun. Tencereyi, daha önce bir demir testeresi ile kesilmiş 50 mL polipropilen tüpün bir ucuna takın, böylece her iki uç da açıktır. (Bir tencere için plastik disk kullanıyoruz (Şekil 5); ancak bunun yerine tüpün orijinal kapağı kullanılabilir).
- Kesilen polipropilen tüpün diğer ucunu malzeme (hortum/tayt) veya lateks eldivenin elastik bantla sabitlenmiş bölümleriyle örtün, böylece yetişkinler tanıtılabilir ancak kaçamazlar (Şekil 5). Diğer alternatif yumurtlama odası tasarımları mevcuttur ve kullanılabilir26.
- 10-15 dişiyi (adım 3.1.2'de beslenen kan) yumurtlama odasına dikkatlice tanıtın. Karanlık üretmek için yumurtlama odasını örtün ve 20 dakika bekletin.
DİkKAT: Yumurtaların karaya oturmasını ve yok olmasını önlemek için yumurtalar bırakıldıktan sonra yumurtlama kabını hareket ettirmekten kaçının. - Sivrisineklerin salınmamasını sağlarken, 50 mL polipropilen tüpü yumurtlama kabından dikkatlice ayırın. Beyaz yumurtalar görünür olmalıdır. Reçeteli amaç için yeterli miktarda olup olmadığını kontrol edin. Gerekirse tekrarlayın.
- Tencereyi örtün (toz koruması için) ve yumurtaların ilginin gelişim aşamasına olgunlaşmasına izin verin.
- Yumurtaları tencereden almak ve 40 mm2 kazılmış bir cam blokta suya yerleştirmek için ince bir boya fırçası kullanın.

Şekil 5 - Bileşenleri vurgulamak için sökülen ve (B) monte edilen bir Yumurtlama Odası (A) örneği. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
-
Embriyo Sabitleme
DİkKAT: Formaldehit kullanımı nedeniyle tüm sabitleme adımlarını (adım 3.3) duman kaputunda gerçekleştirin.- Kaiser ve ark. (2014)22'de açıklandığı gibi FAA çözümünü hazırlayın. FAA, damıtılmış su (dH2O) ile hacme kadar yapılmış 3,6 M formaldehit, 0,87 M asetik asit ve 8,5 M mutlak etanolden oluşur.
- 10 mL FAA için 2,68 mL 13,42 M formaldehit birleştirin, 17,14 M etanol 4,96 mL ve 1,86 mL damıtılmış H2O ile 17,4 M asetik asit 0,5 mL. Fiksatif, belirlenmiş bir kimyasal dolapta tutulan sıkıca kapatılmış bir cam kapta en az 3 ay saklanabilir.
- Suyu bir mikropipette ile cam bloktan dikkatlice çıkarın ve 500 μL FAA'da yumurtaları örtün ve oda sıcaklığında bir orbital çalkalayıcı üzerinde 30 dakika boyunca hafifçe salın. Bu noktada renk değişikliği görünmüyor.
- Yumurtaları damıtılmış suyla iyice durulayın. Formaldehitin tüm izlerini kaldırmak için 15 kez durulama gerçekleştirin. 1000 μL mikropipette kullanarak, yumurtalara zarar vermemeyi sağlamak için bir seferde 1 mL dH2O ekleyin ve çıkarın.
- Durulamalardan elde edilen atık suları, güvenlik yönergelerine göre bertaraf edilmek üzere belirlenmiş bir formaldehit atma kabında saklayın.
- Bu noktada, sabit yumurtalar nemli tutmak için bir gecede 4 ° C'de suda saklanabilir.
- Kaiser ve ark. (2014)22'de açıklandığı gibi FAA çözümünü hazırlayın. FAA, damıtılmış su (dH2O) ile hacme kadar yapılmış 3,6 M formaldehit, 0,87 M asetik asit ve 8,5 M mutlak etanolden oluşur.
-
Embriyo Ağartma
DİkKAT: Sodyum hipoklorit ve asetik asit birleştirildiğinde klor gazının potansiyel salınımı nedeniyle tüm ağartma adımlarını (adım 4) bir duman kaputunda gerçekleştirin.- Ağartma çözeltisi hazırlayın (Trpiš çözeltisi - Trpiš (1970)21'de tanımlanmıştır ve Kaiser ve ark. (2014)22'ye göre değiştirilmiştir). Trpiš çözeltisi damıtılmış H2O'da çözünmüş 0.59 M sodyum hipoklorit ve 0.35 M asetik asittir.
- Trpiš çözeltisinin 10 mL ovolume'si için, 2.68 mL 2.2 M sodyum hipoklorit ve 0.2 mL 17.4 M asetik asit ile 7.12 mL damıtılmış H2O'yu birleştirin.
NOT: Trpiš çözeltisi sıkıca kapatılmış bir cam kapta en az 3 ay saklanabilir ve güvenli bir kimyasal dolapta tutulabilir. Çözeltinin depolandıktan sonra girdaplı olması gerekebilir ve klor gazının salınması durumunda her zaman bir duman kaputunda açılmalıdır.
- Trpiš çözeltisinin 10 mL ovolume'si için, 2.68 mL 2.2 M sodyum hipoklorit ve 0.2 mL 17.4 M asetik asit ile 7.12 mL damıtılmış H2O'yu birleştirin.
- Sabit yumurtaları 1 mL Trpiš çözeltisi ile örtün ve oda sıcaklığında 30 dakika kuluçkaya yatırın. Yumurtalar yaklaşık 5 dakikalık kuluçkadan sonra soluk yamalar geliştirmeye başlayacak ve sonunda temizlendikten sonra süt beyazı bir renge ulaşacaktır.
- Trpiš çözeltisini çıkarmak için yumurtaları adım 3.3.3'te olduğu gibi durulayın.
- Atık suları belirlenmiş bir atık konteynerde saklayın ve fazla su ile giderden aşağı atın.
- Ağartma çözeltisi hazırlayın (Trpiš çözeltisi - Trpiš (1970)21'de tanımlanmıştır ve Kaiser ve ark. (2014)22'ye göre değiştirilmiştir). Trpiš çözeltisi damıtılmış H2O'da çözünmüş 0.59 M sodyum hipoklorit ve 0.35 M asetik asittir.
-
Depolama
- 500 μL dH2O'da saklayın ve birkaç gün boyunca 2-8 °C arasında tutun. Suyun çoğunu kütle üzerinde görüntüleme ve görüntülemeden önce dikkatlice çıkarın, ancak saat camına az miktarda su bırakarak yumurtaların kesilmesini önleyin. Bu yumurtaların fotoğrafının fotoğrafını bozmaz. Bireysel yumurtalar daha yüksek büyütme görüntüleme için mikroskop kaydıraktan yerlenebilir.
Sonuçlar
eYFP, dsRed ve eCFP'nin 3xP3 ekspresyumu, gözlerde ifade üreten belirteç genlerine ve An. gambiae pupalarının ventral gangliyonlarına sahip bireylerin güvenilir, kolayca ayırt edilebilir bir şekilde tanımlanmasını sağlar (Şekil 3). Seks için kullanılan erkek ve kadın dış cinsel organlarında gözlenen diferansiyel morfoloji ve tanımlanamayan bir pupa örneği Şekil 4'te vurgulanmıştır. Tüm suyun pupalardan uzaklaştır?...
Tartışmalar
Sivrisinek gen fonksiyonunu anlamak, Anopheles'i kontrol etmek ve sıtma bulaşmasını etkilemek için yeni yaklaşımlar geliştirmek için hayati öneme sahiptir. Açıklanan GAL4-UAS sistemi, aday genlerin fonksiyonel analizi için çok yönlü ve güçlü bir sistemdir ve bugüne kadar sistemi insektisit direncinin genetik temelini incelemek için kullandık17 ve cutiküler hidrokarbon üretimi15,23, ayrıca farklı sivrisine...
Açıklamalar
Yazarların açıklayacak bir şeyi yok.
Teşekkürler
Tekliflere Gal4UAS analizini dahil eden LSTM ve IVCC (Adriana Adolfi), BBSRC (Yeni Araştırmacı Ödülü (AL), MRC (BCP'ye doktora öğrenciliği:MR/P016197/1), Wellcome (Sir Henry Wellcome Doktora Sonrası LG: 215894/Z/19/Z) tarafından finanse edildiğini memnuniyetle kabul ediyoruz.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 100 x 15 mm plastic Petri dish | SLS | 2175546 | Pack of 10 |
| 1000 µL Gilson Pipette | Gilson | F144059P | |
| 20/25 mL Universal Tubes | Starlab | E1412-3020 | Pack of 400 |
| 3 mL Pasteur Pipettes | SLS | G612398 | Greiner Pasteur pipette 3 mL sterile individually wrapped |
| 50 mL Falcon Tubes | Fisher Scientific | 11512303 | |
| Absolute Ethanol | Fisher Scientific | BP2818-500 | 500 mL |
| Acetic Acid | SLS | 45726-1L-F | 1 L |
| Cages | SLS | E6099 | 30x30x30 with screen port |
| Fine Paint Brushes | Amazon | UKDPB66 | KOLAMOON 9 Pieces Detail Painting Brush Set Miniture Brushes for Watercolor, Acrylic Painting, Oil Painting (Wine Red) |
| Fish food | Amazon | Tetra Min Fish Food, Complete Food for All Tropical Fish for Health, Colour and Vitality, 10 L | |
| Formaldehyde Solution | Sigma Aldrich | F8775 | |
| Mouth Aspirator | John Hock | 612 | |
| Pond Salt | Amazon | Blagdon Guardian Pond Tonic Salt, for Fish Health, Water Quality, General Tonic, pH Buffer, 9.08 kg, treats 9,092 L | |
| Pupae Pots | Cater4you | SP8OZ | 250 pots with lids |
| Small Plastic Buckets | Amazon | 2.5 L White Plastic Pail Complete with White Lid (Pack of 10) | |
| Sodium Hypochlorite | Fisher Scientific | S25552 |
Referanslar
- Brand, A. H., Perimon, N. Targeted gene expression as a means of altering cell fates and generating dominant phenotypes. Development. 118 (2), 401-415 (1993).
- Duffy, J. B. GAL4 system in drosophila: A fly geneticist's swiss army knife. Journal of Genetics and Development. 34 (1-2), 1-15 (2002).
- Dow, J. A. . ELS. , (2012).
- Edi, C. V., et al. CYP6 P450 Enzymes and ACE-1 Duplication Produce Extreme and Multiple Insecticide Resistance in the Malaria Mosquito Anopheles gambiae. PLoS Genetics. 10 (3), 1004236 (2014).
- Daborn, P. J., et al. Using Drosophila melanogaster to validate metabolism-based insecticide resistance from insect pests. Insect Biochemistry and Molecular Biology. 42 (12), 918-924 (2012).
- Riveron, J. M., et al. Genome-wide transcription and functional analyses reveal heterogeneous molecular mechanisms driving pyrethroids resistance in the major malaria vector Anopheles funestus across Africa. Genes Genomes Genetics. 7 (6), 1819-1832 (2017).
- Riveron, J. M., et al. A single mutation in the GSTe2 gene allows tracking of metabolically based insecticide resistance in a major malaria vector. Genome Biology. 15 (2), (2014).
- Lynd, A., Lycett, G. J. Development of the Bi-Partite Gal4-UAS System in the African Malaria Mosquito, Anopheles gambiae. PLoS ONE. 7 (2), 31552 (2012).
- Lynd, A., Lycett, G. J. Optimization of the Gal4-UAS system in an Anopheles gambiae cell line. Insect Molecular Biology. 20 (5), 599-608 (2011).
- Adolfi, A., Pondeville, E., Lynd, A., Bourgouin, C., Lycett, G. J. Multi-tissue GAL4-mediated gene expression in all Anopheles gambiae life stages using an endogenous polyubiquitin promoter. Insect Biochemistry and Molecular Biology. 96, 1-9 (2018).
- Kokoza, V. A., Raikhel, A. A. Targeted gene expression in the transgenic Aedes aegypti using the binary Gal4-UAS system. Insect Biochemistry and Molecular Biology. 41, 637-644 (2011).
- O'Brochta, D. A., Pilitt, K. L., Harrell, R. A., Aluvihare, C., Alford, R. T. Gal4-based Enhancer-Trapping in the Malaria Mosquito Anopheles stephensi. Genes Genomes Genetics. 2, 21305-21315 (2012).
- Zhao, B., et al. Regulation of the Gut-Specific Carboxypeptidase: A Study Using the Binary Gal4/UAS System in the Mosquito Aedes Aegypti. Insect Biochemistry and Molecular Biology. 54, 1-10 (2014).
- Imamura, M., et al. Targeted Gene Expression Using the GAL4/UAS System in the Silkworm Bombyx mori. Genetics. 165 (3), 1329-1340 (2003).
- Lynd, A., et al. Development of a functional genetic tool for Anopheles gambiae oenocyte characterisation: application to cuticular hydrocarbon synthesis. bioRxiv. , (2019).
- Pondeville, E., et al. Hemocyte-targeted gene expression in the female malaria mosquito using the hemolectin promoter from Drosophila. Insect Biochemistry and Molecular Biology. 120, 103339 (2020).
- Adolfi, A., et al. Functional genetic validation of key genes conferring insecticide resistance in the major African malaria vector, Anopheles gambiae. Proceedings of the National Academy of Sciences of the United States of America. 116 (51), 25764-25772 (2019).
- Pondeville, E., et al. Efficient integrase-mediated site-specific germline transformation of Anopheles gambiae. Nature Protocols. 9 (7), 1698-1712 (2014).
- Horn, C., Schmid, B. G. M., Pogoda, F. S., Wimmer, E. A. Fluorescent transformation markers for insect transgenesis. Insect Biochemistry and Molecular Biology. 32, 1221-1235 (2002).
- Clements, A. . A. Biology of Mosquitoes, Volume 1: Development, Nutrition and Reproduction. 1, (1992).
- Trpiš, M. A new bleaching and decalcifying method for general use in zoology. Canadian Journal of Zoology. 48, 892-893 (1970).
- Kaiser, M. L., Duncan, F. D., Brooke, B. D. Embryonic Development and Rates of Metabolic Activity in Early and Late Hatching Eggs of the Major Malaria Vector Anopheles gambiae. PLoS ONE. 9 (12), 114381 (2014).
- Grigoraki, L., Grau-Bové, X., Yates, H. C., Lycett, G. J., Ranson, H. Isolation and transcriptomic analysis of Anopheles gambiae oenocytes enables the delineation of hydrocarbon biosynthesis. eLife. 9, 58019 (2020).
- Xiao, Y. -. H., Yin, M. -. H., Hou, L., Pei, Y. Direct amplification of intron-containing hairpin RNA construct from genomic DNA. BioTechniques. 41 (5), 548-552 (2006).
- Livak, K. J. Organization and Mapping of a Sequence on the Drosophila melanogaster X and Y Chromosomes That Is Transcribed during Spermatogenesis. Genetics. 107 (4), 611-634 (1984).
- MR4, CDC, NEI & beiResources. . The MR4 Methods in Anopheles Research Laboratory Manual. 5th Edition. , (2015).
- Sik Lee, Y., Carthew, R. W. Making a better RNAi vector for Drosophila: use of intron spacers. Methods. 30 (4), 322-329 (2003).
- Cha-aim, K., Hoshida, H., Fukunaga, T., Akada, R., Peccoud, J. . Gene Synthesis: Methods and Protocols. , 97-110 (2012).
- Cavener, D. R. Comparison of the consensus sequence flanking translational start sites in Drosophila and vertebrates. Nucleic Acids Research. 15 (4), 1353-1361 (1987).
- Wang, Y., Wang, F., Wang, R., Zhao, P., Xia, Q. 2A self-cleaving peptide-based multi-gene expression system in the silkworm Bombyx mori. Scientific Reports. 5, (2015).
- Galizi, R., et al. A synthetic sex ratio distortion system for the control of the human malaria mosquito. Nature Communications. 5, 3977 (2014).
- Kondo, S., et al. Neurochemical organisation of the Drosophila Brain Visualised by Endogenously Tagged Neurotransmitter Receptors. Cell Reports. 30 (1), 284-297 (2020).
- Lee, P. -. T., et al. A gene-specific T2A-GAL4 library for Drosophila. eLife. 7, 35574 (2018).
- Marois, E., et al. High-throughput sorting of mosquito larvae for laboratory studies and for future vector control interventions. Malaria Journal. 11, 302 (2012).
- Crawford, J. E., et al. Efficient production of male Wolbachia-infected Aedes aegypti mosquitoes enables large-scale suppression of wild populations. Nature Biotechnology. 38 (4), 482-492 (2020).
- Goltsev, Y., et al. Developmental and evolutionary basis for drought tolerance of the Anopheles gambiae embryo. Developmental Biology. 330 (2), 462-470 (2009).
- Rezende, G. L., et al. Embryonic desiccation resistance in Aedes aegypti: presumptive role of the chitinized Serosal Cuticle. BMC Developmental Biology. 8 (1), 82 (2008).
- Vargas, H. C. M., Farnesi, L. C., Martins, A. J., Valle, D., Rezende, G. L. Serosal cuticle formation and distinct degrees of desiccation resistance in embryos of the mosquito vectors Aedes aegypti, Anopheles aquasalis and Culex quinquefasciatus. Journal of Insect Physiology. 62, 54-60 (2014).
- Chang, C. -. H., et al. The non-canonical Notch signaling is essential for the control of fertility in Aedes aegypti. PLOS Neglected Tropical Diseases. 12 (3), 0006307 (2018).
- Clemons, A., Flannery, E., Kast, K., Severson, D., Duman-Scheel, M. Immunohistochemical Analysis of Protein Expression during Aedes aegypti Development. Spring Harbor Protocols. 10, 1-4 (2010).
- Juhn, J., James, A. A. Hybridization in situ of Salivary Glands, Ovaries and Embryos of Vector Mosquitoes. Journal of Visualized Experiments. , e3709 (2012).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır