Method Article
وصف رسم الخرائط 3D للخلية بواسطة التصوير المقطعي بالأشعة السينية الناعمة Cryo
In This Article
Summary
هنا ، يتم تقديم بروتوكول يصف خطوات إعداد العينات وجمع البيانات المطلوبة في التصوير المقطعي بالأشعة السينية الناعمة بالتبريد (SXT) لتصوير البنية الفائقة للخلايا المحفوظة بالتبريد بالكامل بدقة 25 نانومتر نصف الملعب.
Abstract
تقنيات التصوير أساسية من أجل فهم تنظيم الخلايا والآلات في البحوث البيولوجية والمجالات ذات الصلة. من بين هذه التقنيات ، يسمح التصوير المقطعي بالأشعة السينية الناعمة بالتبريد (SXT) بتصوير الخلايا الكاملة المحفوظة بالتبريد في نطاق طاقة الأشعة السينية لنافذة الماء (284-543 eV) ، حيث تتمتع هياكل الكربون بامتصاص أعلى جوهريا من الماء ، مما يسمح بإعادة بناء 3D لمعامل الامتصاص الخطي للمادة الموجودة في كل فوكسل. ثم يمكن تحقيق المعلومات الهيكلية الكمية على مستوى الخلايا الكاملة التي يصل سمكها إلى 10 ميكرومتر بهذه الطريقة ، مع إنتاجية عالية ودقة مكانية تصل إلى 25-30 نانومتر نصف الملعب. أثبتت Cryo-SXT أنها ذات صلة بالأبحاث الطبية الحيوية الحالية ، حيث توفر معلومات 3D عن عمليات العدوى الخلوية (الفيروسات أو البكتيريا أو الطفيليات) ، والتغيرات المورفولوجية بسبب الأمراض (مثل الأمراض الوراثية المتنحية) وتساعدنا على فهم عمل الدواء على المستوى الخلوي ، أو تحديد مواقع هياكل محددة في البيئة الخلوية ثلاثية الأبعاد. بالإضافة إلى ذلك ، من خلال الاستفادة من الطول الموجي القابل للضبط في مرافق السنكروترون ، يمكن أيضا استخدام المجهر الطيفي أو نظيره 3D ، التصوير الطيفي المقطعي ، لتصوير وتحديد عناصر محددة في الخلية ، مثل الكالسيوم في عمليات التمعدن الحيوي. يوفر Cryo-SXT معلومات تكميلية لتقنيات التصوير البيولوجي الأخرى مثل المجهر الإلكتروني أو تألق الأشعة السينية أو تألق الضوء المرئي ، ويستخدم بشكل عام كطريقة شريكة للتصوير المرتبط 2D أو 3D في الظروف المبردة من أجل ربط الوظيفة والموقع والمورفولوجيا.
Introduction
يمكن أن يلعب Cryo-SXT دورا مركزيا في أبحاث التصوير البيولوجي لأنه يوفر 3D متوسطة الدقة (25-30 نانومتر نصف الملعب) أحجام من الخلايا الكاملة المائية1،2،3،4،5،6. في نطاق طاقة نافذة الماء ، بين الكربون وامتصاص الأكسجين K حواف (4.4-2.3 نانومتر) ، تمتص الهياكل الخلوية الغنية بالكربون 10 مرات أكثر من الوسط الغني بالأكسجين الذي يتخلل ويحيط بها. في نطاق الطاقة هذا ، يمكن تصوير الخلايا المزججة التي يصل سمكها إلى 10 ميكرومتر دون الحاجة إلى التقسيم أو التلطيخ ، مما يؤدي إلى إسقاطات تباين كمية عالية الامتصاص ، والتي ، جنبا إلى جنب مع قدرات دوران العينة ، تسمح بإعادة البناء المقطعي للبنية الخلوية. يملأ Cryo-SXT مكانة من حيث أبعاد العينات والدقة المكانية التي لا يمكن الوصول إليها بسهولة بواسطة أي تقنية تصوير أخرى.
باختصار ، يكون تباين امتصاص cryo-SXT كميا ، حيث أن توهين الفوتونات من خلال عينة السماكة t يطيع قانون Beer-Lambert على النحو التالي: 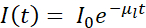 ، حيث يمثل I0 شدة الحادث μl معامل الامتصاص الخطي ، والذي يعتمد على الطول الموجي λ والجزء التخيلي β من معامل الانكسار للعينة (
، حيث يمثل I0 شدة الحادث μl معامل الامتصاص الخطي ، والذي يعتمد على الطول الموجي λ والجزء التخيلي β من معامل الانكسار للعينة (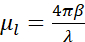 ). التوهين هو دالة للتركيب الكيميائي الحيوي وسماكة الهياكل التي يتم تصويرها ، مع كل مكون كيميائي حيوي له معامل امتصاص خطي محدد للأشعة السينية μلتر (LAC). وهذا يعني أن كل قيمة فوكسل التصوير المقطعي تعتمد على العناصر الكيميائية وتركيزها في فوكسل7. هذا يسمح بالتمييز الطبيعي للعضيات المختلفة مثل النوى أو النواة أو الأجسام الدهنية أو الميتوكوندريا ، أو حالات الضغط المختلفة للكروماتين فقط بناء على قيم LAC المتأصلة التي أعيد بناؤها2،8،9.
). التوهين هو دالة للتركيب الكيميائي الحيوي وسماكة الهياكل التي يتم تصويرها ، مع كل مكون كيميائي حيوي له معامل امتصاص خطي محدد للأشعة السينية μلتر (LAC). وهذا يعني أن كل قيمة فوكسل التصوير المقطعي تعتمد على العناصر الكيميائية وتركيزها في فوكسل7. هذا يسمح بالتمييز الطبيعي للعضيات المختلفة مثل النوى أو النواة أو الأجسام الدهنية أو الميتوكوندريا ، أو حالات الضغط المختلفة للكروماتين فقط بناء على قيم LAC المتأصلة التي أعيد بناؤها2،8،9.
بالإضافة إلى ذلك ، فإن cryo-SXT هي تقنية عالية الإنتاجية مع جمع الصور المقطعية في بضع دقائق. وهذا يتيح على وجه التحديد التصوير المتوسط النطاق لمجموعات الخلايا التي يمكن التقاطها في نقاط زمنية رئيسية مثل الانقسام والتمايز وموت الخلايا المبرمج ، ولكن أيضا في حالات استجابة مختلفة مثل تلك الناجمة عن التعرض الكيميائي لعلاجات دوائية محددة أو للعدوى المسببة للأمراض. البيانات التي تم جمعها في تلك النقاط الرئيسية سوف تقدم وصفا 3D للنظام مع سجل أمين للتنظيم المكاني للعضيات الخلوية المختلفة في تلك اللحظات المحددة.
عادة ، يتم استخدام cryo-SXT بالاشتراك مع تقنيات أخرى تتبع النهج المترابطة التي تسمح بتحديد موقع ميزات أو أحداث أو جزيئات كبيرة محددة داخل البيئة الخلوية ثلاثية الأبعاد4،10،11،12،13،14،15،16 ، أو بيانات تألق الأشعة السينية الصلبة17،18 . النهج المترابطة في الظروف المبردة لها أهمية قصوى من أجل الحصول على الصورة الأكثر اكتمالا وقيمة لنظام الاهتمام. يتم رسم ملخص موجز لسير العمل النموذجي في خطوط الحزم المبردة Mistral (Alba) و B24 (Diamond) في الشكل 1.
وعلاوة على ذلك، وبالاستفادة من قدرة ضبط الطول الموجي في مرافق السنكروترون، يمكن الحصول على المعلومات الطيفية بالإضافة إلى المعلومات الهيكلية باستخدام الامتصاص التفاضلي المحدد لعناصر معينة واردة في العينة. مثال على ذلك هو موقع الكالسيوم في دراسة عمليات التمعدن الحيوي في الخلايا19،20،21. من خلال التقاط صور 2D في طاقات فوتونية مختلفة (أطياف) أو صور مقطعية أدناه وعند حافة امتصاص الأشعة السينية المثيرة للاهتمام ، يمكن تحديد وحدات البكسل أو voxels التي تحتوي على العنصر المحدد. تسمح الأطياف أيضا بالتمييز بين الحالات الكيميائية (أي تطور الكالسيوم غير المتبلور إلى هيدروكسيباتيت كما في مثال التمعدن الحيوي السابق20). القياس الكمي للعناصر المختلفة ممكن في 2D و 3D. عادة ما يتم التصوير الطيفي للخلايا المزججة في نافذة الماء ، ولكنه ممكن أيضا في نطاقات الطاقة الأخرى إذا كان محتوى الماء منخفضا بما فيه الكفاية أو إذا تم استخدام بروتوكولات تحضير العينات الأخرى ، بما في ذلك الجفاف ،22. إن بروتوكول التحليل الطيفي المفصل خطوة بخطوة يتجاوز تركيز البروتوكول الوارد هنا.
في ما يلي ، يركز البروتوكول على تلخيص موجز لخطوات إعداد العينات الرئيسية ، على الرغم من أن كل نظام قد يحتاج إلى تحسين فردي ، يليه إجراء مفصل لجمع البيانات خطوة بخطوة للتصوير المقطعي بالأشعة السينية الناعمة بالتبريد.
Protocol
1. إعداد العينات
- إعداد دعم الشبكة
- قم بتشعيع الشبكات بالأشعة فوق البنفسجية لمدة 3 ساعات مع توجيه فيلم الكربون لأعلى للتعقيم.
- اختياري: في حالة وجود مشاكل في عدم توصيل الخلايا بالشبكة، اتبع إحدى الخطوات التالية.
- قم بتحسين رقائق دعم الكربون عن طريق المعالجة البلازمية للشبكات لزيادة انتشار العينة وتحسين التصاق الخلايا.
- ضع شبكات الكربون جانبا في معدات غرفة تفريغ التوهج وقم بتعريض الشبكة للبلازما لمدة 30 ثانية إلى 15 دقيقة (باستخدام Ar و / أو O2) اعتمادا على المعدات.
- تشغيل الشبكات باستخدام بولي-إل-ليسين (PLL)
- أضف قطرات فردية من 60 ميكرولتر PLL في طبق بتري وضع الشبكة أعلى قطرة PLL مع توجيه فيلم الكربون لأسفل. احتضن لمدة 30 دقيقة عند 37 درجة مئوية ولطخ PLL باستخدام ورقة ترشيح.
- قم بتشغيل الشبكات باستخدام مصل البقر الجنيني (FBS).
- اغمر الشبكات في FBS بين عشية وضحاها. اغمس الشبكات في محلول مخزن مؤقت لغسلها واترك الشبكة على ورقة تصفية لإزالة السائل الزائد.
- قم بتحسين رقائق دعم الكربون عن طريق المعالجة البلازمية للشبكات لزيادة انتشار العينة وتحسين التصاق الخلايا.
- تزايد الخلايا الملتصقة على الشبكات
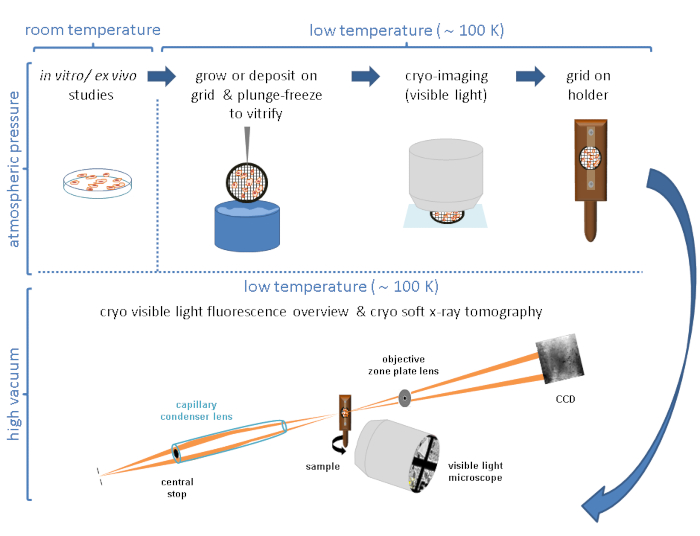
- تنمو الخلايا في طبق زراعة الخلايا من 100 ملم للوصول إلى 80٪ -90٪ التقاء (الشكل 2A).
- البذور 1-5 × 105 خلايا / مل (ضبط القيمة على النظام) فوق شبكات الاتحاد الأفريقي في طبق P60 Petri (إجمالي 3 مل).
ملاحظه: يجب أن تتم إضافة تعليق الخلية بعناية فائقة مع فيلم الكربون للشبكة المواجه لأعلى في طبق زراعة الخلايا من 60 ملم. قم بإعداد عدة شبكات لكل حالة ، شرط واحد لكل طبق P60 Petri (الشكل 2B). - اسمح للخلايا بالاستقرار حتى يصل الالتقاء على الشبكة إلى عدة خلايا (من 1 إلى 10 اعتمادا على حجم الخلية) في كل مربع شبكي (اعتمادا على خط الخلية ، قد يستغرق ذلك ما يصل إلى 24 ساعة).
ملاحظه: قبل التجمد ، يجب فحص الشبكات باستخدام مجهر الضوء المرئي (VLM) ، وتقييم سلامة فيلم الكربون وكذلك التقاء الخلايا في كل شبكة (الشكل 2C). انتظر حتى يتم الوصول إلى كثافة الخلايا المناسبة على الشبكة. إذا كانت الشبكة ملتقية للغاية أو تم كسر رقائق الكربون ، فابدأ من جديد.
- ترسب الخلايا في التعليق على الشبكات
- اختر شبكة Au أو Cu محضرة باستخدام الملقط من الفريزر المغطس (انظر القسم 1.6).
- قم بإعداد تعليق خلوي 1-5 × 105 (امتصاص الكثافة البصرية 0.3 في حالة البكتيريا) وإضافة 4 ميكرولتر من التعليق المحضر إلى الشبكة.
- احتضن الشبكة مع الانخفاض لبضع دقائق أفقيا للسماح بترسب الخلايا ثم ضع الملقط الذي يحمل الشبكة داخل غرفة التزجيج التي يتم التحكم فيها بالمناخ والتي تم ضبطها على ظروف درجة الحرارة والرطوبة المناسبة (الخطوة 1.6.1).
- اختياري: وضع علامات الفلورسنت على العينات
ملاحظه: قد يكون من المفيد تسمية بعض عضيات العينة بالفلورسنت. اعتمادا على الاهتمام ، يمكن استخدام فلوروفورات أو خلايا محددة تعبر بثبات عن بروتين فلورسنت أو منقولة للتعبير العابر عن بروتين ذي أهمية. وهذا يسمح بسهولة الكشف عن الخلايا باستخدام المجهر المجهري البري الفلوري ويساعد في العثور على الخلايا ذات الأهمية للتصوير بالأشعة السينية اللاحقة. في ما يلي ، يفصل البروتوكول فقط استخدام الفلوروفورات.- قم بإعداد حل عملي للفلوروفور (انظر توصية الشركة المصنعة) واتبع البروتوكول المحدد.
- يضاف الفلوروفور إلى طبق بتري الذي يحتوي على الشبكات ويخلط بلطف.
- اتركيه للاحتضان في بيئة مظلمة وانتقل مباشرة إلى الخطوة 1.6 بعد الانتهاء من الحضانة.
ملاحظة: من المهم أن تكون مستعدا للتزجيج بمجرد الانتهاء من الحضانة لتجنب وضع علامات غير محددة وبالتالي عدم وضوح إشارة الفلورسنت.
- إعداد الجسيمات النانوية Au (NPs) لمحاذاة إسقاط التصوير المقطعي
- خذ أليكوت واحد من 1mL من محلول المخزون الائتماني Au (100 نانومتر في Mistral أو 250 نانومتر عند B24) وأجهزة الطرد المركزي بسرعة منخفضة (لتجنب التجميع) لمدة دقيقة واحدة للسماح ل NPs بالتكوير.
ملاحظه: إذا كان ذلك ممكنا ، يفضل ترك fiducials لتستقر بشكل طبيعي بين عشية وضحاها أو أكثر ، لتجنب التجميع. - إزالة supernatant. مباشرة قبل التجميد ، أعد تعليق NPs في محلول متوسط أو مخزن مؤقت خال من المصل 20 ميكرولتر للحصول على محلول متجانس.
ملاحظه: يوصى بالصوتنة والدوامة للمساعدة في تجانس المحلول.
- خذ أليكوت واحد من 1mL من محلول المخزون الائتماني Au (100 نانومتر في Mistral أو 250 نانومتر عند B24) وأجهزة الطرد المركزي بسرعة منخفضة (لتجنب التجميع) لمدة دقيقة واحدة للسماح ل NPs بالتكوير.
- شبكات الغطس والتجميد
تنبيه: يمكن أن يسبب النيتروجين السائل حروقا باردة ويجب ارتداء معدات الحماية المناسبة (معطف المختبر الطويل ونظارات السلامة والقفازات والسراويل الطويلة والأحذية المغلقة). الإيثان شديد الانفجار ويجب أن يبقى بعيدا عن أي شرر أو نار مفتوحة.- اتبع تعليمات الشركة المصنعة لإعداد واستخدام أداة الغطس في الفريزر.
ملاحظه: عادة ما يتم تعيين الرطوبة إلى 80 ٪ -90 ٪ ؛ تعتمد درجة الحرارة على نوع الخلية (الخميرة 30 درجة مئوية كحد أقصى ، خلايا الثدييات 37 درجة مئوية ، خلايا الحشرات 28 درجة مئوية ، إلخ). - خذ شبكة مع ملاقط التثبيت من طبق بتري بجانب الحافة ، مع الحرص الشديد على عدم ثني الشبكة وتركيبها على جهاز التجميد الغطس. تأكد من أن الخلايا تواجه بعيدا عن ورقة النشاف.
- اختياري: اغسل الشبكة ثلاث مرات في المخزن المؤقت في حالة الخلايا الملتصقة.
- أضف 1.5 ميكرولتر من Fiducials Au NP أعلى الخلايا (من خلال الفتحة الموجودة على الجانب الأيمن من الغرفة) واتركها لتستقر لمدة 30 ثانية قبل النشاف وإغراق الشبكة.
ملاحظه: في حالة الخلايا المعلقة ، أضف fiducials Au NP إلى الشبكة بينما لا تزال في الوضع الأفقي قبل تركيب الملقط واتركها تستقر لمدة 30 ثانية. يعد اللطخ أمرا بالغ الأهمية للشبكات عالية الجودة. يجب معايرة مسافة اللطخة قبل البدء ؛ تسطيح ورق النشاف مهم للنشاف القابل للتكرار (اتبع تعليمات الشركة المصنعة). يجب تقييم وقت اللطخ لكل نوع من أنواع الخلايا. - قم بإعداد عدة شبكات لكل حالة. انقل الشبكة وخزنها في درجات حرارة مبردة للحفاظ على التزجيج.
- اتبع تعليمات الشركة المصنعة لإعداد واستخدام أداة الغطس في الفريزر.
- شبكات الفحص باستخدام المجهر الضوئي المرئي المبرد
- انقل الشبكات الموجودة تحت النيتروجين السائل من صناديق التبريد إلى كاسيت تبريد قياسي (ثلاثة مواضع لشبكات TEM مقاس 3 مم) داخل مرحلة تبريد مبردة مسبقا (انظر التعليمات من الشركة المصنعة).
- يتم وضع كاسيت التبريد على جسر مرحلة التبريد ويتم تركيب مرحلة التبريد على مجهر ضوئي واسع المجال فوق الفلوري.
- قم بتصوير الشبكات عند -196.5 درجة مئوية باستخدام هدف مسافة عمل طويلة (10x ، 50x ، 100x) من أجل تحديد موقع الخلايا المناسبة لتصوير cryo-SXT وتقييم جودة الشبكة (وجود جليد سميك ، وسلامة فيلم دعم الكربون ، ووجود إشارة الفلورسنت ، وما إلى ذلك).
- توطين الخلايا ذات الأهمية باستخدام حقل مشرق و / أو التصوير الفلوري.
ملاحظة: في هذه المرحلة، التقط الصور في حالة وجود كاميرا مرتبطة على المجهر. استخدمه لربط الصورة. - بعد الفحص ، أعد الشبكات إلى صناديق التبريد في dewar.
ملاحظه: إذا لم يتم العثور على عينات جيدة، كرر خطوات إعداد العينة التي تعدل أيا من المعلمات. عادة ما تكون المعلمات التي تتطلب التعديل هي وقت النشاف ، في حالة كون الجليد سميكا جدا أو التقاء ، إذا كان هناك عدد كبير جدا من الخلايا لكل مربع شبكة.
2. التحميل في مجهر الأشعة السينية الناقل (TXM)
- قم بتبريد غرفة النقل بالنيتروجين السائل حتى تصل إلى <100 كلفن ، وقم بتبريد محطة العمل (الشكل 3A) وقم بتشغيل سخان حافة محطة العمل. انتظر حتى يتوقف عن الغليان.
- ضع صناديق التبريد اللازمة التي تحتوي على شبكات في المواقع المقابلة في محطة العمل (الشكل 3A). انتبه إلى نقلها بأمان في ظل ظروف التبريد.
- تحميل الشبكات المحددة في حاملات العينات التي تم تبريدها مسبقا (الشكل 3B) ؛ قم بتحميل الحاملات على المكوك وحمايتها بالأغطية (الشكل 3C).
- قم بتحميل المكوك في غرفة النقل عند <100 كلفن وضخه إلى فراغ منخفض (الشكل 3D).
- قم بتوصيل غرفة النقل ب TXM (الشكل 4A) وقم بتحميل المكوك من غرفة النقل إلى TXM بعد إجراء التفريغ على الشاشة (الشكل 4B).
- بمجرد أن يكون المكوك في الداخل مع العينات ، يمكن لذراع الروبوت TXM إحضار حامل عينة واحد في كل مرة إلى مرحلة العينة (الشكل 4C).
3. التصوير باستخدام برنامج TXM
ملاحظة: يتم تصوير الشبكات في مرحلة العينة أولا باستخدام مجهر الضوء المرئي عبر الإنترنت (VLM) لتعيين الشبكة إما في وضع الحقل الساطع و/أو التألق قبل تصويرها بالأشعة السينية. استخدم أيقونة عصا التحكم المقابلة لعلامة التبويب التحكم في الحركة في اللوحة العلوية اليمنى لفتح التحكم في الحركة .
- تصوير الشبكة باستخدام VLM عبر الإنترنت.
- اقتناء فسيفساء الحقل المشرق
- حدد كاميرا VLM (عدسة مكبرة > VLM) وقم بتشغيل مصدر VLM LED للتصوير الميداني الساطع (المجهر > اقتناء > إعدادات الاستحواذ > إعدادات المصدر وحدد الإرسال).
- قم بتدوير العينة إلى -60 درجة من أجل مواجهة هدف VLM (التحكم في الحركة > العينة > العينة θ) ونقل العينة إلى المواضع المركزية المتوقعة (التحكم في الحركة > العينة وتغيير العينة X ، العينة Y).
- أثناء الحصول على الصور في خطوات من 20 إلى 50 ميكرومتر أولا لجعل الشبكة في بؤرة التركيز تقريبا (المجهر > اكتساب > إعدادات الاستحواذ > أوضاع الاستحواذ > بدء > المستمر ؛ التحكم في الحركة > العينة وتغيير العينة Z).
- قم بتحسين التركيز البؤري بخطوات أصغر إلى 5 ميكرومتر حتى تصبح الخلايا و / أو ثقوب فيلم دعم الكربون في بؤرة التركيز (المجهر > اقتناء > إعدادات الاستحواذ > أوضاع الاستحواذ > بدء > المستمر ؛ التحكم في الحركة > العينة وتغيير العينة Z) والبدء في الحصول على خريطة فسيفساء كاملة للشبكة في وضع المجال الساطع. استخدم القيم الافتراضية للفسيفساء. (المجهر > الاستحواذ > إعدادات الاستحواذ > أوضاع الاستحواذ > > الفسيفساء البدء).
ملاحظه: خريطة الفسيفساء مصنوعة من صور واحدة. يجب تعيين عدد الصور (عدد الأعمدة والصفوف وحجم الخطوة في X و Y) لتصور الشبكة بأكملها. يعتمد حجم الخطوة على حجم مجال الرؤية (FoV). يتم استخدام القيم الافتراضية هنا. إذا لم تكن الشبكة متمركزة بشكل جيد في مستوى X-Y فيما يتعلق بالفسيفساء الكاملة FoV ، فأوقف عملية الاستحواذ ، وقم بتصحيح إحداثيات العينة X و Y وكرر عملية الاستحواذ.
- اكتساب الفسيفساء وضع التألق
- قم بإيقاف تشغيل المصدر الذي يقوده VLM للتصوير الميداني الساطع (إعدادات اكتساب > المجهر > > إعدادات المصدر وإلغاء تحديد الإرسال) وحدد مصدر ضوء LED المقابل للطول الموجي للإثارة المطلوب (أحمر أو أخضر أو أزرق) والمرشح البصري المقابل يدويا عند الإعداد.
- تحسين التركيز على صورة التألق (المجهر > اكتساب > إعدادات الاستحواذ > أوضاع الاستحواذ > بدء > المستمر ؛ التحكم في الحركة > العينة وتغيير العينة Z)، ثم الحصول على خريطة فسيفساء تحتفظ بالمعلمات الموضعية (X و Y) من فسيفساء المجال الساطع (المجهر > اقتناء > إعدادات الاستحواذ > أوضاع الاستحواذ > > الفسيفساء البدء).
- إيقاف تشغيل مصدر ضوء LED
- اختياري: استنادا إلى خرائط فسيفساء المجال الساطع والتألق، قم بالتعليق التوضيحي على مناطق الاهتمام (ROI) المحددة مسبقا (الخطوة 1.7.4) أو عائد الاستثمار الجديد (مواضع X-Y في الصورة).
- اقتناء فسيفساء الحقل المشرق
- اكتساب فسيفساء الأشعة السينية
- حدد كاشف الأشعة السينية CCD (عدسة مكبرة > حدد Pixis) ، واجلب العينة إلى دوران 0 درجة (التحكم في الحركة > العينة وتغيير العينة θ) وانقل بصريات الأشعة السينية (المكثف ولوحة المنطقة) إلى المواضع المحاذاة (التحكم في الحركة > المكثف > تغيير المكثف z ؛ التحكم في الحركة > لوحة المنطقة وتغيير لوحة المنطقة Z).
ملاحظه: قم بتبريد شريحة CCD إلى -65 درجة مئوية قبل التصوير (المجهر > درجة حرارة الكاميرا > Pixis وتغيير درجة الحرارة المحددة إلى -65 درجة مئوية وانقر فوق تطبيق). - انقل العينة إلى وسط المربع الشبكي لأحد عائد الاستثمار المحدد (التحكم في الحركة > العينة وقم بتغيير العينة X، العينة Y).
- استخدم binning 2 وشق الخروج عند 5 ميكرومتر لتقليل التشعيع والتعرض ل 1 ثانية في ميسترال ، وربط 1 و 60 ميكرومتر في B24 ، وضبط التركيز باستخدام ترجمة العينة Z (المجهر > الحصول على > إعدادات الاقتناء > إعدادات الكاميرا وتغيير الربط ؛ التحكم في الحركة > XS وتغيير XS ؛ المجهر > الاستحواذ > إعدادات الاستحواذ> أوضاع الاستحواذ > بدء > المستمر؛ التحكم في الحركة > العينة وتغيير العينة Z). ابدأ بخطوات 5 ميكرومتر وقم بصقلها إلى خطوات 0.5 ميكرومتر ، حتى تصبح الخلية أو ثقوب رقائق الكربون في بؤرة التركيز.
- احصل على خريطة فسيفساء لمربع الشبكة (إعدادات اكتساب > المجهر > > وضع الاستحواذ > بدء > الفسيفساء).
ملاحظه: يمكن تحديد معلمات اكتساب الفسيفساء بنفس الطريقة التي يتم بها تحديد فسيفساء VLM (القسم 3.1.1.4). يعتمد حجم الخطوة على التكبير المحدد مسبقا من قبل موظفي خط الحزمة. - انقل العينة إلى موضع حقل مسطح (FF) (منطقة فارغة داخل الشبكة، ويفضل أن تكون هناك ثقب في دعم الكربون) (التحكم في الحركة > العينة وتغيير العينة X، العينة Y).
- اضبط وقت التعريض الضوئي على 1 ثانية في ميسترال و 0.5 ثانية في B24 (إعدادات اكتساب > > المجهر > إعدادات الكاميرا وتغيير وقت التعريض الضوئي) واحصل على صورة واحدة (أوضاع اكتساب > اكتساب > المجهر > بدء تشغيل > واحد).
- تطبيع (تقسيم) الفسيفساء المكتسبة بواسطة صورة FF للحصول على الإرسال (بقيم تتراوح بين 0 و 1) وحفظ الفسيفساء العادية (انقر فوق أيقونة الزاوية العلوية اليمنى الأولى على الجانب الأيمن من الصورة لفتح القائمة>اختر علامة التبويب مرجع> انقر فوق مرجع واحد وتصفح FF المحدد).
- حدد كاشف الأشعة السينية CCD (عدسة مكبرة > حدد Pixis) ، واجلب العينة إلى دوران 0 درجة (التحكم في الحركة > العينة وتغيير العينة θ) وانقل بصريات الأشعة السينية (المكثف ولوحة المنطقة) إلى المواضع المحاذاة (التحكم في الحركة > المكثف > تغيير المكثف z ؛ التحكم في الحركة > لوحة المنطقة وتغيير لوحة المنطقة Z).
- الاستعداد لجمع سلسلة إمالة الأشعة السينية
ملاحظه: أوجد محور الدوران لكل منطقة ذات أهمية يتم تصويرها.- قم بعمل مجموعة مختارة من المناطق داخل الفسيفساء لإجراء التصوير المقطعي ، أي عن طريق وضع شكل مربع (انقر فوق أداة على الجانب الأيسر من نافذة الصورة) بحجم FoV في خريطة فسيفساء الأشعة السينية.
ملاحظه: عند اختيار المناطق ، ضع في اعتبارك المسافة من الحدود (≥10 ميكرومتر) والخلايا الأخرى ، لتجنب تداخل الخلايا أثناء الدوران. بالإضافة إلى ذلك ، تحقق من حالة الخلية (شكل الخلية المتوقع ، سمك الجليد ، نجاح التزجيج ، الانتشار الائتماني ، إلخ). - محاذاة العينة على محور الدوران
ملاحظه: الإجراء المبلغ عنه متكرر. يتقارب التكرار بشكل أسرع باستخدام زوايا ± 60 درجة كأقصى زوايا دوران (θM). إذا لم يكن من الممكن الوصول إليها ، فاستخدم زوايا أقرب ما يمكن إلى ± 60 درجة.- اضبط الكاميرا على binning 2 ، وقت التعرض 1 ثانية (المجهر > اكتساب > إعدادات الاستحواذ > إعدادات الكاميرا وتغيير وقت التعرض ؛ تغيير Binning ؛ المجهر > الاستحواذ > أوضاع الاستحواذ > بدء > المستمر) ، تعيين شق الخروج إلى 5 ميكرومتر.
ملاحظه: قلل الجرعة قدر الإمكان من خلال العمل مع الحد الأدنى من فتحة الخروج. - مع الدوران عند 0 درجة ، انتقل إلى المنطقة المحددة مسبقا باستخدام ترجمة العينة X والعينة Y وركز على ميزة الخلية لوضعها في محور الدوران باستخدام ترجمة العينة Z (التحكم في الحركة > العينة وتغيير العينة x ؛ عينة ذ; عينة ض).
- قم بتدوير العينة إلى + θM (التحكم في الحركة > العينة وقم بتغيير العينة θ) وارسم خطا (L +) (انقر فوق زر أداة الخط على الجانب الأيمن من نافذة الصورة) على ميزة الخلية لوضعها على محور الدوران.
- قم بالتدوير إلى -θM (التحكم في الحركة > العينة وتغيير العينة θ) وارسم خطا (L-) (انقر فوق زر أداة الخط على الجانب الأيمن من نافذة الصورة) على ميزة الخلية التي تريد وضعها على محور الدوران.
- أثناء وجودك عند +θ M أو -θM، استخدم ترجمة العينة Z لنقل الميزة المحددة إلى موضع المركز بين الخطين (التحكم في الحركة > العينة وتغيير العينة Z).
- كرر الإجراء من الخطوة 3.3.2.3 بشكل متكرر حتى يتم الوصول إلى الحد الأدنى للمسافة L+ إلى L- .
ملاحظه: يجب أن تكون المسافة بين الخطين L+ و L- أصغر فيما يتعلق بالتكرار السابق. - في العينة θ = 0 (التحكم في الحركة > العينة وتغيير العينة θ)، حرك العينة X ضعف المسافة اللازمة لوضع الميزة المحددة في وسط كلا الخطين (التحكم في الحركة > العينة وتغيير العينة X). حرك لوحة المنطقة (ZP) X لإعادة الميزة إلى وسط FoV (التحكم في الحركة > ZP وتغيير ZP X). قم بهذه الخطوة مرة واحدة فقط لكل شبكة.
- أعد تحسين موضع ZP Z فيما يتعلق بمحور الدوران الجديد عن طريق تسجيل سلسلة بؤرية ZP Z (مجموعات من الصور في مواضع ZP Z مختلفة ، عادة في خطوات 0.3 ميكرومتر) (إعدادات اكتساب > المجهر > الاكتساب > أوضاع الاقتناء > السلسلة البؤرية > البدء) ونقل ZP Z إلى الموضع الذي تكون فيه العينة في بؤرة التركيز (التحكم في الحركة > لوحة المنطقة وتغيير لوحة المنطقة z).
- قم بتعيين المعلمات الخاصة باكتساب سلسلة الإمالة.
ملاحظه: الحد الأقصى للنطاق الزاوي محدود في نهاية المطاف بالبعد البؤري ل ZP (±70 أو ±65 درجة ل 40 نانومتر أو 25 نانومتر ZP لعينة مسطحة ، على التوالي). تحسين نسبة الإشارة إلى الضوضاء (S/N) والضرر الإشعاعي لتحديد وقت التعرض. بالنسبة للتصوير المقطعي ، استخدم أوقات تعرض مختلفة في نطاقات زاوية مختلفة. - حدد أعلى نطاق زاوي للدوران ، في حالة حدوث التظليل قبل الوصول إلى أقصى زاوية دوران.
- اضبط ربط الكاميرا على 1 (المجهر > الحصول على > إعدادات > إعدادات الكاميرا وتغيير الربط) ، افتح فتحة الخروج إلى 15 ميكرومتر في Mistral (التحكم في الحركة > XS وتغيير XS) واضبط الدوران على 0 درجة (التحكم في الحركة > العينة وتغيير العينة θ).
- احصل على صورة واحدة بزمن تعرض يبلغ 1 ثانية (إعدادات اكتساب > المجهر > > أوضاع الاكتساب > بدء تشغيل > واحد) وتقدير وقت التعرض المطلوب لكل زاوية إمالة للتصوير المقطعي.
- اضبط الكاميرا على binning 2 ، وقت التعرض 1 ثانية (المجهر > اكتساب > إعدادات الاستحواذ > إعدادات الكاميرا وتغيير وقت التعرض ؛ تغيير Binning ؛ المجهر > الاستحواذ > أوضاع الاستحواذ > بدء > المستمر) ، تعيين شق الخروج إلى 5 ميكرومتر.
- قم بعمل مجموعة مختارة من المناطق داخل الفسيفساء لإجراء التصوير المقطعي ، أي عن طريق وضع شكل مربع (انقر فوق أداة على الجانب الأيسر من نافذة الصورة) بحجم FoV في خريطة فسيفساء الأشعة السينية.
- اقتناء التصوير المقطعي
- انتقل إلى الزاوية القصوى السالبة +0.1 (على سبيل المثال، بالنسبة ل ZP 25 نانومتر، انتقل إلى -65.1 درجة) (التحكم في الحركة > العينة وتغيير العينة θ).
- اضبط عدد الصور كإجمالي عدد الزوايا (مع مراعاة الصورة بالزاوية 0) والنطاق الزاوي (المجهر > اكتساب > إعدادات الاكتساب > أوضاع الاكتساب > التصوير المقطعي وتغيير عدد الصور ؛ ثم ، تغيير بداية الزاوية ونهاية الزاوية).
- قم بتعيين وقت التعرض المحدد وابدأ عملية الاستحواذ (المجهر > اكتساب > إعدادات الاستحواذ > إعدادات الكاميرا وتغيير وقت التعرض ثم انقر فوق ابدأ).
- انتقل إلى موضع FF (التحكم في الحركة > العينة وقم بتغيير العينة X ؛ ثم قم بتغيير العينة Y) واحصل على 10 صور FF (المجهر > اكتساب > أوضاع الاكتساب > المتوسط وقم بتغيير عدد الصور ثم انقر فوق ابدأ).
ملاحظه: في ميسترال ، يمكن إجراء الفحص الطيفي أو المجهر المعتمد على الطاقة عند الحصول على الإسقاطات أثناء مسح الطاقة عبر حافة الامتصاص المثيرة للاهتمام. الناتج النهائي هو كومة من الإسقاطات 2D ، والتي ستحتوي على طيف امتصاص الأشعة السينية (XAS) في كل بكسل ، أي الصور التي تحتوي على معلومات كيميائية. التمديد إلى 3D الجمع بين التحليل الطيفي والتصوير المقطعي ممكن من حيث المبدأ. قد تكون الجرعة الإجمالية المطلوبة قيدا ومن ثم يمكن أن تكون هناك حاجة إلى استراتيجيات محددة مثل تصوير الامتصاص التفاضلي.
4. تحليل البيانات
ملاحظة: يتم تحليل جميع البيانات باستخدام البرامج المفتوحة المتاحة والبرامج النصية التي تم تطويرها باستخدام خطوط الأنابيب الآلية.
- في ميسترال
- يقوم Pipeline بتحويل مكدسات التصوير المقطعي من امتداد txrm (امتداد برنامج TXM) إلى hdf5 (تنسيق بيانات هرمية مفتوح المصدر) مع جميع البيانات الوصفية المطلوبة ، ثم يقوم بتطبيع المكدس بواسطة متوسط FF وتيار الماكينة ، وأخيرا يقوم بفك المكدسات بواسطة وظيفة انتشار النقطة المقاسة للنظام البصري لعدسة وطاقة محددة للوحة منطقة فريسنل (ZP)23 ، 24. لإزالة الالتفاف، ابحث عن قيمة k = 1/SNR المناسبة (تعتمد على سمك العينة). بالنسبة للبرنامج النصي الذي تم تطويره في Mistral ، اكتب الأمر: txrm2deconv "إدخال تومو" "إدخال FF" -zp = "ZP المستخدم" - e = " الطاقة " - dx = " حجم البكسل " - k = " 1 / SNR " - t = -1.
- بالنسبة للبرنامج النصي الذي تم تطويره في Mistral للمحاذاة التلقائية ، اكتب الأمر: ctalignxcorr "stack.mrc غير المعقد العادي" "stack.hdf5 العادي".
ملاحظة: يمكن استخدام عدد من التطبيقات البرمجية لمحاذاة الإسقاطات إلى محور دوران مشترك باستخدام ائتمانات Au NP25,26. تتطلب محاذاة الإسقاطات دقة بكسل فرعي. لا يمكن أن تكون المحاذاة التلقائية مرضية إلا عندما تكون ائتمانات Au NP كافية (>7) ومنتشرة بشكل جيد في مجال الرؤية. غالبا ما تكون هناك حاجة إلى محاذاة يدوية خلفية لتصحيح المحاذاة التلقائية لتحقيق أعلى دقة ممكنة. - لإعادة إنشاء المكدس العادي المحاذاة، استخدم أيا من الخوارزميات العديدة المتوفرة.
ملاحظة: يمكن إعادة إنشاء المكدس المحاذاة باستخدام الإسقاط الخلفي المرجح (WBP) أو تقنيات إعادة البناء التكراري المتزامن (SIRT) في بضع دقائق. ومع ذلك ، من أجل الحفاظ على معاملات الامتصاص الخطي (LAC) ، يفضل تقنيات إعادة البناء الجبرية (ART)27. يتطلب ART المزيد من وقت الحوسبة ، لذلك يتم إجراء SIRT28 أولا لإعادة بناء سلسلة إمالة سريعة محاذاة تلقائيا (30 تكرارا في بضع دقائق). بمجرد أن تصبح المحاذاة مرضية ، سيتم استخدام ART.
- في B24
- يقوم خط أنابيب مصمم خصيصا بتحويل ملفات بيانات txrm إلى Tiffs قياسية مع جميع البيانات الوصفية اللازمة ثم يرسلها إلى سير عمل runtomo الدفعي الذي يعالج مجموعات البيانات بثلاث طرق: WBP و SIRT والتصحيح.
النتائج
يمكن أن يكون إعداد عينات ل cryo-SXT أمرا صعبا. حتى داخل نفس شبكة العينة ، من الممكن أن يكون لديك مناطق مثالية ، ومناطق غير مثالية ، كما هو موضح في الشكل 5 ، والذي يوضح مربعين من نفس شبكة مكتشف Au. يجب أن تحتوي العينة المثالية على خلايا مفردة في وسط شبكة مربعة ، مدمجة في طبقة رقيقة من الجليد ومحاطة بعلامات Au fiducial منتشرة جيدا تستخدم لمحاذاة إسقاطات الإمالة قبل إعادة بناء التصوير المقطعي. يوضح الشكل 5A خلية تشبه الخلايا الليفية (NIH 3T3) تتوافق مع العديد من هذه المعايير. تظهر في الشكل 5B شريحة واحدة من إعادة بناء ثلاثية الأبعاد باستخدام ART27 من المنطقة التي تحمل علامة المربع الأحمر الذي يشير إلى مجال الرؤية (FoV). يمكن تمييز العديد من العضيات المختلفة مثل الميتوكوندريا (M) والشبكة الإندوبلازمية (ER) والحويصلات (V) والنواة (N) بفضل إعادة البناء الكمي ل LACs. بالإضافة إلى ذلك ، فإن نسبة الإشارة إلى الضوضاء في إعادة الإعمار عالية جدا مما يسمح بتحقيق تباين عال في الميزات الخلوية. من ناحية أخرى ، يوضح الشكل 5C مربعا بكثافة خلايا أعلى. ولهذا السبب ، عادة ما يكون النشاف أقل كفاءة ، مما يؤدي إلى طبقة جليدية أكثر سمكا ، أو حتى مشاكل التزجيج. في بعض الحالات ، يمكن ملاحظة ذلك بالفعل عند فحص الشبكة باستخدام رسم خرائط epifluorescence قبل التصوير بالأشعة السينية ، ويجب تجنب هذه الشبكات بأي ثمن. في الشكل 5C ، يمكن ملاحظة وجود صدع داخل الشبكة والجليد المزجج يمر عبر مربع الشبكة بأكمله (المميز بالأسهم الحمراء). يجب تجنب أي تصوير بالقرب من الشقوق بسبب عدم الاستقرار المحتمل للشبكة عند تعرضها للشعاع. بالإضافة إلى ذلك ، يمكن أن تكون الشقوق علامة على الجليد السميك ، كما كان الحال في هذا المجال. تم تسجيل سلسلة إمالة في المنطقة التي تحمل علامة المربع الأحمر. في الشكل 5D ، يتم عرض شريحة واحدة من إعادة الإعمار 3D المقابلة. على الرغم من أنه يمكن التعرف على بعض الهياكل الكبيرة ، إلا أن التفاصيل الدقيقة تضيع داخل الضوضاء والملمس المحبب بسبب ضعف جودة التزجيج للجليد السميك ، كما يمكن رؤيته على وجه التحديد ، على سبيل المثال ، على الميتوكوندريا العليا التي أشار إليها السهم.
الشكل 1: سير العمل. تم اتباع سير العمل التخطيطي قبل جمع بيانات cryo-SXT. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
الشكل 2: الخلايا النامية على الشبكات . (أ) الخلايا التي تنمو في طبق بتري P100 مع التقاء حوالي 80٪ -90٪. (ب) طبق بتري P60 مع عدة شبكات بعد بذر الخلايا. (ج) الخلايا التي تنمو فوق الشبكة بعد 24 ساعة. أشرطة المقياس: 100 ميكرومتر. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 3: شبكات التحميل على حاملات العينات وفي غرفة النقل . (أ) محطة عمل مملوءة بالنيتروجين السائل مع المكوك وصناديق التبريد الجاهزة لتحميل الشبكات. (ب) إدخال حامل العينة في اللودر مع تحميل الشبكة. (ج) مكوك مع حامل العينة في الموضع 3 بدون الغطاء. (د) محطة عمل مرفقة بغرفة النقل. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 4: تحميل العينات في TXM (A) إرفاق غرفة النقل ب TXM. (ب) مكوك داخل TXM. (ج) ذراع الروبوت TXM إدخال حامل العينة في مرحلة العينة. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
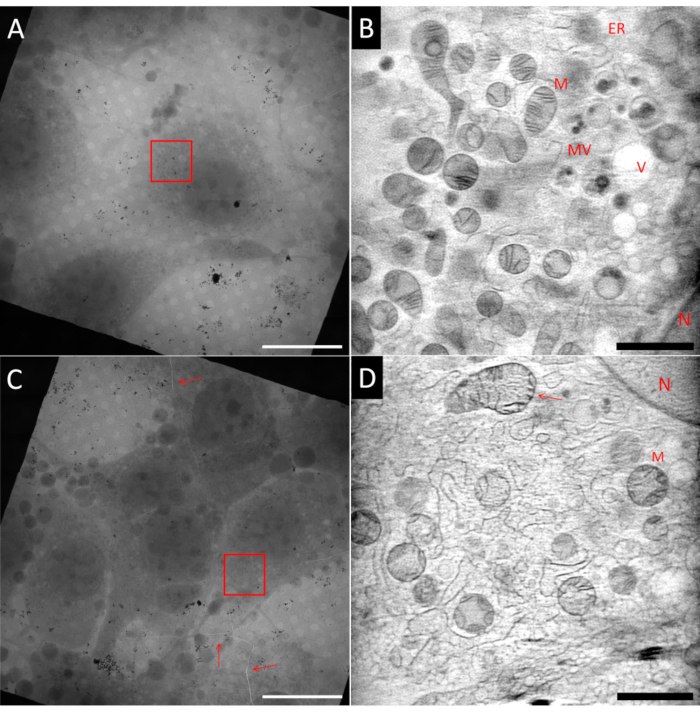
الشكل 5: مثال على التصوير المقطعي بالأشعة السينية الناعمة بالتبريد. الصف العلوي: عينة مثالية ، (A) عرض فسيفساء 2D لمربع شبكة يظهر خلية معزولة في المركز. (ب) شريحة واحدة من وحدة تخزين 3D المعاد بناؤها تظهر المنطقة المحددة مع المربع الأحمر (A). بالمقارنة مع (D) ، تكون الصورة أكثر سلاسة وتظهر المزيد من التفاصيل. الصف السفلي: عينات غير مثالية ، (C) عرض فسيفساء 2D لمربع شبكة يظهر التقاء خلوي مرتفع جدا وتشققات في الجليد ورقائق الشبكة (الأسهم الحمراء). (D) شريحة واحدة من وحدة التخزين 3D المعاد بناؤها تظهر المنطقة التي تحمل علامة المربع الأحمر في (C). يمكن تحديد التزجيج الضعيف أو دون المستوى الأمثل من خلال الملمس المحبب للصورة. N: النواة. م: ميتوكوندريا. ER: الشبكة الإندوبلازمية. MV: الأجسام متعددة الحويصلات ؛ خامسا: فراغ. أشرطة المقياس: A & C 20 ميكرومتر; B & D 2 μm.Vيرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
Discussion
يعد تحضير العينة خطوة حاسمة للحصول على صور مقطعية ناعمة عالية الجودة بالأشعة السينية ، حيث تعتمد جودتها بشكل مباشر على جودة تزجيج العينة وسماكة طبقة الجليد التي يتم تضمين الخلية فيها. سيتم جمع الإسقاطات ذات نسبة الإشارة إلى الضوضاء العالية في المناطق ذات الطبقة الجليدية الرقيقة ، مما يسمح بتقليل جرعة الإشعاع المطلوبة لتحقيق أعلى دقة ممكنة. بالإضافة إلى ذلك ، سيؤثر التقاء الخلايا أيضا على جودة التصوير المقطعي النهائي ، حيث يجب على المرء تجنب دخول الخلايا المجاورة إلى FoV عند الدوران. أخيرا ، سيحدد التشتت الصحيح للعلامات الائتمانية Au دقة محاذاة الإسقاط ثم يحدد في النهاية جودة الحجم النهائي 3D المعاد بناؤه. لاحظ أن الانتشار السليم لائتمانات Au على الشبكة يمكن من أتمتة خطوة محاذاة الإسقاط ، والتي بدونها تكون هناك حاجة إلى خبرة عالية لمثل هذه الخطوة الحرجة.
يصور البروتوكول الوارد هنا استراتيجية واحدة ممكنة لإعداد العينات فقط، والتي لها أوجه تشابه مع تلك المستخدمة في التصوير المقطعي الإلكتروني بالتبريد (cryo-ET). وفي كلتا الحالتين، ستكون البروتوكولات التي تحسن إعداد العينات المطلوبة من أجل تحسين قابلية الاستنساخ أساسية لنجاح هذه التقنيات، وتبذل الجهود لتحقيق هذا الهدف29. تجدر الإشارة إلى أنه بالإضافة إلى تصوير الخلايا المعزولة ، يمكن أيضا تصور أجزاء من الأنسجة بشرط أن تكون إشارة الإرسال عبر القسم كافية بزوايا إمالة عالية. عادة ، سيعني هذا أجزاء من عدد قليل من الميكرونات (أقل من 10 ميكرومتر).
لتصوير بنية أو حدث معين داخل خلية ، يحتاج المرء إلى التأكد من أن هذه الميزة المحددة موجودة داخل FoV لسلسلة الإمالة. نظرا لأن FoV في cryo-SXT يقتصر على 10 × 10 ميكرومتر 2 إلى 15 × 15 ميكرومتر 2 اعتمادا على العدسة ويمثل أخذ عينات زائدة من البكسل للدقة إلى عامل2 على الأقل ، فإنه غالبا ما يكون أصغر من امتداد الخلية الكامل (انظر المربعات الحمراء المشار إليها في الشكل 5). لذلك ، يجب العثور على عائد الاستثمار وتصنيفه بشكل صحيح. وعادة ما يتم ذلك عن طريق علامات الفلورسنت والنهج المرتبطة بالضوء المرئي. استراتيجيات 2D التي تجمع بين epifluorescence واضحة حيث أن مجهر نقل الأشعة السينية الناعم يحتوي على مجهر مشرق الضوء المرئي المتكامل عبر الإنترنت ، ولكن هناك طرق أخرى لإشارة التألق 2D أو 3D عالية الدقة متوفرة أيضا 4,12,13,15,16 . في هذه الحالات ، يجب تصوير الشبكة أولا في أدوات محددة مثل المجاهر فائقة الدقة. لاحظ أن النهج الأكثر كفاءة هي تلك التي تنطوي على جمع البيانات في الظروف المبردة. وذلك لأن الفاصل الزمني بين درجة حرارة الغرفة (RT) ، والتصوير الفلوري للضوء المرئي ، وتزجيج العينات ، على سبيل المثال ، سيعيق التقاط الحدث الخلوي الصحيح في الوقت المحدد ؛ بالإضافة إلى ذلك ، قد يؤدي إجراء التزجيج إلى فصل خلية الاهتمام التي تم تصويرها في RT عن الشبكة. حتى لو كانت معظم أساليب التصوير المترابطة قد تعني ضمنا أنه يجب التعامل مع شبكات العينات ونقلها من أداة إلى أخرى ، وعلى الرغم من زيادة خطر تلوث الشبكة أو تلف هذا ، فإن المكافأة واضحة: أن تكون قادرا على تحديد أحداث أو جزيئات معينة داخل المشهد الخلوي.
عندما تكون هناك حاجة إلى تصوير الخلية بأكملها ، يمكن خياطة صور مقطعية مختلفة بشرط ألا تتجاوز الجرعة الإجمالية المطبقة حد الضرر الإشعاعي. عادة ما تكون الجرعة المودعة لجمع عدد قليل من الصور المقطعية على نفس الخلية أقل بكثير من الحد الأقصى عند الدقة القابلة للتحقيق (109 Gy) ، وبالتالي ، لا توجد حاجة إلى استراتيجية محددة لخفض الجرعة ، على الرغم من أن هذا يعتمد على العينة والتجربة. وفي حالة الجمع المكثف للبيانات مثل التصوير المقطعي الطيفي، ستكون هناك حاجة بالفعل إلى تقليل الجرعة إلى أدنى حد ممكن وسيلزم تطبيق استراتيجيات ملائمة لجمع البيانات ومعالجة محددة.
يحتوي Cryo-SXT على العديد من القيود ، والتي يجب ذكرها هنا. الأول هو الوتد المفقود المعروف ، وهو أمر جوهري لاستخدام دعامات العينات المسطحة. تم استخدام دعامات العينات الشعرية التي تسمح بدوران 180 درجة في الماضي ولا تزال تستخدم في بعض المرافق ، ولكنها تقدم أيضا عيوبا مثل التباين الفقير بسبب امتصاص الزجاج وتقييد استخدام الخلايا في التعليق. طريقة لتقليل تأثير الوتد المفقود هي عن طريق إجراء التصوير المقطعي المزدوج الإمالة. هذا ممكن بالفعل في خط شعاع ميسترال في الوقت الحاضر. يتم تعيين القيد الثاني بواسطة عدسة لوحة منطقة فريسنل المستخدمة في مثل هذه المجاهر. تحدد هذه العدسة الدقة القصوى التي يمكن تحقيقها وعمق المجال (DoF) ، وكلاهما مرتبط ارتباطا وثيقا. وهذا يعني أن زيادة الدقة ستقلل من وزارة المالية في حين أن سمك الخلية غالبا ما يكون أكبر. على سبيل المثال ، سيكون لعدسة 40 نانومتر من الناحية النظرية DoF من 3 ميكرومتر ودقة 24.4 نانومتر نصف الملعب. وبالتالي فإن الحل الوسط بين الدقة ووزارة المالية استراتيجي وسيعتمد اختيار العدسة على نوع الخلية30,31. وأخيرا، فإن أجهزة TXM التشغيلية في جميع أنحاء العالم بعيدة كل البعد عن أن تكون مجاهر مثالية، وتبذل جهود لتحسين الأنظمة البصرية للوصول إلى التوقعات النظرية. أخيرا ، يمكن إجراء تصور وتجزئة المجلدات المعاد بناؤها باستخدام أدوات برمجية محددة25،32،33،34.
باختصار ، يسمح cryo-SXT بتصوير الخلايا كميا بدقة متوسطة (25-30 نانومتر نصف الملعب) وبأرقام إحصائية (بضع عشرات من التصوير المقطعي يوميا). وهذا يسمح بالحصول على تنظيم وتوزيع وأبعاد العضيات في ظروف محددة ، على سبيل المثال ، أثناء العدوى أو الأمراض المسببة للأمراض ، في نقاط زمنية دقيقة أو بعد علاجات معينة. ولذلك، فهي تقنية تصوير بيولوجي تكميلية مفيدة للمجهر الإلكتروني والضوء المرئي الأكثر شيوعا، حيث يتناول كل منها نطاقا محددا من أبعاد العينات ودقتها. يستخدم Cryo-SXT بشكل متكرر في النهج المترابطة التي تنطوي على تألق الضوء المرئي ، ولكن الاستراتيجيات الأخرى المرتبطة بالتبريد ممكنة أيضا.
Disclosures
ويعلن صاحبا البلاغ عدم وجود تضارب في المصالح.
Acknowledgements
تلقى هذا المشروع تمويلا من مشروع iNEXT-Discovery التابع للمفوضية الأوروبية Horizon 2020 وبرنامج البحث والابتكار Horizon 2020 التابع للاتحاد الأوروبي بموجب اتفاقية منحة Marie Skłodowska-Curie رقم 75439.
Materials
| Name | Company | Catalog Number | Comments |
| Amira | Thermo Fisher | Software for segmentation | |
| Au Holey Carbon Films finder grids | (Quantifoil Micro Tools Gmb | R 2/2 Au G200F1 | Au Holey Carbon Films finder grids |
| Au nanoparticles | BBI Group, Cardiff, UK | Au nanoparticles 100nm | 100 nm Au nanoparticles (NPs) at Mistral (Alba) |
| Au nanoparticles | BBI Group, Cardiff, UK | Au nanoparticles 250nm | 250 nm Au nanoparticles (NPs) at B24 (Diamond) |
| Axio Scope A1 | Zeiss | 430035 9060 | Fluorescence microscope |
| Blotting No.1 filter paper | Whatman | WHA10010155 | Blotting filter |
| Bsoft | Software for projection alignment, reconstruction and visualization (Heymann et al., 2008) | ||
| Chimera | Software for segmentation (Pettersen et al. 2004) | ||
| Cryo-EM Glow Discharge Set | PELCO easiGlow | 91000S | Glow Discharge Cleaning System |
| Cu Holey Carbon Films finder grids | (Quantifoil Micro Tools Gmb | R 2/2Cu G200F1 | Cu Holey Carbon Films finder grids |
| Fetal calf serum | Sigma | F9665 | Heat Inactivated, sterile-filtered, suitable for cell culture |
| ImageJ | Software for image processing and analysis in Java (NIH & LOCI University of Wisconsin) | ||
| IMOD | Software for projection alignment, reconstruction and visualization (Kremer et al., 1996) | ||
| Leica EM GP Grid Plunger | Leica | 16706401 | Automatic Plunge Freezer EM |
| LINKAM cryo-stage | Linkam Scientific Instruments | CMS 196 | Cryo-Correlative Microscopy Stage |
| MIB | Software for segmentation (Belevich et al. 2016) | ||
| P100 Petri dish | Sigma | P6106 | Treated for cell culture and sterile |
| P60 Petri dish | Sigma | D8054 | Treated for cell culture and sterile |
| Polylysin | Sigma | P4707 | Poly-L-lysine solution 0.01%, sterile-filtered |
| Soft X-Ray microscope 0.25-1.2keV | Xradia | NCT-SB | Transmission soft X-Ray microscope |
| SURVOS | Software for segmentation (Luengo et al. 2017) | ||
| Tomo3d | Software for reconstruction (SIRT, WBP) (Agulleiro et al. 2011) | ||
| TomoJ | Software for reconstruction (ART) (Messaoudi et al., 2007) | ||
| XM Data Explorer | Zeiss | TXM software |
References
- Carrascosa, J. L., et al. Cryo X-ray tomography of vaccinia virus membranes and inner compartments. Journal of Structural Biology. 168, 234-239 (2009).
- Uchida, M., et al. Soft X-ray tomography of phenotypic switching and the cellular response to antifungal peptoids in Candida albicans. PNAS. 106, 19375-19380 (2009).
- Schneider, G., et al. Three-dimensional cellular ultrastructure resolved by X-ray microscopy. Nature Methods. 10, 1-3 (2010).
- Chichón, F. J., et al. Cryo nano-tomography of vaccinia virus infected cells. Journal of Structural Biology. 177, 202-211 (2012).
- Groen, J., Conesa, J. J., Valcárcel, R., Pereiro, E. The cellular landscape by soft X-ray tomography. Biophysical Reviews. 11, 611-619 (2019).
- Kepsutlu, B., et al. Cells undergo major changes in the quantity of cytoplasmic organelles after uptake of gold nanoparticles with biologically relevant surface coatings. ACS Nano. 14, 2248-2264 (2020).
- Natterer, F. . The mathematics of computerized tomography. , (1986).
- Weiss, D., et al. Computed tomography of cryogenic biological specimens based on X-ray microscopic images. Ultramicroscopy. 84, 185-197 (2000).
- Clowney, E. J., et al. Nuclear aggregation of olfactory receptor genes governs their monogenic expression. Cell. 151, 724-737 (2012).
- Duke, E. M. H., et al. Imaging endosomes and autophagosomes in whole mammalian cells using correlative cryo-fluorescence and cryo-soft X-ray microscopy (cryo-CLXM). Ultramicroscopy. 143, 77-87 (2014).
- Cinquin, B., et al. Putting molecules in their place. Journal of Cellular Biochemistry. 115, 209-216 (2014).
- Hagen, C., et al. Multimodal nanoparticles as alignment and correlation markers in fluorescence/soft X-ray cryo-microscopy/tomography of nucleoplasmic reticulum and apoptosis in mammalian cells. Ultramicroscopy. 146, 46-54 (2014).
- Pérez-Berná, A. J., et al. Structural changes in cells images by soft X-ray cryo-tomography during Hepatitis C virus infection. ACS Nano. 10, 6597-6611 (2016).
- Chiappi, M., et al. Cryo-soft X-ray tomography as a quantitative three-dimensional tool to model nanoparticle:cell interaction. Journal of Nanobiotechnology. 14, 15 (2016).
- Varsano, N., et al. Development of correlative cryo-soft X-ray tomography and stochastic reconstruction microscopy. A study of cholesterol crystal early formation in cells. Journal of the American Chemical Society. 138, 14931-14940 (2016).
- Kounatidis, I., et al. Correlative cryo-structured illumination fluorescence microscopy and soft X-ray tomography elucidates reovirus intracellular release pathway. Cell. 182, 1-16 (2020).
- Kapishnikov, S., et al. Mode of action of quinoline antimalarial drugs in red blood cells infected by Plasmodium falciparum revealed in vivo. PNAS. 116 (46), 22946-22952 (2019).
- Conesa, J. J., et al. Unambiguous intracellular localization and quantification of a potent iridium anticancer compound by correlative 3D cryo X-ray imaging. Angewandte Chemie International Edition. 59, 1270-1278 (2020).
- Gal, A., et al. Native-state imaging of calcifying and noncalcifying microalgae reveals similarities in their calcium storage organelles. PNAS. 115 (43), 11000-11005 (2018).
- Procopio, A., et al. Chemical fingerprint of Zn-hydroxyapatite in the early stages of osteogenic differentiation. ACS Central Science. 5, 1449-1460 (2019).
- Kahil, K., et al. Cellular pathways of calcium transport and concentration toward mineral formation in sea urchin larvae. PNAS. 117 (49), 30957-30965 (2020).
- Conesa, J. J., et al. Intracellular nanoparticles mass quantification by near-edge absorption soft X-ray nanotomography. Scientific Reports. 6, 22354 (2016).
- Otón, J., Sorzano, C. O. S., Maribini, R., Pereiro, E., Carazo, J. M. Measurement of the modulation transfer function of an X-ray microscope based on multiple Fourier orders analysis of a Siemens star. Optics Express. 23 (8), 9567-9572 (2015).
- Otón, J., et al. Characterization of transfer function, resolution and depth of field of a soft X-ray microscope applied to tomography enhancement by Wiener deconvolution. Biomedical Optics Express. 7, 5092-5103 (2016).
- Kremer, J. R., Mastronarde, D. N., McIntosh, J. R. Computer visualization of three-dimensional image data using IMOD. Journal of Structural Biology. 116, 71-76 (1996).
- Heymann, J. B., Cardone, G., Winkler, D. C., Steven, A. C. Computational resources for cryo-electron tomography in Bsoft. Journal of Structural Biology. 161, 232-242 (2008).
- Messaoudi, C., et al. Three-dimensional chemical mapping by EFTEM-TomoJ including improvement of SNR by PCA and ART reconstruction of volume by noise supression. Microscopy Microanalysis. 19, 1669-1677 (2013).
- Agulleiro, J. I., Fernández, J. J. Fast tomographic reconstruction on multicore computers. Bioinformatics. 27, 582-583 (2011).
- Toro-Nahuelpan, M., et al. Tailoring cryo-electron microscopy grids by photo-micropatterning for in-cell structural studies. Nature Methods. 17, 50-54 (2020).
- Attwood, D. . Soft X-rays and Extreme Ultraviolet Radiation. Principles and Applications. , (2000).
- Howells, M., Jacobsen, C., Warwick, T. . Principles and Applications of Zone Plate X-ray. Microscopes. Science of Microscopy. , (2007).
- Pettersen, E. F., et al. UCSF Chimera--a visualization system for exploratory research and analysis. Journal of Computational Chemistry. 25, 1605-1612 (2004).
- Belevich, I., Joensuu, M., Kumar, D., Vihinen, H., Jokitalo, E. Microscopy image browser: a platform for segmentation and analysis of multidimensional datasets. PLOS Biology. 14 (1), 1002340 (2016).
- Luengo, I., et al. SuRVoS: Super-region volume segmentation workbench. Journal of Structural Biology. 198, 43-53 (2017).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved