Method Article
Uma descrição cartográfica 3D da célula por crioma tomografia de raios-X suave
Neste Artigo
Resumo
Aqui, é apresentado um protocolo descrevendo as etapas de preparação da amostra e coleta de dados necessárias na tomografia criobada de raios-X (SXT) para a imagem da ultraestrutura de células inteiras preservadas de crio-preservo em uma resolução de 25 nm meio passo.
Resumo
As técnicas de imagem são fundamentais para compreender a organização celular e o maquinário em pesquisas biológicas e nos campos relacionados. Entre essas técnicas, a tomografia criogênica de raios-X (SXT) permite a imagem de células inteiras conservadas por crio-preservados na faixa de energia de raios-X da janela de água (284-543 eV), na qual as estruturas de carbono têm absorção intrinsecamente maior do que a água, permitindo a reconstrução 3D do coeficiente de absorção linear do material contido em cada voxel. Informações estruturais quantitativas ao nível de células inteiras de até 10 μm de espessura são então alcançáveis desta forma, com alto rendimento e resolução espacial até 25-30 nm de meio-campo. A Crio-SXT tem se mostrado relevante para a pesquisa biomédica atual, fornecendo informações 3D sobre processos de infecção celular (vírus, bactérias ou parasitas), alterações morfológicas devido a doenças (como doenças genéticas recessivas) e nos ajudando a entender a ação medicamentosa no nível celular, ou localizando estruturas específicas no ambiente celular 3D. Além disso, aproveitando o comprimento de onda instável em instalações síncrotrons, espectro-microscopia ou sua contraparte 3D, espectro-tomografia, também pode ser usado para imagem e quantificação de elementos específicos na célula, como cálcio em processos de biomineralização. O Crio-SXT fornece informações complementares a outras técnicas biológicas de imagem, como microscopia eletrônica, fluorescência de raios-X ou fluorescência de luz visível, e é geralmente usado como um método parceiro para imagens correlativas 2D ou 3D em condições criogênicas, a fim de vincular função, localização e morfologia.
Introdução
O Crio-SXT pode desempenhar um papel central na pesquisa de imagem biológica, pois fornece volumes de resolução média 3D (25-30 nm meio pitch) de células inteiras hidratadas 1,2,3,4,5,6. Na faixa de energia da janela de água, entre o carbono e as bordas K de absorção de oxigênio (4,4-2,3 nm), estruturas celulares ricas em carbono absorvem 10 vezes mais do que o meio rico em oxigênio que as permeia e as cerca. Nesta faixa de energia, células vitrificadas de até 10 μm de espessura podem ser imagens sem a necessidade de secção ou coloração, levando a projeções quantitativas de contraste de alta absorção, que, combinadas com capacidades de rotação de amostras, permitem a reconstrução tomográfica da estrutura celular. O Crio-SXT preenche um nicho em termos de dimensões de espécimes e resolução espacial que não é facilmente acessível por qualquer outra técnica de imagem.
Resumindo, o contraste de absorção do crio-SXT é quantitativo, pois a atenuação dos fótons através do espécime de espessura obedece à lei Beer-Lambert da seguinte forma: 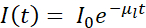 , onde eu0 representa a intensidade do incidente e μl o coeficiente de absorção linear, que depende do comprimento de onda λ e da parte imaginária β do índice de refração do espécime (
, onde eu0 representa a intensidade do incidente e μl o coeficiente de absorção linear, que depende do comprimento de onda λ e da parte imaginária β do índice de refração do espécime (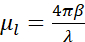 ). A atenuação é uma função da composição bioquímica e da espessura das estruturas sendo imagens, com cada componente bioquímico tendo um coeficiente de absorção linear de raios-X específico μl (LAC). Isso significa que cada valor de voxel de tomografia depende dos elementos químicos e sua concentração naquele voxel7. Isso permite a discriminação natural de diferentes organelas, como núcleos, nucleoli, corpos lipídides ou mitocôndrias, ou diferentes estados de compactação de cromatina apenas com base em seus valores inerentes de LAC reconstruídos 2,8,9.
). A atenuação é uma função da composição bioquímica e da espessura das estruturas sendo imagens, com cada componente bioquímico tendo um coeficiente de absorção linear de raios-X específico μl (LAC). Isso significa que cada valor de voxel de tomografia depende dos elementos químicos e sua concentração naquele voxel7. Isso permite a discriminação natural de diferentes organelas, como núcleos, nucleoli, corpos lipídides ou mitocôndrias, ou diferentes estados de compactação de cromatina apenas com base em seus valores inerentes de LAC reconstruídos 2,8,9.
Além disso, crio-SXT é uma técnica de alto rendimento com tomogramas sendo coletados em poucos minutos. Isso permite especificamente imagens mesoescalas de populações celulares que podem ser capturadas em pontos-chave, como divisão, diferenciação e apoptose, mas também em diferentes estados de resposta, como aqueles induzidos pela exposição química a terapias medicamentosas específicas ou a infecções patogênicas. Os dados coletados nesses pontos-chave fornecerão descrição 3D do sistema com um registro fiel da organização espacial das diferentes organelas celulares nesses momentos específicos.
Geralmente, o crio-SXT é usado em combinação com outras técnicas que seguem abordagens correlativas que permitem localizar características específicas, eventos ou macromoléculas dentro do ambiente celular 3D 4,10,11,12,13,14,15,16 ou dados de fluorescência de raios-X rígidos 17,18 . Abordagens correlativas em condições criogênicas são de suma importância para obter a imagem mais completa e valiosa do sistema de interesse. Um resumo sucinta do fluxo de trabalho típico nas linhas crio-SXT Mistral (Alba) e B24 (Diamond) é esboçado na Figura 1.
Além disso, aproveitando a capacidade de ajuste do comprimento de onda nas instalações síncrotrons, informações espectroscópicas podem ser obtidas, além da estrutural utilizando a absorção diferencial específica de elementos específicos contidos na amostra. Um exemplo disso seria a localização do cálcio no estudo dos processos de biomineralização nas células 19,20,21. Ao tirar imagens 2D em diferentes energias fótons (espectro) ou tomogramas abaixo e na borda de absorção de raios-X de interesse, os pixels ou voxels contendo o elemento selecionado podem ser identificados. O espectro também permite diferenciar estados químicos (ou seja, a evolução do cálcio amorfo para hidroxiapatita como no exemplo anterior de biomineralização20). A quantificação de diferentes elementos é possível em 2D e 3D. A imagem espectroscópica de células vitrificadas é tipicamente feita na janela da água, mas também é possível em outras faixas de energia se o teor de água for baixo o suficiente ou se outros protocolos de preparação de amostras, incluindo a desidratação, forem usados22. Um protocolo detalhado de espectroscopia passo a passo está além do foco do protocolo aqui.
No que se segue, o protocolo se concentra em resumir brevemente as principais etapas de preparação da amostra, embora cada sistema possa precisar de refinamento individual, seguido de um procedimento detalhado de coleta de dados passo a passo para a tomografia de raios-X suaves crio.
Protocolo
1. Preparação da amostra
- Preparando o suporte à grade
- Irradie as grades com UV por 3 h com o filme de carbono voltado para cima para esterilização.
- Opcional: Em caso de problemas com células que não se prendem à grade, use uma das seguintes etapas.
- Hidrofilize a folha de suporte de carbono pelo tratamento plasmá plasma das redes para aumentar a propagação da amostra e melhor adesão celular.
- Coloque as grades do lado carbono para cima no equipamento da câmara de descarga de brilho e exponha a grade ao plasma por 30 s a 15 min (usando Ar ou/e O2) dependendo do equipamento.
- Funcionalize as grades com Poli-L-lysine (PLL)
- Adicione gotas individuais de 60 μL PLL em uma placa de Petri e coloque a grade em cima da gota de PLL com o filme de carbono virado para baixo. Incubar por 30 min a 37 °C e borrar o PLL usando um papel filtro.
- Funcionalizar as grades com soro bovino fetal (FBS).
- Submergir as grades da FBS durante a noite. Mergulhe as grades em uma solução tampão para lavar e deixe a grade em um papel filtro para remover o excesso de líquido.
- Hidrofilize a folha de suporte de carbono pelo tratamento plasmá plasma das redes para aumentar a propagação da amostra e melhor adesão celular.
- Células aderentes crescentes nas grades
- Cultivar células em um prato de cultura celular de 100 mm para atingir 80%-90% de confluência (Figura 2A).
- Semente 1-5 x 105 células/mL (ajustar o valor ao sistema) em cima das grades de Au em uma placa P60 Petri (total de 3 mL).
NOTA: A adição da suspensão celular deve ser feita com muito cuidado com o filme de carbono da grade voltado para cima em um prato de cultura celular de 60 mm. Prepare várias grades por condição, uma condição por placa P60 Petri (Figura 2B). - Permitir que as células se instalem até que a confluência na grade atinja várias células (1 a 10, dependendo do tamanho da célula) em cada quadrado de malha (dependendo da linha celular, isso pode levar até 24 h).
NOTA: Antes do congelamento, as grades devem ser verificadas com um microscópio de luz visível (VLM), avaliando a integridade do filme de carbono, bem como a confluência celular em cada grade (Figura 2C). Espere até que a densidade celular adequada na rede seja atingida. Se a rede for muito confluente ou a folha de carbono for quebrada, comece de novo.
- Deposição de células em suspensão em grades
- Escolha uma grade Au ou preparada usando a pinça do congelador de mergulho (ver seção 1.6).
- Prepare uma suspensão celular de 1-5 x 105 (absorvância de densidade óptica de 0,3 em caso de bactérias) e adicione 4 μL da suspensão preparada à rede.
- Incubar a grade com a gota por alguns minutos horizontalmente para permitir a deposição das células e, em seguida, colocar a pinça segurando a grade dentro da câmara de vitrificação climatificada definida para as condições adequadas de temperatura e umidade (passo 1.6.1).
- Opcional: marcação fluorescente das amostras
NOTA: Pode ser benéfico rotular fluorescentemente algumas organelas da amostra. Dependendo do interesse, fluoroforos específicos ou células expressando uma proteína fluorescente ou transfectadas para expressão transitória de uma proteína de interesse podem ser usadas. Isso permite a fácil detecção de células usando microscopia de crio-epifluorescência e ajuda a encontrar células de interesse para imagens de raios-X subsequentes. No que se segue, o protocolo só detalha o uso de fluoroforos.- Prepare uma solução de trabalho para o fluorforeiro (consulte a recomendação do fabricante) e siga o protocolo específico.
- Adicione os fluoroforos à placa de Petri contendo as grades e misture delicadamente.
- Deixe incubar em um ambiente escuro e vá diretamente para a etapa 1.6 após o término da incubação.
NOTA: É importante estar pronto para vitrificar uma vez que a incubação esteja concluída para evitar marcação inespecífica e, consequentemente, sinal fluorescente borrado.
- Preparação de nanopartículas au (NPs) para alinhamento da projeção de tomograma
- Tome uma alíquota de 1mL da solução de estoque fiducial Au (100 nm no Mistral ou 250 nm em B24) e centrífuga em baixa velocidade (para evitar agregação) por 1 min para permitir que os NPs pelotam.
NOTA: Se possível, é preferível deixar os fiduciários para se estabelecerem naturalmente durante a noite ou mais, para evitar a agregação. - Remova o supernatante. Imediatamente antes do congelamento, suspenda as NPs em uma solução de meio ou tampão sem soro de 20 μL para obter uma solução homogênea.
NOTA: A sônica e o vórtice são recomendados para ajudar a homogeneizar a solução.
- Tome uma alíquota de 1mL da solução de estoque fiducial Au (100 nm no Mistral ou 250 nm em B24) e centrífuga em baixa velocidade (para evitar agregação) por 1 min para permitir que os NPs pelotam.
- Grades de congelamento de mergulho
ATENÇÃO: O nitrogênio líquido pode causar queimaduras frias e devem ser usados equipamentos de proteção adequados (jaleco longo, óculos de segurança, luvas, calças compridas e sapatos fechados). O etano é altamente explosivo e deve ser mantido longe de qualquer faísca ou fogo aberto.- Siga as instruções do fabricante para preparar e usar o instrumento do congelador de mergulho.
NOTA: A umidade é geralmente definida para 80%-90%; a temperatura dependerá do tipo celular (levedura 30 °C máxima, células mamíferas 37 °C, células de insetos 28 °C, etc.). - Tome uma grade com as pinças de montagem da placa de Petri pela borda, tomando muito cuidado para não dobrar a grade e montá-la no dispositivo congelador de mergulho. Certifique-se de que as células se afastem do papel de mancha.
- Opcional: lave a grade três vezes em tampão no caso de células aderentes.
- Adicione 1,5 μL de fiduciais Au NP em cima das células (através do orifício no lado direito da câmara) e deixe se contentar com 30 s antes de borrar e mergulhar a grade.
NOTA: No caso de células em suspensão, adicione fiduciais Au NP à grade enquanto ela ainda estiver na posição horizontal antes de montar a pinça e deixe-as se contentar com 30 s. A mancha é crucial para grades de alta qualidade. A distância de manchas precisa ser calibrada antes de iniciar; o achatamento do papel manchador é importante para a mancha reprodutível (siga as instruções do fabricante). O tempo de mancha precisa ser avaliado para cada tipo de célula. - Prepare várias grades por condição. Transfira a rede e armazene a temperaturas criogênicas para preservar a vitrificação.
- Siga as instruções do fabricante para preparar e usar o instrumento do congelador de mergulho.
- Grades de triagem com microscopia de luz visível criogeno
- Transfira as grades sob nitrogênio líquido das caixas crio-caixas para um crio-cassete padrão (três posições para grades TEM de 3 mm) dentro de um estágio crioque pré-resfriado (veja as instruções do fabricante).
- O crio-cassete é colocado na ponte crio-palco e o crio-palco é montado em um microscópio de luz de epifluorescência de campo largo.
- Imagem as grades a -196,5 °C usando um objetivo de longa distância de trabalho (10x, 50x, 100x) a fim de localizar células adequadas para imagens crio-SXT e avaliar a qualidade da rede (presença de gelo espesso, integridade do filme de suporte de carbono, presença de sinal fluorescente, etc.).
- Localize as células de interesse usando imagens de campo ou/fluorescência brilhantes.
NOTA: Nesta fase, capture as imagens se uma câmera ligada estiver presente no microscópio. Use-o para correlação de imagem. - Após a triagem, devolva as grades para as caixas crio-caixas em uma de guerra de armazenamento de nitrogênio líquido.
NOTA: Se não forem encontradas boas amostras, repita as etapas de preparação da amostra modificando qualquer um dos parâmetros. Geralmente, os parâmetros que requerem modificação são o tempo de mancha, no caso de o gelo ser muito grosso ou a confluência, se houver muitas células por quadrado de malha.
2. Carregando no microscópio de raios-X de transmissão (TXM)
- Esfrie a câmara de transferência com nitrogênio líquido até chegar a <100 K, esfrie a estação de trabalho (Figura 3A) e ligue o aquecedor da borda da estação de trabalho. Espere até parar de ferver.
- Coloque as caixas crio-caixas necessárias contendo grades nos locais correspondentes na estação de trabalho (Figura 3A). Preste atenção para transferi-los com segurança sob condições crio-americanas.
- Carregar as grades selecionadas nos suportes de amostra previamente resfriados (Figura 3B); carregar os suportes na nave auxiliar e protegê-los com as tampas (Figura 3C).
- Carregue a nave auxiliar na câmara de transferência em <100 K e bombeie-a para baixo vácuo (Figura 3D).
- Conecte a câmara de transferência ao TXM (Figura 4A) e carregue a nave auxiliar da câmara de transferência para o TXM seguindo o procedimento de vácuo na tela (Figura 4B).
- Uma vez que a nave está dentro com as amostras, o braço robô TXM pode trazer um suporte de amostra de cada vez para o estágio da amostra (Figura 4C).
3. Imagem usando o software TXM
NOTA: As grades no estágio da amostra são primeiramente imagens usando um microscópio de luz visível on-line (VLM) para mapear a grade no modo brightfield e/ou fluorescência antes de serem imagens com raios-X. Use o ícone joystick correspondente à guia Controle de movimento no painel superior esquerdo para abrir o Controle de Movimento.
- Imagem da grade com o VLM on-line.
- Aquisição de mosaico de campo brilhante
- Selecione a câmera VLM (lente de ampliação > VLM) e ligue a fonte led VLM para imagens de campo brilhante (Microscópio > Aquisição > Configurações de Aquisição > Configurações de Origem e selecione Transmissão).
- Gire a amostra para -60 graus para enfrentar o objetivo VLM (Motion Control > Sample > Sample φ) e mova a amostra para as posições centradas previstas (Motion Control > Sample and change Sample X, Sample Y).
- Ao adquirir imagens em etapas de 20 a 50 μm primeiro para trazer a grade aproximadamente em foco (Microscópio > Aquisição > Configurações de Aquisição > Modos de Aquisição > Contínua > Start; Controle de movimento > Amostra e alteração amostra Z).
- Refine o foco com passos menores até 5 μm até que as células e/ou os furos da película de suporte a carbono estejam em foco (Microscópio > Aquisição > Desarmes > Modos de Aquisição > Contínua > Start; O Controle de Movimento > Amostra e alterar a Amostra Z) e iniciar a aquisição de um mapa de mosaico completo da grade no modo campo brilhante. Use os valores padrão para o mosaico. (Microscópio > Configurações de aquisição > aquisição > modos de aquisição > Mosaic > Start).
NOTA: Um mapa de mosaico é feito de imagens únicas. O número de imagens (número de colunas, linhas e o tamanho da etapa em X e Y) deve ser definido para visualizar toda a grade. O tamanho da etapa depende do tamanho do campo de visão (FoV). Os valores padrão são usados aqui. Se a grade não estiver bem centrada no plano X-Y em relação ao mosaico completo FoV, pare a aquisição, corrija as coordenadas X e Y da amostra e repita a aquisição.
- Aquisição do mosaico do modo fluorescência
- Desligue a fonte led led para imagens de campo brilhante (Microscópio > Aquisição > Configurações de Aquisição > Configurações de Origem e desmarcação de transmissão) e selecione a fonte de luz LED correspondente ao comprimento de onda de excitação desejado (vermelho, verde ou azul) e o filtro óptico correspondente manualmente na configuração.
- Refine o foco na imagem de fluorescência (Microscópio > Aquisição > Configurações de Aquisição > Modos de Aquisição > Início contínuo de >; O controle de movimento > Amostra e alteração amostra Z), e, em seguida, adquirir um mapa de mosaico mantendo os parâmetros posicionais (X e Y) do mosaico de campo brilhante (Microscópio > Aquisição > Configurações de Aquisição > Modos de Aquisição > Mosaic > Start).
- Desligue a fonte de luz LED
- Opcional: Com base nos mapas de mosaico de campo brilhante e fluorescência, anote as regiões de interesse (ROI) identificadas anteriormente (etapa 1.7.4) ou novo ROI (posições X-Y na imagem).
- Aquisição de mosaico de campo brilhante
- Acquistion de mosaico de raios-X
- Selecione o detector de raios-X CCD (lente de ampliação > selecione Pixis), leve a amostra para rotação de 0 graus (Controle de Movimento > Amostra e alteração Amostra φ) e mova a óptica de raios-X (Condensador e Placa de Zona) para as posições alinhadas (Motion Control > Condensador > alterar Condensador z; Controle de movimento > placa de zona e alterar placa de zona Z).
NOTA: Esfrie o chip CCD para -65 °C antes da imagem (Microscópio > Temperatura da câmera > Pixis e altere a temperatura definida para -65 °C e clique em Aplicar). - Mova a amostra para o centro do quadrado de malha de um dos ROI selecionados (Motion Control > Sample and change Sample X, Sample Y).
- Use binning 2 e saída de fenda a 5 μm para minimizar a irradiação e a exposição de 1 s no Mistral, e binning 1 e 60 μm em B24, ajuste o foco usando a tradução Z da amostra (Microscope > Aquisição > Configurações de Aquisição > Configurações da Câmera e binning de alterações; O controle de movimento > XS e altera xs; Microscópio > Configurações de aquisição > aquisição> modos de aquisição > início contínuo de > ; Controle de movimento > Amostra e alteração amostra Z). Comece em etapas de 5 μm e refine-a até passos de 0,5 μm, até que a célula ou os orifícios de folha de carbono estejam bem em foco.
- Adquira um mapa de mosaico do quadrado de malha (Microscópio > Aquisição > Configurações de Aquisição > Modo de Aquisição > Mosaic > Start).
NOTA: Os parâmetros de aquisição do mosaico podem ser determinados da mesma forma que para os mosaicos VLM (seção 3.1.1.4). O tamanho da etapa depende da ampliação preselecionado pela equipe da linha de luz. - Mova a amostra para uma posição flat-field (FF) (uma área vazia dentro da grade, de preferência um orifício no suporte a carbono) (Motion Control > Sample and change Sample X, Sample Y).
- Defina o tempo de exposição para 1 s no Mistral e 0,5 s em B24 (Microscópio > Aquisição > Configurações de Aquisição > Configurações da Câmera e mude o Tempo de Exposição) e adquira uma única imagem (Microscópio > Aquisição > Modos de Aquisição > Único > Start).
- Normalize (divida) o mosaico adquirido pela imagem FF para obter a transmissão (com valores entre 0 e 1) e salvar o mosaico normalizado (clique no primeiro ícone de canto superior direito no lado direito da imagem para abrir a guia de referência > menu> clique em Referência Única e navegue no FF específico).
- Selecione o detector de raios-X CCD (lente de ampliação > selecione Pixis), leve a amostra para rotação de 0 graus (Controle de Movimento > Amostra e alteração Amostra φ) e mova a óptica de raios-X (Condensador e Placa de Zona) para as posições alinhadas (Motion Control > Condensador > alterar Condensador z; Controle de movimento > placa de zona e alterar placa de zona Z).
- Preparando-se para coletar uma série de inclinação de raios-X
NOTA: Encontre o eixo de rotação para cada região de interesse sendo imagens.- Faça uma seleção de áreas dentro dos mosaicos para realizar a tomografia, ou seja, colocando uma forma quadrada (clique na Ferramenta no lado esquerdo da janela da imagem) com o tamanho do FoV no mapa do mosaico de raios-X.
NOTA: Ao selecionar áreas, considere a distância da fronteira (≥10 μm) e outras células, para evitar a sobreposição de células durante a rotação. Além disso, verifique a condição da célula (forma de célula esperada, espessura do gelo, sucesso da vitrificação, propagação fiduciária, etc.). - Alinhamento amostral no eixo de rotação
NOTA: O procedimento relatado é iterativo. A iteração converge mais rápido usando ângulos ± 60° como ângulos de rotação máxima (φM). Se eles não estiverem acessíveis, use ângulos o mais próximos possível para ± 60°.- Defina a câmera para binning 2, tempo de exposição 1 s (Microscópio > Aquisição > Configurações de Aquisição > Configurações da Câmera e mude o tempo de exposição; altere binning; Microscópio > Modos de Aquisição > Aquisição > Contínua > Start), defina a fenda de saída para 5 μm.
NOTA: Minimize a dose o máximo possível trabalhando com abertura mínima de fenda de saída. - Com a rotação em 0°, mova-se para a área previamente selecionada usando a tradução de amostra X e amostra Y e foque no recurso da célula para colocar no eixo de rotação usando a tradução Z da amostra (Motion Control > Sample and change Sample x; Amostra y; Amostra z).
- Gire a amostra para + φM (Controle de movimento > Amostra e alteração Amostra φ) e desenhe uma linha (L+) (clique no botão da ferramenta de linha no lado direito da janela da imagem) no recurso da célula para colocar no eixo de rotação.
- Gire para -φM (Controle de movimento > Amostra e alteração Amostra φ) e desenhe uma linha (L-) (clique no botão de ferramenta de linha no lado direito da janela de imagem) no recurso da célula que deseja colocar no eixo de rotação.
- Enquanto estiver em +φM ou -φM, use a tradução da amostra Z para mover o recurso selecionado para a posição central entre ambas as linhas (Motion Control > Sample e alterar a amostra Z).
- Repita o procedimento da etapa 3.3.2.3 iterativamente até que uma distância mínima L+ até L- seja atingida.
NOTA: A distância entre as duas linhas L+ e L- deve ser menor em relação à iteração anterior. - Na amostra φ = 0 (Controle de movimento > Amostra e alteração Amostra φ), mova a amostra X duas vezes a distância necessária para colocar o recurso selecionado no centro de ambas as linhas (Motion Control > Sample and change Sample X). Mova a Placa de Zona (ZP) X para trazer o recurso de volta ao centro do FoV (Motion Control > ZP e mude ZP X). Faça este passo apenas uma vez por grade.
- Retimize a posição ZP Z em relação ao novo eixo de rotação, registrando uma série focal ZP Z (coleções de imagens em diferentes posições ZP Z, geralmente em etapas de 0,3 μm) (Microscópio > Aquisição > Configurações de Aquisição > Modos de Aquisição > Série Focal > Iniciar) e mover o ZP Z para a posição onde a amostra está em foco (Motion Control > Zone Plate e alterar a Placa da Zona z).
- Defina os parâmetros para a aquisição da série de inclinação.
NOTA: A faixa angular máxima é, em última análise, limitada pela distância focal do ZP (±70 ou ±65 graus para um ZP de 40 nm ou 25 nm para uma amostra plana, respectivamente). Otimize a relação sinal-ruído (S/N) e os danos causados pela radiação para definir o tempo de exposição. Para tomografia, use diferentes tempos de exposição em diferentes faixas angulares. - Determine a faixa angular de rotação mais alta, caso a sombra ocorra antes que o ângulo de rotação máxima seja atingido.
- Defina a câmera binning para 1 (Microscópio > Aquisição > Configurações de Aquisição > Configurações da Câmera e altere Binning), abra a fenda de saída para 15 μm no Mistral (Controle de Movimento > XS e mude XS) e defina a rotação para 0° (Motion Control > Sample and change Sample φ).
- Adquira uma única imagem com um tempo de exposição de 1 s (Microscópio > Configurações de Aquisição > Aquisição > Modos de Aquisição > Single > Start) e estime o tempo de exposição necessário para cada ângulo de inclinação da tomografia.
- Defina a câmera para binning 2, tempo de exposição 1 s (Microscópio > Aquisição > Configurações de Aquisição > Configurações da Câmera e mude o tempo de exposição; altere binning; Microscópio > Modos de Aquisição > Aquisição > Contínua > Start), defina a fenda de saída para 5 μm.
- Faça uma seleção de áreas dentro dos mosaicos para realizar a tomografia, ou seja, colocando uma forma quadrada (clique na Ferramenta no lado esquerdo da janela da imagem) com o tamanho do FoV no mapa do mosaico de raios-X.
- Aquisição de tomografia
- Mova-se para o ângulo máximo negativo +0.1 (por exemplo, para ZP 25 nm ir para -65,1°) (Controle de movimento > Amostra e alterar Amostra φ).
- Defina o número de imagens como número total de ângulos (levando em conta a imagem no ângulo 0) e a faixa angular (Microscópio > Aquisição > Configurações de Aquisição > Modos de Aquisição > Tomografia e alterar o número de imagens; em seguida, alterar Angle Start e Angle End).
- Defina o tempo de exposição definido e inicie a aquisição (Microscópio > Aquisição > Configurações de Aquisição > Configurações da Câmera e altere o Tempo de Exposição e clique em Iniciar).
- Mova-se para a posição FF (Motion Control > Amostra e altere a Amostra X; em seguida, altere a Amostra Y) e adquira 10 imagens FF (Microscópio > Aquisição > Modos de Aquisição > Média e altere o número de imagens e clique em Iniciar).
NOTA: No Mistral, a espectromicroscopia ou microscopia dependente de energia é possível ao adquirir projeções enquanto digitaliza a energia através de uma borda de absorção de interesse. A saída final é uma pilha de projeções 2D, que conterão um espectro de absorção de raios-X (XAS) em cada pixel, ou seja, imagens com informações químicas. A extensão para 3D combinando espectroscopia com tomografia é, em princípio, possível. A dose total necessária pode ser uma limitação e, em seguida, podem ser necessárias estratégias específicas, como a imagem de absorção diferencial.
4. Análise de dados
NOTA: Toda a análise de dados é feita com software aberto disponível e scripts desenvolvidos com pipelines automatizados.
- Em Mistral
- Pipeline converte pilhas de tomografias da extensão txrm (extensão de software TXM) para hdf5 (formato de dados hierárquico de código aberto) com todos os metadados necessários, então normaliza a pilha pela corrente média e da máquina FF, e finalmente desconvolta as pilhas pela função de propagação de ponto medido do sistema óptico para uma lente e energia23, Dia 24. Para a desconvolução, encontre o valor de k adequado = 1/SNR (depende da espessura da amostra). Para o script desenvolvido no Mistral, digite o comando: txrm2deconv "input tomo" "input FF" -zp="ZP usado" - e= " energia " - dx= " tamanho do pixel " - k= " 1/SNR " - t=-1.
- Para o script desenvolvido no Mistral para alinhamento automático, digite o comando: ctalignxcorr "pilha desconvolved normalizada.mrc" "pilha normalizada.hdf5".
NOTA: Uma série de aplicações de software podem ser usadas para o alinhamento das projeções a um eixo de rotação comum usando os fiduciários Au NP25,26. O alinhamento das projeções requer precisão de subpixel. O alinhamento automático só pode ser satisfatório quando os fiduciais Au NP são suficientes (>7) e bem espalhados no campo de visão. O alinhamento manual é frequentemente necessário um posteriori para corrigir o alinhamento automático para alcançar a maior precisão possível. - Para reconstruir a pilha normalizada alinhada, use qualquer um dos vários algoritmos disponíveis.
NOTA: A pilha alinhada pode ser reconstruída usando projeção de coluna ponderada (WBP) ou técnicas simultâneas de reconstrução iterativa (SIRT) em poucos minutos. No entanto, para preservar os coeficientes de absorção linear (LAC), as Técnicas de Reconstrução Algébrica (TARV) são preferidas27. A ART requer mais tempo de computação, por isso o SIRT28 é feito primeiro para uma reconstrução rápida da série de inclinação alinhada automaticamente (30 iterações em poucos minutos). Uma vez que o alinhamento seja satisfatório, a ART será utilizada.
- Na B24
- Um pipeline personalizado converte arquivos de dados txrm em Tiffs padrão com todos os metadados necessários e, em seguida, envia-os para um fluxo de trabalho runtomo em lote que processa os conjuntos de dados de três maneiras: WBP, SIRT e patch.
Resultados
Preparar amostras para crio-SXT pode ser um desafio. Mesmo dentro da mesma grade amostral, é possível ter áreas ideais, e áreas que não são ideais, como pode ser visto na Figura 5, que mostra dois quadrados da mesma grade de localizador de Au. A amostra ideal deve ter células únicas no centro de uma malha quadrada, embutidas em uma fina camada de gelo e cercadas por marcadores fiduciais Au bem dispersos usados para o alinhamento de projeções de inclinação antes da reconstrução da tomografia. A Figura 5A mostra uma célula semelhante a fibroblasto (NIH 3T3) que cumpre muitos desses critérios. Uma única fatia de uma reconstrução 3D usando ART27 da área marcada com a caixa vermelha indicando o campo de visão (FoV) é mostrada na Figura 5B. Muitas organelas diferentes como mitocôndrias (M), ânticulo endoplasmático (ER), vesículas (V) e núcleo (N) podem ser distinguidas graças à reconstrução quantitativa dos LACs. Além disso, a relação sinal-ruído da reconstrução é muito alta, permitindo alcançar alto contraste das características celulares. Por outro lado, a Figura 5C mostra um quadrado com maior densidade celular. Por causa disso, a mancha geralmente é menos eficiente, levando a uma camada de gelo mais espessa, ou mesmo problemas de vitrificação. Em alguns casos, isso já pode ser observado ao triagem da rede usando mapeamento de epifluorescência antes da imagem de raio-X, e essas grades devem ser evitadas a qualquer custo. Na Figura 5C, uma rachadura dentro da grade e o gelo vitrificado podem ser observados passando por todo o quadrado de malha (marcado pelas setas vermelhas). Qualquer imagem próxima a rachaduras deve ser evitada devido à provável instabilidade da rede quando exposta ao feixe. Além disso, rachaduras podem ser um sinal de gelo espesso, como foi o caso nesta área. Uma série de inclinação foi registrada na área marcada com a caixa vermelha. Na Figura 5D, uma única fatia da reconstrução 3D correspondente é mostrada. Embora algumas estruturas maiores possam ser reconhecidas, detalhes finos são perdidos dentro do ruído e textura granulada devido à má qualidade de vitrificação do gelo espesso, como pode ser visto especificamente, por exemplo, nas mitocôndrias superiores apontadas pela seta.
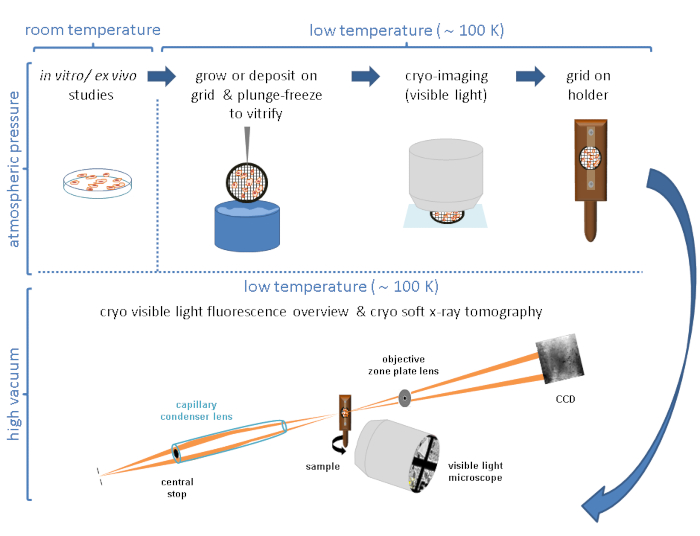
Figura 1: Fluxo de trabalho. Fluxo de trabalho esquemático seguido antes da coleta de dados crio-SXT. Clique aqui para ver uma versão maior desta figura.
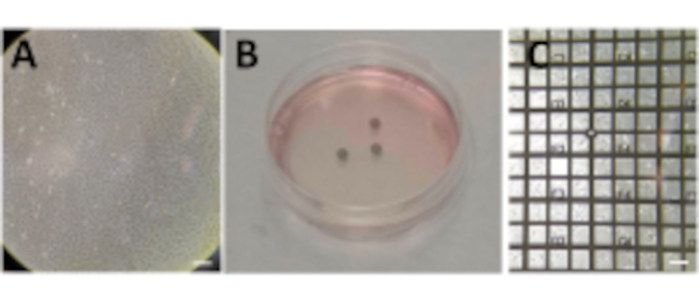
Figura 2: Cultivando células em grades. (A) Células crescendo em uma placa P100 Petri com uma confluência em torno de 80%-90%. (B) Placa de Petri P60 com várias grades após semeadura das células. (C) Células crescendo em cima de uma grade após 24 horas. Barras de escala: 100 μm. Clique aqui para ver uma versão maior desta figura.

Figura 3: Carregar grades nos porta-amostras e na câmara de transferência. (A) Estação de trabalho cheia de nitrogênio líquido com o transporte e as crioboxes prontas para carregar as grades. (B) Porta-amostras inserido no carregador com a grade carregada. (C) Transportado com o suporte de amostra na posição 3 sem a tampa. (D) Estação de trabalho com a câmara de transferência anexada. Clique aqui para ver uma versão maior desta figura.

Figura 4: Carregando amostras no TXM (A) Anexando a câmara de transferência ao TXM. (B) Navegá-lo dentro do TXM. (C) Braço robô TXM inserindo o suporte de amostra no estágio da amostra. Clique aqui para ver uma versão maior desta figura.
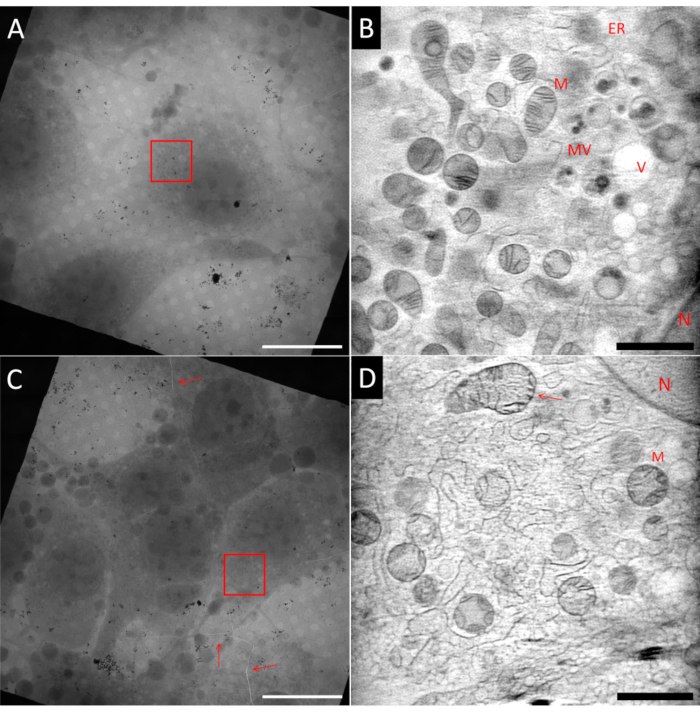
Figura 5: Exemplo de tomogramas de raios-X macios criogênicos. Linha superior: amostra ideal, (A) vista de mosaico 2D de um quadrado de grade mostrando uma célula isolada no centro. (B) Uma fatia do volume 3D reconstruído mostrando a área marcada com a caixa vermelha (A). Em comparação com (D) a imagem é muito mais suave e mais detalhes são visíveis. Linha inferior: amostras não ideais, (C) visão de mosaico 2D de um quadrado de grade mostrando confluência celular muito alta e rachaduras no gelo e folha de grade (setas vermelhas). (D) Uma fatia do volume 3D reconstruído mostrando a área marcada com a caixa vermelha em (C). A vitrificação pobre ou subótimal pode ser identificada pela textura granulada da imagem. N: Núcleo; M: Mitocôndrias; ER: Órticulo endoplasmático; MV: Corpos multivesiculares; V: Vacuole; Barras de escala: A & C 20 μm; B & D 2 μm.VClique aqui para ver uma versão maior desta figura.
Discussão
A preparação da amostra é um passo crítico para obter tomogramas de raios-X macios de alta qualidade, pois sua qualidade depende diretamente da qualidade da vitrificação da amostra e da espessura da camada de gelo em que a célula está incorporada. Projeções com alta relação sinal-ruído serão coletadas em regiões com fina camada de gelo, permitindo minimizar a dose de radiação necessária para alcançar a maior resolução possível. Além disso, a confluência celular também afetará a qualidade final do tomograma, uma vez que deve-se evitar ter células vizinhas entrando no FoV após a rotação. Finalmente, a dispersão correta dos marcadores fiduciais Au determinará a precisão do alinhamento da projeção e, em última instância, determinará a qualidade do volume reconstruído 3D final. Observe que uma disseminação adequada de fiduciais Au na rede permite a automatização da etapa de alinhamento de projeção, sem a qual é necessário um alto conhecimento para um passo tão crítico.
O protocolo aqui apenas retrata uma possível estratégia de preparação de amostras, que tem semelhanças com as utilizadas na tomografia crio-elétron (crio-ET). Em ambos os casos, protocolos que melhorem a exigente preparação amostral para uma melhor reprodutibilidade serão fundamentais para o sucesso dessas técnicas, e esforços estão sendo feitos para esse objetivo29. Vale ressaltar que, além de imagens de células isoladas, seções de tecido também podem ser visualizadas, desde que o sinal de transmissão através da seção seja suficiente em ângulos de inclinação alta. Normalmente, isso implicará seções de poucos mícrons (abaixo de 10 μm).
Para imaginar uma estrutura ou evento específico dentro de uma célula, é preciso ter certeza de que esse recurso em particular está dentro do FoV da série de inclinação. Como o FoV no crio-SXT é limitado a 10 x 10 μm2 a 15 x 15 μm2, dependendo da lente e contabilizando um pixel superdimensionado da resolução para pelo menos um fator de 2, muitas vezes é menor do que a extensão completa da célula (veja os quadrados vermelhos indicados na Figura 5). Portanto, o ROI deve ser encontrado e devidamente rotulado. Isso geralmente é feito por meio de tags fluorescentes e abordagens correlativas de luz visível. Estratégias 2D que combinam epifluorescência são simples, pois o microscópio de transmissão de raios-X macio tem um microscópio integrado de fluorescência de luz visível on-line, mas outras abordagens para sinal de fluorescência 2D ou 3D de alta resolução também estão disponíveis 4,12,13,15,16 . Nesses casos, a grade precisa ser imagens primeiro em instrumentos específicos, como microscópios de super resolução. Note-se que as abordagens correlativas mais eficientes são aquelas que envolvem a coleta de dados em condições criogênicas. Isso porque o lapso de tempo entre a temperatura ambiente (TR), a imagem de fluorescência da luz visível e a vitrificação da amostra, por exemplo, dificultarão a captura do evento celular certo a tempo; além disso, o procedimento de vitrificação pode desacopalar a célula de interesse que foi imaged em RT da grade. Mesmo que a maioria das abordagens de imagem correlativa possa implicar que as redes de amostragem devem ser manipuladas e transportadas de um instrumento para o outro, e apesar do risco aumentado de contaminação da rede ou dano que isso representa, a recompensa é clara: ser capaz de identificar eventos ou moléculas específicas dentro da paisagem celular.
Quando a imagem celular inteira é necessária, a costura de diferentes tomogramas é possível, desde que a dose total aplicada não exceda o limite de dano à radiação. Normalmente, a dose depositada para coletar poucos tomogramas na mesma célula está bem abaixo do limite na resolução alcançável (109 Gy) e, portanto, nenhuma estratégia específica é necessária para diminuir a dose, embora esta seja dependente de amostra e experimento. No caso da coleta intensiva de dados, como a espectro-tomografia, a minimização da dose seria de fato necessária e seria necessária a coleta de dados conveniente e estratégias específicas de processamento.
O Crio-SXT tem várias limitações, que devem ser mencionadas aqui. A primeira é a conhecida cunha ausente, que é intrínseca ao uso de suportes de amostra plana. Suportes de amostra capilar que permitem rotação de 180 graus foram usados no passado e ainda são usados em algumas instalações, mas também apresentam desvantagens, como um contraste empobrecido devido à absorção de vidro e à restrição do uso de células em suspensão. Uma maneira de diminuir o efeito da cunha faltante é realizando tomografia dupla inclinação. Isso é realmente possível na linha de feixe Mistral hoje em dia. A segunda limitação é definida pela lente da placa da zona de Fresnel usada em tais microscópios. Esta lente define a resolução final alcançável e a profundidade de campo (DoF), ambas sendo fortemente relacionadas. Isso implica que o aumento da resolução diminuirá o DoF, enquanto a espessura da célula será muitas vezes maior. Por exemplo, uma lente de 40 nm terá, em teoria, um DoF de 3 μm e uma resolução de 24,4 nm meio campo. O compromisso entre resolução e DoF é, portanto, estratégico e a escolha da lente dependerá do tipo da célula30,31. Finalmente, os TXMs operacionais em todo o mundo estão longe de serem microscópios ideais e esforços estão sendo feitos para melhorar os sistemas ópticos para alcançar as expectativas teóricas. Por fim, a visualização e segmentação dos volumes reconstruídos pode ser realizada com ferramentas específicas de software 25,32,33,34.
Em resumo, o crio-SXT permite que as células de imagem quantitativamente em resolução média (25-30 nm meio pitch) e em números estatísticos (poucas dezenas de tomogramas por dia). Isso permite a obtenção da organização, distribuição e dimensão das organelas em condições específicas, por exemplo, durante a infecção por patógenos ou doenças, em momentos precisos ou após tratamentos específicos. É, portanto, uma técnica de imagem biológica complementar útil para as microscopias de elétrons e luz visível mais comuns, cada uma delas abordando uma gama específica de dimensões e resolução da amostra. O Crio-SXT é frequentemente usado em abordagens correlativas envolvendo fluorescência de luz visível, mas outras estratégias correlativas crio-s também são possíveis.
Divulgações
Os autores não declaram conflito de interesses.
Agradecimentos
Este projeto recebeu financiamento do projeto iNEXT-Discovery da Comissão Europeia Horizon 2020 e do programa de pesquisa e inovação Horizon 2020 da União Europeia sob o acordo de subvenção Marie Skłodowska-Curie nº 75439.
Materiais
| Name | Company | Catalog Number | Comments |
| Amira | Thermo Fisher | Software for segmentation | |
| Au Holey Carbon Films finder grids | (Quantifoil Micro Tools Gmb | R 2/2 Au G200F1 | Au Holey Carbon Films finder grids |
| Au nanoparticles | BBI Group, Cardiff, UK | Au nanoparticles 100nm | 100 nm Au nanoparticles (NPs) at Mistral (Alba) |
| Au nanoparticles | BBI Group, Cardiff, UK | Au nanoparticles 250nm | 250 nm Au nanoparticles (NPs) at B24 (Diamond) |
| Axio Scope A1 | Zeiss | 430035 9060 | Fluorescence microscope |
| Blotting No.1 filter paper | Whatman | WHA10010155 | Blotting filter |
| Bsoft | Software for projection alignment, reconstruction and visualization (Heymann et al., 2008) | ||
| Chimera | Software for segmentation (Pettersen et al. 2004) | ||
| Cryo-EM Glow Discharge Set | PELCO easiGlow | 91000S | Glow Discharge Cleaning System |
| Cu Holey Carbon Films finder grids | (Quantifoil Micro Tools Gmb | R 2/2Cu G200F1 | Cu Holey Carbon Films finder grids |
| Fetal calf serum | Sigma | F9665 | Heat Inactivated, sterile-filtered, suitable for cell culture |
| ImageJ | Software for image processing and analysis in Java (NIH & LOCI University of Wisconsin) | ||
| IMOD | Software for projection alignment, reconstruction and visualization (Kremer et al., 1996) | ||
| Leica EM GP Grid Plunger | Leica | 16706401 | Automatic Plunge Freezer EM |
| LINKAM cryo-stage | Linkam Scientific Instruments | CMS 196 | Cryo-Correlative Microscopy Stage |
| MIB | Software for segmentation (Belevich et al. 2016) | ||
| P100 Petri dish | Sigma | P6106 | Treated for cell culture and sterile |
| P60 Petri dish | Sigma | D8054 | Treated for cell culture and sterile |
| Polylysin | Sigma | P4707 | Poly-L-lysine solution 0.01%, sterile-filtered |
| Soft X-Ray microscope 0.25-1.2keV | Xradia | NCT-SB | Transmission soft X-Ray microscope |
| SURVOS | Software for segmentation (Luengo et al. 2017) | ||
| Tomo3d | Software for reconstruction (SIRT, WBP) (Agulleiro et al. 2011) | ||
| TomoJ | Software for reconstruction (ART) (Messaoudi et al., 2007) | ||
| XM Data Explorer | Zeiss | TXM software |
Referências
- Carrascosa, J. L., et al. Cryo X-ray tomography of vaccinia virus membranes and inner compartments. Journal of Structural Biology. 168, 234-239 (2009).
- Uchida, M., et al. Soft X-ray tomography of phenotypic switching and the cellular response to antifungal peptoids in Candida albicans. PNAS. 106, 19375-19380 (2009).
- Schneider, G., et al. Three-dimensional cellular ultrastructure resolved by X-ray microscopy. Nature Methods. 10, 1-3 (2010).
- Chichón, F. J., et al. Cryo nano-tomography of vaccinia virus infected cells. Journal of Structural Biology. 177, 202-211 (2012).
- Groen, J., Conesa, J. J., Valcárcel, R., Pereiro, E. The cellular landscape by soft X-ray tomography. Biophysical Reviews. 11, 611-619 (2019).
- Kepsutlu, B., et al. Cells undergo major changes in the quantity of cytoplasmic organelles after uptake of gold nanoparticles with biologically relevant surface coatings. ACS Nano. 14, 2248-2264 (2020).
- Natterer, F. . The mathematics of computerized tomography. , (1986).
- Weiss, D., et al. Computed tomography of cryogenic biological specimens based on X-ray microscopic images. Ultramicroscopy. 84, 185-197 (2000).
- Clowney, E. J., et al. Nuclear aggregation of olfactory receptor genes governs their monogenic expression. Cell. 151, 724-737 (2012).
- Duke, E. M. H., et al. Imaging endosomes and autophagosomes in whole mammalian cells using correlative cryo-fluorescence and cryo-soft X-ray microscopy (cryo-CLXM). Ultramicroscopy. 143, 77-87 (2014).
- Cinquin, B., et al. Putting molecules in their place. Journal of Cellular Biochemistry. 115, 209-216 (2014).
- Hagen, C., et al. Multimodal nanoparticles as alignment and correlation markers in fluorescence/soft X-ray cryo-microscopy/tomography of nucleoplasmic reticulum and apoptosis in mammalian cells. Ultramicroscopy. 146, 46-54 (2014).
- Pérez-Berná, A. J., et al. Structural changes in cells images by soft X-ray cryo-tomography during Hepatitis C virus infection. ACS Nano. 10, 6597-6611 (2016).
- Chiappi, M., et al. Cryo-soft X-ray tomography as a quantitative three-dimensional tool to model nanoparticle:cell interaction. Journal of Nanobiotechnology. 14, 15 (2016).
- Varsano, N., et al. Development of correlative cryo-soft X-ray tomography and stochastic reconstruction microscopy. A study of cholesterol crystal early formation in cells. Journal of the American Chemical Society. 138, 14931-14940 (2016).
- Kounatidis, I., et al. Correlative cryo-structured illumination fluorescence microscopy and soft X-ray tomography elucidates reovirus intracellular release pathway. Cell. 182, 1-16 (2020).
- Kapishnikov, S., et al. Mode of action of quinoline antimalarial drugs in red blood cells infected by Plasmodium falciparum revealed in vivo. PNAS. 116 (46), 22946-22952 (2019).
- Conesa, J. J., et al. Unambiguous intracellular localization and quantification of a potent iridium anticancer compound by correlative 3D cryo X-ray imaging. Angewandte Chemie International Edition. 59, 1270-1278 (2020).
- Gal, A., et al. Native-state imaging of calcifying and noncalcifying microalgae reveals similarities in their calcium storage organelles. PNAS. 115 (43), 11000-11005 (2018).
- Procopio, A., et al. Chemical fingerprint of Zn-hydroxyapatite in the early stages of osteogenic differentiation. ACS Central Science. 5, 1449-1460 (2019).
- Kahil, K., et al. Cellular pathways of calcium transport and concentration toward mineral formation in sea urchin larvae. PNAS. 117 (49), 30957-30965 (2020).
- Conesa, J. J., et al. Intracellular nanoparticles mass quantification by near-edge absorption soft X-ray nanotomography. Scientific Reports. 6, 22354 (2016).
- Otón, J., Sorzano, C. O. S., Maribini, R., Pereiro, E., Carazo, J. M. Measurement of the modulation transfer function of an X-ray microscope based on multiple Fourier orders analysis of a Siemens star. Optics Express. 23 (8), 9567-9572 (2015).
- Otón, J., et al. Characterization of transfer function, resolution and depth of field of a soft X-ray microscope applied to tomography enhancement by Wiener deconvolution. Biomedical Optics Express. 7, 5092-5103 (2016).
- Kremer, J. R., Mastronarde, D. N., McIntosh, J. R. Computer visualization of three-dimensional image data using IMOD. Journal of Structural Biology. 116, 71-76 (1996).
- Heymann, J. B., Cardone, G., Winkler, D. C., Steven, A. C. Computational resources for cryo-electron tomography in Bsoft. Journal of Structural Biology. 161, 232-242 (2008).
- Messaoudi, C., et al. Three-dimensional chemical mapping by EFTEM-TomoJ including improvement of SNR by PCA and ART reconstruction of volume by noise supression. Microscopy Microanalysis. 19, 1669-1677 (2013).
- Agulleiro, J. I., Fernández, J. J. Fast tomographic reconstruction on multicore computers. Bioinformatics. 27, 582-583 (2011).
- Toro-Nahuelpan, M., et al. Tailoring cryo-electron microscopy grids by photo-micropatterning for in-cell structural studies. Nature Methods. 17, 50-54 (2020).
- Attwood, D. . Soft X-rays and Extreme Ultraviolet Radiation. Principles and Applications. , (2000).
- Howells, M., Jacobsen, C., Warwick, T. . Principles and Applications of Zone Plate X-ray. Microscopes. Science of Microscopy. , (2007).
- Pettersen, E. F., et al. UCSF Chimera--a visualization system for exploratory research and analysis. Journal of Computational Chemistry. 25, 1605-1612 (2004).
- Belevich, I., Joensuu, M., Kumar, D., Vihinen, H., Jokitalo, E. Microscopy image browser: a platform for segmentation and analysis of multidimensional datasets. PLOS Biology. 14 (1), 1002340 (2016).
- Luengo, I., et al. SuRVoS: Super-region volume segmentation workbench. Journal of Structural Biology. 198, 43-53 (2017).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados