Method Article
通过冷冻软X射线断层扫描对细胞进行3D制图描述
摘要
在这里,提出了一种方案,描述了冷冻软X射线断层扫描(SXT)中所需的样品制备和数据收集步骤,以以25nm半间距的分辨率对整个冷冻保存的细胞的超微结构进行成像。
摘要
成像技术是了解生物学研究和相关领域的细胞组织和机制的基础。在这些技术中,冷冻软X射线断层扫描(SXT)允许在水窗X射线能量范围(284-543 eV)中对整个冷冻保存的细胞进行成像,其中碳结构具有比水更高的吸收率,允许3D重建每个体素中所含材料的线性吸收系数。然后可以通过这种方式实现厚达10μm的整细胞水平的定量结构信息,具有高通量和空间分辨率,低至25-30nm半间距。Cryo-SXT已经证明自己与当前的生物医学研究相关,提供有关细胞感染过程(病毒,细菌或寄生虫),疾病引起的形态变化(如隐性遗传病)的3D信息,并帮助我们在细胞水平上了解药物作用,或在3D细胞环境中定位特定结构。此外,通过利用同步加速器设施的可调波长,光谱显微镜或其3D对应物光谱断层扫描也可用于成像和量化细胞中的特定元素,例如生物矿化过程中的钙。Cryo-SXT为其他生物成像技术(如电子显微镜,X射线荧光或可见光荧光)提供补充信息,通常用作低温条件下2D或3D相关成像的伙伴方法,以连接功能,位置和形态。
引言
Cryo-SXT可以在生物成像研究中起核心作用,因为它提供3D介质分辨率(25-30nm半间距)体积的水合全细胞1,2,3,4,5,6。在水窗能量范围内,在碳和吸氧K边缘(4.4-2.3nm)之间,富碳细胞结构吸收的量是渗透和包围它们的富氧介质的10倍。在此能量范围内,无需切片或染色即可成像厚度达10μm的玻璃化细胞,从而实现定量的高吸收对比度投影,这与样品旋转功能相结合,允许对细胞结构进行断层重建。Cryo-SXT在标本尺寸和空间分辨率方面填补了一个利基市场,这是任何其他成像技术都不容易获得的。
简而言之,冷冻SXT的吸收对比度是定量的,因为通过厚度 t 的标本的光子衰减遵循Beer-Lambert定律如下: 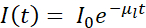 ,其中 I0 表示入射强度, μl表示线性吸收系数,这取决于波长λ和试样折射率的虚部β (
,其中 I0 表示入射强度, μl表示线性吸收系数,这取决于波长λ和试样折射率的虚部β (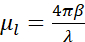 ).衰减是生化成分和被成像结构厚度的函数,每个生化成分具有特定的X射线线性吸收系数 μl (LAC)。这意味着每个断层扫描体素值取决于化学元素及其在该体素7中的浓度。这允许自然区分不同的细胞器,如细胞核,核仁,脂质体或线粒体,或染色质的不同压实状态,仅基于其固有的LAC值重建2,8,9。
).衰减是生化成分和被成像结构厚度的函数,每个生化成分具有特定的X射线线性吸收系数 μl (LAC)。这意味着每个断层扫描体素值取决于化学元素及其在该体素7中的浓度。这允许自然区分不同的细胞器,如细胞核,核仁,脂质体或线粒体,或染色质的不同压实状态,仅基于其固有的LAC值重建2,8,9。
此外,冷冻SXT是一种高通量技术,可在几分钟内收集断层扫描。这特别能够实现细胞群的中尺度成像,这些细胞群可以在关键时间点(如分裂,分化和凋亡)捕获,也可以在不同的反应状态下捕获,例如由化学暴露于特定药物治疗或致病性感染引起的反应状态。在这些关键点收集的数据将提供系统的3D描述,并忠实地记录这些特定时刻不同细胞器的空间组织。
通常,cryo-SXT与其他技术结合使用,遵循相关方法,允许在3D细胞环境中定位特定特征,事件或大分子4,10,11,12,13,14,15,16或硬X射线荧光数据17,18.低温条件下的相关方法对于获得感兴趣系统的最完整和最有价值的图像至关重要。图1简要总结了Mistral(Alba)和B24(Diamond)冷冻SXT光束线的典型工作流程。
此外,利用同步加速器设施的波长调谐能力,除了使用样品中所含特定元素的特定差分吸收的结构信息外,还可以获得光谱信息。这方面的一个例子是钙在细胞生物矿化过程中的位置19,20,21。通过在目标的X射线吸收边缘以不同的光子能量(光谱)或断层扫描拍摄2D图像,可以识别包含所选元素的像素或体素。光谱还允许区分化学状态(即,无定形钙向羟基磷灰石的演变,如前面的生物矿化示例20所示)。在2D和3D中可以量化不同的元素。玻璃化细胞的光谱成像通常在水窗口中进行,但如果水含量足够低或如果使用其他样品制备方案(包括脱水)22,也可以在其他能量范围内进行。详细的光谱学分步实验方案超出了本文方案的重点。
在下文中,该协议侧重于简要总结主要的样品制备步骤,尽管每个系统可能需要单独改进,然后进行详细的分步数据收集程序,以进行冷冻软X射线断层扫描。
研究方案
1. 样品制备
- 准备网格支持
- 用紫外线照射网格3小时,碳膜朝上进行灭菌。
- 可选:如果出现单元格未附加到网格的问题,请使用以下步骤之一。
- 通过对网格进行等离子体处理来水亲化碳载体箔,以增加样品扩散和更好的细胞附着力。
- 将格栅碳面朝上放在辉光放电室设备中,并根据设备将格栅暴露在等离子体中30秒至15分钟(使用Ar或/和O2)。
- 使用聚-L-赖氨酸(PLL)功能化网格
- 在培养皿中加入60μL PLL的单个液滴,并将网格放在PLL滴的顶部,碳膜朝下。在37°C下孵育30分钟,并使用滤纸印迹PLL。
- 用胎牛血清(FBS)使网格功能化。
- 将网格淹没在FBS中过夜。将网格浸入缓冲溶液中进行洗涤,并将网格放在滤纸上以除去多余的液体。
- 通过对网格进行等离子体处理来水亲化碳载体箔,以增加样品扩散和更好的细胞附着力。
- 在网格上生长贴壁细胞
- 在100mm的细胞培养皿中培养细胞以达到80%-90%汇合度(图2A)。
- 在P60培养皿(总共3 mL)中Au网格的顶部接种1-5 x 10 5个细胞/ mL(根据系统调整值)。
注意: 细胞悬浮液的添加必须非常小心地完成,网格的碳膜在60mm的细胞培养皿中朝上。每个条件准备几个网格,每个P60培养皿一个条件(图2B)。 - 让细胞沉降,直到网格上的汇合度在每个网格正方形中达到几个细胞(1到10个,取决于细胞大小)(取决于细胞系,这可能需要长达24小时)。
注意: 在冻结之前,应使用可见光显微镜(VLM)检查网格,评估碳膜完整性以及每个网格中的电池汇合度(图2C)。等到网格上达到适当的细胞密度。如果网格太合流或碳箔断裂,请重新开始。
- 细胞悬浮液沉积在网格上
- 使用跳槽中的镊子选择准备好的Au或Cu网格(参见第1.6节)。
- 制备1-5×105 细胞悬浮液(在细菌的情况下光密度吸光度为0.3),并向网格中加入4μL制备的悬浮液。
- 将网格与液滴水平孵育几分钟,以允许细胞沉积,然后将保持网格的镊子置于气候控制的玻璃化室内,设置为适当的温度和湿度条件(步骤1.6.1)。
- 可选:样品的荧光标记
注意: 用荧光标记样品的某些细胞器可能是有益的。根据感兴趣的情况,可以使用特异性荧光团或稳定表达荧光蛋白的细胞或转染以短暂表达目标蛋白。这允许使用冷冻落射荧光显微镜轻松检测细胞,并有助于找到感兴趣的细胞以进行随后的X射线成像。在下文中,该方案仅详细说明了荧光基团的使用。- 为荧光基团准备一个工作溶液(参见制造商的建议)并遵循特定的方案。
- 将荧光基团加入含有网格的培养皿中,轻轻混合。
- 在黑暗环境中孵育,并在孵育完成后直接进入步骤1.6。
注意:一旦孵育完成,重要的是要准备好玻璃化,以避免非特异性标记,从而模糊荧光信号。
- 用于层析成像投影对准的金纳米颗粒(NPs)制备
- 取一等分试样1mL金基准储备溶液(Mistral为100nm或B24为250nm),并以低速离心(以避免聚集)1分钟,以使NPs沉淀。
注意: 如果可能的话,最好让基准点在一夜或更长时间内自然沉降,以避免聚集。 - 取出上清液。在冷冻前,立即将NPs重新悬浮在20μL无血清培养基或缓冲溶液中,以获得均质溶液。
注意: 建议进行超声处理和涡旋处理,以帮助使溶液均质化。
- 取一等分试样1mL金基准储备溶液(Mistral为100nm或B24为250nm),并以低速离心(以避免聚集)1分钟,以使NPs沉淀。
- 急冻网格
注意:液氮会导致冷灼伤,应穿戴适当的防护装备(长实验室外套、安全护目镜、手套、长裤和封闭的鞋子)。乙烷具有高度爆炸性,应远离任何火花或明火。- 按照制造商的说明准备和使用切入式冷冻仪。
注意: 湿度通常设置为80%-90%;温度将取决于细胞类型(酵母最大30°C,哺乳动物细胞37°C,昆虫细胞28°C等)。 - 从边缘的培养皿上取一个带有安装镊子的网格,非常小心不要弯曲网格并将其安装在切入式冷冻设备上。确保细胞朝向远离印迹纸。
- 可选:在贴壁细胞的情况下,在缓冲液中洗涤网格三次。
- 在细胞顶部(通过腔室右侧的孔)加入1.5μL Au NP基准,并在印迹和击落网格之前静置30秒。
注意: 在细胞悬浮的情况下,在安装镊子之前,在网格中仍然处于水平位置时将Au NP基准添加到网格中,并让它们静置30秒。印迹对于高质量电网至关重要。转印距离在开始之前需要校准;印迹纸的平整度对于可重复的印迹很重要(遵循制造商的说明)。需要评估每种细胞类型的印迹时间。 - 为每个条件准备多个网格。转移网格并在低温下储存以保持玻璃化。
- 按照制造商的说明准备和使用切入式冷冻仪。
- 使用冷冻可见光显微镜筛选网格
- 将液氮下的网格从冷冻盒转移到预冷式低温台内的标准冷冻盒(3 mm TEM网格的三个位置)(请参阅制造商的说明)。
- 将冷冻盒放置在冷冻台桥上,冷冻台安装在宽视场落射荧光光显微镜上。
- 使用长工作距离物镜(10x,50x,100x)在-196.5°C下对网格进行成像,以定位适合冷冻SXT成像的细胞并评估网格质量(是否存在厚冰,碳支撑膜的完整性,荧光信号的存在等)。
- 使用明场或/和荧光成像定位感兴趣的细胞。
注意:在此阶段,如果显微镜上存在链接的相机,请捕获图像。将其用于图像关联。 - 筛选后,将网格返回到液氮储存杜瓦瓶中的冷冻箱中。
注意:如果未找到好的样品,请重复样品制备步骤,修改任何参数。通常,需要修改的参数是印迹时间,以防冰太厚或汇合,如果每个网格正方形的细胞太多。
2. 装入透射X射线显微镜(TXM)
- 用液氮冷却转印室,直到达到<100 K,冷却工作站(图3A),然后打开工作站边缘的加热器。等到它停止沸腾。
- 将包含网格的所需冷冻盒放入工作站中的相应位置(图3A)。注意在冷冻条件下安全转移它们。
- 将选定的网格加载到先前冷却的样品架中(图3B);将支架装载到穿梭车上,并用盖子保护它们(图3C)。
- 将穿梭车以<100 K的速度加载到转移室中,并将其泵入低真空(图3D)。
- 将转移室连接到TXM(图4A),并按照屏幕上的真空程序将转移室的穿梭物装载到TXM中(图4B)。
- 一旦穿梭车与样品一起进入内部,TXM机器人手臂就可以一次将一个样品架带到样品台(图4C)。
3. 使用 TXM 软件进行成像
注意:首先使用在线可见光显微镜(VLM)对样品台的网格进行成像,以明场和/或荧光模式绘制网格,然后再用X射线成像。使用左上面板上" 运动控制 "选项卡对应的操纵杆图标打开运动控制。
- 使用联机 VLM 对网格进行成像。
- 明场镶嵌采集
- 选择VLM相机(放大镜>VLM)并打开VLM LED光源以进行明场成像(显微镜>采集>采集设置>光源设置",然后选择"传输")。
- 将样品旋转至-60度,以面对VLM物镜(运动控制>样品>样品θ),并将样品移动到预期的居中位置(运动控制>样品X,样品Y)。
- 首先以20至50μm的步长采集图像,使网格大致聚焦(显微镜 > 采集 > 采集设置 > 采集模式 > 连续 > 开始; 运动控制 > 采样 和更改 样本 Z)。
- 用小步骤细化聚焦,直到细胞和/或碳支撑膜的孔聚焦(显微镜 > 采集 > 采集设置 > 采集模式 > 连续 > 开始;运动控制 > 采样 并更改 样本 Z),并在明场模式下开始采集网格的完整镶嵌图。使用镶嵌的默认值。(显微镜 > 采集 > 采集设置 > 采集模式 > 马赛克 > 开始)。
注意: 镶嵌地图由单个图像组成。应设置图像数(列数、行数以及 X 和 Y 中的步长)以可视化整个网格。步长大小取决于视场 (FoV) 的大小。此处使用默认值。如果网格相对于完整镶嵌 FoV 在 X-Y 平面上未很好地居中,请停止采集,校正样本 X 和 Y 坐标并重复采集。
- 荧光模式镶嵌采集
- 关闭用于明场成像的VLM led光源(显微镜 > 采集 > 采集设置 > 光源设置 并取消选择 透射),并在设置上手动选择与所需激发波长(红色,绿色或蓝色)相对应的LED光源和相应的光学滤光片。
- 细化荧光图像(显微镜 > 采集 > 采集设置 > 采集模式 > 连续 > 开始; 运动控制 > 采样 并更改 样本 Z),然后从明场马赛克中获取保留位置参数(X 和 Y)的镶嵌贴图(显微镜 > 采集 > 采集设置 > 采集模式 > Mosaic > Start)。
- 关闭 LED 光源
- 可选:基于明场和荧光镶嵌图,注释先前(步骤1.7.4)或新ROI(图像中的X-Y位置)确定的感兴趣区域(ROI)。
- 明场镶嵌采集
- X射线马赛克采集
- 选择CCD X射线探测器(放大镜 >选择 Pixis),将样品旋转0度(运动控制 > 样品 并更改 样品θ),并将X射线光学元件(聚光镜和区域板)移动到对齐位置(运动控制 > 聚光镜 >改变 聚光镜z; 运动控制 > 区板 和更改 区板Z)。
注意: 在成像前将CCD芯片冷却至-65°C(显微镜 > 相机温度 > Pixis ,并将 设定温度 更改为-65°C,然后单击 "应用")。 - 将样本移动到所选 ROI 之一(运动控制 > 样本 "的网格正方形的中心,然后更改 "样本 X"、" 样本 Y"。
- 在5μm处使用分档2和出口狭缝以最小化Mistral处的照射和1秒的曝光,并在B24处分档1和60μm,使用样品Z平移调整焦点(显微镜 > 采集 > 采集设置 > 相机设置 并更改 分档; XS>运动控制 并 改变 XS; 显微镜 > 采集 > 采集设置> 采集模式 > 连续 > 启动;运动控制 > 采样 和更改 样本 Z)。从5μm的步骤开始,并将其细化到0.5μm的步骤,直到电池或碳箔孔很好地聚焦。
- 获取网格正方形的马赛克图(显微镜 > 采集 > 采集设置 > 采集模式 > 马赛克 > 开始)。
注意: 马赛克采集参数的确定方式与 VLM 马赛克相同(第 3.1.1.4 节)。步长取决于光束线工作人员预先选择的放大倍率。 - 将样品移动到平场(FF)位置(网格内的空白区域,最好是碳支撑中的孔)(运动控制>样品X,样品Y的样品和更改)。
- 将Mistral的曝光时间设置为1秒,B24处的曝光时间为0.5秒(显微镜 > 采集 > 采集设置 > 相机设置 和更改 曝光时间),并采集单个图像(显微镜 > 采集 > 采集模式 > 单 > 开始)。
- 通过FF图像对采集的镶嵌进行归一化(除以)以获得传输(值介于0和1之间)并保存归一化镶嵌(单击图像右侧右上角的第一个图标打开菜单>选择参考选项卡>单击单个参考并浏览特定的FF)。
- 选择CCD X射线探测器(放大镜 >选择 Pixis),将样品旋转0度(运动控制 > 样品 并更改 样品θ),并将X射线光学元件(聚光镜和区域板)移动到对齐位置(运动控制 > 聚光镜 >改变 聚光镜z; 运动控制 > 区板 和更改 区板Z)。
- 准备收集X射线倾斜系列
注意: 查找要成像的每个感兴趣区域的旋转轴。- 选择镶嵌中的区域以执行断层扫描,即在X射线马赛克贴图中放置一个具有FoV大小的正方形(单击图像窗口左侧的 "工具 ")。
注意: 选择区域时,请考虑与边框的距离(≥10 μm)和其他像元,以避免在旋转过程中像元重叠。此外,检查细胞的状况(预期的细胞形状,冰厚度,玻璃化成功,基准扩散等)。 - 旋转轴上的样品对齐
注意: 报告的过程是迭代的。使用± 60° 角作为最大旋转角 (θM).如果无法触及,请使用尽可能接近± 60° 的角度。- 将相机设置为像素合并2,曝光时间为1 s(显微镜>采集>采集设置>相机设置"并更改曝光时间;更改合并;显微镜>采集>采集模式>连续>开始),将出口狭缝设置为5 μm。
注意: 通过使用最小的出口狭缝孔径来尽可能减少剂量。 - 旋转0°时,使用样本X和样本Y平移移动到先前选择的区域,并专注于使用样本Z平移将细胞的特征放入旋转轴(运动控制 > 采样 并更改 样本x; 样本 y; 样本 z)。
- 将样品旋转到 + θM (运动控制 > 采样 并更改 样品 θ),并在单元格的特征上绘制一条线 (L+)(单击图像窗口右侧的线条工具按钮)以放在旋转轴上。
- 旋转至 -θM (运动控制 > 采样 并更改 样本 θ),然后在要放置在旋转轴上的单元格的特征上绘制一条线 (L-)(单击图像窗口右侧的线条工具按钮)。
- 在 +θM 或 -θM 处,使用样本 Z 平移将所选特征移动到两条线之间的中心位置(运动控制 > 样本 并更改 样本 Z)。
- 迭代地重复步骤 3.3.2.3 中的过程,直到达到 L+ 到 L- 的最小距离。
注意: 与上一次迭代相比,两条线 L+ 和 L- 之间的距离应该更小。 - 在样本 θ = 0(运动控制 > 采样 并更改 样本 θ)时,移动样本 X 两倍于将所选特征置于两条线中心所需的距离(运动控制 > 采样 并更改 样本 X)。移动区域板 (ZP) X 以将特征带回 FoV 的中心(运动控制 > ZP 并更改 ZP X)。每个网格仅执行一次此步骤。
- 通过记录ZP Z焦点系列(不同ZP Z位置的图像集合,通常以0.3μm为步长)(显微镜 > 采集 > 采集设置 > 采集模式 > 焦点系列 > 开始)来重新优化ZP Z位置,并将ZP Z移动到样品聚焦的位置(运动控制 > 区域板 并更改 区域板z)。
- 设置倾斜系列采集的参数。
注意: 最大角度范围最终受ZP焦距的限制(对于40 nm或25 nm ZP,分别为±70或±65度,对于平面样品,分别为25 nm ZP)。优化信噪比 (S/N) 和辐射损伤,以定义曝光时间。对于断层扫描,在不同的角度范围内使用不同的曝光时间。 - 确定最高旋转角度范围,以防在达到最大旋转角度之前发生阴影。
- 将相机合并设置为1(显微镜 > 采集 > 采集设置 > 相机设置 并更改 合并),在Mistral处将退出狭缝打开至15μm(运动控制 > XS 并更改XS),并将旋转设置为0°(运动控制 > 采样 并更改 样品θ)。
- 获取曝光时间为1 s的单个图像(显微镜 > 采集 > 采集设置 > 采集模式 > 单 > 开始"),并估计断层扫描的每个倾斜角度所需的曝光时间。
- 将相机设置为像素合并2,曝光时间为1 s(显微镜>采集>采集设置>相机设置"并更改曝光时间;更改合并;显微镜>采集>采集模式>连续>开始),将出口狭缝设置为5 μm。
- 选择镶嵌中的区域以执行断层扫描,即在X射线马赛克贴图中放置一个具有FoV大小的正方形(单击图像窗口左侧的 "工具 ")。
- 断层扫描采集
- 移动到负最大角度 +0.1(例如,对于 ZP 25 nm,转到 -65.1°)(运动控制 > 采样 并更改 样品 θ)。
- 将图像数量设置为角度总数(考虑到角度为0的图像)和角度范围(显微镜 > 采集 > 采集设置 > 采集模式 > 断层扫描 并更改图像数量;然后,更改 角度开始 和 角度结束)。
- 设置定义的曝光时间并开始采集(显微镜 > 采集 > 采集设置 > 相机设置" ,更改 曝光时间 ,然后单击" 开始")。
- 移动到FF位置(运动控制 > 采样 并更改 样本X;然后,更改 样本Y)并获取10张FF图像(显微镜 > 采集 > 采集模式 > 平均值 并更改图像数量,然后单击 "开始")。
注意: 在Mistral,当通过感兴趣的吸收边缘扫描能量时,获取投影时,可以进行光谱显微镜或能量依赖性显微镜。最终输出是一堆2D投影,其中每个像素中将包含X射线吸收光谱(XAS),即具有化学信息的图像。原则上可以将光谱学与断层扫描相结合扩展到3D。所需的总剂量可能是一个限制,然后可能需要特定的策略,如差异吸收成像。
4. 数据分析
注意:所有数据分析都是使用可用的开放软件和使用自动化管道开发的脚本完成的。
- 在米斯特拉尔
- Pipeline将层析成像堆栈从txrm扩展(TXM软件扩展)转换为hdf5(开源分层数据格式),具有所有需要的元数据,然后通过FF平均值和机器电流对堆栈进行归一化,最后通过光学系统的测量点扩散函数对堆栈进行解卷,用于特定的菲涅耳区板(ZP)透镜和能量23,24.对于反卷积,找到适当的k = 1 / SNR值(取决于样品厚度)。对于在Mistral开发的脚本,键入命令: txrm2deconv"input tomo""input FF" -zp="ZP used" - e= "energy" - dx= "pixel size" - k= " 1/SNR" - t=-1。
- 对于在Mistral开发的用于自动对齐的脚本,键入命令: ctalignxcorr"规范化反卷积堆栈.mrc""规范化堆栈.hdf5"。
注:许多软件应用程序可用于使用Au NP基准点25,26将投影对齐到公共旋转轴。投影的对齐需要亚像素精度。只有当Au NP基准点足够(>7)并在视野中很好地分布时,自动对准才能令人满意。通常需要手动对准 , 以纠正自动对准,以实现尽可能高的精度。 - 要重建对齐的规范化堆栈,请使用几种可用算法中的任何一种。
注意:可以使用加权背投 (WBP) 或同步迭代重建技术 (SIRT) 在几分钟内重建对齐的堆栈。然而,为了保持线性吸收系数(LAC),代数重构技术(ART)优选27。ART需要更多的计算时间,因此首先完成SIRT28 以进行快速自动对齐的倾斜序列重建(在几分钟内进行30次迭代)。一旦对齐令人满意,将使用ART。
- 在 B24
- 自定义构建的管道将 txrm 数据文件转换为具有所有所需元数据的标准 Tiffs,然后将其发送到批处理 runtomo 工作流,该工作流以三种方式处理数据集:WBP、SIRT 和修补程序。
结果
制备用于冷冻 SXT 的样品可能具有挑战性。即使在相同的样本网格中,也可能具有理想的区域和非理想的区域,如图5所示,该 图显示了来自同一Au取景器网格的两个正方形。理想的样品应该在方形网格的中心具有单个细胞,嵌入薄冰层中,并被分散良好的Au基准标记物包围,用于在断层扫描重建之前对齐倾斜投影。 图5A 显示了符合许多这些标准的成纤维细胞样细胞(NIH 3T3)。使用ART27 对标有指示视场(FoV)的红色框的区域进行3D重建的单个切片如图 5B所示。许多不同的细胞器,如线粒体(M),内质网(ER),囊泡(V)和细胞核(N)可以通过LACs的定量重建来区分。此外,重建的信噪比非常高,可实现蜂窝特征的高对比度。另一方面, 图5C 显示了具有较高细胞密度的正方形。因此,印迹效率通常较低,导致冰层变厚,甚至玻璃化问题。在某些情况下,在X射线成像之前使用落射荧光图筛选网格时已经可以观察到这一点,并且应不惜一切代价避免这些网格。在 图5C中,可以观察到网格和玻璃化冰内的裂缝穿过整个网格方块(由红色箭头标记)。应避免在裂纹附近进行任何成像,因为当暴露于光束时,网格可能不稳定。此外,裂缝可能是厚冰的迹象,就像这个地区的情况一样。在标有红色方框的区域记录了倾斜系列。在 图5D中,显示了来自相应3D重建的单个切片。尽管可以识别一些较大的结构,但由于厚冰的玻璃化质量差,在噪声和颗粒状纹理中会丢失精细的细节,例如,在箭头指向的上线粒体上可以看到。
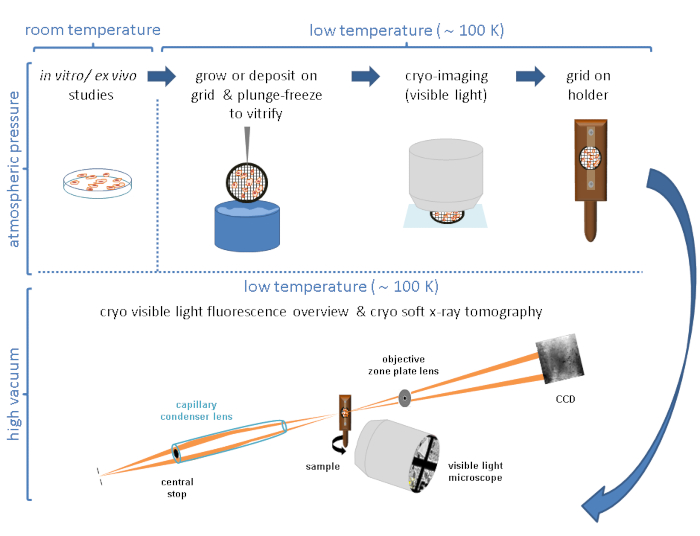
图 1:工作流。 在收集冷冻SXT数据之前遵循的示意图工作流程。 请点击此处查看此图的大图。
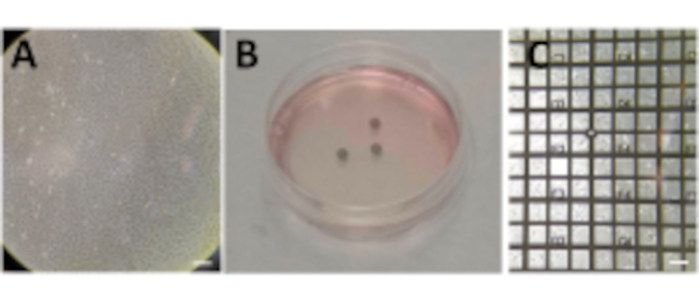
图2:在网格上生长的细胞。(A)在P100培养皿中生长的细胞,汇合度约为80%-90%。(B)P60培养皿,接种细胞后有几个网格。(C)细胞在24小时后在网格顶部生长。比例尺:100 μm。请点击此处查看此图的大图。

图 3:将网格装载到样品架上并放入转移室中。 (A) 充满液氮的工作站,其中有梭子和冷冻箱,准备装载网格。(B)将样品架插入加载器中,并加载网格。(C) 将样品架放在位置 3 的穿梭车,不带盖子。(D) 带有转印室的工作站。 请点击此处查看此图的大图。

图 4:将样品装入 TXM (A) 将转印室连接到 TXM。(B) TXM内部的穿梭巴士。(C) TXM机械臂将样品架插入样品台。 请点击此处查看此图的大图。
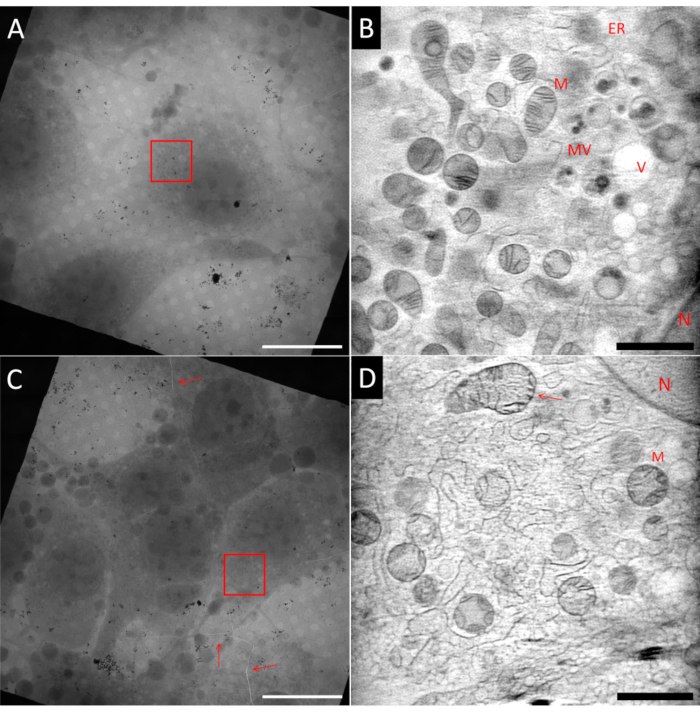
图 5:冷冻软 X 射线断层扫描的示例。上行:理想样品,(A) 网格正方形的 2D 马赛克视图,在中心显示一个孤立的细胞。(B) 重建的 3D 体积中的一个切片,显示带有红色框 (A) 的标记区域。与(D)相比,图像更加平滑,可以看到更多细节。下行:非理想样品,(C)网格正方形的2D马赛克视图,显示过高的细胞汇合度以及冰和网格箔中的裂缝(红色箭头)。(D) 重建的 3D 体积中的一个切片,显示 (C) 中标有红色方框的区域。玻璃化不良或次优可以通过图像的颗粒状纹理来识别。N: 细胞核;M: 线粒体;ER: 内质网;MV:多泡体;V: 真空吸尘器;比例尺:A和C 20μm;B & D 2 μm.V请点击这里查看此图的大图。
讨论
样品制备是获得高质量软X射线断层扫描的关键步骤,因为它们的质量直接取决于样品玻璃化的质量和嵌入细胞的冰层厚度。具有高信噪比的投影将被收集在具有薄冰层的区域,从而最大限度地减少实现最高分辨率所需的辐射剂量。此外,细胞汇合也会影响最终的断层扫描质量,因为应该避免相邻细胞在旋转时进入FoV。最后,Au基准标记的正确色散将决定投影对齐的准确性,然后最终确定最终3D重建体积的质量。请注意,在网格上适当分布 Au 基准点可实现投影对齐步骤的自动化,否则这种关键步骤需要高度的专业知识。
本文的方案仅描述了一种可能的样品制备策略,该策略与冷冻电子断层扫描(cryo-ET)中使用的策略具有相似之处。在这两种情况下,改善苛刻的样品制备以获得更好的再现性的方案将是这些技术成功的基础,并且正在努力实现这一目标29。值得一提的是,除了对分离的细胞进行成像外,还可以可视化组织的各个部分,只要通过该部分的传输信号在高倾斜角度下就足够了。通常,这将意味着几微米(低于10μm)的部分。
要对单元内的特定结构或事件进行成像,需要确保此特定特征位于倾斜系列的FoV内。由于cryo-SXT中的FoV限制在10 x 10 μm2 至15 x 15 μm2 ,具体取决于镜头,并且考虑到分辨率的像素过采样至少为2倍,因此它通常小于全细胞延伸(参见 图5中指示的红色方块)。因此,必须找到并正确标记ROI。这通常是通过荧光标签和可见光相关方法完成的。结合落射荧光的2D策略很简单,因为软X射线透射显微镜具有集成的在线可见光荧光显微镜,但也可以使用其他高分辨率2D或3D荧光信号方法4,12,13,15,16.在这些情况下,网格需要首先在特定仪器(如超分辨率显微镜)中成像。请注意,最有效的相关方法是那些涉及在低温条件下收集数据的方法。这是因为室温(RT),可见光荧光成像和样品玻璃化之间的时间间隔会阻碍按时捕获正确的细胞事件;此外,玻璃化过程可能会将RT成像的感兴趣细胞与网格分离。即使大多数相关成像方法可能意味着必须操纵样品网格并将其从一种仪器运输到另一台仪器,尽管这增加了网格污染或损坏的风险,但回报是显而易见的:能够精确定位细胞景观中的特定事件或分子。
当需要全细胞成像时,如果施加的总剂量不超过辐射损伤限值,则可以拼接不同的断层扫描。通常,在同一细胞上收集少量断层扫描的沉积剂量远低于可实现分辨率(109 Gy)的极限,因此,尽管这是样品和实验依赖性的,因此不需要特定的策略来降低剂量。在诸如光谱断层扫描等密集数据收集的情况下,确实需要尽量减少剂量,并且需要采用方便的数据收集和具体的处理策略。
Cryo-SXT有几个限制,应该在这里提到。第一个是众所周知的缺失楔块,这是使用平面样品支撑的固有特征。过去曾使用过允许180度旋转的毛细管样品载体,并且仍在一些设施中使用,但它们也存在缺点,例如由于玻璃吸收而导致对比度不足以及在悬浮液中使用细胞的限制。减少缺失楔块影响的一种方法是进行双倾斜断层扫描。如今,这在米斯特拉尔光束线上确实是可能的。第二个限制是由这种显微镜中使用的菲涅耳区板透镜设定的。该镜头设定了可实现的最终分辨率和景深(DoF),两者密切相关。这意味着增加分辨率将减少DoF,而电池的厚度通常会更大。例如,40 nm镜头理论上将具有3 μm的DoF和24.4 nm半间距的分辨率。因此,分辨率和DoF之间的折衷是战略性的,镜头的选择将取决于单元30,31的类型。最后,全球可操作的TXM远非理想的显微镜,并且正在努力改进光学系统以达到理论预期。最后,重建体积的可视化和分割可以使用特定的软件工具25,32,33,34进行。
总之,cryo-SXT允许以中等分辨率(25-30nm半间距)和统计数字(每天几十张断层扫描)定量成像细胞。这允许在特定条件下获得细胞器的组织,分布和尺寸,例如,在病原体感染或疾病期间,在精确的时间点或特定治疗之后。因此,它是对更常见的电子和可见光显微镜的有用的补充生物成像技术,每种显微镜都处理特定范围的样品尺寸和分辨率。Cryo-SXT经常用于涉及可见光荧光的相关方法,但其他冷冻相关策略也是可能的。
披露声明
作者声明没有利益冲突。
致谢
该项目已获得欧盟委员会地平线2020 iNEXT-发现项目和欧盟地平线2020研究与创新计划的资助,该计划根据Marie Skłodowska-Curie赠款协议No 75439。
材料
| Name | Company | Catalog Number | Comments |
| Amira | Thermo Fisher | Software for segmentation | |
| Au Holey Carbon Films finder grids | (Quantifoil Micro Tools Gmb | R 2/2 Au G200F1 | Au Holey Carbon Films finder grids |
| Au nanoparticles | BBI Group, Cardiff, UK | Au nanoparticles 100nm | 100 nm Au nanoparticles (NPs) at Mistral (Alba) |
| Au nanoparticles | BBI Group, Cardiff, UK | Au nanoparticles 250nm | 250 nm Au nanoparticles (NPs) at B24 (Diamond) |
| Axio Scope A1 | Zeiss | 430035 9060 | Fluorescence microscope |
| Blotting No.1 filter paper | Whatman | WHA10010155 | Blotting filter |
| Bsoft | Software for projection alignment, reconstruction and visualization (Heymann et al., 2008) | ||
| Chimera | Software for segmentation (Pettersen et al. 2004) | ||
| Cryo-EM Glow Discharge Set | PELCO easiGlow | 91000S | Glow Discharge Cleaning System |
| Cu Holey Carbon Films finder grids | (Quantifoil Micro Tools Gmb | R 2/2Cu G200F1 | Cu Holey Carbon Films finder grids |
| Fetal calf serum | Sigma | F9665 | Heat Inactivated, sterile-filtered, suitable for cell culture |
| ImageJ | Software for image processing and analysis in Java (NIH & LOCI University of Wisconsin) | ||
| IMOD | Software for projection alignment, reconstruction and visualization (Kremer et al., 1996) | ||
| Leica EM GP Grid Plunger | Leica | 16706401 | Automatic Plunge Freezer EM |
| LINKAM cryo-stage | Linkam Scientific Instruments | CMS 196 | Cryo-Correlative Microscopy Stage |
| MIB | Software for segmentation (Belevich et al. 2016) | ||
| P100 Petri dish | Sigma | P6106 | Treated for cell culture and sterile |
| P60 Petri dish | Sigma | D8054 | Treated for cell culture and sterile |
| Polylysin | Sigma | P4707 | Poly-L-lysine solution 0.01%, sterile-filtered |
| Soft X-Ray microscope 0.25-1.2keV | Xradia | NCT-SB | Transmission soft X-Ray microscope |
| SURVOS | Software for segmentation (Luengo et al. 2017) | ||
| Tomo3d | Software for reconstruction (SIRT, WBP) (Agulleiro et al. 2011) | ||
| TomoJ | Software for reconstruction (ART) (Messaoudi et al., 2007) | ||
| XM Data Explorer | Zeiss | TXM software |
参考文献
- Carrascosa, J. L., et al. Cryo X-ray tomography of vaccinia virus membranes and inner compartments. Journal of Structural Biology. 168, 234-239 (2009).
- Uchida, M., et al. Soft X-ray tomography of phenotypic switching and the cellular response to antifungal peptoids in Candida albicans. PNAS. 106, 19375-19380 (2009).
- Schneider, G., et al. Three-dimensional cellular ultrastructure resolved by X-ray microscopy. Nature Methods. 10, 1-3 (2010).
- Chichón, F. J., et al. Cryo nano-tomography of vaccinia virus infected cells. Journal of Structural Biology. 177, 202-211 (2012).
- Groen, J., Conesa, J. J., Valcárcel, R., Pereiro, E. The cellular landscape by soft X-ray tomography. Biophysical Reviews. 11, 611-619 (2019).
- Kepsutlu, B., et al. Cells undergo major changes in the quantity of cytoplasmic organelles after uptake of gold nanoparticles with biologically relevant surface coatings. ACS Nano. 14, 2248-2264 (2020).
- Natterer, F. . The mathematics of computerized tomography. , (1986).
- Weiss, D., et al. Computed tomography of cryogenic biological specimens based on X-ray microscopic images. Ultramicroscopy. 84, 185-197 (2000).
- Clowney, E. J., et al. Nuclear aggregation of olfactory receptor genes governs their monogenic expression. Cell. 151, 724-737 (2012).
- Duke, E. M. H., et al. Imaging endosomes and autophagosomes in whole mammalian cells using correlative cryo-fluorescence and cryo-soft X-ray microscopy (cryo-CLXM). Ultramicroscopy. 143, 77-87 (2014).
- Cinquin, B., et al. Putting molecules in their place. Journal of Cellular Biochemistry. 115, 209-216 (2014).
- Hagen, C., et al. Multimodal nanoparticles as alignment and correlation markers in fluorescence/soft X-ray cryo-microscopy/tomography of nucleoplasmic reticulum and apoptosis in mammalian cells. Ultramicroscopy. 146, 46-54 (2014).
- Pérez-Berná, A. J., et al. Structural changes in cells images by soft X-ray cryo-tomography during Hepatitis C virus infection. ACS Nano. 10, 6597-6611 (2016).
- Chiappi, M., et al. Cryo-soft X-ray tomography as a quantitative three-dimensional tool to model nanoparticle:cell interaction. Journal of Nanobiotechnology. 14, 15 (2016).
- Varsano, N., et al. Development of correlative cryo-soft X-ray tomography and stochastic reconstruction microscopy. A study of cholesterol crystal early formation in cells. Journal of the American Chemical Society. 138, 14931-14940 (2016).
- Kounatidis, I., et al. Correlative cryo-structured illumination fluorescence microscopy and soft X-ray tomography elucidates reovirus intracellular release pathway. Cell. 182, 1-16 (2020).
- Kapishnikov, S., et al. Mode of action of quinoline antimalarial drugs in red blood cells infected by Plasmodium falciparum revealed in vivo. PNAS. 116 (46), 22946-22952 (2019).
- Conesa, J. J., et al. Unambiguous intracellular localization and quantification of a potent iridium anticancer compound by correlative 3D cryo X-ray imaging. Angewandte Chemie International Edition. 59, 1270-1278 (2020).
- Gal, A., et al. Native-state imaging of calcifying and noncalcifying microalgae reveals similarities in their calcium storage organelles. PNAS. 115 (43), 11000-11005 (2018).
- Procopio, A., et al. Chemical fingerprint of Zn-hydroxyapatite in the early stages of osteogenic differentiation. ACS Central Science. 5, 1449-1460 (2019).
- Kahil, K., et al. Cellular pathways of calcium transport and concentration toward mineral formation in sea urchin larvae. PNAS. 117 (49), 30957-30965 (2020).
- Conesa, J. J., et al. Intracellular nanoparticles mass quantification by near-edge absorption soft X-ray nanotomography. Scientific Reports. 6, 22354 (2016).
- Otón, J., Sorzano, C. O. S., Maribini, R., Pereiro, E., Carazo, J. M. Measurement of the modulation transfer function of an X-ray microscope based on multiple Fourier orders analysis of a Siemens star. Optics Express. 23 (8), 9567-9572 (2015).
- Otón, J., et al. Characterization of transfer function, resolution and depth of field of a soft X-ray microscope applied to tomography enhancement by Wiener deconvolution. Biomedical Optics Express. 7, 5092-5103 (2016).
- Kremer, J. R., Mastronarde, D. N., McIntosh, J. R. Computer visualization of three-dimensional image data using IMOD. Journal of Structural Biology. 116, 71-76 (1996).
- Heymann, J. B., Cardone, G., Winkler, D. C., Steven, A. C. Computational resources for cryo-electron tomography in Bsoft. Journal of Structural Biology. 161, 232-242 (2008).
- Messaoudi, C., et al. Three-dimensional chemical mapping by EFTEM-TomoJ including improvement of SNR by PCA and ART reconstruction of volume by noise supression. Microscopy Microanalysis. 19, 1669-1677 (2013).
- Agulleiro, J. I., Fernández, J. J. Fast tomographic reconstruction on multicore computers. Bioinformatics. 27, 582-583 (2011).
- Toro-Nahuelpan, M., et al. Tailoring cryo-electron microscopy grids by photo-micropatterning for in-cell structural studies. Nature Methods. 17, 50-54 (2020).
- Attwood, D. . Soft X-rays and Extreme Ultraviolet Radiation. Principles and Applications. , (2000).
- Howells, M., Jacobsen, C., Warwick, T. . Principles and Applications of Zone Plate X-ray. Microscopes. Science of Microscopy. , (2007).
- Pettersen, E. F., et al. UCSF Chimera--a visualization system for exploratory research and analysis. Journal of Computational Chemistry. 25, 1605-1612 (2004).
- Belevich, I., Joensuu, M., Kumar, D., Vihinen, H., Jokitalo, E. Microscopy image browser: a platform for segmentation and analysis of multidimensional datasets. PLOS Biology. 14 (1), 1002340 (2016).
- Luengo, I., et al. SuRVoS: Super-region volume segmentation workbench. Journal of Structural Biology. 198, 43-53 (2017).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。