Method Article
Cryo Soft X-ray Tomografisi ile Hücrenin 3D Kartografik Açıklaması
Bu Makalede
Özet
Burada, kriyo yumuşak X-ışını tomografisinde (SXT) kriyo-korunmuş hücrelerin ultrayapısını 25 nm yarım perde çözünürlükte görüntülemek için gerekli numune hazırlama ve veri toplama adımlarını açıklayan bir protokol sunulmaktadır.
Özet
Görüntüleme teknikleri, biyolojik araştırmalarda ve ilgili alanlarda hücre organizasyonunu ve makinelerini anlamak için temeldir. Bu teknikler arasında, kriyo yumuşak X-ışını tomografisi (SXT), karbon yapılarının sudan doğal olarak daha yüksek emilime sahip olduğu su penceresi X-ışını enerji aralığındaki (284-543 eV) tüm kriyo korunmuş hücrelerin görüntülenmesini sağlar ve her vokelde bulunan malzemenin doğrusal absorpsiyon katsayısının 3D rekonstrüksiyonuna izin verir. 10 μm kalınlığa kadar tüm hücreler seviyesindeki nicel yapısal bilgi, 25-30 nm yarım perdeye kadar yüksek verim ve uzamsal çözünürlük ile bu şekilde elde edilebilir. Cryo-SXT, hücresel enfeksiyon süreçleri (virüs, bakteri veya parazitler), hastalıklara bağlı morfolojik değişiklikler (resesif genetik hastalıklar gibi) hakkında 3D bilgi sağlayarak ve hücresel düzeyde ilaç etkisini anlamamıza yardımcı olarak veya 3D hücresel ortamdaki belirli yapıları konumlandırmamıza yardımcı olarak mevcut biyomedikal araştırmalarla ilgili olduğunu kanıtlamıştır. Ek olarak, senkrotron tesislerindeki ayarlanabilir dalga boyundan yararlanarak, spektro-mikroskopi veya 3D muadili spektro-tomografi, biyomineralizasyon işlemlerinde kalsiyum gibi hücredeki spesifik elementleri görüntülemek ve ölçmek için de kullanılabilir. Kriyo-SXT, elektron mikroskobu, X-ışını floresansı veya görünür ışık floresansı gibi diğer biyolojik görüntüleme tekniklerine tamamlayıcı bilgiler sağlar ve genellikle fonksiyon, konum ve morfolojiyi birbirine bağlamak için kriyojenik koşullarda 2D veya 3D korelasyon görüntüleme için ortak bir yöntem olarak kullanılır.
Giriş
Cryo-SXT, hidratlanmış bütün hücrelerin 1,2,3,4,5,6 hacimlerini 3D orta çözünürlüklü (25-30 nm yarım perde) sağladığı için biyolojik görüntüleme araştırmalarında merkezi bir rol oynayabilir. Su penceresi enerji aralığında, karbon ve oksijen absorpsiyonu K kenarları (4.4-2.3 nm) arasında, karbon bakımından zengin hücresel yapılar, onlara nüfuz eden ve onları çevreleyen oksijen bakımından zengin ortamdan 10 kat daha fazla emer. Bu enerji aralığında, 10 μm kalınlığa kadar vitrifiye hücreler, kesitleme veya boyama işlemine gerek kalmadan görüntülenebilir, bu da numune rotasyon yetenekleriyle birleştiğinde, hücresel yapının tomografik rekonstrüksiyonuna izin veren nicel yüksek absorpsiyon kontrast projeksiyonlarına yol açar. Cryo-SXT, numune boyutları ve uzamsal çözünürlük açısından başka herhangi bir görüntüleme tekniği tarafından kolayca erişilemeyen bir boşluğu doldurur.
Kısacası, kriyo-SXT'nin absorpsiyon kontrastı nicelikseldir, çünkü fotonların t kalınlığı örneği boyunca zayıflaması Beer-Lambert yasasına aşağıdaki gibi uyar: 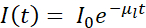 Burada I0, olay yoğunluğunu temsil eder ve μl λ dalga boyuna ve numunenin kırılma indisinin hayali kısmına bağlı olan doğrusal absorpsiyon katsayısı β (
Burada I0, olay yoğunluğunu temsil eder ve μl λ dalga boyuna ve numunenin kırılma indisinin hayali kısmına bağlı olan doğrusal absorpsiyon katsayısı β (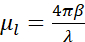 ). Zayıflama, biyokimyasal bileşimin ve görüntülenen yapıların kalınlığının bir fonksiyonudur ve her biyokimyasal bileşen, l'μ (LAC) belirli bir X-ışını doğrusal absorpsiyon katsayısına sahiptir. Bu, her tomografi voksel değerinin kimyasal elementlere ve bunların voksel7'deki konsantrasyonlarına bağlı olduğu anlamına gelir. Bu, çekirdekler, nükleoller, lipit cisimleri veya mitokondri gibi farklı organellerin doğal ayrımcılığına veya kromatinin farklı sıkıştırma durumlarına, yalnızca doğal LAC değerlerine dayanarak yeniden yapılandırılmasına izin verir 2,8,9.
). Zayıflama, biyokimyasal bileşimin ve görüntülenen yapıların kalınlığının bir fonksiyonudur ve her biyokimyasal bileşen, l'μ (LAC) belirli bir X-ışını doğrusal absorpsiyon katsayısına sahiptir. Bu, her tomografi voksel değerinin kimyasal elementlere ve bunların voksel7'deki konsantrasyonlarına bağlı olduğu anlamına gelir. Bu, çekirdekler, nükleoller, lipit cisimleri veya mitokondri gibi farklı organellerin doğal ayrımcılığına veya kromatinin farklı sıkıştırma durumlarına, yalnızca doğal LAC değerlerine dayanarak yeniden yapılandırılmasına izin verir 2,8,9.
Ek olarak, kriyo-SXT, tomogramların birkaç dakika içinde toplanmasıyla yüksek verimli bir tekniktir. Bu, özellikle bölünme, farklılaşma ve apoptoz gibi kilit zaman noktalarında, aynı zamanda spesifik ilaç tedavilerine veya patojenik enfeksiyonlara kimyasal maruziyetin neden olduğu gibi farklı yanıt durumlarında yakalanabilen hücre popülasyonlarının mezoölçekli görüntülenmesini sağlar. Bu kilit noktalarda toplanan veriler, bu belirli anlarda farklı hücresel organellerin mekansal organizasyonunun sadık bir kaydı ile sistemin 3D tanımını sunacaktır.
Genellikle, kriyo-SXT, 3D hücresel ortam 4,10,11,12,13,14,15,16 veya sert X-ışını floresan verileri 17,18 içinde belirli özelliklerin, olayların veya makromoleküllerin bulunmasına izin veren korelasyon yaklaşımlarını izleyen diğer tekniklerle birlikte kullanılır. . Kriyojenik koşullardaki korelasyon yaklaşımları, ilgilenilen sistemin en eksiksiz ve değerli resmini elde etmek için büyük önem taşımaktadır. Mistral (Alba) ve B24 (Diamond) kriyo-SXT ışın hatlarındaki tipik iş akışının kısa bir özeti Şekil 1'de çizilmiştir.
Ayrıca, senkrotron tesislerindeki dalga boyu ayarlama yeteneğinden yararlanarak, numunede bulunan belirli elemanların spesifik diferansiyel absorpsiyonu kullanılarak yapısal olana ek olarak spektroskopik bilgi elde edilebilir. Bunun bir örneği, 19,20,21 hücrelerindeki biyomineralizasyon işlemlerinin incelenmesinde kalsiyumun yeri olabilir. Farklı foton enerjilerinde (spektrumlar) veya tomogramlarda ve ilgilenilen x-ışını absorpsiyon kenarında 2D görüntüler çekerek, seçilen elemanı içeren pikseller veya vokseller tanımlanabilir. Spektrumlar ayrıca kimyasal durumların farklılaşmasına izin verir (yani, önceki biyomineralizasyon örneği20'de olduğu gibi amorf kalsiyumun hidroksiapatit'e evrimi). Farklı elemanların nicelleştirilmesi 2D ve 3D olarak mümkündür. Vitrifiye hücrelerin spektroskopik görüntülemesi tipik olarak su penceresinde yapılır, ancak su içeriği yeterince düşükse veya dehidrasyon da dahil olmak üzere diğer numune hazırlama protokolleri kullanılıyorsa diğer enerji aralıklarında da mümkündür22. Ayrıntılı bir spektroskopi adım adım protokolü, buradaki protokolün odağının ötesindedir.
Bundan sonra, protokol ana numune hazırlama adımlarını kısaca özetlemeye odaklanır, ancak her sistem bireysel iyileştirmeye ihtiyaç duyabilir, ardından kriyo yumuşak X-ışını tomografisi için ayrıntılı bir adım adım veri toplama prosedürü izler.
Protokol
1. Numune hazırlama
- Şebeke desteğinin hazırlanması
- Izgaraları 3 saat boyunca UV ile ışınlayın, karbon film sterilizasyon için yukarı bakacak şekilde.
- İsteğe bağlı: Hücrelerle ilgili kılavuza bağlanmamasıyla ilgili sorunlar olması durumunda, aşağıdaki adımlardan birini kullanın.
- Numune yayılımını ve daha iyi hücre yapışmasını artırmak için ızgaraların plazma muamelesi ile karbon destek folyosunu hidrofilize edin.
- Izgaraları karbon tarafını kızdırma boşaltma odası ekipmanına yerleştirin ve ızgarayı ekipmana bağlı olarak 30 s ila 15 dakika (Ar veya / veO2 kullanarak) plazmaya maruz bırakın.
- Poli-L-lizin (PLL) ile ızgaraları işlevselleştirin
- Petri kabına ayrı ayrı 60 μL PLL damlaları ekleyin ve ızgarayı karbon filmi aşağı bakacak şekilde PLL damlasının üzerine yerleştirin. 37 °C'de 30 dakika boyunca inkübe edin ve bir filtre kağıdı kullanarak PLL'yi lekeleyin.
- Izgaraları fetal sığır serumu (FBS) ile işlevselleştirin.
- Izgaraları bir gecede FBS'ye batırın. Yıkamak için ızgaraları bir tampon çözeltisine batırın ve fazla sıvıyı gidermek için ızgarayı bir filtre kağıdına bırakın.
- Numune yayılımını ve daha iyi hücre yapışmasını artırmak için ızgaraların plazma muamelesi ile karbon destek folyosunu hidrofilize edin.
- Izgaralarda yapışkan hücrelerin büyümesi
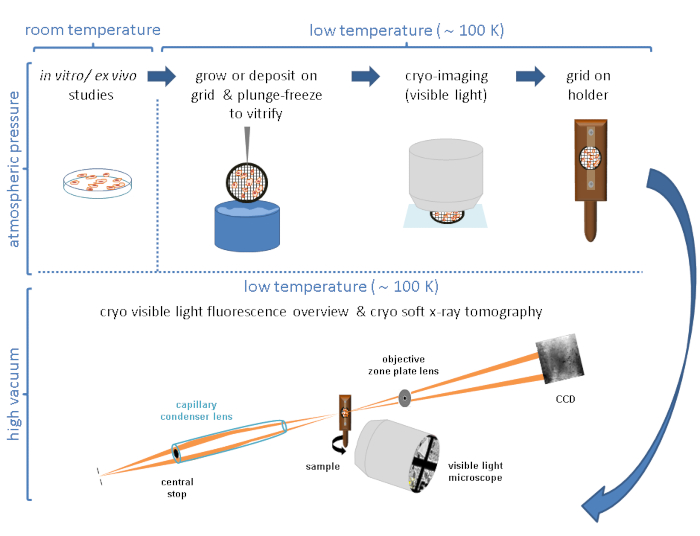
- 100 mm'lik bir hücre kültürü kabındaki hücreleri büyüterek %80-%90 akıcılığa ulaşın (Şekil 2A).
- Bir P60 Petri kabında (toplam 3 mL) Au ızgaralarının üstünde tohum 1-5 x 105 hücre/mL (sisteme göre değeri ayarlayın).
NOT: Hücre süspansiyonunun eklenmesi, ızgaranın karbon filmi 60 mm'lik bir hücre kültürü kabında yukarı bakacak şekilde çok dikkatli bir şekilde yapılmalıdır. Koşul başına birkaç ızgara, P60 Petri kabı başına bir koşul hazırlayın (Şekil 2B). - Izgaradaki akıcılık her ağ karesinde birkaç hücreye (hücre boyutuna bağlı olarak 1 ila 10) ulaşana kadar hücrelerin yerleşmesine izin verin (hücre çizgisine bağlı olarak, bu 24 saate kadar sürebilir).
NOT: Donmadan önce, ızgaralar görünür ışık mikroskobu (VLM) ile kontrol edilmeli, karbon film bütünlüğünün yanı sıra her ızgaradaki hücre akıcılığı değerlendirilmelidir (Şekil 2C). Izgaradaki uygun hücre yoğunluğuna ulaşılana kadar bekleyin. Izgara çok akıcıysa veya karbon folyo kırılmışsa, baştan başlayın.
- Izgaralarda süspansiyondaki hücrelerin biriktirilmesi
- Dalma dondurucudaki cımbızı kullanarak hazırlanmış bir Au veya Cu ızgarası seçin (bkz. bölüm 1.6).
- 1-5 x 105 hücreli bir süspansiyon hazırlayın (bakteri durumunda 0.3 optik yoğunluk emilimi) ve hazırlanan süspansiyonun 4 μL'sini ızgaraya ekleyin.
- Hücrelerin birikmesine izin vermek için ızgarayı birkaç dakika boyunca yatay olarak damla ile inkübe edin ve ardından ızgarayı tutan cımbızı, uygun sıcaklık ve nem koşullarına ayarlanmış iklim kontrollü vitrifikasyon odasının içine yerleştirin (adım 1.6.1).
- İsteğe bağlı: numunelerin floresan etiketlemesi
NOT: Numunenin bazı organellerini floresan olarak etiketlemek faydalı olabilir. İlgi alanına bağlı olarak, bir floresan proteinini kararlı bir şekilde eksprese eden veya ilgilenilen bir proteinin geçici ifadesi için transfekte edilen spesifik floroforlar veya hücreler kullanılabilir. Bu, kriyo-epifloresan mikroskopi kullanarak hücrelerin kolayca tespit edilmesini sağlar ve sonraki X-ışını görüntülemesi için ilgilenilen hücrelerin bulunmasına yardımcı olur. Aşağıda, protokol sadece floroforların kullanımını detaylandırır.- Florofor için çalışan bir çözelti hazırlayın (üreticinin tavsiyesine bakın) ve özel protokolü izleyin.
- Floroforları, ızgaraları içeren Petri kabına ekleyin ve yavaşça karıştırın.
- Karanlık bir ortamda kuluçkaya bırakın ve inkübasyon bittikten sonra doğrudan adım 1.6'ya gidin.
NOT: Spesifik olmayan etiketlemeyi ve dolayısıyla bulanık floresan sinyalini önlemek için inkübasyon bittikten sonra vitrifiye hazır olmak önemlidir.
- Tomogram projeksiyon hizalaması için Au nanopartikülleri (NP'ler) hazırlığı
- Au fiducial stok çözeltisinin 1mL'lik bir aliquot'unu (Mistral'de 100 nm veya B24'te 250 nm) alın ve NP'lerin peletlenmesine izin vermek için 1 dakika boyunca düşük hızda (kümelenmeyi önlemek için) santrifüj yapın.
NOT: Mümkünse, toplanmayı önlemek için referansların bir gecede veya daha fazla doğal olarak yerleşmesi için bırakılması tercih edilir. - Süper natantı çıkarın. Donmadan hemen önce, homojen bir çözelti elde etmek için NP'leri 20 μL serumsuz ortam veya tampon çözeltisinde tekrar askıya alın.
NOT: Çözümü homojenize etmeye yardımcı olmak için sonikasyon ve vorteksleme önerilir.
- Au fiducial stok çözeltisinin 1mL'lik bir aliquot'unu (Mistral'de 100 nm veya B24'te 250 nm) alın ve NP'lerin peletlenmesine izin vermek için 1 dakika boyunca düşük hızda (kümelenmeyi önlemek için) santrifüj yapın.
- Dalma donma ızgaraları
DİKKAT: Sıvı azot soğuk yanıklarına neden olabilir ve uygun koruyucu ekipman giyilmelidir (uzun laboratuvar önlüğü, güvenlik gözlükleri, eldivenler, uzun pantolonlar ve kapalı ayakkabılar). Etan oldukça patlayıcıdır ve herhangi bir kıvılcımdan veya açık ateşten uzak tutulmalıdır.- Dalma dondurucu cihazını hazırlamak ve kullanmak için üreticinin talimatlarını izleyin.
NOT: Nem genellikle% 80 -% 90 olarak ayarlanır; sıcaklık hücre tipine bağlı olacaktır (maya maksimum 30 ° C, memeli hücreleri 37 ° C, böcek hücreleri 28 ° C, vb.). - Petri kabından jant tarafından monte edilen cımbızlarla bir ızgara alın, ızgarayı bükmemeye ve dalma dondurucu cihazına monte etmemeye büyük özen gösterin. Hücrelerin leke kağıdından uzağa baktığından emin olun.
- İsteğe bağlı: yapışkan hücreler durumunda ızgarayı tamponda üç kez yıkayın.
- Hücrelerin üstüne 1,5 μL Au NP referansları ekleyin (odanın sağ tarafındaki delikten) ve ızgarayı lekelemeden ve daldırmadan önce 30 sn boyunca yerleşmeye bırakın.
NOT: Süspansiyondaki hücreler söz konusu olduğunda, cımbızı monte etmeden önce hala yatay konumdayken ızgaraya Au NP referansları ekleyin ve 30 sn için yerleşmelerine izin verin. Lekeleme, yüksek kaliteli ızgaralar için çok önemlidir. Başlamadan önce lekelenme mesafesinin kalibre edilmesi gerekir; Kurutma kağıdının düzlüğü, tekrarlanabilir lekelenme için önemlidir (üreticinin talimatlarını izleyin). Lekelenme süresinin her hücre tipi için değerlendirilmesi gerekir. - Koşul başına birkaç ızgara hazırlayın. Vitrifikasyonu korumak için ızgarayı aktarın ve kriyojenik sıcaklıklarda saklayın.
- Dalma dondurucu cihazını hazırlamak ve kullanmak için üreticinin talimatlarını izleyin.
- Kriyogörünür ışık mikroskobu ile tarama ızgaraları
- Sıvı azot altındaki ızgaraları kriyo-kutulardan önceden soğutulmuş bir kriyo aşaması içindeki standart bir kriyo-kasete (3 mm TEM ızgaraları için üç konum) aktarın (üreticinin talimatlarına bakın).
- Kriyo-kaset, kriyo-aşama köprüsüne yerleştirilir ve kriyo-aşama, geniş alan epifloresan ışık mikroskobu üzerine monte edilir.
- Kriyo-SXT görüntüleme için uygun hücreleri bulmak ve ızgara kalitesini (kalın buzun varlığı, karbon destek filminin bütünlüğü, floresan sinyalinin varlığı, vb.) değerlendirmek için uzun bir çalışma mesafesi hedefi (10x, 50x, 100x) kullanarak ızgaraları -196.5 ° C'de görüntüleyin.
- Parlak alan ve/veya floresan görüntüleme kullanarak ilgilenilen hücreleri lokalize edin.
NOT: Bu aşamada, mikroskopta bağlı bir kamera varsa görüntüleri yakalayın. Görüntü korelasyonu için kullanın. - Taramadan sonra, ızgaraları sıvı azot depolama dewar'ındaki kriyo-kutulara geri koyun.
NOT: İyi bir numune bulunamazsa, parametrelerden herhangi birini değiştirerek numune hazırlama adımlarını tekrarlayın. Genellikle, modifikasyon gerektiren parametreler, buzun çok kalın olması veya ağ karesi başına çok fazla hücre olması durumunda, akıcılık durumunda lekelenme süresidir.
2. İletim X-Işını Mikroskobuna Yükleme (TXM)
- Transfer odasını <100 K'ya ulaşana kadar sıvı azotla soğutun, iş istasyonunu soğutun (Şekil 3A) ve iş istasyonu jantının ısıtıcısını açın. Kaynamayı bırakana kadar bekleyin.
- Izgaraları içeren gerekli kriyo-kutuları iş istasyonundaki ilgili yerlere koyun (Şekil 3A). Kriyoklima koşullarında güvenli bir şekilde aktarmaya dikkat edin.
- Seçilen ızgaraları önceden soğutulmuş numune tutuculara yükleyin (Şekil 3B); tutucuları mekiğe yükleyin ve kapaklarla koruyun (Şekil 3C).
- Mekiği <100 K'da transfer odasına yükleyin ve düşük vakuma pompalayın (Şekil 3D).
- Transfer odasını TXM'ye takın (Şekil 4A) ve mekiği ekrandaki vakum prosedürünü izleyerek transfer odasından TXM'ye yükleyin (Şekil 4B).
- Mekik numunelerle içeri girdikten sonra, TXM robot kolu numune aşamasına bir seferde bir numune tutucu getirebilir (Şekil 4C).
3. TXM yazılımını kullanarak görüntüleme
NOT: Numune aşamasındaki ızgaralar, X-ışınlarıyla görüntülenmeden önce ızgarayı parlak alan ve/veya floresan modunda eşlemek için ilk önce çevrimiçi görünür ışık mikroskobu (VLM) kullanılarak görüntülenir. Hareket Kontrolü'nü açmak için sol üst paneldeki Hareket Kontrolü sekmesine karşılık gelen joystick simgesini kullanın.
- Izgarayı on-line VLM ile görüntüleme.
- Parlak alan mozaiği edinimi
- VLM kamerayı seçin (VLM > büyüteç) ve parlak alan görüntüleme için VLM led kaynağını açın (Mikroskop > Alma > Edinme Ayarları > Kaynak Ayarları'nı seçin ve İletim'i seçin).
- VLM hedefine (Hareket Kontrolü > Örnek > Örnek θ) yüzleşmek için numuneyi -60 dereceye döndürün ve numuneyi beklenen ortalanmış konumlara taşıyın (Hareket Kontrolü > Numune ve Örnek X, Örnek Y'yi değiştirin).
- Izgarayı kabaca odak noktasına getirmek için önce 20 ila 50 μm'lik adımlarla görüntüler elde ederken (Mikroskop > Edinme > Edinme Ayarları > Edinme Modları > Sürekli > Başlangıcı; Hareket Kontrolü > Örnek ve Numune Z'yi değiştirin).
- Karbon destek filminin hücreleri ve/veya delikleri odaklanana kadar odağı 5 μm'ye kadar daha küçük adımlarla hassaslaştırın (Mikroskop > Edinme > Edinme Ayarları > Edinme Modları > Sürekli > Başlangıcı ; Hareket Kontrolü > Örnek Z'yi örnekleyin ve değiştirin) ve parlak alan modunda ızgaranın tam bir mozaik haritasının alınmasına başlayın. Mozaik için varsayılan değerleri kullanın. (Mikroskop > Edinme > Edinme Ayarları > Edinme Modları > Mozaik > Başlangıç).
NOT: Tek görüntülerden bir mozaik harita yapılır. Görüntü sayısı (sütun sayısı, satır sayısı ve X ve Y'deki adım boyutu) tüm ızgarayı görselleştirmek için ayarlanmalıdır. Adım boyutu, görüş alanının boyutuna (FoV) bağlıdır. Varsayılan değerler burada kullanılır. Izgara, tam mozaik FoV'ye göre X-Y düzleminde iyi ortalanmamışsa, edinimi durdurun, örnek X ve Y koordinatlarını düzeltin ve edinimi tekrarlayın.
- Floresan modu mozaik edinimi
- Parlak alan görüntüleme için VLM liderliğindeki kaynağı kapatın (Mikroskop > Alma > Alma Ayarları > Kaynak Ayarları ve İletim seçimini kaldırın) ve istenen uyarma dalga boyuna (kırmızı, yeşil veya mavi) karşılık gelen LED ışık kaynağını ve ilgili optik filtreyi kurulumda manuel olarak seçin.
- Floresan görüntüye odaklanmayı hassaslaştırın (Mikroskop > Edinme > Edinme Ayarları > Edinme Modları > Sürekli > Başlangıç; Hareket Kontrolü > Örnek Z'yi örnekleyin ve değiştirin) ve ardından parlak alan mozaiğinden konumsal parametreleri (X ve Y) koruyan bir mozaik harita elde edin (Mikroskop > Edinme > Edinme Ayarları > Edinme Modları > Mozaik > Başlangıç).
- LED ışık kaynağını kapatın
- İsteğe bağlı: Parlak alan ve floresan mozaik haritalarına dayanarak, daha önce tanımlanan ilgi alanlarına (YG) (adım 1.7.4) veya yeni YG'ye (görüntüdeki X-Y konumları) açıklama ekleyin.
- Parlak alan mozaiği edinimi
- X-ışını mozaik edinimi
- CCD X-ışını dedektörünü seçin (Büyüteç > Pixis'i seçin), numuneyi 0 derece döndürmeye getirin (Hareket Kontrolü > Numune ve Numune θ'yu değiştirin) ve X-ışını optiklerini (Kondenser ve Bölge Plakası) hizalanmış konumlara taşıyın (Hareket Kontrolü > Kondenser > Kondenser z'yi değiştirin; Hareket Kontrolü > Bölge Plakasını ve Bölge Plakasını Z'yi değiştirin).
NOT: Görüntülemeden önce CCD çipini -65 °C'ye soğutun (Pixis > Mikroskop > Kamera sıcaklığı ve ayarlanan sıcaklığı -65 °C olarak değiştirin ve Uygula'ya tıklayın). - Numuneyi, seçilen ROI'lerden birinin ağ karesinin ortasına taşıyın (Hareket Kontrolü > Numune ve Örnek X, Örnek Y'yi değiştirin).
- Mistral'de ışınlamayı ve 1 sn'lik pozlamayı en aza indirmek için 5 μm'de binning 2 ve çıkış yarığını kullanın ve B24'te 1 ve 60 μm'yi bağlayın, örnek Z çevirisini kullanarak odağı ayarlayın (Kamera Ayarları > Alma > Alma Ayarları > Mikroskop ve bağlamayı değiştirin; XS > Hareket Kontrolü ve XS'yi değiştirmek; Mikroskop > Edinme > Edinme Ayarları> Sürekli > Başlatma > Edinme Modları; Hareket Kontrolü > Örnek ve Numune Z'yi değiştirin). 5 μm'lik adımlarla başlayın ve hücre veya karbon folyo delikleri iyice odaklanana kadar 0,5 μm'lik adımlara kadar hassaslaştırın.
- Ağ karesinin mozaik haritasını edinin (Mikroskop > Edinme > Edinme Ayarları > Edinme Modu > Mozaik > Başlangıç).
NOT: Mozaik edinme parametreleri, VLM mozaikleri ile aynı şekilde belirlenebilir (bölüm 3.1.1.4). Adım boyutu, ışın hattı personeli tarafından önceden seçilen büyütmeye bağlıdır. - Numuneyi bir Düz Alan (FF) konumuna taşıyın (ızgara içinde boş bir alan, tercihen karbon desteğinde bir delik) (Hareket Kontrolü > Numune ve Örnek X, Örnek Y'yi değiştirin).
- Pozlama süresini Mistral'de 1 sn'ye ve B24'te 0,5 sn'ye ayarlayın (Kamera Ayarları > Alma > Alma Ayarları > Mikroskop Alma Ayarları ve Pozlama Süresini Değiştirme) ve tek bir görüntü elde edin (Mikroskop > Alma > Edinme Modları > Tek > Başlangıç).
- İletimi elde etmek için (0 ile 1 arasındaki değerlerle) elde edilen mozaiği FF görüntüsüyle normalleştirin (bölün) ve normalleştirilmiş mozaiği kaydedin (menüyü açmak için görüntünün sağ tarafındaki ilk sağ üst köşe simgesine tıklayın>Referans sekmesini seçin> Tek Referans'ı tıklayın ve belirli FF'ye göz atın).
- CCD X-ışını dedektörünü seçin (Büyüteç > Pixis'i seçin), numuneyi 0 derece döndürmeye getirin (Hareket Kontrolü > Numune ve Numune θ'yu değiştirin) ve X-ışını optiklerini (Kondenser ve Bölge Plakası) hizalanmış konumlara taşıyın (Hareket Kontrolü > Kondenser > Kondenser z'yi değiştirin; Hareket Kontrolü > Bölge Plakasını ve Bölge Plakasını Z'yi değiştirin).
- Bir X-ışını eğim serisi toplamaya hazırlanma
NOT: Görüntülenen her ilgi alanı için döndürme eksenini bulun.- Tomografi yapmak için mozaiklerin içindeki alanların bir seçimini yapın, yani X-ışını mozaik haritasındaki FoV boyutuyla kare bir şekil yerleştirerek (görüntü penceresinin sol tarafındaki Araç'a tıklayın).
NOT: Alanları seçerken, dönme sırasında hücrelerin üst üste binmesini önlemek için kenarlıktan (≥10 μm) ve diğer hücrelerden olan mesafeyi göz önünde bulundurun. Ek olarak, hücrenin durumunu kontrol edin (beklenen hücre şekli, buz kalınlığı, vitrifikasyonun başarısı, referans yayılımı vb.). - Dönüş ekseninde numune hizalaması
NOT: Bildirilen yordam yinelemelidir. Yineleme, maksimum dönüş açıları (θ θ) olarak ± 60° açı kullanarak daha hızlı yakınsarM). Erişilebilir değillerse, 60°'± için mümkün olduğunca yakın açılar kullanın.- Fotoğraf makinesini 2, pozlama süresi 1 sn (Mikroskop > Alma > Alma Ayarları > Kamera Ayarları'na ayarlayın ve Pozlama Süresi'ni değiştirin; Bağlamayı değiştirin; Mikroskop > Edinme > Edinme Modları > Sürekli > Başlangıç), çıkış yarığını 5 μm'ye ayarlayın.
NOT: Minimum çıkış yarığı açıklığı ile çalışarak dozu mümkün olduğunca en aza indirin. - 0°'de döndürme ile, X örneğini ve örnek Y çevirisini kullanarak daha önce seçilen alana gidin ve örnek Z çevirisini kullanarak dönme eksenine koymak için hücrenin özelliğine odaklanın (Hareket Kontrolü > Numune ve Örnek x'i değiştirin; Örnek y; Örnek z).
- Örneği + θ M'ye (Hareket Kontrolü > Numune ve Örnek θ'yu değiştirin) döndürün ve döndürme eksenine koymak için hücrenin özelliğine bir çizgi (L+) (görüntü penceresinin sağ tarafındaki çizgi aracı düğmesine tıklayın) çizin.
- -θ M'ye döndürün (Hareket Kontrolü > Örneği ve Örnek θ'yu değiştirin) ve döndürme eksenine koymak istediğiniz hücrenin özelliğine bir çizgi (L-) çizin (görüntü penceresinin sağ tarafındaki çizgi aracı düğmesine tıklayın).
- +θ M veya -θM'deyken, seçilen unsuru her iki çizgi arasındaki merkez konumuna taşımak için örnek Z çevirisini kullanın (Hareket Kontrolü > Numune ve Numune Z'yi değiştirin).
- Adım 3.3.2.3'ten L+'ya minimum L- uzaklığına ulaşılana kadar yordamı yinelemeli olarak yineleyin.
NOT: İki satır L+ ve L- arasındaki mesafe, önceki yinelemeye göre daha küçük olmalıdır. - θ = 0 örneğinde (Hareket Kontrolü > Numune ve Numune θ'yu değiştirin), seçilen unsuru her iki çizginin merkezine koymak için gereken mesafenin iki katı kadar X örneğini hareket ettirin (Hareket Kontrolü > Numune ve Numune X'i değiştirin). Özelliği FoV'nin merkezine geri getirmek için Bölge Plakası (ZP) X'i hareket ettirin (ZP'> Hareket Kontrolü ve ZP X'i değiştirin). Bu adımı ızgara başına yalnızca bir kez yapın.
- Bir ZP Z odak serisi (genellikle 0,3 μm'lik adımlarla farklı ZP Z konumlarındaki görüntü koleksiyonları) (Mikroskop > Yakalama > Edinme Modları > Odak Serisi > Başlangıç >) kaydederek ZP Z konumunu yeni dönüş eksenine göre yeniden optimize edin ve ZP Z'yi numunenin odakta olduğu konuma taşıyın (Hareket Kontrolü > Bölge Plakasını değiştirin ve Bölge Plakasını değiştirin).
- Eğim serisi alımı için parametreleri ayarlayın.
NOT: Maksimum açısal aralık nihayetinde ZP'nin odak uzaklığı ile sınırlıdır (40 nm için sırasıyla ±70 veya ±65 derece veya düz bir numune için 25 nm ZP). Maruz kalma süresini tanımlamak için sinyal-gürültü oranını (S/N) ve radyasyon hasarını optimize edin. Tomografi için, farklı açısal aralıklarda farklı maruz kalma süreleri kullanın. - Maksimum dönme açısına ulaşılmadan önce gölgelemenin gerçekleşmesi durumunda en yüksek dönme açısal aralığını belirleyin.
- Kamera bağlamasını 1'e ayarlayın (Kamera Ayarları'> Alma > Mikroskop > Alma Ayarları ve Bağlama'yı değiştirin), Mistral'de çıkış yarığını 15 μm'ye açın (XS'> Hareket Kontrolü ve XS'yi değiştirin) ve dönüşü 0° olarak ayarlayın (Hareket Kontrolü > Örneği ve Örneği θ'yu değiştirin).
- Pozlama süresi 1 s olan tek bir görüntü elde edin (Mikroskop > Alma > Alma Ayarları > Alma Modları > Tek > Başlangıç) ve tomografinin her eğim açısı için gereken pozlama süresini tahmin edin.
- Fotoğraf makinesini 2, pozlama süresi 1 sn (Mikroskop > Alma > Alma Ayarları > Kamera Ayarları'na ayarlayın ve Pozlama Süresi'ni değiştirin; Bağlamayı değiştirin; Mikroskop > Edinme > Edinme Modları > Sürekli > Başlangıç), çıkış yarığını 5 μm'ye ayarlayın.
- Tomografi yapmak için mozaiklerin içindeki alanların bir seçimini yapın, yani X-ışını mozaik haritasındaki FoV boyutuyla kare bir şekil yerleştirerek (görüntü penceresinin sol tarafındaki Araç'a tıklayın).
- Tomografi alımı
- Negatif maksimum açı +0,1'e gidin (örneğin, ZP 25 nm için -65,1°'ye gidin) (Hareket Kontrolü > Numune ve Numune θ olarak değiştirin).
- Görüntü sayısını toplam açı sayısı (0 açısındaki görüntüyü dikkate alarak) ve açısal aralık (Mikroskop > Alma > Edinme Ayarları > Tomografi > Yakalama Modları olarak ayarlayın ve görüntü sayısını değiştirin; ardından Açı Başlangıcı ve Açı Sonu'nu değiştirin).
- Tanımlanan pozlama süresini ayarlayın ve çekimi başlatın (Kamera Ayarları'> Alma Ayarları > Mikroskop > Alma Ayarları'nı seçin ve ardından Pozlama Süresi'ni değiştirin ve ardından Başlat'a tıklayın).
- FF konumuna gidin (Hareket Kontrolü > Örneği ve Örnek X'i değiştirin; ardından Örnek Y'yi değiştirin) ve 10 FF görüntüsü elde edin (Mikroskop > Edinme > Edinme Modları > Ortalama'yı seçin ve görüntü sayısını değiştirin ve ardından Başlat'a tıklayın).
NOT: Mistral'de, spektromikroskopi veya enerjiye bağımlı mikroskopi, enerjiyi ilgilenilen bir emilim kenarı boyunca tararken projeksiyonlar elde ederken mümkündür. Son çıktı, her pikselde bir X-ışını absorpsiyon spektrumu (XAS), yani kimyasal bilgi içeren görüntüler içerecek bir 2D projeksiyon yığınıdır. Spektroskopiyi tomografi ile birleştiren 3D'ye genişletme prensipte mümkündür. Gerekli toplam doz bir sınırlama olabilir ve daha sonra diferansiyel absorpsiyon görüntüleme gibi spesifik stratejiler gerekli olabilir.
4. Veri analizi
NOT: Tüm veri analizi, otomatik işlem hatlarıyla geliştirilen mevcut açık yazılım ve komut dosyalarıyla yapılır.
- Mistral'da
- Pipeline, tomografi yığınlarını gerekli tüm meta verilerle txrm uzantısından (TXM yazılım uzantısı) hdf5'e (açık kaynaklı hiyerarşik veri formatı) dönüştürür, ardından yığını FF ortalamasına ve makine akımına göre normalleştirir ve son olarak belirli bir Fresnel bölge plakası (ZP) lensi ve enerji23 için optik sistemin ölçülen nokta yayılma işleviyle yığınları çözer, 24. Dekonvolüsyon için, uygun k = 1/SNR değerini bulun (numune kalınlığına bağlıdır). Mistral'de geliştirilen komut dosyası için şu komutu yazın: txrm2deconv "input tomo" "input FF" -zp="ZP used" - e= " energy " - dx= " pixel size " - k= " 1/SNR " - t=-1.
- Mistral'de otomatik hizalama için geliştirilen komut dosyası için şu komutu yazın: ctalignxcorr "normalized deconvolved stack.mrc" "normalized stack.hdf5".
NOT: Au NP referansları25,26 kullanılarak projeksiyonların ortak bir dönme eksenine hizalanması için bir dizi yazılım uygulaması kullanılabilir. Projeksiyonların hizalanması alt piksel doğruluğu gerektirir. Otomatik hizalama ancak Au NP referansları yeterli olduğunda (>7) ve görüş alanına iyi yayıldığında tatmin edici olabilir. Mümkün olan en yüksek doğruluğu elde etmek için otomatik hizalamayı düzeltmek için genellikle manuel hizalamaya a posteriori ihtiyaç duyulur. - Hizalanmış normalleştirilmiş yığını yeniden oluşturmak için, kullanılabilir çeşitli algoritmalardan herhangi birini kullanın.
NOT: Hizalanmış yığın, Ağırlıklı Arka Projeksiyon (WBP) veya Eşzamanlı Yinelemeli Yeniden Yapılandırma Teknikleri (SIRT) kullanılarak birkaç dakika içinde yeniden oluşturulabilir. Ancak doğrusal absorpsiyon katsayılarını (LAC) korumak için Cebirsel Rekonstrüksiyon Teknikleri (ART) tercih edilmektedir27. ART daha fazla bilgi işlem süresi gerektirir, bu nedenle SIRT28 ilk önce hızlı bir otomatik hizalanmış eğim serisi yeniden yapılandırması için yapılır (birkaç dakikada 30 yineleme). Hizalama tatmin edici olduğunda, ART kullanılacaktır.
- B24'te
- Özel olarak oluşturulmuş bir işlem hattı, txrm veri dosyalarını gereken tüm meta verilerle standart Tiff'lere dönüştürür ve ardından bunları veri kümelerini üç şekilde işleyen bir toplu runtomo iş akışına gönderir: WBP, SIRT ve yama.
Sonuçlar
Kriyo-SXT için numune hazırlamak zor olabilir. Aynı örnek ızgara içinde bile, aynı Au finder ızgarasından iki kare gösteren Şekil 5'te görülebileceği gibi, ideal olan alanlara ve ideal olmayan alanlara sahip olmak mümkündür. İdeal numune, kare bir ağın merkezinde, ince bir buz tabakasına gömülü ve tomografi rekonstrüksiyonundan önce eğim projeksiyonlarının hizalanması için kullanılan iyi dağılmış Au fiducial belirteçlerle çevrili tek hücrelere sahip olmalıdır. Şekil 5A , bu kriterlerin çoğuna uyan fibroblast benzeri bir hücreyi (NIH 3T3) göstermektedir. Görüş alanını (FoV) gösteren kırmızı kutu ile işaretlenmiş alanın ART27 kullanılarak yapılan bir 3B rekonstrüksiyonundan tek bir dilim Şekil 5B'de gösterilmiştir. Mitokondri (M), endoplazmik retikulum (ER), veziküller (V) ve çekirdek (N) gibi birçok farklı organel, LAC'ların kantitatif rekonstrüksiyonu sayesinde ayırt edilebilir. Ek olarak, rekonstrüksiyonun sinyal-gürültü oranı çok yüksektir ve hücresel özelliklerin yüksek kontrastını elde etmeyi sağlar. Öte yandan, Şekil 5C, daha yüksek hücre yoğunluğuna sahip bir kare göstermektedir. Bu nedenle, lekelenme genellikle daha az verimlidir, bu da daha kalın bir buz tabakasına ve hatta vitrifikasyon sorunlarına yol açar. Bazı durumlarda, X-ışını görüntülemeden önce epifloresan haritalaması kullanılarak ızgarayı tararken bu zaten gözlemlenebilir ve bu ızgaralardan ne pahasına olursa olsun kaçınılmalıdır. Şekil 5C'de, ızgara içinde bir çatlak ve vitrifiye buzun tüm ağ karesinden (kırmızı oklarla işaretlenmiş) geçtiği gözlemlenebilir. Çatlakların yakınındaki herhangi bir görüntüleme, kirişe maruz kaldığında ızgaranın olası dengesizliği nedeniyle kaçınılmalıdır. Ek olarak, çatlaklar bu alanda olduğu gibi kalın buzun bir işareti olabilir. Kırmızı kutuyla işaretlenmiş alana bir eğim serisi kaydedildi. Şekil 5D'de, karşılık gelen 3B rekonstrüksiyondan tek bir dilim gösterilmiştir. Bazı daha büyük yapılar tanınabilse de, kalın buzun zayıf vitrifikasyon kalitesi nedeniyle gürültü ve grenli doku içinde ince detaylar kaybolur, örneğin okla işaret edilen üst mitokondride de görülebileceği gibi.
Şekil 1: İş akışı. Kriyo-SXT veri toplamadan önce şematik iş akışı izlendi. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
Şekil 2: Izgaralarda büyüyen hücreler. (A) P100 Petri kabında %80-%90 civarında bir birleşimle büyüyen hücreler. (B) P60 Petri kabı, hücreleri tohumladıktan sonra birkaç ızgara ile. (C) 24 saat sonra bir ızgaranın üstünde büyüyen hücreler. Ölçek çubukları: 100 μm. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.

Şekil 3: Kılavuzların numune tutuculara ve transfer odasına yüklenmesi . (A) Mekik ve kriyokutular ızgaraları yüklemeye hazır halde sıvı azotla doldurulmuş iş istasyonu. (B) Izgara yüklüyken yükleyiciye yerleştirilen numune tutucu. (C) Numune tutucu 3 pozisyonunda kapak olmadan mekik. (D) Transfer bölmesi takılı iş istasyonu. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.

Şekil 4: Numunelerin TXM'ye yüklenmesi (A) Aktarım odasının TXM'ye bağlanması. (B) TXM içindeki mekik. (C) Numune tutucuyu numune aşamasına yerleştiren TXM robot kolu. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
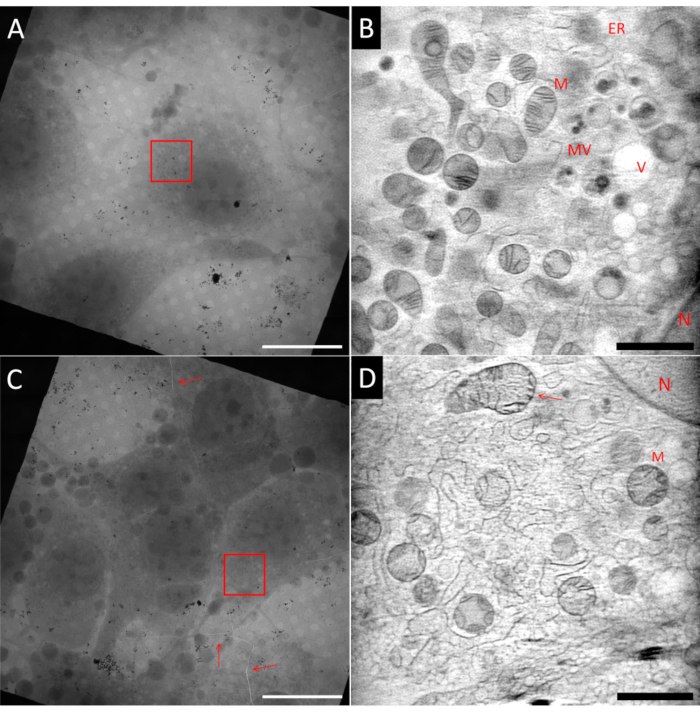
Şekil 5: Kriyo yumuşak X-ışını tomogramları örneği. Üst sıra: ideal örnek, (A) merkezde izole edilmiş bir hücreyi gösteren bir ızgara karesinin 2D mozaik görünümü. (B) Yeniden yapılandırılmış 3B hacimden kırmızı kutu (A) ile işaretlenmiş alanı gösteren bir dilim. (D) ile karşılaştırıldığında görüntü çok daha pürüzsüzdür ve daha fazla ayrıntı görülebilir. Alt sıra: ideal olmayan örnekler, (C) çok yüksek hücre akıcılığı ve buz ve ızgara folyosundaki çatlakları (kırmızı oklar) gösteren bir ızgara karesinin 2D mozaik görünümü. (D) Yeniden yapılandırılmış 3B hacimden (C) içindeki kırmızı kutuyla işaretlenmiş alanı gösteren bir dilim. Zayıf veya yetersiz vitrifikasyon, görüntünün grenli dokusu ile tanımlanabilir. N: Çekirdek; M: Mitokondri; ER: Endoplazmik Retikulum; MV: Multiveziküler cisimler; V: Vakuol; Ölçek çubukları: A ve C 20 μm; B & D 2 μm.VBu rakamın daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
Tartışmalar
Numune hazırlama, yüksek kaliteli yumuşak X-ışını tomogramları elde etmek için kritik bir adımdır, çünkü kaliteleri doğrudan numune vitrifikasyonunun kalitesine ve hücrenin gömülü olduğu buz tabakası kalınlığına bağlıdır. Yüksek sinyal-gürültü oranına sahip projeksiyonlar, ince buz tabakasına sahip bölgelerde toplanacak ve mümkün olan en yüksek çözünürlüğü elde etmek için gereken radyasyon dozunu en aza indirmeye izin verecektir. Ek olarak, hücre akıcılığı son tomogram kalitesini de etkileyecektir, çünkü komşu hücrelerin rotasyon sırasında FoV'ye girmesinden kaçınılmalıdır. Son olarak, Au fiducial işaretleyicilerin doğru dağılımı, projeksiyon hizalamasının doğruluğunu belirleyecek ve daha sonra nihai 3D yeniden yapılandırılmış hacmin kalitesini belirleyecektir. Au referanslarının ızgaraya düzgün bir şekilde yayılmasının, projeksiyon hizalama adımının otomatikleştirilmesini sağladığını ve bu olmadan böyle kritik bir adım için yüksek bir uzmanlığa ihtiyaç duyulduğunu unutmayın.
Buradaki protokol, kriyoelektron tomografisinde (kriyo-ET) kullanılanlarla benzerlikleri olan yalnızca bir olası numune hazırlama stratejisini göstermektedir. Her iki durumda da, daha iyi tekrarlanabilirlik için zorlu numune hazırlığını geliştiren protokoller, bu tekniklerin başarısı için temel olacaktır ve bu hedefe yönelik çabalar sarf edilmektedir29. İzole edilmiş hücrelerin görüntülenmesine ek olarak, bölümden geçen iletim sinyalinin yüksek eğim açılarında yeterli olması koşuluyla doku bölümlerinin de görselleştirilebileceğini belirtmekte fayda var. Tipik olarak, bu birkaç mikronluk bölümler anlamına gelir (10 μm'nin altında).
Bir hücrenin içindeki belirli bir yapıyı veya olayı görüntülemek için, bu özelliğin tilt serisinin FoV'sinde olduğundan emin olunması gerekir. Kriyo-SXT'deki FoV, lense bağlı olarak 10 x 10 μm 2 ila 15 x 15 μm 2 ile sınırlı olduğundan ve çözünürlüğün en az2 faktörüne kadar bir piksel aşırı örneklemesini hesaba kattığından, genellikle tam hücre uzantısından daha küçüktür (Şekil 5'te belirtilen kırmızı karelere bakın). Bu nedenle, yatırım getirisi bulunmalı ve uygun şekilde etiketlenmelidir. Bu genellikle floresan etiketler ve görünür ışık bağıntılı yaklaşımlar aracılığıyla yapılır. Epifloresanı birleştiren 2D stratejileri, yumuşak X-ışını iletim mikroskobunun entegre bir çevrimiçi görünür ışık floresan mikroskobuna sahip olması nedeniyle basittir, ancak yüksek çözünürlüklü 2D veya 3D floresan sinyali için diğer yaklaşımlar da mevcuttur 4,12,13,15,16 . Bu gibi durumlarda, ızgaranın önce süper çözünürlüklü mikroskoplar gibi belirli cihazlarda görüntülenmesi gerekir. En etkili korelasyon yaklaşımlarının, kriyojenik koşullarda veri toplamayı içerenler olduğunu unutmayın. Bunun nedeni, oda sıcaklığı (RT), görünür ışık floresan görüntüleme ve numune vitrifikasyonu arasındaki zaman atlamasının, örneğin, doğru hücresel olayın zamanında yakalanmasını engelleyeceğidir; Ek olarak, vitrifikasyon prosedürü, RT'de görüntülenen ilgili hücreyi ızgaradan ayırabilir. Çoğu korelasyonel görüntüleme yaklaşımı, numune ızgaralarının manipüle edilmesi ve bir cihazdan diğerine taşınması gerektiği anlamına gelse bile ve bunun ortaya çıkardığı ızgara kontaminasyonu veya hasar riskinin artmasına rağmen, ödül açıktır: hücresel manzara içindeki belirli olayları veya molekülleri belirleyebilmek.
Tüm hücre görüntülemesi gerektiğinde, uygulanan toplam dozun radyasyon hasarı sınırını aşmaması koşuluyla farklı tomogramların dikilmesi mümkündür. Genellikle, aynı hücrede birkaç tomogram toplamak için biriken doz, ulaşılabilir çözünürlükteki (109 Gy) sınırın çok altındadır ve bu nedenle, numune ve deneye bağlı olmasına rağmen, dozu düşürmek için spesifik bir strateji gerekmez. Spektro-tomografi gibi yoğun veri toplama durumunda, dozun en aza indirilmesi gerçekten gerekli olacaktır ve uygun veri toplama ve spesifik işleme stratejilerinin uygulanması gerekecektir.
Cryo-SXT'nin burada belirtilmesi gereken birkaç sınırlaması vardır. Birincisi, düz numune desteklerinin kullanılmasına özgü olan iyi bilinen eksik kamadır. 180 derecelik rotasyona izin veren kılcal numune destekleri geçmişte kullanılmış ve hala bazı tesislerde kullanılmaktadır, ancak cam emilimi ve süspansiyonda hücrelerin kullanılmasının kısıtlanması nedeniyle fakirleşmiş bir kontrast gibi dezavantajlar da sunmaktadırlar. Eksik kamanın etkisini azaltmanın bir yolu da dual tilt tomografi yapmaktır. Bu, günümüzde Mistral ışın hattında gerçekten mümkündür. İkinci sınırlama, bu tür mikroskoplarda kullanılan Fresnel bölgesi plaka lensi tarafından belirlenir. Bu lens, her ikisi de sıkı sıkıya ilişkili olan elde edilebilir nihai çözünürlüğü ve alan derinliğini (DoF) ayarlar. Bu, çözünürlüğün arttırılmasının DoF'u azaltacağı, hücrenin kalınlığının ise genellikle daha büyük olacağı anlamına gelir. Örneğin, 40 nm lens, teoride 3 μm'lik bir DoF'ye ve 24.4 nm yarım perdelik bir çözünürlüğe sahip olacaktır. Bu nedenle çözünürlük ve DoF arasındaki uzlaşma stratejiktir ve lensin seçimi30,31 hücresinin tipine bağlı olacaktır. Son olarak, dünya çapında operasyonel TXM'ler ideal mikroskoplar olmaktan uzaktır ve teorik beklentilere ulaşmak için optik sistemleri geliştirmek için çaba sarf edilmektedir. Son olarak, yeniden yapılandırılan hacimlerin görselleştirilmesi ve segmentasyonu, belirli yazılım araçları25,32,33,34 ile gerçekleştirilebilir.
Özetle, kriyo-SXT, görüntüleme hücrelerine kantitatif olarak orta çözünürlükte (25-30 nm yarım perde) ve istatistiksel sayılarda (günde birkaç on tomogram) izin verir. Bu, organellerin organizasyonunu, dağılımını ve boyutunu, örneğin patojen enfeksiyonu veya hastalıkları sırasında, kesin zaman noktalarında veya belirli tedavilerden sonra belirli koşullarda elde etmeyi sağlar. Bu nedenle, her biri belirli bir numune boyutu ve çözünürlüğü aralığını ele alan daha yaygın elektron ve görünür ışık mikroskopileri için yararlı bir tamamlayıcı biyolojik görüntüleme tekniğidir. Kriyo-SXT, görünür ışık floresansını içeren korelasyon yaklaşımlarında sıklıkla kullanılır, ancak diğer kriyo korelasyon stratejileri de mümkündür.
Açıklamalar
Yazarlar çıkar çatışması olmadığını beyan ederler.
Teşekkürler
Bu proje, Marie Skłodowska-Curie hibe anlaşması No 75439 kapsamında Avrupa Komisyonu Horizon 2020 iNEXT-Discovery projesinden ve Avrupa Birliği'nin Horizon 2020 araştırma ve inovasyon programından finansman almıştır.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Amira | Thermo Fisher | Software for segmentation | |
| Au Holey Carbon Films finder grids | (Quantifoil Micro Tools Gmb | R 2/2 Au G200F1 | Au Holey Carbon Films finder grids |
| Au nanoparticles | BBI Group, Cardiff, UK | Au nanoparticles 100nm | 100 nm Au nanoparticles (NPs) at Mistral (Alba) |
| Au nanoparticles | BBI Group, Cardiff, UK | Au nanoparticles 250nm | 250 nm Au nanoparticles (NPs) at B24 (Diamond) |
| Axio Scope A1 | Zeiss | 430035 9060 | Fluorescence microscope |
| Blotting No.1 filter paper | Whatman | WHA10010155 | Blotting filter |
| Bsoft | Software for projection alignment, reconstruction and visualization (Heymann et al., 2008) | ||
| Chimera | Software for segmentation (Pettersen et al. 2004) | ||
| Cryo-EM Glow Discharge Set | PELCO easiGlow | 91000S | Glow Discharge Cleaning System |
| Cu Holey Carbon Films finder grids | (Quantifoil Micro Tools Gmb | R 2/2Cu G200F1 | Cu Holey Carbon Films finder grids |
| Fetal calf serum | Sigma | F9665 | Heat Inactivated, sterile-filtered, suitable for cell culture |
| ImageJ | Software for image processing and analysis in Java (NIH & LOCI University of Wisconsin) | ||
| IMOD | Software for projection alignment, reconstruction and visualization (Kremer et al., 1996) | ||
| Leica EM GP Grid Plunger | Leica | 16706401 | Automatic Plunge Freezer EM |
| LINKAM cryo-stage | Linkam Scientific Instruments | CMS 196 | Cryo-Correlative Microscopy Stage |
| MIB | Software for segmentation (Belevich et al. 2016) | ||
| P100 Petri dish | Sigma | P6106 | Treated for cell culture and sterile |
| P60 Petri dish | Sigma | D8054 | Treated for cell culture and sterile |
| Polylysin | Sigma | P4707 | Poly-L-lysine solution 0.01%, sterile-filtered |
| Soft X-Ray microscope 0.25-1.2keV | Xradia | NCT-SB | Transmission soft X-Ray microscope |
| SURVOS | Software for segmentation (Luengo et al. 2017) | ||
| Tomo3d | Software for reconstruction (SIRT, WBP) (Agulleiro et al. 2011) | ||
| TomoJ | Software for reconstruction (ART) (Messaoudi et al., 2007) | ||
| XM Data Explorer | Zeiss | TXM software |
Referanslar
- Carrascosa, J. L., et al. Cryo X-ray tomography of vaccinia virus membranes and inner compartments. Journal of Structural Biology. 168, 234-239 (2009).
- Uchida, M., et al. Soft X-ray tomography of phenotypic switching and the cellular response to antifungal peptoids in Candida albicans. PNAS. 106, 19375-19380 (2009).
- Schneider, G., et al. Three-dimensional cellular ultrastructure resolved by X-ray microscopy. Nature Methods. 10, 1-3 (2010).
- Chichón, F. J., et al. Cryo nano-tomography of vaccinia virus infected cells. Journal of Structural Biology. 177, 202-211 (2012).
- Groen, J., Conesa, J. J., Valcárcel, R., Pereiro, E. The cellular landscape by soft X-ray tomography. Biophysical Reviews. 11, 611-619 (2019).
- Kepsutlu, B., et al. Cells undergo major changes in the quantity of cytoplasmic organelles after uptake of gold nanoparticles with biologically relevant surface coatings. ACS Nano. 14, 2248-2264 (2020).
- Natterer, F. . The mathematics of computerized tomography. , (1986).
- Weiss, D., et al. Computed tomography of cryogenic biological specimens based on X-ray microscopic images. Ultramicroscopy. 84, 185-197 (2000).
- Clowney, E. J., et al. Nuclear aggregation of olfactory receptor genes governs their monogenic expression. Cell. 151, 724-737 (2012).
- Duke, E. M. H., et al. Imaging endosomes and autophagosomes in whole mammalian cells using correlative cryo-fluorescence and cryo-soft X-ray microscopy (cryo-CLXM). Ultramicroscopy. 143, 77-87 (2014).
- Cinquin, B., et al. Putting molecules in their place. Journal of Cellular Biochemistry. 115, 209-216 (2014).
- Hagen, C., et al. Multimodal nanoparticles as alignment and correlation markers in fluorescence/soft X-ray cryo-microscopy/tomography of nucleoplasmic reticulum and apoptosis in mammalian cells. Ultramicroscopy. 146, 46-54 (2014).
- Pérez-Berná, A. J., et al. Structural changes in cells images by soft X-ray cryo-tomography during Hepatitis C virus infection. ACS Nano. 10, 6597-6611 (2016).
- Chiappi, M., et al. Cryo-soft X-ray tomography as a quantitative three-dimensional tool to model nanoparticle:cell interaction. Journal of Nanobiotechnology. 14, 15 (2016).
- Varsano, N., et al. Development of correlative cryo-soft X-ray tomography and stochastic reconstruction microscopy. A study of cholesterol crystal early formation in cells. Journal of the American Chemical Society. 138, 14931-14940 (2016).
- Kounatidis, I., et al. Correlative cryo-structured illumination fluorescence microscopy and soft X-ray tomography elucidates reovirus intracellular release pathway. Cell. 182, 1-16 (2020).
- Kapishnikov, S., et al. Mode of action of quinoline antimalarial drugs in red blood cells infected by Plasmodium falciparum revealed in vivo. PNAS. 116 (46), 22946-22952 (2019).
- Conesa, J. J., et al. Unambiguous intracellular localization and quantification of a potent iridium anticancer compound by correlative 3D cryo X-ray imaging. Angewandte Chemie International Edition. 59, 1270-1278 (2020).
- Gal, A., et al. Native-state imaging of calcifying and noncalcifying microalgae reveals similarities in their calcium storage organelles. PNAS. 115 (43), 11000-11005 (2018).
- Procopio, A., et al. Chemical fingerprint of Zn-hydroxyapatite in the early stages of osteogenic differentiation. ACS Central Science. 5, 1449-1460 (2019).
- Kahil, K., et al. Cellular pathways of calcium transport and concentration toward mineral formation in sea urchin larvae. PNAS. 117 (49), 30957-30965 (2020).
- Conesa, J. J., et al. Intracellular nanoparticles mass quantification by near-edge absorption soft X-ray nanotomography. Scientific Reports. 6, 22354 (2016).
- Otón, J., Sorzano, C. O. S., Maribini, R., Pereiro, E., Carazo, J. M. Measurement of the modulation transfer function of an X-ray microscope based on multiple Fourier orders analysis of a Siemens star. Optics Express. 23 (8), 9567-9572 (2015).
- Otón, J., et al. Characterization of transfer function, resolution and depth of field of a soft X-ray microscope applied to tomography enhancement by Wiener deconvolution. Biomedical Optics Express. 7, 5092-5103 (2016).
- Kremer, J. R., Mastronarde, D. N., McIntosh, J. R. Computer visualization of three-dimensional image data using IMOD. Journal of Structural Biology. 116, 71-76 (1996).
- Heymann, J. B., Cardone, G., Winkler, D. C., Steven, A. C. Computational resources for cryo-electron tomography in Bsoft. Journal of Structural Biology. 161, 232-242 (2008).
- Messaoudi, C., et al. Three-dimensional chemical mapping by EFTEM-TomoJ including improvement of SNR by PCA and ART reconstruction of volume by noise supression. Microscopy Microanalysis. 19, 1669-1677 (2013).
- Agulleiro, J. I., Fernández, J. J. Fast tomographic reconstruction on multicore computers. Bioinformatics. 27, 582-583 (2011).
- Toro-Nahuelpan, M., et al. Tailoring cryo-electron microscopy grids by photo-micropatterning for in-cell structural studies. Nature Methods. 17, 50-54 (2020).
- Attwood, D. . Soft X-rays and Extreme Ultraviolet Radiation. Principles and Applications. , (2000).
- Howells, M., Jacobsen, C., Warwick, T. . Principles and Applications of Zone Plate X-ray. Microscopes. Science of Microscopy. , (2007).
- Pettersen, E. F., et al. UCSF Chimera--a visualization system for exploratory research and analysis. Journal of Computational Chemistry. 25, 1605-1612 (2004).
- Belevich, I., Joensuu, M., Kumar, D., Vihinen, H., Jokitalo, E. Microscopy image browser: a platform for segmentation and analysis of multidimensional datasets. PLOS Biology. 14 (1), 1002340 (2016).
- Luengo, I., et al. SuRVoS: Super-region volume segmentation workbench. Journal of Structural Biology. 198, 43-53 (2017).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır