Method Article
Cryo Soft X선 단층 촬영에 의한 세포의 3D Cartographic 설명
요약
여기서, 25 nm 하프 피치의 해상도로 전체 냉동 보존된 세포의 초구조를 이미지화하기 위해 냉동 소프트 X선 단층촬영(SXT)에 필요한 샘플 준비 및 데이터 수집 단계를 기술하는 프로토콜이 제시된다.
초록
이미징 기술은 생물학적 연구 및 관련 분야에서 세포 조직 및 기계를 이해하기 위해 기본입니다. 이러한 기술 중에서 냉동 소프트 X 선 단층 촬영 (SXT)은 탄소 구조가 본질적으로 물보다 높은 흡수력을 갖는 물 창 X 선 에너지 범위 (284-543 eV)에서 전체 냉동 보존 세포를 이미징 할 수있게하여 각 복셀에 포함 된 재료의 선형 흡수 계수를 3D 재구성 할 수 있습니다. 최대 10 μm 두께의 전체 세포 수준에서 정량적 구조 정보는 25-30 nm 하프 피치까지 높은 처리량과 공간 분해능으로 이러한 방식으로 달성 할 수 있습니다. Cryo-SXT는 세포 감염 과정 (바이러스, 박테리아 또는 기생충), 질병 (예 : 열성 유전 질환)으로 인한 형태 학적 변화에 대한 3D 정보를 제공하고 세포 수준에서 약물 작용을 이해하거나 3D 세포 환경에서 특정 구조를 찾는 데 도움이되는 현재의 생물 의학 연구와 관련이 있음이 입증되었습니다. 또한, 싱크로트론 시설에서의 파장 조정 가능한 파장을 이용함으로써, 분광-현미경 또는 그의 3D 대응물, 분광-단층 촬영, 또한 생체 미네랄화 공정에서 칼슘과 같은 세포 내의 특정 원소를 이미지화하고 정량화하는 데 사용될 수 있다. Cryo-SXT는 전자 현미경, X선 형광 또는 가시광선 형광과 같은 다른 생물학적 이미징 기술에 상보적인 정보를 제공하며, 일반적으로 기능, 위치 및 형태를 연결하기 위해 극저온 조건에서 2D 또는 3D 상관 영상화를 위한 파트너 방법으로 사용됩니다.
서문
Cryo-SXT는 수화된 전체 세포 1,2,3,4,5,6의 3D 배지 분해능(25-30nm 하프 피치) 부피를 제공하기 때문에 생물학적 이미징 연구에서 중심적인 역할을 할 수 있습니다. 물 창 에너지 범위에서, 탄소와 산소 흡수 K 가장자리 (4.4-2.3 nm) 사이에서, 탄소가 풍부한 세포 구조는 그들을 투과하고 둘러싸고있는 산소가 풍부한 매질보다 10 배 더 많이 흡수합니다. 이 에너지 범위에서 최대 10 μm 두께의 유리화 된 세포는 절편이나 염색 없이도 이미징 할 수 있으므로 정량적 인 고 흡수 대비 돌출부가 생겨 샘플 회전 기능과 결합하여 세포 구조의 단층 촬영 재구성을 허용합니다. Cryo-SXT는 다른 이미징 기술로는 쉽게 접근 할 수없는 시편 치수 및 공간 해상도 측면에서 틈새 시장을 채 웁니다.
간단히 말해서, cryo-SXT의 흡수 콘트라스트는 두께 t의 표본을 통한 광자의 감쇠가 다음과 같이 Beer-Lambert 법칙을 따르기 때문에 정량적이다: 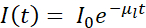 여기서 I0은 입사 강도를 나타내고 μl은 시편의 굴절률의 파장 λ 및 허수 부분 β에 의존하는 선형 흡수 계수를 나타낸다(
여기서 I0은 입사 강도를 나타내고 μl은 시편의 굴절률의 파장 λ 및 허수 부분 β에 의존하는 선형 흡수 계수를 나타낸다( ). 감쇠는 이미지화되는 구조물의 생화학적 조성 및 두께의 함수이며, 각 생화학적 성분은 특정 X선 선형 흡수 계수 μl(LAC)을 갖는다. 이것은 각 단층 촬영 복셀 값이 화학 원소와 복셀7에서의 농도에 달려 있음을 의미합니다. 이것은 핵, 핵, 지질 몸체 또는 미토콘드리아와 같은 다른 소기관의 자연적 차별을 허용하거나, 단지 그들의 고유 한 LAC 값 재구성 2,8,9에 기초한 염색질의 다른 압축 상태를 허용합니다.
). 감쇠는 이미지화되는 구조물의 생화학적 조성 및 두께의 함수이며, 각 생화학적 성분은 특정 X선 선형 흡수 계수 μl(LAC)을 갖는다. 이것은 각 단층 촬영 복셀 값이 화학 원소와 복셀7에서의 농도에 달려 있음을 의미합니다. 이것은 핵, 핵, 지질 몸체 또는 미토콘드리아와 같은 다른 소기관의 자연적 차별을 허용하거나, 단지 그들의 고유 한 LAC 값 재구성 2,8,9에 기초한 염색질의 다른 압축 상태를 허용합니다.
또한 cryo-SXT는 단층 촬영이 몇 분 안에 수집되는 높은 처리량 기술입니다. 이것은 특히 분열, 분화 및 아폽토시스와 같은 주요 시점에서뿐만 아니라 특정 약물 요법 또는 병원성 감염에 대한 화학적 노출에 의해 유도 된 것과 같은 다른 반응 상태에서도 포획 될 수있는 세포 집단의 메조 스케일 이미징을 가능하게합니다. 이러한 핵심 지점에서 수집 된 데이터는 특정 순간에 다른 세포 소기관의 공간 조직에 대한 충실한 기록과 함께 시스템의 3D 설명을 제공합니다.
보통, cryo-SXT는 3D 세포 환경 4,10,11,12,13,14,15,16, 또는 경질 X선 형광 데이터(17,18) 내에서 특정 특징, 사건 또는 거대분자를 위치시킬 수 있도록 하는 상관학적 접근법에 따르는 다른 기술들과 함께 사용된다. . 극저온 조건에서의 상관 관계 접근법은 관심 시스템에 대한 가장 완전하고 가치있는 그림을 얻기 위해 가장 중요합니다. Mistral (Alba) 및 B24 (다이아몬드) cryo-SXT 빔라인의 일반적인 워크플로우에 대한 간략한 요약이 그림 1에 스케치되어 있습니다.
더욱이, 싱크로트론 시설에서의 파장 튜닝 능력을 이용하여, 분광학적 정보는 샘플에 포함된 특정 원소의 특정 차등 흡수를 사용하는 구조적인 것 이외에 얻어질 수 있다. 이것의 예는 세포19,20,21에서 생물 미네랄화 과정에 대한 연구에서 칼슘의 위치입니다. 아래의 다른 광자 에너지(spectra) 또는 토모그램에서 그리고 관심 있는 x-레이 흡수 가장자리에서 2D 이미지를 촬영함으로써, 선택된 요소를 포함하는 픽셀 또는 복셀이 식별될 수 있다. 스펙트럼은 또한 화학적 상태를 분화시키는 것을 허용한다(즉, 이전의 생물광물화 실시예20에서와 같이 비정질 칼슘이 하이드록시아파타이트로 진화됨). 서로 다른 요소의 정량화는 2D 및 3D에서 가능합니다. 유리화된 세포의 분광학적 이미징은 전형적으로 물 윈도우에서 행해지지만, 수분 함량이 충분히 낮거나 탈수를 포함한 다른 샘플 준비 프로토콜이 사용되는 경우 다른 에너지 범위에서도 가능하다(22). 상세한 분광법 단계별 프로토콜은 본 명세서에서 프로토콜의 초점을 벗어난다.
다음 내용에서 프로토콜은 주요 샘플 준비 단계를 간략하게 요약하는 데 중점을 두지만 각 시스템은 개별 개선이 필요할 수 있지만 냉동 소프트 X 선 단층 촬영을위한 자세한 단계별 데이터 수집 절차가 뒤 따릅니다.
프로토콜
1. 시료 준비
- 그리드 지원 준비
- 살균을 위해 탄소 필름이 위쪽을 향하도록 3 시간 동안 UV로 그리드를 조사하십시오.
- 선택 사항: 셀이 격자선에 연결되지 않는 데 문제가 있는 경우 다음 단계 중 하나를 사용합니다.
- 격자의 플라즈마 처리에 의해 탄소 지지체 호일을 친수화하여 샘플 확산을 증가시키고 세포 부착을 개선한다.
- 그리드를 글로우 방전 챔버 장비에 탄소 쪽을 올려 놓고 장비에 따라 그리드를 30 ~ 15 분 동안 플라즈마에 노출시킵니다 (Ar 또는 / 및O2 사용).
- 폴리-L-라이신(PLL)으로 그리드 기능 개선
- 페트리 접시에 60μL PLL의 개별 방울을 넣고 탄소 필름이 아래를 향하도록 PLL 드롭 위에 그리드를 놓습니다. 37°C에서 30분 동안 인큐베이션하고, 여과지를 이용하여 PLL을 블롯한다.
- 태아 소 혈청 (FBS)으로 그리드를 기능화하십시오.
- 하룻밤 사이에 FBS의 그리드를 잠급니다. 그리드를 완충 용액에 담그고 세척하고 그리드를 여과지에 남겨 두어 과도한 액체를 제거하십시오.
- 격자의 플라즈마 처리에 의해 탄소 지지체 호일을 친수화하여 샘플 확산을 증가시키고 세포 부착을 개선한다.
- 격자에 부착 세포 성장
- 100mm의 세포 배양 접시에서 세포를 성장시켜 80%-90% 컨플루언시에 도달한다(그림 2A).
- P60 페트리 접시 (총 3 mL)의 Au 그리드 위에1-5 x 10 5 세포 / mL (시스템에 값을 조정)를 시드하십시오.
메모: 세포 현탁액의 첨가는 60 mm의 세포 배양 접시에서 위쪽을 향하는 그리드의 탄소 막으로 매우 조심스럽게 행해져야 한다. 조건당 여러 개의 격자를 준비하고, P60 페트리 접시당 하나의 조건을 준비합니다(그림 2B). - 그리드의 컨플루언시가 각 메쉬 사각형의 여러 셀(셀 크기에 따라 1~10개)에 도달할 때까지 셀이 침전되도록 허용합니다(세포주에 따라 최대 24시간이 소요될 수 있음).
메모: 동결하기 전에 그리드를 가시광선 현미경(VLM)으로 점검하여 각 그리드의 탄소 필름 무결성 및 셀 컨플루언시를 평가해야 합니다(그림 2C). 격자의 적절한 셀 밀도에 도달 할 때까지 기다리십시오. 그리드가 너무 합류하거나 탄소 호일이 파손되면 다시 시작하십시오.
- 격자에 현탁액에 있는 세포의 퇴적
- 플런지 냉동고에서 핀셋을 사용하여 준비된 Au 또는 Cu 그리드를 선택하십시오 (섹션 1.6 참조).
- 1-5 x 105 세포 현탁액 (박테리아의 경우 0.3의 광학 밀도 흡광도)을 준비하고 준비된 현탁액 4 μL를 그리드에 첨가한다.
- 세포의 증착을 허용하도록 몇 분 동안 방울과 함께 그리드를 수평으로 인큐베이션한 다음, 그리드를 보유하는 핀셋을 적절한 온도 및 습도 조건으로 설정된 기후 조절 유리화 챔버 내부에 배치한다(단계 1.6.1).
- 선택 사항: 샘플의 형광 태깅
메모: 샘플의 일부 소기관을 형광 표지하는 것이 유익 할 수 있습니다. 관심에 따라, 형광 단백질을 안정적으로 발현하거나 관심있는 단백질의 일시적 발현을 위해 형질감염된 특이적 형광단 또는 세포가 사용될 수 있다. 이를 통해 냉동 에피형광 현미경을 사용하여 세포를 쉽게 검출할 수 있으며 후속 X선 이미징을 위해 관심 있는 세포를 찾는 데 도움이 됩니다. 다음의 내용에서, 프로토콜은 형광단의 사용에 대해서만 상세하다.- 형광단에 대한 작업 솔루션을 준비하고 (제조업체의 권장 사항 참조) 특정 프로토콜을 따르십시오.
- 격자가 들어있는 페트리 접시에 형광단을 넣고 부드럽게 섞으십시오.
- 어두운 환경에서 인큐베이션하도록 방치하고 인큐베이션이 끝난 후 1.6단계로 바로 이동한다.
참고: 인큐베이션이 완료되면 비특이적 태깅과 결과적으로 형광 신호가 흐려지는 것을 피하기 위해 유리화할 준비를 하는 것이 중요합니다.
- 단층 구상 정렬을 위한 Au 나노입자(NP) 준비
- Au 피두시얼 원액 1mL(미스트랄에서 100nm, B24에서 250nm)의 분취량 1개를 취하여 NP가 펠릿화될 수 있도록 1분 동안 저속(응집을 피하기 위해)으로 원심분리한다.
메모: 가능하다면, 집합체를 피하기 위해 하룻밤 이상 자연적으로 정착하도록 신탁을 떠나는 것이 바람직하다. - 상층액을 제거하십시오. 동결 직전에, NPs를 20 μL 무혈청 배지 또는 완충 용액에 재현탁시켜 균질한 용액을 수득한다.
메모: 초음파 처리 및 볼텍싱은 솔루션을 균질화하는 데 도움이되는 것이 좋습니다.
- Au 피두시얼 원액 1mL(미스트랄에서 100nm, B24에서 250nm)의 분취량 1개를 취하여 NP가 펠릿화될 수 있도록 1분 동안 저속(응집을 피하기 위해)으로 원심분리한다.
- 급락 동결 그리드
주의: 액체 질소는 냉화상을 일으킬 수 있으며 적절한 보호 장비(긴 실험실 코트, 안전 고글, 장갑, 긴 바지 및 닫힌 신발)를 착용해야 합니다. 에탄은 폭발성이 높기 때문에 불꽃이나 화재로부터 멀리 떨어져 있어야합니다.- 제조업체의 지침에 따라 플런지 냉동고 장비를 준비하고 사용하십시오.
메모: 습도는 일반적으로 80 % -90 %로 설정됩니다. 온도는 세포 유형(최대 효모 30°C, 포유동물 세포 37°C, 곤충 세포 28°C 등)에 따라 달라질 것이다. - 테두리 옆의 Petri 접시에서 핀셋을 장착 한 그리드를 가져 와서 그리드를 구부리지 말고 플런지 냉동고 장치에 장착하십시오. 세포가 블롯팅 용지에서 멀리 향하도록 하십시오.
- 선택 사항 : 부착 세포의 경우 완충액에서 그리드를 세 번 세척하십시오.
- 세포 상부에 1.5 μL의 Au NP 피두시알을 첨가하고(챔버의 오른쪽에 있는 구멍을 통해) 그리드를 블롯팅하고 플런징하기 전에 30초 동안 정착하도록 방치한다.
메모: 현탁액에있는 세포의 경우, 핀셋을 장착하기 전에 수평 위치에있는 동안 Au NP 신탁을 그리드에 추가하고 30 초 동안 정착하게하십시오. 블롯팅은 고품질 그리드에 매우 중요합니다. 블롯팅 거리는 시작하기 전에 보정해야합니다. 블롯팅 용지의 평탄도는 재현 가능한 블롯팅에 중요합니다 (제조업체의 지시 사항을 따르십시오). 블롯팅 시간은 각 세포 유형에 대해 평가될 필요가 있다. - 조건당 여러 격자를 준비합니다. 그리드를 옮기고 극저온에 보관하여 유리화를 보존하십시오.
- 제조업체의 지침에 따라 플런지 냉동고 장비를 준비하고 사용하십시오.
- 냉동 가시광선 현미경으로 선별 그리드
- 액체 질소 아래의 그리드를 냉동 박스에서 사전 냉각 된 냉동 스테이지 내부의 표준 냉동 카세트 (3mm TEM 그리드의 경우 3 위치)로 옮깁니다 (제조업체의 지침 참조).
- 냉동 카세트는 냉동 스테이지 브리지 위에 배치되고 냉동 스테이지는 넓은 필드 에피형광 광 현미경에 장착됩니다.
- cryo-SXT 이미징에 적합한 셀을 찾기 위해 장거리 작동 거리 대물(10x, 50x, 100x)을 사용하여 -196.5°C에서 그리드를 이미지화하고 그리드 품질(두꺼운 얼음의 존재, 탄소 지지 필름의 무결성, 형광 신호의 존재 등)을 평가한다.
- 밝은 필드 또는 / 및 형광 이미징을 사용하여 관심있는 세포를 현지화하십시오.
참고: 이 단계에서 연결된 카메라가 현미경에 있는 경우 이미지를 캡처합니다. 이미지 상관 관계에 사용하십시오. - 스크리닝 후, 액체 질소 저장 디워 내의 냉동 박스에 그리드를 되돌린다.
메모: 좋은 샘플이 발견되지 않으면 매개 변수를 수정하는 샘플 준비 단계를 반복하십시오. 일반적으로 수정이 필요한 매개 변수는 얼음이 너무 두껍거나 합류 할 때 메쉬 사각형 당 셀이 너무 많은 경우 블롯팅 시간입니다.
2. 전송 X 선 현미경 (TXM)에 로딩
- <100K에 도달할 때까지 액체 질소로 이송 챔버를 냉각하고 워크스테이션(그림 3A)을 냉각한 다음 워크스테이션 림의 히터를 켭니다. 끓는 것을 멈출 때까지 기다리십시오.
- 격자가 포함된 필요한 냉동 상자를 워크스테이션의 해당 위치에 넣습니다(그림 3A). 냉동 조건에서 안전하게 이송하도록주의하십시오.
- 선택한 격자를 이전에 냉각된 샘플 홀더에 로드합니다(그림 3B). 홀더를 셔틀에 싣고 덮개로 보호하십시오(그림 3C).
- 셔틀을 <100K의 이송 챔버에 적재하고 저진공으로 펌핑합니다(그림 3D).
- TXM에 이송 챔버를 부착하고(그림 4A) 화면의 진공 절차에 따라 이송 챔버에서 TXM으로 셔틀을 로드합니다(그림 4B).
- 셔틀이 샘플과 함께 내부에 있으면 TXM 로봇 암은 한 번에 하나의 샘플 홀더를 샘플 스테이지로 가져올 수 있습니다(그림 4C).
3. TXM 소프트웨어를 사용한 이미징
참고: 샘플 단계의 그리드는 먼저 온라인 가시광선 현미경(VLM)을 사용하여 X선으로 이미징되기 전에 밝은 필드 및/또는 형광 모드에서 그리드를 매핑합니다. 왼쪽 상단 패널의 모션 컨트롤 탭에 해당하는 조이스틱 아이콘을 사용하여 모션 컨트롤 을 엽니다.
- 온라인 VLM으로 그리드를 이미징합니다.
- 밝은 필드 모자이크 획득
- VLM 카메라(확대 렌즈 > VLM)를 선택하고 밝은 필드 이미징을 위해 VLM LED 소스를 켭니다(현미경 > 획득 > 획득 설정 > 소스 설정 및 전송 선택).
- VLM 목표(모션 컨트롤 > 샘플 > 샘플 θ)를 향하도록 샘플을 -60도로 회전시키고 샘플을 예상 중심 위치(모션 컨트롤 > 샘플 및 샘플 X, 샘플 Y를 변경)로 이동합니다.
- 먼저 그리드에 대략 초점을 맞추기 위해 20 내지 50 μm의 단계에서 이미지를 획득하면서 (현미경 > 획득 > 획득 설정 > 연속 > 시작> 획득 모드; 모션 제어 > 샘플 및 변경 샘플 Z).
- 셀 및/또는 탄소 지지 필름의 구멍에 초점이 맞춰질 때까지 5μm까지 더 작은 단계로 초점을 다듬습니다(현미경 > 획득 > 획득 설정 > 연속 > 시작>; 모션 컨트롤 > 샘플 및 샘플 Z)를 변경하고 밝은 필드 모드에서 그리드의 전체 모자이크 맵의 획득을 시작합니다. 모자이크의 기본값을 사용합니다. (현미경 > 획득 > 획득 설정 > 획득 모드 > 모자이크 > 시작).
메모: 모자이크 맵은 단일 이미지로 만들어집니다. 이미지 수(열, 행 수 및 X와 Y의 단계 크기)는 전체 그리드를 시각화하도록 설정해야 합니다. 스텝 크기는 시야각(FoV)의 크기에 따라 달라집니다. 여기서 기본값이 사용됩니다. 그리드가 전체 모자이크 FoV에 대해 X-Y 평면의 중심에 잘 맞지 않으면 수집을 중지하고 샘플 X 및 Y 좌표를 수정하고 인수를 반복하십시오.
- 형광 모드 모자이크 획득
- 밝은 필드 이미징을 위해 VLM 주도 소스를 끄고(현미경 > 획득 > 획득 설정 > 소스 설정 및 전송 선택 해제) 원하는 여기 파장(빨강, 녹색 또는 파랑)에 해당하는 LED 광원과 설정 시 해당 광학 필터를 수동으로 선택합니다.
- 형광 이미지 (현미경 > 획득 > 획득 설정 > 연속 > 시작> 초점을 다듬습니다. 모션 컨트롤 > 샘플 및 변경 샘플 Z)은 밝은 필드 모자이크로부터 위치 파라미터(X 및 Y)를 유지하는 모자이크 맵을 획득한 후(현미경 > 획득 > 획득 설정> 획득 모드 > 모자이크 > 시작).
- LED 광원 끄기
- 옵션: 밝은 필드 및 형광 모자이크 맵을 기반으로 이전에 식별된 관심 영역(ROI)(단계 1.7.4) 또는 새로운 ROI(이미지에서 X-Y 위치)에 주석을 추가합니다.
- 밝은 필드 모자이크 획득
- X선 모자이크 묵인
- CCD X선 검출기(확대 렌즈 > Pixis 선택)를 선택하고, 샘플을 0도 회전으로 가져오고(모션 컨트롤 > 샘플 및 샘플 θ 변경 ) X선 광학(콘덴서 및 존 플레이트)을 정렬된 위치로 이동(모션 제어 > 콘덴서 > 변경 콘덴서 z; 모션 컨트롤 > 영역 플레이트 및 변경 영역 플레이트 Z).
메모: 이미징하기 전에 CCD 칩을 -65 °C로 식히십시오 (현미경 > 카메라 온도 > Pixis를 사용하고 설정 온도를 -65 °C로 변경하고 적용을 클릭하십시오). - 샘플을 선택한 ROI 중 하나의 메쉬 사각형의 가운데로 이동합니다(모션 컨트롤 > 샘플 및 샘플 X, 샘플 Y를 변경합니다).
- 5μm에서 비닝 2 및 출구 슬릿을 사용하여 미스트랄에서의 조사 및 1초 노출을 최소화하고, B24에서 1 및 60μm를 비닝하고, 샘플 Z 변환(현미경 > 획득 > 획득 설정 > 카메라 설정 및 변경 비닝을 사용하여 초점을 조정합니다. 모션 컨트롤 > XS 및 변경 XS; 현미경 > 획득 > 획득 설정> 연속 > 시작> 획득 모드; 모션 제어 > 샘플 및 변경 샘플 Z). 5 μm의 단계에서 시작하여 셀 또는 탄소 호일 구멍이 잘 초점이 맞춰질 때까지 0.5 μm의 단계로 세분화하십시오.
- 메쉬 사각형의 모자이크 맵을 획득합니다(획득 > 획득 설정 > 획득 모드 > 모자이크 > 시작> 현미경).
메모: 모자이크 획득 파라미터는 VLM 모자이크에 대한 것과 동일한 방식으로 결정될 수 있다(섹션 3.1.1.4). 스텝 크기는 빔라인 스태프가 미리 선택한 배율에 따라 달라집니다. - 샘플을 플랫 필드 (FF) 위치 (그리드 내의 빈 영역, 바람직하게는 탄소 지지대의 구멍)로 이동하십시오 (모션 컨트롤 > 샘플 및 샘플 X, 샘플 Y를 변경 ).
- 노출 시간을 Mistral에서 1초, B24에서 0.5초로 설정하고(현미경 > 획득 > 획득 설정 > 카메라 설정 및 노출 시간 변경) 단일 이미지를 획득합니다(현미경 > 획득 > 획득 모드 > 단일 > 시작).
- 획득한 모자이크를 FF 이미지로 정규화(분할)하여 전송을 획득하고(0과 1 사이의 값을 가짐) 정규화된 모자이크를 저장합니다(이미지의 오른쪽에 있는 첫 번째 오른쪽 상단 모서리 아이콘을 클릭하여 메뉴를 엽니>참조 탭을 선택하> 단일 참조를 클릭하고 특정 FF를 탐색합니다).
- CCD X선 검출기(확대 렌즈 > Pixis 선택)를 선택하고, 샘플을 0도 회전으로 가져오고(모션 컨트롤 > 샘플 및 샘플 θ 변경 ) X선 광학(콘덴서 및 존 플레이트)을 정렬된 위치로 이동(모션 제어 > 콘덴서 > 변경 콘덴서 z; 모션 컨트롤 > 영역 플레이트 및 변경 영역 플레이트 Z).
- X선 틸트 시리즈 수집 준비
메모: 이미지화되는 각 관심 영역의 회전 축을 찾습니다.- 단층 촬영을 수행하기 위해 모자이크 내의 영역을 선택하도록하십시오 (즉, X 선 모자이크 맵에 FoV의 크기와 함께 사각형 모양 (이미지 창의 왼쪽에있는 도구 클릭)을 배치하십시오.
메모: 영역을 선택할 때 회전 중에 셀이 겹치지 않도록 경계 (≥10 μm) 및 기타 셀로부터의 거리를 고려하십시오. 또한, 세포의 상태(예상 세포 모양, 얼음 두께, 유리화 성공, 신탁 확산 등)를 확인합니다. - 회전축의 샘플 정렬
메모: 보고된 절차는 반복적입니다. 반복은 최대 회전 각도(θ)로 ± 60° 각도를 사용하여 더 빠르게 수렴합니다.M). 접근할 수 없는 경우 가능한 한 가까운 각도를 사용하여 60°±니다.- 카메라를 비닝 2, 노출 시간 1 초 (현미경 > 획득 > 획득 설정 > 카메라 설정으로 설정하고 노출 시간을 변경; 비닝을 변경; 현미경 > 수집 > 수집 모드 >연속 > 시작), 출구 슬릿을 5 μm로 설정합니다.
메모: 출구 슬릿의 조리개를 최소화하여 가능한 한 복용량을 최소화하십시오. - 0°에서 회전하면서, 샘플 X 및 샘플 Y 번역을 이용하여 이전에 선택된 영역으로 이동하고, 샘플 Z 번역을 이용하여 회전축에 넣어 세포의 특징에 초점을 맞추고 샘플 Z 번역(Motion Control > 샘플 및 샘플 x를 변경; 샘플 y; 샘플 z).
- 샘플을 + θM (모션 컨트롤 > 샘플 및 샘플 θ 변경)으로 회전시키고 셀의 특징에 선 (L +) (이미지 창의 오른쪽에있는 선 도구 버튼을 클릭)을 그려 회전 축에 놓습니다.
- -θm (모션 컨트롤 > 샘플 및 샘플 θ 변경)으로 회전하고 회전 축에 놓으려는 셀의 피쳐에 선(L-)(이미지 창의 오른쪽에 있는 선 도구 버튼을 클릭)을 그립니다.
- +θM 또는 -θM에서 샘플 Z 변환을 사용하여 선택한 피쳐를 두 라인 사이의 중심 위치로 이동합니다(샘플 및 샘플 Z 변경> 모션 제어).
- L+에서 L-까지의 최소 거리에 도달할 때까지 3.3.2.3단계부터 절차를 반복적으로 반복합니다.
메모: L+와 L-두 선 사이의 거리는 이전 반복에 비해 더 작아야 합니다. - 샘플 θ = 0(샘플 및 변경 샘플 θ> 모션 컨트롤)에서 선택한 피쳐를 두 라인의 중앙에 배치하는 데 필요한 거리의 두 배로 샘플 X를 이동합니다(모션 컨트롤 > 샘플 및 샘플 X 변경 ). ZP(영역 플레이트) X를 이동하여 피쳐를 FoV의 중앙으로 되돌립니다(ZP를 > 동작 제어 및 ZP X 변경). 그리드당 한 번만 이 단계를 수행합니다.
- ZP Z 초점 시리즈(서로 다른 ZP Z 위치에서의 이미지 모음, 보통 0.3μm 단위)(현미경 > 획득 > 획득 설정 > 초점 시리즈> 시작)를 기록하여 새로운 회전축에 대해 ZP Z 위치를 다시 최적화하고 ZP Z를 샘플이 초점이 맞춰진 위치로 이동(모션 제어 >> 존 플레이트 및 변경 영역 플레이트 z)합니다.
- 틸트 계열 획득에 대한 매개변수를 설정합니다.
메모: 최대 각도 범위는 궁극적으로 ZP의 초점 거리에 의해 제한됩니다 (평평한 샘플의 경우 각각 40nm 또는 25nm ZP의 경우 ±70 또는 ±65도). 신호 대 잡음비(S/N) 및 방사선 손상을 최적화하여 노출 시간을 정의합니다. 단층 촬영의 경우 다른 각도 범위에서 다른 노출 시간을 사용하십시오. - 최대 회전 각도에 도달하기 전에 그림자가 발생하는 경우 가장 높은 회전 각도 범위를 결정합니다.
- 카메라 비닝을 1로 설정(현미경 > 획득 > 획득 설정 > 카메라 설정 및 비닝 변경)으로 설정하고, 미스트랄에서 출구 슬릿을 15μm로 열고(모션 컨트롤 > XS 및 XS 변경) 회전을 0°로 설정합니다(모션 제어 > 샘플 및 샘플 θ 변경).
- 노출 시간이 1초인 단일 이미지(현미경 > 획득 > 획득 설정 > 획득 모드 > 단일 > 시작)를 획득하고 단층 촬영의 각 기울기 각도에 필요한 노출 시간을 추정합니다.
- 카메라를 비닝 2, 노출 시간 1 초 (현미경 > 획득 > 획득 설정 > 카메라 설정으로 설정하고 노출 시간을 변경; 비닝을 변경; 현미경 > 수집 > 수집 모드 >연속 > 시작), 출구 슬릿을 5 μm로 설정합니다.
- 단층 촬영을 수행하기 위해 모자이크 내의 영역을 선택하도록하십시오 (즉, X 선 모자이크 맵에 FoV의 크기와 함께 사각형 모양 (이미지 창의 왼쪽에있는 도구 클릭)을 배치하십시오.
- 단층 촬영
- 음의 최대 각도 +0.1로 이동(예를 들어, ZP 25nm의 경우 -65.1°로 이동)(모션 컨트롤 은 샘플 > 변화하고 샘플 θ를 변경함).
- 이미지 수를 총 각도 수(각도 0에서 이미지를 고려)와 각도 범위(현미경 > 획득 > 획득 설정 > 획득 모드 > 단층 촬영으로 설정하고 이미지 수를 변경한 다음 앵글 시작과 앵글 엔드를 변경합니다.
- 정의된 노출 시간을 설정하고 수집을 시작합니다(현미경 > 획득 > 획득 설정 > 카메라 설정 및 노출 시간 변경은 시작을 클릭합니다).
- FF 위치로 이동(모션 컨트롤 > 샘플 및 샘플 X 변경, 샘플 Y 변경)과 10개의 FF 이미지를 획득합니다(현미경 > 획득 > 획득 모드 평균> 이미지 수를 변경한 다음 시작을 클릭하십시오).
메모: Mistral에서는 분광 현미경 또는 에너지 의존 현미경 검사가 관심 흡수 가장자리를 가로 질러 에너지를 스캔하면서 돌출부를 획득 할 때 가능합니다. 최종 출력은 각 픽셀에 X선 흡수 스펙트럼(XAS), 즉 화학 정보가 있는 이미지를 포함하는 2D 프로젝션 스택입니다. 분광법과 단층 촬영을 결합하는 3D로의 확장은 원칙적으로 가능합니다. 요구되는 총 투여량은 한계일 수 있고, 그 후 차등 흡수 영상화와 같은 특정 전략이 요구될 수 있다.
4. 데이터 분석
참고: 모든 데이터 분석은 자동화된 파이프라인으로 개발된 사용 가능한 개방형 소프트웨어 및 스크립트로 수행됩니다.
- 미스트랄에서
- 파이프라인은 단층 촬영 스택을 txrm 확장(TXM 소프트웨어 확장)에서 hdf5(오픈 소스 계층적 데이터 형식)로 변환하여 필요한 모든 메타데이터를 사용하여 FF 평균 및 기계 전류로 스택을 정규화한 다음 마지막으로 특정 프레넬 영역 플레이트(ZP) 렌즈 및 에너지(23)에 대한 광학 시스템의 측정된 포인트 확산 함수에 의해 스택을 디컨볼브합니다. 24. 디컨볼루션의 경우 적절한 k = 1/SNR 값을 찾습니다(샘플 두께에 따라 다름). Mistral에서 개발된 스크립트의 경우 txrm2deconv "input tomo" "input FF" -zp="ZP used" - e= " energy " - dx= " pixel size " - k= " 1/SNR " - t=-1 명령을 입력하십시오.
- 자동 정렬을 위해 Mistral에서 개발된 스크립트의 경우 ctalignxcorr "정규화된 디컨볼브 stack.mrc" "정규화된 stack.hdf5" 명령을 입력합니다.
참고: Au NP 신탁25,26을 사용하여 프로젝션을 공통 회전 축에 정렬하는 데 여러 소프트웨어 응용 프로그램을 사용할 수 있습니다. 프로젝션을 정렬하려면 서브픽셀 정확도가 필요합니다. 자동 정렬은 Au NP 신탁이 충분하고 (>7) 시야에 잘 퍼져있을 때만 만족 스러울 수 있습니다. 수동 정렬은 종종 가능한 가장 높은 정확도를 달성하기 위해 자동 정렬을 수정하기 위해 사후가 필요합니다. - 정렬된 정규화된 스택을 재구성하려면 사용 가능한 여러 알고리즘 중 하나를 사용합니다.
참고: 정렬된 스택은 몇 분 안에 WBP(가중 백 프로젝션) 또는 SIRT(동시 반복 재구성 기술)를 사용하여 재구성할 수 있습니다. 그러나, 선형 흡수 계수(LAC)를 보존하기 위해, 대수 재구성 기술(ART)이 바람직하다(27). ART는 더 많은 컴퓨팅 시간을 요구하므로 SIRT28 은 빠른 자동 정렬 틸트 시리즈 재구성 (몇 분 안에 30 회 반복)을 위해 먼저 수행됩니다. 정렬이 만족스러우면 ART가 사용됩니다.
- B24에서
- 사용자 지정 파이프라인은 txrm 데이터 파일을 필요한 모든 메타데이터가 있는 표준 Tiffs로 변환한 다음 WBP, SIRT 및 patch의 세 가지 방법으로 데이터 세트를 처리하는 배치 runtomo 워크플로로 보냅니다.
결과
cryo-SXT용 샘플을 준비하는 것은 어려울 수 있습니다. 동일한 샘플 그리드 내에서도 그림 5에서 볼 수 있듯이 동일한 Au 파인더 격자의 두 사각형을 보여 주는 이상적인 영역과 이상적이지 않은 영역을 가질 수 있습니다. 이상적인 샘플은 사각형 메쉬의 중앙에 단일 셀이 있어야하며, 얇은 얼음 층에 내장되어 있어야하며 단층 촬영 재구성 전에 틸트 돌기의 정렬에 사용되는 잘 분산 된 Au 신탁 마커로 둘러싸여 있어야합니다. 도 5A는 이들 기준의 다수를 준수하는 섬유아세포형 세포(NIH 3T3)를 도시한다. 시야각(FoV)을 나타내는 빨간색 박스로 표시된 영역의 ART27 을 이용한 3D 재구성으로부터의 단일 슬라이스가 도 5B에 도시되어 있다. 미토콘드리아(M), 소포체(ER), 소포(V) 및 핵(N)과 같은 많은 상이한 소기관들은 LACs의 정량적 재구성 덕분에 구별될 수 있다. 또한, 재구성의 신호 대 잡음비는 매우 높아 세포 특징의 높은 콘트라스트를 달성할 수 있게 한다. 한편, 도 5C는 더 높은 셀 밀도를 갖는 사각형을 나타낸다. 이 때문에 블롯팅은 일반적으로 효율성이 떨어지며 얼음층이 두꺼워 지거나 유리화 문제가 발생합니다. 일부 경우에, 이것은 X선 이미징 전에 에피형광 매핑을 사용하여 그리드를 스크리닝할 때 이미 관찰될 수 있으며, 이러한 그리드는 어떠한 비용으로도 피해야 한다. 도 5C에서, 격자 내의 균열 및 유리화된 얼음이 전체 메쉬 사각형(적색 화살표로 표시됨)을 통과하는 것을 관찰할 수 있다. 균열 근처의 모든 이미징은 빔에 노출 될 때 그리드의 불안정성 때문에 피해야합니다. 또한, 균열은이 지역의 경우와 같이 두꺼운 얼음의 징후가 될 수 있습니다. 틸트 시리즈가 빨간색 상자로 표시된 영역에 기록되었습니다. 도 5D에서, 대응하는 3D 재구성으로부터의 단일 슬라이스가 도시된다. 일부 더 큰 구조물이 인식 될 수 있지만, 예를 들어 화살표가 가리키는 상부 미토콘드리아에서 구체적으로 볼 수 있듯이 두꺼운 얼음의 유리화 품질이 좋지 않기 때문에 소음과 거친 질감 내에서 미세한 세부 사항이 손실됩니다.
그림 1: 워크플로 cryo-SXT 데이터 수집 전에 회로도 워크플로우가 뒤따랐습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
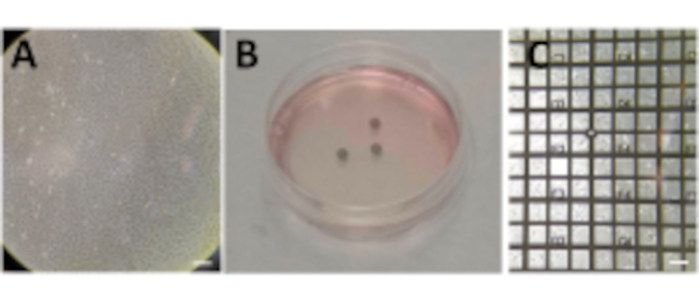
그림 2: 그리드에서 성장하는 세포. (A) P100 페트리 접시에서 약 80%-90%의 합류율을 보이는 세포. (b) P60 페트리 접시와 세포를 시딩한 후 여러 격자를 가한다. (c) 세포는 24시간 후에 격자 상부에서 성장한다. 스케일 바: 100 μm. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 3: 샘플 홀더와 이송 챔버에 그리드 를 적재합니다. (A) 그리드를 적재할 준비가 된 셔틀 및 냉동 박스로 액체 질소로 채워진 워크스테이션. (B) 그리드가 적재 된 상태에서 로더에 삽입 된 샘플 홀더. (C) 덮개 없이 위치 3에 있는 샘플 홀더와 셔틀. (D) 이송 챔버가 부착된 워크스테이션. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 4: TXM(A)에 샘플을 로딩하고 전사 챔버를 TXM에 부착. (B) TXM 내부 셔틀. (c) TXM 로봇 암이 샘플 홀더를 샘플 스테이지 내로 삽입한다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
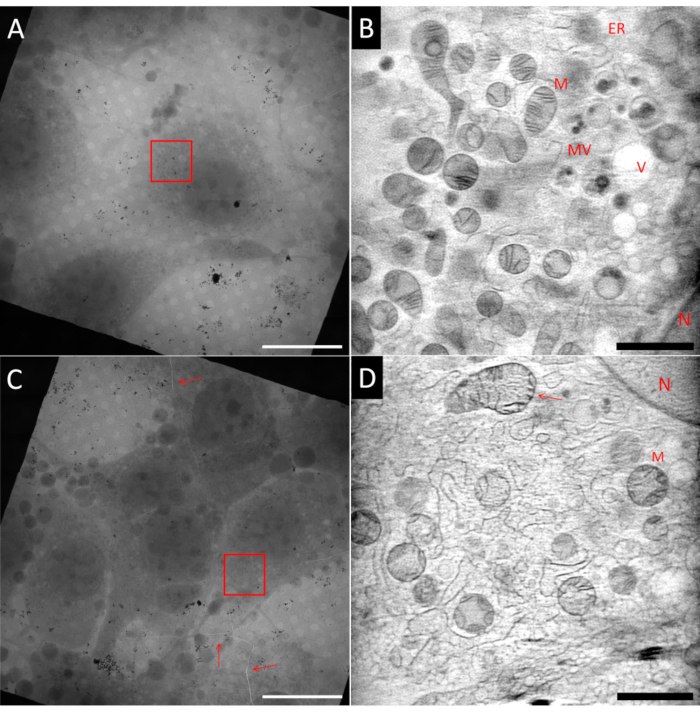
도 5: 냉동 소프트 X선 단층 촬영의 예. 상부 행: 이상적인 샘플, (A) 중앙에서 분리된 세포를 나타내는 격자 사각형의 2D 모자이크 도면. (B) 재구성된 3D 볼륨으로부터 하나의 슬라이스가 레드 박스(A)로 표시된 영역을 나타낸다. (D)에 비해 이미지가 훨씬 부드럽고 더 많은 세부 사항이 표시됩니다. 아래쪽 행: 비이상적인 샘플, (C) 얼음 및 그리드 호일에 너무 높은 셀 합류도와 균열을 보여주는 그리드 사각형의 2D 모자이크 보기(빨간색 화살표). (d) 재구성된 3D 볼륨으로부터 하나의 슬라이스가 (C)에서 레드 박스로 표시된 영역을 나타낸다. 불량하거나 차선책의 유리화는 이미지의 거친 질감으로 식별 할 수 있습니다. N: 핵; M: 미토콘드리아; ER: 소포체; MV: 다소포체; V: 액포; 스케일 바: A & C 20 μm; B & D 2 μm.V이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
토론
샘플 준비는 고품질의 부드러운 X 선 단층 촬영을 얻는 중요한 단계이며, 그 품질은 샘플 유리화의 품질과 세포가 내장되어있는 얼음층 두께에 직접적으로 달려 있습니다. 신호 대 잡음비가 높은 프로젝션은 얼음층이 얇은 지역에서 수집되어 가능한 가장 높은 분해능을 달성하는 데 필요한 방사선 선량을 최소화할 수 있습니다. 또한, 셀 컨플루언시는 또한 최종 토모그램 품질에 영향을 미치는데, 이는 회전 시 이웃 셀이 FoV에 들어가는 것을 피해야 하기 때문이다. 마지막으로, Au 신탁 마커의 올바른 분산은 프로젝션 정렬의 정확도를 결정한 다음 궁극적으로 최종 3D 재구성 볼륨의 품질을 결정합니다. 그리드에 Au 신탁을 적절히 분산하면 프로젝션 정렬 단계의 자동화가 가능하며, 이 단계가 없으면 이러한 중요한 단계에 대한 높은 전문 지식이 필요합니다.
본 명세서의 프로토콜은 단지 하나의 가능한 샘플 준비 전략을 묘사하며, 이는 냉동 전자 단층 촬영 (cryo-ET)에 사용되는 것들과 유사성을 갖는다. 두 경우 모두, 더 나은 재현성을 위해 까다로운 샘플 준비를 개선하는 프로토콜이 이러한 기술의 성공을 위한 기본이 될 것이며, 이러한 목표(29)를 향한 노력이 이루어지고 있다. 격리된 세포를 영상화하는 것 외에도, 조직을 통한 전달 신호가 높은 기울기 각도에서 충분할 것이라는 점을 제공하면 조직의 절편도 시각화될 수 있다는 것을 언급할 가치가 있다. 일반적으로 이것은 몇 미크론 (10 μm 미만)의 섹션을 의미합니다.
셀 내부의 특정 구조나 이벤트를 이미지화하려면 이 특정 기능이 틸트 시리즈의 FoV 내부에 있는지 확인해야 합니다. cryo-SXT에서 FoV는 렌즈에 따라 10 x 10 μm2 내지 15 x 15μm2로 제한되고 분해능의 픽셀 오버샘플링을 적어도 2배로 차지하므로, 종종 전체 셀 확장보다 작다(도 5에 표시된 적색 사각형 참조). 따라서 ROI를 찾고 적절하게 표시해야합니다. 이것은 일반적으로 형광 태그와 가시 광선 상관 관계 접근법을 통해 수행됩니다. 소프트 X선 투과 현미경이 통합된 온라인 가시광선 형광 현미경을 가지고 있기 때문에 에피형광을 결합하는 2D 전략은 간단하지만, 고분해능 2D 또는 3D 형광 신호에 대한 다른 접근법도 사용할 수 있습니다 4,12,13,15,16 . 이러한 경우 그리드를 초해상도 현미경과 같은 특정 장비에서 먼저 이미징해야 합니다. 가장 효율적인 상관 관계 접근법은 극저온 조건에서 데이터 수집과 관련된 접근법입니다. 이는 실온 (RT), 가시광선 형광 이미징, 및 샘플 유리화 사이의 시간 경과가 예를 들어, 시간에 맞는 세포 이벤트를 포착하는 것을 방해하기 때문이다; 또한, 유리화 절차는 RT에서 이미지화된 관심 셀을 그리드로부터 분리할 수 있다. 대부분의 상관 관계 이미징 접근법이 샘플 그리드를 조작하고 한 장비에서 다른 장비로 운반해야한다는 것을 암시 할 수 있으며, 그리드 오염 또는 손상의 위험이 증가하더라도 세포 환경 내에서 특정 사건이나 분자를 정확히 지적 할 수 있다는 보상은 분명합니다.
전체 세포 영상화가 요구될 때, 적용된 총 선량이 방사선 손상 한계를 초과하지 않는 한 상이한 단층촬영을 바느질할 수 있다. 보통, 동일한 세포 상에서 몇 개의 단층체를 수집하기 위한 기탁된 투여량은 달성 가능한 해상도(10,9 Gy)에서 한계보다 훨씬 낮으며, 따라서, 투여량을 낮추기 위해 특별한 전략이 요구되지 않지만, 이것은 샘플- 및 실험-의존적이다. 분광 단층 촬영과 같은 집중적 인 데이터 수집의 경우 실제로 복용량을 최소화해야하며 편리한 데이터 수집 및 특정 처리 전략을 적용해야합니다.
Cryo-SXT에는 몇 가지 제한 사항이 있으며 여기에서 언급해야합니다. 첫 번째는 잘 알려진 누락 된 쐐기로, 평평한 샘플 지지대를 사용하는 데 필수적입니다. 180도 회전을 허용하는 모세관 샘플 지지대는 과거에 사용되어 왔으며 일부 시설에서도 여전히 사용되었지만 유리 흡수 및 현탁액에서 세포 사용 제한으로 인한 빈곤 한 대비와 같은 단점도 있습니다. 누락 된 쐐기의 효과를 줄이는 방법은 이중 틸트 단층 촬영을 수행하는 것입니다. 이것은 실제로 요즘 미스트랄 빔 라인에서 가능합니다. 두 번째 한계는 이러한 현미경에 사용되는 프레넬 존 플레이트 렌즈에 의해 설정된다. 이 렌즈는 달성 가능한 최고의 해상도와 피사계 심도(DoF)를 설정하며, 둘 다 밀접하게 관련되어 있습니다. 이것은 해상도를 높이면 DoF가 감소하는 반면 셀의 두께는 종종 더 커질 것임을 의미합니다. 예를 들어, 40nm 렌즈는 이론적으로 3μm의 DoF와 24.4nm 하프 피치의 분해능을 가질 것이다. 따라서 해상도와 DoF 사이의 절충안은 전략적이며 렌즈의 선택은 셀30,31의 유형에 따라 달라집니다. 마지막으로, 전 세계적으로 작동하는 TXM은 이상적인 현미경과는 거리가 멀고 이론적 인 기대에 도달하기 위해 광학 시스템을 개선하기위한 노력이 이루어지고 있습니다. 마지막으로, 재구성된 볼륨의 시각화 및 세분화는 특정 소프트웨어 도구(25,32,33,34)로 수행될 수 있다.
요약하면, cryo-SXT는 중간 분해능 (25-30 nm 하프 피치) 및 통계적 수치 (하루에 수십 개의 토모그램)에서 세포를 정량적으로 이미징 할 수 있습니다. 이를 통해 특정 조건, 예를 들어 병원균 감염 또는 질병 중, 정확한 시점 또는 특정 치료 후 소기관의 조직, 분포 및 치수를 얻을 수 있습니다. 따라서, 이는 보다 일반적인 전자 및 가시광선 현미경에 유용한 상보적인 생물학적 이미징 기술이며, 이들 각각은 샘플 치수 및 분해능의 특정 범위를 다루어준다. Cryo-SXT는 가시광선 형광을 포함하는 상관관계 접근법에 자주 사용되지만, 다른 cryo 상관관계 전략도 가능하다.
공개
저자는 이해 상충이 없다고 선언합니다.
감사의 말
이 프로젝트는 Marie Skłodowska-Curie 보조금 계약 No 75439에 따라 유럽 집행위원회 호라이즌 2020 iNEXT-Discovery 프로젝트와 유럽 연합의 Horizon 2020 연구 및 혁신 프로그램으로부터 자금을 지원받았습니다.
자료
| Name | Company | Catalog Number | Comments |
| Amira | Thermo Fisher | Software for segmentation | |
| Au Holey Carbon Films finder grids | (Quantifoil Micro Tools Gmb | R 2/2 Au G200F1 | Au Holey Carbon Films finder grids |
| Au nanoparticles | BBI Group, Cardiff, UK | Au nanoparticles 100nm | 100 nm Au nanoparticles (NPs) at Mistral (Alba) |
| Au nanoparticles | BBI Group, Cardiff, UK | Au nanoparticles 250nm | 250 nm Au nanoparticles (NPs) at B24 (Diamond) |
| Axio Scope A1 | Zeiss | 430035 9060 | Fluorescence microscope |
| Blotting No.1 filter paper | Whatman | WHA10010155 | Blotting filter |
| Bsoft | Software for projection alignment, reconstruction and visualization (Heymann et al., 2008) | ||
| Chimera | Software for segmentation (Pettersen et al. 2004) | ||
| Cryo-EM Glow Discharge Set | PELCO easiGlow | 91000S | Glow Discharge Cleaning System |
| Cu Holey Carbon Films finder grids | (Quantifoil Micro Tools Gmb | R 2/2Cu G200F1 | Cu Holey Carbon Films finder grids |
| Fetal calf serum | Sigma | F9665 | Heat Inactivated, sterile-filtered, suitable for cell culture |
| ImageJ | Software for image processing and analysis in Java (NIH & LOCI University of Wisconsin) | ||
| IMOD | Software for projection alignment, reconstruction and visualization (Kremer et al., 1996) | ||
| Leica EM GP Grid Plunger | Leica | 16706401 | Automatic Plunge Freezer EM |
| LINKAM cryo-stage | Linkam Scientific Instruments | CMS 196 | Cryo-Correlative Microscopy Stage |
| MIB | Software for segmentation (Belevich et al. 2016) | ||
| P100 Petri dish | Sigma | P6106 | Treated for cell culture and sterile |
| P60 Petri dish | Sigma | D8054 | Treated for cell culture and sterile |
| Polylysin | Sigma | P4707 | Poly-L-lysine solution 0.01%, sterile-filtered |
| Soft X-Ray microscope 0.25-1.2keV | Xradia | NCT-SB | Transmission soft X-Ray microscope |
| SURVOS | Software for segmentation (Luengo et al. 2017) | ||
| Tomo3d | Software for reconstruction (SIRT, WBP) (Agulleiro et al. 2011) | ||
| TomoJ | Software for reconstruction (ART) (Messaoudi et al., 2007) | ||
| XM Data Explorer | Zeiss | TXM software |
참고문헌
- Carrascosa, J. L., et al. Cryo X-ray tomography of vaccinia virus membranes and inner compartments. Journal of Structural Biology. 168, 234-239 (2009).
- Uchida, M., et al. Soft X-ray tomography of phenotypic switching and the cellular response to antifungal peptoids in Candida albicans. PNAS. 106, 19375-19380 (2009).
- Schneider, G., et al. Three-dimensional cellular ultrastructure resolved by X-ray microscopy. Nature Methods. 10, 1-3 (2010).
- Chichón, F. J., et al. Cryo nano-tomography of vaccinia virus infected cells. Journal of Structural Biology. 177, 202-211 (2012).
- Groen, J., Conesa, J. J., Valcárcel, R., Pereiro, E. The cellular landscape by soft X-ray tomography. Biophysical Reviews. 11, 611-619 (2019).
- Kepsutlu, B., et al. Cells undergo major changes in the quantity of cytoplasmic organelles after uptake of gold nanoparticles with biologically relevant surface coatings. ACS Nano. 14, 2248-2264 (2020).
- Natterer, F. . The mathematics of computerized tomography. , (1986).
- Weiss, D., et al. Computed tomography of cryogenic biological specimens based on X-ray microscopic images. Ultramicroscopy. 84, 185-197 (2000).
- Clowney, E. J., et al. Nuclear aggregation of olfactory receptor genes governs their monogenic expression. Cell. 151, 724-737 (2012).
- Duke, E. M. H., et al. Imaging endosomes and autophagosomes in whole mammalian cells using correlative cryo-fluorescence and cryo-soft X-ray microscopy (cryo-CLXM). Ultramicroscopy. 143, 77-87 (2014).
- Cinquin, B., et al. Putting molecules in their place. Journal of Cellular Biochemistry. 115, 209-216 (2014).
- Hagen, C., et al. Multimodal nanoparticles as alignment and correlation markers in fluorescence/soft X-ray cryo-microscopy/tomography of nucleoplasmic reticulum and apoptosis in mammalian cells. Ultramicroscopy. 146, 46-54 (2014).
- Pérez-Berná, A. J., et al. Structural changes in cells images by soft X-ray cryo-tomography during Hepatitis C virus infection. ACS Nano. 10, 6597-6611 (2016).
- Chiappi, M., et al. Cryo-soft X-ray tomography as a quantitative three-dimensional tool to model nanoparticle:cell interaction. Journal of Nanobiotechnology. 14, 15 (2016).
- Varsano, N., et al. Development of correlative cryo-soft X-ray tomography and stochastic reconstruction microscopy. A study of cholesterol crystal early formation in cells. Journal of the American Chemical Society. 138, 14931-14940 (2016).
- Kounatidis, I., et al. Correlative cryo-structured illumination fluorescence microscopy and soft X-ray tomography elucidates reovirus intracellular release pathway. Cell. 182, 1-16 (2020).
- Kapishnikov, S., et al. Mode of action of quinoline antimalarial drugs in red blood cells infected by Plasmodium falciparum revealed in vivo. PNAS. 116 (46), 22946-22952 (2019).
- Conesa, J. J., et al. Unambiguous intracellular localization and quantification of a potent iridium anticancer compound by correlative 3D cryo X-ray imaging. Angewandte Chemie International Edition. 59, 1270-1278 (2020).
- Gal, A., et al. Native-state imaging of calcifying and noncalcifying microalgae reveals similarities in their calcium storage organelles. PNAS. 115 (43), 11000-11005 (2018).
- Procopio, A., et al. Chemical fingerprint of Zn-hydroxyapatite in the early stages of osteogenic differentiation. ACS Central Science. 5, 1449-1460 (2019).
- Kahil, K., et al. Cellular pathways of calcium transport and concentration toward mineral formation in sea urchin larvae. PNAS. 117 (49), 30957-30965 (2020).
- Conesa, J. J., et al. Intracellular nanoparticles mass quantification by near-edge absorption soft X-ray nanotomography. Scientific Reports. 6, 22354 (2016).
- Otón, J., Sorzano, C. O. S., Maribini, R., Pereiro, E., Carazo, J. M. Measurement of the modulation transfer function of an X-ray microscope based on multiple Fourier orders analysis of a Siemens star. Optics Express. 23 (8), 9567-9572 (2015).
- Otón, J., et al. Characterization of transfer function, resolution and depth of field of a soft X-ray microscope applied to tomography enhancement by Wiener deconvolution. Biomedical Optics Express. 7, 5092-5103 (2016).
- Kremer, J. R., Mastronarde, D. N., McIntosh, J. R. Computer visualization of three-dimensional image data using IMOD. Journal of Structural Biology. 116, 71-76 (1996).
- Heymann, J. B., Cardone, G., Winkler, D. C., Steven, A. C. Computational resources for cryo-electron tomography in Bsoft. Journal of Structural Biology. 161, 232-242 (2008).
- Messaoudi, C., et al. Three-dimensional chemical mapping by EFTEM-TomoJ including improvement of SNR by PCA and ART reconstruction of volume by noise supression. Microscopy Microanalysis. 19, 1669-1677 (2013).
- Agulleiro, J. I., Fernández, J. J. Fast tomographic reconstruction on multicore computers. Bioinformatics. 27, 582-583 (2011).
- Toro-Nahuelpan, M., et al. Tailoring cryo-electron microscopy grids by photo-micropatterning for in-cell structural studies. Nature Methods. 17, 50-54 (2020).
- Attwood, D. . Soft X-rays and Extreme Ultraviolet Radiation. Principles and Applications. , (2000).
- Howells, M., Jacobsen, C., Warwick, T. . Principles and Applications of Zone Plate X-ray. Microscopes. Science of Microscopy. , (2007).
- Pettersen, E. F., et al. UCSF Chimera--a visualization system for exploratory research and analysis. Journal of Computational Chemistry. 25, 1605-1612 (2004).
- Belevich, I., Joensuu, M., Kumar, D., Vihinen, H., Jokitalo, E. Microscopy image browser: a platform for segmentation and analysis of multidimensional datasets. PLOS Biology. 14 (1), 1002340 (2016).
- Luengo, I., et al. SuRVoS: Super-region volume segmentation workbench. Journal of Structural Biology. 198, 43-53 (2017).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유