Method Article
クライオ軟X線断層撮影による細胞の3D地図作成記述
要約
ここでは、クライオ軟X線断層撮影法(SXT)で凍結保存細胞全体の超構造を25nmハーフピッチの分解能で画像化するために必要なサンプル調製およびデータ収集ステップを説明するプロトコルを提示する。
要約
イメージング技術は、生物学研究および関連分野における細胞組織および機構を理解するための基礎である。これらの技術の中で、クライオ軟X線断層撮影法(SXT)は、炭素構造が本質的に水よりも高い吸収を有する水窓X線エネルギー範囲(284〜543eV)で凍結保存細胞全体をイメージングすることを可能にし、各ボクセルに含まれる材料の線形吸収係数の3D再構成を可能にする。厚さ10μmまでの細胞全体のレベルでの定量的構造情報は、このようにして、25〜30nmのハーフピッチまでの高スループットと空間分解能で達成可能です。Cryo-SXTは、細胞感染プロセス(ウイルス、細菌、寄生虫)、疾患(劣性遺伝性疾患など)による形態学的変化に関する3D情報を提供し、細胞レベルでの薬物作用の理解、または3D細胞環境における特定の構造の特定に関する3D情報を提供し、現在の生物医学研究に関連することが証明されています。さらに、シンクロトロン施設での同調可能な波長を利用して、分光顕微鏡またはその3D対応物である分光断層撮影法は、バイオミネラリゼーションプロセスにおけるカルシウムなどの細胞内の特定の元素を画像化および定量するためにも使用することができる。Cryo-SXTは、電子顕微鏡、蛍光X線、可視光蛍光などの他の生物学的イメージング技術に補完的な情報を提供し、機能、位置、形態をリンクするために極低温条件下での2Dまたは3D相関イメージングのパートナー方法として一般的に使用されています。
概要
Cryo-SXTは、水和した全細胞1、2、3、4、5、6の3D媒体分解能(25〜30nmハーフピッチ)ボリュームを提供するため、生物学的イメージング研究において中心的な役割を果たすことができます。水窓エネルギー範囲では、炭素と酸素吸収Kエッジ(4.4-2.3nm)の間に、炭素に富む細胞構造は、それらを浸透して取り囲む酸素に富む媒体の10倍以上を吸収する。このエネルギー範囲では、厚さ10μmまでのガラス化細胞を切片化や染色を必要とせずに画像化することができ、定量的な高吸収コントラスト投影をもたらし、サンプル回転能力と組み合わせることで、細胞構造の断層再構成を可能にする。Cryo-SXTは、他のイメージング技術では容易にアクセスできない試料寸法と空間分解能の点でニッチを埋めます。
簡単に言えば、厚さtの試料を通る光子の減衰は、以下のようにビール・ランバートの法則に従うので、クライオ−SXTの吸収コントラストは定量的である: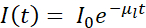 ここで、I0は入射強度を表し、μlは波長λおよび試料の屈折率の虚部βに依存する線形吸収係数(
ここで、I0は入射強度を表し、μlは波長λおよび試料の屈折率の虚部βに依存する線形吸収係数(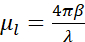 ).減衰は、生化学的組成と画像化される構造の厚さの関数であり、各生化学成分は特定のX線線形吸収係数μ1(LAC)を有する。これは、各断層撮影ボクセル値が、そのボクセル7中の化学元素およびそれらの濃度に依存することを意味する。これにより、核、ヌクレオリ、脂質体またはミトコンドリアなどの異なる細胞小器官の自然な識別、または再構成された固有のLAC値のみに基づいてクロマチンの異なる圧縮状態を自然に識別することができます2,8,9。
).減衰は、生化学的組成と画像化される構造の厚さの関数であり、各生化学成分は特定のX線線形吸収係数μ1(LAC)を有する。これは、各断層撮影ボクセル値が、そのボクセル7中の化学元素およびそれらの濃度に依存することを意味する。これにより、核、ヌクレオリ、脂質体またはミトコンドリアなどの異なる細胞小器官の自然な識別、または再構成された固有のLAC値のみに基づいてクロマチンの異なる圧縮状態を自然に識別することができます2,8,9。
さらに、クライオSXTはハイスループット技術で、断層撮影は数分で収集されます。これにより、分裂、分化、アポトーシスなどの重要な時点でキャプチャできる細胞集団のメソスケールイメージングが特に可能になりますが、特定の薬物療法への化学的曝露や病原性感染によって誘発されるような異なる応答状態でもキャプチャできます。これらの重要なポイントで収集されたデータは、それらの特定の瞬間における異なる細胞小器官の空間組織の忠実な記録とともに、システムの3D記述を提供する。
通常、クライオ−SXTは、3D細胞環境内の特定の特徴、事象、または巨大分子の位置を特定することを可能にする相関的アプローチに従う他の技術と組み合わせて使用される4、10、11、12、13、14、15、16、またはハード蛍光X線データ17、18.極低温条件下での相関アプローチは、関心のあるシステムの最も完全で価値のある画像を得るために最も重要です。ミストラル(Alba)およびB24(ダイヤモンド)クライオSXTビームラインの典型的なワークフローの簡潔な要約を図1にスケッチします。
また、シンクロトロン設備の波長同調能力を活かして、試料に含まれる特定の元素の特定の微分吸収を利用した構造的な情報に加えて、分光情報も得ることができる。この例は、細胞19、20、21におけるバイオミネラリゼーションプロセスの研究におけるカルシウムの位置であろう。異なる光子エネルギー(スペクトル)または断層図で2D画像を撮影することによって、関心のあるX線吸収端で、選択された元素を含むピクセルまたはボクセルを識別することができる。スペクトルはまた、化学状態の鑑別(すなわち、前のバイオミネラリゼーション例20におけるような非晶質カルシウムのハイドロキシアパタイトへの進化)を可能にする。異なる元素の定量化は2Dと3Dで可能です。ガラス化細胞の分光画像化は、典型的には、水窓で行われるが、含水率が十分に低い場合、または脱水を含む他の試料調製プロトコルが使用される場合、他のエネルギー範囲でも可能である22。ステップバイステップの詳細な分光法プロトコルは、本明細書のプロトコルの焦点を超えている。
以下では、プロトコルは主要なサンプル調製ステップを簡単に要約することに焦点を当てていますが、各システムは個々の改良が必要な場合がありますが、クライオ軟X線断層撮影のための詳細なステップバイステップのデータ収集手順が続きます。
プロトコル
1. サンプル調製
- グリッド・サポートの準備
- 滅菌のために炭素膜を上に向けてグリッドにUVを3時間照射する。
- オプション: セルがグリッドにアタッチされないという問題がある場合は、以下のいずれかのステップを使用します。
- グリッドのプラズマ処理によって炭素支持箔を親水化して、サンプルの拡散と細胞接着を改善します。
- グロー放電室装置内にカーボン側のグリッドを上にして配置し、装置に応じてグリッドをプラズマに30秒~15分間(ArまたはO2を使用)さらします。
- ポリ-L-リジン(PLL)でグリッドを機能化する
- ペトリ皿に60 μL PLLの個々の滴を加え、炭素膜を下に向けてPLL滴の上にグリッドを置きます。37°Cで30分間インキュベートし、ろ紙を用いてPLLをブロットした。
- グリッドをウシ胎児血清(FBS)で機能化します。
- グリッドを一晩FBSに沈めます。グリッドを緩衝液に浸して洗浄し、グリッドをろ紙に残して余分な液体を除去します。
- グリッドのプラズマ処理によって炭素支持箔を親水化して、サンプルの拡散と細胞接着を改善します。
- グリッド上の付着細胞の成長
- 100mmの細胞培養皿中で細胞を増殖させ、80%〜90%のコンフルエントに達する(図2A)。
- P60ペトリ皿(合計3mL)のAuグリッドの上に1-5 x 105セル/ mL(システムに合わせて値を調整)をシードします。
手記: 細胞懸濁液の添加は、60mmの細胞培養皿においてグリッドの炭素膜が上を向いて非常に慎重に行われなければならない。条件ごとに複数のグリッドを用意し、P60ペトリ皿ごとに1つの条件を準備します(図2B)。 - グリッド上のコンフルエンシーが各メッシュ正方形の複数のセル (セル サイズに応じて 1 ~ 10) に達するまでセルが沈降するのを待ちます (セル ラインによっては、これには最大 24 時間かかることがあります)。
手記: 凍結する前に、グリッドを可視光顕微鏡(VLM)でチェックし、各グリッドの炭素膜の完全性とセルコンフルエンシーを評価する必要があります(図2C)。グリッド上の適切なセル密度に達するまで待ちます。グリッドが合流しすぎたり、カーボンホイルが壊れている場合は、最初からやり直してください。
- グリッド上の懸濁液中の細胞の沈着
- プランジ冷凍庫からピンセットを使用して、準備したAuまたはCuグリッドを選択します(セクション1.6を参照)。
- 1〜5 x105 細胞懸濁液(細菌の場合の光学密度吸光度0.3)を調製し、調製した懸濁液を4 μLをグリッドに加える。
- 細胞の堆積を可能にするために、滴と共にグリッドを水平に数分間インキュベートし、次いで、適切な温度および湿度条件に設定した気候制御ガラス化保存チャンバ内にグリッドを保持するピンセットを置く(ステップ1.6.1)。
- オプション:サンプルの蛍光タグ付け
手記: 試料の一部の細胞小器官を蛍光標識することは有益であり得る。目的に応じて、蛍光タンパク質を安定に発現する特定の蛍光団または細胞、または目的のタンパク質の一過性発現のためにトランスフェクトされた細胞が使用できる。これにより、クライオエピ蛍光顕微鏡を使用して細胞を簡単に検出でき、その後のX線イメージングで目的の細胞を見つけるのに役立ちます。以下では、このプロトコルは蛍光色素の使用についてのみ詳述しています。- 蛍光色素分子用の有効なソリューションを準備し(メーカーの推奨を参照)、特定のプロトコルに従います。
- グリッドを含むペトリ皿に蛍光色素を加え、穏やかに混ぜる。
- 暗い環境でインキュベートし、インキュベーションが終了したらステップ1.6に直接進みます。
注:インキュベーションが終了したら、非特異的なタグ付けとその結果の蛍光シグナルのぼやけを避けるために、ガラス化する準備ができていることが重要です。
- 断層図投影アライメントのためのAuナノ粒子(NP)調製
- Au基準原液1mL(ミストラルで100nmまたはB24で250nm)の1つのアリコートを取り、NPをペレット化できるように低速で(凝集を避けるために)1分間遠心分離する。
手記: 可能であれば、凝集を避けるために、受託者を一晩以上自然に沈降させることが好ましい。 - 上清を取り除きます。凍結の直前に、NPsを20μLの無血清培地または緩衝液に再懸濁して、均一な溶液を得る。
手記: 超音波処理とボルテックスは、溶液を均質化するために推奨されます。
- Au基準原液1mL(ミストラルで100nmまたはB24で250nm)の1つのアリコートを取り、NPをペレット化できるように低速で(凝集を避けるために)1分間遠心分離する。
- プランジ凍結グリッド
警告: 液体窒素は冷やけの原因となる可能性があるため、適切な保護具(長い白衣、安全ゴーグル、手袋、長ズボン、閉じた靴)を着用する必要があります。エタンは非常に爆発性があり、火花や直火から遠ざけてください。- 製造元の指示に従って、プランジ冷凍装置を準備して使用します。
手記: 湿度は通常80%〜90%に設定されています。温度は細胞種に依存する(酵母は最大30°C、哺乳動物細胞は37°C、昆虫細胞は28°Cなど)。 - リムのそばのペトリ皿から取り付けピンセットでグリッドを取り、グリッドを曲げないように細心の注意を払ってプランジ冷凍装置に取り付けます。セルが吸い取り紙から離れていることを確認します。
- オプション:付着細胞の場合はグリッドをバッファーで3回洗浄する。
- 細胞の上部(チャンバーの右側の穴を通して)に1.5μLのAu NPフィデューシャルを加え、30秒間沈降させてから、グリッドを吸い取って急降下させる。
手記: 懸濁液中の細胞の場合、ピンセットを取り付ける前に、水平位置に留まっている間にAu NP基準をグリッドに追加し、30秒間静止させます。ブロッティングは、高品質のグリッドにとって非常に重要です。ブロッティング距離は、開始する前に較正する必要があります。吸い取り紙の平坦性は、再現可能な吸い取りのために重要です(メーカーの指示に従ってください)。ブロッティング時間は、細胞タイプごとに評価する必要があります。 - 条件ごとに複数のグリッドを用意します。グリッドを転送し、ガラス化を維持するために極低温で保管します。
- 製造元の指示に従って、プランジ冷凍装置を準備して使用します。
- クライオ可視光顕微鏡によるグリッドのスクリーニング
- 液体窒素下のグリッドをクライオボックスから、予冷却されたクライオステージ内の標準クライオカセット(3 mm TEMグリッドの場合は3つの位置)に移します(メーカーの指示を参照)。
- クライオカセットはクライオステージブリッジ上に置かれ、クライオステージは広視野落射蛍光光学顕微鏡に取り付けられます。
- クライオSXTイメージングに適した細胞を見つけ、グリッドの品質(厚い氷の存在、炭素支持膜の完全性、蛍光シグナルの存在など)を評価するために、長い作動距離対物レンズ(10x、50x、100x)を使用して-196.5°Cでグリッドを画像化します。
- 明視野または蛍光イメージングを使用して、目的の細胞を局在化します。
注:この段階で、顕微鏡にリンクカメラがある場合は、画像をキャプチャします。画像の相関に使用します。 - スクリーニング後、グリッドを液体窒素貯蔵デュワー内のクライオボックスに戻します。
手記:適切なサンプルが見つからない場合は、サンプル調製手順を繰り返して、パラメーターのいずれかを変更します。通常、変更が必要なパラメータは、メッシュ正方形あたりのセルが多すぎる場合の氷の厚すぎる場合や合流度の場合のブロッティング時間です。
2. 透過X線顕微鏡(TXM)への装填
- 移送チャンバを液体窒素で<100 Kになるまで冷却し、ワークステーションを冷却し(図3A)、ワークステーションリムのヒーターをオンにします。沸騰が止まるまで待ちます。
- グリッドを含む必要なクライオボックスをワークステーション内の対応する場所に置きます(図3A)。クライオ条件下でそれらを安全に転送するように注意してください。
- 選択したグリッドを、以前に冷却したサンプルホルダーにロードします(図3B)。ホルダーをシャトルに積み込み、カバーで保護します(図3C)。
- シャトルを<100 Kで移送チャンバにロードし、低真空にポンプで送り込みます(図3D)。
- 搬送チャンバをTXMに取り付け(図4A)、スクリーン上の真空手順に従って搬送チャンバからTXMにシャトルをロードします(図4B)。
- シャトルがサンプルとともに内部に入ると、TXMロボットアームは一度に1つのサンプルホルダーをサンプルステージに持ち込むことができます(図4C)。
3. TXMソフトウェアを使用したイメージング
注:サンプルステージのグリッドは、X線でイメージングされる前に、まずオンライン可視光顕微鏡(VLM)を使用してグリッドをマッピングし、明視野および/または蛍光モードでグリッドをマッピングします。左上パネルの「モーションコントロール」タブに対応するジョイスティックアイコンを使用して、 モーションコントロール を開きます。
- オンラインVLMによるグリッドのイメージング
- 明視野モザイク取得
- VLMカメラ(拡大レンズ>VLM)を選択し、VLM LEDソースをオンにして明視野イメージングを行います(顕微鏡>取得>取得設定>ソース設定、送信を選択します)。
- VLM対物レンズ(モーションコントロール>サンプル>サンプルθ)に対向するようにサンプルを-60度に回転させ、サンプルを予想される中心位置に移動します(モーションコントロール>サンプル、サンプルX、サンプルYを変更します)。
- グリッドにほぼ焦点を合わせるために、最初に20~50μmのステップで画像を取得しながら(顕微鏡 > 取得 > 取得設定 > 取得モード > 連続 > 開始; モーションコントロール > サンプル と変更 サンプルZ)。
- 細胞および/またはカーボン支持フィルムの穴に焦点が合うまで、5μmまでの小さなステップで焦点を絞り込みます(顕微鏡>取得>取得設定>取得モード>連続>開始;モーションコントロール>サンプルとサンプルZの変更)を行い、明視野モードでグリッドの完全なモザイクマップの取得を開始します。モザイクのデフォルト値を使用します。(顕微鏡>の集録>取得設定>モザイク>開始>取得モード)。
手記: モザイク マップは、単一の画像から作成されます。画像の数 (列の数、行数、および X と Y のステップ サイズ) を設定して、グリッド全体を視覚化する必要があります。ステップサイズは、視野(FoV)のサイズに依存する。ここではデフォルト値が使用されます。グリッドが完全なモザイクFoVに対してX-Y平面の中央に正しくない場合は、集録を停止し、サンプルのX座標とY座標を修正して集録を繰り返します。
- 蛍光モードモザイク取得
- 明視野イメージング用のVLM主導の光源(顕微鏡 > 取得 > 取得設定 > 光源設定 、 および送信の選択解除)をオフにし、所望の励起波長(赤、緑、または青)に対応するLED光源と対応する光学フィルタを手動で選択しますセットアップ。
- 蛍光画像(顕微鏡>取得>取得設定>連続>開始>取得モードに焦点を合わせます。モーションコントロール>サンプルおよび変更サンプルZ)を取得し、明視野モザイクから位置パラメータ(XおよびY)を保持するモザイクマップを取得します(顕微鏡>取得>取得設定>取得モード>モザイク>開始)。
- LED光源をオフにする
- オプション:明視野および蛍光モザイクマップに基づいて、以前に特定された関心領域(ROI)または新しいROI(画像内のX−Y位置)に注釈を付ける。
- 明視野モザイク取得
- X線モザイク取得
- CCD X線検出器(拡大レンズ>ピクシスを選択)を選択し、サンプルを0度回転させ(モーションコントロール>サンプルとサンプルθの変更)、X線 光学系(コンデンサとゾーンプレート)を整列位置に移動します(モーションコントロール>コンデンサ>コンデンサzを変更します。 モーションコントロール>ゾーンプレートとゾーンプレートZ)を変更します。
手記: イメージング前にCCDチップを-65°Cまで冷却します(顕微鏡 > カメラの温度 を ピクシス >し 、設定温度 を-65°Cに変更して [適用]をクリックします)。 - サンプルを選択したROIの1つのメッシュ正方形の中心に移動し(モーションコントロール > サンプル 、 サンプルX、 サンプルYを変更します)。
- ビニング2と出口スリットを5μmで使用してミストラルでの照射と1秒の露出を最小限に抑え、B24でビニング1と60μmを使用し、サンプルZ変換(顕微鏡>取得>取得設定>カメラ設定を使用してフォーカスを調整し、ビニングを変更します。モーションコントロールはXS>し、XSを変更します。顕微鏡>取得>取得設定>取得モード>連続>開始。モーションコントロール>サンプルおよび変更サンプルZ)。5 μmのステップから始めて、セルまたはカーボンホイルの穴にピントが合うまで、0.5 μmのステップまで微調整します。
- メッシュ正方形のモザイクマップを取得します(顕微鏡 > 取得 > 取得設定 > 取得モード > モザイク > 開始)。
手記: モザイク取得パラメータは、VLMモザイクの場合と同じ方法で決定できます(セクション3.1.1.4)。刻み幅は、ビームラインスタッフによって事前に選択された倍率に依存する。 - サンプルをフラットフィールド(FF)位置(グリッド内の空の領域、好ましくはカーボンサポートの穴)に移動します(モーションコントロール > サンプル と サンプルX、 サンプルYを変更します)。
- ミストラルで露光時間を1秒、B24で0.5秒(顕微鏡 > 取得 > 取得設定 > カメラ設定 、 露出時間の変更)に設定し、単一の画像を取得します(顕微鏡 > 取得 > 取得モード > シングル > スタート)。
- 取得したモザイクをFF画像で正規化(分割)して透過(0〜1の値)を取得し、正規化されたモザイクを保存します(画像の右側にある最初の右上隅のアイコンをクリックしてメニューを開きます>[参照]タブを選択>[単一の参照]をクリックして特定のFFを参照します)。
- CCD X線検出器(拡大レンズ>ピクシスを選択)を選択し、サンプルを0度回転させ(モーションコントロール>サンプルとサンプルθの変更)、X線 光学系(コンデンサとゾーンプレート)を整列位置に移動します(モーションコントロール>コンデンサ>コンデンサzを変更します。 モーションコントロール>ゾーンプレートとゾーンプレートZ)を変更します。
- X線チルトシリーズを収集する準備
手記: イメージ化される各関心領域の回転軸を見つけます。- 断層撮影を行うモザイク内の領域の選択、すなわち、X線モザイクマップ内のFoVのサイズを有する正方形の形状(画像ウィンドウの左側にある ツール をクリック)を配置することによって行う。
手記: 領域を選択するときは、回転中にセルが重ならないように、境界線 (≥10 μm) と他のセルからの距離を考慮してください。さらに、細胞の状態(予想される細胞形状、氷厚、ガラス化の成功、基準広がりなど)を確認します。 - 回転軸上の整列の例
手記: 報告された手順は反復的です。反復は±、最大回転角度(θM).アクセスできない場合は、60°±の角度をできるだけ近づけます。- カメラをビニング2、露出時間1秒(顕微鏡 > 取得 > 取得設定 > カメラ設定 、 露出時間の変更、 ビニングの変更; 顕微鏡 > 取得 > 取得モード > 連続 > 開始)、出口スリットを5μmに設定します。
手記: 出口スリットの最小絞りで作業することにより、線量を可能な限り最小限に抑えます。 - 回転を0°にして、サンプルXとサンプルYの平行移動を使用して以前に選択した領域に移動し、サンプルZの平行移動を使用して回転軸に入れるセルの特徴に焦点を合わせます(モーションコントロール > サンプル と サンプルxを変更します。 サンプル y; サンプルz)。
- サンプルを+ θM(モーションコントロール>サンプルとサンプルθの変更)に回転させ、回転軸に置くセルの特徴に線(L +)を描画します(画像ウィンドウの右側にあるラインツールボタンをクリックします)。
- -θM(モーションコントロール>サンプルとサンプルθの変更)に回転させ、回転軸上に置きたいセルの特徴に線(L-)を描きます(画像ウィンドウの右側にある線ツールボタンをクリックします)。
- +θM または -θM では、サンプル Z 平行移動を使用して、選択したフィーチャを両方のライン間の中心位置に移動します(モーションコントロール > サンプル と変更 サンプル Z)。
- ステップ 3.3.2.3 の手順を、L+ から L- までの最小距離に達するまで繰り返し繰り返します。
手記: 2本の線L+とL-の間の距離は、前の反復に対して小さくなければなりません。 - サンプルθ = 0(モーションコントロール>サンプルおよび変更サンプルθ)で、サンプルXを両方の線の中心に選択したフィーチャを配置するのに必要な距離の2倍移動させます(サンプル> モーションコントロールとサンプルXの変更)。ゾーンプレート(ZP)Xを移動して、フィーチャをFoVの中心に戻します(モーションコントロール>ZPとZP Xを変更します)。この手順は、グリッドごとに 1 回だけ実行します。
- ZP Zフォーカルシリーズ(異なるZP Z位置の画像のコレクション、通常は0.3μmのステップで)を記録することによって、新しい回転軸に対するZP Z位置を再最適化し(顕微鏡>取得>取得設定>集録モード>フォーカルシリーズ>開始)、ZP Zをサンプルが焦点を合わせている位置に移動します(モーションコントロール>ゾーンプレートとゾーンプレートzの変更)。
- チルトシリーズ集録のパラメータを設定します。
手記: 最大角度範囲は、最終的にZPの焦点距離によって制限されます(平らなサンプルの場合はそれぞれ40nmまたは25nmのZPの場合は±70度または±65度)。信号対雑音比(S/N)と放射線損傷を最適化して、露光時間を定義します。断層撮影では、角度範囲ごとに異なる露光時間を使用します。 - 最大回転角度に達する前にシャドウイングが発生した場合に備えて、最大回転角度範囲を決定します。
- カメラビニングを1に設定し(顕微鏡 > 取得 > 取得設定 > カメラ設定 と ビニングの変更)、ミストラルで出口スリットを15μmに開き(モーションコントロール > XSとXS の変更)、回転を0°に設定します(モーションコントロール > サンプル と サンプルθの変更)。
- 露光時間1秒の単一画像(顕微鏡 > 取得 > 取得設定 > 取得モード > シングル > スタート)を取得し、断層撮影の各傾斜角に必要な露光時間を推定します。
- カメラをビニング2、露出時間1秒(顕微鏡 > 取得 > 取得設定 > カメラ設定 、 露出時間の変更、 ビニングの変更; 顕微鏡 > 取得 > 取得モード > 連続 > 開始)、出口スリットを5μmに設定します。
- 断層撮影を行うモザイク内の領域の選択、すなわち、X線モザイクマップ内のFoVのサイズを有する正方形の形状(画像ウィンドウの左側にある ツール をクリック)を配置することによって行う。
- 断層撮影の取得
- 負の最大角度+0.1に移動します(たとえば、ZP 25 nmの場合は-65.1°に移動します)(モーションコントロール > サンプル に移動し、 サンプルθを変更します)。
- 画像の数を角度の合計数(角度0の画像を考慮)と角度範囲(顕微鏡 > 取得 > 取得設定 >集 録モード > 断層撮影 で画像数を変更し、角度 開始 と 角度終了を変更)として設定します。
- 定義された露出時間を設定し、取得を開始します(顕微鏡 > 取得 > 取得設定 > カメラ設定 、 露出時間 を変更してから 開始をクリックします)。
- FF位置に移動し(モーションコントロール>サンプルXを変更し、次にサンプルYを変更します)、10枚のFF画像を取得します(顕微鏡>取得>取得モード>平均、画像数を変更してから開始をクリックします)。
手記: ミストラルでは、目的の吸収端を横切ってエネルギーをスキャンしながら投影を取得すると、分光顕微鏡またはエネルギー依存顕微鏡が可能です。最終出力は2D投影のスタックであり、各ピクセルのX線吸収スペクトル(XAS)、すなわち化学情報を含む画像を含む。分光法と断層撮影を組み合わせた3Dへの拡張は、原理的には可能です。必要な総線量は制限である可能性があり、その後、差動吸収イメージングなどの特定の戦略が必要になることがあります。
4. データ解析
注: すべてのデータ分析は、利用可能なオープンソフトウェアと自動パイプラインで開発されたスクリプトで行われます。
- ミストラルにて
- パイプラインは、トモグラフィスタックを、必要なすべてのメタデータを用いてtxrm拡張(TXMソフトウェア拡張)からhdf5(オープンソース階層データ形式)に変換し、次いで、FF平均および機械電流によってスタックを正規化し、最後に、特定のフレネルゾーンプレート(ZP)レンズおよびエネルギー23に対する光学系の測定点像分布関数によってスタックを逆畳し、24。デコンボリューションの場合は、適切なk = 1/SNR値を求めます(サンプルの厚さによって異なります)。ミストラルで開発されたスクリプトの場合は、txrm2deconv "input tomo" "input FF" -zp="ZP used" - e= " energy " - dx= " pixel size " - k= " 1/SNR " - t=-1 というコマンドを入力します。
- ミストラルで開発された自動アライメント用のスクリプトには、ctalignxcorr "正規化されたデコンボルブド stack.mrc" "正規化されたスタック.hdf5" というコマンドを入力します。
メモ:Au NP基準25,26を使用して、投影を共通の回転軸に整列させるために、多くのソフトウェアアプリケーションを使用できます。投影の位置合わせには、サブピクセルの精度が必要です。自動アライメントは、Au NP基準が十分であり(>7)、視野上に十分に広がっている場合にのみ満足できる。手動アライメントは、多くの場合、可能な限り高い精度を達成するために自動アライメントを修正するために事後的に必要とされる。 - 整列された正規化されたスタックを再構築するには、使用可能ないくつかのアルゴリズムのいずれかを使用します。
注: アライメントされたスタックは、加重逆投影法 (WBP) または同時反復再構成手法 (SIRT) を使用して数分で再構築できます。しかしながら、線形吸収係数(LAC)を保存するために、代数的再構成技術(ART)は27が好ましい。ARTはより多くの計算時間を必要とするため、SIRT28 は高速自動アライメントチルトシリーズ再構築(数分で30回の反復)のために最初に行われます。アライメントが満足のいくものになると、ARTが使用されます。
- B24で
- カスタムビルドのパイプラインは、txrm データファイルを必要なすべてのメタデータを含む標準の Tiffs に変換し、WBP、SIRT、パッチの 3 つの方法でデータセットを処理するバッチ runtomo ワークフローに送信します。
結果
クライオ SXT 用のサンプルの準備は困難な場合があります。同じサンプルグリッド内であっても、同じ Au ファインダーグリッドからの 2 つの正方形を示す 図 5 に示すように、理想的な領域と非理想的な領域を持つことができます。理想的なサンプルは、正方形のメッシュの中心に単一の細胞を持ち、薄い氷の層に埋め込まれ、断層撮影再建の前に傾斜突起の位置合わせに使用されるよく分散したAu基準マーカーに囲まれている必要があります。 図5A は、これらの基準の多くに準拠した線維芽細胞様細胞(NIH 3T3)を示す。視野(FoV)を示す赤いボックスでマークされた領域のART27 を使用した3D再構成からの単一のスライスを 図5Bに示す。ミトコンドリア(M)、小胞体(ER)、小胞体(V)、核(N)などの多くの異なる細胞小器官は、LACの定量的再構成のおかげで区別することができる。加えて、再構成の信号対雑音比は非常に高いので、細胞特徴の高いコントラストを達成することを可能にする。一方、 図5C は、より高いセル密度を有する正方形を示す。このため、ブロッティングは通常効率が低く、氷層が厚くなったり、ガラス化の問題が生じたりします。場合によっては、X線イメージングの前に落射蛍光マッピングを使用してグリッドをスクリーニングするときに、これはすでに観察することができ、これらのグリッドはいかなる犠牲を払っても避けるべきである。 図5Cでは、グリッド内の亀裂とガラス化氷がメッシュ正方形全体(赤い矢印でマーク)を通っていることが観察できます。亀裂の近くのイメージングは、ビームにさらされたときのグリッドの不安定性のために避けるべきです。さらに、亀裂は、この地域の場合と同様に、厚い氷の兆候である可能性があります。チルトシリーズは、赤いボックスでマークされた領域に記録されました。 図5Dでは、対応する3D再構成からの単一のスライスが示されている。いくつかの大きな構造は認識できますが、例えば矢印で指し示された上部ミトコンドリアに具体的に見られるように、厚い氷のガラス化品質が悪いため、ノイズやざらざらした質感の中で細かいディテールが失われます。
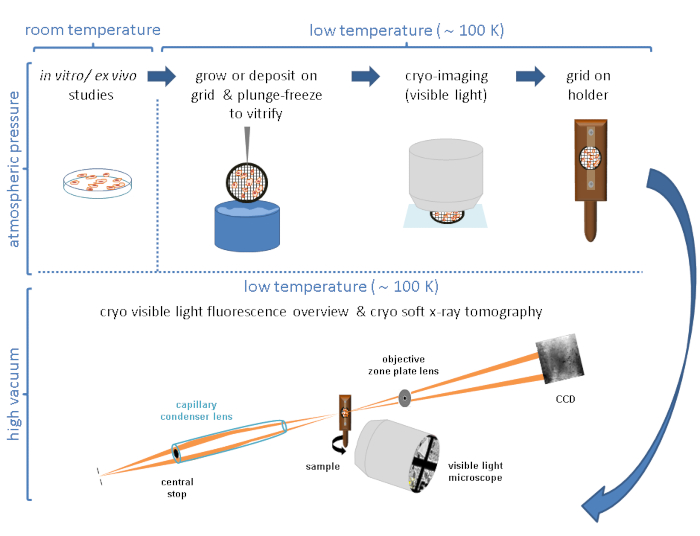
図1:ワークフロー クライオ-SXTデータ収集の前に回路図ワークフローが続きました。 この図の拡大版を表示するには、ここをクリックしてください。
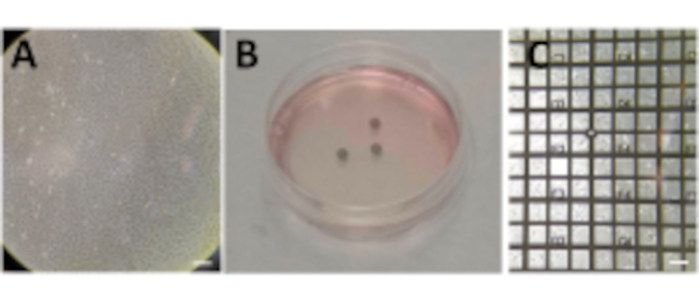
図2:グリッド上の細胞の成長。 (A)約80%〜90%の合流点を有するP100ペトリ皿で成長する細胞。(B)細胞を播種した後にいくつかのグリッドを有するP60ペトリ皿。(C) 24 時間後にグリッドの上に成長するセル。スケール バー: 100 μm。 この図の拡大版を表示するには、ここをクリックしてください。

図3:サンプルホルダーと移送チャンバへのグリッドの積み込み 。(A)シャトルとクライオボックスで液体窒素で満たされたワークステーションは、グリッドをロードする準備ができています。(B)グリッドをロードした状態でローダーに挿入されたサンプルホルダー。(C)カバーなしでサンプルホルダーを位置3にしてシャトル。(D) 移送室が取り付けられたワークステーション。 この図の拡大版を表示するには、ここをクリックしてください。

図4:TXMへのサンプルの装填(A)移送チャンバをTXMに取り付ける。(B) TXM内のシャトル。(c)サンプルホルダーをサンプルステージに挿入するTXMロボットアーム。この図の拡大版を表示するには、ここをクリックしてください。
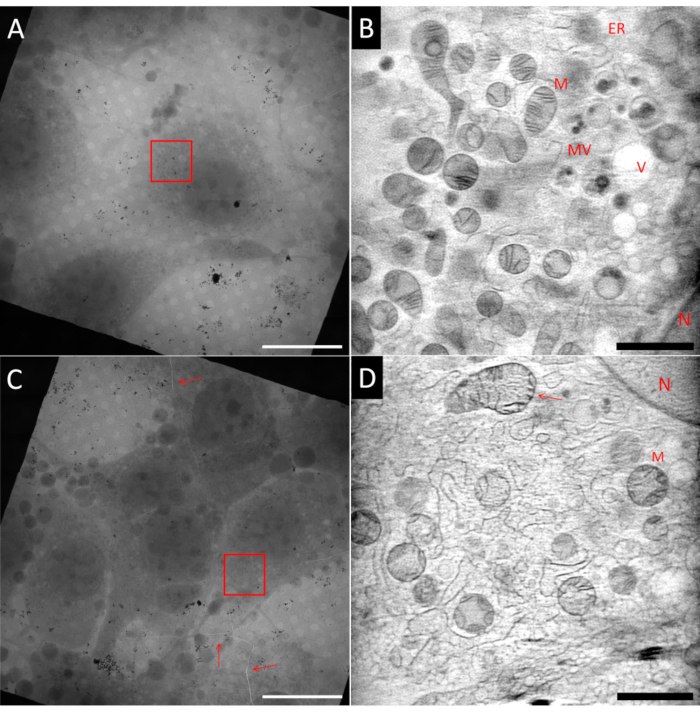
図5:クライオ軟X線断層撮影の例。上段:理想的なサンプル、(A)中央に孤立したセルを示すグリッド正方形の2Dモザイク図。(B)赤いボックス(A)でマークされた領域を示す再構築された3Dボリュームからの1つのスライス。(D)と比較して、画像ははるかに滑らかで、より多くの詳細が表示されます。下段:理想的でないサンプル、(C)高すぎるセルコンフルエンシーおよび氷およびグリッド箔の亀裂を示すグリッド正方形の2Dモザイク図(赤い矢印)。(D) (C) の赤いボックスでマークされた領域を示す再構築された 3D ボリュームからの 1 つのスライス。ガラス化が悪いか、または最適でないガラス化は、画像の粒状の質感によって識別することができる。N:核;M: ミトコンドリア;ER:小胞体;MV:多胞体;V:液胞;スケールバー:A & C 20 μm;B & D 2 μm.Vこの図の拡大版を見るにはここをクリックしてください。
ディスカッション
サンプル調製は、高品質の軟X線断層撮影を得るための重要なステップであり、その品質はサンプルガラス化の品質および細胞が埋め込まれた氷層の厚さに直接依存する。信号対雑音比の高い突起は、薄い氷層を有する領域に収集され、可能な限り高い分解能を達成するために必要な放射線量を最小限に抑えることができる。さらに、セルのコンフルエンシーは、回転時に隣接するセルがFoVに入るのを避ける必要があるため、最終的な断層撮影の品質にも影響します。最後に、Au基準マーカーの正しい分散によって投影アライメントの精度が決定され、最終的に最終的な3D再構成ボリュームの品質が決定されます。グリッド上にAu基準が適切に広がると、投影アライメントステップの自動化が可能になり、そのような重要なステップには高い専門知識が必要ないことに注意してください。
本明細書のプロトコルは、1つの可能な試料調製戦略を描写しているにすぎず、これはクライオ電子断層撮影法(cryo−ET)で使用されるものと類似している。どちらの場合も、より再現性を高めるために要求の厳しいサンプル調製を改善するプロトコルは、これらの技術の成功のための基本であり、この目標に向けて努力が払われている29。単離された細胞を画像化することに加えて、セクションを通る伝達信号が高い傾斜角で十分であれば、組織の切片も視覚化できることに言及する価値がある。通常、これは数ミクロン(10μm未満)のセクションを意味します。
セル内の特定の構造またはイベントをイメージするには、この特定の機能がチルトシリーズのFoV内にあることを確認する必要があります。クライオSXTのFoVは、レンズに応じて10 x 10μm2~15 x 15μm2に制限されており、解像度のピクセルオーバーサンプリングを少なくとも2倍にするため、多くの場合、セル全体の拡張よりも小さくなります(図5に示す赤い四角を参照)。したがって、ROIが見つかり、適切にラベル付けされる必要があります。これは通常、蛍光タグと可視光相関アプローチによって行われます。軟X線透過顕微鏡は統合されたオンライン可視光蛍光顕微鏡を備えているため、落射蛍光を組み合わせた2D戦略は簡単ですが、高解像度の2Dまたは3D蛍光シグナルのための他のアプローチも利用可能です4、12、13、15、16.そのような場合、グリッドは、超解像顕微鏡などの特定の機器で最初に画像化する必要があります。最も効率的な相関アプローチは、極低温条件下でのデータ収集を伴うアプローチであることに注意してください。これは、例えば、室温(RT)、可視光蛍光イメージング、およびサンプルガラス化の間の時間経過が、適切な細胞事象を時間通りに捕捉することを妨げるためである。さらに、ガラス化保存手順は、RTで画像化された目的の細胞をグリッドから切り離す可能性がある。たとえほとんどの相関イメージングアプローチが、サンプルグリッドを操作してある機器から別の機器に輸送しなければならないことを意味するとしても、グリッドの汚染や損傷のリスクが高まっているにもかかわらず、その報酬は明らかです:細胞ランドスケープ内の特定のイベントや分子を特定できること。
全細胞イメージングが必要な場合、適用される総線量が放射線損傷限界を超えない限り、異なる断層画像をステッチングすることが可能である。通常、同じ細胞上に少数の断層画像を収集するための堆積線量は、達成可能な分解能(109Gy )で限界をはるかに下回っているため、これはサンプルおよび実験に依存するが、線量を下げるための特定の戦略は必要ない。分光断層撮影などの集中的なデータ収集の場合、線量を最小限に抑えることが実際に必要であり、便利なデータ収集と特定の処理戦略を適用する必要があります。
Cryo-SXTにはいくつかの制限がありますが、ここで言及する必要があります。最初のものはよく知られている欠落ウエッジで、フラットサンプルサポートの使用に固有のものです。180度の回転を可能にするキャピラリーサンプルサポートは過去に使用されており、現在でも一部の施設で使用されていますが、ガラス吸収によるコントラストの低下や懸濁液中の細胞の使用制限などの欠点もあります。欠落したくさびの影響を軽減する方法は、デュアルチルト断層撮影を行うことです。これは確かに今日のミストラルビームラインで可能です。第2の制限は、顕微鏡などに用いられるフレネルゾーンプレートレンズによって設定される。このレンズは、達成可能な究極の解像度と被写界深度(DoF)を設定し、どちらも密接に関連しています。これは、分解能を上げるとDoFが減少し、セルの厚さが大きくなることが多いことを意味します。たとえば、40 nmレンズは理論的には3 μmのDoFと24.4 nmのハーフピッチの分解能を持ちます。したがって、解像度とDoFとの間の妥協は戦略的であり、レンズの選択は、セル30、31のタイプに依存するであろう。最後に、世界中で運用されているTXMは理想的な顕微鏡とはほど遠く、理論的な期待に達するために光学系を改善するための努力が払われています。最後に、再構成されたボリュームの視覚化およびセグメンテーションは、特定のソフトウェアツール25、32、33、34を用いて行うことができる。
要約すると、cryo-SXTは、中程度の分解能(25〜30nmのハーフピッチ)および統計的な数値(1日あたり数十の断層撮影)で細胞を定量的にイメージングすることを可能にする。これにより、特定の条件、例えば病原体の感染または疾患の間、正確な時点または特定の治療後における細胞小器官の組織、分布、および寸法を得ることができる。したがって、これは、より一般的な電子顕微鏡および可視光顕微鏡に有用な補完的な生物学的イメージング技術であり、それぞれが特定の範囲のサンプル寸法および分解能に取り組む。Cryo-SXTは、可視光蛍光を含む相関アプローチで頻繁に使用されますが、他のクライオ相関戦略も可能です。
開示事項
著者らは利益相反がないと宣言しています。
謝辞
このプロジェクトは、欧州委員会のHorizon 2020 iNEXT-Discoveryプロジェクトと、Marie Skłodowska-Curie助成金契約No 75439に基づく欧州連合のHorizon 2020研究およびイノベーションプログラムから資金提供を受けています。
資料
| Name | Company | Catalog Number | Comments |
| Amira | Thermo Fisher | Software for segmentation | |
| Au Holey Carbon Films finder grids | (Quantifoil Micro Tools Gmb | R 2/2 Au G200F1 | Au Holey Carbon Films finder grids |
| Au nanoparticles | BBI Group, Cardiff, UK | Au nanoparticles 100nm | 100 nm Au nanoparticles (NPs) at Mistral (Alba) |
| Au nanoparticles | BBI Group, Cardiff, UK | Au nanoparticles 250nm | 250 nm Au nanoparticles (NPs) at B24 (Diamond) |
| Axio Scope A1 | Zeiss | 430035 9060 | Fluorescence microscope |
| Blotting No.1 filter paper | Whatman | WHA10010155 | Blotting filter |
| Bsoft | Software for projection alignment, reconstruction and visualization (Heymann et al., 2008) | ||
| Chimera | Software for segmentation (Pettersen et al. 2004) | ||
| Cryo-EM Glow Discharge Set | PELCO easiGlow | 91000S | Glow Discharge Cleaning System |
| Cu Holey Carbon Films finder grids | (Quantifoil Micro Tools Gmb | R 2/2Cu G200F1 | Cu Holey Carbon Films finder grids |
| Fetal calf serum | Sigma | F9665 | Heat Inactivated, sterile-filtered, suitable for cell culture |
| ImageJ | Software for image processing and analysis in Java (NIH & LOCI University of Wisconsin) | ||
| IMOD | Software for projection alignment, reconstruction and visualization (Kremer et al., 1996) | ||
| Leica EM GP Grid Plunger | Leica | 16706401 | Automatic Plunge Freezer EM |
| LINKAM cryo-stage | Linkam Scientific Instruments | CMS 196 | Cryo-Correlative Microscopy Stage |
| MIB | Software for segmentation (Belevich et al. 2016) | ||
| P100 Petri dish | Sigma | P6106 | Treated for cell culture and sterile |
| P60 Petri dish | Sigma | D8054 | Treated for cell culture and sterile |
| Polylysin | Sigma | P4707 | Poly-L-lysine solution 0.01%, sterile-filtered |
| Soft X-Ray microscope 0.25-1.2keV | Xradia | NCT-SB | Transmission soft X-Ray microscope |
| SURVOS | Software for segmentation (Luengo et al. 2017) | ||
| Tomo3d | Software for reconstruction (SIRT, WBP) (Agulleiro et al. 2011) | ||
| TomoJ | Software for reconstruction (ART) (Messaoudi et al., 2007) | ||
| XM Data Explorer | Zeiss | TXM software |
参考文献
- Carrascosa, J. L., et al. Cryo X-ray tomography of vaccinia virus membranes and inner compartments. Journal of Structural Biology. 168, 234-239 (2009).
- Uchida, M., et al. Soft X-ray tomography of phenotypic switching and the cellular response to antifungal peptoids in Candida albicans. PNAS. 106, 19375-19380 (2009).
- Schneider, G., et al. Three-dimensional cellular ultrastructure resolved by X-ray microscopy. Nature Methods. 10, 1-3 (2010).
- Chichón, F. J., et al. Cryo nano-tomography of vaccinia virus infected cells. Journal of Structural Biology. 177, 202-211 (2012).
- Groen, J., Conesa, J. J., Valcárcel, R., Pereiro, E. The cellular landscape by soft X-ray tomography. Biophysical Reviews. 11, 611-619 (2019).
- Kepsutlu, B., et al. Cells undergo major changes in the quantity of cytoplasmic organelles after uptake of gold nanoparticles with biologically relevant surface coatings. ACS Nano. 14, 2248-2264 (2020).
- Natterer, F. . The mathematics of computerized tomography. , (1986).
- Weiss, D., et al. Computed tomography of cryogenic biological specimens based on X-ray microscopic images. Ultramicroscopy. 84, 185-197 (2000).
- Clowney, E. J., et al. Nuclear aggregation of olfactory receptor genes governs their monogenic expression. Cell. 151, 724-737 (2012).
- Duke, E. M. H., et al. Imaging endosomes and autophagosomes in whole mammalian cells using correlative cryo-fluorescence and cryo-soft X-ray microscopy (cryo-CLXM). Ultramicroscopy. 143, 77-87 (2014).
- Cinquin, B., et al. Putting molecules in their place. Journal of Cellular Biochemistry. 115, 209-216 (2014).
- Hagen, C., et al. Multimodal nanoparticles as alignment and correlation markers in fluorescence/soft X-ray cryo-microscopy/tomography of nucleoplasmic reticulum and apoptosis in mammalian cells. Ultramicroscopy. 146, 46-54 (2014).
- Pérez-Berná, A. J., et al. Structural changes in cells images by soft X-ray cryo-tomography during Hepatitis C virus infection. ACS Nano. 10, 6597-6611 (2016).
- Chiappi, M., et al. Cryo-soft X-ray tomography as a quantitative three-dimensional tool to model nanoparticle:cell interaction. Journal of Nanobiotechnology. 14, 15 (2016).
- Varsano, N., et al. Development of correlative cryo-soft X-ray tomography and stochastic reconstruction microscopy. A study of cholesterol crystal early formation in cells. Journal of the American Chemical Society. 138, 14931-14940 (2016).
- Kounatidis, I., et al. Correlative cryo-structured illumination fluorescence microscopy and soft X-ray tomography elucidates reovirus intracellular release pathway. Cell. 182, 1-16 (2020).
- Kapishnikov, S., et al. Mode of action of quinoline antimalarial drugs in red blood cells infected by Plasmodium falciparum revealed in vivo. PNAS. 116 (46), 22946-22952 (2019).
- Conesa, J. J., et al. Unambiguous intracellular localization and quantification of a potent iridium anticancer compound by correlative 3D cryo X-ray imaging. Angewandte Chemie International Edition. 59, 1270-1278 (2020).
- Gal, A., et al. Native-state imaging of calcifying and noncalcifying microalgae reveals similarities in their calcium storage organelles. PNAS. 115 (43), 11000-11005 (2018).
- Procopio, A., et al. Chemical fingerprint of Zn-hydroxyapatite in the early stages of osteogenic differentiation. ACS Central Science. 5, 1449-1460 (2019).
- Kahil, K., et al. Cellular pathways of calcium transport and concentration toward mineral formation in sea urchin larvae. PNAS. 117 (49), 30957-30965 (2020).
- Conesa, J. J., et al. Intracellular nanoparticles mass quantification by near-edge absorption soft X-ray nanotomography. Scientific Reports. 6, 22354 (2016).
- Otón, J., Sorzano, C. O. S., Maribini, R., Pereiro, E., Carazo, J. M. Measurement of the modulation transfer function of an X-ray microscope based on multiple Fourier orders analysis of a Siemens star. Optics Express. 23 (8), 9567-9572 (2015).
- Otón, J., et al. Characterization of transfer function, resolution and depth of field of a soft X-ray microscope applied to tomography enhancement by Wiener deconvolution. Biomedical Optics Express. 7, 5092-5103 (2016).
- Kremer, J. R., Mastronarde, D. N., McIntosh, J. R. Computer visualization of three-dimensional image data using IMOD. Journal of Structural Biology. 116, 71-76 (1996).
- Heymann, J. B., Cardone, G., Winkler, D. C., Steven, A. C. Computational resources for cryo-electron tomography in Bsoft. Journal of Structural Biology. 161, 232-242 (2008).
- Messaoudi, C., et al. Three-dimensional chemical mapping by EFTEM-TomoJ including improvement of SNR by PCA and ART reconstruction of volume by noise supression. Microscopy Microanalysis. 19, 1669-1677 (2013).
- Agulleiro, J. I., Fernández, J. J. Fast tomographic reconstruction on multicore computers. Bioinformatics. 27, 582-583 (2011).
- Toro-Nahuelpan, M., et al. Tailoring cryo-electron microscopy grids by photo-micropatterning for in-cell structural studies. Nature Methods. 17, 50-54 (2020).
- Attwood, D. . Soft X-rays and Extreme Ultraviolet Radiation. Principles and Applications. , (2000).
- Howells, M., Jacobsen, C., Warwick, T. . Principles and Applications of Zone Plate X-ray. Microscopes. Science of Microscopy. , (2007).
- Pettersen, E. F., et al. UCSF Chimera--a visualization system for exploratory research and analysis. Journal of Computational Chemistry. 25, 1605-1612 (2004).
- Belevich, I., Joensuu, M., Kumar, D., Vihinen, H., Jokitalo, E. Microscopy image browser: a platform for segmentation and analysis of multidimensional datasets. PLOS Biology. 14 (1), 1002340 (2016).
- Luengo, I., et al. SuRVoS: Super-region volume segmentation workbench. Journal of Structural Biology. 198, 43-53 (2017).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved