A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
تقييم تفاعلات البروتين في الخلايا الحية مع انبعاث الحنق الحساس
In This Article
Erratum Notice
Summary
يمكن استخدام نقل طاقة الرنين Förster (FRET) بين جزيئين من الفلوروفور لدراسة تفاعلات البروتين في الخلية الحية. هنا ، يتم توفير بروتوكول حول كيفية قياس FRET في الخلايا الحية عن طريق الكشف عن الانبعاث الحساس للمستقبل وإخماد جزيء المتبرع باستخدام مجهر المسح بالليزر متحد البؤر.
Abstract
نقل طاقة الرنين Förster (FRET) هو نقل الطاقة بدون إشعاع من متبرع متحمس إلى جزيء متقبل ويعتمد على مسافة واتجاه الجزيئات بالإضافة إلى مدى التداخل بين انبعاث المانحين وأطياف امتصاص المستقبل. يسمح الحنق بدراسة تفاعل البروتينات في الخلية الحية بمرور الوقت وفي المقصورات تحت الخلوية المختلفة. تم وصف خوارزميات مختلفة قائمة على الشدة لقياس FRET باستخدام الفحص المجهري في الأدبيات. هنا ، يتم توفير بروتوكول وخوارزمية لتحديد كفاءة FRET بناء على قياس كل من الانبعاث الحساس للمتلقي وإخماد جزيء المتبرع. لا يتطلب القياس الكمي للفريت النسبي في الخلية الحية فقط تحديد الحديث المتبادل (الانسكاب الطيفي ، أو النزيف) للبروتينات الفلورية ولكن أيضا كفاءة الكشف عن الإعداد المجهري. ويفصل البروتوكول المقدم هنا كيفية تقييم هذه البارامترات الحاسمة.
Introduction
يسمح التحليل المجهري لنقل طاقة الرنين Förster (FRET) بتقييم التفاعلات بين البروتينات في الخلايا الحية. يوفر معلومات مكانية وزمانية ، بما في ذلك معلومات حول مكان حدوث التفاعل في الخلية وفي أي مقصورة تحت خلوية وما إذا كان هذا التفاعل يتغير بمرور الوقت.
وضع ثيودور فورستر الأساس النظري ل FRET في عام 19481. FRET هو نقل للطاقة بدون إشعاع من متبرع متحمس إلى جزيء متقبل ويعتمد على مسافة الجزيئات والاتجاه النسبي لثنائيات أقطاب انتقالها بالإضافة إلى التداخل بين انبعاث المانحين وأطياف امتصاص المستقبل. يتناسب معدل نقل الطاقة عكسيا مع القوة السادسة لمسافة المتبرع والمستقبل. وبالتالي ، يمكن استخدام FRET لقياس القرب الجزيئي في حدود 1-10 نانومتر.
يتنافس FRET مع عمليات إزالة الإثارة الأخرى لجزيء المتبرع وينتج عنه ما يسمى بتبريد المانحين وانبعاث التحسس للمتقبل. تبريد المانحين هو تقليل عدد الفوتونات المانحة المنبعثة ، في حين أن الانبعاث الحساس هو زيادة في الفوتونات المستقبلة المنبعثة. تستخدم العديد من تحليلات FRET المجهرية قياسات شدة التألق ، بما في ذلك التبييض الضوئي المتقبل 2 ، أو التبييض الضوئي للمانح2 ، أو التبييض الضوئي الحساس بالحنق للمتقبل3.
هنا ، يتم تقديم بروتوكول تجريبي خطوة بخطوة وخوارزمية رياضية لتحديد FRET باستخدام تبريد المانحين والانبعاث المتقبل 4,5 ، وهي طريقة يشار إليها غالبا باسم FRET النسبي. تم نشر العديد من البروتوكولات حول كيفية تقريب الانبعاثات الحساسة ، وقليل منها حدد كفاءة FRET المطلقة6،7،8،9. يتطلب القياس الكمي لكفاءات FRET في الخلية الحية تحديد (i) الحديث المتبادل (الانسكاب الطيفي ، أو النزيف) للبروتينات الفلورية ، وكذلك (ii) كفاءة الكشف عن الإعداد المجهري. في حين يمكن تقييم الحديث المتبادل عن طريق تصوير الخلايا التي تعبر عن واحد فقط من الفلوروفورات ، فإن تقييم كفاءة الكشف النسبية لتألق المتبرع والمستقبل أكثر تعقيدا. يتطلب معرفة نسبة عدد جزيئات المانحين والمستقبلين على الأقل التي تؤدي إلى الإشارات المقاسة. ومع ذلك ، يختلف عدد الفلوروفورات المعبر عنها في الخلايا الحية من خلية إلى أخرى وهو غير معروف. يميز ما يسمى بعامل α قوة الإشارة النسبية من جزيء مانح ومتقبل واحد متحمس. تعد معرفة العامل شرطا أساسيا لقياسات FRET التناسبية الكمية في العينات ذات نسب جزيء المستقبل إلى المتبرع المتغيرة كما تمت مواجهتها أثناء تصوير الخلايا الحية باستخدام البروتينات الفلورية. يسمح استخدام بروتين اندماج 1 إلى 1 من المتبرع والمتلقي كمسبار معايرة بتحديد عامل α ويعمل أيضا كعنصر تحكم إيجابي. يتم التعبير عن هذا المسبار المقترن وراثيا بواسطة الخلايا بكميات إجمالية غير معروفة ولكن بكمية نسبية ثابتة ومعروفة من واحد إلى واحد. يحدد البروتوكول التالي كيفية بناء مسبار 1 إلى 1 وكيفية استخدامه لقياس كفاءة RET. يمكن العثور على جدول بيانات يتضمن جميع الصيغ في الملحق ويمكن استخدامه من قبل القراء لإدخال قياساتهم الخاصة في الأعمدة المعنية كما هو موضح أدناه.
بينما يستخدم البروتوكول زوج مانح / متقبل GFP-Cherry ، يمكن تنفيذ النهج المقدم مع أي زوج FRET آخر. يقدم الملف التكميلي 1 تفاصيل عن أزواج السماوي والأصفر.
Access restricted. Please log in or start a trial to view this content.
Protocol
1. بناء البلازميد
- لتوليد مسبار الانصهار eGFP-mCherry1 ، استخدم متجه تعبير خلية الثدييات N1 (انظر جدول المواد) مع إدخال mCherry110 باستخدام مواقع التقييد AgeI و BsrGI.
- استخدم قليل النيوكليوتيدات التالية لتضخيم eGFP11 بدون كودون توقف كجزء من SalI-BamHI : التمهيدي N-terminal 5'-AAT TAA CAG TCG ACG ATG GTG AGC AAG GGC GAG G G 3' والتمهيدي C-terminal 5'-AAT ATA TGG ATC CCG CTT GTA CAG CTC GTC CAT GC 3'.
- أدخل جزء SalI-BamHI هذا في موقع الاستنساخ المتعدد للناقل N1 لإدخال رابط RNPPV (خمسة أحماض أمينية) بين البروتين الفلوري الأخضر والأحمر.
ملاحظة: ينتج عن هذا الرابط متوسط كفاءة الحنق لزوج المانحين والمستقبلين GFP-Cherry البالغ حوالي 0.25 -0.3 (الشكل 1 أ). تمت مناقشة اختيار الروابطالصلبة 12 والحلزونية13 ذات الأطوال المتفاوتة لتوسيع نطاق كفاءات FRET المقاسة في مكان آخر ولكنها ليست مطلوبة لغرضنا من بروتين الاندماج. للمضي قدما من أجل البساطة ، سوف نسمي البروتينات الفلورية "GFP" و "الكرز".
2. ثقافة الخلية ونقلها
- استخدم أي خط خلوي ، على سبيل المثال ، خلايا NRK ، لتجارب FRET في الوسائط ، على سبيل المثال ، وسائط النسر المعدلة من Dulbecco (DMEM) ، بدون الفينول الأحمر ، لتقليل مضان الخلفية. للسبب نفسه ، ينصح باستخدام التربسين الأحمر الخالي من الفينول.
- بمجرد أن تصبح الخلايا متقاربة بنسبة 80٪ ، افصل الخلايا التي تحتوي على 1 مل من 0.05٪ من التربسين-EDTA ، واحسب عدد الخلايا المعلقة باستخدام غرفة نيوباور وزرع حوالي 10000 خلية لكل بئر من زجاج غطاء ذو 8 غرف جيدا ؛ بدلا من ذلك ، من مزرعة خلية متقاربة نمت في دورق T25 ، استخدم قطرة واحدة من تعليق الخلية من ماصة 2 مل أو 3 قطرات من معلق خلية 5 مل من ثقافة متقاربة نمت في دورق ثقافة الخلايا التائية 12.5.
- تنمو الخلايا في غرف ذات 8 آبار (0.8 سم 2 / بئر) مع غطاء زجاجي # 1.0 للفحص المجهري للخلايا الحية الفلورية في ظروف زراعة الخلايا القياسية (37 درجة مئوية و 5٪ CO2).
- بعد 24 ساعة من الطلاء ، قم بنقل الخلايا باستخدام وسائط نقل مناسبة متاحة تجاريا (انظر جدول المواد) ، مع مزيج GFP والكرز و GFP / Cherry (مزيج 1: 1 ، أي 0.8 ميكروغرام و 0.8 ميكروغرام GFP والحمض النووي لبلازميد الكرز) ، و GFP-Cherry chimera.
- للتحويل ، استخدم 5 ميكرولتر من كاشف النقل في 45 ميكرولتر من DMEM و 1.6 ميكروغرام من الحمض النووي البلازميد. حرك عن طريق تحريك أنبوب الطرد المركزي الدقيق برفق.
- بعد 15 دقيقة من حضانة المزيج في درجة حرارة الغرفة ، أضف 1-2 ميكرولتر من خليط كاشف النقل إلى كل بئر من شريحة الغرفة المكونة من 8 آبار. أعد زجاج الغطاء الحجري إلى الحاضنة.
- دع 20 ساعة بعد النقل تنقضي قبل تصوير الخلايا الحية ، للسماح بالتعبير المناسب للبروتين الفلوري ، والطي والنضج ، وخاصة الفلوروفور الأحمر.
3. تصوير الحنق
- صورة الخلايا المنقولة في غرفة بيئية مرطبة ومدفأة عند 37 درجة مئوية. لتخزين وسائط الخلية عند درجة الحموضة الفسيولوجية ، استخدم غاز CO 2 مضبوطا على تدفق 5٪ ، أو أضف 20 mM HEPES لجعل وسائط الخلية CO2 مستقلة.
- استخدم مجهر المسح بالليزر متحد البؤر. اضبط الإثارة والانبعاث على النحو التالي لتحسين الإشارة وتقليل الحديث المتبادل.
- استخدم خط 488 نانومتر من ليزر أيون الأرجون لإثارة GFP وليزر الحالة الصلبة الذي يتم ضخه من الصمام الثنائي 561 نانومتر (أو ليزر نيون الهيليوم 543 نانومتر ، اعتمادا على خطوط الليزر المتاحة) لإثارة الكرز.
- اضبط ما يلي في برنامج مجهر متحد البؤر تجاري. اضبط مرآة Dichroic على 488/561 بنقرة زر باستخدام القائمة المنسدلة. اجمع التألق باستخدام ضوء ليزر 488 نانومتر للإثارة في القناة 1 من خلال نطاق انبعاث من 505 - 530 نانومتر (أو 505 - 550 نانومتر) وفي القناة 2 مع مرشح تمرير طويل >585 نانومتر واستخدم ضوء الليزر 561 نانومتر للإثارة في القناة 3 مع مرشح تمرير طويل > 585 نانومتر (اكتب الأطوال الموجية). يمكن أيضا استخدام مرشحات تمرير النطاق ، على سبيل المثال ، 590 - 650 نانومتر أو ما شابه ذلك والتي لها ميزة استبعاد تشتت رامان.
- قم بالإثارة باستخدام الليزرين بالتتابع واضبط وضع التصوير على التبديل بعد كل سطر بحيث يتناوب إثارة الصورة 512 × 512 بكسل بعد كل سطر (وليس بعد كل إطار مما يلغي القدرة على اكتشاف FRET بسبب انتشار البروتينات المسماة أثناء تسجيل الصور بإثارة مختلفة ؛ انقر فوق الزر).
- قم بإعداد سلسلة زمنية مصغرة من ثلاث صور عن طريق النقر على الأزرار لاكتشاف ما إذا كان هناك تبييض ضوئي كبير ، ومن المحتمل أن يقلل من طاقة الليزر. التبييض الضوئي أقل من 1٪ هو الأمثل. يمكن أن تؤدي كثافة الليزر العالية أيضا إلى تشبع الامتصاص مما يقلل من كفاءة FRET الظاهرة14. طاقة الليزر ، حتى 10-20 μW المقاسة في العدسة الموضوعية آمنة للاستخدام.
- أولا ، خلايا الصورة التي تعبر عن بنية اندماج GFP-Cherry . اضبط المعلمات التي تحدد كثافة الليزر المدمجة زمنيا لكل بكسل في صورة متحدة البؤر ، أي وقت بقاء البكسل بالميكروثانية ، ونقل المرشح الصوتي البصري القابل للضبط (AOTF) بالنسبة المئوية ، والتكبير.
- خلايا الصورة باستخدام هدف زيت 63x وتعيين Zoom على 3x. يوفر هذا تكبيرا ودقة كافية لخلايا الصورة بالكامل. استهدف حجم بكسل 70-80 نانومتر.
- اضبط وقت بقاء Pixel على 2-4 μs ونقل AOTF لليزر 488 نانومتر و 561 نانومتر بحيث تتمتع الصور بنسبة إشارة إلى ضوضاء جيدة بدون تبييض ولا تظهر وحدات البكسل تشبع شدة التألق. من المفيد ضبط طاقة الليزر 488 و 561 بحيث تكون مستويات الإشارة في القناة 1 والقناة 3 متشابهة.
- اضبط كسب المضاعف الضوئي (وضع المتوسط) على 600-800.
- صورة بهذه الإعدادات 15-20 خلية تعبر عن بروتين اندماج GFP-Cherry . توفر 15-20 خلية إحصائيات جيدة مع الحفاظ على الوقت الإجمالي لجلسة قياس FRET محدودا ببضع ساعات للمساعدة في ضمان استقرار الإعداد المجهري.
- صورة بنفس خلايا الإعدادات التي تعبر عن GFP و Cherry و GFP و Cherry والخلايا غير المنقولة. ابحث عن خلايا التعبير في القناة الخضراء أو القناة الحمراء ، على التوالي.
- ثم ، صورة 15-20 خلية تشارك في التعبير عن البروتينات ذات الأهمية إلى جانب GFP و Cherry ، على التوالي. البحث عن الخلايا المعبرة ، وتجنب التعرض الطويل للخلايا من أجل عدم تبييض البروتينات الفلورية. الكرز لديه استقرار ضوئي أقل من GFP ، وتبييض الكرز ، المتقبل يضر تحليل الحنق.
ملاحظة: يظهر الشكل التكميلي 1 أطياف الامتصاص والانبعاث ل GFP والكرز. بعد القياس لمدة 5-6 ساعات ، ينصح بتكرار تصوير عدد قليل من الخلايا التي تعبر عن وهم GFP-Cherry في نهاية جلسة التصوير لتوثيق أن الإعداد ظل مستقرا ولم تتغير كفاءات FRET المكتشفة لبروتين اندماج GFP-Cherry بشكل كبير أثناء جلسة التصوير.
4. تحليل الصور للكشف عن كفاءات FRET المطلقة باستخدام تبريد المانحين والانبعاثات الحساسة
ملاحظة: هنا ، يتم توفير دليل عملي خطوة بخطوة حول كيفية تحديد كفاءة FRET باستخدام جدول البيانات المرفق (الملف التكميلي 2). يمكن العثور على نظرية واشتقاق المعادلات المقدمة بالتفصيل في المنشورات السابقة4،15،16،17. مع الإعدادات الموصوفة ، يتم جمع شدة التألق التالية.
- قم بقياس إشارة المتبرع I 1 في القناة 1 ، القناة المانحة ، بإثارة 488 نانومتر ونطاق انبعاث 505-530 نانومتر.
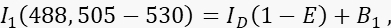
حيث ID هي إشارة المتبرع غير المروية في القناة 1 والتي سيتم قياسها في حالة عدم وجود متقبل ، هي متوسط كفاءة FRET ، و B 1 متوسط إشارة الخلفية في القناة 1. - قم بقياس إشارة المستقبل I 3 في القناة 3 ، قناة المستقبل ، مع إثارة وانبعاث 561 نانومتر عند >585 نانومتر.
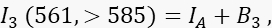
حيث IA هي إشارة المستقبل و B 3 الخلفية في القناة 3. - قم بقياس إشارة FRET في القناة 2 ، قناة النقل ، مع إثارة وانبعاث 488 نانومتر عند >585 نانومتر.
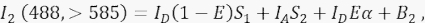
حيث ، الإشارة في القناة 2 هي مجموع أربعة مكونات مختلفة: (i) I D (1 - E) S 1 هو الامتداد الطيفي من إشارة المتبرع المروية إلى قناة الكشف >585 (مع عامل الحديث المتقاطع S 1) ، (ii) IA S 2 هي إشارة المستقبل من الإثارة المباشرة بواسطة ضوء 488 نانومتر (مع عامل الحديث المتقاطع S2) ، (iii) IDEα هو الانبعاث الحساس للمتقبل بواسطة FRET من جزيء المتبرع المثار (سيتم تفصيل α بمزيد من التفصيل في 4.8. - 4.10.) ، و (iv) B2 هي إشارة الخلفية. - قياس متوسط كثافة الخلفية في القنوات 1 و 2 و 3 في الخلايا غير المنقولة أو المنقولة وهمية ؛ إما على ما يرام مع اختلاف ضئيل. بالنسبة لجميع قياسات الخلايا ، استخدم الأداة اليدوية لتحديد مناطق الاهتمام وتجنب الحويصلات المحيطة بالنواة مع زيادة التألق الذاتي. من المهم تجنب التألق الذاتي الكبير من هذه الحويصلات المحيطة بالنواة.
- أدخل القياسات في الأعمدة X وY وZ من جدول البيانات المقدم. يتم إدخال متوسط كثافة الخلفية في القنوات الثلاث في A2 و B2 و C2 من جدول بيانات Excel (الملف التكميلي 2).
- قم بقياس متوسط الشدة في القنوات 1 و 2 و 3 من الخلايا التي تعبر عن GFP أو Cherry وحدها ، وأدخل القياسات في الأعمدة C و D و E و N و O و P. يتم طرح شدة الخلفية ذات الصلة (في F و G و H و Q و R و S).
- من أجل حساب E ، كفاءة FRET ، حدد عوامل الحديث المتقاطع S 1 و S2. يتم حساب عامل الحديث المتقاطع الطيفي S1 من الخلايا التي تعبر عن GFP فقط
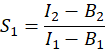
في العمود I. أدخل القيمة المتوسطة ل S1 في الخلية D2 في جدول بيانات Excel. - احسب عامل الحديث المتقاطع الطيفي S2 من الخلايا التي تعبر عن الكرز فقط
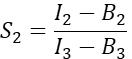
في العمود T. أدخل متوسط S2 في الخلية E2 في جدول بيانات Excel. - تأكد من أن العامل α يربط الإشارة من أي عدد معين من جزيئات GFP المثارة في القناة 1 بإشارة عدد متساو من جزيئات الكرز المثارة في القناة 2 ، ويتم تعريفه بواسطة
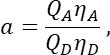

حيث Q A و QD هي الغلة الكمومية الفلورية للكرز و GFP ؛ ηA و ηD كفاءة الكشف عن مضان المستقبل والمانحين في القناتين 2 و 1 ، على التوالي.
ملاحظة: يمكن تحديد عامل α من عينتين تعبران عن كميات مطلقة معروفة من GFP والكرز. ومع ذلك ، من المستحيل معرفة المقدار الدقيق ل GFP و Cherry المعبر عنه في الخلية. لذلك ، قمنا بحساب العامل باستخدام الخلايا التي تعبر عن بروتين اندماج GFP-Chere. هنا ، في حين أن الكمية المطلقة لا تزال غير معروفة ، فمن المعروف أن نسبة جزيئات المتبرع والمستقبل واحدة. - قم بقياس متوسط الشدة في القنوات 1 و 2 و 3 للخلايا التي تعبر عن بروتين اندماج GFP-Cherry ، وأدخل القياسات في الأعمدة AE و AF و AG. يتم طرح كثافة الخلفية (في AH ، الذكاء الاصطناعي ، AJ).
- احسب عامل α (عمود AJ) من شدة التألق في القناة 1 و 2 و 3 من بروتين اندماج GFP-Cherry على النحو التالي:
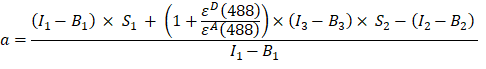
- يتم قياس الشدة المصححة في الخلفية المقاسة في القناة 1 (I 1 - B 1) و 2 (I 2 - B 2) و 3 (I 3 - B3) ، على التوالي ، باستخدام وهم GFP-Cherry . تم تحديد عامل الحديث المتقاطع الطيفي S1 باستخدام الخلايا التي تعبر عن GFP فقط (انظر 4.7.). εD و ε A هما معاملتا الانقراض ل GFP ، المتبرع ، والكرز ، المستقبل ، عند 488 نانومتر ، ويمكن تحديدهما من الأدبيات (ε GFP = 53000 M-1 cm-1)18 ومنحنى امتصاص الكرز (εالكرز ≈ 5560 M-1cm 1). تم إدخال النسبة
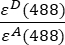 في الخلية G2 من جدول بيانات Excel. أدخل القيمة المتوسطة للعامل α في J2.
في الخلية G2 من جدول بيانات Excel. أدخل القيمة المتوسطة للعامل α في J2. - استخدم عامل α المحدد لحساب كفاءة FRET ، E ، على النحو التالي (العمود AK):
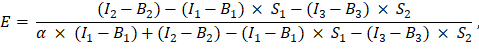
- بدلا من ذلك ، حدد كفاءة FRET ، E ، للضوابط السلبية ، أي التعبير المشترك ل GFP و Cherry والتعبير عن GFP وحده عن طريق إضافة قياسات القنوات 1 و 2 و 3 في ورقة Excel في العمود AD و AE و AF تحت قياسات بروتين اندماج GFP-Cherry . حدد كفاءات FRET بين GFP والبروتينات التي تحمل علامة الكرز ذات الأهمية بنفس الطريقة.
- تحديد شدة المتبرع غير المروي ، I D ك (I 1 - B 1) / (1 - E) ، وشدة المستقبل ك I A = I 3 - B3 ؛ تتناسب هذه القيم مع مستويات التعبير للبروتينات الموسومة.
- تحديد نسبة كثافة المتقبل إلى المتبرع المصححة (Q) لبروتين اندماج GFP-Cherry على النحو التالي (العمود AL):

- بالنسبة للخلايا الأخرى المنقولة بشكل مشترك ، احسب النسبة الجزيئية المتقبلة إلى المانحة N A / ND على النحو التالي:
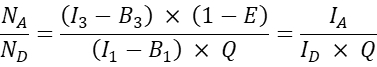
ملاحظة: الأساس المنطقي لتحديد نسبة N A / N D ورسم متوسط كفاءة FRET الخلوية E مقابل N A / N D ، هو أن جزيء مانح واحد يمكنه نقل الطاقة إلى متقبلات متعددة بينما يمكن لجزيء المستقبل تلقي الطاقة فقط من متبرع واحد في وقت معين. حتى لو كان بإمكان متقبل واحد فقط التفاعل مع متبرع بسبب القياس الكيميائي للتفاعل ، فمن المتوقع أن تؤدي زيادة تركيز المتقبل إلى زيادة جزء المتبرعين في المجمع مع المستقبل بسبب قانون العمل الجماعي. وبالتالي ، بالنسبة لتعبير ثابت (أو ضيق من) المانحين ، يجب أن ترتفع كفاءة FRET مع زيادة NA /N D. عند رسم كفاءة FRET E مقابل N A / N D للتعبير المشترك عن GFP و Cherry ، أي المسبار السلبي ، ومع ذلك ، لا ينبغي أن تؤدي الزيادة في N A / N D إلى زيادة في كفاءة FRET (على الأقل عند تركيزات متقبلة منخفضة بما فيه الكفاية حيث لا يحدث FRET عشوائي بسبب قرب الأصباغ المستقبلة للأصباغ المانحة).
Access restricted. Please log in or start a trial to view this content.
النتائج
يوضح الشكل 1 الصور التي تم الحصول عليها في القناة المانحة ، القناة 1 (488 ، 505-530 نانومتر) ، قناة النقل ، القناة 2 (488 ، >585 نانومتر) ، وقناة المستقبل ، القناة 3 (561 ، >585 نانومتر) ، على التوالي. صور تمثيلية للخلايا التي تعبر عن GFP فقط ، الكرز فقط ، والتعبير المشترك عن GFP...
Access restricted. Please log in or start a trial to view this content.
Discussion
يفصل البروتوكول المقدم استخدام مسبار معايرة البروتين الفلوري المقترن وراثيا من واحد إلى واحد لقياس FRET باستخدام الكشف عن الانبعاث الحساس لمستقبل وتبريد جزيء المتبرع بواسطة المجهر متحد البؤر. يمكن تطبيق هذه الطريقة لتقييم تفاعلات البروتين في السياق الفسيولوجي للخلية الحية في مقصورات تحت...
Access restricted. Please log in or start a trial to view this content.
Disclosures
ليس لدى المؤلفين ما يكشفون عنه.
Acknowledgements
نود أن نشكر خدمة تصوير علم الأعصاب في كلية الطب بجامعة ستانفورد على توفير المعدات والمساحة لهذا المشروع. تم دعم هذا البحث من خلال التمويل الداخلي لمعهد ستانفورد للسرطان وقسم الأورام النسائية في ستانفورد بالإضافة إلى GINOP-2.3.2-15-2016-00026 و GINOP-2.3.3-15-2016-00030 و NN129371 و ANN135107 من المكتب الوطني للبحث والتطوير والابتكار ، المجر.
Access restricted. Please log in or start a trial to view this content.
Materials
| Name | Company | Catalog Number | Comments |
| 0.5% Trypsin-EDTA without phenol red (10x) | Thermo Fisher Scientific | 15400054 | |
| Clontech mCherry N1 vector | Addgene | 3553 | |
| DMEM without phenol red | Thermo Fisher Scientific | 11054020 | |
| Fugene 6 | Promega | E2691 | |
| HEPES | Thermo Fisher Scientific | 15630080 | |
| LabTek 8-well chambers #1.0 | Thermo Fisher Scientific | 12565470 | |
| L-Glutamine (200 mM) | Thermo Fisher Scientific | 25030081 |
References
- Förster, T. Zwischenmolekulare Energiewanderung und Fluoreszenz. Annal der Physik. 437, 55-75 (1948).
- Jovin, T. M., Arndt-Jovin, D. J. Luminescence digital imaging microscopy. Annual Review of Biophysics and Biophysical Chemistry. 18, 271-308 (1989).
- Mekler, V. M. A photochemical technique to enhance sensitivity of detection of fluorescence resonance energy transfer. Photochemistry and Photobiology. 59, 615-620 (1994).
- Vamosi, G., et al. Conformation of the c-Fos/c-Jun complex in vivo: A combined FRET, FCCS, and MD-modeling study. Biophysical Journal. 94 (7), 2859-2868 (2008).
- Renz, M., Daniels, B. R., Vamosi, G., Arias, I. M., Lippincott-Schwartz, J. Plasticity of the asialoglycoprotein receptor deciphered by ensemble FRET imaging and single-molecule counting PALM imaging. Proceedings of the National Academy of Science U. S. A. 109 (44), 2989-2997 (2012).
- van Rheenen, J., Langeslag, M., Jalink, K. Correcting confocal acquisition to optimize imaging of fluorescence resonance energy transfer by sensitized emission. Biophysical Journal. 86 (4), 2517-2529 (2004).
- Muller, S. M., Galliardt, H., Schneider, J., Barisas, B. G., Seidel, T. Quantification of Forster resonance energy transfer by monitoring sensitized emission in living plant cells. Frontiers in Plant Sciences. 4, 413(2013).
- Gates, E. M., LaCroix, A. S., Rothenberg, K. E., Hoffman, B. D. Improving quality, reproducibility, and usability of FRET-based tension sensors. Cytometry Part A. 95 (2), 201-213 (2019).
- Menaesse, A., et al. Simplified instrument calibration for wide-field fluorescence resonance energy transfer (FRET) measured by the sensitized emission method. Cytometry Part A. , 24194(2020).
- Shaner, N. C., et al. Improved monomeric red, orange and yellow fluorescent proteins derived from Discosoma sp. red fluorescent protein. Nature Biotechnology. 22 (12), 1567-1572 (2004).
- Cormack, B. P., Valdivia, R. H., Falkow, S. FACS-optimized mutants of the green fluorescent protein (GFP). Gene. 173, 1 Spec No 33-38 (1996).
- Nagy, P., et al. Novel calibration method for flow cytometric fluorescence resonance energy transfer measurements between visible fluorescent proteins. Cytometry Part A. 67 (2), 86-96 (2005).
- Arai, R., Ueda, H., Kitayama, A., Kamiya, N., Nagamune, T. Design of the linkers which effectively separate domains of a bifunctional fusion protein. Protein Engineering. 14 (8), 529-532 (2001).
- Szendi-Szatmari, T., Szabo, A., Szollosi, J., Nagy, P. Reducing the detrimental effects of saturation phenomena in FRET microscopy. Analytical Chemistry. 91 (9), 6378-6382 (2019).
- Tron, L., et al. Flow cytometric measurement of fluorescence resonance energy transfer on cell surfaces. Quantitative evaluation of the transfer efficiency on a cell-by-cell basis. Biophysical Journal. 45 (5), 939-946 (1984).
- Sebestyen, Z., et al. Long wavelength fluorophores and cell-by-cell correction for autofluorescence significantly improves the accuracy of flow cytometric energy transfer measurements on a dual-laser benchtop flow cytometer. Cytometry. 48 (3), 124-135 (2002).
- Szaloki, N., et al. High throughput FRET analysis of protein-protein interactions by slide-based imaging laser scanning cytometry. Cytometry Part A. 83 (9), 818-829 (2013).
- McRae, S. R., Brown, C. L., Bushell, G. R. Rapid purification of EGFP, EYFP, and ECFP with high yield and purity. Protein Expression and Purification. 41 (1), 121-127 (2005).
- Kremers, G. J., Goedhart, J., van Munster, E. B., Gadella, T. W. Cyan and yellow super fluorescent proteins with improved brightness, protein folding, and FRET Forster radius. Biochemistry. 45 (21), 6570-6580 (2006).
- Bajar, B. T., Wang, E. S., Zhang, S., Lin, M. Z., Chu, J. A Guide to Fluorescent Protein FRET Pairs. Sensors (Basel). 16 (9), (2016).
- Scott, B. L., Hoppe, A. D. Optimizing fluorescent protein trios for 3-Way FRET imaging of protein interactions in living cells. Science Reports. 5, 10270(2015).
- Chen, Y. C., Spring, B. Q., Clegg, R. M. Fluorescence lifetime imaging comes of age how to do it and how to interpret it. Methods Molecular Biology. 875, 1-22 (2012).
- King, C., Sarabipour, S., Byrne, P., Leahy, D. J., Hristova, K. The FRET signatures of noninteracting proteins in membranes: Simulations and experiments. Biophysical Journal. 106 (6), 1309-1317 (2014).
Access restricted. Please log in or start a trial to view this content.
Erratum
Formal Correction: Erratum: Assessing Protein Interactions in Live-Cells with FRET-Sensitized Emission
Posted by JoVE Editors on 3/14/2023. Citeable Link.
An erratum was issued for: Assessing Protein Interactions in Live-Cells with FRET-Sensitized Emission. The Authors section was updated from:
György Vámosi1
Sarah Miller2
Molika Sinha2
Gabor Mocsár1
Malte Renz2
1Department of Biophysics and Cell Biology, Faculty of Medicine, University of Debrecen
2Gynecologic Oncology Division, Stanford University School of Medicine
to:
György Vámosi1
Sarah Miller2
Molika Sinha2
Maria Kristha Fernandez2
Gabor Mocsár1
Malte Renz2
1Department of Biophysics and Cell Biology, Faculty of Medicine, University of Debrecen
2Gynecologic Oncology Division, Stanford University School of Medicine
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved