È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Valutazione delle interazioni proteiche nelle cellule vive con emissione sensibilizzata alla FRET
In questo articolo
Riepilogo
Il trasferimento di energia di risonanza di Förster (FRET) tra due molecole di fluorofori può essere utilizzato per studiare le interazioni proteiche nella cellula vivente. Qui, viene fornito un protocollo su come misurare la FRET nelle cellule vive rilevando l'emissione sensibilizzata dell'accettore e la tempra della molecola donatrice utilizzando la microscopia a scansione laser confocale.
Abstract
Il trasferimento di energia di risonanza di Förster (FRET) è il trasferimento di energia senza radiazioni da un donatore eccitato a una molecola accettore e dipende dalla distanza e dall'orientamento delle molecole, nonché dall'entità della sovrapposizione tra gli spettri di emissione del donatore e di assorbimento dell'accettore. FRET permette di studiare l'interazione delle proteine nella cellula vivente nel tempo e in diversi compartimenti subcellulari. In letteratura sono stati descritti diversi algoritmi basati sull'intensità per misurare la FRET utilizzando la microscopia. Qui vengono forniti un protocollo e un algoritmo per quantificare l'efficienza FRET sulla base della misurazione sia dell'emissione sensibilizzata dell'accettore che della tempra della molecola donatrice. La quantificazione della FRET raziometrica nella cellula vivente richiede non solo la determinazione della diafonia (spill-over spettrale, o bleed-through) delle proteine fluorescenti, ma anche l'efficienza di rilevazione della configurazione microscopica. Il protocollo fornito qui descrive come valutare questi parametri critici.
Introduzione
L'analisi basata sulla microscopia del trasferimento di energia di risonanza di Förster (FRET) consente di valutare le interazioni tra proteine in cellule vive. Fornisce informazioni spaziali e temporali, comprese informazioni su dove nella cellula e in quale compartimento subcellulare avviene l'interazione e se questa interazione cambia nel tempo.
Theodor Förster pose le basi teoriche della FRET nel 19481. La FRET è un trasferimento di energia senza radiazioni da un donatore eccitato a una molecola accettore e dipende dalla distanza delle molecole e dall'orientamento relativo dei loro dipoli di transizione, nonché dalla sovrapposizione tra gli spettri di emissione del donatore e di assorbimento dell'accettore. La velocità di trasferimento di energia è inversamente proporzionale alla sesta potenza della distanza donatore-accettore. Pertanto, FRET può essere utilizzato per misurare la prossimità molecolare nell'intervallo 1-10 nm.
La FRET compete con altri processi di deeccitazione della molecola donatrice e provoca il cosiddetto donor-quenching e l'emissione sensibilizzata dell'accettore. L'estinzione del donatore è una riduzione del numero di fotoni donatori emessi, mentre l'emissione sensibilizzata è un aumento dei fotoni accettori emessi. Molte analisi microscopiche FRET utilizzano misure di intensità di fluorescenza, tra cui il fotosbiancamento dell'accettore 2, il fotosbiancamento del donatore2 o il fotosbiancamento dell'accettore3 sensibilizzato al FRET.
Qui, un protocollo sperimentale passo-passo e un algoritmo matematico sono presentati per quantificare FRET utilizzando la tempra del donatore e l'emissione sensibilizzata all'accettore4,5, un metodo spesso indicato come FRET raziometrico. Sono stati pubblicati molti protocolli su come approssimare l'emissione sensibilizzata, pochi hanno quantificato l'efficienza assoluta FRET 6,7,8,9. La quantificazione delle efficienze FRET nella cellula vivente richiede la determinazione (i) della diafonia (spill-over spettrale o sanguinamento) delle proteine fluorescenti e, inoltre, (ii) dell'efficienza di rilevazione della configurazione microscopica. Mentre la diafonia può essere valutata mediante imaging delle cellule che esprimono solo uno dei fluorofori, la valutazione dell'efficienza di rilevazione relativa della fluorescenza del donatore e dell'accettore è più complicata. Richiede la conoscenza almeno del rapporto tra il numero di molecole donatrici e accettori che danno origine ai segnali misurati. Il numero di fluorofori espressi nelle cellule vive varia, tuttavia, da cellula a cellula ed è sconosciuto. Il cosiddetto fattore α caratterizza le potenze del segnale relative da una singola molecola eccitata del donatore e dell'accettore. La conoscenza del fattore è un prerequisito per le misure quantitative raziometriche FRET in campioni con rapporti molecola accettore-donatore variabili come riscontrato durante l'imaging di cellule vive con proteine fluorescenti. L'utilizzo di una proteina di fusione donatore-accettore 1 a 1 come sonda di calibrazione consente la determinazione del fattore α e serve anche come controllo positivo. Questa sonda geneticamente accoppiata è espressa dalle cellule in quantità totali sconosciute ma in una quantità relativa fissa e nota di uno-a-uno. Il seguente protocollo spiega come costruire la sonda 1-to-1 e come utilizzarla per quantificare l'efficienza del FRET. Un foglio di calcolo che include tutte le formule può essere trovato nel supplemento e può essere utilizzato dai lettori per inserire le proprie misure nelle rispettive colonne come descritto di seguito.
Mentre il protocollo utilizza la coppia donatore/accettore GFP-Cherry, l'approccio presentato può essere eseguito con qualsiasi altra coppia FRET. Il file supplementare 1 fornisce dettagli sulle coppie ciano-giallo.
Protocollo
1. Costruzione plasmidica
- Per generare la sonda di fusione eGFP-mCherry1, utilizzare un vettore di espressione cellulare di mammifero N1 (vedi Tabella dei materiali) con mCherry110 inserito utilizzando i siti di restrizione AgeI e BsrGI.
- Utilizzare i seguenti oligonucleotidi per amplificare eGFP11 senza codone di stop come frammento di SalI-BamHI : N-terminale primer 5'-AAT TAA CAG TCG ACG ATG GTG AGC AAG GGC GAG G 3' e C-terminale primer 5'-AAT ATA TGG ATC CCG CTT GTA CAG CTC GTC CAT GC 3'.
- Inserire questo frammento SalI-BamHI nel sito di clonazione multipla del vettore N1 per introdurre il linker RNPPV (cinque aminoacidi) linker tra la proteina fluorescente verde e rossa.
NOTA: Questo linker produce un'efficienza media FRET per la coppia donatore-accettore GFP-Cherry di circa 0,25 -0,3 (Figura 1A). La scelta di linker rigidi12 ed elicoidali13 di lunghezza variabile per scalare le efficienze FRET misurate è stata discussa altrove, ma non è richiesta per il nostro scopo della proteina di fusione. Andando avanti per semplicità chiameremo le proteine fluorescenti 'GFP' e 'Cherry'.
2. Coltura cellulare e trasfezione
- Utilizzare qualsiasi linea cellulare, ad esempio cellule NRK, per esperimenti FRET in media, ad esempio, il mezzo di Eagle modificato di Dulbecco (DMEM), senza rosso fenolo, per ridurre la fluorescenza di fondo. Per lo stesso motivo, si consiglia l'uso di tripsina libera rosso fenolo.
- Una volta che le cellule sono confluenti all'80%, staccare le cellule con 1 ml di tripsina-EDTA allo 0,05%, contare il numero di cellule in sospensione usando una camera Neubauer e seminare circa 10.000 cellule per pozzetto di un vetro di copertura a 8 pozzetti; in alternativa, da una coltura cellulare confluente coltivata in matraccio T25, utilizzare 1 goccia di sospensione cellulare da una pipetta da 2 mL o 3 gocce da una sospensione cellulare da 5 mL da una coltura confluente coltivata in un matraccio di coltura T da 12,5 cellule.
- Coltivare cellule in camere a 8 pozzetti (0,8 cm 2 / pozzetto) con vetro di copertura #1.0 per microscopia a cellule vive a fluorescenza in condizioni di coltura cellulare standard (37 ° C e 5% CO2).
- 24 ore dopo la placcatura trasfettare le cellule utilizzando un mezzo di trasfezione appropriato disponibile in commercio (vedi Tabella dei materiali), con GFP, Cherry, GFP/ Cherry mix (miscela 1:1, cioè 0,8 μg e 0,8 μg GFP e DNA plasmidico Cherry) e la chimera GFP-Cherry.
- Per la trasfezione, utilizzare 5 μL del reagente di trasfezione in 45 μL di DMEM e 1,6 μg di DNA plasmide. Mescolare facendo scorrere delicatamente il tubo della microcentrifuga.
- Dopo 15 minuti di incubazione della miscela a temperatura ambiente, aggiungere 1-2 μL della miscela di reagenti di trasfezione a ciascun pozzetto del vetrino della camera a 8 pozzetti. Restituire il vetro di copertura camerato all'incubatore.
- Lasciare trascorrere 20 ore dopo la trasfezione prima dell'imaging delle cellule vive, per consentire una corretta espressione, ripiegamento e maturazione delle proteine fluorescenti, in particolare del fluoroforo rosso.
3. Imaging FRET
- Immagine di celle trasfettate in una camera ambientale umidificata e riscaldata a 37 °C. Per tamponare i mezzi cellulari a pH fisiologico, utilizzare gas CO 2 impostato sul flusso del 5% o aggiungere 20 mM HEPES per rendere il supporto cellulare CO2-indipendente.
- Utilizzare un microscopio a scansione laser confocale. Impostare l'eccitazione e l'emissione come segue per ottimizzare il segnale e ridurre al minimo la diafonia.
- Utilizzare la linea a 488 nm del laser agli ioni di argon per eccitare la GFP e il laser a stato solido pompato a diodi da 561 nm (o laser Helium Neon da 543 nm, a seconda delle linee laser disponibili) per eccitare Cherry.
- Impostare quanto segue nel software di un microscopio confocale commerciale. Impostate lo specchio Dicroico su 488/561 facendo clic utilizzando il menu a discesa. Raccogliere la fluorescenza utilizzando la luce laser a 488 nm per l'eccitazione nel canale 1 attraverso una banda di emissione di 505 - 530 nm (o 505 - 550 nm) e nel canale 2 con un filtro passa-lungo >585 nm e utilizzare la luce laser a 561 nm per l'eccitazione nel canale 3 con un filtro passa-lungo > 585 nm (tipo in lunghezze d'onda). Possono essere utilizzati anche filtri passa-banda, ad esempio 590 - 650 nm o simili, che hanno il vantaggio di escludere lo scattering Raman.
- Eccitare con i due laser in sequenza e impostare la modalità di imaging su Switch dopo ogni riga in modo che l'eccitazione dell'immagine 512 x 512 pixel si alterni dopo ogni linea (e non dopo ogni fotogramma che abbrogherebbe la capacità di rilevare FRET a causa della diffusione delle proteine marcate durante la registrazione delle immagini con eccitazioni diverse; clic del pulsante).
- Imposta una mini-serie temporale di tre immagini con clic dei pulsanti per rilevare se si verifica un significativo photobleaching e potenzialmente ridurre la potenza del laser. Il fotosbiancamento inferiore all'1% è ottimale. Un'elevata intensità laser può anche portare alla saturazione dell'assorbimento riducendo l'apparente efficienza FRET14. La potenza del laser, fino a 10-20 μW misurata sulla lente dell'obiettivo, è sicura da usare.
- In primo luogo, le cellule dell'immagine che esprimono il costrutto di fusione GFP-Cherry. Impostare i parametri che definiscono l'intensità laser integrata nel tempo per pixel in un'immagine confocale, ovvero il tempo di permanenza del pixel in microsecondi, la trasmissione del filtro acusto-ottico sintonizzabile (AOTF) in percentuale e lo zoom.
- Celle immagine con un obiettivo olio 63x e Zoom impostato su 3x. Ciò fornisce un ingrandimento e una risoluzione sufficienti alle celle dell'immagine nella sua interezza. Punta a una dimensione dei pixel di 70-80 nm.
- Impostare il tempo di permanenza dei pixel a 2-4 μs e la trasmissione AOTF per il laser a 488 nm e 561 nm in modo tale che le immagini abbiano un buon rapporto segnale-rumore senza sbiancamento e nessun pixel che mostri la saturazione dell'intensità della fluorescenza. È vantaggioso regolare la potenza del laser di 488 e 561 in modo tale che i livelli di segnale nel canale 1 e nel canale 3 siano simili.
- Impostare il guadagno del fotomoltiplicatore (modalità media) su 600-800.
- Immagine con queste impostazioni 15-20 cellule che esprimono la proteina di fusione GFP-Cherry. 15-20 celle forniscono buone statistiche mantenendo il tempo totale di una sessione di misurazione FRET limitato a poche ore per garantire la stabilità del set-up microscopico.
- Immagine con le stesse celle di impostazioni che esprimono GFP, Cherry, GFP e Cherry e celle non trasfettate. Cerca le celle che esprimono rispettivamente nel canale verde o nel canale rosso.
- Quindi, immagina 15-20 cellule che co-esprimono proteine di interesse accoppiate rispettivamente a GFP e Cherry. Alla ricerca di cellule espresse, evitare una lunga esposizione delle cellule per non sbiancare le proteine fluorescenti. Cherry ha una fotostabilità inferiore rispetto alla GFP e sbiancando Cherry, l'accettore compromette l'analisi FRET.
NOTA: Gli spettri di assorbimento ed emissione di GFP e Cherry sono mostrati nella figura supplementare 1. Dopo aver misurato per 5-6 ore, è consigliabile ripetere l'imaging di alcune cellule che esprimono la chimera GFP-Cherry alla fine della sessione di imaging per documentare che il set-up è rimasto stabile e le efficienze FRET rilevate della proteina di fusione GFP-Cherry non sono cambiate significativamente nel corso di una sessione di imaging.
4. Analisi delle immagini per rilevare le efficienze assolute di FRET mediante tempra del donatore ed emissione sensibilizzata
NOTA: Qui viene fornita una guida pratica passo-passo su come determinare l'efficienza FRET con l'uso del foglio di calcolo allegato (file supplementare 2). La teoria e la derivazione delle equazioni presentate possono essere trovate in dettaglio nelle pubblicazioni precedenti 4,15,16,17. Con le impostazioni descritte, vengono raccolte le seguenti intensità di fluorescenza.
- Misurare il segnale donatore I 1 nel canale 1, il canale donatore, con eccitazione a 488 nm e una banda di emissione di 505-530 nm.
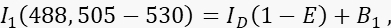
dove ID è il segnale donatore non spento nel canale 1 che verrebbe misurato in assenza di un accettore, è l'efficienza media FRET e B 1 il segnale medio di fondo nel canale 1. - Misurare il segnale accettore I 3 nel canale 3, il canale accettore, con eccitazione a 561 nm ed emissione a >585 nm.
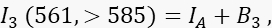
dove IA è il segnale accettore e B 3 lo sfondo nel canale 3. - Misurare il segnale FRET nel canale 2, il canale di trasferimento, con eccitazione a 488 nm ed emissione a >585 nm.
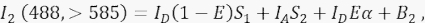
Dove, il segnale nel canale 2 è una somma di quattro diverse componenti: (i) I D(1 - E)S 1 è la fuoriuscita spettrale dal segnale del donatore spento nel canale di rivelazione >585 (con il fattore di diafonia S 1), (ii) IA S 2 è il segnale accettore dall'eccitazione diretta da parte della luce a 488 nm (con il fattore di diafonia S2), (iii) IDEα è l'emissione sensibilizzata dell'accettore da parte di FRET dalla molecola donatrice eccitata (α sarà ulteriormente dettagliato in 4.8. - 4.10.), e (iv) B2 è il segnale di fondo. - Misurare le intensità medie di fondo nei canali 1, 2, 3 in celle non trasfettate o fintamente trasfettate; O va bene con una differenza trascurabile. Per tutte le misurazioni cellulari, utilizzare lo strumento a mano libera per delineare le regioni di interesse ed evitare vescicole perinucleari con maggiore autofluorescenza. È importante evitare una significativa autofluorescenza da queste vescicole perinucleari.
- Inserisci le misure nelle colonne X, Y e Z del foglio di calcolo fornito. Le intensità medie di sfondo nei 3 canali vengono immesse in A2, B2 e C2 del foglio di calcolo Excel (file supplementare 2).
- Misurare le intensità medie nei canali 1, 2, 3 delle cellule che esprimono GFP o Cherry da solo, e inserire le misurazioni nelle colonne C, D, E e N, O, P. Le rispettive intensità di fondo vengono sottratte (in F, G, H e Q, R, S).
- Per calcolare E, l'efficienza FRET, determinare i fattori di diafonia S 1 e S2. Il fattore spettrale di diafonia S1 è calcolato da cellule che esprimono solo GFP
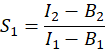
nella colonna I. Immettere il valore medio per S1 nella cella D2 del foglio di calcolo di Excel. - Calcolare il fattore spettrale di diafonia S2 da cellule che esprimono solo Cherry
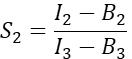
nella colonna T. Immettere la media per S2 nella cella E2 del foglio di calcolo Excel. - Assicurarsi che il fattore α metta in relazione il segnale di un dato numero di molecole GFP eccitate nel canale 1 con il segnale di un numero uguale di molecole di ciliegio eccitate nel canale 2 e sia definito da
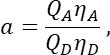

dove Q A e QD sono le rese quantiche di fluorescenza di Cherry e GFP; ηA e ηD le efficienze di rilevazione della fluorescenza dell'accettore e del donatore nei canali 2 e 1, rispettivamente.
NOTA: Il fattore α può essere determinato da due campioni che esprimono quantità assolute note di GFP e Cherry. Tuttavia, è impossibile conoscere l'esatta quantità di GFP e Cherry espressa in una cellula. Pertanto, abbiamo calcolato il fattore utilizzando cellule che esprimono la proteina di fusione GFP-Cherry. Qui, mentre la quantità assoluta è ancora sconosciuta, il rapporto tra molecole donatrici e accettori è noto per essere uno. - Misurare le intensità medie nei canali 1, 2, 3 delle cellule che esprimono la proteina di fusione GFP-Cherry e inserire le misure nelle colonne AE, AF, AG. Le intensità di fondo vengono sottratte (in AH, AI, AJ).
- Calcolare il fattore α (colonna AJ) dalle intensità di fluorescenza nei canali 1, 2 e 3 della proteina di fusione GFP-Cherry come segue:
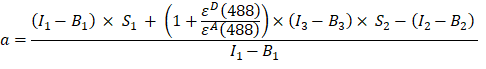
- Le intensità corrette di fondo misurate rispettivamente nel canale 1 (I 1 - B 1), 2 (I 2 - B 2) e 3 (I 3 - B3), sono misurate utilizzando la chimera GFP-Cherry. Il fattore spettrale di diafonia incrociata S1 è stato determinato utilizzando cellule che esprimono solo GFP (vedere 4.7.). εD e ε A sono i coefficienti di estinzione della GFP, il donatore, e della ciliegia, l'accettore, a 488 nm, e possono essere determinati dalla letteratura (ε GFP = 53.000 M-1 cm-1)18 e dalla curva di assorbimento della ciliegia (εciliegio ≈ 5560 M-1cm 1). Il rapporto
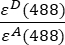 è stato inserito nella cella G2 del foglio di calcolo Excel. Immettete il valore medio per il fattore α in J2.
è stato inserito nella cella G2 del foglio di calcolo Excel. Immettete il valore medio per il fattore α in J2. - Utilizzare il fattore di α determinato per il calcolo dell'efficienza del FRET, E, come segue (colonna AK):
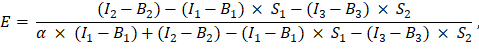
- In alternativa, determinare l'efficienza FRET, E, per i controlli negativi, cioè la co-espressione di GFP e Cherry e l'espressione della sola GFP aggiungendo le misurazioni dei canali 1, 2 e 3 nel foglio excel nella colonna AD, AE e AF sotto le misurazioni della proteina di fusione GFP-Cherry. Determinare le efficienze FRET tra le proteine di interesse GFP e Cherry allo stesso modo.
- Determinare l'intensità del donatore non spento, ID come (I 1 - B 1)/(1 - E) e l'intensità dell'accettore come I A = I 3 - B3; Questi valori sono proporzionali ai livelli di espressione delle proteine marcate.
- Determinare il corretto rapporto di intensità accettore-donatore (Q) della proteina di fusione GFP-Cherry come segue (colonna AL):

- Per altre cellule co-trasfettate, calcolare il rapporto molecolare accettore-donatore N A/ND come segue:
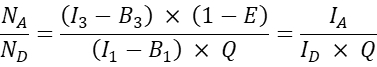
NOTA: Il razionale per determinare il rapporto N A / N D e tracciare l'efficienza FRET cellulare media E rispetto a N A / N D, è che una molecola donatrice può trasferire energia a più accettori mentre una molecola accettore può ricevere energia solo da un donatore in un dato momento. Anche se solo un accettore può interagire con un donatore a causa della stechiometria dell'interazione, un aumento della concentrazione dell'accettore dovrebbe aumentare la frazione di donatori in complesso con l'accettore a causa della legge dell'azione di massa. Pertanto, per un intervallo fisso (o ristretto di) espressione del donatore, l'efficienza FRET dovrebbe aumentare con l'aumentare di N A / ND. Quando si traccia l'efficienza FRET E rispetto a N A/N D per la co-espressione di GFP e Cherry, cioè la sonda negativa, tuttavia, un aumento di N A/N D non dovrebbe comportare un aumento dell'efficienza FRET (almeno a concentrazioni accettori sufficientemente basse in cui non si verifica FRET casuale a causa della vicinanza di coloranti accettori a coloranti donatori).
Risultati
La Figura 1 mostra le immagini ottenute rispettivamente nel canale donatore, canale 1 (488, 505-530 nm), canale di trasferimento, canale 2 (488, >585 nm) e canale accettore, canale 3 (561, >585 nm). Immagini rappresentative di cellule che esprimono solo GFP, solo Cherry, che co-esprimono GFP e Cherry ed esprimono la proteina di fusione GFP-Cherry. Le efficienze medie di FRET cellulare calcolate nelle cellule NRK che esprimono la proteina di fusione GFP-Cherry...
Discussione
Il protocollo presentato descrive in dettaglio l'uso della sonda di calibrazione della proteina fluorescente uno-a-uno geneticamente accoppiata per quantificare la FRET utilizzando la rilevazione dell'emissione sensibilizzata dell'accettore e la tempra della molecola donatrice mediante microscopia confocale. Questo metodo può essere applicato per valutare le interazioni proteiche nel contesto fisiologico della cellula vivente in diversi compartimenti subcellulari. La risoluzione spaziale può essere ulteriormente miglio...
Divulgazioni
Gli autori non hanno nulla da rivelare.
Riconoscimenti
Vorremmo ringraziare il Neuroscience Imaging Service della Stanford University School of Medicine per aver fornito attrezzature e spazio per questo progetto. Questa ricerca è stata supportata dal finanziamento intramurale dello Stanford Cancer Institute e della Gynecologic Oncology Division Stanford, nonché da GINOP-2.3.2-15-2016-00026, GINOP-2.3.3-15-2016-00030, NN129371, ANN135107 dal National Research, Development and Innovation Office, Ungheria.
Materiali
| Name | Company | Catalog Number | Comments |
| 0.5% Trypsin-EDTA without phenol red (10x) | Thermo Fisher Scientific | 15400054 | |
| Clontech mCherry N1 vector | Addgene | 3553 | |
| DMEM without phenol red | Thermo Fisher Scientific | 11054020 | |
| Fugene 6 | Promega | E2691 | |
| HEPES | Thermo Fisher Scientific | 15630080 | |
| LabTek 8-well chambers #1.0 | Thermo Fisher Scientific | 12565470 | |
| L-Glutamine (200 mM) | Thermo Fisher Scientific | 25030081 |
Riferimenti
- Förster, T. Zwischenmolekulare Energiewanderung und Fluoreszenz. Annal der Physik. 437, 55-75 (1948).
- Jovin, T. M., Arndt-Jovin, D. J. Luminescence digital imaging microscopy. Annual Review of Biophysics and Biophysical Chemistry. 18, 271-308 (1989).
- Mekler, V. M. A photochemical technique to enhance sensitivity of detection of fluorescence resonance energy transfer. Photochemistry and Photobiology. 59, 615-620 (1994).
- Vamosi, G., et al. Conformation of the c-Fos/c-Jun complex in vivo: A combined FRET, FCCS, and MD-modeling study. Biophysical Journal. 94 (7), 2859-2868 (2008).
- Renz, M., Daniels, B. R., Vamosi, G., Arias, I. M., Lippincott-Schwartz, J. Plasticity of the asialoglycoprotein receptor deciphered by ensemble FRET imaging and single-molecule counting PALM imaging. Proceedings of the National Academy of Science U. S. A. 109 (44), 2989-2997 (2012).
- van Rheenen, J., Langeslag, M., Jalink, K. Correcting confocal acquisition to optimize imaging of fluorescence resonance energy transfer by sensitized emission. Biophysical Journal. 86 (4), 2517-2529 (2004).
- Muller, S. M., Galliardt, H., Schneider, J., Barisas, B. G., Seidel, T. Quantification of Forster resonance energy transfer by monitoring sensitized emission in living plant cells. Frontiers in Plant Sciences. 4, 413 (2013).
- Gates, E. M., LaCroix, A. S., Rothenberg, K. E., Hoffman, B. D. Improving quality, reproducibility, and usability of FRET-based tension sensors. Cytometry Part A. 95 (2), 201-213 (2019).
- Menaesse, A., et al. Simplified instrument calibration for wide-field fluorescence resonance energy transfer (FRET) measured by the sensitized emission method. Cytometry Part A. , 24194 (2020).
- Shaner, N. C., et al. Improved monomeric red, orange and yellow fluorescent proteins derived from Discosoma sp. red fluorescent protein. Nature Biotechnology. 22 (12), 1567-1572 (2004).
- Cormack, B. P., Valdivia, R. H., Falkow, S. FACS-optimized mutants of the green fluorescent protein (GFP). Gene. 173, 33-38 (1996).
- Nagy, P., et al. Novel calibration method for flow cytometric fluorescence resonance energy transfer measurements between visible fluorescent proteins. Cytometry Part A. 67 (2), 86-96 (2005).
- Arai, R., Ueda, H., Kitayama, A., Kamiya, N., Nagamune, T. Design of the linkers which effectively separate domains of a bifunctional fusion protein. Protein Engineering. 14 (8), 529-532 (2001).
- Szendi-Szatmari, T., Szabo, A., Szollosi, J., Nagy, P. Reducing the detrimental effects of saturation phenomena in FRET microscopy. Analytical Chemistry. 91 (9), 6378-6382 (2019).
- Tron, L., et al. Flow cytometric measurement of fluorescence resonance energy transfer on cell surfaces. Quantitative evaluation of the transfer efficiency on a cell-by-cell basis. Biophysical Journal. 45 (5), 939-946 (1984).
- Sebestyen, Z., et al. Long wavelength fluorophores and cell-by-cell correction for autofluorescence significantly improves the accuracy of flow cytometric energy transfer measurements on a dual-laser benchtop flow cytometer. Cytometry. 48 (3), 124-135 (2002).
- Szaloki, N., et al. High throughput FRET analysis of protein-protein interactions by slide-based imaging laser scanning cytometry. Cytometry Part A. 83 (9), 818-829 (2013).
- McRae, S. R., Brown, C. L., Bushell, G. R. Rapid purification of EGFP, EYFP, and ECFP with high yield and purity. Protein Expression and Purification. 41 (1), 121-127 (2005).
- Kremers, G. J., Goedhart, J., van Munster, E. B., Gadella, T. W. Cyan and yellow super fluorescent proteins with improved brightness, protein folding, and FRET Forster radius. Biochemistry. 45 (21), 6570-6580 (2006).
- Bajar, B. T., Wang, E. S., Zhang, S., Lin, M. Z., Chu, J. A Guide to Fluorescent Protein FRET Pairs. Sensors (Basel). 16 (9), (2016).
- Scott, B. L., Hoppe, A. D. Optimizing fluorescent protein trios for 3-Way FRET imaging of protein interactions in living cells. Science Reports. 5, 10270 (2015).
- Chen, Y. C., Spring, B. Q., Clegg, R. M. Fluorescence lifetime imaging comes of age how to do it and how to interpret it. Methods Molecular Biology. 875, 1-22 (2012).
- King, C., Sarabipour, S., Byrne, P., Leahy, D. J., Hristova, K. The FRET signatures of noninteracting proteins in membranes: Simulations and experiments. Biophysical Journal. 106 (6), 1309-1317 (2014).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon