需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
评估具有FRET敏化发射的活细胞中的蛋白质相互作用
Erratum Notice
摘要
两个荧光团分子之间的福斯特共振能量转移(FRET)可用于研究活细胞中的蛋白质相互作用。在这里,提供了有关如何通过使用共聚焦激光扫描显微镜检测受体的敏化发射和供体分子的淬灭来测量活细胞中的FRET的协议。
摘要
福斯特共振能量转移(FRET)是从激发的供体到受体分子的能量的无辐射转移,取决于分子的距离和方向以及供体发射和受体吸收光谱之间的重叠程度。FRET允许研究活细胞中蛋白质随时间变化和不同亚细胞区室中的相互作用。文献中已经描述了使用显微镜测量FRET的不同基于强度的算法。在这里,提供了一种协议和算法,用于基于测量受体的敏化发射和供体分子的淬灭来量化FRET效率。活细胞中比例FRET的定量不仅需要确定荧光蛋白的串扰(光谱溢出或渗漏),还需要确定显微镜装置的检测效率。此处提供的协议详细说明了如何评估这些关键参数。
引言
基于显微镜的福斯特共振能量转移(FRET)分析允许评估活细胞中蛋白质之间的相互作用。它提供空间和时间信息,包括有关细胞中发生相互作用的位置和亚细胞区室中发生以及这种相互作用是否随时间变化的信息。
Theodor Förster于1948年奠定了FRET的理论基础1.FRET是从激发的供体到受体分子的能量的无辐射转移,取决于分子的距离及其过渡偶极子的相对方向以及供体发射和受体吸收光谱之间的重叠。能量转移速率与供体-受体距离的六次方成反比。因此,FRET可用于测量1-10nm范围内的分子接近度。
FRET与供体分子的其他去激发过程竞争,并导致受体的所谓供体淬灭和敏化发射。供体猝灭是发射供体光子数量的减少,而敏化发射是发射受体光子的增加。许多显微FRET分析使用荧光强度测量,包括受体光漂白2,供体光漂白2或受体3的FRET敏化光漂白。
在这里,提出了一种分步实验方案和数学算法,以使用供体淬灭和受体敏化发射4,5(通常称为比率FRET)来量化FRET的方法。关于如何近似敏化发射的许多协议已经发布,很少有量化绝对FRET效率6,7,8,9。活细胞中FRET效率的定量需要确定(i)荧光蛋白的串扰(光谱溢出或渗漏),以及(ii)显微镜装置的检测效率。虽然串扰可以通过仅表达一种荧光团的细胞成像来评估,但对供体和受体荧光的相对检测效率的评估更为复杂。它至少需要了解产生测量信号的供体和受体分子数量的比率。然而,活细胞中表达的荧光团数量因细胞而异,并且是未知的。所谓的α因子表征来自单个激发供体和受体分子的相对信号强度。了解该因子是在具有可变受体-供体分子比例的样品中进行定量比例法FRET测量的先决条件,就像在使用荧光蛋白进行活细胞成像时遇到的一样。使用1对1供体-受体融合蛋白作为校准探针可以确定α因子,也可以作为阳性对照。这种基因偶联探针由细胞以未知的总量表达,但以固定且已知的相对量一对一表达。以下协议列出了如何构建1对1探头以及如何使用它来量化FRET效率。在增刊中可以找到包含所有公式的电子表格,读者可以使用该电子表格在相应的列中输入自己的测量值,如下所述。
虽然该协议使用GFP-Cherry供体/受体对,但所提出的方法可以用任何其他FRET对执行。 补充文件 1 提供了有关青黄色对的详细信息。
Access restricted. Please log in or start a trial to view this content.
研究方案
1. 质粒构建
- 为了生成eGFP-mCherry1融合探针,使用N1哺乳动物细胞表达载体(参见材料表),使用限制性位点AgeI和BsrGI插入mCherry110。
- 使用以下寡核苷酸在没有终止密码子的情况下扩增 eGFP11 作为 SalI-BamHI 片段:N 末端引物 5'-AAT TAA CAG TCG ACG ATG GTG AGC AAG GGC GAG G 3' 和 C 末端引物 5'-AAT ATA TGG ATC CCG CTT GTA CAG CTC GTC CAT GC 3'。
- 将该 SalI-BamHI 片段插入N1载体的多个克隆位点,以在绿色和红色荧光蛋白之间引入RNPPV接头(五个氨基酸)接头。
注意:该接头产生GFP-Cherry供体-受体对的平均FRET效率约为0.25 -0.3(图1A)。选择不同长度的刚性12 和螺旋13 接头来衡量测量的FRET效率已在别处讨论过,但对于我们的融合蛋白目的来说不是必需的。为了简单起见,我们将荧光蛋白称为"GFP"和"樱桃"。
2. 细胞培养和转染
- 使用任何细胞系,例如NRK细胞,在培养基中进行FRET实验,例如Dulbecco的改良Eagle培养基(DMEM),不含 酚红,以减少背景荧光。出于同样的原因,建议使用酚红游离胰蛋白酶。
- 一旦细胞汇合80%,用1mL的0.05%胰蛋白酶-EDTA分离细胞,使用Neubauer室计数悬浮细胞的数量,并在8孔腔盖玻片的每孔中接种约10,000个细胞;或者,从T25烧瓶中生长的融合细胞培养物中,使用来自2 mL移液管的1滴细胞悬液或来自T 12.5细胞培养瓶中生长的融合培养物中的5 mL细胞悬液中的3滴。
- 在标准细胞培养条件(37°C 和 5% CO 2)下,在 8 孔室(0.8 cm2 /孔)中用 #1.0 盖玻片培养细胞,用于荧光活细胞显微镜。
- 接种后24小时,使用适当的市售转染培养基(参见 材料表),用GFP,樱桃,GFP /樱桃混合物(1:1混合物,即0.8μg和0.8μgGFP和樱桃质粒DNA)和GFP-樱桃嵌合体转染细胞。
- 转染时,在 45 μL DMEM 和 1.6 μg 质粒 DNA 中使用 5 μL 转染试剂。轻轻轻弹微量离心管搅拌。
- 在室温下孵育混合物15分钟后,向8孔室载玻片的每个孔中加入1-2μL转染试剂混合物。将腔室盖玻片放回培养箱。
- 在转染后20小时经过活细胞成像,以允许适当的荧光蛋白表达,折叠和成熟,特别是红色荧光团。
3. 烦恼成像
- 在37°C的加湿和加热的环境室中成像转染的细胞。 为了在生理pH下缓冲细胞培养基,请使用设置为5%流量的CO2 气体,或添加20mM HEPES以使细胞培养基CO2与细胞培养基无关。
- 使用共聚焦激光扫描显微镜。按如下方式设置激励和发射,以优化信号并最大限度地减少串扰。
- 使用氩离子激光器的 488 nm 线激发 GFP,使用 561 nm 二极管泵浦固态激光器(或 543 nm 氦氖激光器,取决于可用的激光线)激发樱桃。
- 在商用共聚焦显微镜的软件中设置以下内容。通过使用下拉菜单单击按钮将 二向色镜 设置为 488/561。使用 488 nm 激光在通道 1 中通过 505 - 530 nm(或 505 - 550 nm)的发射带和在通道 2 中使用长通滤光片 >585 nm)激发荧光,并使用 561 nm 激光在通道 3 中使用长通滤光>片激发 585 nm(输入波长)。也可以使用带通滤光片,例如590 - 650 nm或类似滤光片,其优点是排除拉曼散射。
- 依次用两个激光器激发,并将成像模式设置为在 每行之后切换 ,以便512 x 512像素图像的激发在每行之后交替(而不是在每帧之后,这将取消由于标记蛋白质的扩散而检测FRET的能力,同时记录具有不同激发的图像;按钮单击)。
- 通过单击按钮设置三个图像的迷你时间序列,以检测是否发生明显的光漂白,并可能降低激光功率。光漂白小于1%是最佳的。高激光强度也会导致吸收饱和,降低表观FRET效率14。激光功率,在物镜上测量的高达10-20 μW是安全的。
- 首先,对表达GFP-樱桃融合构建体的细胞进行成像。设置定义共聚焦图像中每个像素的时间积分激光强度的参数,即像素停留时间(以微秒为单位)、声光可调谐滤光片 (AOTF) 传输(以百分比为单位)和变焦。
- 使用 63 倍油镜对细胞进行成像, 变焦 设置为 3 倍。这为整个细胞成像提供了足够的放大倍率和分辨率。瞄准 70-80 nm 的像素大小。
- 将 像素停留时间 设置为 2-4 μs,并将 488 nm 和 561 nm 激光器的 AOTF 透射 设置为图像,以便图像具有良好的信噪比而不会漂白,并且没有显示荧光强度饱和度的像素。调整 488 和 561 的激光功率是有利的,使得通道 1 和通道 3 中的信号电平相似。
- 将 光电倍增管(平均模式)增益 设置为 600-800。
- 使用这些设置的图像 15-20 个表达 GFP-樱桃融合蛋白的细胞。15-20个电池提供良好的统计数据,同时将FRET测量的总时间限制在几个小时内,以帮助确保显微镜设置的稳定性。
- 具有表达GFP,樱桃,GFP和樱桃的相同设置细胞以及非转染细胞的图像。分别在绿色通道或红色通道中搜索表达细胞。
- 然后,图像15-20细胞共表达感兴趣的蛋白质分别偶联到GFP和樱桃。寻找表达细胞时,避免长时间暴露细胞,以免漂白荧光蛋白。樱桃的光稳定性低于GFP,漂白樱桃,受体会影响FRET分析。
注意:GFP和樱桃的吸收和发射光谱如 补充图1所示。测量5-6小时后,建议在成像会话结束时对表达GFP-Cherry嵌合体的几个细胞重复成像,以记录设置保持稳定并且检测到GFP-Cherry融合蛋白的FRET效率在成像过程中没有显着变化。
4. 使用供体淬灭和敏化发射检测绝对FRET效率的图像分析
注意:这里提供了有关如何使用随附的电子表格(补充文件2)确定FRET效率的实用分步指南。所提出的方程的理论和推导可以在以前的出版物4,15,16,17中找到。使用所述设置,收集以下荧光强度。
- 测量通道1(供体通道)中的供体信号I1,激发波长为488 nm,发射带为505-530 nm。
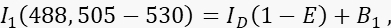
其中ID是通道1中未淬灭的供体信号,在没有受体的情况下测量,是平均FRET效率,B 1是通道1中的平均背景信号。 - 测量通道 3(受体通道)中的受体信号 I 3,激发波长为 561 nm,发射波长为 >585 nm。
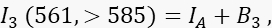
其中 I A 是接受器信号,B 3 是通道 3 中的背景信号。 - 测量通道 2(传输通道)中的 FRET 信号,激发波长为 488 nm,发射波长为 >585 nm。
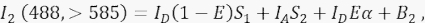
其中,通道 2 中的信号是四个不同分量的总和:(i) I D(1 - E)S 1 是从淬灭的供体信号溢出到 >585 检测通道(串扰因子 S 1),(ii) IAS 2 是来自 488 nm 光直接激发的受体信号(串扰因子 S 2), (iii)IDEα是FRET从激发的供体分子中对受体的敏化发射(α将在4.8.-4.10中进一步详细说明),(iv)B2是背景信号。 - 测量非转染或模拟转染细胞中通道 1、2、3 中的平均背景强度;两者都很好,差异可以忽略不计。对于所有细胞测量,请使用徒手工具描绘感兴趣的区域,并避免自发荧光增加的核周囊泡。避免这些核周囊泡产生显著的自发荧光很重要。
- 在提供的电子表格的 X、Y 和 Z 列中输入测量值。3 个通道的平均背景强度输入到 excel 电子表格的 A2、B2 和 C2 中(补充文件 2)。
- 测量单独表达GFP或樱桃的细胞通道1,2,3中的平均强度,并将测量值输入C,D,E和N,O,P列。
- 为了计算E,FRET效率,确定串扰因子S 1和S2。光谱串扰因子 S1 是根据仅表达 GFP 的细胞计算得出的
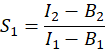
在 I 列中,在 Excel 电子表格的单元格 D2 中输入 S1 的平均值。 - 计算仅表达樱桃的细胞的光谱串扰因子 S2
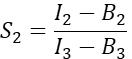
在 T 列中,在 Excel 电子表格的单元格 E2 中输入 S2 的平均值。 - 确保α因子将通道 1 中任何给定数量的激发 GFP 分子的信号与通道 2 中等数的激发 Cherry 分子的信号相关联,并由下式定义
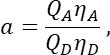
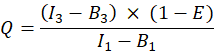
其中Q A和QD是樱桃和GFP的荧光量子产率;ηA和ηD分别表示通道2和1中受体和供体荧光的检测效率。
注意:α因子可以从两个表示已知绝对量的GFP和樱桃的样品中确定。然而,不可能知道细胞中表达的GFP和樱桃的确切量。因此,我们使用表达GFP-Cherry融合蛋白的细胞计算了该因子。在这里,虽然绝对量仍然未知,但已知供体和受体分子的比例为一。 - 测量表达GFP-Cherry融合蛋白的细胞通道1,2,3中的平均强度,并将测量值输入AE,AF,AG列。减去背景强度(以 AH、AI、AJ 为单位)。
- 根据GFP-Cherry融合蛋白通道1,2和3中的荧光强度计算α因子(AJ柱),如下所示:
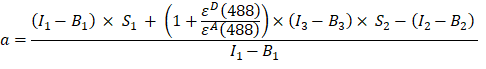
- 分别在通道 1 (I 1 - B 1)、2 (I 2 - B 2) 和 3 (I 3 - B 3) 中测量的背景校正强度使用 GFP-Cherry 嵌合体测量。光谱串扰因子S1仅使用表达GFP的细胞测定(见4.7)。εD和εA是供体GFP和受体樱桃在488nm处的消光系数,可以从文献(εGFP = 53,000 M-1 cm-1)18和樱桃(ε樱桃≈5560 M-1cm 1)的吸收曲线确定。该比率
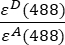 已在 Excel 电子表格的单元格 G2 中输入。在 J2 中输入α因子的平均值。
已在 Excel 电子表格的单元格 G2 中输入。在 J2 中输入α因子的平均值。 - 使用确定的α系数计算FRET 效率E,如下所示(AK列):
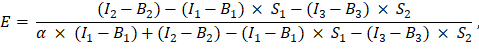
- 或者,通过在 GFP-Cherry 融合蛋白测量下的 AD、AE 和 AF 列的 excel 表中添加通道 1、2 和 3 的测量值,确定阴性对照的 FRET 效率 E,即 GFP 和 Cherry 的共表达以及单独的 GFP 表达。以相同的方式确定GFP和Cherry标记的目标蛋白之间的FRET效率。
- 确定未淬灭的供体强度,I D为(I 1 - B 1)/(1 - E),受体强度为I A = I 3 - B3;这些值与标记蛋白的表达水平成正比。
- 确定GFP-樱桃融合蛋白的校正受体-供体强度比(Q),如下所示(AL列):
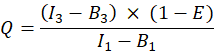
- 对于其他共转染细胞,按如下方式计算受体-供体分子比N A / ND:
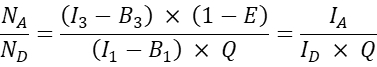
注意:确定N A / N D比率并绘制平均细胞FRET效率E与N A / N D的基本原理是,一个供体分子可以将能量传递给多个受体,而受体分子只能在给定时间从一个供体接收能量。即使只有一个受体可以由于相互作用的化学计量而与供体相互作用,由于质量作用定律,受体浓度的增加有望增加与受体复合的供体比例。因此,对于固定(或窄范围)供体表达,FRET效率应随着NA /N D的增加而提高。然而,当绘制GFP和樱桃共表达的FRET效率E与N A / N D时,即负探针,N A / N D的增加不应导致FRET效率的增加(至少在足够低的受体浓度下,由于受体染料与供体染料的附近不会发生随机FRET)。
Access restricted. Please log in or start a trial to view this content.
结果
图1分别显示了在供体通道通道1(488,505-530 nm),转移通道通道2(488,>585 nm)和受体通道3(561,>585 nm)中获得的图像。仅表达GFP,仅表达樱桃,共表达GFP和樱桃以及表达GFP-樱桃融合蛋白的细胞的代表性图像。绘制在表达GFP-樱桃融合蛋白的NRK细胞(阳性对照,图2A)和共表达GFP-樱桃(阴性对照,图2B)的NRK
Access restricted. Please log in or start a trial to view this content.
讨论
所提出的协议详细介绍了使用基因偶联的一对一荧光蛋白校准探针来量化FRET使用共聚焦显微镜检测受体的敏化发射和供体分子的淬灭。该方法可用于评估不同亚细胞区室中活细胞生理环境中的蛋白质相互作用。通过应用所提出的算法来计算图像每个像素的FRET效率(逐像素FRET),可以进一步提高空间分辨率。基于强度的绝对FRET效率测定需要确定串扰,此处用 S 因子量化,以及通过给定的显...
Access restricted. Please log in or start a trial to view this content.
披露声明
作者没有什么可透露的。
致谢
我们要感谢斯坦福大学医学院的神经科学成像服务为这个项目提供设备和空间。这项研究得到了斯坦福癌症研究所和斯坦福妇科肿瘤科的校内资助,以及匈牙利国家研究、发展和创新办公室的GINOP-2.3.2-15-2016-00026、GINOP-2.3.3-15-2016-00030、NN129371、ANN135107。
Access restricted. Please log in or start a trial to view this content.
材料
| Name | Company | Catalog Number | Comments |
| 0.5% Trypsin-EDTA without phenol red (10x) | Thermo Fisher Scientific | 15400054 | |
| Clontech mCherry N1 vector | Addgene | 3553 | |
| DMEM without phenol red | Thermo Fisher Scientific | 11054020 | |
| Fugene 6 | Promega | E2691 | |
| HEPES | Thermo Fisher Scientific | 15630080 | |
| LabTek 8-well chambers #1.0 | Thermo Fisher Scientific | 12565470 | |
| L-Glutamine (200 mM) | Thermo Fisher Scientific | 25030081 |
参考文献
- Förster, T. Zwischenmolekulare Energiewanderung und Fluoreszenz. Annal der Physik. 437, 55-75 (1948).
- Jovin, T. M., Arndt-Jovin, D. J. Luminescence digital imaging microscopy. Annual Review of Biophysics and Biophysical Chemistry. 18, 271-308 (1989).
- Mekler, V. M. A photochemical technique to enhance sensitivity of detection of fluorescence resonance energy transfer. Photochemistry and Photobiology. 59, 615-620 (1994).
- Vamosi, G., et al. Conformation of the c-Fos/c-Jun complex in vivo: A combined FRET, FCCS, and MD-modeling study. Biophysical Journal. 94 (7), 2859-2868 (2008).
- Renz, M., Daniels, B. R., Vamosi, G., Arias, I. M., Lippincott-Schwartz, J. Plasticity of the asialoglycoprotein receptor deciphered by ensemble FRET imaging and single-molecule counting PALM imaging. Proceedings of the National Academy of Science U. S. A. 109 (44), 2989-2997 (2012).
- van Rheenen, J., Langeslag, M., Jalink, K. Correcting confocal acquisition to optimize imaging of fluorescence resonance energy transfer by sensitized emission. Biophysical Journal. 86 (4), 2517-2529 (2004).
- Muller, S. M., Galliardt, H., Schneider, J., Barisas, B. G., Seidel, T. Quantification of Forster resonance energy transfer by monitoring sensitized emission in living plant cells. Frontiers in Plant Sciences. 4, 413(2013).
- Gates, E. M., LaCroix, A. S., Rothenberg, K. E., Hoffman, B. D. Improving quality, reproducibility, and usability of FRET-based tension sensors. Cytometry Part A. 95 (2), 201-213 (2019).
- Menaesse, A., et al. Simplified instrument calibration for wide-field fluorescence resonance energy transfer (FRET) measured by the sensitized emission method. Cytometry Part A. , 24194(2020).
- Shaner, N. C., et al. Improved monomeric red, orange and yellow fluorescent proteins derived from Discosoma sp. red fluorescent protein. Nature Biotechnology. 22 (12), 1567-1572 (2004).
- Cormack, B. P., Valdivia, R. H., Falkow, S. FACS-optimized mutants of the green fluorescent protein (GFP). Gene. 173, 1 Spec No 33-38 (1996).
- Nagy, P., et al. Novel calibration method for flow cytometric fluorescence resonance energy transfer measurements between visible fluorescent proteins. Cytometry Part A. 67 (2), 86-96 (2005).
- Arai, R., Ueda, H., Kitayama, A., Kamiya, N., Nagamune, T. Design of the linkers which effectively separate domains of a bifunctional fusion protein. Protein Engineering. 14 (8), 529-532 (2001).
- Szendi-Szatmari, T., Szabo, A., Szollosi, J., Nagy, P. Reducing the detrimental effects of saturation phenomena in FRET microscopy. Analytical Chemistry. 91 (9), 6378-6382 (2019).
- Tron, L., et al. Flow cytometric measurement of fluorescence resonance energy transfer on cell surfaces. Quantitative evaluation of the transfer efficiency on a cell-by-cell basis. Biophysical Journal. 45 (5), 939-946 (1984).
- Sebestyen, Z., et al. Long wavelength fluorophores and cell-by-cell correction for autofluorescence significantly improves the accuracy of flow cytometric energy transfer measurements on a dual-laser benchtop flow cytometer. Cytometry. 48 (3), 124-135 (2002).
- Szaloki, N., et al. High throughput FRET analysis of protein-protein interactions by slide-based imaging laser scanning cytometry. Cytometry Part A. 83 (9), 818-829 (2013).
- McRae, S. R., Brown, C. L., Bushell, G. R. Rapid purification of EGFP, EYFP, and ECFP with high yield and purity. Protein Expression and Purification. 41 (1), 121-127 (2005).
- Kremers, G. J., Goedhart, J., van Munster, E. B., Gadella, T. W. Cyan and yellow super fluorescent proteins with improved brightness, protein folding, and FRET Forster radius. Biochemistry. 45 (21), 6570-6580 (2006).
- Bajar, B. T., Wang, E. S., Zhang, S., Lin, M. Z., Chu, J. A Guide to Fluorescent Protein FRET Pairs. Sensors (Basel). 16 (9), (2016).
- Scott, B. L., Hoppe, A. D. Optimizing fluorescent protein trios for 3-Way FRET imaging of protein interactions in living cells. Science Reports. 5, 10270(2015).
- Chen, Y. C., Spring, B. Q., Clegg, R. M. Fluorescence lifetime imaging comes of age how to do it and how to interpret it. Methods Molecular Biology. 875, 1-22 (2012).
- King, C., Sarabipour, S., Byrne, P., Leahy, D. J., Hristova, K. The FRET signatures of noninteracting proteins in membranes: Simulations and experiments. Biophysical Journal. 106 (6), 1309-1317 (2014).
Access restricted. Please log in or start a trial to view this content.
Erratum
Formal Correction: Erratum: Assessing Protein Interactions in Live-Cells with FRET-Sensitized Emission
Posted by JoVE Editors on 3/14/2023. Citeable Link.
An erratum was issued for: Assessing Protein Interactions in Live-Cells with FRET-Sensitized Emission. The Authors section was updated from:
György Vámosi1
Sarah Miller2
Molika Sinha2
Gabor Mocsár1
Malte Renz2
1Department of Biophysics and Cell Biology, Faculty of Medicine, University of Debrecen
2Gynecologic Oncology Division, Stanford University School of Medicine
to:
György Vámosi1
Sarah Miller2
Molika Sinha2
Maria Kristha Fernandez2
Gabor Mocsár1
Malte Renz2
1Department of Biophysics and Cell Biology, Faculty of Medicine, University of Debrecen
2Gynecologic Oncology Division, Stanford University School of Medicine
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。