A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
הערכת אינטראקציות חלבונים בתאים חיים עם פליטה רגישה ל-FRET
In This Article
Erratum Notice
Summary
Förster Resonance Energy Transfer (FRET) בין שתי מולקולות פלואורופור יכול לשמש לחקר אינטראקציות חלבונים בתא החי. כאן, פרוטוקול מסופק כיצד למדוד FRET בתאים חיים על ידי זיהוי פליטה רגישה של המקבל ומרווה של מולקולת התורם באמצעות מיקרוסקופ סריקת לייזר קונפוקלי.
Abstract
Förster Resonance Energy Transfer (FRET) היא העברת אנרגיה ללא קרינה מתורם נרגש למולקולה מקבלת ותלויה במרחק ובכיוון של המולקולות, כמו גם במידת החפיפה בין ספקטרום פליטת התורם לספקטרום קליטת המקבל. FRET מאפשר לחקור את האינטראקציה של חלבונים בתא החי לאורך זמן ובתאים תת-תאיים שונים. אלגוריתמים שונים מבוססי עוצמה למדידת FRET באמצעות מיקרוסקופיה תוארו בספרות. כאן, פרוטוקול ואלגוריתם מסופקים לכימות יעילות FRET בהתבסס על מדידת הפליטה הרגישה של המקבל ומרווה של מולקולת התורם. הכימות של FRET יחסימטרי בתא החי דורש לא רק את קביעת הקרוס-טוק (זליגה ספקטרלית, או דימום) של החלבונים הפלואורסצנטיים, אלא גם את יעילות הזיהוי של המערך המיקרוסקופי. הפרוטוקול המובא כאן מפרט כיצד להעריך פרמטרים קריטיים אלה.
Introduction
ניתוח מבוסס מיקרוסקופיה של Förster Resonance Energy Transfer (FRET) מאפשר הערכה של אינטראקציות בין חלבונים בתאים חיים. הוא מספק מידע מרחבי וזמני, כולל מידע על היכן בתא ובאיזה תא תת-תאי מתרחשת האינטראקציה ואם אינטראקציה זו משתנה עם הזמן.
תיאודור פורסטר הניח את הבסיס התאורטי של FRET בשנת 19481. FRET היא העברה ללא קרינה של אנרגיה מתורם נרגש למולקולת קבלה, והיא תלויה במרחק המולקולות ובאוריינטציה היחסית של דיפולי המעבר שלהן, כמו גם בחפיפה בין ספקטרום פליטת התורם לספקטרום קליטת המקבל. קצב העברת האנרגיה עומד ביחס הפוך לחזקה השישית של מרחק התורם-מקבל. לפיכך, FRET יכול לשמש למדידת קרבה מולקולרית בטווח של 1-10 ננומטר.
FRET מתחרה בתהליכי עירור אחרים של מולקולת התורם ומביא למה שמכונה פליטה מרוותה ורגישה של התורם של המקבל. מרווה מתורם היא הפחתה של מספר פוטוני התורם הנפלטים, בעוד פליטה רגישה היא עלייה בפוטונים הקולטים הנפלטים. ניתוחי FRET מיקרוסקופיים רבים משתמשים במדידות עוצמת פלואורסצנטיות, כולל הלבנה פוטואורסצנטית של המקבל 2, הלבנה פוטו-לוגית של תורם2, או הלבנה פוטו-רגישה ל-FRET של המקבל3.
כאן, פרוטוקול ניסויי שלב אחר שלב ואלגוריתם מתמטי מוצגים כדי לכמת FRET באמצעות מרווה תורם ומקבל פליטה רגישה4,5, שיטה המכונה לעתים קרובות FRET יחסי. פרוטוקולים רבים כיצד להעריך פליטה רגישה פורסמו, מעטים כימתו את יעילות FRET המוחלטת 6,7,8,9. כימות יעילות FRET בתא החי דורש לקבוע (i) את crosstalk (זליגה ספקטרלית, או דימום דרך) של החלבונים הפלואורסצנטיים, וגם (ii) את יעילות הזיהוי של המערך המיקרוסקופי. בעוד שניתן להעריך דיבור צולב על ידי תאי הדמיה המבטאים רק אחד מהפלואורופורים, הערכת יעילות הזיהוי היחסית של התורם והפלואורסצנטיות המקבלת מורכבת יותר. זה דורש ידע של לפחות את היחס בין מספר מולקולות תורם ומקבל היוצר את האותות הנמדדים. עם זאת, מספר הפלואורופורים המבוטאים בתאים חיים משתנה מתא לתא ואינו ידוע. מה שמכונה גורם α מאפיין את עוצמות האות היחסיות ממולקולת תורם ומקבל נרגשת אחת. ידיעת הגורם היא תנאי מוקדם למדידות FRET יחסיות כמותיות בדגימות עם יחסי מולקולות משתנים בין קבלה לתורם, כפי שנתקלים בהן במהלך הדמיה של תאים חיים עם חלבונים פלואורסצנטיים. שימוש בחלבון היתוך 1 ל-1 תורם-מקבל כבדיקת כיול מאפשר קביעת גורם α ומשמש גם כבקרה חיובית. בדיקה מצומדת גנטית זו מבוטאת על ידי תאים בכמויות כוללות לא ידועות אך בכמות יחסית קבועה וידועה של אחד לאחד. הפרוטוקול הבא מפרט כיצד לבנות את הגשושית 1 ל-1 וכיצד להשתמש בה לכימות יעילות FET. גיליון אלקטרוני הכולל את כל הנוסחאות נמצא במוסף ויכול לשמש את הקוראים כדי להזין את המידות שלהם בעמודות המתאימות כמפורט להלן.
בעוד שהפרוטוקול משתמש בזוג התורם/מקבל GFP-Cherry, ניתן לבצע את הגישה המוצגת עם כל זוג FRET אחר. הקובץ המשלים 1 מספק פרטים על זוגות ציאן-צהוב.
Access restricted. Please log in or start a trial to view this content.
Protocol
1. בניית פלסמיד
- ליצירת בדיקת ההיתוך eGFP-mCherry1, השתמש בווקטור ביטוי תאי יונקים N1 (ראה טבלת חומרים) עם mCherry110 שהוכנס באמצעות אתרי ההגבלה AgeI ו - BsrGI.
- השתמש באוליגונוקלאוטידים הבאים כדי להגביר את eGFP11 ללא קודון עצירה כקטע SalI-BamHI : פריימר N-terminal 5'-AAT TAA CAG TCG ACG ATG GTG AGC AAG GGC GAG G 3' ופריימר C-terminal 5'-AAT ATA TGG ATC CCG CTT GTA CAG CTC CTC GTC GTC CAT GC 3'.
- הכנס מקטע SalI-BamHI זה לאתר השיבוט המרובה של וקטור N1 כדי להציג מקשר RNPPV (חמש חומצות אמינו) בין החלבון הפלואורסצנטי הירוק והאדום.
הערה: מקשר זה מניב יעילות FRET ממוצעת עבור זוג התורמים-מקבלים GFP-Cherry של כ-0.25-0.3 (איור 1A). הבחירה במקשרים קשיחים12 וסליליים13 באורכים משתנים כדי להגדיל את יעילות FRET הנמדדת נדונה במקומות אחרים, אך אינה נדרשת למטרתנו של חלבון ההיתוך. בהמשך לשם הפשטות נקרא לחלבונים הפלואורסצנטיים 'GFP' ו'דובדבן'.
2. תרבית תאים וטרנספקציה
- השתמש בכל קו תאים, למשל, תאי NRK, עבור ניסויי FRET במדיה, למשל, מדיה שונה של Eagle's Media (DMEM) של Dulbecco, ללא אדום פנול, כדי להפחית פלואורסצנטיות רקע. מאותה סיבה, מומלץ להשתמש בטריפסין ללא פנול אדום.
- ברגע שהתאים נפגשים ב-80%, מנתקים תאים עם 1 מ"ל של 0.05% טריפסין-EDTA, סופרים את מספר התאים בתרחיף באמצעות תא נויבאואר וזורעים כ-10,000 תאים לבאר של זכוכית כיסוי בעלת 8 תאים; לחלופין, מתרבית תאים קונפלואנטית שגדלה בבקבוק T25, השתמשו בטיפה אחת של תרחיף תאים מפיפטה של 2 מ"ל או ב-3 טיפות מתרחיף תאים של 5 מ"ל מתרבית מפגש שגדלה בצלוחית של תרבית תאי T 12.5.
- לגדל תאים בתאי 8 בארות (0.8 ס"מ 2 / טוב) עם זכוכית כיסוי #1.0 למיקרוסקופ תאים חיים פלואורסצנטיים בתנאי תרבית תאים סטנדרטיים (37 מעלות צלזיוס ו -5% CO2).
- 24 שעות לאחר ציפוי ההדבקה של התאים באמצעות מדיית טרנספקציה מסחרית מתאימה (ראה טבלת חומרים), עם תערובת GFP, דובדבן, GFP/דובדבן (תערובת 1:1, כלומר 0.8 מיקרוגרם ו-0.8 מיקרוגרם GFP ו-DNA פלסמיד דובדבן), וכימרה GFP-Cherry.
- עבור transfection, להשתמש 5 μL של מגיב transfection ב 45 μL של DMEM ו 1.6 מיקרוגרם של DNA פלסמיד. ערבבו על ידי תנועה עדינה של צינור המיקרוצנטריפוגה.
- לאחר 15 דקות דגירה של התערובת בטמפרטורת החדר, להוסיף 1-2 μL של תערובת מגיב transfection לכל באר של שקופית תא 8 בארות. מחזירים את זכוכית הכיסוי התאית לאינקובטור.
- יש לחלוף 20 שעות לאחר הטרנספקציה לפני הדמיה של תאים חיים, כדי לאפשר ביטוי תקין של חלבון פלואורסצנטי, קיפול והבשלה, במיוחד של הפלואורופור האדום.
3. הדמיית FRET
- תמונה תאים נגועים בתא סביבתי לח ומחומם ב 37 ° C. כדי לאגור את המדיה התאית ב- pH פיזיולוגי, השתמש בגז CO 2 המוגדר לזרימה של 5%, או הוסף HEPES של 20 mM כדי להפוך את המדיה התאית לבלתי תלויה ב- CO2.
- השתמש במיקרוסקופ סריקת לייזר קונפוקלי. הגדר את העירור והפליטה באופן הבא כדי למטב את האות ולמזער דיבור צולב.
- השתמש בקו 488 ננומטר של לייזר יון ארגון כדי לעורר GFP ובלייזר מצב מוצק שאוב דיודה 561 ננומטר (או לייזר הליום ניאון 543 ננומטר, בהתאם לקווי לייזר זמינים) כדי לעורר את Cherry.
- הגדר את הדברים הבאים בתוכנה של מיקרוסקופ קונפוקלי מסחרי. הגדר את המראה הדיכרואית ל- 488/ 561 בלחיצת כפתור באמצעות התפריט הנפתח. לאסוף פלואורסצנטיות באמצעות אור לייזר 488 ננומטר לעירור בערוץ 1 דרך פס פליטה של 505 - 530 ננומטר (או 505 - 550 ננומטר) ובערוץ 2 עם מסנן מעבר ארוך >585 ננומטר ולהשתמש באור לייזר 561 ננומטר לעירור בתעלה 3 עם מסנן מעבר ארוך > 585 ננומטר (הקלד באורכי גל). ניתן להשתמש גם במסנני פסים כגון 590 - 650 ננומטר או דומים שיש להם את היתרון של אי הכללת פיזור ראמאן.
- התרגש עם שני הלייזרים ברצף והגדר את מצב ההדמיה ל - Switch לאחר כל שורה , כך שהעירור של התמונה בגודל 512 x 512 פיקסלים לסירוגין לאחר כל שורה (ולא לאחר כל פריים, מה שיבטל את היכולת לזהות FRET עקב דיפוזיה של החלבונים המסומנים בעת הקלטת התמונות עם עירורים שונים; לחץ על כפתור).
- הגדר סדרה מיני-טיבית של שלוש תמונות בלחיצות לחצן כדי לזהות אם מתרחשת הלבנה משמעותית של הצבעה, ואולי להפחית את עוצמת הלייזר. הלבנה של פחות מ-1% היא אופטימלית. עוצמת לייזר גבוהה יכולה גם להוביל לרוויית ספיגה המפחיתה את יעילות FRET לכאורה14. עוצמת לייזר, עד 10-20 μW הנמדדת בעדשת האובייקט בטוחה לשימוש.
- ראשית, תאי תמונה המבטאים את מבנה ההיתוך GFP-Cherry. הגדר את הפרמטרים המגדירים את עוצמת הלייזר המשולבת בזמן לפיקסל בתמונה קונפוקלית, כלומר, זמן השהייה של הפיקסלים במיקרו-שניות, שידור המסנן האקוסטי-אופטי (AOTF) באחוזים והזום.
- תאים בתמונה המשתמשים במטרה שמן של 63x וזום מוגדר ל- 3x. הדבר מספק הגדלה ורזולוציה מספיקות לתאי תמונה בשלמותם. כוונו לגודל פיקסלים של 70-80 ננומטר.
- הגדר את זמן השהייה של פיקסלים ל- 2-4 μs ושידור AOTF עבור לייזר 488 ננומטר ו- 561 ננומטר, כך שלתמונות יהיה יחס אות לרעש טוב ללא הלבנה וללא פיקסלים המציגים רוויה בעוצמת פלואורסצנטיות. יתרון הוא להתאים את עוצמת הלייזר של 488 ו 561 כך שרמות האות בערוץ 1 ובערוץ 3 יהיו דומות.
- הגדר את הרווח Photomultiplier (מצב ממוצע) ל- 600-800.
- תמונה עם הגדרות אלה 15-20 תאים המבטאים את חלבון ההיתוך GFP-Cherry. 15-20 תאים מספקים נתונים סטטיסטיים טובים תוך שמירה על הזמן הכולל של סשן מדידת FRET מוגבל למספר שעות כדי לסייע להבטיח יציבות של ההגדרה המיקרוסקופית.
- תמונה עם תאי הגדרות זהים המבטאים GFP, Cherry, GFP ו- Cherry ותאים שאינם נגועים. חפשו תאים המבטאים תאים בערוץ הירוק או בערוץ האדום, בהתאמה.
- לאחר מכן, תמונה 15-20 תאים המבטאים במשותף חלבונים בעלי עניין המצומדים ל-GFP ולדובדבן, בהתאמה. בחיפוש אחר תאים מבטאים, הימנעו מחשיפה ארוכה של התאים על מנת לא להלבין את החלבונים הפלואורסצנטיים. לדובדבן יש יציבות אור נמוכה יותר מאשר GFP, והלבנה של צ'רי, המקבל פוגעת בניתוח FET.
הערה: ספקטרום הספיגה והפליטה של GFP ודובדבן מוצג באיור משלים 1. לאחר מדידה של 5-6 שעות, מומלץ לחזור על הדמיה של מספר תאים המבטאים את כימרה GFP-Cherry בסוף ההדמיה כדי לתעד שהמערך נשאר יציב ויעילות FRET של חלבון ההיתוך GFP-Cherry לא השתנתה באופן משמעותי במהלך סשן ההדמיה.
4. ניתוח תמונה לאיתור יעילות FRET מוחלטת באמצעות מרווה של תורמים ופליטה רגישה
הערה: כאן מסופק מדריך מעשי שלב אחר שלב כיצד לקבוע יעילות FRET באמצעות הגיליון האלקטרוני המצורף (קובץ משלים 2). תיאוריה וגזירה של המשוואות המוצגות ניתן למצוא בפירוט בפרסומים קודמים 4,15,16,17. עם ההגדרות המתוארות, נאספות עוצמות הפלואורסצנטיות הבאות.
- מדוד את אות התורם I 1 בערוץ 1, ערוץ התורם, עם עירור 488 ננומטר ורצועת פליטה של 505-530 ננומטר.
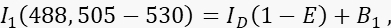
כאשר ID הוא אות התורם הבלתי מרוווה בערוץ 1 שיימדד בהיעדר מקבל, הוא יעילות FRET הממוצעת, ו- B 1 אות הרקע הממוצע בערוץ 1. - מדוד את אות המקבל I 3 בערוץ 3, ערוץ המקבל, עם עירור ופליטה של 561 ננומטר ב- >585 ננומטר.
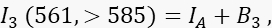
כאשר IA הוא אות הקבלה ו-B 3 הוא הרקע בערוץ 3. - מדוד את אות FRET בערוץ 2, ערוץ ההעברה, עם עירור ופליטה של 488 ננומטר ב- >585 ננומטר.
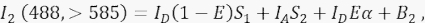
כאשר, האות בערוץ 2 הוא סכום של ארבעה מרכיבים שונים: (i) I D(1 - E)S 1 הוא הזליגה הספקטרלית מהאות התורם המרווה לערוץ הגילוי >585 (עם גורם הדיבור הצולב S 1), (ii) IA S 2 הוא האות המקבל מהעירור הישיר על ידי אור 488 ננומטר (עם גורם הדיבור הצולב S2), (iii) IDEα הוא הפליטה הרגישה של המקבל על ידי FRET ממולקולת התורם הנרגש (α יפורט בהמשך 4.8 - 4.10.), ו- (iv) B2 הוא אות הרקע. - למדוד עוצמות רקע ממוצעות בתעלות 1, 2, 3 בתאים שאינם נגועים או מדומים; כל אחד מהם בסדר עם הבדל זניח. עבור כל מדידות התא, השתמש בכלי יד חופשית כדי לתחום אזורי עניין ולהימנע משלפוחיות פרי-גרעיניות עם אוטופלואורסצנטיות מוגברת. חשוב להימנע autofluorescence משמעותי מן שלפוחיות perinuclear אלה.
- הזן את המידות בעמודות X, Y ו- Z של הגיליון האלקטרוני שסופק. עוצמות הרקע הממוצעות בשלושת הערוצים מוזנות ל- A2, B2 ו- C2 של הגיליון האלקטרוני של Excel (קובץ משלים 2).
- מדדו עוצמות ממוצעות בתעלות 1, 2, 3 של תאים המבטאים GFP או דובדבן בלבד, והזינו את המדידות לעמודות C, D, E ו-N, O, P. עוצמות הרקע המתאימות מופחתות (ב-F, G, H ו-Q, R, S).
- על מנת לחשב E, יעילות FRET, לקבוע את גורמי הדיבור הצולבות S 1 ו- S2. גורם הדיבור הצולבות הספקטרלי S1 מחושב מתאים המבטאים GFP בלבד
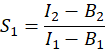
בעמודה I. הזן את הערך הממוצע עבור S1 בתא D2 בגיליון האלקטרוני של Excel. - חישוב פקטור הדיבור הצולב-ספקטרלי S2 מתאים המבטאים רק דובדבן
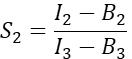
בעמודה T. הזן את הממוצע עבור S2 בתא E2 בגיליון האלקטרוני של Excel. - ודא שגורם α מקשר את האות מכל מספר נתון של מולקולות GFP מעוררות בערוץ 1 לאות של מספר שווה של מולקולות דובדבן מעוררות בערוץ 2, ומוגדר על ידי
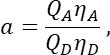

כאשר Q A ו-Q D הם התשואות הקוונטיות הפלואורסצנטיות של Cherry ו-GFP; ηA ו-ηD יעילות הזיהוי של פלואורסצנטיות של מקבל ותורם בתעלות 2 ו-1, בהתאמה.
הערה: ניתן לקבוע את גורם α משתי דגימות המבטאות כמויות מוחלטות ידועות של GFP ודובדבן. עם זאת, אי אפשר לדעת את הכמות המדויקת של GFP ודובדבן המבוטאים בתא. לכן, חישבנו את הגורם באמצעות תאים המבטאים את חלבון ההיתוך GFP-Cherry. כאן, בעוד שהכמות האבסולוטית עדיין אינה ידועה, היחס בין מולקולות התורם והמקבל ידוע כאחד. - מדדו עוצמות ממוצעות בתעלות 1, 2, 3 של תאים המבטאים את חלבון ההיתוך GFP-Cherry, והזינו את המדידות לעמודות AE, AF, AG. עוצמות הרקע מופחתות (ב- AH, AI, AJ).
- חשב את גורם α (עמודת AJ) מעוצמות הפלואורסצנטיות בערוץ 1, 2 ו- 3 של חלבון היתוך GFP-Cherry באופן הבא:
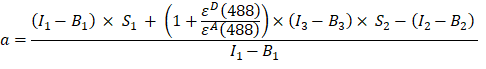
- עוצמות מתוקנות רקע שנמדדו בערוץ 1 (I 1 - B 1), 2 (I 2 - B 2) ו- 3 (I 3 - B3), בהתאמה, נמדדות באמצעות כימרה GFP-Cherry. גורם הדיבור הצולבות הספקטרלי S1 נקבע באמצעות תאים המבטאים GFP בלבד (ראה 4.7). εD ו-ε A הם מקדמי ההכחדה של GFP, התורם, וצ'רי, המקבל, ב-488 ננומטר, וניתן לקבוע אותם מהספרות (ε GFP = 53,000 M-1 cm-1)18 ועקומת הספיגה של דובדבן (εCherry ≈ 5560 M-1cm 1). היחס
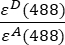 הוזן בתא G2 של הגיליון האלקטרוני של Excel. הזן את הערך הממוצע של גורם α ב- J2.
הוזן בתא G2 של הגיליון האלקטרוני של Excel. הזן את הערך הממוצע של גורם α ב- J2. - השתמש בגורם α שנקבע לחישוב יעילות FET, E, באופן הבא (עמודה AK):
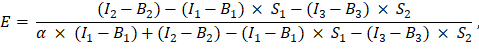
- לחלופין, קבע יעילות FET, E, עבור הבקרות השליליות, כלומר, הביטוי המשותף של GFP ו- Cherry והביטוי של GFP בלבד על ידי הוספת המדידות של ערוצים 1, 2 ו- 3 בגיליון האקסל בעמודה AD, AE ו- AF תחת מדידות חלבון היתוך GFP-Cherry. לקבוע יעילות FRET בין GFP וחלבונים מסומנים דובדבן של עניין באותו אופן.
- לקבוע את עוצמת התורם הבלתי מרווה, I D כמו (I 1 - B 1)/(1 - E), ואת עוצמת המקבל כמו I A = I 3 - B3; ערכים אלה פרופורציונליים לרמות הביטוי של החלבונים המתויגים.
- קבע את יחס עוצמת המקבל לתורם המתוקן (Q) של חלבון היתוך GFP-Cherry באופן הבא (עמודה AL):

- עבור תאים אחרים שעברו טרנסבקציה משותפת, חשב את היחס המולקולרי בין מקבל לתורם N A/ND באופן הבא:
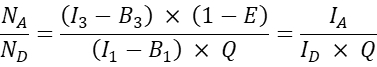
הערה: הרציונל לקבוע את יחס N A/N D ולשרטט את יעילות ה-FRET התאית הממוצעת E לעומת N A/N D, הוא שמולקולה תורמת אחת יכולה להעביר אנרגיה למספר מקבלים בעוד שמולקולה מקבלת יכולה לקבל אנרגיה רק מתורם אחד בזמן נתון. גם אם רק מקבל אחד יכול לקיים אינטראקציה עם תורם בגלל הסטויכיומטריה של האינטראקציה, עלייה בריכוז המקבל צפויה להגדיל את שיעור התורמים המורכבים עם המקבל בגלל חוק הפעולה ההמונית. לכן, עבור טווח קבוע (או צר של) ביטוי תורם, יעילות FRET צריכה לעלות עם הגדלת N A/ND. כאשר משרטטים את יעילות FRET E לעומת N A/N D עבור הביטוי המשותף של GFP ו- Cherry, כלומר הבדיקה השלילית, עם זאת, עלייה ב- N A/N D לא אמורה לגרום לעלייה ביעילות FRET (לפחות בריכוזי קבלה נמוכים מספיק שבהם FRET אקראי עקב קרבת צבעים מקובלים לצבעי תורם אינו מתרחש).
Access restricted. Please log in or start a trial to view this content.
תוצאות
איור 1 מציג את התמונות שהתקבלו בערוץ התורם, ערוץ 1 (488, 505-530 ננומטר), ערוץ ההעברה, ערוץ 2 (488, >585 ננומטר) וערוץ המקבל, ערוץ 3 (561, >585 ננומטר), בהתאמה. תמונות מייצגות של תאים המבטאים GFP בלבד, דובדבן בלבד, המבטאים במשותף GFP ודובדבן, ומבטאים את חלבון ההיתוך GFP-Cherry. יעילות ?...
Access restricted. Please log in or start a trial to view this content.
Discussion
הפרוטוקול המוצג מפרט את השימוש בבדיקת כיול חלבון פלואורסצנטי מצומד גנטית אחד לאחד לכימות FRET באמצעות זיהוי פליטה רגישה של המקבל ומרווה של מולקולת התורם על ידי מיקרוסקופ קונפוקלי. שיטה זו יכולה להיות מיושמת כדי להעריך אינטראקציות חלבונים בהקשר הפיזיולוגי של התא החי בתאים תת-תאיים שונים. נ?...
Access restricted. Please log in or start a trial to view this content.
Disclosures
למחברים אין מה לחשוף.
Acknowledgements
ברצוננו להודות לשירות הדימות של מדעי המוח בבית הספר לרפואה של אוניברסיטת סטנפורד על אספקת ציוד ומקום לפרויקט זה. מחקר זה נתמך על ידי מימון פנימי של מכון הסרטן של סטנפורד והחטיבה האונקולוגית הגינקולוגית בסטנפורד, כמו גם GINOP-2.3.2-15-2016-00026, GINOP-2.3.3-15-2016-00030, NN129371, ANN135107 מהמשרד הלאומי למחקר, פיתוח וחדשנות, הונגריה.
Access restricted. Please log in or start a trial to view this content.
Materials
| Name | Company | Catalog Number | Comments |
| 0.5% Trypsin-EDTA without phenol red (10x) | Thermo Fisher Scientific | 15400054 | |
| Clontech mCherry N1 vector | Addgene | 3553 | |
| DMEM without phenol red | Thermo Fisher Scientific | 11054020 | |
| Fugene 6 | Promega | E2691 | |
| HEPES | Thermo Fisher Scientific | 15630080 | |
| LabTek 8-well chambers #1.0 | Thermo Fisher Scientific | 12565470 | |
| L-Glutamine (200 mM) | Thermo Fisher Scientific | 25030081 |
References
- Förster, T. Zwischenmolekulare Energiewanderung und Fluoreszenz. Annal der Physik. 437, 55-75 (1948).
- Jovin, T. M., Arndt-Jovin, D. J. Luminescence digital imaging microscopy. Annual Review of Biophysics and Biophysical Chemistry. 18, 271-308 (1989).
- Mekler, V. M. A photochemical technique to enhance sensitivity of detection of fluorescence resonance energy transfer. Photochemistry and Photobiology. 59, 615-620 (1994).
- Vamosi, G., et al. Conformation of the c-Fos/c-Jun complex in vivo: A combined FRET, FCCS, and MD-modeling study. Biophysical Journal. 94 (7), 2859-2868 (2008).
- Renz, M., Daniels, B. R., Vamosi, G., Arias, I. M., Lippincott-Schwartz, J. Plasticity of the asialoglycoprotein receptor deciphered by ensemble FRET imaging and single-molecule counting PALM imaging. Proceedings of the National Academy of Science U. S. A. 109 (44), 2989-2997 (2012).
- van Rheenen, J., Langeslag, M., Jalink, K. Correcting confocal acquisition to optimize imaging of fluorescence resonance energy transfer by sensitized emission. Biophysical Journal. 86 (4), 2517-2529 (2004).
- Muller, S. M., Galliardt, H., Schneider, J., Barisas, B. G., Seidel, T. Quantification of Forster resonance energy transfer by monitoring sensitized emission in living plant cells. Frontiers in Plant Sciences. 4, 413(2013).
- Gates, E. M., LaCroix, A. S., Rothenberg, K. E., Hoffman, B. D. Improving quality, reproducibility, and usability of FRET-based tension sensors. Cytometry Part A. 95 (2), 201-213 (2019).
- Menaesse, A., et al. Simplified instrument calibration for wide-field fluorescence resonance energy transfer (FRET) measured by the sensitized emission method. Cytometry Part A. , 24194(2020).
- Shaner, N. C., et al. Improved monomeric red, orange and yellow fluorescent proteins derived from Discosoma sp. red fluorescent protein. Nature Biotechnology. 22 (12), 1567-1572 (2004).
- Cormack, B. P., Valdivia, R. H., Falkow, S. FACS-optimized mutants of the green fluorescent protein (GFP). Gene. 173, 1 Spec No 33-38 (1996).
- Nagy, P., et al. Novel calibration method for flow cytometric fluorescence resonance energy transfer measurements between visible fluorescent proteins. Cytometry Part A. 67 (2), 86-96 (2005).
- Arai, R., Ueda, H., Kitayama, A., Kamiya, N., Nagamune, T. Design of the linkers which effectively separate domains of a bifunctional fusion protein. Protein Engineering. 14 (8), 529-532 (2001).
- Szendi-Szatmari, T., Szabo, A., Szollosi, J., Nagy, P. Reducing the detrimental effects of saturation phenomena in FRET microscopy. Analytical Chemistry. 91 (9), 6378-6382 (2019).
- Tron, L., et al. Flow cytometric measurement of fluorescence resonance energy transfer on cell surfaces. Quantitative evaluation of the transfer efficiency on a cell-by-cell basis. Biophysical Journal. 45 (5), 939-946 (1984).
- Sebestyen, Z., et al. Long wavelength fluorophores and cell-by-cell correction for autofluorescence significantly improves the accuracy of flow cytometric energy transfer measurements on a dual-laser benchtop flow cytometer. Cytometry. 48 (3), 124-135 (2002).
- Szaloki, N., et al. High throughput FRET analysis of protein-protein interactions by slide-based imaging laser scanning cytometry. Cytometry Part A. 83 (9), 818-829 (2013).
- McRae, S. R., Brown, C. L., Bushell, G. R. Rapid purification of EGFP, EYFP, and ECFP with high yield and purity. Protein Expression and Purification. 41 (1), 121-127 (2005).
- Kremers, G. J., Goedhart, J., van Munster, E. B., Gadella, T. W. Cyan and yellow super fluorescent proteins with improved brightness, protein folding, and FRET Forster radius. Biochemistry. 45 (21), 6570-6580 (2006).
- Bajar, B. T., Wang, E. S., Zhang, S., Lin, M. Z., Chu, J. A Guide to Fluorescent Protein FRET Pairs. Sensors (Basel). 16 (9), (2016).
- Scott, B. L., Hoppe, A. D. Optimizing fluorescent protein trios for 3-Way FRET imaging of protein interactions in living cells. Science Reports. 5, 10270(2015).
- Chen, Y. C., Spring, B. Q., Clegg, R. M. Fluorescence lifetime imaging comes of age how to do it and how to interpret it. Methods Molecular Biology. 875, 1-22 (2012).
- King, C., Sarabipour, S., Byrne, P., Leahy, D. J., Hristova, K. The FRET signatures of noninteracting proteins in membranes: Simulations and experiments. Biophysical Journal. 106 (6), 1309-1317 (2014).
Access restricted. Please log in or start a trial to view this content.
Erratum
Formal Correction: Erratum: Assessing Protein Interactions in Live-Cells with FRET-Sensitized Emission
Posted by JoVE Editors on 3/14/2023. Citeable Link.
An erratum was issued for: Assessing Protein Interactions in Live-Cells with FRET-Sensitized Emission. The Authors section was updated from:
György Vámosi1
Sarah Miller2
Molika Sinha2
Gabor Mocsár1
Malte Renz2
1Department of Biophysics and Cell Biology, Faculty of Medicine, University of Debrecen
2Gynecologic Oncology Division, Stanford University School of Medicine
to:
György Vámosi1
Sarah Miller2
Molika Sinha2
Maria Kristha Fernandez2
Gabor Mocsár1
Malte Renz2
1Department of Biophysics and Cell Biology, Faculty of Medicine, University of Debrecen
2Gynecologic Oncology Division, Stanford University School of Medicine
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved