Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Évaluation des interactions protéiques dans les cellules vivantes avec émission sensibilisée au FRET
Dans cet article
Erratum Notice
Résumé
Le transfert d’énergie par résonance de Förster (FRET) entre deux molécules de fluorophore peut être utilisé pour étudier les interactions protéiques dans la cellule vivante. Ici, un protocole est fourni sur la façon de mesurer FRET dans les cellules vivantes en détectant l’émission sensibilisée de l’accepteur et la trempe de la molécule donneuse à l’aide de la microscopie confocale à balayage laser.
Résumé
Le transfert d’énergie par résonance de Förster (FRET) est le transfert d’énergie sans rayonnement d’un donneur excité à une molécule acceptrice et dépend de la distance et de l’orientation des molécules ainsi que de l’étendue du chevauchement entre les spectres d’émission du donneur et d’absorption de l’accepteur. FRET permet d’étudier l’interaction des protéines dans la cellule vivante au fil du temps et dans différents compartiments subcellulaires. Différents algorithmes basés sur l’intensité pour mesurer FRET à l’aide de la microscopie ont été décrits dans la littérature. Ici, un protocole et un algorithme sont fournis pour quantifier l’efficacité FRET basée sur la mesure à la fois de l’émission sensibilisée de l’accepteur et de la trempe de la molécule donneuse. La quantification du FRET ratiométrique dans la cellule vivante nécessite non seulement la détermination de la diaphonie (débordement spectral, ou bleed-through) des protéines fluorescentes, mais aussi l’efficacité de détection de la configuration microscopique. Le protocole fourni ici détaille comment évaluer ces paramètres critiques.
Introduction
L’analyse par microscopie du transfert d’énergie par résonance de Förster (FRET) permet d’évaluer les interactions entre les protéines dans les cellules vivantes. Il fournit des informations spatiales et temporelles, y compris des informations sur l’endroit de la cellule et dans quel compartiment subcellulaire l’interaction a lieu et si cette interaction change au fil du temps.
Theodor Förster a posé les bases théoriques du FRET en 19481. FRET est un transfert d’énergie sans rayonnement d’un donneur excité à une molécule acceptrice et dépend de la distance des molécules et de l’orientation relative de leurs dipôles de transition ainsi que du chevauchement entre les spectres d’émission donneuse et d’absorption accepteur. Le taux de transfert d’énergie est inversement proportionnel à la sixième puissance de la distance donneur-accepteur. Ainsi, FRET peut être utilisé pour mesurer la proximité moléculaire dans la gamme de 1-10 nm.
FRET entre en compétition avec d’autres processus de désexcitation de la molécule donneuse et entraîne l’émission dite de trempe du donneur et sensibilisée de l’accepteur. La trempe du donneur est une réduction du nombre de photons donneurs émis, tandis que l’émission sensibilisée est une augmentation des photons accepteurs émis. De nombreuses analyses microscopiques FRET utilisent des mesures d’intensité de fluorescence, y compris le photoblanchiment accepteur 2, le photoblanchiment donneur2 ou le photoblanchiment sensible au FRET de l’accepteur3.
Ici, un protocole expérimental étape par étape et un algorithme mathématique sont présentés pour quantifier FRET en utilisant la trempe du donneur et l’émission sensibilisée par accepteur4,5, une méthode souvent appelée FRET ratiométrique. De nombreux protocoles sur la façon d’approximer les émissions sensibilisées ont été publiés, peu ont quantifié l’efficacité absoluedu FRET 6,7,8,9. La quantification des rendements FRET dans la cellule vivante nécessite de déterminer (i) la diaphonie (débordement spectral, ou bleed-through) des protéines fluorescentes et, également (ii) l’efficacité de détection de la configuration microscopique. Alors que la diaphonie peut être évaluée en imageant des cellules exprimant un seul des fluorophores, l’évaluation de l’efficacité relative de détection de la fluorescence donneuse et acceptrice est plus compliquée. Elle nécessite de connaître au moins le rapport entre le nombre de molécules donneuses et acceptrices donnant lieu aux signaux mesurés. Le nombre de fluorophores exprimés dans les cellules vivantes varie cependant d’une cellule à l’autre et est inconnu. Le facteur dit α caractérise les forces relatives du signal d’une seule molécule donneuse et acceptrice excitée. La connaissance du facteur est une condition préalable aux mesures quantitatives ratiométriques FRET dans des échantillons présentant des rapports de molécules accepteur/donneur variables, comme lors de l’imagerie de cellules vivantes avec des protéines fluorescentes. L’utilisation d’une protéine de fusion donneur-accepteur 1 pour 1 comme sonde d’étalonnage permet de déterminer le facteur α et sert également de contrôle positif. Cette sonde génétiquement couplée est exprimée par des cellules en quantités totales inconnues, mais dans une quantité relative fixe et connue de un à un. Le protocole suivant explique comment construire la sonde 1-to-1 et comment l’utiliser pour quantifier l’efficacité FRET. Une feuille de calcul qui comprend toutes les formules peut être trouvée dans le supplément et peut être utilisée par les lecteurs pour entrer leurs propres mesures dans les colonnes respectives comme indiqué ci-dessous.
Bien que le protocole utilise la paire donneur / accepteur GFP-Cherry, l’approche présentée peut être réalisée avec n’importe quelle autre paire FRET. Le dossier supplémentaire 1 fournit des détails sur les paires cyan-jaune.
Access restricted. Please log in or start a trial to view this content.
Protocole
1. Construction plasmidique
- Pour générer la sonde de fusion eGFP-mCherry1, utiliser un vecteur d’expression cellulaire de mammifère N1 (voir le tableau des matériaux) avec mCherry110 inséré à l’aide des sites de restriction AgeI et BsrGI.
- Utiliser les oligonucléotides suivants pour amplifier eGFP11 sans codon stop comme fragment SalI-BamHI : amorce N-terminale 5'-AAT TAA CAG TCG ACG ATG GTG AGC AAG GGC GAG G 3' et amorce C-terminale 5'-AAT ATA TGG ATC CCG CTT GTA CAG CTC GTC CAT GC 3'.
- Insérez ce fragment SalI-BamHI dans le site de clonage multiple du vecteur N1 pour introduire un liant RNPPV (cinq acides aminés) entre la protéine fluorescente verte et rouge.
REMARQUE : Cet agent de liaison donne une efficacité FRET moyenne pour la paire donneur-accepteur GFP-Cherry d’environ 0,25 -0,3 (Figure 1A). Le choix de liants rigides12 et hélicoïdaux13 de longueurs variables pour mettre à l’échelle les efficacités FRET mesurées a été discuté ailleurs, mais n’est pas nécessaire pour notre objectif de la protéine de fusion. À l’avenir, pour plus de simplicité, nous appellerons les protéines fluorescentes « GFP » et « Cherry ».
2. Culture cellulaire et transfection
- Utiliser n’importe quelle lignée cellulaire, par exemple les cellules NRK, pour les expériences FRET dans les milieux, par exemple, le milieu d’Eagle modifié de Dulbecco (DMEM), sans rouge de phénol, pour réduire la fluorescence de fond. Pour la même raison, l’utilisation de trypsine sans rouge de phénol est conseillée.
- Une fois que les cellules sont confluentes à 80 %, détacher les cellules contenant 1 mL de trypsine-EDTA à 0,05 %, compter le nombre de cellules en suspension à l’aide d’une chambre de Neubauer et ensemencer environ 10 000 cellules par puits d’un verre de couverture chambré à 8 puits; sinon, à partir d’une culture cellulaire confluente cultivée dans un flacon T25, utiliser 1 goutte de suspension cellulaire provenant d’une pipette de 2 ml ou 3 gouttes d’une suspension cellulaire de 5 ml provenant d’une culture confluente cultivée dans un flacon de culture T 12,5.
- Cultiver des cellules dans des chambres à 8 puits (0,8 cm 2 / puits) avec du verre de couverture #1.0 pour la microscopie de cellules vivantes à fluorescence dans des conditions de culture cellulaire standard (37 ° C et 5% CO2).
- 24 h après le placage, transfecter les cellules à l’aide d’un milieu de transfection approprié disponible dans le commerce (voir le tableau des matières), avec le mélange GFP, Cherry, GFP/Cherry (mélange 1:1, c.-à-d. 0,8 μg et 0,8 μg GFP et ADN plasmidique de cerise), et la chimère GFP-Cerise.
- Pour la transfection, utiliser 5 μL du réactif de transfection dans 45 μL de DMEM et 1,6 μg d’ADN plasmidique. Remuer en agitant doucement le tube de microcentrifugeuse.
- Après 15 minutes d’incubation du mélange à température ambiante, ajouter 1-2 μL du mélange de réactifs de transfection à chaque puits de la lame de chambre à 8 puits. Remettez le verre de couvercle chambré dans l’incubateur.
- Soit 20 heures après la transfection avant l’imagerie des cellules vivantes, pour permettre une expression, un repliement et une maturation appropriés des protéines fluorescentes, en particulier du fluorophore rouge.
3. Imagerie FRET
- Image transfectée de cellules dans une chambre environnementale humidifiée et chauffée à 37 °C. Pour tamponner le milieu cellulaire à un pH physiologique, utilisez du gaz CO 2 réglé sur un débit de 5 % ou ajoutez 20 mM d’HEPES pour rendre le milieu cellulaire indépendant du CO2.
- Utilisez un microscope confocal à balayage laser. Réglez l’excitation et l’émission comme suit pour optimiser le signal et minimiser la diaphonie.
- Utilisez la ligne 488 nm du laser argon ionique pour exciter le GFP et le laser à semi-conducteurs pompé par diode 561 nm (ou le laser hélium néon de 543 nm, selon les lignes laser disponibles) pour exciter Cherry.
- Définissez ce qui suit dans le logiciel d’un microscope confocal commercial. Réglez le miroir dichroïque sur 488/561 en cliquant sur un bouton à l’aide du menu déroulant. Recueillir la fluorescence à l’aide d’une lumière laser de 488 nm pour l’excitation dans le canal 1 à travers une bande d’émission de 505 - 530 nm (ou 505 - 550 nm) et dans le canal 2 avec un filtre passe-long >585 nm et utiliser la lumière laser 561 nm pour l’excitation dans le canal 3 avec un filtre passe-long > 585 nm (type longueurs d’onde). Des filtres passe-bande par exemple 590 - 650 nm ou similaires peuvent également être utilisés, ce qui présente l’avantage d’exclure la diffusion Raman.
- Excitez avec les deux lasers séquentiellement et réglez le mode d’imagerie sur Switch après chaque ligne afin que l’excitation de l’image de 512 x 512 pixels alterne après chaque ligne (et non après chaque image, ce qui abrogerait la capacité de détecter FRET en raison de la diffusion des protéines marquées lors de l’enregistrement des images avec différentes excitations; clic sur le bouton).
- Configurez une mini-série chronologique de trois images en cliquant sur des boutons pour détecter si un photoblanchiment important se produit et potentiellement réduire la puissance du laser. Un photoblanchiment inférieur à 1% est optimal. Une intensité laser élevée peut également entraîner une saturation de l’absorption réduisant l’efficacité apparente du FRET14. La puissance laser, jusqu’à 10-20 μW mesurée à la lentille de l’objectif est sûre à utiliser.
- Tout d’abord, les cellules d’image exprimant la construction de fusion GFP-Cherry. Définissez les paramètres qui définissent l’intensité laser intégrée dans le temps par pixel dans une image confocale, c’est-à-dire le temps de séjour des pixels en microsecondes, la transmission du filtre accordable acousto-optique (AOTF) en pourcentage et le zoom.
- Imagez les cellules à l’aide d’un objectif d’huile 63x et d’un zoom réglé sur 3x. Cela fournit un grossissement et une résolution suffisants pour imager les cellules dans leur intégralité. Visez une taille de pixel de 70 à 80 nm.
- Réglez le temps de séjour des pixels sur 2-4 μs et la transmission AOTF pour les lasers 488 nm et 561 nm de sorte que les images aient un bon rapport signal sur bruit sans blanchiment et sans pixels montrant une saturation de l’intensité de fluorescence. Il est avantageux d’ajuster la puissance laser de 488 et 561 de manière à ce que les niveaux de signal dans les canaux 1 et 3 soient similaires.
- Réglez le gain du photomultiplicateur (mode de moyenne) sur 600-800.
- Image avec ces paramètres 15-20 cellules exprimant la protéine de fusion GFP-Cerise. 15-20 cellules fournissent de bonnes statistiques tout en limitant la durée totale d’une session de mesure FRET à quelques heures pour aider à assurer la stabilité de la configuration microscopique.
- Image avec les mêmes cellules de paramètres exprimant GFP, Cherry, GFP et Cherry et cellules non transfectées. Recherchez les cellules exprimant dans le canal vert ou le canal rouge, respectivement.
- Ensuite, imagez 15 à 20 cellules co-exprimant des protéines d’intérêt couplées à la GFP et à la cerise, respectivement. En recherchant des cellules exprimantes, évitez une longue exposition des cellules afin de ne pas blanchir les protéines fluorescentes. Cherry a une photostabilité inférieure à GFP, et blanchissant Cherry, l’accepteur compromet l’analyse FRET.
NOTA: Les spectres d’absorption et d’émission de la GFP et de la cerise sont indiqués à la figure supplémentaire 1. Après avoir mesuré pendant 5-6 h, il est conseillé de répéter l’imagerie de quelques cellules exprimant la chimère GFP-Cherry à la fin de la séance d’imagerie pour documenter que la configuration est restée stable et détectée Les efficacités FRET de la protéine de fusion GFP-Cherry n’ont pas changé de manière significative au cours d’une séance d’imagerie.
4. Analyse d’images pour détecter les efficacités absolues du FRET à l’aide de la trempe du donneur et de l’émission sensibilisée
REMARQUE : Ici, un guide pratique étape par étape sur la façon de déterminer l’efficacité du FRET à l’aide de la feuille de calcul ci-jointe (fichier supplémentaire 2) est fourni. La théorie et la dérivation des équations présentées peuvent être trouvées en détail dans les publications précédentes 4,15,16,17. Avec les réglages décrits, les intensités de fluorescence suivantes sont collectées.
- Mesurer le signal émetteur I 1 dans le canal 1, le canal donneur, avec une excitation de 488 nm et une bande d’émission de 505-530 nm.
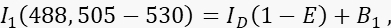
où ID est le signal donneur non éteint dans le canal 1 qui serait mesuré en l’absence d’accepteur, est l’efficacité FRET moyenne, et B 1 le signal de fond moyen dans le canal 1. - Mesurer le signal accepteur I 3 dans le canal 3, le canal accepteur, avec une excitation et une émission de 561 nm à >585 nm.
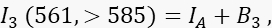
où IA est le signal accepteur et B 3 l’arrière-plan dans le canal 3. - Mesurez le signal FRET dans le canal 2, le canal de transfert, avec une excitation et une émission de 488 nm à >585 nm.
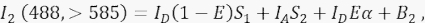
Où le signal du canal 2 est une somme de quatre composantes différentes: (i) I D(1 - E)S 1 est le débordement spectral du signal donneur éteint dans le canal de détection >585 (avec le facteur de diaphonie S 1), (ii) IA S 2 est le signal accepteur de l’excitation directe par une lumière de 488 nm (avec le facteur de diaphonie S2), (iii) IDEα est l’émission sensibilisée de l’accepteur par FRET à partir de la molécule donneuse excitée (α sera détaillée plus en détail aux points 4.8. - 4.10.), et (iv) B2 est le signal de fond. - Mesurer les intensités de fond moyennes dans les canaux 1, 2, 3 dans les cellules non transfectées ou simulées; L’un ou l’autre est bien avec une différence négligeable. Pour toutes les mesures cellulaires, utilisez l’outil à main levée pour délimiter les régions d’intérêt et éviter les vésicules périnucléaires avec une autofluorescence accrue. Il est important d’éviter une autofluorescence importante de ces vésicules périnucléaires.
- Entrez les mesures dans les colonnes X, Y et Z de la feuille de calcul fournie. Les intensités de fond moyennes dans les 3 canaux sont entrées dans A2, B2 et C2 de la feuille de calcul Excel (fichier supplémentaire 2).
- Mesurez les intensités moyennes dans les canaux 1, 2, 3 des cellules exprimant la GFP ou Cherry seul, et entrez les mesures dans les colonnes C, D, E et N, O, P. Les intensités de fond respectives sont soustraites (en F, G, H et Q, R, S).
- Afin de calculer E, l’efficacité FRET, déterminer les facteurs de diaphonie S 1 et S2. Le facteur de diaphonie spectrale S1 est calculé à partir de cellules exprimant uniquement la GFP
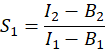
dans la colonne I. Entrez la valeur moyenne de S1 dans la cellule D2 de la feuille de calcul Excel. - Calculer le facteur de diaphonie spectrale S2 à partir de cellules exprimant uniquement Cherry
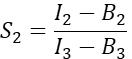
dans la colonne T. Entrez la moyenne de S2 dans la cellule E2 de la feuille de calcul Excel. - S’assurer que le facteur α relie le signal d’un nombre donné de molécules GFP excitées dans le canal 1 au signal d’un nombre égal de molécules de cerise excitées dans le canal 2, et est défini par
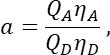

où Q A et QD sont les rendements quantiques de fluorescence de Cherry et GFP; ηA et ηD les efficacités de détection de la fluorescence de l’accepteur et du donneur dans les canaux 2 et 1, respectivement.
REMARQUE : Le facteur α a pu être déterminé à partir de deux échantillons exprimant des quantités absolues connues de GFP et de cerise. Il est cependant impossible de connaître la quantité exacte de GFP et de Cherry exprimée dans une cellule. Par conséquent, nous avons calculé le facteur en utilisant des cellules qui expriment la protéine de fusion GFP-Cerise. Ici, alors que la quantité absolue est encore inconnue, le rapport entre les molécules donneuses et acceptrices est connu pour être un. - Mesurer les intensités moyennes dans les canaux 1, 2, 3 des cellules exprimant la protéine de fusion GFP-Cherry, et entrer les mesures dans les colonnes AE, AF, AG. Les intensités de fond sont soustraites (en AH, AI, AJ).
- Calculer le facteur α (colonne AJ) à partir des intensités de fluorescence dans les canaux 1, 2 et 3 de la protéine de fusion GFP-Cherry comme suit :
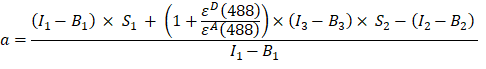
- Les intensités corrigées du bruit de fond mesurées dans les canaux 1 (I 1 - B 1), 2 (I 2 - B 2) et 3 (I 3 - B3), respectivement, sont mesurées à l’aide de la chimère GFP-Cerise. Le facteur de diaphonie spectrale S1 a été déterminé en utilisant uniquement des cellules exprimant la GFP (voir 4.7.). εD et ε A sont les coefficients d’extinction de la GFP, le donneur, et de Cherry, l’accepteur, à 488 nm, et peuvent être déterminés à partir de la littérature (ε GFP = 53 000 M-1 cm-1)18 et de la courbe d’absorption de Cherry (εCherry ≈ 5560 M-1cm 1). Le ratio
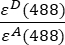 a été entré dans la cellule G2 de la feuille de calcul Excel. Entrez la valeur moyenne du facteur α dans J2.
a été entré dans la cellule G2 de la feuille de calcul Excel. Entrez la valeur moyenne du facteur α dans J2. - Utiliser le facteur α déterminé pour le calcul du rendement FRET, E, comme suit (colonne AK):
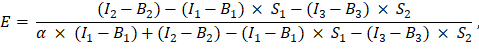
- Vous pouvez également déterminer l’efficacité FRET, E, pour les témoins négatifs, c’est-à-dire la co-expression de la GFP et de Cherry et l’expression de la GFP seule en ajoutant les mesures des canaux 1, 2 et 3 dans la feuille Excel dans les colonnes AD, AE et AF sous les mesures de la protéine de fusion GFP-Cherry. Déterminer l’efficacité FRET entre les protéines d’intérêt marquées GFP et Cherry de la même manière.
- Déterminer l’intensité non éteinte du donneur, I D comme (I 1 - B 1)/(1 - E), et l’intensité accepteur comme I A = I 3 - B3; Ces valeurs sont proportionnelles aux niveaux d’expression des protéines marquées.
- Déterminer le rapport d’intensité accepteur-donneur (Q) corrigé de la protéine de fusion GFP-Cherry comme suit (colonne AL) :

- Pour les autres cellules co-transfectées, calculer le rapport moléculaire accepteur/donneur N A/ND comme suit :
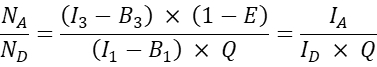
NOTE: La justification pour déterminer le rapport N A / N D et tracer l’efficacité moyenne du FRET cellulaire E par rapport à N A / N D, est qu’une molécule donneuse peut transférer de l’énergie à plusieurs accepteurs alors qu’une molécule acceptrice ne peut recevoir de l’énergie que d’un donneur à un moment donné. Même si un seul accepteur peut interagir avec un donneur en raison de la stœchiométrie de l’interaction, une augmentation de la concentration de l’accepteur devrait augmenter la fraction de donneurs en complexe avec l’accepteur en raison de la loi de l’action de masse. Ainsi, pour une expression donneuse fixe (ou étroite), l’efficacité FRET devrait augmenter avec l’augmentation de N A/ND. Lors du tracé de l’efficacité FRET E par rapport à N A/N D pour la co-expression de la GFP et de la cerise, c’est-à-dire la sonde négative, cependant, une augmentation de N A/N D ne devrait pas entraîner une augmentation de l’efficacité FRET (au moins à des concentrations d’accepteur suffisamment faibles où il n’y a pas de FRET aléatoire due à la proximité des colorants accepteurs avec les colorants donneurs).
Access restricted. Please log in or start a trial to view this content.
Résultats
La figure 1 montre les images obtenues respectivement dans le canal donneur, canal 1 (488, 505-530 nm), le canal de transfert, canal 2 (488, >585 nm) et le canal accepteur, canal 3 (561, >585 nm). Images représentatives de cellules exprimant uniquement la GFP, la cerise uniquement, co-exprimant la GFP et la cerise, et exprimant la protéine de fusion GFP-Cherry. Les efficacités cellulaires moyennes du FRET calculées dans les cellules NRK exprimant la prot?...
Access restricted. Please log in or start a trial to view this content.
Discussion
Le protocole présenté détaille l’utilisation de la sonde d’étalonnage de protéines fluorescentes un à un génétiquement couplé pour quantifier FRET en utilisant la détection de l’émission sensibilisée de l’accepteur et la trempe de la molécule donneuse par microscopie confocale. Cette méthode peut être appliquée pour évaluer les interactions protéiques dans le contexte physiologique de la cellule vivante dans différents compartiments subcellulaires. La résolution spatiale peut être encore amé...
Access restricted. Please log in or start a trial to view this content.
Déclarations de divulgation
Les auteurs n’ont rien à divulguer.
Remerciements
Nous tenons à remercier le service d’imagerie en neurosciences de la faculté de médecine de l’Université de Stanford pour avoir fourni l’équipement et l’espace nécessaires à ce projet. Cette recherche a été financée par le financement intra-muros du Stanford Cancer Institute et de la Gynecologic Oncology Division Stanford, ainsi que par GINOP-2.3.2-15-2016-00026, GINOP-2.3.3-15-2016-00030, NN129371, ANN135107 du Bureau national de recherche, de développement et d’innovation, Hongrie.
Access restricted. Please log in or start a trial to view this content.
matériels
| Name | Company | Catalog Number | Comments |
| 0.5% Trypsin-EDTA without phenol red (10x) | Thermo Fisher Scientific | 15400054 | |
| Clontech mCherry N1 vector | Addgene | 3553 | |
| DMEM without phenol red | Thermo Fisher Scientific | 11054020 | |
| Fugene 6 | Promega | E2691 | |
| HEPES | Thermo Fisher Scientific | 15630080 | |
| LabTek 8-well chambers #1.0 | Thermo Fisher Scientific | 12565470 | |
| L-Glutamine (200 mM) | Thermo Fisher Scientific | 25030081 |
Références
- Förster, T. Zwischenmolekulare Energiewanderung und Fluoreszenz. Annal der Physik. 437, 55-75 (1948).
- Jovin, T. M., Arndt-Jovin, D. J. Luminescence digital imaging microscopy. Annual Review of Biophysics and Biophysical Chemistry. 18, 271-308 (1989).
- Mekler, V. M. A photochemical technique to enhance sensitivity of detection of fluorescence resonance energy transfer. Photochemistry and Photobiology. 59, 615-620 (1994).
- Vamosi, G., et al. Conformation of the c-Fos/c-Jun complex in vivo: A combined FRET, FCCS, and MD-modeling study. Biophysical Journal. 94 (7), 2859-2868 (2008).
- Renz, M., Daniels, B. R., Vamosi, G., Arias, I. M., Lippincott-Schwartz, J. Plasticity of the asialoglycoprotein receptor deciphered by ensemble FRET imaging and single-molecule counting PALM imaging. Proceedings of the National Academy of Science U. S. A. 109 (44), 2989-2997 (2012).
- van Rheenen, J., Langeslag, M., Jalink, K. Correcting confocal acquisition to optimize imaging of fluorescence resonance energy transfer by sensitized emission. Biophysical Journal. 86 (4), 2517-2529 (2004).
- Muller, S. M., Galliardt, H., Schneider, J., Barisas, B. G., Seidel, T. Quantification of Forster resonance energy transfer by monitoring sensitized emission in living plant cells. Frontiers in Plant Sciences. 4, 413(2013).
- Gates, E. M., LaCroix, A. S., Rothenberg, K. E., Hoffman, B. D. Improving quality, reproducibility, and usability of FRET-based tension sensors. Cytometry Part A. 95 (2), 201-213 (2019).
- Menaesse, A., et al. Simplified instrument calibration for wide-field fluorescence resonance energy transfer (FRET) measured by the sensitized emission method. Cytometry Part A. , 24194(2020).
- Shaner, N. C., et al. Improved monomeric red, orange and yellow fluorescent proteins derived from Discosoma sp. red fluorescent protein. Nature Biotechnology. 22 (12), 1567-1572 (2004).
- Cormack, B. P., Valdivia, R. H., Falkow, S. FACS-optimized mutants of the green fluorescent protein (GFP). Gene. 173, 1 Spec No 33-38 (1996).
- Nagy, P., et al. Novel calibration method for flow cytometric fluorescence resonance energy transfer measurements between visible fluorescent proteins. Cytometry Part A. 67 (2), 86-96 (2005).
- Arai, R., Ueda, H., Kitayama, A., Kamiya, N., Nagamune, T. Design of the linkers which effectively separate domains of a bifunctional fusion protein. Protein Engineering. 14 (8), 529-532 (2001).
- Szendi-Szatmari, T., Szabo, A., Szollosi, J., Nagy, P. Reducing the detrimental effects of saturation phenomena in FRET microscopy. Analytical Chemistry. 91 (9), 6378-6382 (2019).
- Tron, L., et al. Flow cytometric measurement of fluorescence resonance energy transfer on cell surfaces. Quantitative evaluation of the transfer efficiency on a cell-by-cell basis. Biophysical Journal. 45 (5), 939-946 (1984).
- Sebestyen, Z., et al. Long wavelength fluorophores and cell-by-cell correction for autofluorescence significantly improves the accuracy of flow cytometric energy transfer measurements on a dual-laser benchtop flow cytometer. Cytometry. 48 (3), 124-135 (2002).
- Szaloki, N., et al. High throughput FRET analysis of protein-protein interactions by slide-based imaging laser scanning cytometry. Cytometry Part A. 83 (9), 818-829 (2013).
- McRae, S. R., Brown, C. L., Bushell, G. R. Rapid purification of EGFP, EYFP, and ECFP with high yield and purity. Protein Expression and Purification. 41 (1), 121-127 (2005).
- Kremers, G. J., Goedhart, J., van Munster, E. B., Gadella, T. W. Cyan and yellow super fluorescent proteins with improved brightness, protein folding, and FRET Forster radius. Biochemistry. 45 (21), 6570-6580 (2006).
- Bajar, B. T., Wang, E. S., Zhang, S., Lin, M. Z., Chu, J. A Guide to Fluorescent Protein FRET Pairs. Sensors (Basel). 16 (9), (2016).
- Scott, B. L., Hoppe, A. D. Optimizing fluorescent protein trios for 3-Way FRET imaging of protein interactions in living cells. Science Reports. 5, 10270(2015).
- Chen, Y. C., Spring, B. Q., Clegg, R. M. Fluorescence lifetime imaging comes of age how to do it and how to interpret it. Methods Molecular Biology. 875, 1-22 (2012).
- King, C., Sarabipour, S., Byrne, P., Leahy, D. J., Hristova, K. The FRET signatures of noninteracting proteins in membranes: Simulations and experiments. Biophysical Journal. 106 (6), 1309-1317 (2014).
Access restricted. Please log in or start a trial to view this content.
Erratum
Formal Correction: Erratum: Assessing Protein Interactions in Live-Cells with FRET-Sensitized Emission
Posted by JoVE Editors on 3/14/2023. Citeable Link.
An erratum was issued for: Assessing Protein Interactions in Live-Cells with FRET-Sensitized Emission. The Authors section was updated from:
György Vámosi1
Sarah Miller2
Molika Sinha2
Gabor Mocsár1
Malte Renz2
1Department of Biophysics and Cell Biology, Faculty of Medicine, University of Debrecen
2Gynecologic Oncology Division, Stanford University School of Medicine
to:
György Vámosi1
Sarah Miller2
Molika Sinha2
Maria Kristha Fernandez2
Gabor Mocsár1
Malte Renz2
1Department of Biophysics and Cell Biology, Faculty of Medicine, University of Debrecen
2Gynecologic Oncology Division, Stanford University School of Medicine
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon