JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
FRET-Sensitized Emission with FRET-Sensitized Release를 사용한 살아있는 세포의 단백질 상호 작용 평가
Erratum Notice
요약
두 형광단 분자 사이의 Förster 공명 에너지 전달(FRET)은 살아있는 세포에서 단백질 상호 작용을 연구하는 데 사용할 수 있습니다. 여기서는 공초점 레이저 스캐닝 현미경을 사용하여 수용체의 감작 방출을 감지하고 공초점 레이저 주사 현미경을 사용하여 기증자 분자의 소멸을 통해 살아있는 세포에서 FRET를 측정하는 방법에 대한 프로토콜이 제공됩니다.
초록
Förster 공명 에너지 전달(FRET)은 여기된 기증자에서 수용체 분자로 에너지를 방사선 없이 전달하는 것이며 분자의 거리와 방향, 기증자 방출과 수용체 흡수 스펙트럼 사이의 겹침 정도에 따라 달라집니다. FRET를 사용하면 시간이 지남에 따라 살아있는 세포와 다른 세포 내 구획에서 단백질의 상호 작용을 연구할 수 있습니다. 현미경을 사용하여 FRET를 측정하는 다양한 강도 기반 알고리즘이 문헌에 설명되어 있습니다. 여기서, 수용체의 감작된 방출과 공여체 분자의 담금질 모두를 측정하여 FRET 효율을 정량화하기 위한 프로토콜과 알고리즘이 제공됩니다. 살아있는 세포에서 비율계량 FRET의 정량화는 형광 단백질의 누화(스펙트럼 유출 또는 블리드 스루)의 측정뿐만 아니라 현미경 설정의 검출 효율도 필요로 합니다. 여기에 제공된 프로토콜은 이러한 중요한 매개 변수를 평가하는 방법을 자세히 설명합니다.
서문
Förster 공명 에너지 전달(FRET)의 현미경 기반 분석을 통해 살아있는 세포에서 단백질 간의 상호 작용을 평가할 수 있습니다. 그것은 세포 내 어디에 있고 어떤 세포 내 구획에서 상호 작용이 일어나는지, 그리고 이 상호 작용이 시간이 지남에 따라 변하는지에 대한 정보를 포함하여 공간 및 시간 정보를 제공합니다.
Theodor Förster는 1948년 FRET의 이론적 토대를 마련했습니다1. FRET는 여기 된 기증자에서 수용체 분자로의 무방사선 에너지 전달이며 분자의 거리와 전이 쌍극자의 상대적 방향, 기증자 방출과 수용체 흡수 스펙트럼 사이의 겹침에 따라 달라집니다. 에너지 전달 속도는 도너-수용체 거리의 6승에 반비례합니다. 따라서 FRET는 1-10nm 범위의 분자 근접성을 측정하는 데 사용할 수 있습니다.
FRET는 기증자 분자의 다른 여기 제거 과정과 경쟁하여 수용체의 소위 기증자 담금질 및 감작 방출을 초래합니다. 도너 담금질은 방출된 도너 광자의 수를 감소시키는 반면, 감응 방출은 방출된 수용체 광자의 증가입니다. 많은 현미경 FRET 분석은 수용체 광표백2, 기증자 광표백2 또는 수용체3의 FRET 민감 광표백을 포함한 형광 강도 측정을 사용합니다.
여기에서는 종종 비율계량 FRET라고 하는 방법인 기증자 담금질 및 수용체 감응 방출 4,5를 사용하여 FRET를 정량화하기 위한 단계별 실험 프로토콜과 수학적 알고리즘이 제시됩니다. 감작 방출을 근사화하는 방법에 대한 많은 프로토콜이 발표되었지만 절대 FRET 효율 6,7,8,9를 정량화한 프로토콜은 거의 없습니다. 살아있는 세포에서 FRET 효율을 정량화하려면 (i) 형광 단백질의 누화(스펙트럼 유출 또는 블리드 스루)와 (ii) 현미경 설정의 검출 효율을 결정해야 합니다. 누화는 형광단 중 하나만 발현하는 이미징 세포로 평가할 수 있지만 공여체 및 수용체 형광의 상대적 검출 효율 평가는 더 복잡합니다. 측정된 신호를 발생시키는 공여체와 수용체 분자의 수의 비율에 대한 지식이 필요합니다. 그러나 살아있는 세포에서 발현되는 형광단의 수는 세포마다 다르며 알려져 있지 않습니다. 소위 α 인자는 단일 여기 기증자 및 수용체 분자의 상대적 신호 강도를 특성화합니다. 인자에 대한 지식은 형광 단백질을 사용한 생세포 이미징 중에 발생하는 가변 수용체-기증자 분자 비율을 가진 샘플에서 정량적 비율계량 FRET 측정을 위한 전제 조건입니다. 1:1 공여체-수용체 융합 단백질을 보정 프로브로 사용하면 α 인자를 측정할 수 있으며 양성 대조군으로도 사용할 수 있습니다. 이 유전적으로 결합된 프로브는 세포에 의해 알려지지 않은 총량으로 발현되지만 고정되고 알려진 상대적인 일대일의 양으로 발현됩니다. 다음 프로토콜은 1:1 프로브를 구성하는 방법과 FRET 효율의 정량화에 사용하는 방법을 설명합니다. 모든 공식이 포함된 스프레드시트는 부록에서 찾을 수 있으며 독자가 아래에 설명된 대로 각 열에 자신의 측정값을 입력하는 데 사용할 수 있습니다.
프로토콜은 GFP-Cherry 기증자/수용체 쌍을 사용하지만 제시된 접근 방식은 다른 FRET 쌍으로 수행할 수 있습니다. 보충 파일 1 은 청록색-노란색 쌍에 대한 세부 정보를 제공합니다.
프로토콜
1. 플라스미드 구성
- eGFP-mCherry1 융합 프로브를 생성하기 위해, 제한 부위 AgeI 및 BsrGI를 사용하여 mCherry110이 삽입된 N1 포유동물 세포 발현 벡터(재료 표 참조)를 사용합니다.
- 다음 올리고뉴클레오티드를 사용하여 정지 코돈 없이 eGFP11 을 SalI-BamHI 단편으로 증폭합니다: N-말단 프라이머 5'-AAT TAA CAG TCG ACG ATG GTG AGC AAG GGC GAG G G 3' 및 C-말단 프라이머 5'-AAT ATA TGG ATC CCG CTT GTA CAG CTC GTC CAT GC 3'.
- 이 SalI-BamHI 절편을 N1 벡터의 다중 클로닝 부위에 삽입하여 녹색 형광 단백질과 적색 형광 단백질 사이에 RNPPV 링커(5개의 아미노산) 링커를 도입한다.
참고: 이 링커는 약 0.25 -0.3의 GFP-Cherry 기증자-수용체 쌍에 대한 평균 FRET 효율을 산출합니다(그림 1A). 측정된 FRET 효율을 측정하기 위해 다양한 길이의 뻣뻣한12 및 나선형13 링커를 선택하는 것은 다른 곳에서 논의되었지만 융합 단백질의 목적에 필요하지 않습니다. 단순화를 위해 앞으로 우리는 형광 단백질을 'GFP'와 '체리'라고 부를 것입니다.
2. 세포 배양 및 형질주입
- 배경 형광을 줄이기 위해 페놀 레드가 없는 DMEM(Dulbecco's modified Eagle's media)과 같은 배지의 FRET 실험에 NRK 세포와 같은 모든 세포주를 사용하십시오. 같은 이유로, 페놀 레드 프리 트립신의 사용이 권장됩니다.
- 세포가 80% 합류하면, 0.05% 트립신-EDTA 1mL로 세포를 분리하고, Neubauer 챔버를 사용하여 현탁액 중의 세포 수를 세고, 8-웰 챔버 커버 유리의 웰 당 약 10,000개의 세포를 시딩하고; 또는 T25 플라스크에서 성장한 융합성 세포 배양물에서 2mL 피펫의 세포 현탁액 1방울 또는 T 12.5세포 배양 플라스크에서 성장한 융합성 배양액의 5mL 세포 현탁액에서 3방울을 사용합니다.
- 표준 세포 배양 조건(37°C 및 5% CO 2)에서 형광 생세포 현미경 검사용 #1.0 커버 유리를 사용하여 8웰 챔버(0.8cm2/웰)에서 세포를 성장시킵니다.
- 도금 후 24시간 후 적절한 시판되는 형질주입 배지( 재료 표 참조)를 사용하여 GFP, Cherry, GFP/Cherry mix(1:1 mix, 즉 0.8μg 및 0.8μg GFP 및 Cherry 플라스미드 DNA) 및 GFP-Cherry 키메라.
- 형질감염을 위해 45μL의 DMEM과 1.6μg의 플라스미드 DNA에 5μL의 형질주입 시약을 사용합니다. 미세 원심분리기 튜브를 부드럽게 튕겨 저어줍니다.
- 혼합물을 실온에서 15분 동안 인큐베이션한 후, 형질주입 시약 혼합물 1-2 μL를 8-웰 챔버 슬라이드의 각 웰에 첨가한다. 챔버 커버 유리를 인큐베이터로 되돌립니다.
- 형질주입 후 20시간이 경과하여 특히 적색 형광단의 적절한 형광 단백질 발현, 접힘 및 성숙을 허용하도록 생세포 이미징 전에 경과시킵니다.
3. FRET 이미징
- 37°C에서 가습되고 가열된 환경 챔버에서 세포를 형질주입하여 이미지화합니다. 생리학적 pH에서 세포 배지를 완충하기 위해, 5% 흐름으로 설정된 CO2 가스를 사용하거나, 20 mM HEPES를 첨가하여 세포 배지를CO2-독립적이게 한다.
- 컨포칼 레이저 스캐닝 현미경을 사용합니다. 여기와 방출을 다음과 같이 설정하여 신호를 최적화하고 누화를 최소화합니다.
- 아르곤 이온 레이저의 488nm 라인을 사용하여 GFP를 여기시키고 561nm 다이오드 펌핑 고체 레이저(또는 사용 가능한 레이저 라인에 따라 543nm 헬륨 네온 레이저)를 사용하여 Cherry를 여기시킵니다.
- 상용 컨포칼 현미경의 소프트웨어에서 다음을 설정합니다. 풀다운 메뉴를 사용하여 버튼을 클릭하여 Dichroic mirror 를 488/561로 설정합니다. 505 - 530 nm (또는 505 - 550 nm)의 방출 대역을 통과하는 채널 1과 >585 nm의 롱 패스 필터를 사용하여 채널 2에서 여기를 위해 488nm 레이저 광을 사용하여 형광을 수집하고, 585 nm(파장 유형)의 롱 패스 필터가 있는 채널 3에서 여기를 위해 561nm 레이저 광> 사용합니다. 대역 통과 필터, 예를 들어, 590 - 650 nm 또는 이와 유사한 것을 사용할 수 있으며, 이는 라만 산란을 배제하는 이점이 있습니다.
- 두 개의 레이저로 순차적으로 여기하고 이미징 모드를 각 라인 뒤에서 전환 으로 설정하여 512 x 512 픽셀 이미지의 여기가 각 라인 후에 번갈아 가도록 합니다(각 프레임 이후가 아니라 다른 여기로 이미지를 기록하는 동안 표지된 단백질의 확산으로 인해 FRET를 감지하는 기능을 폐지합니다. 버튼 클릭).
- 버튼 클릭으로 3개의 이미지로 구성된 미니 시계열을 설정하여 심각한 광표백이 발생하는지 감지하고 잠재적으로 레이저 출력을 줄일 수 있습니다. 1% 미만의 광표백이 최적입니다. 높은 레이저 강도는 또한 흡수 포화로 이어져 겉보기 FRET 효율(14)을 감소시킬 수 있다. 대물 렌즈에서 측정된 최대 10-20μW의 레이저 출력은 안전하게 사용할 수 있습니다.
- 먼저, GFP-Cherry 융합 구조체를 발현하는 이미지 세포입니다. 컨포칼 이미지에서 픽셀당 시간 통합 레이저 강도를 정의하는 매개변수(예: 픽셀 체류 시간(마이크로초), 음향 광학 조정 가능 필터(AOTF) 투과율(백분율) 및 줌)를 설정합니다.
- 63x 오일 대물렌즈를 사용하고 Zoom 을 3x로 설정하여 셀을 이미지화합니다. 이것은 이미지 셀 전체에 충분한 배율과 해상도를 제공합니다. 70-80nm의 픽셀 크기를 목표로 합니다.
- 488nm 및 561nm 레이저의 경우 픽셀 체류 시간을 2-4μs로 설정하고 AOTF 투과 율을 설정하여 이미지가 표백 없이 양호한 신호 대 잡음비를 가지며 형광 강도 포화를 나타내는 픽셀이 없도록 합니다. 488 및 561의 레이저 파워를 조정하여 채널 1 및 채널 3에서의 신호 레벨이 유사하도록 하는 것이 유리하다.
- 광전자 증배관(평균 모드) 게인을 600-800으로 설정합니다.
- GFP-Cherry 융합 단백질을 발현하는 15-20개의 세포가 이러한 설정으로 설정된 이미지. 15-20 셀은 미세한 설정의 안정성을 보장하기 위해 FRET 측정 세션의 총 시간을 몇 시간으로 제한하면서 좋은 통계를 제공합니다.
- GFP, Cherry, GFP 및 Cherry를 발현하는 세포와 형질감염되지 않은 세포와 동일한 설정을 가진 이미지. 각각 녹색 채널 또는 빨간색 채널에서 발현 세포를 검색합니다.
- 이어서, 이미지 15-20 세포는 각각 GFP 및 체리에 결합된 관심있는 단백질을 공동 발현한다. 발현 세포를 찾고, 형광 단백질을 표백하지 않기 위해 세포의 장시간 노출을 피하십시오. 체리는 GFP보다 광안정성이 낮고, 수용체인 체리를 표백하면 FRET 분석이 저하됩니다.
참고: GFP와 Cherry의 흡수 및 방출 스펙트럼은 보충 그림 1에 나와 있습니다. 5-6시간 동안 측정한 후, 이미징 세션이 끝날 때 GFP-Cherry 키메라를 발현하는 몇 개의 세포를 이미징을 반복하여 설정이 안정적으로 유지되고 GFP-Cherry 융합 단백질의 검출된 FRET 효율이 이미징 세션 동안 크게 변하지 않았습니다.
4. 기증자 담금질 및 민감 방출을 사용하여 절대적인 FRET 효율성을 감지하기 위한 이미지 분석
알림: 여기에서는 첨부된 스프레드시트(보충 파일 2)를 사용하여 FRET 효율성을 결정하는 방법에 대한 실용적인 단계별 가이드가 제공됩니다. 제시된 방정식의 이론 및 유도는 이전 간행물 4,15,16,17에서 상세히 찾을 수 있다. 설명된 설정을 사용하면 다음과 같은 형광 강도가 수집됩니다.
- 488nm 여기 및 505-530nm의 방출 대역으로 채널 1, 도너 채널에서 도너 신호 I1을 측정합니다.
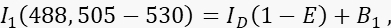
여기서 ID는 수용체가 없을 때 측정되는 채널 1의 소멸되지 않은 도너 신호이고, 평균 FRET 효율이며, B 1은 채널 1의 평균 배경 신호입니다. - >585 nm에서 561nm 여기 및 방출로 채널 3, 수용체 채널에서 수용체 신호 I3을 측정합니다.
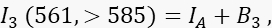
여기서 I A는 수용체 신호이고 B 3은 채널 3의 배경입니다. - >585nm에서 488nm 여기 및 방출로 전송 채널인 채널 2에서 FRET 신호를 측정합니다.
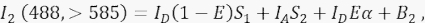
여기서, 채널 2에서의 신호는 4개의 상이한 성분들의 합이다: (i) ID(1 - E)S1은 소멸된 도너 신호로부터 >585 검출 채널로의 스펙트럼 유출(누화 계수 S1 포함)이고, (ii) IAS 2는 488nm 광에 의한 직접 여기로부터의 수용체 신호이다(누화 계수 S2 포함), (iii) IDEα는 여기 공여자 분자로부터 FRET에 의한 수용체의 감작 방출이고(α 4.8 - 4.10.에서 더 상세히 설명될 것이다), (iv) B2는 배경 신호이다. - 비형질주입 또는 모의 형질주입된 세포에서 채널 1, 2, 3의 평균 배경 강도를 측정합니다. 어느 쪽이든 무시할 수있는 차이로 괜찮습니다. 모든 세포 측정에서 자유 도구를 사용하여 관심 영역을 묘사하고 자가형광이 증가한 핵주위 소포를 피할 수 있습니다. 이러한 핵주위 소포에서 상당한 자가형광을 피하는 것이 중요합니다.
- 제공된 스프레드시트의 X, Y, Z 열에 측정값을 입력합니다. 3개 채널의 평균 배경 강도는 Excel 스프레드시트의 A2, B2 및 C2에 입력됩니다(보충 파일 2).
- GFP 또는 Cherry 단독을 발현하는 세포의 채널 1, 2, 3에서 평균 강도를 측정하고 측정값을 C, D, E 및 N, O, P 열에 입력합니다. 각각의 배경 강도를 뺍니다(F, G, H 및 Q, R, S).
- FRET 효율인 E를 계산하기 위해 누화 계수 S 1 및 S2를 결정하십시오. 스펙트럼 누화 인자 S1은 GFP만을 발현하는 세포로부터 계산된다
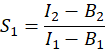
열 I. Excel 스프레드시트의 D1 셀에 S 2의 평균값을 입력합니다. - Cherry만을 발현하는 세포로부터 스펙트럼 누화 인자 S2를 계산한다
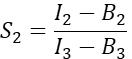
T 열에서 S2 의 평균을 Excel 스프레드시트의 E2 셀에 입력합니다. - α 인자는 채널 1에 있는 임의의 주어진 수의 여기된 GFP 분자의 신호를 채널 2에 있는 동일한 수의 여기된 체리 분자의 신호와 관련시키고 다음과 같이 정의되는지 확인합니다.
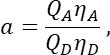

여기서 Q A 및 QD는 Cherry 및 GFP의 형광 양자 수율입니다. η A 및 ηD는 각각 채널 2 및 1에서 수용체 및 공여체 형광의 검출 효율을 나타냅니다.
참고: α 인자는 알려진 절대량의 GFP와 체리를 발현하는 두 개의 샘플에서 결정할 수 있습니다. 그러나 세포에서 발현되는 GFP와 체리의 정확한 양을 아는 것은 불가능합니다. 따라서 GFP-Cherry 융합 단백질을 발현하는 세포를 이용하여 인자를 계산하였다. 여기서, 절대량은 아직 알려지지 않았지만, 공여체와 수용체 분자의 비율은 1인 것으로 알려져 있다. - GFP-Cherry 융합 단백질을 발현하는 세포의 채널 1, 2, 3에서 평균 강도를 측정하고 측정값을 AE, AF, AG 컬럼에 입력합니다. 배경 강도를 뺍니다(AH, AI, AJ).
- GFP-Cherry 융합 단백질의 채널 1, 2 및 3의 형광 강도에서 α 인자(AJ 컬럼)를 다음과 같이 계산합니다.
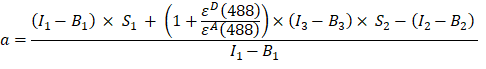
- 채널 1 (I 1 - B 1), 2 (I 2 - B 2) 및 3 (I 3 - B3)에서 각각 측정된 배경 보정 강도는 GFP-체리 키메라를 사용하여 측정됩니다. 스펙트럼 크로스토크 인자 S1은 GFP만을 발현하는 세포를 사용하여 결정하였다(4.7 참조). εD와 ε A는 488 nm에서 공여체인 GFP와 수용체인 체리의 흡광계수이며, 문헌(ε GFP = 53,000 M-1 cm-1)18 및 체리의 흡수 곡선(ε체리 ≈ 5560 M-1cm1)에서 확인할 수 있다. 비율은
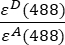 Excel 스프레드시트의 G2 셀에 입력되었습니다. α 요인의 평균값을 J2에 입력합니다.
Excel 스프레드시트의 G2 셀에 입력되었습니다. α 요인의 평균값을 J2에 입력합니다. - FRET 효율 E를 계산하기 위해 결정된 α 계수를 다음과 같이 사용합니다(AK 열).
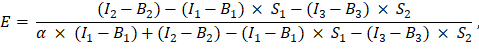
- 대안적으로, 음성 대조군, 즉 GFP와 Cherry의 공동 발현 및 GFP 단독의 발현에 대해 FRET 효율, E를 결정하여 열 AD, AE 및 AF의 엑셀 시트에 채널 1, 2 및 3의 측정값을 추가하여 GFP-Cherry 융합 단백질 측정. 동일한 방식으로 GFP와 Cherry 표지 관심 단백질 사이의 FRET 효율성을 결정합니다.
- 담금질되지 않은 기증자 강도, I D as (I 1 - B 1)/(1 - E) 및 수용체 강도를 I A = I 3 - B3으로 결정합니다. 이 값은 태그가 지정된 단백질의 발현 수준에 비례합니다.
- 다음과 같이 GFP-Cherry 융합 단백질의 보정된 수용체 대 기증자 강도 비율(Q)을 결정합니다(AL 열).

- 다른 공동 형질주입된 세포의 경우, 다음과 같이 수용체 대 공여자 분자 비율 NA/ND를 계산합니다.
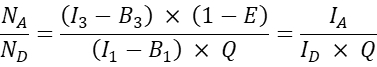
참고: NA/ND 비율을 결정하고 평균 세포 FRET 효율 E 대 NA/ND를 표시하는 근거는 하나의 기증자 분자가 여러 수용체로 에너지를 전달할 수 있는 반면 수용체 분자는 주어진 시간에 하나의 기증자로부터만 에너지를 받을 수 있다는 것입니다. 상호작용의 화학량론으로 인해 하나의 수용자만이 기증자와 상호작용할 수 있다 하더라도, 집단 작용의 법칙 때문에 수용체 농도의 증가는 수용체와 복합체에 있는 기증자의 비율을 증가시킬 것으로 예상된다. 따라서 고정된(또는 좁은 범위의) 기증자 발현의 경우 FRET 효율은 NA/ND가 증가함에 따라 증가해야 합니다. GFP와 Cherry의 공동 발현, 즉 음성 프로브에 대한 FRET 효율 E 대 NA/ND를 플로팅할 때 NA/ND의 증가는 FRET 효율의 증가를 초래해서는 안 됩니다(적어도 충분히 낮은 수용체 농도에서 기증자 염료에 대한 수용체 염료 부근으로 인한 무작위 FRET가 발생하지 않습니다).
결과
도 1은 공여 채널, 채널 1 (488, 505-530 nm), 전달 채널 2 (488, >585 nm) 및 수용체 채널 채널 3 (561, >585 nm)에서 각각 획득된 이미지를 보여준다. GFP만 발현하는 세포, Cherry만 발현하는 세포, GFP와 Cherry를 동시에 발현하는 세포, GFP-Cherry 융합 단백질을 발현하는 세포의 대표 이미지. GFP-Cherry 융합 단백질을 발현하는 NRK 세포(양성 대조군, 그림 2A
토론
제시된 프로토콜은 수용체의 민감 방출 검출 및 공초점 현미경에 의한 기증자 분자의 소멸을 사용하여 FRET를 정량화하기 위한 유전적으로 결합된 일대일 형광 단백질 보정 프로브의 사용에 대해 자세히 설명합니다. 이 방법은 서로 다른 세포 내 구획에 있는 살아있는 세포의 생리학적 맥락에서 단백질 상호작용을 평가하는 데 적용할 수 있습니다. 공간 해상도는 제시된 알고리즘을 적용하여 이미...
공개
저자는 공개 할 것이 없습니다.
감사의 말
이 프로젝트를 위한 장비와 공간을 제공한 Stanford University School of Medicine의 Neuroscience Imaging Service에 감사드립니다. 이 연구는 스탠포드 암 연구소 (Stanford Cancer Institute)와 스탠포드 부인과 종양학 부서 (Gynecologic Oncology Division Stanford)의 교내 자금 지원과 헝가리 국립 연구 개발 혁신 사무소의 GINOP-2.3.2-15-2016-00026, GINOP-2.3.3-15-2016-00030, NN129371, ANN135107의 지원을 받았습니다.
자료
| Name | Company | Catalog Number | Comments |
| 0.5% Trypsin-EDTA without phenol red (10x) | Thermo Fisher Scientific | 15400054 | |
| Clontech mCherry N1 vector | Addgene | 3553 | |
| DMEM without phenol red | Thermo Fisher Scientific | 11054020 | |
| Fugene 6 | Promega | E2691 | |
| HEPES | Thermo Fisher Scientific | 15630080 | |
| LabTek 8-well chambers #1.0 | Thermo Fisher Scientific | 12565470 | |
| L-Glutamine (200 mM) | Thermo Fisher Scientific | 25030081 |
참고문헌
- Förster, T. Zwischenmolekulare Energiewanderung und Fluoreszenz. Annal der Physik. 437, 55-75 (1948).
- Jovin, T. M., Arndt-Jovin, D. J. Luminescence digital imaging microscopy. Annual Review of Biophysics and Biophysical Chemistry. 18, 271-308 (1989).
- Mekler, V. M. A photochemical technique to enhance sensitivity of detection of fluorescence resonance energy transfer. Photochemistry and Photobiology. 59, 615-620 (1994).
- Vamosi, G., et al. Conformation of the c-Fos/c-Jun complex in vivo: A combined FRET, FCCS, and MD-modeling study. Biophysical Journal. 94 (7), 2859-2868 (2008).
- Renz, M., Daniels, B. R., Vamosi, G., Arias, I. M., Lippincott-Schwartz, J. Plasticity of the asialoglycoprotein receptor deciphered by ensemble FRET imaging and single-molecule counting PALM imaging. Proceedings of the National Academy of Science U. S. A. 109 (44), 2989-2997 (2012).
- van Rheenen, J., Langeslag, M., Jalink, K. Correcting confocal acquisition to optimize imaging of fluorescence resonance energy transfer by sensitized emission. Biophysical Journal. 86 (4), 2517-2529 (2004).
- Muller, S. M., Galliardt, H., Schneider, J., Barisas, B. G., Seidel, T. Quantification of Forster resonance energy transfer by monitoring sensitized emission in living plant cells. Frontiers in Plant Sciences. 4, 413 (2013).
- Gates, E. M., LaCroix, A. S., Rothenberg, K. E., Hoffman, B. D. Improving quality, reproducibility, and usability of FRET-based tension sensors. Cytometry Part A. 95 (2), 201-213 (2019).
- Menaesse, A., et al. Simplified instrument calibration for wide-field fluorescence resonance energy transfer (FRET) measured by the sensitized emission method. Cytometry Part A. , 24194 (2020).
- Shaner, N. C., et al. Improved monomeric red, orange and yellow fluorescent proteins derived from Discosoma sp. red fluorescent protein. Nature Biotechnology. 22 (12), 1567-1572 (2004).
- Cormack, B. P., Valdivia, R. H., Falkow, S. FACS-optimized mutants of the green fluorescent protein (GFP). Gene. 173, 33-38 (1996).
- Nagy, P., et al. Novel calibration method for flow cytometric fluorescence resonance energy transfer measurements between visible fluorescent proteins. Cytometry Part A. 67 (2), 86-96 (2005).
- Arai, R., Ueda, H., Kitayama, A., Kamiya, N., Nagamune, T. Design of the linkers which effectively separate domains of a bifunctional fusion protein. Protein Engineering. 14 (8), 529-532 (2001).
- Szendi-Szatmari, T., Szabo, A., Szollosi, J., Nagy, P. Reducing the detrimental effects of saturation phenomena in FRET microscopy. Analytical Chemistry. 91 (9), 6378-6382 (2019).
- Tron, L., et al. Flow cytometric measurement of fluorescence resonance energy transfer on cell surfaces. Quantitative evaluation of the transfer efficiency on a cell-by-cell basis. Biophysical Journal. 45 (5), 939-946 (1984).
- Sebestyen, Z., et al. Long wavelength fluorophores and cell-by-cell correction for autofluorescence significantly improves the accuracy of flow cytometric energy transfer measurements on a dual-laser benchtop flow cytometer. Cytometry. 48 (3), 124-135 (2002).
- Szaloki, N., et al. High throughput FRET analysis of protein-protein interactions by slide-based imaging laser scanning cytometry. Cytometry Part A. 83 (9), 818-829 (2013).
- McRae, S. R., Brown, C. L., Bushell, G. R. Rapid purification of EGFP, EYFP, and ECFP with high yield and purity. Protein Expression and Purification. 41 (1), 121-127 (2005).
- Kremers, G. J., Goedhart, J., van Munster, E. B., Gadella, T. W. Cyan and yellow super fluorescent proteins with improved brightness, protein folding, and FRET Forster radius. Biochemistry. 45 (21), 6570-6580 (2006).
- Bajar, B. T., Wang, E. S., Zhang, S., Lin, M. Z., Chu, J. A Guide to Fluorescent Protein FRET Pairs. Sensors (Basel). 16 (9), (2016).
- Scott, B. L., Hoppe, A. D. Optimizing fluorescent protein trios for 3-Way FRET imaging of protein interactions in living cells. Science Reports. 5, 10270 (2015).
- Chen, Y. C., Spring, B. Q., Clegg, R. M. Fluorescence lifetime imaging comes of age how to do it and how to interpret it. Methods Molecular Biology. 875, 1-22 (2012).
- King, C., Sarabipour, S., Byrne, P., Leahy, D. J., Hristova, K. The FRET signatures of noninteracting proteins in membranes: Simulations and experiments. Biophysical Journal. 106 (6), 1309-1317 (2014).
Erratum
Formal Correction: Erratum: Assessing Protein Interactions in Live-Cells with FRET-Sensitized Emission
Posted by JoVE Editors on 3/14/2023. Citeable Link.
An erratum was issued for: Assessing Protein Interactions in Live-Cells with FRET-Sensitized Emission. The Authors section was updated from:
György Vámosi1
Sarah Miller2
Molika Sinha2
Gabor Mocsár1
Malte Renz2
1Department of Biophysics and Cell Biology, Faculty of Medicine, University of Debrecen
2Gynecologic Oncology Division, Stanford University School of Medicine
to:
György Vámosi1
Sarah Miller2
Molika Sinha2
Maria Kristha Fernandez2
Gabor Mocsár1
Malte Renz2
1Department of Biophysics and Cell Biology, Faculty of Medicine, University of Debrecen
2Gynecologic Oncology Division, Stanford University School of Medicine
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유