Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
FRET'e duyarlı emisyona sahip canlı hücrelerdeki protein etkileşimlerinin değerlendirilmesi
Bu Makalede
Erratum Notice
Özet
İki florofor molekülü arasındaki Förster Rezonans Enerji Transferi (FRET), canlı hücredeki protein etkileşimlerini incelemek için kullanılabilir. Burada, alıcı ve konfokal lazer tarama mikroskobu kullanılarak donör molekülünün söndürülmesi ile alıcının duyarlılaştırılmış emisyonunu tespit ederek canlı hücrelerde FRET'nin nasıl ölçüleceğine dair bir protokol sağlanmaktadır.
Özet
Förster Rezonans Enerji Transferi (FRET), uyarılmış bir donörden bir alıcı moleküle radyasyonsuz enerji transferidir ve moleküllerin mesafesine ve oryantasyonuna ve ayrıca donör emisyonu ile alıcı absorpsiyon spektrumları arasındaki örtüşme derecesine bağlıdır. FRET, canlı hücredeki proteinlerin zaman içinde ve farklı hücre altı bölmelerdeki etkileşimini incelemeye izin verir. Literatürde mikroskopi kullanarak FRET ölçümü için farklı yoğunluk tabanlı algoritmalar tanımlanmıştır. Burada, hem alıcının duyarlılaştırılmış emisyonunu hem de donör molekülün söndürülmesini ölçmeye dayanarak FRET verimliliğini ölçmek için bir protokol ve bir algoritma sağlanmaktadır. Canlı hücredeki oranmetrik FRET'nin nicelleştirilmesi, sadece floresan proteinlerinin çapraz konuşmasının (spektral dökülme veya kanama) belirlenmesini değil, aynı zamanda mikroskobik kurulumun tespit verimliliğini de gerektirir. Burada sağlanan protokol, bu kritik parametrelerin nasıl değerlendirileceğini ayrıntılarıyla açıklamaktadır.
Giriş
Förster Rezonans Enerji Transferi'nin (FRET) mikroskopi tabanlı analizi, canlı hücrelerdeki proteinler arasındaki etkileşimlerin değerlendirilmesine izin verir. Etkileşimin hücrenin neresinde ve hangi hücre altı bölmede gerçekleştiği ve bu etkileşimin zaman içinde değişip değişmediği hakkında bilgi de dahil olmak üzere mekansal ve zamansal bilgi sağlar.
Theodor Förster, 1948'de FRET'in teorik temelini attı1. FRET, uyarılmış bir donörden bir alıcı moleküle radyasyonsuz bir enerji transferidir ve moleküllerin mesafesine ve geçiş dipollerinin göreceli oryantasyonuna ve ayrıca donör emisyonu ile alıcı absorpsiyon spektrumları arasındaki örtüşmeye bağlıdır. Enerji transfer hızı, donör-alıcı mesafesinin altıncı gücü ile ters orantılıdır. Böylece, FRET 1-10 nm aralığında moleküler yakınlığı ölçmek için kullanılabilir.
FRET, donör molekülün diğer uyarım giderme işlemleriyle rekabet eder ve alıcının donör söndürme ve hassaslaştırılmış emisyonu ile sonuçlanır. Donör söndürme, yayılan donör fotonlarının sayısının azaltılmasıdır, hassaslaştırılmış emisyon ise yayılan alıcı fotonlarda bir artıştır. Birçok mikroskobik FRET analizi, alıcı fotobeyazlatma 2, donör fotobeyazlatma2 veya alıcı3'ün FRET-duyarlılaştırılmış fotobeyazlatma dahil olmak üzere floresan yoğunluğu ölçümlerini kullanır.
Burada, genellikle oranmetrik FRET olarak adlandırılan bir yöntem olan donör söndürme ve alıcı duyarlılaştırılmış emisyon 4,5 kullanarak FRET'yi ölçmek için adım adım deneysel bir protokol ve matematiksel algoritma sunulmaktadır. Hassaslaştırılmış emisyonun nasıl yaklaşacağına dair birçok protokol yayınlanmıştır, çok azı mutlak FRET verimliliğiniölçmüştür 6,7,8,9. Canlı hücredeki FRET verimliliklerinin nicelleştirilmesi, (i) floresan proteinlerin çapraz konuşmasının (spektral dökülme veya kanama) ve ayrıca (ii) mikroskobik kurulumun tespit verimliliğinin belirlenmesini gerektirir. Çapraz konuşma, floroforlardan sadece birini eksprese eden görüntüleme hücreleri ile değerlendirilebilirken, donör ve alıcı floresansının göreceli tespit etkinliğinin değerlendirilmesi daha karmaşıktır. En azından ölçülen sinyallere yol açan donör ve alıcı molekül sayısının oranının bilinmesini gerektirir. Bununla birlikte, canlı hücrelerde eksprese edilen floroforların sayısı hücreden hücreye değişir ve bilinmemektedir. Sözde α faktörü, tek bir uyarılmış donör ve alıcı molekülden gelen göreceli sinyal güçlerini karakterize eder. Faktör bilgisi, floresan proteinlerle canlı hücre görüntülemesi sırasında karşılaşılan değişken alıcı-donör molekül oranlarına sahip örneklerde kantitatif oranmetrik FRET ölçümleri için bir ön koşuldur. Kalibrasyon probu olarak 1'e 1 donör-alıcı füzyon proteini kullanmak, α faktörünün belirlenmesine izin verir ve ayrıca pozitif bir kontrol görevi görür. Bu genetik olarak bağlanmış prob, hücreler tarafından bilinmeyen toplam miktarlarda, ancak bire bir sabit ve bilinen göreceli bir miktarda eksprese edilir. Aşağıdaki protokol, 1'e 1 probun nasıl oluşturulacağını ve FRET verimliliğinin ölçülmesi için nasıl kullanılacağını ortaya koymaktadır. Tüm formülleri içeren bir elektronik tablo ekte bulunabilir ve okuyucular tarafından aşağıda belirtildiği gibi ilgili sütunlara kendi ölçümlerini girmek için kullanılabilir.
Protokol GFP-Cherry donör / alıcı çiftini kullanırken, sunulan yaklaşım başka herhangi bir FRET çifti ile gerçekleştirilebilir. Ek Dosya 1, camgöbeği-sarı çiftleri hakkında ayrıntılı bilgi sağlar.
Access restricted. Please log in or start a trial to view this content.
Protokol
1. Plazmid yapımı
- eGFP-mCherry1 füzyon probunu oluşturmak için, AgeI ve BsrGI kısıtlama bölgeleri kullanılarak eklenen mCherry1 10 ile bir N1 memeli hücre ekspresyon vektörü (bkz. Malzeme Tablosu) kullanın.
- SalI-BamHI parçası olarak bir durdurma kodonu olmadan eGFP11'i yükseltmek için aşağıdaki oligonükleotidleri kullanın: N-terminal primer 5'-AAT TAA CAG TCG ACG ATG GTG AGC AAG GGC GAG G 3' ve C-terminal primer 5'-AAT ATA TGG ATC CCG CTT GTA CAG CTC GTC CAT GC 3'.
- Yeşil ve kırmızı floresan proteini arasına RNPPV bağlayıcı (beş aminoasit) bağlayıcıyı tanıtmak için bu SalI-BamHI fragmanını N1 vektörünün çoklu klonlama bölgesine yerleştirin.
NOT: Bu bağlayıcı, GFP-Cherry donör-alıcı çifti için yaklaşık 0.25-0.3'lük bir ortalama FRET verimliliği sağlar (Şekil 1A). Ölçülen FRET verimliliklerini ölçeklendirmek için farklı uzunluklarda sert12 ve helisel13 bağlayıcıların seçimi başka yerlerde tartışılmıştır, ancak füzyon proteini amacımız için gerekli değildir. Basitlik için ileriye dönük olarak, floresan proteinlerine 'GFP' ve 'Kiraz' adını vereceğiz.
2. Hücre kültürü ve transfeksiyon
- Arka plan floresansını azaltmak için fenol kırmızısı olmadan ortamdaki FRET deneyleri için herhangi bir hücre hattını, örneğin NRK hücrelerini kullanın, örneğin, Dulbecco'nun modifiye edilmiş Eagle's media (DMEM). Aynı nedenle, fenol kırmızısı serbest tripsin kullanımı tavsiye edilir.
- Hücreler% 80 birleştiğinde, hücreleri 1 mL% 0.05 tripsin-EDTA ile ayırın, bir Neubauer odası kullanarak süspansiyondaki hücre sayısını sayın ve 8 iyi odacıklı bir kapak camının kuyusu başına yaklaşık 10.000 hücre tohumlayın; Alternatif olarak, T25 şişesinde yetiştirilen bir akıcık hücre kültüründen, 2 mL'lik bir pipetten 1 damla hücre süspansiyonu veya bir T 12.5 hücreli kültür şişesinde yetiştirilen bir akıcılık kültüründen 5 mL'lik bir hücre süspansiyonundan 3 damla kullanın.
- Standart hücre kültürü koşullarında (37 ° C ve% 5 CO 2) floresan canlı hücre mikroskobu için # 1.0 kapak camı ile 8 kuyucuklu odalarda (0.8 cm2 / kuyu) hücreleri büyütün.
- Kaplamadan 24 saat sonra, GFP, Kiraz, GFP / Kiraz karışımı (1: 1 karışım, yani 0.8 μg ve 0.8 μg GFP ve Kiraz plazmid DNA'sı) ve GFP-Cherry kimera ile ticari olarak temin edilebilen uygun bir transfeksiyon ortamı ( Malzeme Tablosuna bakınız) kullanarak hücreleri transfekte edin.
- Transfeksiyon için, 45 μL DMEM ve 1.6 μg plazmid DNA'sında 5 μL transfeksiyon reaktifi kullanın. Mikrosantrifüj tüpünü hafifçe hafifçe sallayarak karıştırın.
- Karışımın oda sıcaklığında 15 dakikalık inkübasyonundan sonra, 8 delikli oda kızağının her bir oyuğuna 1-2 μL transfeksiyon reaktif karışımı ekleyin. Odalı kapak camını inkübatöre geri koyun.
- Canlı hücre görüntülemeden önce transfeksiyondan sonra 20 saat geçmesine izin verin, böylece uygun floresan protein ekspresyonuna, katlanmasına ve olgunlaşmasına, özellikle kırmızı floroforun olgunlaşmasına izin verin.
3. FRET Görüntüleme
- 37 °C'de nemlendirilmiş ve ısıtılmış bir çevre odasında transfekte edilmiş hücreleri görüntüleyin. Hücre ortamını fizyolojik pH'da tamponlamak için,% 5 akışa ayarlanmış CO 2 gazı kullanın veya hücre ortamını CO2'den bağımsız hale getirmek için20 mM HEPES ekleyin.
- Konfokal lazer tarama mikroskobu kullanın. Sinyali optimize etmek ve çapraz konuşmayı en aza indirmek için uyarımı ve emisyonu aşağıdaki gibi ayarlayın.
- GFP'yi heyecanlandırmak için argon iyon lazerinin 488 nm çizgisini ve Cherry'yi heyecanlandırmak için 561 nm diyot pompalı katı hal lazerini (veya mevcut lazer hatlarına bağlı olarak 543 nm Helyum Neon lazeri) kullanın.
- Ticari bir konfokal mikroskop yazılımında aşağıdakileri ayarlayın. Dichroic aynasını açılır menüyü kullanarak düğme tıklamasıyla 488 / 561 olarak ayarlayın. Kanal 1'de 505 - 530 nm (veya 505 - 550 nm) emisyon bandından ve kanal 2'de uzun geçirgen filtreli >585 nm ile uyarma için 488 nm lazer ışığı kullanarak floresan toplayın ve 585 nm (dalga boylarında tip) uzun geçiş filtresi ile kanal 3>'te uyarma için 561 nm lazer ışığını kullanın. Raman-saçılımını dışlama avantajına sahip 590 - 650 nm veya benzeri bant geçiş filtreleri de kullanılabilir.
- İki lazerle sırayla heyecanlanın ve görüntüleme modunu her satırdan sonra Değiştir olarak ayarlayın, böylece 512 x 512 piksellik görüntünün uyarılması her satırdan sonra değişir (ve görüntüleri farklı uyarımlarla kaydederken etiketli proteinlerin difüzyonu nedeniyle FRET algılama yeteneğini ortadan kaldıracak her kareden sonra değil; düğme tıklaması).
- Önemli fotobeyazlatma olup olmadığını algılamak ve potansiyel olarak lazer gücünü azaltmak için düğme tıklamalarıyla üç görüntüden oluşan mini bir dizi ayarlayın. %1'den az fotobeyazlatma en uygunudur. Yüksek lazer yoğunluğu ayrıca görünür FRET verimliliğini azaltan emilim doygunluğuna yol açabilir14. Lazer gücü, objektif lenste ölçülen 10-20 μW'a kadar kullanımı güvenlidir.
- İlk olarak, GFP-Cherry füzyon yapısını ifade eden görüntü hücreleri. Konfokal bir görüntüde piksel başına zamana entegre lazer yoğunluğunu, yani pikselin mikrosaniye cinsinden bekleme süresini, akusto-optik ayarlanabilir filtre (AOTF) iletimini yüzde olarak ve yakınlaştırmayı tanımlayan parametreleri ayarlayın.
- 63x yağ hedefi kullanan görüntü hücreleri ve 3x olarak ayarlanmış Yakınlaştırma . Bu, görüntü hücrelerine bütünüyle yeterli büyütme ve çözünürlük sağlar. 70-80 nm piksel boyutunu hedefleyin.
- 488 nm ve 561 nm lazer için Pixel bekleme süresini 2-4 μs ve AOTF iletimine ayarlayın, böylece görüntüler ağartma olmadan iyi bir sinyal-gürültü oranına sahip olur ve floresan yoğunluğu doygunluğunu gösteren pikseller olmaz. 488 ve 561'in lazer gücünü, kanal 1 ve kanal 3'teki sinyal seviyeleri benzer olacak şekilde ayarlamak avantajlıdır.
- Fotoçarpan (ortalama modu) kazancını 600-800 olarak ayarlayın.
- Bu ayarlarla birlikte GFP-Cherry füzyon proteinini eksprese eden 15-20 hücrenin görüntüsü. 15-20 hücre, mikroskobik kurulumun stabilitesini sağlamaya yardımcı olmak için FRET ölçüm oturumunun toplam süresini birkaç saatle sınırlı tutarken iyi istatistikler sağlar.
- GFP, Cherry, GFP ve Cherry'yi eksprese eden aynı ayar hücrelerine sahip görüntü ve transfekte olmayan hücreler. Sırasıyla yeşil kanaldaki veya kırmızı kanaldaki eksprese edici hücreleri arayın.
- Daha sonra, görüntü 15-20 hücre, sırasıyla GFP ve Cherry ile birleştiğinde, ilgilenilen proteinleri birlikte ifade eder. Eksprese edici hücreleri aramak, floresan proteinleri ağartmamak için hücrelerin uzun süre maruz kalmasını önleyin. Kiraz, GFP'den daha düşük bir fotostabiliteye sahiptir ve alıcı olan Cherry'yi ağartmak, FRET analizini tehlikeye atar.
NOT: GFP ve Cherry'nin absorpsiyonu ve emisyon spektrumları Ek Şekil 1'de gösterilmiştir. 5-6 saat ölçüm yaptıktan sonra, kurulumun stabil kaldığını ve GFP-Cherry füzyon proteininin FRET verimliliklerinin bir görüntüleme seansı sırasında önemli ölçüde değişmediğini belgelemek için görüntüleme seansının sonunda GFP-Cherry kimerasını eksprese eden birkaç hücrenin görüntülenmesinin tekrarlanması önerilir.
4. Donör söndürme ve hassaslaştırılmış emisyon kullanarak mutlak FRET verimliliklerini tespit etmek için görüntü analizi
NOT: Burada, ekli elektronik tablonun (Ek Dosya 2) kullanımıyla FRET verimliliğinin nasıl belirleneceğine ilişkin pratik bir adım adım kılavuz sağlanmaktadır. Sunulan denklemlerin teorisi ve türetilmesi önceki yayınlarda ayrıntılı olarak bulunabilir 4,15,16,17. Açıklanan ayarlarla, aşağıdaki floresan yoğunlukları toplanır.
- Kanal 1'de, donör kanalında, 488-nm uyarma ve 505-530 nm emisyon bandı ile donör sinyali I1'i ölçün.
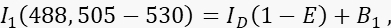
burada ID, bir alıcının yokluğunda ölçülecek olan kanal 1'deki söndürülmemiş donör sinyalidir, ortalama FRET verimliliğidir ve B1, kanal 1'deki ortalama arka plan sinyalidir. - Alıcı sinyal I 3'ü, alıcı kanal olan kanal 3'te, 561 nm uyarma ve >585 nm'de emisyon ile ölçün.
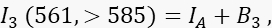
burada IA alıcı sinyaldir ve B3 kanal 3'teki arka plandır. - FRET sinyalini kanal 2'de, transfer kanalında, 488 nm uyarma ve >585 nm'de emisyon ile ölçün.
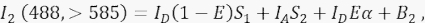
Burada, kanal 2'deki sinyal dört farklı bileşenin toplamıdır: (i) I D (1 - E) S 1, söndürülmüş donör sinyalinden >585 algılama kanalına (çapraz konuşma faktörü S 1 ile) spektral dökülmedir, (ii) IA S 2, 488 nm ışık tarafından doğrudan uyarılmadan gelen alıcı sinyaldir (çapraz konuşma faktörü S2 ile), (iii) IDEα, alıcının FRET tarafından uyarılmış donör molekülünden duyarlılaştırılmış emisyonudur (α 4.8. - 4.10'da daha ayrıntılı olarak açıklanacaktır.) ve (iv) B2 arka plan sinyalidir. - Transfekte edilmemiş veya alaycı transfekte edilmiş hücrelerde kanal 1, 2, 3'teki ortalama arka plan yoğunluklarını ölçün; ya da ihmal edilebilir bir farkla iyidir. Tüm hücre ölçümleri için, ilgi alanlarını tanımlamak ve otofloresansı artmış perinükleer veziküllerden kaçınmak için serbest el aletini kullanın. Bu perinükleer veziküllerden önemli otofloresanlardan kaçınmak önemlidir.
- Ölçümleri, sağlanan elektronik tablonun X, Y ve Z sütunlarına girin. 3 kanaldaki ortalama arka plan yoğunlukları excel elektronik tablosunun A2, B2 ve C2'sine girilir (Ek Dosya 2).
- Yalnızca GFP veya Cherry'yi eksprese eden hücrelerin 1, 2, 3 kanallarındaki ortalama yoğunlukları ölçün ve ölçümleri C, D, E ve N, O, P sütunlarına girin.
- E'yi, FRET verimliliğini hesaplamak için, çapraz konuşma faktörleri S 1 ve S 2'yi belirleyin. Spektral çapraz konuşma faktörü S1, sadece GFP'yi eksprese eden hücrelerden hesaplanır.
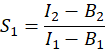
sütun I. Excel elektronik tablosundaki D2 hücresine S1 için ortalama değeri girin. - Sadece Cherry'yi eksprese eden hücrelerden spektral çapraz konuşma faktörü S2'yi hesaplayın
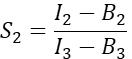
T sütununda. Excel elektronik tablosundaki E2 hücresine S 2 ortalamasını girin. - α faktörünün, kanal 1'deki herhangi bir sayıda uyarılmış GFP molekülünden gelen sinyali, kanal 2'deki eşit sayıda uyarılmış Kiraz molekülünün sinyaliyle ilişkilendirdiğinden ve
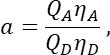

burada Q A ve QD, Cherry ve GFP'nin floresan kuantum verimleridir; ηA ve ηD, sırasıyla kanal 2 ve 1'deki alıcı ve donör floresansının tespit verimliliklerini gösterir.
NOT: α faktörü, GFP ve Cherry'nin bilinen mutlak miktarlarını ifade eden iki numuneden belirlenebilir. Bununla birlikte, bir hücrede ifade edilen GFP ve Cherry'nin tam miktarını bilmek imkansızdır. Bu nedenle, GFP-Cherry füzyon proteinini eksprese eden hücreleri kullanarak faktörü hesapladık. Burada, mutlak miktar hala bilinmemekle birlikte, donör ve alıcı moleküllerin oranının bir olduğu bilinmektedir. - GFP-Cherry füzyon proteinini eksprese eden hücrelerin 1, 2, 3 kanallarındaki ortalama yoğunlukları ölçün ve ölçümleri AE, AF, AG sütunlarına girin. Arka plan yoğunlukları çıkarılır (AH, AI, AJ'de).
- GFP-Cherry füzyon proteininin kanal 1, 2 ve 3'teki floresan yoğunluklarından α faktörünü (AJ sütunu) aşağıdaki gibi hesaplayın:
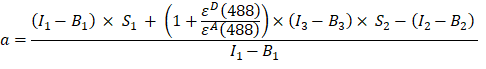
- Sırasıyla kanal 1 (I 1 - B 1), 2 (I 2 - B2) ve 3 (I 3 - B3) olarak ölçülen arka plan düzeltmeli yoğunluklar, GFP-Cherry kimera kullanılarak ölçülür. Spektral çapraz konuşma faktörü S1, sadece GFP'yi eksprese eden hücreler kullanılarak belirlendi (bkz. 4.7.). εD ve ε A, donör GFP'nin ve alıcı Kiraz'ın 488 nm'deki yok olma katsayılarıdır ve literatürden (ε GFP = 53.000 M-1 cm-1)18 ve Kirazın emilim eğrisi (εKiraz ≈ 5560 M-1 cm1) olarak belirlenebilir. Oran
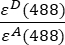 , excel elektronik tablosunun G2 hücresine girilmiştir. J2'ye α faktörün ortalama değerini girin.
, excel elektronik tablosunun G2 hücresine girilmiştir. J2'ye α faktörün ortalama değerini girin. - FRET verimliliğinin hesaplanması için belirlenen α faktörü olan E'yi aşağıdaki gibi kullanın (sütun AK):
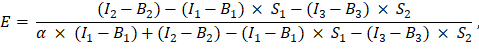
- Alternatif olarak, negatif kontroller için FRET verimliliğini, E'yi, yani GFP-Cherry füzyon proteini ölçümleri altında AD, AE ve AF sütunundaki excel sayfasındaki kanal 1, 2 ve 3'ün ölçümlerini ekleyerek GFP ve Cherry'nin birlikte ekspresyonunu ve GFP'nin tek başına ekspresyonunu belirleyin. GFP ve Cherry etiketli proteinler arasındaki FRET verimliliklerini aynı şekilde belirleyin.
- Söndürülmemiş donör yoğunluğunu, I D'yi (I 1 - B 1)/(1 - E) ve alıcı yoğunluğunu IA = I3 - B3 olarak belirleyin; bu değerler, etiketlenmiş proteinlerin ekspresyon seviyeleri ile orantılıdır.
- GFP-Cherry füzyon proteininin düzeltilmiş alıcı-donör yoğunluk oranını (Q) aşağıdaki gibi belirleyin (kolon AL):

- Diğer ko-transfekte hücreler için, alıcı-donör moleküler oranını N A / ND'yi aşağıdaki gibi hesaplayın:
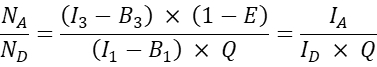
NOT: N A / N D oranını belirlemenin ve ortalama hücresel FRET verimliliği E'ye karşı N A / N D'yi çizmenin mantığı, bir donör molekülün enerjiyi birden fazla alıcıya aktarabilmesi, bir alıcı molekülün ise belirli bir zamanda yalnızca bir donörden enerji alabilmesidir. Etkileşimin stokiyometrisi nedeniyle sadece bir alıcı bir donörle etkileşime girebilse bile, alıcı konsantrasyonundaki bir artışın, kitle eylem yasası nedeniyle alıcı ile kompleks halindeki donörlerin fraksiyonunu arttırması beklenir. Bu nedenle, sabit (veya dar bir donör aralığı) ifadesi için, FRET verimliliği artan NA / ND ile artmalıdır. Bununla birlikte, GFP ve Kiraz'ın birlikte ekspresyonu için FRET verimliliği E ve N A / N D'yi çizerken, yani negatif prob, N A / ND'deki bir artış, FRET verimliliğinde bir artışa neden olmamalıdır (en azından, alıcı boyaların donör boyalara yakınlığı nedeniyle rastgele FRET'nin meydana gelmediği yeterince düşük alıcı konsantrasyonlarında).
Access restricted. Please log in or start a trial to view this content.
Sonuçlar
Şekil 1, sırasıyla donör kanal, kanal 1 (488, 505-530 nm), transfer kanalı, kanal 2 (488, >585 nm) ve alıcı kanal, kanal 3'te (561, >585 nm) elde edilen görüntüleri göstermektedir. Sadece GFP'yi, sadece Cherry'yi, GFP ve Cherry'yi birlikte eksprese eden ve GFP-Cherry füzyon proteinini eksprese eden hücrelerin temsili görüntüleri. GFP-Cherry füzyon proteinini eksprese eden NRK hücrelerinde (pozitif kontrol, Şekil 2A) ve GFP-Cherry'yi (negati...
Access restricted. Please log in or start a trial to view this content.
Tartışmalar
Sunulan protokol, alıcının duyarlılaştırılmış emisyonunun tespitini ve donör molekülün konfokal mikroskopi ile söndürülmesini kullanarak FRET'yi ölçmek için genetik olarak eşleşmiş bire bir floresan protein kalibrasyon probunun kullanımını detaylandırmaktadır. Bu yöntem, farklı hücre altı bölmelerde canlı hücrenin fizyolojik bağlamındaki protein etkileşimlerini değerlendirmek için uygulanabilir. Uzamsal çözünürlük, bir görüntünün her pikselindeki FRET verimliliklerini hesapl...
Access restricted. Please log in or start a trial to view this content.
Açıklamalar
Yazarların açıklayacak hiçbir şeyleri yoktur.
Teşekkürler
Stanford Üniversitesi Tıp Fakültesi Sinirbilim Görüntüleme Servisi'ne bu proje için ekipman ve alan sağladığı için teşekkür ederiz. Bu araştırma, Stanford Kanser Enstitüsü ve Jinekolojik Onkoloji Bölümü Stanford'un intramural finansmanının yanı sıra Macaristan Ulusal Araştırma, Geliştirme ve İnovasyon Ofisi'nden GINOP-2.3.2-15-2016-00026, GINOP-2.3.3-15-2016-00030, NN129371, ANN135107 tarafından desteklenmiştir.
Access restricted. Please log in or start a trial to view this content.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 0.5% Trypsin-EDTA without phenol red (10x) | Thermo Fisher Scientific | 15400054 | |
| Clontech mCherry N1 vector | Addgene | 3553 | |
| DMEM without phenol red | Thermo Fisher Scientific | 11054020 | |
| Fugene 6 | Promega | E2691 | |
| HEPES | Thermo Fisher Scientific | 15630080 | |
| LabTek 8-well chambers #1.0 | Thermo Fisher Scientific | 12565470 | |
| L-Glutamine (200 mM) | Thermo Fisher Scientific | 25030081 |
Referanslar
- Förster, T. Zwischenmolekulare Energiewanderung und Fluoreszenz. Annal der Physik. 437, 55-75 (1948).
- Jovin, T. M., Arndt-Jovin, D. J. Luminescence digital imaging microscopy. Annual Review of Biophysics and Biophysical Chemistry. 18, 271-308 (1989).
- Mekler, V. M. A photochemical technique to enhance sensitivity of detection of fluorescence resonance energy transfer. Photochemistry and Photobiology. 59, 615-620 (1994).
- Vamosi, G., et al. Conformation of the c-Fos/c-Jun complex in vivo: A combined FRET, FCCS, and MD-modeling study. Biophysical Journal. 94 (7), 2859-2868 (2008).
- Renz, M., Daniels, B. R., Vamosi, G., Arias, I. M., Lippincott-Schwartz, J. Plasticity of the asialoglycoprotein receptor deciphered by ensemble FRET imaging and single-molecule counting PALM imaging. Proceedings of the National Academy of Science U. S. A. 109 (44), 2989-2997 (2012).
- van Rheenen, J., Langeslag, M., Jalink, K. Correcting confocal acquisition to optimize imaging of fluorescence resonance energy transfer by sensitized emission. Biophysical Journal. 86 (4), 2517-2529 (2004).
- Muller, S. M., Galliardt, H., Schneider, J., Barisas, B. G., Seidel, T. Quantification of Forster resonance energy transfer by monitoring sensitized emission in living plant cells. Frontiers in Plant Sciences. 4, 413(2013).
- Gates, E. M., LaCroix, A. S., Rothenberg, K. E., Hoffman, B. D. Improving quality, reproducibility, and usability of FRET-based tension sensors. Cytometry Part A. 95 (2), 201-213 (2019).
- Menaesse, A., et al. Simplified instrument calibration for wide-field fluorescence resonance energy transfer (FRET) measured by the sensitized emission method. Cytometry Part A. , 24194(2020).
- Shaner, N. C., et al. Improved monomeric red, orange and yellow fluorescent proteins derived from Discosoma sp. red fluorescent protein. Nature Biotechnology. 22 (12), 1567-1572 (2004).
- Cormack, B. P., Valdivia, R. H., Falkow, S. FACS-optimized mutants of the green fluorescent protein (GFP). Gene. 173, 1 Spec No 33-38 (1996).
- Nagy, P., et al. Novel calibration method for flow cytometric fluorescence resonance energy transfer measurements between visible fluorescent proteins. Cytometry Part A. 67 (2), 86-96 (2005).
- Arai, R., Ueda, H., Kitayama, A., Kamiya, N., Nagamune, T. Design of the linkers which effectively separate domains of a bifunctional fusion protein. Protein Engineering. 14 (8), 529-532 (2001).
- Szendi-Szatmari, T., Szabo, A., Szollosi, J., Nagy, P. Reducing the detrimental effects of saturation phenomena in FRET microscopy. Analytical Chemistry. 91 (9), 6378-6382 (2019).
- Tron, L., et al. Flow cytometric measurement of fluorescence resonance energy transfer on cell surfaces. Quantitative evaluation of the transfer efficiency on a cell-by-cell basis. Biophysical Journal. 45 (5), 939-946 (1984).
- Sebestyen, Z., et al. Long wavelength fluorophores and cell-by-cell correction for autofluorescence significantly improves the accuracy of flow cytometric energy transfer measurements on a dual-laser benchtop flow cytometer. Cytometry. 48 (3), 124-135 (2002).
- Szaloki, N., et al. High throughput FRET analysis of protein-protein interactions by slide-based imaging laser scanning cytometry. Cytometry Part A. 83 (9), 818-829 (2013).
- McRae, S. R., Brown, C. L., Bushell, G. R. Rapid purification of EGFP, EYFP, and ECFP with high yield and purity. Protein Expression and Purification. 41 (1), 121-127 (2005).
- Kremers, G. J., Goedhart, J., van Munster, E. B., Gadella, T. W. Cyan and yellow super fluorescent proteins with improved brightness, protein folding, and FRET Forster radius. Biochemistry. 45 (21), 6570-6580 (2006).
- Bajar, B. T., Wang, E. S., Zhang, S., Lin, M. Z., Chu, J. A Guide to Fluorescent Protein FRET Pairs. Sensors (Basel). 16 (9), (2016).
- Scott, B. L., Hoppe, A. D. Optimizing fluorescent protein trios for 3-Way FRET imaging of protein interactions in living cells. Science Reports. 5, 10270(2015).
- Chen, Y. C., Spring, B. Q., Clegg, R. M. Fluorescence lifetime imaging comes of age how to do it and how to interpret it. Methods Molecular Biology. 875, 1-22 (2012).
- King, C., Sarabipour, S., Byrne, P., Leahy, D. J., Hristova, K. The FRET signatures of noninteracting proteins in membranes: Simulations and experiments. Biophysical Journal. 106 (6), 1309-1317 (2014).
Access restricted. Please log in or start a trial to view this content.
Erratum
Formal Correction: Erratum: Assessing Protein Interactions in Live-Cells with FRET-Sensitized Emission
Posted by JoVE Editors on 3/14/2023. Citeable Link.
An erratum was issued for: Assessing Protein Interactions in Live-Cells with FRET-Sensitized Emission. The Authors section was updated from:
György Vámosi1
Sarah Miller2
Molika Sinha2
Gabor Mocsár1
Malte Renz2
1Department of Biophysics and Cell Biology, Faculty of Medicine, University of Debrecen
2Gynecologic Oncology Division, Stanford University School of Medicine
to:
György Vámosi1
Sarah Miller2
Molika Sinha2
Maria Kristha Fernandez2
Gabor Mocsár1
Malte Renz2
1Department of Biophysics and Cell Biology, Faculty of Medicine, University of Debrecen
2Gynecologic Oncology Division, Stanford University School of Medicine
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır