Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Оценка белковых взаимодействий в живых клетках с FRET-сенсибилизированным излучением
В этой статье
Erratum Notice
Резюме
Резонансный перенос энергии Фёрстера (FRET) между двумя молекулами флуорофора может быть использован для изучения белковых взаимодействий в живой клетке. Здесь представлен протокол о том, как измерять FRET в живых клетках путем обнаружения сенсибилизированного излучения акцептора и гашения донорной молекулы с помощью конфокальной лазерной сканирующей микроскопии.
Аннотация
Резонансный перенос энергии Фёрстера (FRET) представляет собой безрадиационный перенос энергии от возбужденного донора к акцепторной молекуле и зависит от расстояния и ориентации молекул, а также от степени перекрытия между спектрами донорского излучения и акцепторного поглощения. FRET позволяет изучать взаимодействие белков в живой клетке с течением времени и в различных субклеточных компартментах. В литературе описаны различные алгоритмы измерения FRET с помощью микроскопии, основанные на интенсивности. Здесь представлены протокол и алгоритм для количественной оценки эффективности FRET, основанные на измерении как сенсибилизированного излучения акцептора, так и гашения молекулы-донора. Количественная оценка ратиометрического FRET в живой клетке требует не только определения перекрестных помех (спектрального перелива или утечки) флуоресцентных белков, но и эффективности обнаружения микроскопической установки. В приведенном здесь протоколе подробно описано, как оценить эти критические параметры.
Введение
Анализ резонансного переноса энергии Фёрстера (FRET) на основе микроскопии позволяет оценить взаимодействия между белками в живых клетках. Он предоставляет пространственную и временную информацию, включая информацию о том, где в клетке и в каком субклеточном компартменте происходит взаимодействие, и изменяется ли это взаимодействие с течением времени.
Теодор Фёрстер заложил теоретическую основу FRET в 1948 году1. FRET представляет собой безрадиационную передачу энергии от возбужденного донора к акцепторной молекуле и зависит от расстояния между молекулами и относительной ориентации их переходных диполей, а также от перекрытия между спектрами донорского излучения и акцепторного поглощения. Скорость передачи энергии обратно пропорциональна шестой степени расстояния донор-акцептор. Таким образом, FRET можно использовать для измерения молекулярной близости в диапазоне 1-10 нм.
FRET конкурирует с другими процессами девозбуждения молекулы-донора и приводит к так называемому донор-гашению и сенсибилизированному излучению акцептора. Донорное гашение — это уменьшение количества испускаемых фотонов-доноров, в то время как сенсибилизированное излучение — увеличение испускаемых акцепторных фотонов. Во многих микроскопических анализах FRET используются измерения интенсивности флуоресценции, включая акцепторное фотообесцвечивание 2, донорское фотообесцвечивание2 или FRET-сенсибилизированное фотообесцвечивание акцептора3.
Здесь представлен пошаговый экспериментальный протокол и математический алгоритм для количественной оценки FRET с использованием донорного гашения и акцепторно-сенсибилизированного излучения4,5, метода, часто называемого ратиометрическим FRET. Было опубликовано много протоколов о том, как аппроксимировать сенсибилизированное излучение, лишь немногие количественно определили абсолютную эффективность FRET 6,7,8,9. Количественная оценка эффективности FRET в живой клетке требует определения (i) перекрестных помех (спектрального перелива или утечки) флуоресцентных белков, а также (ii) эффективности обнаружения микроскопической установки. В то время как перекрестные помехи могут быть оценены путем визуализации клеток, экспрессирующих только один из флуорофоров, оценка относительной эффективности обнаружения донорской и акцепторной флуоресценции является более сложной. Это требует знания, по крайней мере, соотношения числа молекул-доноров и акцепторов, порождающих измеряемые сигналы. Однако количество флуорофоров, экспрессируемых в живых клетках, варьируется от клетки к клетке и неизвестно. Так называемый фактор α характеризует относительную силу сигнала от одной возбужденной молекулы-донора и акцептора. Знание фактора является необходимым условием для количественных измерений коэффициентометрического FRET в образцах с переменным отношением акцепторных и донорных молекул, как это происходит во время визуализации живых клеток флуоресцентными белками. Использование белка слияния донора-акцептора 1 к 1 в качестве калибровочного зонда позволяет определить фактор α, а также служит положительным контролем. Этот генетически связанный зонд экспрессируется клетками в неизвестных общих количествах, но в фиксированном и известном относительном количестве один к одному. В следующем протоколе изложено, как построить зонд 1-к-1 и как использовать его для количественной оценки эффективности FRET. Электронная таблица, включающая все формулы, может быть найдена в приложении и может использоваться читателями для ввода своих собственных измерений в соответствующие столбцы, как указано ниже.
В то время как протокол использует пару донор/акцептор GFP-Cherry, представленный подход может быть выполнен с любой другой парой FRET. Дополнительный файл 1 содержит подробную информацию о голубо-желтых парах.
Access restricted. Please log in or start a trial to view this content.
протокол
1. Плазмидная конструкция
- Для генерации зонда слияния eGFP-mCherry1 используйте вектор экспрессии клеток млекопитающих N1 (см. Таблицу материалов) со вставленным mCherry110 с использованием сайтов рестрикции AgeI и BsrGI.
- Используйте следующие олигонуклеотиды для амплификации eGFP11 без стоп-кодона в виде фрагмента SalI-BamHI : N-концевой праймер 5'-AAT, TAA, CAG, TCG, ACG, ATG, GTG, AGC, AGC, AGC, GAG G, 3' и C-концевой праймер 5'-AAT, ATA, TGG, ATC, CCG, CTT, GTA, CGT, CTC, CAT, GC 3'.
- Вставьте этот фрагмент SalI-BamHI в сайт множественного клонирования вектора N1, чтобы ввести линкер RNPPV (пять аминокислот) линкер между зеленым и красным флуоресцентным белком.
ПРИМЕЧАНИЕ: Этот линкер дает среднюю эффективность FRET для пары донор-акцептор GFP-Cherry около 0,25-0,3 (рис. 1A). Выбор жестких12 и спиральных13 линкеров различной длины для масштабирования измеренной эффективности FRET обсуждался в другом месте, но не требуется для нашей цели слияния белка. Для простоты мы будем называть флуоресцентные белки «GFP» и «Cherry».
2. Культивирование клеток и трансфекция
- Используйте любую клеточную линию, например, клетки NRK, для экспериментов FRET в средах, например, модифицированных средах Дульбекко Игла (DMEM), без фенольного красного, чтобы уменьшить фоновую флуоресценцию. По этой же причине рекомендуется использовать свободный трипсин фенола.
- После того, как клетки слились на 80%, отделите клетки с 1 мл 0,05% трипсина-ЭДТА, подсчитайте количество клеток в суспензии с помощью камеры Нойбауэра и засейте около 10 000 клеток в лунку 8-луночного покровного стекла; в качестве альтернативы, из сливной клеточной культуры, выращенной в колбе Т25, используют 1 каплю клеточной суспензии из пипетки объемом 2 мл или 3 капли из суспензии клеток объемом 5 мл из сливной культуры, выращенной в колбе для культуры Т25.
- Выращивайте клетки в 8-луночных камерах (0,8 см 2 / лунка) с покровным стеклом #1,0 для флуоресцентной микроскопии живых клеток в стандартных условиях культивирования клеток (37 ° C и 5% CO2).
- Через 24 часа после нанесения покрытия трансфицируют клетки, используя соответствующую коммерчески доступную среду для трансфекции (см. Таблицу материалов) смесью GFP, Cherry, GFP/Cherry (смесь 1:1, т.е. 0,8 мкг и 0,8 мкг GFP и плазмидной ДНК вишни) и химерой GFP-Cherry.
- Для трансфекции используют 5 мкл реагента для трансфекции в 45 мкл DMEM и 1,6 мкг плазмидной ДНК. Перемешайте, осторожно щелкнув пробирку микроцентрифуги.
- После 15-минутной инкубации смеси при комнатной температуре добавляют по 1-2 мкл смеси трансфекционных реагентов в каждую лунку 8-луночного предметного стекла. Верните камерное покровное стекло в инкубатор.
- Пусть пройдет 20 ч после трансфекции перед визуализацией живых клеток, чтобы обеспечить надлежащую экспрессию, сворачивание и созревание флуоресцентного белка, особенно красного флуорофора.
3. Визуализация FRET
- Изображение трансфицированных клеток в увлажненной и нагретой камере окружающей среды при 37 ° C. Чтобы буферизовать клеточную среду при физиологическом pH, используйте газ CO2, установленный на поток 5%, или добавьте 20 мМ HEPES, чтобы сделать клеточную среду CO 2-независимой.
- Используйте конфокальный лазерный сканирующий микроскоп. Установите возбуждение и излучение следующим образом, чтобы оптимизировать сигнал и свести к минимуму перекрестные помехи.
- Используйте линейку аргоново-ионного лазера с длиной волны 488 нм для возбуждения GFP и твердотельный лазер с диодной накачкой 561 нм (или гелий-неоновый лазер с длиной волны 543 нм, в зависимости от доступных лазерных линий), чтобы возбудить Cherry.
- Установите следующее в программном обеспечении коммерческого конфокального микроскопа. Установите Dichroic зеркало на 488/561 нажатием кнопки с помощью выпадающего меню. Собирают флуоресценцию с помощью лазерного излучения с длиной волны 488 нм для возбуждения в канале 1 через полосу излучения 505 - 530 нм (или 505 - 550 нм) и в канале 2 с фильтром длинных частот >585 нм и используют лазерный свет 561 нм для возбуждения в канале 3 с фильтром длинных частот > 585 нм (тип по длинам волн). Также могут использоваться полосовые фильтры, например, 590 - 650 нм или аналогичные, которые имеют то преимущество, что исключают рамановское рассеяние.
- Возбуждайте двумя лазерами последовательно и установите режим визуализации на Switch после каждой строки , чтобы возбуждение изображения размером 512 x 512 пикселей чередовалось после каждой строки (а не после каждого кадра, что свело бы на нет возможность обнаружения FRET из-за диффузии меченых белков при записи изображений с различными возбуждениями; нажатие кнопки).
- Настройте мини-временную серию из трех изображений нажатием кнопки, чтобы определить, происходит ли значительное фотообесцвечивание, и потенциально уменьшить мощность лазера. Фотообесцвечивание менее 1% является оптимальным. Высокая интенсивность лазера также может привести к насыщению поглощения, снижая кажущуюся эффективность FRET14. Мощность лазера до 10-20 мкВт, измеренная на линзе объектива, безопасна в использовании.
- Во-первых, ячейки изображения, экспрессирующие конструкцию слияния GFP-Cherry. Установите параметры, определяющие интегрированную по времени интенсивность лазера на пиксель в конфокальном изображении, т. е. время выдержки пикселя в микросекундах, пропускание акустооптического перестраиваемого фильтра (AOTF) в процентах и зум.
- Ячейки изображения с использованием 63-кратного масляного объектива и 3-кратного увеличения . Это обеспечивает достаточное увеличение и разрешение для изображения ячеек целиком. Стремитесь к размеру пикселя 70-80 нм.
- Установите время выдержки пикселя на 2-4 мкс и передачу AOTF для лазера с длиной волны 488 нм и 561 нм, чтобы изображения имели хорошее соотношение сигнал/шум без обесцвечивания и без пикселей, показывающих насыщенность интенсивностью флуоресценции. Выгодно отрегулировать мощность лазера 488 и 561 таким образом, чтобы уровни сигнала в канале 1 и канале 3 были одинаковыми.
- Установите коэффициент усиления фотоумножителя (режим усреднения) на 600-800.
- Изображение с этими настройками 15-20 клеток, экспрессирующих слитый белок GFP-Cherry. 15-20 ячеек обеспечивают хорошую статистику, сохраняя при этом общее время сеанса измерения FRET ограниченным несколькими часами, чтобы обеспечить стабильность микроскопической установки.
- Изображение с одинаковыми настройками ячеек, выражающих GFP, Cherry, GFP и Cherry и нетрансфицированных ячеек. Поиск экспрессирующих ячеек в зеленом или красном канале соответственно.
- Затем сфотографируйте 15-20 клеток, совместно экспрессирующих интересующие белки, связанные с GFP и Cherry соответственно. При поиске экспрессирующих клеток избегайте длительного воздействия на клетки, чтобы не обесцвечивать флуоресцентные белки. Вишня имеет более низкую фотостабильность, чем GFP, и отбеливание вишни, акцептор ставит под угрозу анализ FRET.
ПРИМЕЧАНИЕ: Спектры поглощения и излучения GFP и Cherry показаны на дополнительном рисунке 1. После измерения в течение 5-6 часов рекомендуется повторить визуализацию нескольких клеток, экспрессирующих химеру GFP-Cherry в конце сеанса визуализации, чтобы документально подтвердить, что установка оставалась стабильной и обнаруженная эффективность FRET слитого белка GFP-Cherry существенно не изменилась в ходе сеанса визуализации.
4. Анализ изображений для определения абсолютной эффективности FRET с использованием донорского гашения и сенсибилизированного излучения
ПРИМЕЧАНИЕ: Здесь приведено практическое пошаговое руководство о том, как определить эффективность FRET с помощью прилагаемой электронной таблицы (Дополнительный файл 2). С теорией и выводом представленных уравнений можно подробно ознакомиться в предыдущих публикациях 4,15,16,17. При описанных настройках собираются следующие интенсивности флуоресценции.
- Измерьте донорный сигнал I 1 в канале 1, донорском канале, с возбуждением 488 нм и полосой излучения 505-530 нм.
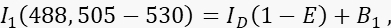
где I D - непогашенный донорский сигнал в канале 1, который был бы измерен в отсутствие акцептора, - средняя эффективность FRET, а B 1 - средний фоновый сигнал в канале 1. - Измерьте акцепторный сигнал I 3 в канале 3, канале акцептора, с возбуждением и излучением 561 нм на длине волны >585 нм.
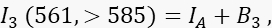
где I A — акцепторный сигнал, а B 3 — фон в канале 3. - Измерьте сигнал FRET в канале 2, канале передачи, с возбуждением и излучением 488 нм на длине волны >585 нм.
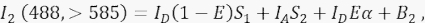
Где, сигнал в канале 2 представляет собой сумму четырех различных компонентов: (i) ID(1 - E)S 1 - спектральный перетек из погашенного сигнала-донора в канал детектирования >585 (с коэффициентом перекрестных помех S 1), (ii) I A S 2 является акцепторным сигналом от прямого возбуждения светом с длиной волны 488 нм (с коэффициентом перекрестных помех S2), (iii) I D Eα представляет собой сенсибилизированное излучение акцептора FRET от возбужденной молекулы-донора (α будет подробно описано в 4.8 - 4.10.), и (iv) B2 - фоновый сигнал. - Измерение средней интенсивности фона в каналах 1, 2, 3 в нетрансфицированных или имитационных трансфицированных клетках; И то, и другое нормально с незначительной разницей. Для всех измерений клеток используйте инструмент «свободная рука», чтобы очертить интересующие области и избежать перинуклеарных везикул с повышенной автофлуоресценцией. Важно избегать значительной аутофлуоресценции от этих перинуклеарных везикул.
- Введите измерения в столбцы X, Y и Z предоставленной электронной таблицы. Средняя интенсивность фона в 3 каналах вводится в A2, B2 и C2 электронной таблицы Excel (дополнительный файл 2).
- Измерьте среднюю интенсивность в каналах 1, 2, 3 клеток, экспрессирующих только GFP или Cherry, и введите измерения в столбцы C, D, E и N, O, P. Соответствующие фоновые интенсивности вычитаются (в F, G, H и Q, R, S).
- Чтобы рассчитать E, эффективность FRET, определите коэффициенты перекрестных помех S 1 и S2. Спектральный коэффициент перекрестных помех S1 рассчитывается из клеток, экспрессирующих только GFP
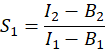
в столбце I. Введите среднее значение для S1 в ячейку D2 электронной таблицы Excel. - Рассчитайте спектральный коэффициент перекрестных помех S2 из ячеек, экспрессирующих только Cherry
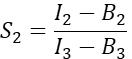
в столбце T. Введите среднее значение для S2 в ячейку E2 электронной таблицы Excel. - Убедитесь, что коэффициент α связывает сигнал от любого заданного числа возбужденных молекул GFP в канале 1 с сигналом равного числа возбужденных молекул Cherry в канале 2 и определяется формулой
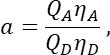

где Q A и QD - квантовые выходы флуоресценции вишни и GFP; ηA и η D эффективность детектирования акцепторной и донорной флуоресценции в каналах 2 и 1 соответственно.
ПРИМЕЧАНИЕ: Фактор α может быть определен по двум образцам, экспрессирующим известные абсолютные количества GFP и вишни. Однако невозможно узнать точное количество GFP и вишни, экспрессируемых в клетке. Поэтому мы рассчитали фактор с помощью клеток, экспрессирующих слитый белок GFP-Cherry. Здесь, хотя абсолютное количество до сих пор неизвестно, известно, что соотношение молекул-доноров и акцепторов равно единице. - Измерьте среднюю интенсивность в каналах 1, 2, 3 клеток, экспрессирующих слитый белок GFP-Cherry, и введите измерения в столбцы AE, AF, AG. Интенсивность фона вычитается (в AH, AI, AJ).
- Рассчитайте коэффициент α (столбец AJ) по интенсивности флуоресценции в каналах 1, 2 и 3 белка слияния GFP-Cherry следующим образом:
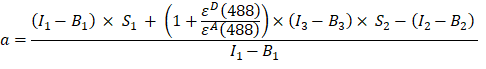
- Интенсивности с поправкой на фон, измеренные в каналах 1 (I 1 - B 1), 2 (I 2 - B 2) и 3 (I 3 - B3), соответственно, измеряются с использованием химеры GFP-Cherry. Фактор спектральных перекрестных помех S1 определяли с использованием клеток, экспрессирующих только GFP (см. 4.7.). εD и ε A являются коэффициентами экстинкции GFP, донора, и вишни, акцептора, при 488 нм и могут быть определены из литературы (ε GFP = 53 000 М-1 см-1)18 и кривой поглощения вишни (εCherry ≈ 5560 M-1см 1). Соотношение
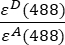 было введено в ячейку G2 электронной таблицы Excel. Введите среднее значение множителя α в J2.
было введено в ячейку G2 электронной таблицы Excel. Введите среднее значение множителя α в J2. - Для расчета КПД FRET, E, используйте определенный коэффициент α следующим образом (колонка AK):
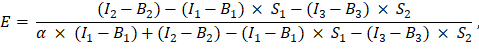
- В качестве альтернативы определите эффективность FRET, E, для отрицательного контроля, т. е. коэкспрессии GFP и Cherry и экспрессии только GFP, добавив измерения каналов 1, 2 и 3 на листе Excel в столбцах AD, AE и AF под измерениями слитого белка GFP-Cherry. Определите эффективность FRET между интересующими белками GFP и Cherry.
- Определить интенсивность неугасимого донора, I D как (I 1 - B 1)/(1 - E), а акцепторную интенсивность как I A = I 3 - B3; Эти значения пропорциональны уровням экспрессии меченых белков.
- Определите скорректированное отношение интенсивности акцептора к донору (Q) слитого белка GFP-Cherry следующим образом (столбец AL):

- Для других котрансфицированных клеток рассчитайте молекулярное отношение акцептора к донору NA /N D следующим образом:
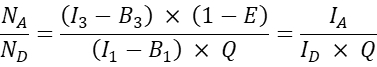
ПРИМЕЧАНИЕ: Обоснование для определения соотношения N A/N D и построения графика средней клеточной эффективности FRET E по сравнению с N A / N D заключается в том, что одна молекула-донор может передавать энергию нескольким акцепторам, в то время как молекула-акцептор может получать энергию только от одного донора в данный момент времени. Даже если только один акцептор может взаимодействовать с донором из-за стехиометрии взаимодействия, ожидается, что увеличение концентрации акцептора увеличит долю доноров в комплексе с акцептором из-за закона действия масс. Таким образом, для фиксированной (или узкого диапазона) донорской экспрессии эффективность FRET должна возрастать с увеличением N A/ND. Однако при построении графика эффективности FRET E по сравнению с N A/N D для совместной экспрессии GFP и Cherry, т.е. отрицательного зонда, увеличение NA/N D не должно приводить к увеличению эффективности FRET (по крайней мере, при достаточно низких концентрациях акцепторов, когда случайный FRET из-за близости акцепторных красителей к донорным красителям не возникает).
Access restricted. Please log in or start a trial to view this content.
Результаты
На рисунке 1 показаны изображения, полученные в донорном канале, канале 1 (488, 505-530 нм), канале передачи, канале 2 (488, >585 нм) и акцепторном канале, канале 3 (561, >585 нм) соответственно. Репрезентативные изображения клеток, экспрессирующих только GFP, только вишню, ...
Access restricted. Please log in or start a trial to view this content.
Обсуждение
В представленном протоколе подробно описано использование генетически связанного взаимно-однозначного калибровочного зонда флуоресцентного белка для количественной оценки FRET с использованием детектирования сенсибилизированного излучения акцептора и гашения донорной молекулы ме...
Access restricted. Please log in or start a trial to view this content.
Раскрытие информации
Авторам раскрывать нечего.
Благодарности
Мы хотели бы поблагодарить Службу визуализации неврологии в Медицинской школе Стэнфордского университета за предоставление оборудования и места для этого проекта. Это исследование было поддержано очным финансированием Стэнфордского института рака и отделения гинекологической онкологии Стэнфорда, а также GINOP-2.3.2-15-2016-00026, GINOP-2.3.3-15-2016-00030, NN129371, ANN135107 от Национального управления исследований, разработок и инноваций, Венгрия.
Access restricted. Please log in or start a trial to view this content.
Материалы
| Name | Company | Catalog Number | Comments |
| 0.5% Trypsin-EDTA without phenol red (10x) | Thermo Fisher Scientific | 15400054 | |
| Clontech mCherry N1 vector | Addgene | 3553 | |
| DMEM without phenol red | Thermo Fisher Scientific | 11054020 | |
| Fugene 6 | Promega | E2691 | |
| HEPES | Thermo Fisher Scientific | 15630080 | |
| LabTek 8-well chambers #1.0 | Thermo Fisher Scientific | 12565470 | |
| L-Glutamine (200 mM) | Thermo Fisher Scientific | 25030081 |
Ссылки
- Förster, T. Zwischenmolekulare Energiewanderung und Fluoreszenz. Annal der Physik. 437, 55-75 (1948).
- Jovin, T. M., Arndt-Jovin, D. J. Luminescence digital imaging microscopy. Annual Review of Biophysics and Biophysical Chemistry. 18, 271-308 (1989).
- Mekler, V. M. A photochemical technique to enhance sensitivity of detection of fluorescence resonance energy transfer. Photochemistry and Photobiology. 59, 615-620 (1994).
- Vamosi, G., et al. Conformation of the c-Fos/c-Jun complex in vivo: A combined FRET, FCCS, and MD-modeling study. Biophysical Journal. 94 (7), 2859-2868 (2008).
- Renz, M., Daniels, B. R., Vamosi, G., Arias, I. M., Lippincott-Schwartz, J. Plasticity of the asialoglycoprotein receptor deciphered by ensemble FRET imaging and single-molecule counting PALM imaging. Proceedings of the National Academy of Science U. S. A. 109 (44), 2989-2997 (2012).
- van Rheenen, J., Langeslag, M., Jalink, K. Correcting confocal acquisition to optimize imaging of fluorescence resonance energy transfer by sensitized emission. Biophysical Journal. 86 (4), 2517-2529 (2004).
- Muller, S. M., Galliardt, H., Schneider, J., Barisas, B. G., Seidel, T. Quantification of Forster resonance energy transfer by monitoring sensitized emission in living plant cells. Frontiers in Plant Sciences. 4, 413(2013).
- Gates, E. M., LaCroix, A. S., Rothenberg, K. E., Hoffman, B. D. Improving quality, reproducibility, and usability of FRET-based tension sensors. Cytometry Part A. 95 (2), 201-213 (2019).
- Menaesse, A., et al. Simplified instrument calibration for wide-field fluorescence resonance energy transfer (FRET) measured by the sensitized emission method. Cytometry Part A. , 24194(2020).
- Shaner, N. C., et al. Improved monomeric red, orange and yellow fluorescent proteins derived from Discosoma sp. red fluorescent protein. Nature Biotechnology. 22 (12), 1567-1572 (2004).
- Cormack, B. P., Valdivia, R. H., Falkow, S. FACS-optimized mutants of the green fluorescent protein (GFP). Gene. 173, 1 Spec No 33-38 (1996).
- Nagy, P., et al. Novel calibration method for flow cytometric fluorescence resonance energy transfer measurements between visible fluorescent proteins. Cytometry Part A. 67 (2), 86-96 (2005).
- Arai, R., Ueda, H., Kitayama, A., Kamiya, N., Nagamune, T. Design of the linkers which effectively separate domains of a bifunctional fusion protein. Protein Engineering. 14 (8), 529-532 (2001).
- Szendi-Szatmari, T., Szabo, A., Szollosi, J., Nagy, P. Reducing the detrimental effects of saturation phenomena in FRET microscopy. Analytical Chemistry. 91 (9), 6378-6382 (2019).
- Tron, L., et al. Flow cytometric measurement of fluorescence resonance energy transfer on cell surfaces. Quantitative evaluation of the transfer efficiency on a cell-by-cell basis. Biophysical Journal. 45 (5), 939-946 (1984).
- Sebestyen, Z., et al. Long wavelength fluorophores and cell-by-cell correction for autofluorescence significantly improves the accuracy of flow cytometric energy transfer measurements on a dual-laser benchtop flow cytometer. Cytometry. 48 (3), 124-135 (2002).
- Szaloki, N., et al. High throughput FRET analysis of protein-protein interactions by slide-based imaging laser scanning cytometry. Cytometry Part A. 83 (9), 818-829 (2013).
- McRae, S. R., Brown, C. L., Bushell, G. R. Rapid purification of EGFP, EYFP, and ECFP with high yield and purity. Protein Expression and Purification. 41 (1), 121-127 (2005).
- Kremers, G. J., Goedhart, J., van Munster, E. B., Gadella, T. W. Cyan and yellow super fluorescent proteins with improved brightness, protein folding, and FRET Forster radius. Biochemistry. 45 (21), 6570-6580 (2006).
- Bajar, B. T., Wang, E. S., Zhang, S., Lin, M. Z., Chu, J. A Guide to Fluorescent Protein FRET Pairs. Sensors (Basel). 16 (9), (2016).
- Scott, B. L., Hoppe, A. D. Optimizing fluorescent protein trios for 3-Way FRET imaging of protein interactions in living cells. Science Reports. 5, 10270(2015).
- Chen, Y. C., Spring, B. Q., Clegg, R. M. Fluorescence lifetime imaging comes of age how to do it and how to interpret it. Methods Molecular Biology. 875, 1-22 (2012).
- King, C., Sarabipour, S., Byrne, P., Leahy, D. J., Hristova, K. The FRET signatures of noninteracting proteins in membranes: Simulations and experiments. Biophysical Journal. 106 (6), 1309-1317 (2014).
Access restricted. Please log in or start a trial to view this content.
Erratum
Formal Correction: Erratum: Assessing Protein Interactions in Live-Cells with FRET-Sensitized Emission
Posted by JoVE Editors on 3/14/2023. Citeable Link.
An erratum was issued for: Assessing Protein Interactions in Live-Cells with FRET-Sensitized Emission. The Authors section was updated from:
György Vámosi1
Sarah Miller2
Molika Sinha2
Gabor Mocsár1
Malte Renz2
1Department of Biophysics and Cell Biology, Faculty of Medicine, University of Debrecen
2Gynecologic Oncology Division, Stanford University School of Medicine
to:
György Vámosi1
Sarah Miller2
Molika Sinha2
Maria Kristha Fernandez2
Gabor Mocsár1
Malte Renz2
1Department of Biophysics and Cell Biology, Faculty of Medicine, University of Debrecen
2Gynecologic Oncology Division, Stanford University School of Medicine
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены