Method Article
تسليم مركب البروتين الريبي النووي Cas9/sgRNA في الخلايا الخالدة والأولية عبر جزيئات تشبه الفيروسات ("الشفرات النانوية")
In This Article
Summary
لقد طورنا بروتوكولا بسيطا وغير مكلف لتحميل مجمعات البروتين الريبي النووي الريبي Cas9 / RNA أحادي التوجيه (sgRNA) داخل جزيئات تشبه الفيروسات. تسمح هذه الجسيمات ، التي تسمى "Nanoblades" ، بالتسليم الفعال لمركب Cas9 / sgRNA في الخلايا الخالدة والأولية وكذلك في الجسم الحي.
Abstract
أدى نظام التكرار الباليندرومي القصير المتجمع بانتظام (CRISPR)-Cas إلى إضفاء الطابع الديمقراطي على تحرير الجينوم في الخلايا حقيقية النواة وأدى إلى تطوير العديد من التطبيقات المبتكرة. ومع ذلك ، فإن توصيل بروتين Cas9 والحمض النووي الريبي أحادي التوجيه (sgRNA) إلى الخلايا المستهدفة يمكن أن يكون تحديا تقنيا. تسمح النواقل الفيروسية الكلاسيكية، مثل تلك المشتقة من فيروسات lentivirus (LVs) أو الفيروسات المرتبطة بالغدية (AAVs)، بتوصيل فعال لترميز الجينات المحورة لبروتين Cas9 والحمض النووي الريبوزي المرسال المرتبط به في العديد من الخلايا الأولية وفي الجسم الحي. ومع ذلك، يمكن أن تعاني هذه النواقل من عيوب مثل دمج الجين المتحول في جينوم الخلية المستهدفة، وسعة شحن محدودة، والتعبير طويل الأجل عن بروتين Cas9 وتوجيه الحمض النووي الريبي في الخلايا المستهدفة.
للتغلب على بعض هذه المشاكل ، تم تطوير ناقل توصيل يعتمد على فيروس سرطان الدم الفئراني (MLV) لتعبئة بروتين Cas9 والحمض النووي الريبي المرتبط به في غياب أي جين محوري مشفر. من خلال دمج بروتين Cas9 مع المحطة C للبروتين الهيكلي Gag من MLV ، تم تشكيل جزيئات تشبه الفيروسات (VLPs) محملة ببروتين Cas9 و sgRNA (المسمى "Nanoblades"). يمكن جمع الشفرات النانوية من الوسط الزراعي للخلايا المنتجة ، وتنقيتها ، وتحديدها كميا ، واستخدامها لنقل الخلايا المستهدفة وتقديم مركب Cas9 / sgRNA النشط. تقوم الشفرات النانوية بتوصيل شحناتها من البروتين النووي الريبي (RNP) بشكل عابر وسريع في مجموعة واسعة من الخلايا الأولية والخالدة ويمكن برمجتها لتطبيقات أخرى ، مثل التنشيط النسخي العابر للجينات المستهدفة ، باستخدام بروتينات Cas9 المعدلة. الشفرات النانوية قادرة على تحرير الجينوم في الجسم الحي في كبد الفئران البالغة المحقونة وفي البويضات لتوليد معدلة وراثيا. وأخيرا ، يمكن تعقيدها مع الحمض النووي للمتبرع من أجل الإصلاح الموجه "الخالي من الانتقالات". يعد إعداد Nanoblade بسيطا ومنخفض التكلفة نسبيا ويمكن تنفيذه بسهولة في أي مختبر لبيولوجيا الخلية.
Introduction
بالمقارنة مع النوكلياز الأخرى القابلة للبرمجة ، قام نظام CRISPR-Cas بتبسيط وإضفاء الطابع الديمقراطي بشكل كبير على إجراء استهداف الجينوم الخاص بالتسلسل والانقسام في الخلايا حقيقية النواة. من خلال التعبير البسيط عن sgRNA، يمكن للمستخدمين برمجة بروتين Cas9 (أو المتغيرات المحسنة) لأي موضع خلوي تقريبا1. في هذا السيناريو، يصبح تسليم بروتين Cas9 و sgRNA القيد الرئيسي عند إجراء الطفرات الموجهة للموقع. في الخلايا المخلدة ، يمكن التعبير بسهولة عن sgRNA وبروتين Cas من البلازميدات المنقولة لتحقيق استهداف الجينوم الفعال في معظم الخلايا. ومع ذلك ، فإن التعبير التأسيسي لمركب Cas9 / sgRNA يمكن أن يزيد من النشاط غير المستهدف لبروتين Cas9 وإدخال تغييرات غير مرغوب فيها في loci2 غير محددة. في الخلايا الأولية ، يمكن أن يكون من الصعب تقنيا تحقيق نقل الحمض النووي ويؤدي إلى ضعف التعبير أو نسبة صغيرة من الخلايا المنقولة. تشمل بدائل نقل الحمض النووي الكلاسيكي استخدام النواقل الفيروسية التي توفر ترميزا جينيا متحولا ل Cas9 و sgRNA أو التفريغ الكهربائي لبروتين Cas9 المؤتلف مقترنا ب sgRNA اصطناعي. ومع ذلك ، يمكن أن تؤدي هذه الأساليب إلى تكامل الجينات المحورة داخل جينوم مضيف الخلية (كما هو الحال بالنسبة لناقلات التعبير الفيروسية الرجعية والفيروسية الرجعية الكلاسيكية) ، والتقييد بواسطة العوامل الخلوية ، وتؤدي إلى التعبير التأسيسي لبروتين Cas9 و sgRNA.
يمكن أن يتغلب الكهربية لمركب Cas9 / sgRNA RNP على معظم هذه المشاكل ويؤدي إلى تسليم فعال وعابر في الخلايا الأولية وفي الجسم الحي بالإضافة إلى السماح باستجابة تعتمد على الجرعة. ومع ذلك ، فإنه يعتمد عادة على معدات وكواشف باهظة الثمن ومن الصعب أيضا الارتقاء به إذا كان لا بد من معالجة عدد كبير من الخلايا. كبديل للتقنيات المذكورة أعلاه ، طور هؤلاء المؤلفون "Nanoblades" - وهو ناقل توصيل فيروسي رجعي لبروتين Cas9 و sgRNA3 يشبه من الناحية المفاهيمية أنظمة توصيل بروتين القفيصة الأخرى المشتقة من الفيروسات4،5،6،7،8. تستغل الشفرات النانوية القدرة الطبيعية للبروتين المتعدد Gag من الفيروسات القهقرية لإنتاج VLPs التي يتم إطلاقها في الوسط خارج الخلية ، عندما يتم التعبير عنها بمفردها في الخلايا المستزرعة9. من خلال دمج بروتين Cas9 في الطرف الطرفي C من بروتين هفوة فيروس سرطان الدم الفئران (MLV) والمشاركة في التعبير عن sgRNA والبروتينات السكرية المغلفة الفيروسية ، يمكن تغليف بروتين Cas9 داخل VLPs أو Nanoblades الصادرة. عند التنقية ، يمكن احتضان Nanoblades بالخلايا المستهدفة أو حقنها في الجسم الحي للتوسط في التسليم السريع والعابر والمعتمد على الجرعة لمركب Cas9 / sgRNA RNP 3.
يمكن برمجة الشفرات النانوية باستخدام sgRNAs متعددة للتحرير المتزامن في مواقع مختلفة أو مع متغيرات Cas9 لأداء تطبيقات أخرى مثل تنشيط النسخ أو القمع الخاص بالهدف 3. وعلى النقيض من كهربية البروتين، التي تعتمد على التعبير المؤتلف، يمكن بسهولة استنساخ متغيرات كاس الموصوفة حديثا من الأدبيات في متجه التعبير الانصهاري Gag، مما يجعلها منصة متعددة الاستخدامات. يمكن زيادة تعقيد الشفرات النانوية أو تحميلها بأوليغوديوكسي نيوكليوتيدات أحادية الخيط ومزدوجة الخيوط (ssODNs) لإجراء إصلاح موجه نحو التماثل3. إنتاج Nanoblade بسيط نسبيا ورخيص. علاوة على ذلك ، يمكن تخزين Nanoblades عند 4 درجات مئوية لعدة أيام أو عند -80 درجة مئوية للتخزين على المدى الطويل. عادة ما تتوسط الشفرات النانوية في تحرير الجينوم الفعال والخالي من الجينات في معظم الخلايا الخالدة والأولية المستزرعة. ومع ذلك ، قد تكون بعض الخلايا الأولية حساسة لوجود جزيئات فيروسية ، مما يؤدي إلى زيادة معدل الوفيات. يمكن أن تتفاعل خلايا الجهاز المناعي الفطري أيضا مع وجود شفرات نانوية (بسبب أصلها الفيروسي) وتصبح نشطة. في هذه الحالات ، يجب تحسين بروتوكول النقل للحد من وقت التعرض للشفرات النانوية وتقليل التأثيرات غير المحددة. تمثل الشفرات النانوية بديلا قابلا للتطبيق وسهل التنفيذ لطرق توصيل CRISPR الأخرى المتاحة.
Protocol
1. تصميم واستنساخ sgRNA
ملاحظة: يمكن الحصول على إرشادات لتصميم sgRNAs من مصادر متعددة مثل https://blog.addgene.org/how-to-design-your-grna-for-crispr-genome-editing أو من Hanna و Doench10.
- بمجرد تصميم تسلسلات 20 من النيوكليوتيدات sgRNA ، اطلب أوليغونوكليوتيدات الحمض النووي أحادية الخيط التالية:
- إلى الأمام: 5' caccgNNNNNNNNNNNNNNNNNNNNNNNNNN 3' (N يتوافق مع الموضع المستهدف بدون تسلسل الشكل المجاور للفاصل الأولي (PAM) )
- العكس: 5' aaacNNNNNNNNNNNNNNNNNNNNNNNNc 3' (N يتوافق مع المكمل العكسي للموضع المستهدف بدون تسلسل PAM)
ملاحظة: لا يلزم إجراء تعديلات خاصة عند طلب أوليغونوكليوتيدات (لا يوجد شرط للفوسفات 5 ').
- قم بتهجين اثنين من أوليغونوكليوتيدات الحمض النووي في أنبوب تفاعل البوليميراز المتسلسل (PCR) سعة 0.2 مل عن طريق خلط 5 ميكرولتر من المخزن المؤقت للتلدين (500 مللي متر كلوريد الصوديوم ؛ 100 ملليمتر تريس هيدروكلوريد ؛ 100 مللي متر MgCl2 ؛ 10 ميكرومتر DTT ؛ الرقم الهيدروجيني 7.9 عند 25 درجة مئوية) ، 1 ميكرولتر من كل قليل النوكليوتيد الحمض النووي (محلول مخزون 100 ميكرومتر في الماء) ، و 42 ميكرولتر من الماء.
- على كتلة PCR ، احتضن العينات عند 95 درجة مئوية لمدة 15 ثانية ثم اخفض درجة الحرارة إلى 20 درجة مئوية مع منحدر قدره 0.5 درجة مئوية / ثانية. يحفظ في درجة حرارة الغرفة أو يخزن في درجة حرارة -20 درجة مئوية.
ملاحظة: يمكن إيقاف البروتوكول مؤقتا هنا. - هضم 10 ميكروغرام من بلازميدات التعبير BLADE أو SUPERBLADE sgRNA مع 10 وحدات من إنزيم تقييد BsmBI-v2 لمدة 3 ساعات عند 55 درجة مئوية في حجم تفاعل إجمالي قدره 50 ميكرولتر.
ملاحظة: يجب أن يطلق المتجه المهضوم إدراج الحمض النووي من ~ 1.9 كيلو بايت وجزء ثان من الحمض النووي من ~ 3.3 كيلو بايت. - قم بتحميل تفاعل التقييد على هلام أغاروز 1٪ ملطخ ب 5 ميكروغرام / مل من بروميد الإيثيديوم (أو بقعة هلام الحمض النووي البديلة الأكثر أمانا).
ملاحظة: ارتد معدات الحماية المناسبة عند التلاعب ببروميد الإيثيديوم، الذي يشتبه في أنه يسبب عيوبا وراثية.- على طاولة الأشعة فوق البنفسجية (UV) المحددة على طول موجي يبلغ 312 نانومتر (لتجنب إتلاف الحمض النووي) ، اقطع جزء الحمض النووي 3.3 كيلو بايت من الجل ، وضعه في أنبوب جهاز طرد مركزي دقيق 1.5 مل.
ملاحظة: ارتد معدات الحماية المناسبة (القفازات ونظارات الحماية من الأشعة فوق البنفسجية) عند التعامل مع بروميد الإيثيديوم والعمل على طاولة الأشعة فوق البنفسجية. - استخراج الحمض النووي من شرائح الجل التي تحتوي على جزء الحمض النووي 3.3 كيلو بايت باستخدام مجموعة مخصصة لاستخراج هلام الحمض النووي (انظر جدول المواد). حدد كمية الحمض النووي النقي باستخدام مقياس الطيف الضوئي.
ملاحظة: يمكن إيقاف البروتوكول مؤقتا هنا.
- على طاولة الأشعة فوق البنفسجية (UV) المحددة على طول موجي يبلغ 312 نانومتر (لتجنب إتلاف الحمض النووي) ، اقطع جزء الحمض النووي 3.3 كيلو بايت من الجل ، وضعه في أنبوب جهاز طرد مركزي دقيق 1.5 مل.
- قم بتحريك أوليغونوكليوتيدات الحمض النووي الهجينة إلى الأمام والعكسي من الخطوة 1.2 إلى الشفرات المهضومة بالهلام BsmB1 أو متجه SUPERBLADE من الخطوة 1.5.2. لهذا ، أضف 2 ميكرولتر من المخزن المؤقت للحمض النووي T4 ، و 50 نانوغرام من الناقل المنقى بالهلام (من الخطوة 1.5.2) ، و 1 ميكرولتر من أوليغونوكليوتيدات الحمض النووي الهجينة (من الخطوة 1.2) ، والماء لتكوين الحجم إلى 19 ميكرولتر ، و 1 ميكرولتر من ليغاز الحمض النووي T4. احتضان التفاعل عند 25 درجة مئوية لمدة 10 دقائق.
- قم بتحويل منتج الربط إلى بكتيريا مختصة (انظر جدول المواد) كما هو موضح في11. قم بصب البكتيريا المتحولة على صفيحة الأمبيسلين لوريا بيرتاني أجار واحتضنها بين عشية وضحاها عند 37 درجة مئوية.
- حدد عدة مستعمرات معزولة على صفيحة الأجار لإجراء تحضير الحمض النووي المصغر11 (انظر جدول المواد)، وقم بإجراء تسلسل سانجر باستخدام تمهيدي أمامي U6 (5 أقدام GACTATCATATGCTTACCGT 3 بوصة) للتحقق من الربط الصحيح لتسلسل متغير sgRNA.
ملاحظة: يمكن استخدام بلازميدات تعبير sgRNA الأخرى إذا لم ترمز لبروتين Cas9 ، مما قد يتداخل مع إنتاج Nanoblade.
2. إعداد البلازميد
- قم بإجراء التحضير الأقصى (انظر جدول المواد) لجميع البلازميدات المطلوبة ، وإعداد 10 ميكروغرام من الأليكوتات عند 1 ميكروغرام / مل لتخزينها عند -20 درجة مئوية. تجنب دورات التجميد / الذوبان المتكررة للبلازميدات ؛ استخدم aliquots مرتين قبل التخلص منها.
3. إعداد نانوبليد
- في اليوم الأول ، البذور بين 3.5 و 4 × 106 خلايا HEK293T (انظر جدول المواد) في 10 مل من وسط النسر المعدل من دولبيكو (DMEM) الذي يحتوي على نسبة عالية من الجلوكوز ، بيروفات الصوديوم ، L-glutamine ، مصل بقري جنيني 10٪ (FBS) ، والبنسلين / الستربتومايسين في طبق زراعة الخلايا 10 سم. حرك الطبق الذي يبلغ طوله 10 سم بلطف للخلف وإلى الأمام ، ثم من اليمين إلى اليسار (كرر هذا التسلسل 5x) لتوزيع الخلايا بشكل متجانس على طبق الاستزراع. احتضان الخلايا عند 37 درجة مئوية في حاضنة الخلايا مع 5٪ CO2.
ملاحظة: يجب تنفيذ جميع الإجراءات المتعلقة بالتعامل مع الخلايا المستزرعة والشفرات النانوية تحت غطاء التدفق الرقائقي لزراعة الخلايا لتجنب تلوثها. - اليوم 2: نقل البلازميد
- يجب أن تكون الخلايا 70-80٪ ملتقية 24 ساعة بعد الطلاء (الشكل 1A). استبدل الوسط ب 10 مل من DMEM الطازج الذي يحتوي على نسبة عالية من الجلوكوز ، بيروفات الصوديوم ، L-glutamine ، 10٪ FBS (يمكن حذف البنسلين والستربتومايسين على الرغم من أنه ليس إلزاميا) قبل النقل.
ملاحظة: في هذه الخطوة، من المهم ألا تكون الخلايا ملتقية. خلاف ذلك ، يمكن تقليل كفاءة النقل وكذلك إنتاج الجسيمات. - لكل صفيحة طولها 10 سم، قم بإعداد الكميات التالية من البلازميدات في أنبوب 1.5 مل: 0.3 ميكروغرام PCMV-VSV-G، 0.7 ميكروغرام pBaEVRless، 2.7 ميكروغرام MLV Gag/Pol، 1.7 ميكروغرام BIC-Gag-Cas9، 4.4 ميكروغرام من الشفرات أو SUPERBLADES البلازميد الذي يشفر الحمض النووي الريبوزي المرسال المستنسخ (أو 2.2 ميكروغرام لكل منهما إذا كان يستخدم اثنين من الحمض النووي الريبوزي المرسال).
- أضف 500 ميكرولتر من المخزن المؤقت للنقل (انظر جدول المواد) ، والدوامة لمدة 10 ثوان ، ثم جهاز الطرد المركزي لمدة 1 ثانية. أضف 20 ميكرولتر من كاشف النقل (انظر جدول المواد) ، ودوامة الأنبوب لمدة 1 ثانية ، ثم جهاز طرد مركزي لمدة 1 ثانية.
- احتضن لمدة 10 دقائق في درجة حرارة الغرفة ، وأضف المحلول بأكمله قطرة إلى الخلايا في وسط DMEM باستخدام ماصة P1000. حرك الصفيحة مقاس 10 سم بلطف للخلف وإلى الأمام ، ثم من اليمين إلى اليسار (كرر هذا التسلسل 5x) لتوزيع كاشف النقل بشكل موحد على الخلايا. احتضان الخلايا عند 37 درجة مئوية لمدة 40 ساعة على الأقل في حاضنة الخلايا مع 5٪ CO2.
ملاحظة: إذا رغبت في ذلك ، يمكن تغيير الوسط بعد 4 ساعات من النقل.
- يجب أن تكون الخلايا 70-80٪ ملتقية 24 ساعة بعد الطلاء (الشكل 1A). استبدل الوسط ب 10 مل من DMEM الطازج الذي يحتوي على نسبة عالية من الجلوكوز ، بيروفات الصوديوم ، L-glutamine ، 10٪ FBS (يمكن حذف البنسلين والستربتومايسين على الرغم من أنه ليس إلزاميا) قبل النقل.
- في اليوم 3 ، تحقق من مورفولوجيا الخلايا المنقولة تحت المجهر.
ملاحظة: ستبدأ الخلايا المنتجة في الاندماج. هذا أمر طبيعي بسبب التعبير عن المغلفات الفيروسية المزعجة المنشأ (الشكل 1B ، C). - اليوم 4: حصاد الشفرات النانوية
ملاحظة: بعد 40 ساعة على الأقل من النقل ، كانت الخلايا قد اندمجت معا بسبب التعبير عن المغلفات الفيروسية الفوسوجينية ، وفي بعض الأحيان ، تكون الخلايا منفصلة تماما عن دعم اللوحة (الشكل 1D).- اجمع 9 مل من السوبر نات المتوسط للثقافة باستخدام ماصة 10 مل.
ملاحظة: الشفرات النانوية هي VLPs قادرة على توصيل بروتين Cas9 و sgRNA المرتبط به إلى الخلايا الأولية وفي الجسم الحي. على الرغم من أنها لا تعتبر كائنات معدلة وراثيا لأنها خالية من المواد الوراثية ، إلا أنها يمكن أن تحفز التغيرات الجينية. لذلك ، يجب التعامل معها بحذر لتجنب أي اتصال مع المستخدمين (خاصة إذا كانت مبرمجة لاستهداف الجينات المثبطة للورم). وينصح المستعملون باتباع المبادئ التوجيهية المحلية للسلامة الخاصة بهم فيما يتعلق بمعالجة نواقل الفيروسات القهقرية والعمل في مختبر على مستوى BSL-2 عند إعداد ال VLPs وإجراء تجارب التوصيل. يمكن تعطيل الشفرات النانوية بنسبة 70٪ من الإيثانول أو 0.5٪ من هيبوكلوريت الصوديوم. من المستحسن أيضا معالجة جميع النفايات البلاستيكية (نصائح الماصة ، لوحات زراعة الأنسجة ، أنابيب الطرد المركزي) مع هيبوكلوريت الصوديوم بنسبة 0.5٪ لمدة 10 دقائق على الأقل لتعطيل Nanoblades. - قم بطرد مركزي للجهاز الفائق الذي تم جمعه عند 500 × جم لمدة 5 دقائق لإزالة الحطام الخلوي واستعادة السوبرنات دون إزعاج بيليه الخلية.
ملاحظة: إذا كان من المفترض استخدام الشفرات النانوية على الخلايا الأولية، فقم بتصفية المادة الفائقة باستخدام مرشح 0.45 ميكرومتر أو 0.8 ميكرومتر. كن على علم بأن هذه الخطوة تقلل بشكل كبير من عيار Nanoblade حيث سيتم حظر جزء كبير في غشاء المرشح. - قم بتكوير الشفرات النانوية بين عشية وضحاها (12-16 ساعة) في دوار دلو متأرجح عند 4,300 × جم أو عند 209,490 × جم في جهاز طرد مركزي فائق لمدة 75 دقيقة عند 4 درجات مئوية (انظر جدول المواد).
ملاحظة: إذا كان بإمكان الخلايا المستهدفة أن تنمو في DMEM ، فمن الممكن احتضانها مباشرة باستخدام supernatant الذي تم الحصول عليه بعد الخطوة 3.4.2 دون تركيز Nanoblades.
- اجمع 9 مل من السوبر نات المتوسط للثقافة باستخدام ماصة 10 مل.
- اليوم 5: إعادة تعليق وتخزين الشفرات النانوية
- بعد الطرد المركزي ، قم بشفط الوسط ببطء وأعد تعليق الكريات البيضاء مع 100 ميكرولتر من الملح البارد 1x المخزن بالفوسفات (PBS). قم بتغطية الأنبوب بالبارافيلم ، واحتضنه لمدة 1 ساعة عند 4 درجات مئوية مع إثارة لطيفة قبل إعادة تعليق الكريات عن طريق السحب لأعلى ولأسفل.
ملاحظة: قد تظهر مادة بيضاء لزجة عند إعادة التعليق؛ هذا أمر طبيعي ولا يؤثر بشكل كبير على كفاءة النقل. - قم بتخزين الشفرات النانوية على درجة حرارة 4 درجات مئوية إذا كنت تخطط لاستخدامها في غضون أربعة أسابيع. خلاف ذلك ، قم بتجميد Nanoblades في النيتروجين السائل وتخزينها عند -80 درجة مئوية.
ملاحظة: ارتد نظارات الحماية والقفازات المبردة عند التعامل مع النيتروجين السائل. يؤدي التجميد المفاجئ والتخزين عند -80 درجة مئوية إلى انخفاض كبير في كفاءة Nanoblade. علاوة على ذلك ، لا ينبغي تجميد Nanoblades المذابة مرة أخرى. يمكن إيقاف البروتوكول مؤقتا هنا.
- بعد الطرد المركزي ، قم بشفط الوسط ببطء وأعد تعليق الكريات البيضاء مع 100 ميكرولتر من الملح البارد 1x المخزن بالفوسفات (PBS). قم بتغطية الأنبوب بالبارافيلم ، واحتضنه لمدة 1 ساعة عند 4 درجات مئوية مع إثارة لطيفة قبل إعادة تعليق الكريات عن طريق السحب لأعلى ولأسفل.
4. تركيز الشفرات النانوية على وسادة السكروز
ملاحظة: كبديل للطرد المركزي بين عشية وضحاها أو الطرد المركزي الفائق (الخطوة 3.4.3) ، يمكن تركيز Nanoblades على وسادة السكروز. ينتج عن ذلك جزء أنقى من Nanoblades ، على الرغم من أن إجمالي الكمية المستردة سيكون أقل.
- قم بإعداد محلول سكروز بنسبة 10٪ (الوزن إلى الحجم) في 1x PBS ، وقم بتصفيته من خلال مرشح حقنة 0.2 ميكرومتر (انظر جدول المواد).
- ابدأ عملية تركيز Nanoblades على وسادة السكروز.
- ضع 9 مل من العينة المحتوية على VLP (من الخطوة 3.4.3) في أنبوب جهاز طرد مركزي فائق (انظر جدول المواد). باستخدام حقنة وقنية سعة 3 مل ، قم بطبقة 2.5 مل ببطء من السكروز بنسبة 10٪ تحت العينة ، في محاولة لعدم خلط العينة المحتوية على VLP ومحلول السكروز.
- بدلا من ذلك ، ضع 2.5 مل من السكروز بنسبة 10٪ في أنبوب جهاز طرد مركزي فائق (انظر جدول المواد). قم بإمالة الأنبوب وأضف ببطء 9 مل من العينة المحتوية على VLP (من الخطوة 3.4.3) باستخدام ماصة منخفضة السرعة. خلال هذه العملية ، ارفع الأنبوب تدريجيا إلى وضع رأسي.
- الطرد المركزي للعينات عند 209,490 × جم في جهاز طرد مركزي فائق لمدة 90 دقيقة عند 4 درجات مئوية.
ملاحظة: يمكن تكييف هذه التقنية للطرد المركزي منخفض السرعة (4300 × جم) بين عشية وضحاها كما هو موضح في 12. - بعد الطرد المركزي ، قم بإزالة supernatant بعناية ووضع الأنبوب رأسا على عقب على المناديل الورقية لإزالة أي سائل متبقي. بعد دقيقة واحدة ، أضف 100 ميكرولتر من 1x PBS وضع الأنبوب عند 4 درجات مئوية مع غطاء parafilm في حامل أنبوب على طاولة إثارة لمدة 1 ساعة (انظر جدول المواد) قبل إعادة تعليق الكريات عن طريق السحب لأعلى ولأسفل.
ملاحظة: يمكن إيقاف البروتوكول مؤقتا هنا.
5. مراقبة تحميل Cas9 داخل Nanoblades عن طريق بقعة نقطية
- قم بإعداد المخزن المؤقت للتخفيف عن طريق إضافة 1 حجم من المخزن المؤقت للتحلل الذي يحتوي على خافض للتوتر السطحي غير الأيوني (انظر جدول المواد) في 4 مجلدات من 1x PBS. قم بتخفيف 2 ميكرولتر من الشفرات النانوية المركزة في 50 ميكرولتر من المخزن المؤقت للتخفيف ، والدوامة لفترة وجيزة ، ونقل 25 ميكرولتر من هذا الخليط إلى أنبوب جديد يحتوي على 25 ميكرولتر من المخزن المؤقت للتخفيف. كرر هذه العملية للحصول على 4 أنابيب من تخفيفات Nanoblade (خطوات تخفيف 2 أضعاف).
- بالنسبة للضوابط القياسية ، قم بتخفيف 2 ميكرولتر من نوكليز Cas9 المؤتلف (انظر جدول المواد) إلى 50 ميكرولتر من المخزن المؤقت للتخفيف ، دوامة لفترة وجيزة ، والمضي قدما في إجراء ثمانية تخفيفات تسلسلية (تخفيف 2 أضعاف لكل خطوة).
- ضع بعناية 2.5 ميكرولتر من كل تخفيف VLP و 2.5 ميكرولتر من كل معيار على غشاء نيتروسليلوز مع ماصة متعددة القنوات (قد يؤدي حجم أكبر إلى بقع متداخلة).
ملاحظة: يمكن أيضا استخدام غشاء البولي فينيل ثنائي فلوريد المعالج بالميثانول. - بمجرد امتصاص الجسيمات على الغشاء ، قم بسد الغشاء بمحلول ملحي مخزن مؤقتا 1x Tris يحتوي على خافض للتوتر السطحي غير الأيوني (TBS-T) مكمل بالحليب الجاف غير الدهني (5٪ w / v) لمدة 45 دقيقة في درجة حرارة الغرفة.
ملاحظة: يمكن إيقاف البروتوكول مؤقتا هنا ، وتخزين الغشاء عند 4 درجات مئوية في 1x TBS-T. - تخلص من 1x TBST المكمل بالحليب الجاف غير الدهني ، واحتضن الغشاء بين عشية وضحاها عند 4 درجات مئوية باستخدام الجسم المضاد للبيروكسيديز الفجل Cas9 (تخفيف 1/1000 في 1x TBST ، حليب 5٪). اغسل الغشاء 3x باستخدام TBS-T ، وتصور الإشارة باستخدام مجموعة ركيزة كيميائية محسنة.
- حدد كثافة النقاط للشفرات النانوية والتخفيفات القياسية Cas9 المؤتلفة باستخدام البرنامج الاحتكاري المزود بمحطة التصوير الهلامية أو imageJ13. حدد منحنى خطيا يربط شدة النقطة بتركيز Cas9. باستخدام وظيفة المنحنى الذي تم الحصول عليه ، استقراء محتوى Cas9 في كل إعداد.
ملاحظة: يمكن لكمية التحكم في بروتين Cas9 المؤتلف أن تشبع القراءة للعينات الأكثر تركيزا من مجموعة التخفيف القياسية (الشكل 2). لذلك ينصح عند تحديد المنحنى الخطي بإزالة القراءة من العينات غير المخففة (وأحيانا من خطوات التخفيف الأولى) إذا لم تكن في النطاق الخطي فيما يتعلق بالتركيز المعروف ل Cas9 الذي تم رصده. وبالمثل ، عند استقراء كمية Cas9 داخل عينات Nanoblade ، استخدم فقط القراءات الموجودة ضمن النطاق الخطي للمنحنى القياسي.
6. نقل الخلايا المستهدفة باستخدام شفرات نانوية (إجراء للنقل في صفيحة من 12 بئرا)
- في صفيحة من 12 بئرا ، بذور 100،000-200،000 خلية (إما خلايا ملتصقة أولية أو خالدة) لكل بئر في 1 مل من وسط زراعة الخلايا المناسب. اسمح للخلايا بالالتصاق بسطح اللوحة قبل النقل.
- في أنبوب الطرد المركزي الدقيق سعة 1.5 مل ، أضف 5-20 ميكرولتر من شفرات نانوية مركزة (من الخطوة 3.5.1 أو 4.4) إلى 500 ميكرولتر من وسط زراعة الخلايا ، واخلطها عن طريق السحب لأعلى ولأسفل باستخدام ماصة P1000. قم بإزالة الوسط من الخلايا ، واستبدله ب 500 ميكرولتر من خليط Nanoblade هذا.
ملاحظة: يجب تحسين النقل لكل نوع من أنواع الخلايا. من المهم استخدام أصغر حجم ممكن من الوسط (مع تجنب تجفيف الخلايا المستهدفة) بحيث تظل الشفرات النانوية عالية التركيز. يجب نقل الخلايا الملتصقة مباشرة أثناء توصيلها باللوحة (لا تتنقل في التعليق لأن هذا سيقلل بشكل كبير من كفاءة التوصيل). تتحمل بعض الخلايا التعرض المطول للشفرات النانوية (24-48 ساعة) في حين أن البعض الآخر حساس للغاية وقد يشكل تخلفا صغيرا. في هذه الحالة ، يجب احتضان Nanoblades بخلايا لمدة 4-6 ساعات فقط قبل استبدال الوسط. يمكن أن يحسن Spinoculation14 أيضا نقل الخلايا المزروعة في التعليق. يمكن للمواد المساعدة مثل البوليمرات الكاتيونية (انظر جدول المواد) أيضا تحسين كفاءة النقل في بعض أنواع الخلايا. - بعد 4-6 ساعات من حضانة الخلايا في حجم منخفض من الوسط الذي يحتوي على شفرات نانوية ، قم بزيادة حجم الوسط إلى الكمية الطبيعية (1 مل إذا كنت تعمل مع لوحة 12 بئرا) ، أو استبدلها بوسط جديد إذا كانت الخلايا حساسة ل VLPs.
ملاحظة: يجب تعطيل وسط الخلية الذي يحتوي على شفرات نانوية بنسبة 0.5٪ من هيبوكلوريت الصوديوم لمدة 10 دقائق قبل التخلص منه. استخدم القفازات والنظارات الواقية عند التلاعب بهيبوكلوريت الصوديوم. إذا كانت الشفرات النانوية تحفز موت الخلايا ، فقم بتكييف كمية وإجمالي وقت التعرض لتقليل وفيات الخلايا.
7. قياس كفاءة كريسبر في الموضع المستهدف بواسطة اختبار إندونوكلياز T7
- صمم الاشعال PCR لتضخيم منطقة 400-700 زوج أساسي (bp) تشمل موقع انقسام كريسبر.
ملاحظة: يجب أن يكون موقع الانقسام بعيدا عن حافة الأمبليكون بمقدار 200 نقطة أساس على الأقل ويجب أن يتحول قليلا عن مركز الأمبليكون بحيث عند انقسام إندونوكلياز T7 ، سيتم إطلاق شظايا من أحجام مختلفة. - استخراج الحمض النووي الجينومي من الخلايا المعالجة بالشفرات النانوية التي تستهدف الجين محل الاهتمام ومن خلايا التحكم المعالجة بشفرات نانوية مبرمجة باستخدام sgRNA للتحكم (انظر جدول المواد).
ملاحظة: يمكن إيقاف البروتوكول مؤقتا هنا. - باستخدام 150 نانوغرام من الحمض النووي الجينومي كقالب ، قم ببرمجة تفاعل PCR بحجم 30 ميكرولتر (الحجم النهائي) باتباع بروتوكول الشركة المصنعة. تحقق من أن تضخيم PCR ينتج أمبليكون واحد بالحجم المتوقع عن طريق تشغيل هلام أغاروز 2٪ ملطخ ب 5 ميكروغرام / مل من بروميد الإيثيديوم (أو وصمة هلام بديلة أكثر أمانا للحمض النووي).
ملاحظة: ارتد معدات الحماية المناسبة عند التلاعب ببروميد الإيثيديوم، الذي يشتبه في أنه يسبب عيوبا وراثية. يمكن إيقاف البروتوكول مؤقتا هنا. - توليد التباين والهضم
- في أنبوب PCR سعة 0.2 مل ، أضف 5 ميكرولتر من المخزن المؤقت للإنزيم (المزود مع T7 endonuclease I) ، و 20 ميكرولتر من الماء ، و 24 ميكرولتر من منتج PCR من الخطوة 7.3. اسمح بتكوين التباين عن طريق تسخين العينات إلى 94 درجة مئوية على مدى 3 دقائق ثم عن طريق خفض درجة الحرارة (2 درجة مئوية في الدقيقة) للوصول إلى 40 درجة مئوية.
- أضف 0.5 ميكرولتر من T7-endonuclease I في درجة حرارة الغرفة إلى كل أنبوب غير متجانس ، بما في ذلك التحكم. تحضن عند 37 درجة مئوية لمدة 15 دقيقة. قم بتحميل التفاعل الناتج في هلام أغاروز 2.5٪ (الوزن / الحجم) ملطخ ببروميد الإيثيديوم. بعد الهجرة ، قم بتصوير الجل على جهاز إضاءة الأشعة فوق البنفسجية.
ملاحظة: ارتد معدات الحماية المناسبة عند التلاعب ببروميد الإيثيديوم، الذي يشتبه في أنه يسبب عيوبا وراثية. استخدم نظارات واقية من الأشعة فوق البنفسجية عند استخدام جهاز الإضاءة من الأشعة فوق البنفسجية. - قم بقياس كفاءة الانقسام من خلال تحليل الصورة الناتجة عن تفاعل الهضم لتحديد شدة كل نطاق باستخدام البرنامج المناسب (انظر جدول المواد).
8. قياس كفاءة كريسبر في الموقع المستهدف عن طريق تسلسل سانجر وتحليل TIDE
ملاحظة: كبديل لفحص إندونوكلياز T7، يمكن مراقبة كفاءة كريسبر عن طريق تحليل آثار تسلسل سانجر وفك الالتفاف عنها استنادا إلى بروتوكول TIDE15.
- قم بإجراء تسلسل Sanger لأمبليونات PCR من الخطوة 7.3 (بما في ذلك حالة تحكم تتوافق مع الخلايا غير المعالجة) باستخدام التمهيدي PCR الأمامي أو الخلفي.
- قم بتحليل آثار تسلسل Sanger لحالة التحكم (الخلايا غير المعالجة) والعينات المعالجة بشفرة Nanoblade باستخدام خادم TIDE (https://tide.nki.nl) واتباع إرشادات التحليل الخاصة بهم.
9. تشكيل مجمع نانوي مع الجهات المانحة ssODN للإصلاح الموجه بالتماثل (إجراء النقل في لوحة 12 بئرا)
ملاحظة: تم وصف المبادئ التوجيهية لتصميم ssODN للتحرير الفعال الموجه بوساطة الإصلاح الموجه بالتماثل سابقا16.
- في صفيحة من 12 بئرا ، بذور 100000-200000 خلية لكل بئر في 1 مل من وسط زراعة الخلايا المناسب. اسمح للخلايا بالالتصاق بسطح اللوحة قبل النقل.
- تحضير 100 ميكرولتر من محلول البوليمر الكاتيوني (انظر جدول المواد) عند 8 ميكروغرام / مل في 1x PBS.
- امزج 19 ميكرولتر من محلول البوليمر الكاتيوني مع 100 بمول من قالب ssODN. أضف 20 ميكرولتر من الشفرات النانوية المركزة (من الخطوة 3.5.1 أو 4.4) ، واحتضنها لمدة 15 دقيقة على الجليد.
- قم بإزالة شفرات Nanoblades / ssODN المعقدة من الجليد ، وأضف 500 ميكرولتر من وسط زراعة الخلايا (عند 37 درجة مئوية). قم بإزالة الوسط من الخلايا المستهدفة (من الخطوة 9.1) ، وأضف 500 ميكرولتر من الوسط الذي يحتوي على Nanoblades / ssODN المعقدة. اسمح للخلايا بالتكاثر لمدة 48 ساعة قبل التنميط الجيني.
- استخراج الحمض النووي الجينومي من جزء صغير من سكان الخلايا باستخدام مجموعة استخراج مخصصة (انظر جدول المواد).
- صمم الاشعال PCR لتضخيم منطقة 400-700 نقطة أساس تشمل موقع الضربة القاضية.
ملاحظة: يجب ألا تتداخل الاشعال PCR مع أذرع التماثل الخاصة ب ssODN لتجنب النتائج الإيجابية الكاذبة الناتجة عن تضخيم PCR لأي ssODN متبقي لا يزال موجودا داخل الخلايا المستهدفة. - باستخدام 150 نانوغرام من الحمض النووي الجينومي من خلايا التحكم (غير المعالجة) أو الخلايا المعالجة بالشفرة النانوية كقالب ، قم ببرمجة تفاعل تفاعل البوليميراز المتسلسل 30 ميكرولتر باتباع بروتوكول الشركة المصنعة.
ملاحظة: قد تكون آثار ssODN موجودة في وسط الخلية بعد عدة أيام من النقل مع المجمع. قد يكون هذا ssODN بمثابة قالب جزئي لاختبارات PCR التي تحاول فحص التكامل الصحيح. وبالتالي ، فمن المستحسن تمرير الخلايا مرتين على الأقل بعد النقل ، لتجنب الفحوصات الإيجابية الكاذبة في نهاية المطاف. - قم بتحميل 5 ميكرولتر من تفاعلات تفاعل البوليميراز المتسلسل المعالجة بشفرة نانوية في هلام أغاروز 1٪ (وزن/حجم) ملطخ ببروميد الإيثيديوم. بعد الهجرة ، قم بتصوير الجل على جهاز تحويل الأشعة فوق البنفسجية.
ملاحظة: إذا كانت إعادة تركيب التماثل ناجحة وتتوافق مع إدخال أكثر من 1 نقطة أساس من المواد الوراثية ، فيجب أن يكون هناك اختلاف في الوزن الجزيئي لأمبليونات PCR بين العينة الضابطة والعينة المعالجة بالشفرة النانوية. نظرا لأن كفاءة HDR لا تصل إلى 100٪ ، يجب أن يكون نطاقان مرئيين في العينة المعالجة بالشفرة النانوية (واحدة بحجم مماثل لأمبليكون PCR المتحكم المقابل للأليل غير المحرر وواحدة ذات وزن جزيئي أعلى تتوافق مع أليل الضربة القاضية ، انظر الشكل 3B اللوحة الوسطى).
- صمم الاشعال PCR لتضخيم منطقة 400-700 نقطة أساس تشمل موقع الضربة القاضية.
- قم بإجراء تسلسل Sanger للتحكم ومضخمات PCR المعالجة بشفرة Nanoblade.
- حدد كفاءة الضربة القاضية باستخدام بروتوكول TIDER17.
10. تسليم نانوبليد في الجسم الحي
- قم بتوصيل ما يصل إلى 25 ميكرولتر من الشفرات النانوية المركزة من الخطوة 3.5.1 من خلال الحقن المداري الرجعي أو ما يصل إلى 100 ميكرولتر من خلال حقن الوريد الذيل ، كما هو موضح في 18 ، إذا كنت تعمل مع الفئران.
ملاحظة: تتطلب جميع الإجراءات التي تنطوي على تجارب على الحيوانات (بما في ذلك حقن Nanoblade لأغراض تحرير الجينوم) بروتوكولا معتمدا من لجنة أخلاقيات محلية. - لتوليد الفئران المعدلة وراثيا، استخدم حاقن دقيق لتوصيل من 1 pL إلى 10 pL من شفرات Nanoblades المركزة من الخطوة 4.4 إلى الفضاء perivitelline من بويضات الفئران كما هو موضح سابقا18.
ملاحظة: بالنسبة لحقن البيريفيتيلين ، من الضروري تنقية وتركيز شفرات Nanoblades على وسادة السكروز لتجنب انسداد الحاقن الصغير.
النتائج
بروتوكول إعداد Nanoblade بسيط إلى حد ما ويتطلب معدات مختبرية بسيطة إلى جانب الوصول إلى غطاء زراعة الأنسجة ، وحاضنة CO2 ، وأجهزة الطرد المركزي المتأرجحة أو جهاز الطرد المركزي فائق التركيز. ومع ذلك ، تتطلب بعض الخطوات اهتماما خاصا مثل مصدر الخلايا المنتجة ومعالجتها ، وكذلك ظروف النقل. كما هو موضح في الشكل 1 أ ، من المهم أن تزرع الخلايا بحيث يتم توزيعها بشكل متجانس في اللوحة وتصل إلى التقاء ~ 70-80٪ في يوم النقل (تجنب وجود كتل من الخلايا). بعد أربع وعشرين ساعة من النقل (الشكل 1B ، C) ، ستشكل الخلايا المنتجة سينسيتيا مما يؤدي إلى خلايا أكبر حجما مع نوى متعددة. بعد أربعين ساعة من النقل (الشكل 1D) ، ستكون معظم الخلايا في اللوحة قد شكلت syncytia وتبدأ في الانفصال عن اللوحة.
هذا أمر طبيعي تماما وينتج عن التعبير عن البروتين السكري المغلف ، والذي يحفز الاندماج بين الخلايا المجاورة. عند التركيز عن طريق الطرد المركزي (أو حتى مباشرة من supernatant من الخلايا المنتجة) ، يمكن تحديد كمية Cas9 المحملة داخل Nanoblades بطريقة مطلقة عن طريق لطخة نقطية على غشاء النيتروسليلوز باستخدام Cas9 المؤتلف كمرجع (الشكل 2). هذه الخطوة مهمة لتحديد الكمية الصحيحة من الشفرات النانوية لاستخدامها في نقل الخلايا المستهدفة. عند إجراء فحص اللطخة النقطية ، من المهم مراعاة القراءات التي تقع ضمن النطاق الخطي للمنحنى القياسي فقط. ومع ذلك ، بغض النظر عن كمية Cas9 الموجودة داخل Nanoblades ، من الضروري اختبار كفاءة تحرير الجينوم مباشرة على الخلايا المستهدفة باستخدام اختبار T7 endonuclease (الشكل 3) أو تسلسل Sanger.
كما هو موضح في الشكل 3 ، يمكن أن تختلف كفاءة Nanoblades من دفعة إلى أخرى على الرغم من أنها ترتبط عادة بكمية Cas9. في المثال الموضح في الشكل 3 ، تؤدي الدفعة من المسار 1 إلى كفاءة تحرير إجمالية بنسبة 20٪ بينما تؤدي الدفعة من المسار 3 إلى كفاءة بنسبة 60٪. في هذه الحالة ، من الممكن زيادة حجم Nanoblades المستخدمة من الدفعة 1 لتحقيق كفاءة تحرير مماثلة لتلك الموجودة في الدفعة 3. يوضح الشكل 4 الحد الأقصى لكفاءة التحرير التي تم الحصول عليها باستخدام Nanoblades في أنواع مختلفة من الخلايا الأولية. من المهم ملاحظة أن الكفاءة قد تختلف اعتمادا على تسلسل sgRNA المستخدم وإمكانية الوصول إلى الهدف.
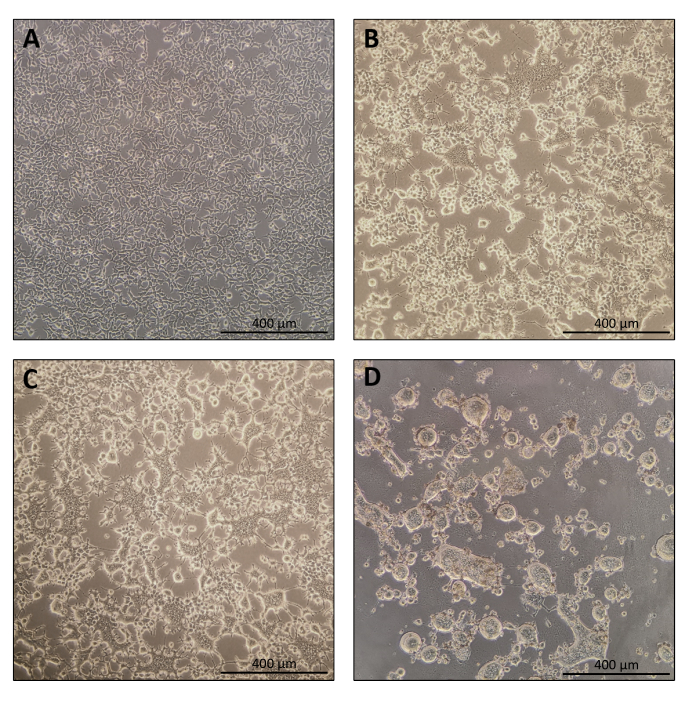
الشكل 1: مورفولوجيا الخلايا المنتجة أثناء إنتاج الشفرة النانوية . (A) خلايا HEK293T عند التقاء 70-80٪ بعد 24 ساعة من الطلاء. (B و C) HEK293T مورفولوجيا الخلايا 24 ساعة بعد النقل. (د) مورفولوجيا الخلايا التائية HEK293T بعد 40 ساعة من النقل. أشرطة المقياس = 400 ميكرومتر. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
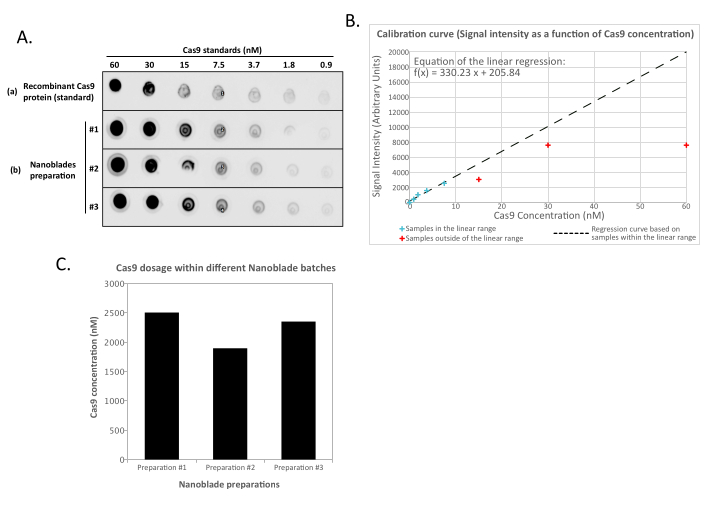
الشكل 2: القياس الكمي لتحميل Cas9 داخل الشفرات النانوية بواسطة بقعة نقطية. (أ) المؤتلف Cas9 أو 100x مركزة (عن طريق الطرد المركزي الفائق) يتم تخفيف عينات الشفرة النانوية (# 1 و # 2 و # 3) مرتين بالتتابع ورصدها على غشاء النيتروسليلوز قبل احتضانها بأجسام مضادة مضادة ل Cas9 HRP. يتم الكشف عن الإشارة من خلال التلألؤ الكيميائي المحسن. (ب) يتم الحصول على إشارة التلألؤ الكيميائي وتحديدها كميا لتخفيفات Cas9 المؤتلفة وشدة الإشارة المرسومة مقابل الكمية المعروفة من Cas9 المرصودة على غشاء النيتروسليلوز. يتم حساب منحنى الانحدار للتخفيفات الموجودة داخل النطاق الخطي (انظر الصلبان الزرقاء)، باستثناء جميع التركيزات الموجودة خارج النطاق الخطي (انظر الصلبان الحمراء). (C) تم استقراء تركيز Cas9 (nM) في كل مستحضر Nanoblade باستخدام المعادلة من الانحدار الخطي الذي تم الحصول عليه في (B). لهذا ، من المهم فقط استخدام الإشارة الكمية من تخفيفات Nanoblade التي تقع ضمن النطاق الخطي لمنحنى الانحدار. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 3: مراقبة كفاءة التحرير عند النقل. (A) اختبار إندونوكليز T7 يقيس كفاءة الانقسام في الخلايا المعالجة بالشفرة النانوية. تم تحليل الخلايا المحولة باستخدام شفرات نانوية تستهدف جين EMX1 بواسطة فحص إندونوكليز T7. Lane 1: دفعة إعداد Nanoblade # 1 (كفاءة الانقسام بنسبة 20٪) ؛ حارة 2: خلايا التحكم; المسار 3: دفعة إعداد شفرة النانو #2 (كفاءة الانقسام بنسبة 60٪). (ب) إدخال تسلسل علامة العلم داخل إطار القراءة المفتوح DDX3. تم إنتاج شفرات نانوية مركزة مبرمجة باستخدام sgRNA تستهدف موضع DDX3 من مستنسخات HEK293T مختلفة (# 1 ، # 2) ومعقدة مع جرعات متزايدة من قالب ssODN Flag-DDX3 والمجمعات التي تم الحصول عليها المستخدمة لنقل الخلايا المستهدفة HEK293T. عند النقل ، نمت الخلايا لمدة ثلاثة أيام قبل جمعها لاستخراج الحمض النووي الجيني والبروتينات الكلية. تم ترسيب بروتينات Flag-DDX3 المناعية باستخدام حبات الأغاروز المضادة للعلم تليها تحليل اللطخة الغربية للبروتينات المستردة باستخدام جسم مضاد مضاد للعلم (اللوحة العلوية). كما تم فحص الإدراج الموجه للموقع لعلامة العلم في موضع Ddx3 بواسطة PCR باستخدام إما الاشعال التي تحيط بموقع الإدراج (اللوحة الوسطى) ، أو باستخدام تمهيدي أمامي يتعرف على تسلسل علامة العلم وتمهيدي عكسي خاص بموضع Ddx3 في اتجاه المصب لموقع إدراج العلم (اللوحة السفلية). الاختصارات: EMX1 = Empty Spiracles Homeobox 1; DDX3 = مهبط طائرات الهليكوبتر RNA DEAD-box 3 ؛ PCR = تفاعل البوليميراز المتسلسل. ODN = أوليغوديوكسي نيوكليوتيد; ssODN = ODN الغنائي العالق ؛ sgRNA = الحمض النووي الريبي أحادي الدليل. IP = هطول الأمطار المناعية. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
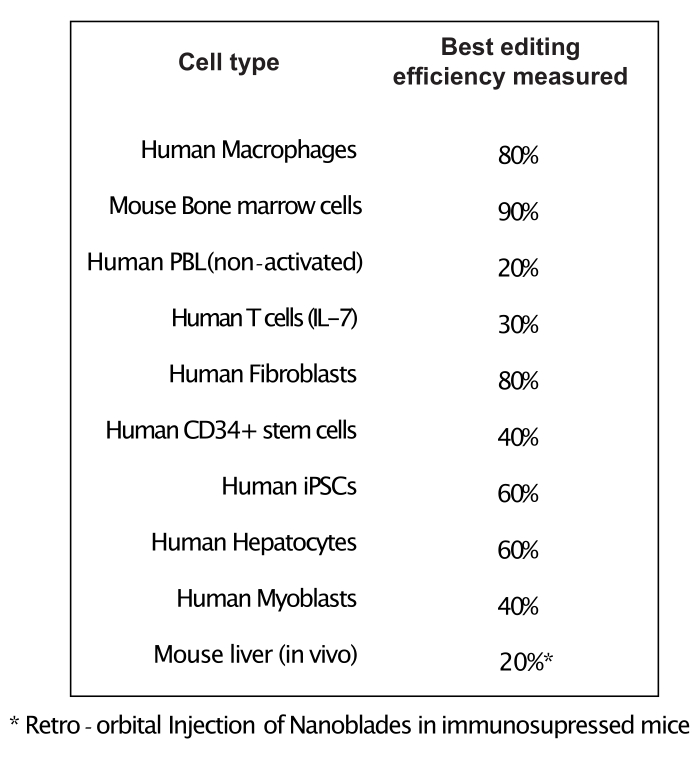
الشكل 4: كفاءة التحرير المحققة في أنواع الخلايا الأولية المختلفة باستخدام Nanoblades. الاختصارات: PBL = الخلايا الليمفاوية في الدم المحيطي. IL = إنترلوكين; CD = مجموعة من التمايز; iPSC = الخلايا الجذعية المستحثة متعددة القدرات. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
Discussion
تسمح الشفرات النانوية بالتسليم السريع والمعتمد على الجرعة لمركب Cas9 / sgRNA RNP في خطوط الخلايا والخلايا الأولية. على النقيض من النقل الكلاسيكي وناقلات التوصيل الفيروسي الأخرى ، ولكن مثل كهربية البروتين ، تتمتع Nanoblades بميزة التسليم العابر ل Cas9 / sgRNA RNP بطريقة خالية من الجينات المحورة. توفر الشفرات النانوية منصة متعددة الاستخدامات وبسيطة وغير مكلفة للغاية لتوصيل البروتين والتي يمكن تكييفها بسهولة وسرعة مع عائلة متغيرات كريسبر المتزايدة باستمرار. يمكن إنتاج الشفرات النانوية في خط الخلايا HEK293T أو مشتقاته. تم تطوير خطوط الخلايا HEK293T المستخدمة هنا لتحقيق أقصى قدر من إنتاج الجسيمات الفيروسية الرجعية والفيروسية اللينتيفيروسية (انظر جدول المواد). ومع ذلك ، على الرغم من أن المصادر الأخرى لخلايا HEK293T قد تكون مناسبة ، يجب على المستخدمين اختبار ومقارنة خلايا HEK293T من مصادر مختلفة حيث لوحظت اختلافات كبيرة في إنتاج الجسيمات اعتمادا على مصدر خلية HEK293T. يجب أيضا فحص الخلايا بحثا عن تلوث الميكوبلازما بشكل متكرر ومرورها كل ثلاثة أيام (تخفيف 1/8 كلاسيكي) لتجنب الالتقاء الزائد ، والذي له تأثير سلبي على إنتاج الجسيمات.
لا ينبغي الحفاظ على الخلايا لأكثر من 20 مقطعا. تم استخدام DMEM المكمل بالجلوكوز والبنسلين / الستربتومايسين والجلوتامين و 10٪ مصل البقر الجنيني غير المكمل لزراعة الخلايا. نظرا لأن أصل المصل قد يؤثر على جودة إعداد Nanoblade ، فيجب اختبار دفعات مختلفة من المصل قبل الإنتاج على نطاق واسع. يمكن إنتاج الشفرات النانوية بكفاءة في وسائط أخرى مثل RPMI أو التعديلات الخالية من المصل للحد الأدنى من الوسائط الأساسية التي يمكن أن تحل محل DMEM في اليوم التالي للنقل. وكما هو مبين أدناه، على الرغم من أن الاستبدال المتوسط بعد النقل ببعض كواشف نقل الحمض النووي أمر اختياري، فقد يكون من المفيد تعديل الوسط الذي يتم فيه إطلاق VLPs، خاصة للحد من آثار المصل في إعداد الجسيمات. ومع ذلك ، لم تتم بعد محاولة زراعة الخلايا في الحد الأدنى من الوسط الأساسي في المصل في اليوم السابق للنقل.
كما ذكرنا ، يتم إنتاج الشفرات النانوية عند الإفراط في التعبير عن خليط من البلازميدات في الخلايا المنتجة. يبدو أن التعبير الزائد مطلوب للإنتاج الأمثل. في الواقع ، طور هذا المختبر خطا للخلايا المنتجة حيث تم تثبيت بنية التعبير عن Gag-Pol عن طريق اختيار المضادات الحيوية. ومع ذلك ، فشل هذا النظام في إنتاج كميات كبيرة من Nanoblades. تم إجراء ملاحظة مماثلة عندما تم دمج بنية ترميز sgRNA بشكل ثابت في جينوم الخلايا المنتجة. وكما هو موضح في أنظمة إنتاج الجسيمات الأخرى، قد يكون من المفيد وجود خط خلوي مستقر يعبر على الأقل عن بعض التركيبات المشاركة في إنتاج الشفرات النانوية؛ ومع ذلك ، فإن هذا يتطلب بالتأكيد معالجة كميات كبيرة من supernatant وتقنية مناسبة لتنقية الجسيمات. يحدد البروتوكول أعلاه الإجراء المفضل لإنتاج شفرات نانوية تستغل كواشف نقل محددة (انظر جدول المواد).
على الرغم من أن كواشف النقل من الشركات المصنعة الأخرى قد تم اختبارها بنجاح ، إلا أن الغالبية العظمى من نتائج هذه المجموعة باستخدام Nanoblades تتبع الإجراء الموضح هنا. يمكن تحقيق نقل منخفض التكلفة باستخدام كواشف فوسفات الكالسيوم وتحقيق كفاءة إنتاج جيدة ؛ ومع ذلك ، فإن هذه الطريقة تتطلب تماما استبدال وسط النقل في اليوم التالي للنقل وقد تترك بقايا فوسفات الكالسيوم في إعداد الجسيمات الرسوبية. تمشيا مع ضرورة وجود مستويات تعبير عالية لمكونات Nanoblade داخل الخلايا المنتجة ، هناك ملاحظة مفادها أن كمية sgRNAs المرتبطة ببروتين Cas9 يمكن أن تكون عاملا مقيدا لتحرير الجينوم بكفاءة. لتحسين تحميل sgRNA ، تم تطوير نهجين تقنيين مؤخرا من قبل مجموعات مستقلة باستخدام ناقلات توصيل البروتين المشابهة ل Nanoblades. تعتمد هذه على استخدام التعبير السيتوبلازمي المعتمد على البوليميراز T7 ل sgRNA6 أو من خلال إضافة إشارة تغليف الفيروسات القهقرية إلى تسلسل sgRNA للتوسط في الارتباط بالبروتين المتعدد Gag 6. يمكن لهذه الأساليب بالفعل تحسين تحميل sgRNA داخل Nanoblades على الرغم من أنه لم يتم اختبارها بعد.
يعد نقل الخلايا المستهدفة خطوة حاسمة في هذا الإجراء. في معظم خطوط الخلايا المخلدة ، يكون للنقل باستخدام Nanoblades تأثير خلوي ضئيل أو معدوم. ومع ذلك ، في الخلايا الأولية ، يمكن أن تكون السمية مشكلة. لذلك يجب تحسين النقل لكل نوع من أنواع الخلايا. على وجه التحديد ، يعد وقت التعرض ل Nanoblades عاملا مهما للتعديل عند تحسين بروتوكول النقل. بالنسبة للخلايا الحساسة مثل الخلايا العصبية الأولية أو خلايا نخاع العظم ، فإن 4-6 ساعات من الحضانة باستخدام Nanoblades قبل استبدال الوسط تسمح بالتسليم الفعال لبروتين Cas9 مع تقليل سمية الخلايا. علاوة على ذلك ، يمكن للمواد المساعدة مثل البوليمرات الكاتيونية ، من بين أمور أخرى ، أن تحسن بشكل كبير من كفاءة النقل في بعض الخلايا (انظر جدول المواد). من المهم ملاحظة أن الشفرات النانوية هي VLPs ويمكن أن تحفز استجابة مناعية. يمكن أن يكون هذا قيدا إذا كان العمل مع أنواع معينة من الخلايا الأولية ، مثل البلاعم أو الخلايا المتغصنة ، حيث يمكن أن تؤدي الحضانة باستخدام Nanoblades إلى تغييرات مهمة في التعبير الجيني والنمط الظاهري للخلايا. إذا كانت البلاعم والخلايا المتغصنة مشتقة من سلائف الخلايا الجذعية المكونة للدم (مثل خلايا نخاع عظم الفأر) ، فمن الأفضل تحويل الخلايا باستخدام Nanoblades قبل أن يتم تمييزها بالكامل لتجنب إحداث استجابة خلوية ضد Nanoblades. خلاف ذلك ، يمكن أن يمثل كهربية بروتين Cas9 بديلا قابلا للتطبيق عند العمل مع الخلايا المناعية المتباينة.
يمكن استخدام الشفرات النانوية في الجسم الحي لنقل زيجوت الفئران أو الأجنة لتوليد معدلة وراثيا. على غرار ناقلات الفيروسات القهقرية أو الفيروسات القهقرية الكلاسيكية ، يمكن أيضا حقنها مباشرة في أنسجة الحيوانات البالغة. ومع ذلك ، يمكن تعطيل الشفرات النانوية (على غرار ناقلات الفيروسات القهقرية والفيروسية اللينتيفيروسية) عن طريق الاستجابة المناعية للحيوان المضيف. وبالتالي ، يجب تحسين الجرعة المراد حقنها لكل تطبيق. يمكن لهذه الاستجابة المناعية أيضا أن تحد من توزيع VLPs الوظيفية على الأنسجة القريبة من موقع الحقن. أخيرا ، على عكس ناقلات الفيروسات اللينتيفيروسية ، فإن Nanoblades خالية من الجينات المحورة وتقدم Cas9 في إطار زمني مقيد. لذلك ، لا يمكن استخدامها لإجراء فحوصات وظيفية على مستوى الجينوم تتطلب تسلسلا عالي الإنتاجية ل sgRNAs عند اختيار الخلايا. تكون الشفرات النانوية مفيدة عندما تكون هناك حاجة إلى تحرير جينوم سريع يعتمد على الجرعة وخال من الجينات المحورة20. علاوة على ذلك، وعلى غرار كهربية البروتين، تؤدي الشفرات النانوية إلى تأثيرات أقل خارج الهدف من التعبير المطول عن Cas9/sgRNA من خلال نقل الحمض النووي أو النواقل الفيروسية الكلاسيكية3. يركز التطوير المستقبلي ل Nanoblades على دمج متغيرات Cas9 للتطبيقات التكنولوجية المختلفة مثل تحرير القاعدة واستهداف الحمض النووي الريبي.
Disclosures
تم تسمية فيليب إي مانجو وإميليانو ب. ريتشي كمخترعين على براءة اختراع تتعلق بتكنولوجيا الشفرات النانوية (مودعي طلبات البراءات: المعهد الوطني للصحة والبحوث الطبية (INSERM) ، المركز الوطني للبحوث العلمية (CNRS) ، المدرسة العليا للذكور في ليون ، جامعة كلود برنارد ليون 1 ، Villeurbanne Cedex ؛ رقم الطلب: WO 2017/068077 Al؛ حالة براءة الاختراع: نشرت ، 27th أبريل 2017 ؛ يتم تغطية جميع جوانب المخطوطة من خلال طلب البراءة. أما المؤلفون المتبقون فلا يعلنون عن أي مصالح متنافسة.
Acknowledgements
تم تمويل هذا العمل من قبل Labex Ecofect (ANR-11-LABX-0048) التابع لجامعة ليون ، ضمن برنامج Investissements d'Avenir (ANR-11-IDEX-0007) الذي تديره الوكالة الوطنية الفرنسية للبحوث (ANR) ، ومؤسسة FINOVI ، والوكالة الوطنية للبحوث حول SIDA et les Hépatites Virales (ANRS-ECTZ3306) ومن قبل مجلس البحوث الأوروبي (ERC-StG-LS6-805500 إلى E.P.R.) في إطار برامج البحث والابتكار Horizon 2020 التابعة للاتحاد الأوروبي.
Materials
| Name | Company | Catalog Number | Comments |
| 13.2 mL, Thinwall Polypropylene Tubes, 14 x 89 mm - 50Pk | Beckman Coulter Life Sciences | 331372 | Ultracentrifugation tubes for Nanoblades purification |
| Amersham Protran Premium Western blotting membranes, nitrocellulose | Merck | GE10600004 | Nitrocellulose membrane for quantifying Cas9 levels within purified Nanoblades |
| BIC-Gag-CAS9 | Addgene | 119942 | Encodes a GAG (F-MLV)-CAS9(sp) fusion. Allows the production of GAG-CAS9 Virus like particles from producer cells in association with over expressed gRNA(s) and appropriate envelopes |
| BICstim-Gag-dCAS9-VPR | Addgene | 120922 | Encodes a GAG-dCAS9-VPR fusion for targeted transcriptional activation |
| BLADE | Addgene | 134912 | Empty backbone for cloning sgRNA sequence to be used in Nanoblades system |
| BsmBI-v2 | New England Biolabs | R0739S | Restriction enzyme to digest the BLADE and SUPERBLADES vectors for sgRNA cloning |
| Cas9 (7A9-3A3) Mouse mAb (HRP Conjugate) #97982 | Cell Signaling Technology | 97982S | Anti-Cas9 antibody for Cas9 quantification by dot-blot |
| Cas9 Nuclease, S. pyogenes | New England Biolabs | M0386T | Recombinant Cas9 protein to be used as a reference for absolute quantification of the amount of Cas9 loaded within Nanoblades |
| Ethidium bromide solution (10 mg/mL in H2O) | Sigma-Aldrich | E1510-10ML | For staining agarose gels and visualize DNA |
| Fisherbrand Wave Motion Shakers | Fisher Scientific | 88-861-028 | Agitation table to resuspend Nanoblades upon centrifugation |
| gelAnalyzer | http://www.gelanalyzer.com; quantifying band intensity after digestion | ||
| Gesicle Producer 293T | Takara | 632617 | Nanoblades producer cell line |
| Gibco DMEM, high glucose, pyruvate | ThermoFisher Scientific | 41966052 | Cell culture medium for Gesicle Producer 293T cells |
| GoTaq G2 DNA Polymerase | Promega | M7848 | Taq polymerase for amplification of genomic DNA before T7 endonuclease assays |
| jetPRIME Transfection Reagent kit for DNA and DNA/siRNA | Polyplus | POL114-15 | Transfection reagent for Nanoblade production in Gesicle Producer 293T cells |
| Millex-AA, 0.80 µm, syringe filter | Millipore | SLAA033SS | Syringe filter to remove cellular debris before concentration of Nanoblades |
| Millex-GS, 0.22 µm, syringe filter | Millipore | SLGS033SS | Syringe filter to sterilise the sucrose cushion solution |
| Millex-HP, 0.45 µm, polyethersulfone, syringe filter | Millipore | SLHP033RS | Syringe filter to remove cellular debris before Nanoblades concentration |
| Monarch DNA Gel Extraction Kit | New England Biolabs | T1020L | DNA gel extraction kit for purification of the pBLADES or pSUPERBLADES plasmid fragment upon digestion with BsmBI |
| NEB Stable Competent E. coli (High Efficiency) | New England Biolabs | C3040I | Competent bacteria for plasmid transformation and amplification |
| NucleoBond Xtra Midi kit for transfection-grade plasmid DNA | Macherey-Nagel | 740410.50 | Maxipreparation kit for purification of plasmid DNA from cultured bacteria |
| Nucleospin gDNA extraction kit | Macherey-Nagel | 740952.50 | Extraction of genomic DNA from transduced cells |
| NucleoSpin Plasmid, Mini kit for plasmid DNA | Macherey-Nagel | 740588.50 | Minipreparation kit for purification of plasmid DNA from cultured bacteria |
| NucleoSpin Tissue, Mini kit for DNA from cells and tissue | Macherey-Nagel | 740952.5 | Genomic DNA extraction kit |
| Optima XE-90 | Beckman Coulter Life Sciences | A94471 | Ultracentrifuge |
| pBaEVRless | Els Verhoeyen (Inserm U1111) | Personnal requests have to be sent to: els.verhoyen@ens-lyon.fr | Baboon Endogenous retrovirus Rless glycoprotein described in Girard-Gagnepain, A. et al. Baboon envelope pseudotyped LVs outperform VSV-G-LVs for gene transfer into early-cytokine-stimulated and resting HSCs. Blood 124, 1221–1231 (2014) |
| pBS-CMV-gagpol | Addgene | 35614 | Enocdes the Murine Leukemia Virus gag and pol genes |
| pCMV-VSV-G | Addgene | 8454 | Envelope protein for producing lentiviral and MuLV retroviral particles |
| Phosphate-Buffered Saline (PBS) | ThermoFisher Scientific | 14200091 | 10X PBS to dilute in millipore water |
| Polybrene Transfection Reagent | Millipore Sigma | TR-1003-G | Cationic polymer that enhances the efficiency of retroviral transduction in specific mammalian cells. It can also allow viral-dependent entry of an Oligodeoxynucleotide (ODN) for homology-directed repair |
| Sucrose,for molecular biology, ≥99.5% (GC) | Sigma-Aldrich | S0389-5KG | Sucrose to prepare a cushion for Nanoblade purification through ultracentrifugation |
| SUPERBLADE5 | Addgene | 134913 | Empty backbone for cloning sgRNA sequence to be used in nanoblades system (Optimized for increased genome editing efficiency via Chen B et al., 2013) |
| SuperSignal West Dura Extended Duration Substrate | ThermoFisher Scientific | 34076 | Enhanced chemiluminescence (ECL) HRP substrate for Cas9 dot blots |
| SW 41 Ti Swinging-Bucket Rotor | Beckman Coulter Life Sciences | 331362 | Rotor for ultracentrifugation |
| SYBR Safe DNA Gel Stain | ThermoFisher Scientific | S33102 | Alternative to ethidium bromide for staining agarose gels and visualize DNA |
| T4 DNA Ligase | New England Biolabs | M0202S | DNA ligase to ligate the BLADE or SUPERBLADES vectors with the duplexed DNA oligos corresponding to the variable region of the sgRNA |
| T7 Endonuclease I | New England Biolabs | M0302S | T7 Endonuclease I recognizes and cleaves non-perfectly matched DNA. Allows to monitor the extent of genome editing at a specific locus |
| Triton-containing lysis buffer | Promega | E291A | Lysis buffer to disrupt Nanoblades and allow Cas9 quantification |
| TWEEN 20 | Sigma-Aldrich | P9416 | For the preparation of TBST |
References
- Jinek, M., et al. A programmable dual-RNA-guided DNA endonuclease in adaptive bacterial immunity. Science. 337 (6096), 816-821 (2012).
- Zuris, J. A., et al. Cationic lipid-mediated delivery of proteins enables efficient protein-based genome-editing in vitro and in vivo. Nature Biotechnology. 33, 73-80 (2015).
- Mangeot, P. E., et al. Genome editing in primary cells and in vivo using viral-derived Nanoblades loaded with Cas9-sgRNA ribonucleoproteins. Nature Communications. 10 (1), 45 (2019).
- Cai, Y., Bak, R. O., Mikkelsen, J. G. Targeted genome editing by lentiviral protein transduction of zinc-finger and TAL-effector nucleases. eLife. 3, 01911 (2014).
- Choi, J. G., et al. Lentivirus pre-packed with Cas9 protein for safer gene editing. Gene Therapy. 23 (7), 627-633 (2016).
- Gee, P., et al. Extracellular nanovesicles for packaging of CRISPR-Cas9 protein and sgRNA to induce therapeutic exon skipping. Nature Communications. 11, 1334 (2020).
- Indikova, I., Indik, S. Highly efficient 'hit-and-run' genome editing with unconcentrated lentivectors carrying Vpr.Prot.Cas9 protein produced from RRE-containing transcripts. Nucleic Acids Research. 48 (14), 8178-8187 (2020).
- Lyu, P., Javidi-Parsijani, P., Atala, A., Lu, B. Delivering Cas9/sgRNA ribonucleoprotein (RNP) by lentiviral capsid-based bionanoparticles for efficient 'hit-and-run' genome editing. Nucleic Acids Research. 47 (17), 99 (2019).
- Gheysen, D., Jacobs, E., de Foresta, F., Thiriart, C. Assembly and release of HIV-1 precursor Pr55gag virus-like particles from recombinant baculovirus-infected insect cells. Cell. 59 (1), 103-112 (1989).
- Hanna, R. E., Doench, J. G. Design and analysis of CRISPR-Cas experiments. Nature Biotechnology. 38 (7), 813-823 (2020).
- Sambrook, J. . Molecular cloning a laboratory manual. Third edition. , (2001).
- Jiang, W., et al. An optimized method for high-titer lentivirus preparations without ultracentrifugation. Scientific Reports. 5, 13875 (2015).
- Rueden, C. T., et al. ImageJ2: ImageJ for the next generation of scientific image data. BMC Bioinformatics. 18 (1), 529 (2017).
- O'Doherty, U., Swiggard, W. J., Malim, M. H. Human immunodeficiency virus type 1 spinoculation enhances infection through virus binding. Journal of Virology. 74 (21), 10074-10080 (2000).
- Brinkman, E. K., Chen, T., Amendola, M., van Steensel, B. Easy quantitative assessment of genome editing by sequence trace decomposition. Nucleic Acids Research. 42 (22), 168 (2014).
- Bollen, Y., Post, J., Koo, B. -. K., Snippert, H. J. G. How to create state-of-the-art genetic model systems: strategies for optimal CRISPR-mediated genome editing. Nucleic Acids Research. 46 (13), 6435-6454 (2018).
- Brinkman, E. K., et al. Easy quantification of template-directed CRISPR/Cas9 editing. Nucleic Acids Research. 46 (10), 58 (2018).
- Dussaud, S., Pardanaud-Glavieux, C., Sauty-Colace, C., Ravassard, P. Lentiviral mediated production of transgenic mice: a simple and highly efficient method for direct study of founders. Journal of Visualized Experiments. (140), e57609 (2018).
- Montagna, C., et al. VSV-G-enveloped vesicles for traceless delivery of CRISPR-Cas9. Molecular Therapy. Nucleic Acids. 12, 453-462 (2018).
- Marnef, A., et al. A cohesin/HUSH- and LINC-dependent pathway controls ribosomal DNA double-strand break repair. Genes & Development. 33 (17-18), 1175-1190 (2019).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved