Method Article
משלוח של Cas9/ sgRNA ריבונוקלאופרוטאין קומפלקס בתאים מונצחים וראשוניים באמצעות חלקיקים דמויי וירוס ("Nanoblades")
In This Article
Summary
פיתחנו פרוטוקול פשוט וזול לטעון Cas9 / מדריך יחיד RNA RNA (sgRNA) rbonucleoprotein מתחמים בתוך חלקיקים דמויי וירוס. חלקיקים אלה, הנקראים "Nanoblades", מאפשרים העברה יעילה של קומפלקס Cas9/sgRNA בתאים מונצחים וראשוניים, כמו גם ב- vivo.
Abstract
מערכת החזרות פלינדרומיות קצרות (CRISPR)-Cas המקובצת באופן קבוע בין-מרחבית הפכה את עריכת הגנום לדמוקרטית בתאים אאוקריוטים והובילה לפיתוח יישומים חדשניים רבים. עם זאת, אספקת חלבון Cas9 ו- RNA חד-מדריך יחיד (sgRNA) לתאי היעד יכולה להיות אתגר מבחינה טכנית. וקטורים ויראליים קלאסיים, כגון אלה הנגזרים מ- lentiviruses (LVs) או וירוסים הקשורים לאדנו (AAVs), מאפשרים אספקה יעילה של קידוד טרנסג'נים עבור חלבון Cas9 וה- sgRNA הקשור אליו בתאים ראשוניים רבים וב- vivo. עם זאת, וקטורים אלה יכולים לסבול מחסרונות כגון שילוב של הטרנסג'ן בגנום תא היעד, קיבולת מטען מוגבלת, וביטוי ארוך טווח של חלבון Cas9 ומדריך RNA בתאי היעד.
כדי להתגבר על חלק מהבעיות הללו, פותח וקטור אספקה המבוסס על נגיף לוקמיה מורין (MLV) כדי לארוז את חלבון Cas9 ואת RNA המדריך הקשורים אליו בהיעדר כל טרנסג'ן קידוד. על ידי היתוך חלבון Cas9 לטרמינל C של החלבון המבני Gag מ- MLV, נוצרו חלקיקים דמויי וירוס (VLPs) עמוסים בחלבון Cas9 וב- sgRNA (הנקראים "Nanoblades") . Nanoblades ניתן לאסוף ממדיום התרבות של תאים מפיקים, מטוהר, מכמת, ומשמש כדי transduce תאי היעד ולספק את קומפלקס Cas9 / sgRNA הפעיל. ננו-בלידים מספקים את מטען הריבונוקלאופרוטאין (RNP) שלהם באופן ארעי ומהיר במגוון רחב של תאים ראשוניים ומונצחים וניתן לתכנת אותם עבור יישומים אחרים, כגון הפעלה שעתוק חולפת של גנים ממוקדים, באמצעות חלבוני Cas9 מותאמים. Nanoblades מסוגלים בעריכת גנום vivo בכבד של עכברים בוגרים מוזרקים בביציות כדי ליצור בעלי חיים מהונדסים. לבסוף, הם יכולים להיות מורכבים עם DNA תורם עבור "ללא טרנספקטיה" תיקון הומולוגי מונחה. הכנת Nanoblade היא פשוטה, בעלות נמוכה יחסית, והוא יכול להתבצע בקלות בכל מעבדה לביולוגיה של התא.
Introduction
בהשוואה לנוקלאזים ניתנים לתכנות אחרים, מערכת CRISPR-Cas פישטה באופן דרמטי ודמוקרטיזציה של ההליך של פילוח גנום ספציפי לרצף ומחשוף בתאים אאוקריוטים. באמצעות הביטוי הפשוט של sgRNA, משתמשים יכולים לתכנת את חלבון Cas9 (או גרסאות ממוטבות) עבור כמעט כל לוקוס תאי1. בתרחיש זה, משלוח של חלבון Cas9 ו sgRNA הופך את המגבלה העיקרית בעת ביצוע mutagenesis מכוון לאתר. בתאים מונצחים, ניתן לבטא בקלות את ה- sgRNA ואת חלבון Cas מפלסמידים שעברו טרנספוזידים כדי להשיג מיקוד גנום יעיל ברוב התאים. עם זאת, ביטוי מכונן של קומפלקס Cas9/sgRNA יכול להגביר את הפעילות מחוץ למטרה של חלבון Cas9 ולהציג שינויים לא רצויים ב- loci2 לא ספציפי. בתאים ראשוניים, טרנספקטיבה DNA יכול להיות קשה מבחינה טכנית להשיג ולהוביל ביטוי לקוי או אחוז קטן של תאים transfected. חלופות לטרנספקטיה קלאסית של דנ"א כוללות שימוש בווקטורים ויראליים המספקים קידוד טרנסג'ן עבור Cas9 ו- sgRNA או אלקטרופורציה של חלבון Cas9 רקומביננטי בשילוב עם sgRNA סינתטי. עם זאת, גישות אלה יכולות להוביל לשילוב טרנסג'ן בתוך הגנום המארח של התא (כמו במקרה של וקטורים קלאסיים של ביטוי רטרו-ויראלי ולנטי-ויראלי), הגבלה על ידי גורמים תאיים, ולהוביל לביטוי מכונן של חלבון Cas9 ו- sgRNA.
אלקטרופורציה של קומפלקס Cas9/sgRNA RNP יכולה להתגבר על רוב הבעיות הללו ולהוביל לאספקה יעילה וחולפת בתאים הראשיים וב- vivo, כמו גם לאפשר תגובה תלוית מינון. עם זאת, זה בדרך כלל מסתמך על ציוד יקר ריאגנטים והוא גם קשה לשדרג אם מספר רב של תאים צריך להיות מטופלים. כחלופה לטכניקות הנ"ל, מחברים אלה פיתחו את "Nanoblades" - וקטור אספקה רטרו-ויראלי עבור חלבון Cas9 ו- sgRNA3 הדומה מבחינה רעיונית למערכות אחרות להעברת חלבונים קפסידים שמקורן בנגיף4,5,6,7,8. Nanoblades לנצל את היכולת הטבעית של פוליפרוטאין Gag מן retroviruses לייצר, כאשר לידי ביטוי לבד בתאים בתרבית, VLPs המשוחררים במדיום חוץ תאי9. על ידי היתוך חלבון Cas9 לקצה מסוף C של נגיף לוקמיה מורין (MLV) פוליפרוטאין Gag וביטוי משותף של sgRNA וגליקופרוטינים של מעטפה ויראלית, חלבון Cas9 יכול להיות אנקפסולציה בתוך VLPs שוחררו או Nanoblades. עם הטיהור, Nanoblades ניתן לדגור עם תאי היעד או מוזרק ויוו כדי לתווך מסירה מהירה, חולפת, ותלויה במינון של Cas9 / sgRNA RNP קומפלקס3.
Nanoblades ניתן לתכנת עם sgRNAs מרובים לעריכה בו זמנית ב loci שונים או עם וריאנטים Cas9 לבצע יישומים אחרים כגון הפעלה תמלול ספציפית ליעד או דיכוי3. בניגוד לאלקטרופורציה של חלבונים, המסתמכת על ביטוי רקומביננטי, ניתן לשכפל בקלות גרסאות Cas המתוארות לאחרונה מהספרות לווקטור ביטוי היתוך Gag, מה שהופך אותו לפלטפורמה רב-תכליתית. Nanoblades יכול להיות מורכב עוד יותר או טעון עם אוליגודודאוקסינוקלאוטידים חד גדילים כפולים (ssODNs) כדי לבצע תיקון מונחה הומולוגיה3. ייצור Nanoblade הוא יחסית פשוט וזול. יתר על כן, Nanoblades ניתן לאחסן ב 4 °C (4 °F) במשך ימים רבים או ב -80 °C (80 °F) לאחסון לטווח ארוך. בדרך כלל, Nanoblades מתווכים יעיל, עריכת גנום ללא טרנסג'ן בתאים התרבותיים המונצחים והראשוניים ביותר. עם זאת, תאים ראשוניים מסוימים עשויים להיות רגישים לנוכחות של חלקיקים ויראליים, וכתוצאה מכך תמותה מוגברת. תאים של המערכת החיסונית המולדת יכולים גם להגיב לנוכחות של Nanoblades (בגלל מוצאם הנגיפי) ולהיות מופעלים. במקרים אלה, פרוטוקול transduction צריך להיות ממוטב כדי להגביל את זמן החשיפה Nanoblades ולמזער השפעות לא ספציפיות. Nanoblades מייצגים חלופה מעשית וקלה ליישום לשיטות משלוח CRISPR זמינות אחרות.
Protocol
1. sgRNA עיצוב ושיבוט
הערה: הנחיות לעיצוב sgRNAs ניתן לקבל ממקורות מרובים כגון https://blog.addgene.org/how-to-design-your-grna-for-crispr-genome-editing או מחנה ו Doench10.
- לאחר ש-20 רצפי הנוקלאוטידים של sgRNA תוכננו, הזמינו את האוליגונוקלאוטידים הבאים של הדנ"א החד-גדילי:
- קדימה: 5' caccgNNNNNNNNNNNNNNNNNNNNNN 3' (N מתאים למוקוס הממוקד ללא רצף המוטיב הסמוך לפרוטו-חלל (PAM)
- הפוך: 5' aaacNNNNNNNNNNNNNNNNNC 3' (N מתאים להשלמה ההפוכה של הלוקוס הממוקד ללא רצף PAM)
הערה: אין צורך בשינויים מיוחדים בעת הזמנת האוליגנוקלאוטידים (אין דרישה לפוספט 5').
- הכלאה שני oligonucleotides DNA ב 0.2 מ"ל תגובת שרשרת פולימראז (PCR) צינור על ידי ערבוב 5 μL של חישול חוצץ (500 מ"מ NaCl; 100 mM Tris-HCl; 100 מ"מ MgCl2; 10 מ"מ DTT; pH 7.9 ב 25 °C), 1 μL של כל oligonucleotide DNA (100 μM פתרון מלאי במים), ו 42 μL של מים.
- בבלוק PCR, דגימות דגירה ב 95 °C (95 °F) עבור 15 s ולאחר מכן להקטין את הטמפרטורה ל 20 °C (6 °F) עם רמפה של 0.5 °C (6 °F)/s. יש לשמור בטמפרטורת החדר או לאחסן בטמפרטורה של 20 מעלות צלזיוס.
הערה: ניתן להשהות את הפרוטוקול כאן. - לעכל 10 מיקרוגרם של להב או SUPERBLADE sgRNA ביטוי פלסמידים עם 10 יחידות של אנזים הגבלת BsmBI-v2 עבור 3 שעות ב 55 °C (55 °C) בנפח תגובה כולל של 50 μL.
הערה: הווקטור המעוכל אמור לשחרר כניסת DNA של ~ 1.9 kb וקטע DNA שני של ~ 3.3 kb. - טען את תגובת ההגבלה על 1% ג'ל agarose מוכתם עם 5 מיקרוגרם / מ"ל של אתידיום ברומיד (או כתם ג'ל DNA חלופי בטוח יותר).
הערה: ללבוש ציוד הגנה מתאים בעת מניפולציה אתידיום ברומיד, אשר חשוד בגרימת פגמים גנטיים.- על שולחן אולטרה סגול (UV) שנקבע באורך גל של 312 ננומטר (כדי למנוע פגיעה ב- DNA), לחתוך את שבר ה- DNA של 3.3 kb מהג'ל, ולהניח אותו בצינור מיקרוצנטריפוגה של 1.5 מ"ל.
הערה: יש ללבוש ציוד הגנה מתאים (כפפות ומשקפי מגן UV) בעת מניפולציה של אתידיום ברומיד ועבודה על שולחן UV. - יש לחלץ דנ"א מהג'ל הפרוס המכיל את שבר הדנ"א של 3.3 ק"ג באמצעות ערכת מיצוי ייעודית של ג'ל דנ"א (ראו טבלת החומרים). לכמת את כמות הדנ"א המטוהר באמצעות ספקטרופוטומטר.
הערה: ניתן להשהות את הפרוטוקול כאן.
- על שולחן אולטרה סגול (UV) שנקבע באורך גל של 312 ננומטר (כדי למנוע פגיעה ב- DNA), לחתוך את שבר ה- DNA של 3.3 kb מהג'ל, ולהניח אותו בצינור מיקרוצנטריפוגה של 1.5 מ"ל.
- ליכוד את האוליגנוקלאוטידים ההיברידיים קדימה וההיפוך של הדנ"א משלב 1.2 לשלב 1.2 ללהבים המעוכלים של BsmB1, המטוהרים בג'ל או לווקטור SUPERBLADE משלב 1.5.2. לשם כך, להוסיף 2 μL של T4 DNA מאגר ligase, 50 ng של וקטור מטוהר ג'ל (משלב 1.5.2), 1 μL של oligonucleotides DNA ההיברידי (משלב 1.2), מים כדי לפצות את הנפח ל 19 μL, ו 1 μL של T4 DNA ligase. לדגור על התגובה ב 25 °C (50 °F) במשך 10 דקות.
- הפכו את מוצר הקשירה לחיידקים מוסמכים (ראו טבלת החומרים) כמתואר ב-11. צלחת החיידקים שהפכו על צלחת אגר אמפיצילין לוריא ברטאני ודגר לילה ב 37 °C (50 °F).
- בחר מספר מושבות מבודדות על צלחת אגר כדי לבצע minipreparation DNA11 (ראה את טבלת החומרים), ולבצע רצף Sanger באמצעות פריימר U6 קדימה (5' GACTATCATATGCTTACCGT 3 ') כדי לבדוק קשירה נכונה של רצף משתני sgRNA.
הערה: פלסמידים ביטוי sgRNA אחרים ניתן להשתמש אם הם אינם מקודדים עבור חלבון Cas9, אשר עלול להפריע לייצור Nanoblade.
2. הכנת פלסמיד
- בצע maxipreparation (ראה את טבלת החומרים) של כל הפלסמידים הנדרשים, ולהכין 10 מיקרוגרם aliquots ב 1 מיקרוגרם / מ"ל לאחסן ב -20 °C (80 °F). הימנע מחזורי הקפאה/הפשרה חוזרים ונשנים של הפלסמידים; השתמש aliquots פעמיים לפני השלכתם.
3. הכנת ננו-בלייד
- ביום 1, זרעים בין 3.5 ל -4 × 106 תאי HEK293T (ראה טבלת החומרים) ב 10 מ"ל של מדיום הנשר שונה של Dulbecco (DMEM) המכיל גלוקוז גבוה, נתרן פירובט, L-גלוטמין, סרום בקר עוברי 10% (FBS), ופניצילין / סטרפטומיצין בצלחת תרבית תאים 10 ס"מ. הזז את הצלחת 10 ס"מ בעדינות אחורה וקדימה, ולאחר מכן מימין לשמאל (חזור על רצף זה 5x) כדי להפיץ תאים הומוגנית על צלחת התרבות. תאי דגירה בטמפרטורה של 37 מעלות צלזיוס באינקובטור תאים עם 5% CO2.
הערה: כל ההליכים הקשורים לטיפול של תאים בתרבית Nanoblades צריך להתבצע תחת מכסה המנוע זרימה למינארי תרבית תאים כדי למנוע זיהום שלהם. - יום 2: טרנספקטירה של פלסמיד
- התאים צריכים להיות 70-80% רציפים 24 שעות לאחר הציפוי (איור 1A). החלף את המדיום עם 10 מ"ל של DMEM טרי המכיל גלוקוז גבוה, נתרן פירובט, L-גלוטמין, 10% FBS (פניצילין וסטרפטומיצין ניתן להשמיט למרות שזה לא חובה) לפני טרנספקטו.
הערה: בשלב זה, חשוב כי התאים אינם עולים בקנה אחד. אחרת, יעילות טרנספקטו, כמו גם ייצור חלקיקים יכול להיות מופחת. - עבור כל צלחת 10 ס"מ, להכין את הכמויות הבאות של plasmids בצינור 1.5 מ"ל: 0.3 מיקרוגרם pCMV-VSV-G, 0.7 מיקרוגרם pBaEVRless, 2.7 מיקרוגרם MLV Gag / Pol, 1.7 מיקרוגרם BIC-Gag-Cas9, 4.4 מיקרוגרם של להבים או SUPERBLADES plasmid קידוד sgRNA המשובט (או 2.2 מיקרוגרם כל אחד אם באמצעות שני sgRNAs).
- הוסף 500 μL של מאגר טרנספקטיה (ראה את טבלת החומרים), מערבולת עבור 10 שניות, ולאחר מכן צנטריפוגה עבור 1 s s. הוסף 20 μL של ריאגנט transfection (ראה את טבלת החומרים), מערבולת את הצינור עבור 1 s, ולאחר מכן צנטריפוגה עבור 1 s.
- יש לדגר במשך 10 דקות בטמפרטורת החדר, ולהוסיף את כל הפתרון כלפי טיפה לתאים במדיום DMEM באמצעות צינור P1000. הזז את הצלחת 10 ס"מ בעדינות אחורה וקדימה, ולאחר מכן מימין לשמאל (חזור על רצף זה 5x) כדי לפזר באופן אחיד את ריאגנט transfection על התאים. תאי דגירה בטמפרטורה של 37 מעלות צלזיוס לפחות 40 שעות באינקובטור תאים עם 5% CO2.
הערה: אם תרצה, ניתן לשנות את הבינוני 4 שעות לאחר ההעברה.
- התאים צריכים להיות 70-80% רציפים 24 שעות לאחר הציפוי (איור 1A). החלף את המדיום עם 10 מ"ל של DMEM טרי המכיל גלוקוז גבוה, נתרן פירובט, L-גלוטמין, 10% FBS (פניצילין וסטרפטומיצין ניתן להשמיט למרות שזה לא חובה) לפני טרנספקטו.
- ביום 3, בדוק את המורפולוגיה של התאים המודבקים מתחת למיקרוסקופ.
הערה: תאים מפיקים יתחילו להתמזג. זוהי תופעה רגילה בשל הביטוי של מעטפות ויראליות fusogenic (איור 1B, C). - יום 4: קצירת ננו-בלידים
הערה: לפחות 40 שעות לאחר ההעברה, התאים היו מתמזגים יחד בגלל הבעת המעטפות הנגיפיות הפוגגניות, ולפעמים התאים מנותקים לחלוטין מתמיכת הצלחת (איור 1D).- לאסוף 9 מ"ל של תרבות בינונית supernatant באמצעות פיפטה 10 מ"ל.
הערה: Nanoblades הם VLPs המסוגלים לספק את חלבון Cas9 ואת ה- sgRNA הקשורים אליו לתאים ראשיים וב- vivo. למרות שהם אינם נחשבים אורגניזמים מהונדסים גנטית כפי שהם נטולי חומר גנטי, הם יכולים לגרום לשינויים גנטיים. לכן, הם חייבים להיות מניפולציה בזהירות כדי למנוע כל מגע עם משתמשים (במיוחד אם הם מתוכנתים למקד גנים מדכאי גידול). מומלץ למשתמשים לעקוב אחר הנחיות הבטיחות המקומיות שלהם למניפולציה של וקטורים רטרו-ויראליים ולעבוד במעבדה ברמת BSL-2 בעת הכנת VLP וביצוע ניסויי טרנסדוקציה. Nanoblades ניתן להשבית עם 70% אתנול או 0.5% של hypochlorite נתרן. מומלץ גם לטפל בכל פסולת הפלסטיק (טיפים פיפטה, לוחות תרבית רקמות, צינורות צנטריפוגה) עם 0.5% hypochlorite נתרן לפחות 10 דקות כדי להשבית את Nanoblades. - צנטריפוגה supernatant שנאסף ב 500 × גרם במשך 5 דקות כדי להסיר פסולת הסלולר ולשחזר את supernatant מבלי להפריע גלולה התא.
הערה: אם Nanoblades נועדו לשמש בתאים ראשיים, לסנן את supernatant באמצעות מסנן 0.45 מיקרומטר או 0.8 מיקרומטר. שים לב כי שלב זה מפחית באופן דרסטי את titer Nanoblade כמו שבר משמעותי ייחסם בקרום המסנן. - גלולה Nanoblades לילה (12-16 שעות) ברוטור דלי מתנדנד ב 4,300 × גרם או ב 209,490 × גרם ב ultracentrifuge במשך 75 דקות ב 4 °C (ראה את טבלת החומרים).
הערה: אם תאי היעד יכולים לגדול ב- DMEM, ניתן לדגור אותם ישירות עם supernatant המתקבל לאחר שלב 3.4.2 מבלי לרכז את Nanoblades.
- לאסוף 9 מ"ל של תרבות בינונית supernatant באמצעות פיפטה 10 מ"ל.
- יום 5: חידוש ואחסון של Nanoblades
- לאחר צנטריפוגה, לאט לשאוף את המדיום resuspend את הכדור הלבן עם 100 μL של קר 1x פוספט חוצץ מלוחים (PBS). לכסות את הצינור עם parafilm, ודגור במשך 1 שעות ב 4 °C (4 °F) עם תסיסה עדינה לפני resuspending גלולה על ידי צינור למעלה ולמטה.
הערה: חומר צמיג לבן עשוי להופיע עם resuspension; זה נורמלי ואינו משפיע באופן משמעותי על היעילות של transduction. - לאחסן את Nanoblades ב 4 °C (65 °F) אם מתכננים להשתמש בהם בתוך ארבעה שבועות. אחרת, להקפיא את Nanoblades בחנקן נוזלי ולאחסן אותם ב -80 °C (80 °F).
הערה: יש להרכיב משקפי מגן וכפפות קריוגניות בעת מניפולציה של חנקן נוזלי. הקפאת הצמדה ואחסון ב-80 °C (80 °F) מובילה לירידה משמעותית ביעילות Nanoblade. יתר על כן, Nanoblades מופשר לא צריך להיות קפוא שוב. ניתן להשהות את הפרוטוקול כאן.
- לאחר צנטריפוגה, לאט לשאוף את המדיום resuspend את הכדור הלבן עם 100 μL של קר 1x פוספט חוצץ מלוחים (PBS). לכסות את הצינור עם parafilm, ודגור במשך 1 שעות ב 4 °C (4 °F) עם תסיסה עדינה לפני resuspending גלולה על ידי צינור למעלה ולמטה.
4. ריכוז של Nanoblades על כרית סוכרוז
הערה: כחלופה לצנטריפוגה לילית או אולטרה-צנטריפוגה (שלב 3.4.3), ניתן להתרכז בננובלידים בכרית סוכרוז. זה מניב שבריר טהור יותר של Nanoblades, אם כי הסכום הכולל התאושש יהיה נמוך יותר.
- הכן פתרון סוכרוז 10% (משקל לנפח) ב 1x PBS, ולסנן אותו באמצעות מסנן מזרק 0.2 מיקרומטר (ראה את טבלת החומרים).
- התחל את התהליך של ריכוז Nanoblades על כרית סוכרוז.
- מניחים 9 מ"ל של מדגם המכיל VLP (משלב 3.4.3) לתוך צינור אולטרה-מרכזי (ראה טבלת החומרים). באמצעות מזרק 3 מ"ל וצינורית, לאט שכבה 2.5 מ"ל של 10% סוכרוז מתחת למדגם, מנסה לא לערבב את המדגם המכיל VLP ואת פתרון סוכרוז.
- לחלופין, מניחים 2.5 מ"ל של 10% סוכרוז לתוך צינור אולטרה-מרכזי (ראה את טבלת החומרים). הטה את הצינור והוסף לאט את 9 מ"ל של מדגם המכיל VLP (משלב 3.4.3) עם pipettor במהירות נמוכה. במהלך פעולה זו, להעלות בהדרגה את הצינור למצב אנכי.
- צנטריפוגה הדגימות ב 209,490 × גרם ב ultracentrifuge במשך 90 דקות ב 4 °C (60 °F).
הערה: טכניקה זו יכולה להיות מותאמת לצנטריפוגה במהירות נמוכה (4,300 × גרם) בין לילה כמתואר ב - 12. - לאחר צנטריפוגה, להסיר את supernatant בזהירות ומניחים את הצינור הפוך על נייר טישו כדי להסיר את כל הנוזל שנותר. לאחר דקה אחת, מוסיפים 100 μL של 1x PBS ומניחים את הצינור ב 4 °C (65 °F) עם כיסוי parafilm במחזיק צינור על שולחן עצבנות במשך 1 שעות (ראה את טבלת החומרים) לפני resuspending את הכדור על ידי צנרת למעלה ולמטה.
הערה: ניתן להשהות את הפרוטוקול כאן.
5. ניטור טעינת Cas9 בתוך Nanoblades על ידי כתם נקודה
- הכן את מאגר הדילול על-ידי הוספת נפח אחד של מאגר תמוגה המכיל חומר פעילי שטח לא יוניים (ראה טבלת החומרים) בארבעה כרכים של 1x PBS. לדלל 2 μL של Nanoblades מרוכז ב 50 μL של מאגר דילול, מערבולת בקצרה, ולהעביר 25 μL של תערובת זו לתוך צינור חדש המכיל 25 μL של מאגר דילול. חזור על פעולה זו כדי לקבל 4 צינורות של דילול Nanoblade (שלבי דילול פי 2).
- עבור הפקדים הסטנדרטיים, לדלל 2 μL של נוקלאז Cas9 רקומביננטי (ראה את טבלת החומרים) לתוך 50 μL של מאגר דילול, מערבולת בקצרה, ולהמשיך לעשות שמונה דילול סדרתי (דילול פי 2 עבור כל צעד).
- בזהירות לזהות 2.5 μL של כל דילול VLP ו 2.5 μL של כל תקן על קרום ניטרוצלולוז עם pipet רב ערוצי (נפח גדול יותר עלול לגרום כתמים חופפים).
הערה: ניתן להשתמש גם בקרום פוליווינילדיפלואוריד שטופלו במתנול. - לאחר החלקיקים נספגים על הממברנה, לחסום את הממברנה עם 1x טריס חוצץ מלוחים המכילים פעילי שטח לא יוניים (TBS-T) בתוספת חלב יבש ללא שומן (5% w / v) במשך 45 דקות בטמפרטורת החדר.
הערה: ניתן להשהות את הפרוטוקול כאן, ואת הממברנה מאוחסנת ב 4 °C (60 °F) ב 1x TBS-T. - יש להשליך את ה-1x TBST בתוספת חלב יבש ללא שומן, ולדגור על הממברנה למשך הלילה ב-4 °C (4 °F ) עם נוגדן פרוקסידאז Cas9-חזרת (1/1000 דילול ב-1x TBST, 5% חלב). לשטוף את הממברנה 3x עם TBS-T, ולדמיין את האות באמצעות ערכת מצע chemiluminescent משופרת.
- כימת את עוצמת הנקודות עבור Nanoblades ודילול סטנדרטי Cas9 רקומביננטי באמצעות התוכנה הקניינית המסופקת עם תחנת הדמיית הג'ל או imageJ13. הגדר עקומה ליניארית המקשרת את עוצמת הנקודות לריכוז Cas9. באמצעות הפונקציה של העקומה המתקבלת, אקסטרפולציה של תוכן Cas9 בכל הכנה.
הערה: כמות בקרת החלבון Cas9 הרומביננטית יכולה להרוות את הקריאה עבור הדגימות המרוכזות ביותר של ערכת הדילול הסטנדרטית (איור 2). לכן מומלץ, בעת הגדרת העקומה הליניארית, להסיר את הקריאה מהדגימות הלא מדוללות (ולפעמים זו שלבי הדילול הראשונים) אם הם אינם בטווח הליניארי ביחס לריכוז הידוע של Cas9 שזוהה. באופן דומה, בעת אקסטרפולציה של כמות Cas9 בתוך דגימות Nanoblade, השתמש רק את הקריאות הנמצאות בטווח הליניארי של העקומה הסטנדרטית.
6. טרנסדוקציה של תאי יעד עם Nanoblades (הליך עבור transduction בצלחת 12-well)
- בצלחת של 12 בארות, זרע 100,000-200,000 תאים (תאים חסידים ראשוניים או מונצחים) לבאר ב 1 מ"ל של המדיום הנכון תרבית התא. אפשר לתאים להיצמד לפני משטח הלוח לפני ההמרה.
- בצינור מיקרוצנטריפוגה של 1.5 מ"ל, הוסף 5-20 μL של Nanoblades מרוכז (משלב 3.5.1 או 4.4) ל 500 μL של מדיום תרבית תאים, וערבב על ידי צנרת למעלה ולמטה עם pipettor P1000. הסר את המדיום מהתאים, והחלף אותו עם 500 μL של תערובת Nanoblade זה.
הערה: יש למטב את ההמרה עבור כל סוג תא. חשוב להשתמש בנפח הקטן ביותר האפשרי של בינוני (תוך הימנעות ייבוש של תאי היעד) כך Nanoblades להישאר מרוכז מאוד. תאים דבקים חייבים להיות מועברים ישירות כאשר הם מחוברים לצלחת (אין לבצע העברה בהשעיה מכיוון שהדבר יקטין באופן משמעותי את יעילות ההמרה). תאים מסוימים סובלים חשיפה ממושכת Nanoblades (24-48 שעות) בעוד שאחרים רגישים מאוד ועלולים ליצור סנכרון קטן. במקרה זה, Nanoblades חייב להיות דגירה עם תאים רק עבור 4-6 שעות לפני החלפת המדיום. Spinoculation14 יכול גם לשפר את התמרה עבור תאים הגדלים בהשעיה. אדג'ובנטים כגון פולימרים קטיוניים (ראה טבלת החומרים) יכולים גם לשפר את יעילות ההעברה בסוגי תאים מסוימים. - לאחר 4-6 שעות של דגירה של תאים בנפח נמוך של בינוני המכיל Nanoblades, להגדיל את הנפח של בינוני לכמות הרגילה (1 מ"ל אם עובד עם צלחת 12-well), או להחליף אותו עם בינוני טרי אם התאים רגישים VLPs.
הערה: מדיום התא המכיל Nanoblades חייב להיות מושבת עם 0.5% נתרן hypochlorite במשך 10 דקות לפני השלכתו. השתמש כפפות ומשקפי מגן בעת מניפולציה hypochlorite נתרן. אם Nanoblades לגרום למוות תאים, להתאים את כמות וזמן החשיפה הכולל כדי להפחית את התמותה תאים.
7. מדידת יעילות CRISPR במוקד על ידי בדיקת אנדונוקלאז T7
- עצב פריימרים של PCR להגברת אזור 400-700 בסיס-זוג (bp) המקיף את אתר מחשוף CRISPR.
הערה: אתר המחשוף צריך להיות רחוק מקצה האמפליקון על ידי לפחות 200 bp ויש להזיז אותו מעט ממרכז האמפליקון, כך שעל מחשוף אנדונוקלאז T7, 2 שברים בגדלים שונים ישוחררו. - לחלץ DNA גנומי מתאים שטופלו עם Nanoblades מיקוד הגן של עניין מתאי בקרה שטופלו Nanoblades מתוכנתים עם sgRNA בקרה (ראה את טבלת החומרים).
הערה: ניתן להשהות את הפרוטוקול כאן. - באמצעות 150 ng של DNA גנומי כתבנית, לתכנת תגובת PCR של נפח 30 μL (נפח סופי) על ידי ביצוע הפרוטוקול של היצרן. ודא כי הגברת PCR מניבה מגבר יחיד בגודל הצפוי על ידי הפעלת ג'ל 2% אגרוז מוכתם עם 5 מיקרוגרם / מ"ל של אתידיום ברומיד (או כתם ג'ל DNA חלופי בטוח יותר).
הערה: ללבוש ציוד הגנה מתאים בעת מניפולציה אתידיום ברומיד, אשר חשוד בגרימת פגמים גנטיים. ניתן להשהות את הפרוטוקול כאן. - דור הטרודופלקס ועיכול
- בצינור PCR 0.2 מ"ל, להוסיף 5 μL של מאגר האנזים (מסופק עם T7 אנדונוקלאז I), 20 μL של מים, ו 24 μL של מוצר PCR משלב 7.3. אפשר היווצרות heteroduplex על ידי חימום הדגימות ל 94 °C (64 °F) מעל 3 דקות ולאחר מכן על ידי הפחתת הטמפרטורה (2 °C (60 °F) כדי להגיע 40 °C (60 °F).
- הוסף 0.5 μL של T7-אנדונוקלאז I בטמפרטורת החדר לכל צינור heteroduplex, כולל הפקד. דגירה בטמפרטורה של 37 מעלות צלזיוס למשך 15 דקות. טען את התגובה המתקבלת בג'ל אגרוז 2.5% (משקל/נפח) המוכתם על ידי אתידיום ברומיד. לאחר הנדידה, דמיינו את הג'ל על טרנסילומינטור UV.
הערה: ללבוש ציוד הגנה מתאים בעת מניפולציה אתידיום ברומיד, אשר חשוד בגרימת פגמים גנטיים. השתמש במשקפי מגן UV בעת שימוש transilluminator UV. - מדוד את יעילות המחשוף על ידי ניתוח התמונה הנובעת מתגובת העיכול כדי לכמת את עוצמת כל רצועה עם תוכנה מתאימה (ראה טבלת החומרים).
8. מדידת יעילות CRISPR בלוקר הממוקד על ידי רצף סנגר וניתוח גאות ושפל
הערה: כחלופה לבדיקת אנדונוקלאז T7, ניתן לפקח על יעילות CRISPR על-ידי ניתוח וניתוק של עקבות רצף סנגר בהתבסס על פרוטוקול TIDE15.
- בצע רצף Sanger של אמפליקונים PCR משלב 7.3 (כולל תנאי בקרה המתאים לתאים לא מטופלים) באמצעות פריימר PCR קדימה או הפוך.
- נתח את עקבות הרצף של סנגר של מצב הבקרה (תאים לא מטופלים) ודגימות שטופלו ב- Nanoblade באמצעות שרת TIDE (https://tide.nki.nl) ובהתאם להנחיות הניתוח שלהם.
9. היווצרות מורכבת Nanoblade עם תורמי SsODN לתיקון בהומולוגיה מכוונת (הליך להעברה בלוח 12-well)
הערה: הנחיות לעיצוב ssODN לעריכה יעילה בתיווך תיקון מונחה הומולוגיה תוארו בעבר16.
- בצלחת 12-well, זרע 100,000-200,000 תאים לבאר ב 1 מ"ל של המדיום הנכון תרבית התא. אפשר לתאים להיצמד לפני משטח הלוח לפני ההמרה.
- הכן 100 μL של פתרון של פולימר קטיוני (ראה את טבלת החומרים) ב 8 מיקרוגרם / מ"ל ב 1x PBS.
- ערבבו 19 μL של פתרון הפולימר הקטיוני עם 100 pmol של תבנית ssODN. הוסף 20 μL של Nanoblades מרוכז (משלב 3.5.1 או 4.4), ודגר במשך 15 דקות על קרח.
- הסר את Nanoblades מורכב / ssODN מקרח, ולהוסיף 500 μL של מדיום תרבית התא (ב 37 °C (ב 37 °C (37 °C). הסר את המדיום מתאי היעד (משלב 9.1), והוסף את 500 μL של מדיום המכיל את Nanoblades/ ssODN המורכבים. אפשר לתאים להתרבות במשך 48 שעות לפני genotyping.
- חלץ דנ"א גנומי מחלק קטן מאוכלוסיית התאים באמצעות ערכת מיצוי ייעודית (ראו טבלת החומרים).
- עצב פריימרים של PCR כדי להגביר אזור של 400-700 bp המקיף את אתר הנוק-אין.
הערה: פריימרים PCR לא צריך לחפוף עם הזרועות ההומולוגיות של ssODN כדי למנוע תוצאות חיוביות שווא הנובעות הגברת PCR של כל ssODN שיורית עדיין קיים בתוך תאי היעד. - באמצעות 150 ננוגרם של DNAs גנומיים מתאי בקרה (לא מטופלים) או תאים שטופלו בננו-בלייד כתבנית, תכנת תגובת PCR של 30 μL בעקבות פרוטוקול היצרן.
הערה: עקבות ssODN עשויים להיות נוכחים במדיום התא מספר ימים לאחר ההמרה עם המתחם. SsODN זה עשוי לשמש כתבנית חלקית עבור בדיקות PCR המנסות לסנן עבור השילוב הנכון. לפיכך, מומלץ להעביר את התאים לפחות פעמיים לאחר ההמרה, כדי למנוע בדיקות חיוביות שווא בסופו של דבר. - טען 5 μL של הפקד ותגובות PCR שטופלו Nanoblade בג'ל agarose 1% (משקל / נפח) מוכתם על ידי אתידיום ברומיד. לאחר הנדידה, דמיינו את הג'ל על טרנסילומינטור UV.
הערה: אם רקומבינציה הומולוגית מוצלחת ומתאימה להכנסה של יותר מ-1 bp של חומר גנטי, צריך להיות הבדל במשקל המולקולרי של האמפליקונים של PCR בין הפקד לדגימה שטופלו בננובלייד. מכיוון שהיעילות של HDR אינה מגיעה ל-100%, שתי רצועות צריכות להיות גלויות במדגם שטופלו בננו-בלייד (אחת בגודל דומה לאמפליקון PCR הבקרה המתאים לאלל הלא ערוך ואחת מהמשקל המולקולרי הגבוה יותר המתאים לאלל הנוק-אין, ראה איור 3B בלוח האמצעי).
- עצב פריימרים של PCR כדי להגביר אזור של 400-700 bp המקיף את אתר הנוק-אין.
- בצע רצף סנגר של הפקד ואמפליקונים PCR שטופלו Nanoblade.
- כימת את יעילות ההפעלה באמצעות פרוטוקול TIDER17.
10. משלוח Nanoblade ב vivo
- לספק עד 25 μL של Nanoblades מרוכז משלב 3.5.1 דרך הזרקה רטרו-מסלולית או עד 100 μL באמצעות הזרקת וריד הזנב, כמתואר ב 18, אם עובדים עם עכברים.
הערה: כל ההליכים הכרוכים בניסויים בבעלי חיים (כולל זריקות Nanoblade למטרות עריכת גנום) דורשים פרוטוקול מאושר מוועדת אתיקה מקומית. - עבור הדור של עכברים מהונדסים, להשתמש מיקרו מזרק כדי לספק מ 1 pL ל 10 pL של Nanoblades מרוכז משלב 4.4 לתוך החלל perivitelline של ביציות עכבר כפי שתואר בעבר18.
הערה: עבור הזרקת perivitelline, זה חיוני כדי לטהר ולרכז Nanoblades על כרית סוכרוז, כדי למנוע סתימת מיקרו מזרק.
תוצאות
הפרוטוקול להכנת Nanoblade הוא פשוט למדי ודורש ציוד מעבדה פשוט מלבד גישה למכסה המנוע תרבית רקמות, חממת CO2 , וצנטריפוגת דלי מתנדנדת או אולטרה-צנטריפוגה. עם זאת, צעדים מסוימים דורשים תשומת לב מיוחדת כגון המקור והטיפול בתאי היצרן, כמו גם תנאי transduction. כפי שניתן לראות באיור 1A, חשוב לזרוע תאים כך שהם יחולקו בצורה הומוגנית בצלחת ויגיעו למפגש של כ-70%-80% ביום ההעברה (הימנעו מגושים של תאים). עשרים וארבע שעות לאחר ההעברה (איור 1B, C), תאי היצרן ייצרו סינסיטיה המובילה לתאים בגודל גדול יותר עם גרעינים מרובים. ארבעים שעות לאחר ההעברה (איור 1D), רוב התאים בצלחת ייצרו סינסיטיה ויתחילו להתנתק מהצלחת.
זה נורמלי לחלוטין והוא נגרם על ידי הביטוי של גליקופרוטאין המעטפה, אשר גורם היתוך בין תאים שכנים. עם ריכוז על ידי צנטריפוגה (או אפילו ישר מן supernatant של תאים מפיקים), כמות Cas9 טעון בתוך Nanoblades ניתן לכמת באופן מוחלט על ידי כתם נקודות על קרום ניטרוצלולוז באמצעות Cas9 רקומביננטי כהפניה (איור 2). שלב זה חשוב כדי לקבוע את הכמות הנכונה של Nanoblades לשימוש עבור transduction של תאי היעד. בעת ביצוע בדיקת כתמי הנקודות, חשוב לקחת בחשבון רק את הקריאות הנכללות בטווח הליניארי של העקומה הסטנדרטית. עם זאת, ללא תלות בכמות ה-Cas9 הקיימת בננובלאדס, חיוני לבדוק את היעילות של עריכת הגנום ישירות בתאי היעד באמצעות בדיקת אנדונוקלאז T7 (איור 3) או ריצוף סנגר.
כפי שמוצג באיור 3, היעילות של Nanoblades יכולה להיות שונה מאצווה לאצווה למרות שהיא בדרך כלל מתואמת לכמות Cas9. בדוגמה המוצגת באיור 3, האצווה מנתיב 1 מובילה ליעילות עריכה כוללת של 20%, בעוד האצווה מנתיב 3 מובילה ליעילות של 60%. במקרה זה, ניתן להגדיל את הנפח של Nanoblades המשמש מאצווה 1 כדי להשיג יעילות עריכה דומה לזו מאצווה 3. איור 4 מציג את יעילות העריכה המרבית המתקבלת באמצעות Nanoblades בסוגים שונים של תאים ראשיים. חשוב לציין כי היעילות עשויה להשתנות בהתאם לרצף של sgRNA בשימוש ונגישות היעד.
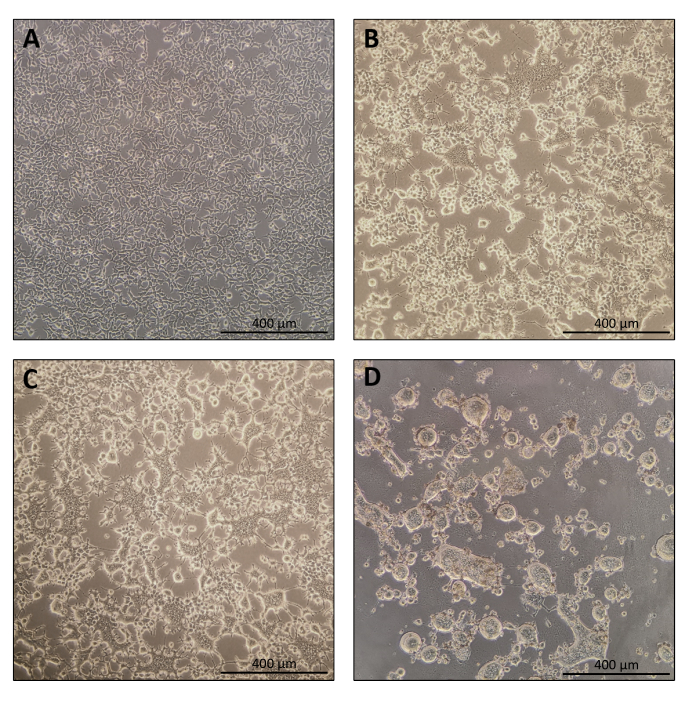
איור 1: מורפולוגיה של תאים מפיקים במהלך ייצור Nanoblade. (A) תאי HEK293T במפגש של 70-80% 24 שעות לאחר הציפוי. (B ו - C) מורפולוגיה של תאים HEK293T 24 שעות לאחר טרנספקטה. (D) HEK293T מורפולוגיה של תאים 40 שעות לאחר ההעברה. סרגלי קנה מידה = 400 מיקרומטר. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
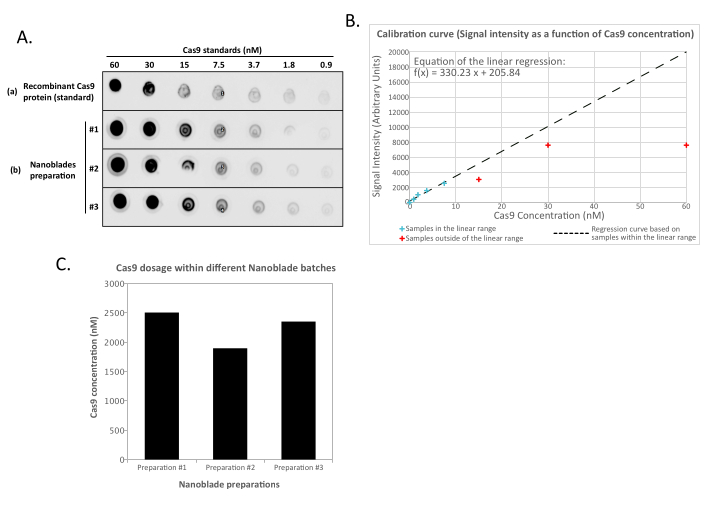
איור 2: כימות טעינת Cas9 בתוך Nanoblades לפי כתם נקודות. (A) רקומביננטי Cas9 או 100x מרוכז (על ידי אולטרה-מרכזיות) דגימות Nanoblade (#1, #2 ו- #3) מדוללות פי 2 ברצף ומזוהות על קרום ניטרוצלולוז לפני הדגירה עם נוגדנים משולבים נגד Cas9 HRP. האות מתגלה על ידי chemiluminescence משופרת. (B) אות Chemiluminescence נרכש ומכמת עבור דילול Cas9 רקומביננטי ועוצמת האות שנועד כנגד הכמות הידועה של Cas9 שזוהתה על קרום הניטרוצלולוז. עקומת רגרסיה מחושבת עבור הדילולים הנמצאים בטווח הליניארי (ראו צלבים כחולים), למעט כל הריכוזים הנמצאים מחוץ לטווח הליניארי (ראו צלבים אדומים). (C) ריכוז Cas9 (nM) בכל הכנה Nanoblade היה אקסטרפולציה באמצעות המשוואה מן הרגרסיה הליניארית המתקבלת ב(B). לשם כך, חשוב להשתמש רק באות המכומת מדילול Nanoblade הנופלים בטווח הליניארי של עקומת הרגרסיה. לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.

איור 3: ניטור יעילות העריכה בעת ההעתקה. (A) בדיקת אנדונוקלאז T7 המודדת את יעילות המחשוף בתאים שטופלו בננו-בלייד. תאים שהועברו עם Nanoblades מיקוד הגן EMX1 נותחו על ידי בדיקת אנדונוקלאז T7. נתיב 1: אצוות הכנה Nanoblade #1 (20% יעילות מחשוף); נתיב 2: תאי בקרה; נתיב 3: אצוות הכנה Nanoblade #2 (60% יעילות מחשוף). (ב) הקשה על רצף תגיות הדגל במסגרת הקריאה הפתוחה של DDX3 . Nanoblades מרוכז מתוכנת עם sgRNA מיקוד לוקוס DDX3 הופקו שיבוטים HEK293T שונים (#1, #2) ומורכבים עם מינונים הולכים וגדלים של תבנית Flag-DDX3 ssODN ואת המתחמים המתקבלים המשמשים לתעבורה של תאי היעד HEK293T. עם ההמרה, תאים גדלו במשך שלושה ימים לפני איסוף אותם כדי לחלץ DNA גנומי וחלבונים הכוללים. חלבוני דגל-DDX3 היו immunoprecipitated באמצעות חרוזי אגרוזים נגד דגל ואחריו ניתוח כתם מערבי של חלבונים התאוששו באמצעות נוגדן נגד דגל (פאנל עליון). החדרה מכוונת אתר של תג הדגל בלוקוס Ddx3 נבדקה גם על ידי PCR באמצעות או פריימרים המאגפים את אתר הכניסה (פאנל אמצעי), או באמצעות פריימר קדמי המזהה את רצף תג הדגל ופריימר הפוך ספציפי ל- Ddx3 locus במורד הזרם של אתר הכנסת הדגל (החלונית התחתונה). קיצורים: EMX1 = ריק ספירקלס הומיאובוקס 1; DDX3 = RNA helicase 3; PCR = תגובת שרשרת פולימראז; ODN = אוליגודודאוקסינוקלאוטיד; ssODN = ODN סינג-גדיל; sgRNA = RNA מדריך יחיד; IP = immunoprecipitation. לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
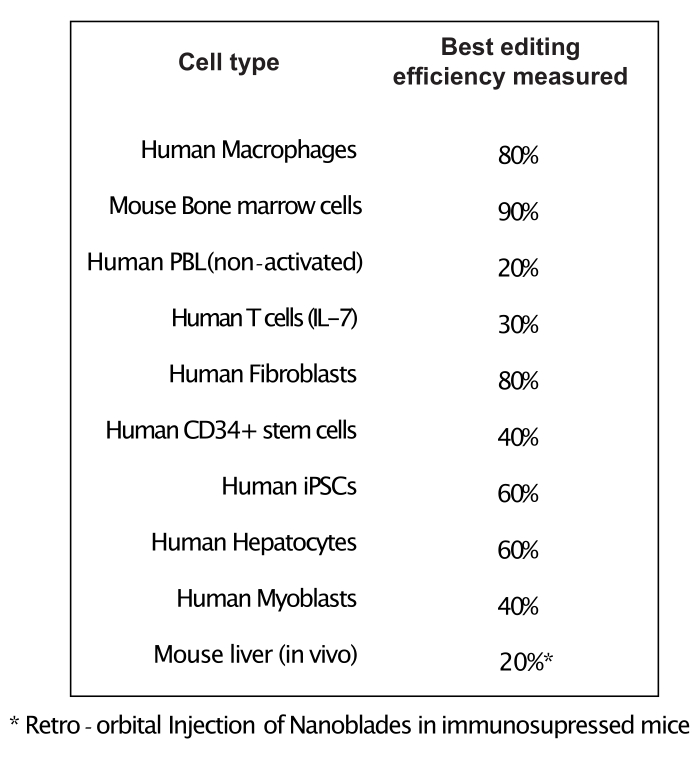
איור 4: יעילות העריכה שהושגה בסוגי תאים ראשיים שונים באמצעות Nanoblades. קיצורים: PBL = לימפוציט דם היקפי; IL = אינטרלוקין; CD = אשכול של בידול; iPSC = תאי גזע פלוריפוטנטים מושרים. לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
Discussion
Nanoblades לאפשר משלוח מהיר ותלוי במינון של קומפלקס Cas9/ sgRNA RNP בשורות התא ותאים ראשיים. בניגוד לטרנספקטיה קלאסית וקטורים ויראליים אחרים, אך בדומה לאלקטרופורציה של חלבונים, לננובלאדים יש את היתרון של משלוח ארעי של Cas9/sgRNA RNP באופן נטול טרנסג'ן. Nanoblades מציעים פלטפורמה רב-תכליתית, פשוטה וזולה ביותר לאספקת חלבונים שניתן להתאים בקלות ובמהירות למשפחה ההולכת ומתרחבת של גרסאות CRISPR. Nanoblades ניתן לייצר בקו התא HEK293T או נגזרותיו. קווי תאים HEK293T המשמשים כאן פותחו כדי למקסם את ייצור החלקיקים הרטרו-ויראלי והרטי-ויראלי (ראו טבלת החומרים). עם זאת, למרות מקורות אחרים של תאי HEK293T עשויים להיות מתאימים, משתמשים חייבים לבדוק ולהשוות תאי HEK293T ממקורות שונים כמו הבדלים עיקריים בייצור חלקיקים נצפו בהתאם למקור התא HEK293T. תאים צריכים גם להיבדק לזיהום Mycoplasma לעתים קרובות ועבר כל שלושה ימים (קלאסי 1/8 דילול) כדי למנוע עומס יתר, אשר יש השפעה שלילית על ייצור חלקיקים.
תאים לא צריכים להיות מתוחזקים במשך מעל 20 קטעים. DMEM בתוספת גלוקוז, פניצילין/סטרפטומיצין, גלוטמין, ו-10% סרום בקר עוברי מפורק שימש לתרבות תאים. כמו מקור סרום עשוי להשפיע על איכות ההכנה Nanoblade, אצוות שונות של סרום צריך להיבדק לפני ייצור בקנה מידה גדול. Nanoblades יכול להיות מיוצר ביעילות במדיה אחרת כגון RPMI או שינויים ללא סרום של מדיום חיוני מינימלי שיכול להחליף DMEM ביום שלאחר טרנספקטיבה. כפי שצוין להלן, למרות החלפה בינונית לאחר transfection עם כמה ריאגנטים DNA-transfection הוא אופציונלי, זה עשוי להיות מועיל לשנות את המדיום שבו VLPs משוחררים, במיוחד כדי להגביל את עקבות סרום בהכנת החלקיקים. עם זאת, טיפוח תאים במדיום חיוני מינימלי בסרום מופחת ביום שלפני הטרנספוזיציה עדיין לא נוסה.
כאמור, Nanoblades מיוצרים על overexpression של תערובת של פלסמידים בתאי היצרן. נראה כי ביטוי היתר נדרש לייצור אופטימלי. ואכן, מעבדה זו פיתחה קו תאים מפיק שבו המבנה המבטא Gag-Pol התייצב על ידי בחירת אנטיביוטיקה; עם זאת, מערכת זו נכשלה לייצר כמויות משמעותיות של Nanoblades. תצפית דומה נעשתה כאשר מבנה קידוד sgRNA שולב ביציבות בגנום של תאי היצרן. כפי שתואר עבור מערכות ייצור חלקיקים אחרות, קו תאים יציב המבטא לפחות כמה מבנים המעורבים בייצור Nanoblades עשוי להיות שימושי; עם זאת, זה בהחלט ידרוש עיבוד של כמויות גדולות של supernatant וטכניקה מתאימה כדי לטהר חלקיקים. הפרוטוקול לעיל מתאר את ההליך המועדף לייצור Nanoblades המנצל ריאגנטים טרנספקטים ספציפיים (ראה טבלת החומרים).
למרות ריאגנטים transfection מיצרני אחרים נבדקו גם בהצלחה, הרוב המכריע של תוצאות קבוצה זו עם Nanoblades בצע את ההליך המתואר בזאת. טרנספקטיה בעלות נמוכה ניתן להשיג באמצעות ריאגנטים סידן פוספט ולהניב יעילות ייצור טובה; עם זאת, שיטה זו בהחלט דורשת החלפת מדיום transfection ביום שלאחר transfection ועלול להשאיר שאריות סידן פוספט בהכנת חלקיקים משקעים. עולה בקנה אחד עם הצורך של רמות ביטוי גבוהות עבור רכיבי Nanoblade בתוך תאים מפיקים היא התצפית כי כמות sgRNAs הקשורים חלבון Cas9 יכול להיות גורם מגביל לעריכת גנום יעילה. כדי לשפר את טעינת sgRNA, שתי גישות טכניות פותחו לאחרונה על ידי קבוצות עצמאיות באמצעות וקטורים אספקת חלבון דומה Nanoblades. אלה מסתמכים על השימוש בביטוי ציטופלסמי תלוי פולימראז T7 של sgRNA6 או באמצעות תוספת של אות אנקפזיציה רטרו-ויראלי לרצף sgRNA כדי לתווך כריכה לפוליפרוטאין Gag6. גישות אלה אכן יכול לשפר את טעינת sgRNA בתוך Nanoblades למרות שהם לא נבדקו עדיין.
טרנסדוקציה של תאי יעד היא צעד קריטי בהליך. ברוב קווי התאים המונצחים, לתמרה עם Nanoblades יש השפעה ציטופתית מועטה, אם בכלל. עם זאת, בתאים ראשוניים, רעילות יכולה להיות בעיה. לפיכך, יש למטב את ההמרה עבור כל סוג תא. באופן ספציפי, זמן החשיפה Nanoblades הוא גורם חשוב לשנות בעת אופטימיזציה של פרוטוקול transduction. עבור תאים רגישים כגון נוירונים ראשוניים או תאי מח עצם, 4-6 שעות של דגירה עם Nanoblades לפני החלפת המדיום מאפשר משלוח יעיל של חלבון Cas9 תוך מזעור רעילות התא. יתר על כן, אדג'ובנטים כגון פולימרים קטיוניים, בין היתר, יכולים לשפר באופן משמעותי את היעילות של transduction בתאים מסוימים (ראה את טבלת החומרים). חשוב לציין כי Nanoblades הם VLPs והוא יכול לגרום לתגובה אימונוגנית. זה יכול להיות מגבלה אם עובדים עם סוגים מסוימים של תאים ראשוניים, כגון מקרופאגים או תאים דנדריטיים, שבהם דגירה עם Nanoblades יכול לגרום לשינויים חשובים בביטוי הגנים ואת פנוטיפ של התאים. אם מקרופאגים ותאים דנדריטיים נגזרים ממבשרי תאי גזע hematopoietic (כגון תאי מח עצם עכבר), עדיף להעביר תאים עם Nanoblades לפני שהם מובחנים לחלוטין כדי למנוע גרימת תגובה תאית נגד Nanoblades. אחרת, אלקטרופורציה של חלבון Cas9 יכולה לייצג חלופה מעשית בעת עבודה עם תאים חיסוניים מובחנים.
Nanoblades ניתן להשתמש vivo כדי להמרת זיגוטים עכבר או עוברים כדי ליצור בעלי חיים מהונדסים. בדומה לווקטורים רטרו-ויראליים קלאסיים או lentiviral, הם יכולים גם להיות מוזרקים ישירות לתוך רקמות מבעלי חיים בוגרים. עם זאת, Nanoblades (בדומה לווקטורים רטרו-ויראליים ו lentiviral) יכול להיות מושבת על ידי התגובה החיסונית של החיה המארחת; לפיכך, המינון שיש להזריק צריך להיות ממוטב עבור כל יישום. תגובה חיסונית זו יכולה גם להגביל את ההתפלגות של VLPs פונקציונליים לרקמות קרוב לאתר ההזרקה. לבסוף, שלא כמו וקטורים lentiviral, Nanoblades הם ללא transgene ולספק את Cas9 במסגרת זמן מוגבלת. לכן, הם לא יכולים לשמש לביצוע הקרנות פונקציונליות ברחבי הגנום הדורשות רצף תפוקה גבוהה של sgRNAs על בחירת תאים. Nanoblades שימושיים כאשר נדרשת עריכת גנום מהירה, תלוית מינון וטרנסג'ן20. יתר על כן, בדומה אלקטרופורציה חלבון, Nanoblades להוביל פחות השפעות מחוץ למטרה מאשר ביטוי ממושך של Cas9 / sgRNA באמצעות טרנספקטיה DNA או וקטורים ויראליים קלאסיים3. פיתוח עתידי של Nanoblades מתמקד בשילוב וריאנטים Cas9 עבור יישומים טכנולוגיים שונים כגון עריכת בסיס ומיקוד RNA.
Disclosures
פיליפ א. מנגוט ואמיליאנו פ. ריצ'י נקראים כממציאים על פטנט הנוגע לטכנולוגיית Nanoblades (מועמדים לפטנטים: המכון הלאומי דה לה סנטה et de la Recherche Médicale (INSERM), Centre National de la Recherche Scientifique (CNRS), Ecole Normale Superieure de Lyon, Université Claude Bernard Lyon 1, Villeurbanne Cedex; מספר יישום: WO 2017/068077 Al; מצב פטנט: פורסם, 27 באפריל 2017; כל ההיבטים של כתב היד מכוסים על ידי בקשת הפטנט. המחברים הנותרים מצהירים שאין אינטרסים מתחרים.
Acknowledgements
עבודה זו מומנה על ידי Labex Ecofect (ANR-11-LABX-0048) של אוניברסיטת ליון, במסגרת התוכנית Investissements d'Avenir (ANR-11-IDEX-0007) המופעלת על ידי סוכנות המחקר הלאומית הצרפתית (ANR), Fondation FINOVI, Agence Nationale des Recherches sur le SIDA et les Hépatites Virales (ANRS-ECTZ33306) ועל ידי מועצת המחקר האירופית (ERC-StG-LS6-805500 ל- E.P.R.) במסגרת תוכניות המחקר והחדשנות Horizon 2020 של האיחוד האירופי.
Materials
| Name | Company | Catalog Number | Comments |
| 13.2 mL, Thinwall Polypropylene Tubes, 14 x 89 mm - 50Pk | Beckman Coulter Life Sciences | 331372 | Ultracentrifugation tubes for Nanoblades purification |
| Amersham Protran Premium Western blotting membranes, nitrocellulose | Merck | GE10600004 | Nitrocellulose membrane for quantifying Cas9 levels within purified Nanoblades |
| BIC-Gag-CAS9 | Addgene | 119942 | Encodes a GAG (F-MLV)-CAS9(sp) fusion. Allows the production of GAG-CAS9 Virus like particles from producer cells in association with over expressed gRNA(s) and appropriate envelopes |
| BICstim-Gag-dCAS9-VPR | Addgene | 120922 | Encodes a GAG-dCAS9-VPR fusion for targeted transcriptional activation |
| BLADE | Addgene | 134912 | Empty backbone for cloning sgRNA sequence to be used in Nanoblades system |
| BsmBI-v2 | New England Biolabs | R0739S | Restriction enzyme to digest the BLADE and SUPERBLADES vectors for sgRNA cloning |
| Cas9 (7A9-3A3) Mouse mAb (HRP Conjugate) #97982 | Cell Signaling Technology | 97982S | Anti-Cas9 antibody for Cas9 quantification by dot-blot |
| Cas9 Nuclease, S. pyogenes | New England Biolabs | M0386T | Recombinant Cas9 protein to be used as a reference for absolute quantification of the amount of Cas9 loaded within Nanoblades |
| Ethidium bromide solution (10 mg/mL in H2O) | Sigma-Aldrich | E1510-10ML | For staining agarose gels and visualize DNA |
| Fisherbrand Wave Motion Shakers | Fisher Scientific | 88-861-028 | Agitation table to resuspend Nanoblades upon centrifugation |
| gelAnalyzer | http://www.gelanalyzer.com; quantifying band intensity after digestion | ||
| Gesicle Producer 293T | Takara | 632617 | Nanoblades producer cell line |
| Gibco DMEM, high glucose, pyruvate | ThermoFisher Scientific | 41966052 | Cell culture medium for Gesicle Producer 293T cells |
| GoTaq G2 DNA Polymerase | Promega | M7848 | Taq polymerase for amplification of genomic DNA before T7 endonuclease assays |
| jetPRIME Transfection Reagent kit for DNA and DNA/siRNA | Polyplus | POL114-15 | Transfection reagent for Nanoblade production in Gesicle Producer 293T cells |
| Millex-AA, 0.80 µm, syringe filter | Millipore | SLAA033SS | Syringe filter to remove cellular debris before concentration of Nanoblades |
| Millex-GS, 0.22 µm, syringe filter | Millipore | SLGS033SS | Syringe filter to sterilise the sucrose cushion solution |
| Millex-HP, 0.45 µm, polyethersulfone, syringe filter | Millipore | SLHP033RS | Syringe filter to remove cellular debris before Nanoblades concentration |
| Monarch DNA Gel Extraction Kit | New England Biolabs | T1020L | DNA gel extraction kit for purification of the pBLADES or pSUPERBLADES plasmid fragment upon digestion with BsmBI |
| NEB Stable Competent E. coli (High Efficiency) | New England Biolabs | C3040I | Competent bacteria for plasmid transformation and amplification |
| NucleoBond Xtra Midi kit for transfection-grade plasmid DNA | Macherey-Nagel | 740410.50 | Maxipreparation kit for purification of plasmid DNA from cultured bacteria |
| Nucleospin gDNA extraction kit | Macherey-Nagel | 740952.50 | Extraction of genomic DNA from transduced cells |
| NucleoSpin Plasmid, Mini kit for plasmid DNA | Macherey-Nagel | 740588.50 | Minipreparation kit for purification of plasmid DNA from cultured bacteria |
| NucleoSpin Tissue, Mini kit for DNA from cells and tissue | Macherey-Nagel | 740952.5 | Genomic DNA extraction kit |
| Optima XE-90 | Beckman Coulter Life Sciences | A94471 | Ultracentrifuge |
| pBaEVRless | Els Verhoeyen (Inserm U1111) | Personnal requests have to be sent to: els.verhoyen@ens-lyon.fr | Baboon Endogenous retrovirus Rless glycoprotein described in Girard-Gagnepain, A. et al. Baboon envelope pseudotyped LVs outperform VSV-G-LVs for gene transfer into early-cytokine-stimulated and resting HSCs. Blood 124, 1221–1231 (2014) |
| pBS-CMV-gagpol | Addgene | 35614 | Enocdes the Murine Leukemia Virus gag and pol genes |
| pCMV-VSV-G | Addgene | 8454 | Envelope protein for producing lentiviral and MuLV retroviral particles |
| Phosphate-Buffered Saline (PBS) | ThermoFisher Scientific | 14200091 | 10X PBS to dilute in millipore water |
| Polybrene Transfection Reagent | Millipore Sigma | TR-1003-G | Cationic polymer that enhances the efficiency of retroviral transduction in specific mammalian cells. It can also allow viral-dependent entry of an Oligodeoxynucleotide (ODN) for homology-directed repair |
| Sucrose,for molecular biology, ≥99.5% (GC) | Sigma-Aldrich | S0389-5KG | Sucrose to prepare a cushion for Nanoblade purification through ultracentrifugation |
| SUPERBLADE5 | Addgene | 134913 | Empty backbone for cloning sgRNA sequence to be used in nanoblades system (Optimized for increased genome editing efficiency via Chen B et al., 2013) |
| SuperSignal West Dura Extended Duration Substrate | ThermoFisher Scientific | 34076 | Enhanced chemiluminescence (ECL) HRP substrate for Cas9 dot blots |
| SW 41 Ti Swinging-Bucket Rotor | Beckman Coulter Life Sciences | 331362 | Rotor for ultracentrifugation |
| SYBR Safe DNA Gel Stain | ThermoFisher Scientific | S33102 | Alternative to ethidium bromide for staining agarose gels and visualize DNA |
| T4 DNA Ligase | New England Biolabs | M0202S | DNA ligase to ligate the BLADE or SUPERBLADES vectors with the duplexed DNA oligos corresponding to the variable region of the sgRNA |
| T7 Endonuclease I | New England Biolabs | M0302S | T7 Endonuclease I recognizes and cleaves non-perfectly matched DNA. Allows to monitor the extent of genome editing at a specific locus |
| Triton-containing lysis buffer | Promega | E291A | Lysis buffer to disrupt Nanoblades and allow Cas9 quantification |
| TWEEN 20 | Sigma-Aldrich | P9416 | For the preparation of TBST |
References
- Jinek, M., et al. A programmable dual-RNA-guided DNA endonuclease in adaptive bacterial immunity. Science. 337 (6096), 816-821 (2012).
- Zuris, J. A., et al. Cationic lipid-mediated delivery of proteins enables efficient protein-based genome-editing in vitro and in vivo. Nature Biotechnology. 33, 73-80 (2015).
- Mangeot, P. E., et al. Genome editing in primary cells and in vivo using viral-derived Nanoblades loaded with Cas9-sgRNA ribonucleoproteins. Nature Communications. 10 (1), 45 (2019).
- Cai, Y., Bak, R. O., Mikkelsen, J. G. Targeted genome editing by lentiviral protein transduction of zinc-finger and TAL-effector nucleases. eLife. 3, 01911 (2014).
- Choi, J. G., et al. Lentivirus pre-packed with Cas9 protein for safer gene editing. Gene Therapy. 23 (7), 627-633 (2016).
- Gee, P., et al. Extracellular nanovesicles for packaging of CRISPR-Cas9 protein and sgRNA to induce therapeutic exon skipping. Nature Communications. 11, 1334 (2020).
- Indikova, I., Indik, S. Highly efficient 'hit-and-run' genome editing with unconcentrated lentivectors carrying Vpr.Prot.Cas9 protein produced from RRE-containing transcripts. Nucleic Acids Research. 48 (14), 8178-8187 (2020).
- Lyu, P., Javidi-Parsijani, P., Atala, A., Lu, B. Delivering Cas9/sgRNA ribonucleoprotein (RNP) by lentiviral capsid-based bionanoparticles for efficient 'hit-and-run' genome editing. Nucleic Acids Research. 47 (17), 99 (2019).
- Gheysen, D., Jacobs, E., de Foresta, F., Thiriart, C. Assembly and release of HIV-1 precursor Pr55gag virus-like particles from recombinant baculovirus-infected insect cells. Cell. 59 (1), 103-112 (1989).
- Hanna, R. E., Doench, J. G. Design and analysis of CRISPR-Cas experiments. Nature Biotechnology. 38 (7), 813-823 (2020).
- Sambrook, J. . Molecular cloning a laboratory manual. Third edition. , (2001).
- Jiang, W., et al. An optimized method for high-titer lentivirus preparations without ultracentrifugation. Scientific Reports. 5, 13875 (2015).
- Rueden, C. T., et al. ImageJ2: ImageJ for the next generation of scientific image data. BMC Bioinformatics. 18 (1), 529 (2017).
- O'Doherty, U., Swiggard, W. J., Malim, M. H. Human immunodeficiency virus type 1 spinoculation enhances infection through virus binding. Journal of Virology. 74 (21), 10074-10080 (2000).
- Brinkman, E. K., Chen, T., Amendola, M., van Steensel, B. Easy quantitative assessment of genome editing by sequence trace decomposition. Nucleic Acids Research. 42 (22), 168 (2014).
- Bollen, Y., Post, J., Koo, B. -. K., Snippert, H. J. G. How to create state-of-the-art genetic model systems: strategies for optimal CRISPR-mediated genome editing. Nucleic Acids Research. 46 (13), 6435-6454 (2018).
- Brinkman, E. K., et al. Easy quantification of template-directed CRISPR/Cas9 editing. Nucleic Acids Research. 46 (10), 58 (2018).
- Dussaud, S., Pardanaud-Glavieux, C., Sauty-Colace, C., Ravassard, P. Lentiviral mediated production of transgenic mice: a simple and highly efficient method for direct study of founders. Journal of Visualized Experiments. (140), e57609 (2018).
- Montagna, C., et al. VSV-G-enveloped vesicles for traceless delivery of CRISPR-Cas9. Molecular Therapy. Nucleic Acids. 12, 453-462 (2018).
- Marnef, A., et al. A cohesin/HUSH- and LINC-dependent pathway controls ribosomal DNA double-strand break repair. Genes & Development. 33 (17-18), 1175-1190 (2019).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved