Method Article
Доставка рибонуклеопротеинового комплекса Cas9/sgRNA в увековеченные и первичные клетки через вирусоподобные частицы («нанолезвища»)
В этой статье
Резюме
Мы разработали простой и недорогой протокол для загрузки рибонуклеопротеиновых комплексов Cas9/однонаправленной РНК (sgRNA) в вирусоподобные частицы. Эти частицы, называемые «нанолезвиями», позволяют эффективно доставлять комплекс Cas9/sgRNA в увековеченные и первичные клетки, а также in vivo.
Аннотация
Кластерная регулярно интерширмированная система коротких палиндромных повторов (CRISPR)-Cas демократизировала редактирование генома в эукариотических клетках и привела к разработке многочисленных инновационных приложений. Однако доставка белка Cas9 и однонаправленной РНК (sgRNA) в клетки-мишени может быть технически сложной задачей. Классические вирусные векторы, такие как лентивирусы (LN) или аденоассоциированные вирусы (AAV), позволяют эффективно доставлять трансгены, кодирующие белок Cas9 и связанную с ним sgRNA во многие первичные клетки и in vivo. Тем не менее, эти векторы могут страдать от таких недостатков, как интеграция трансгена в геном клетки-мишени, ограниченная грузоподъемность и долгосрочная экспрессия белка Cas9 и направляющей РНК в клетках-мишенях.
Чтобы преодолеть некоторые из этих проблем, был разработан вектор доставки, основанный на вирусе лейкемии мышей (MLV), для упаковки белка Cas9 и связанной с ним направляющей РНК в отсутствие какого-либо кодирующего трансгена. Путем слияния белка Cas9 с С-концом структурного белка Gag из MLV образовались вирусоподобные частицы (VLP), загруженные белком Cas9 и sgRNA (названными «Nanoblades»). Нанобелки могут быть собраны из культуральной среды клеток-продуцентов, очищены, количественно определены и использованы для трансдукции клеток-мишеней и доставки активного комплекса Cas9/sgRNA. Нанолезвия доставляют свой груз рибонуклеопротеинов (RNP) временно и быстро в широкий спектр первичных и увековеченных клеток и могут быть запрограммированы для других применений, таких как переходная транскрипционная активация целевых генов с использованием модифицированных белков Cas9. Нанолопасти способны in vivo редактировать геном в печени введенных взрослых мышей и в ооцитах генерировать трансгенных животных. Наконец, они могут быть комплексованы с донорской ДНК для «без трансфекции» гомологии, направленной на восстановление. Подготовка наноблостей проста, относительно недорога и может быть легко проведена в любой лаборатории клеточной биологии.
Введение
По сравнению с другими программируемыми нуклеазами, система CRISPR-Cas значительно упростила и демократизировала процедуру последовательно-специфического нацеливания генома и расщепления в эукариотических клетках. Благодаря простой экспрессии sgRNA пользователи могут запрограммировать белок Cas9 (или оптимизированные варианты) практически для любого клеточного локуса1. В этом сценарии доставка белка Cas9 и sgRNA становится основным ограничением при выполнении сайт-направленного мутагенеза. В увековеченных клетках sgRNA и белок Cas могут быть легко экспрессированы из трансфектированных плазмид для достижения эффективного нацеливания генома в большинстве клеток. Однако конститутивная экспрессия комплекса Cas9/sgRNA может повышать нецелевую активность белка Cas9 и вносить нежелательные изменения в неспецифические локусы2. В первичных клетках трансфекция ДНК может быть технически труднодостижимой и привести к плохой экспрессии или небольшому проценту трансфектированных клеток. Альтернативы классической трансфекции ДНК включают использование вирусных векторов, которые доставляют трансген, кодирующий Cas9 и sgRNA, или электропорацию рекомбинантного белка Cas9, связанного с синтетической sgRNA. Однако эти подходы могут привести к трансгенной интеграции в геноме клеточного хозяина (как в случае с классическими ретровирусными и лентивирусными векторами экспрессии), ограничению клеточными факторами и привести к конститутивной экспрессии белка Cas9 и sgRNA.
Электропорация комплекса Cas9/sgRNA RNP может преодолеть большинство из этих проблем и привести к эффективной и преходящей доставке в первичные клетки и in vivo, а также обеспечить дозозависимый ответ. Тем не менее, он обычно полагается на дорогостоящее оборудование и реагенты, а также его трудно масштабировать, если приходится обрабатывать большое количество клеток. В качестве альтернативы вышеупомянутым методам эти авторы разработали «Nanoblades» - ретровирусный вектор доставки для белка Cas9 и sgRNA3, который концептуально похож на другие вирусные системы доставки капсидного белка4,5,6,7,8. Нанобелки используют естественную способность полипротеина Gag из ретровирусов производить, когда экспрессируются отдельно в культивируемых клетках, VLP, которые высвобождаются во внеклеточной среде9. Сплавляя белок Cas9 с С-концевым концом полипротеина вируса лейкемии мышей (MLV) Gag и коэкспрессируя сгРНК и гликопротеины вирусной оболочки, белок Cas9 может быть инкапсидирован в высвобождаемых VLP или Nanoblades. После очистки нанобелки могут быть инкубированы с клетками-мишенями или введены in vivo для опосредования быстрой, переходной и дозозависимой доставки комплекса Cas9/sgRNA RNP3.
Нанолезвия могут быть запрограммированы с помощью нескольких sgRNAs для одновременного редактирования в разных локусах или с вариантами Cas9 для выполнения других приложений, таких как целевая транскрипционная активация или вытеснение3. В отличие от электропорации белка, которая опирается на рекомбинантную экспрессию, недавно описанные варианты Cas из литературы могут быть легко клонированы в вектор экспрессии слияния Гэга, что делает его универсальной платформой. Нанолезвия могут быть дополнительно комбинированы или загружены одноцепочечными и двухцепочечными олигодезоксинуклеотидами (ssODNs) для выполнения гомологического восстановления3. Производство nanoblade относительно простое и дешевое. Кроме того, nanoblades можно хранить при 4 °C в течение многих дней или при -80 °C для длительного хранения. Как правило, nanoblades опосредуют эффективное, не содержащее трансгенов редактирование генома в большинстве увековеченных и первичных культивируемых клеток. Однако некоторые первичные клетки могут быть чувствительны к присутствию вирусных частиц, что приводит к увеличению смертности. Клетки врожденной иммунной системы также могут реагировать на присутствие нанолезв (из-за их вирусного происхождения) и активироваться. В этих случаях протокол трансдукции должен быть оптимизирован для ограничения времени воздействия нанолезв и минимизации неспецифических эффектов. Nanoblades представляют собой жизнеспособную и простую в реализации альтернативу другим доступным методам доставки CRISPR.
протокол
1. Проектирование и клонирование sgRNA
ПРИМЕЧАНИЕ: Руководство по проектированию sgRNAs может быть получено из нескольких источников, таких как https://blog.addgene.org/how-to-design-your-grna-for-crispr-genome-editing или от Hanna и Doench10.
- После того, как 20 нуклеотидных последовательностей сгРНК были разработаны, закажите следующие одноцепочечные олигонуклеотиды ДНК:
- Вперед: 5' caccgNNNNNNNNNNNNNNNNNNNNNNNNNN 3' (N соответствует целевому локусу без последовательности протоспейсер-смежных мотивов (PAM))
- Реверс: 5' aaacNNNNNNNNNNNNNNNNNNNNNNNNC 3' (N соответствуют обратному дополнению целевого локуса без последовательности PAM)
ПРИМЕЧАНИЕ: При заказе олигонуклеотидов не требуется никаких специальных модификаций (не требуется 5' фосфат).
- Гибридизируйте два олигонуклеотида ДНК в трубке полимеразной цепной реакции (ПЦР) объемом 0,2 мл, смешивая 5 мкл буфера отжига (500 мМ NaCl; 100 мМ Tris-HCl; 100 мМ MgCl2; 10 мМ DTT; рН 7,9 при 25 °C), 1 мкл каждого олигонуклеотида ДНК (100 мкМ исходного раствора в воде) и 42 мкл воды.
- На блоке ПЦР инкубируют образцы при 95 °C в течение 15 с, а затем снижают температуру до 20 °C с рампой 0,5 °C/s. Хранить при комнатной температуре или при температуре -20 °C.
ПРИМЕЧАНИЕ: Здесь протокол можно приостановить. - Переваривает 10 мкг экспрессии плазмиды экспрессии сгРНК BLADE или SUPERBLADE с 10 единицами фермента рестрикции BsmBI-v2 в течение 3 ч при 55 °C в общем реакционном объеме 50 мкл.
ПРИМЕЧАНИЕ: Переваренный вектор должен высвобождать вставку ДНК ~1,9 кб и второй фрагмент ДНК ~3,3 КБ. - Нагрузите реакцию рестрикции на 1% агарозный гель, окрашенный 5 мкг/мл бромида этидия (или более безопасное альтернативное пятно ДНК-геля).
ПРИМЕЧАНИЕ: Носите соответствующее защитное снаряжение при манипулировании бромидом этидия, который подозревается в возникновении генетических дефектов.- На ультрафиолетовой (УФ) таблице, установленной на длине волны 312 нм (чтобы избежать повреждения ДНК), отрежьте фрагмент ДНК размером 3,3 кб из геля и поместите его в микроцентрифужную трубку объемом 1,5 мл.
ПРИМЕЧАНИЕ: Носите соответствующее защитное снаряжение (перчатки и защитные очки от ультрафиолетового излучения) при манипулировании бромидом этидия и работе на УФ-столе. - Извлеките ДНК из нарезанного геля, содержащего фрагмент ДНК размером 3,3 кб, используя специальный набор для экстракции ДНК-геля (см. Таблицу материалов). Количественно оцените количество очищенной ДНК с помощью спектрофотометра.
ПРИМЕЧАНИЕ: Здесь протокол можно приостановить.
- На ультрафиолетовой (УФ) таблице, установленной на длине волны 312 нм (чтобы избежать повреждения ДНК), отрежьте фрагмент ДНК размером 3,3 кб из геля и поместите его в микроцентрифужную трубку объемом 1,5 мл.
- Лигируйте гибридизированные олигонуклеотиды прямой и обратной ДНК со стадии 1.2 на переваренный BsmB1, очищенный гелем ЛОПАСТИ или вектор SUPERBLADE с этапа 1.5.2. Для этого добавляют 2 мкл буфера ДНК-лигазы Т4, 50 нг гелеобразуемого вектора (со стадии 1.5.2), 1 мкл гибридизированных олигонуклеотидов ДНК (со стадии 1.2), воду, чтобы составить объем до 19 мкл, и 1 мкл Т4 ДНК-лигазы. Инкубируют реакцию при 25 °C в течение 10 мин.
- Превратите продукт лигирования в компетентную бактерию (см. Таблицу материалов), как описано в 11. Нанесите трансформированные бактерии на ампициллиновую агаровую пластину Лурия Бертани и высиживаете в течение ночи при 37 °C.
- Выберите несколько изолированных колоний на агаровой пластине для выполнения минипрепаратации ДНК11 (см. Таблицу материалов) и выполните секвенирование Сэнгера с использованием прямого праймера U6 (5' GACTATCATATGCTTACCGT 3'), чтобы проверить правильность лигирования переменной последовательности sgRNA.
ПРИМЕЧАНИЕ: Другие плазмиды экспрессии sgRNA могут быть использованы, если они не кодируют белок Cas9, который может помешать производству Nanoblade.
2. Плазмидный препарат
- Выполните максимальную подготовку (см. Таблицу материалов) всех необходимых плазмид и подготовьте 10 мкг аликвот при 1 мкг/мл для хранения при -20 °C. Избегайте повторных циклов замораживания/оттаивания плазмид; используйте аликвоты дважды, прежде чем отбрасывать их.
3. Подготовка наноблейда
- На 1-й день семена между 3,5 и 4 × 106 клеток HEK293T (см. Таблицу материалов) в 10 мл модифицированной среды Dulbecco Eagle (DMEM), содержащей высокую глюкозу, пируват натрия, L-глутамин, 10% фетальную бычью сыворотку (FBS) и пенициллин / стрептомицин в чашке для культивирования клеток 10 см. Осторожно переместите 10-сантиметровую пластину назад и вперед, затем справа налево (повторите эту последовательность 5x), чтобы равномерно распределить клетки по чашке для культивирования. Инкубировать клетки при 37 °C в клеточном инкубаторе с 5% CO2.
ПРИМЕЧАНИЕ: Все процедуры, связанные с обработкой культивируемых клеток и нанолезвий, должны выполняться под ламинарным проточным капюшоном клеточной культуры, чтобы избежать их загрязнения. - День 2: Плазмидная трансфекция
- Ячейки должны быть 70-80% сливающимися через 24 ч после нанесения покрытия (рисунок 1А). Замените среду 10 мл свежего ДМЭМ, содержащего высокий уровень глюкозы, пируват натрия, L-глутамин, 10% FBS (пенициллин и стрептомицин могут быть опущены, хотя это не обязательно) перед трансфекцией.
ПРИМЕЧАНИЕ: На этом этапе важно, чтобы клетки не сливались. В противном случае эффективность трансфекции, а также производство частиц могут быть снижены. - Для каждой 10-сантиметровой пластины подготовьте следующие количества плазмид в пробирке объемом 1,5 мл: 0,3 мкг pCMV-VSV-G, 0,7 мкг pBaEVRless, 2,7 мкг MLV Gag/Pol, 1,7 мкг BIC-Gag-Cas9, 4,4 мкг плазмиды BLADES или SUPERBLADES, кодирующие клонированную сгРНК (или 2,2 мкг каждая при использовании двух sgRNAs).
- Добавьте 500 мкл трансфекционного буфера (см. Таблицу материалов), вихрь в течение 10 с, а затем центрифугу в течение 1 с. Добавьте 20 мкл трансфекционного реагента (см. Таблицу материалов), вращайте трубку в течение 1 с, а затем центрифугу в течение 1 с.
- Инкубировать в течение 10 мин при комнатной температуре и добавлять весь раствор по каплям в ячейки в среде DMEM с помощью пипетка P1000. Осторожно переместите пластину 10 см назад и вперед, затем справа налево (повторите эту последовательность 5x), чтобы равномерно распределить трансфекционный реагент по клеткам. Инкубировать клетки при 37 °C в течение не менее 40 ч в клеточном инкубаторе с 5% CO2.
ПРИМЕЧАНИЕ: При желании среду можно менять через 4 ч после трансфекции.
- Ячейки должны быть 70-80% сливающимися через 24 ч после нанесения покрытия (рисунок 1А). Замените среду 10 мл свежего ДМЭМ, содержащего высокий уровень глюкозы, пируват натрия, L-глутамин, 10% FBS (пенициллин и стрептомицин могут быть опущены, хотя это не обязательно) перед трансфекцией.
- На 3-й день проверьте морфологию трансфектированных клеток под микроскопом.
ПРИМЕЧАНИЕ: Клетки-продуценты начнут сливаться. Это нормальное явление из-за экспрессии фузогенных вирусных оболочек (рисунок 1B, C). - День 4: Сбор нанобелей
ПРИМЕЧАНИЕ: По крайней мере, через 40 ч после трансфекции клетки слились бы вместе из-за экспрессии фузогенных вирусных оболочек, и иногда клетки полностью отделяются от пластинчатой опоры (рисунок 1D).- Соберите 9 мл супернатанта питательной среды с помощью пипетки объемом 10 мл.
ПРИМЕЧАНИЕ: Нанолезвища представляют собой VLP, способные доставлять белок Cas9 и связанную с ним сгРНК в первичные клетки и in vivo. Хотя они не считаются генетически модифицированными организмами, поскольку они лишены генетического материала, они могут вызывать генетические изменения. Поэтому ими следует манипулировать с осторожностью, чтобы избежать любого контакта с пользователями (особенно если они запрограммированы на нацеливание на гены-супрессоры опухолей). Пользователям рекомендуется следовать местным рекомендациям по безопасности при манипулировании ретровирусными векторами и работать в лаборатории уровня BSL-2 при подготовке VLP и проведении экспериментов по трансдукции. Нанобелки могут быть инактивированы 70% этанолом или 0,5% гипохлорита натрия. Также желательно обрабатывать все пластиковые отходы (наконечники пипеток, пластины для посева тканей, центрифугирующие трубки) 0,5% гипохлорита натрия в течение не менее 10 мин для инактивации нанолезв. - Центрифугируйте собранный супернатант при 500 × г в течение 5 мин, чтобы удалить клеточный мусор и восстановить супернатант, не нарушая клеточную гранулу.
ПРИМЕЧАНИЕ: Если Nanoblades предназначены для использования на первичных ячейках, фильтруйте супернатант с помощью фильтра 0,45 мкм или 0,8 мкм. Имейте в виду, что этот шаг резко снижает титр Nanoblade, так как значительная часть будет заблокирована в фильтрующей мембране. - Гранулируйте нанобелки в течение ночи (12-16 ч) в качающемся роторе ковша при 4 300 × г или при 209 490 × г в ультрацентрифуге в течение 75 мин при 4 °C (см. Таблицу материалов).
ПРИМЕЧАНИЕ: Если клетки-мишени могут расти в DMEM, их можно инкубировать непосредственно с супернатантом, полученным после стадии 3.4.2, без концентрации нанобелей.
- Соберите 9 мл супернатанта питательной среды с помощью пипетки объемом 10 мл.
- День 5: Повторное суспендирование и хранение наноблоков
- После центрифугирования медленно аспирируют среду и повторно суспендируют белую гранулу 100 мкл холодного 1x фосфат-буферного физиологического раствора (PBS). Накройте трубку парапленкой и инкубируйте в течение 1 ч при 4 °C с мягким перемешиванием перед повторным использованием гранулы путем пипетки вверх и вниз.
ПРИМЕЧАНИЕ: Белый вязкий материал может появиться при повторном суспенденции; это нормально и существенно не влияет на эффективность трансдукции. - Храните nanoblades при температуре 4 °C, если планируете использовать их в течение четырех недель. В противном случае заморозьте nanoblades в жидком азоте и храните их при -80 °C.
ПРИМЕЧАНИЕ: Носите защитные очки и криогенные перчатки при манипулировании жидким азотом. Мгновенное замораживание и хранение при -80 °C приводит к значительному снижению эффективности Nanoblade. Более того, размороженные наноблоки не должны быть заморожены снова. Здесь протокол можно приостановить.
- После центрифугирования медленно аспирируют среду и повторно суспендируют белую гранулу 100 мкл холодного 1x фосфат-буферного физиологического раствора (PBS). Накройте трубку парапленкой и инкубируйте в течение 1 ч при 4 °C с мягким перемешиванием перед повторным использованием гранулы путем пипетки вверх и вниз.
4. Концентрация нанобелей на сахарозной подушке
ПРИМЕЧАНИЕ: В качестве альтернативы ночному центрифугированию или ультрацентрифугированию (этап 3.4.3) nanoblades могут быть сконцентрированы на сахарозной подушке. Это дает более чистую долю nanoblades, хотя общее количество восстановленных будет ниже.
- Приготовьте 10% раствор сахарозы (от веса к объему) в 1x PBS и процедите его через шприцевой фильтр 0,2 мкм (см. Таблицу материалов).
- Начните процесс концентрации нанобломбов на сахарозной подушке.
- Поместите 9 мл VLP-содержащего образца (из стадии 3.4.3) в ультрацентрифужную трубку (см. Таблицу материалов). Используя шприц 3 мл и канюлю, медленно наслаивайте 2,5 мл 10% сахарозы под образец, стараясь не смешивать VLP-содержащий образец и раствор сахарозы.
- Альтернативно поместить 2,5 мл 10% сахарозы в ультрацентрифужную трубку (см. Таблицу материалов). Наклоните трубку и медленно добавьте 9 мл VLP-содержащего образца (из шага 3.4.3) с помощью низкоскоростного пипеттера. Во время этой операции постепенно поднимите трубку в вертикальное положение.
- Центрифугирование образцов при 209 490 × г в ультрацентрифуге в течение 90 мин при 4 °C.
ПРИМЕЧАНИЕ: Этот метод может быть адаптирован для низкоскоростного центрифугирования (4 300 × g) в течение ночи, как описано в 12. - После центрифугирования осторожно удалите супернатант и поместите трубку вверх ногами на папиросную бумагу, чтобы удалить оставшуюся жидкость. Через 1 мин добавьте 100 мкл 1x PBS и поместите трубку при 4 °C с крышкой парапленки в держатель трубки на столе для перемешивания в течение 1 ч (см. Таблицу материалов) перед повторным использованием гранулы путем пипетки вверх и вниз.
ПРИМЕЧАНИЕ: Здесь протокол можно приостановить.
5. Мониторинг загрузки Cas9 в Nanoblades с помощью dot-blot
- Подготовьте буфер разбавления, добавив 1 объем буфера лизиса, содержащего неионное поверхностно-активное вещество (см. Таблицу материалов) в 4 томах по 1x PBS. Разбавить 2 мкл концентрированных нанобелков в 50 мкл буфера разбавления, кратковременно вихрь и перенести 25 мкл этой смеси в новую трубку, содержащую 25 мкл буфера разбавления. Повторите эту операцию, чтобы иметь 4 трубки разбавления Nanoblade (2-кратные стадии разбавления).
- Для стандартных элементов контроля разбавляют 2 мкл рекомбинантной нуклеазы Cas9 (см. Таблицу материалов) в 50 мкл буфера разбавления, кратковременно вихрь и переходят к восьми последовательным разбавлениям (2-кратное разбавление для каждой стадии).
- Осторожно определите 2,5 мкл каждого разведения VLP и 2,5 мкл каждого стандарта на нитроцеллюлозной мембране с многоканальной пипеткой (больший объем может привести к перекрытию пятен).
ПРИМЕЧАНИЕ: Также может быть использована обработанная метанолом поливинилдифторидная мембрана. - Как только частицы всасываются на мембрану, блокируйте мембрану 1x Tris-буферным физиологическим раствором, содержащим неионное поверхностно-активное вещество (TBS-T), дополненное обезжиренным сухим молоком (5% мас./об.) в течение 45 мин при комнатной температуре.
ПРИМЕЧАНИЕ: Здесь протокол может быть приостановлен, а мембрана сохранена при 4 °C в 1x TBS-T. - Откажитесь от 1x TBST, дополненного обезжиренным сухим молоком, и инкубируйте мембрану в течение ночи при 4 °C с антителом к пероксидазе Cas9-хрена (1/1000 разведения в 1x TBST, 5% молока). Промывайте мембрану 3x с помощью TBS-T и визуализируйте сигнал с помощью улучшенного набора хемилюминесцентных подложек.
- Количественно оцените интенсивность точек для стандартных разведений Nanoblades и рекомбинантных Cas9 с помощью запатентованного программного обеспечения, поставляемого с гелевой станцией визуализации или imageJ13. Определите линейную кривую, связывающую интенсивность точек с концентрацией Cas9. Используя функцию полученной кривой, экстраполируют содержание Cas9 в каждом препарате.
ПРИМЕЧАНИЕ: Количество рекомбинантного контроля белка Cas9 может насытить показания для наиболее концентрированных образцов стандартного набора разбавления (рисунок 2). Поэтому при определении линейной кривой рекомендуется удалять показания неразбавленных образцов (а иногда и показаний первых стадий разбавления), если они не находятся в линейном диапазоне по отношению к известной концентрации Cas9, которая была обнаружена. Аналогичным образом, при экстраполяции количества Cas9 в образцах Nanoblade используйте только показания, которые находятся в линейном диапазоне стандартной кривой.
6. Трансдукция клеток-мишеней с помощью nanoblades (процедура трансдукции в 12-луночной пластине)
- В 12-луночной пластине посеяли 100 000-200 000 клеток (либо первичных, либо увековеченных адгезивных клеток) на лунку в 1 мл соответствующей клеточной культуральной среды. Позвольте клеткам прилипнуть к поверхности пластины перед трансдукцией.
- В микроцентрифужной трубке объемом 1,5 мл добавляют 5-20 мкл концентрированных нанобелков (со стадии 3,5,1 или 4,4) до 500 мкл клеточной культуральной среды и смешивают путем пипетки вверх и вниз с помощью пипетка P1000. Удалите среду из клеток и замените ее 500 мкл этой смеси Nanoblade.
ПРИМЕЧАНИЕ: Трансдукция должна быть оптимизирована для каждого типа ячеек. Важно использовать минимально возможный объем среды (избегая при этом высыхания клеток-мишеней), чтобы нанолопасти оставались высококонцентрированными. Адгезивные ячейки должны трансдуцироваться непосредственно при прикреплении к пластине (не преобразуйте в суспензии, так как это значительно снизит эффективность трансдукции). Некоторые клетки переносят длительное воздействие nanoblades (24-48 ч), в то время как другие очень чувствительны и могут образовывать небольшую синцитию. При этом нанобелки необходимо инкубировать с клетками только в течение 4-6 ч перед заменой среды. Спинокуляция14 также может улучшить трансдукцию клеток, выращенных во взвешенном состоянии. Адъюванты, такие как катионные полимеры (см. Таблицу материалов), также могут повышать эффективность трансдукции в некоторых типах клеток. - После 4-6 ч инкубации клеток в малом объеме среды, содержащей нанобелки, увеличивают объем среды до нормального количества (1 мл при работе с 12-луночной пластиной) или заменяют ее свежей средой, если клетки чувствительны к VLP.
ПРИМЕЧАНИЕ: Клеточная среда, содержащая nanoblades, должна быть инактивирована 0,5% гипохлорита натрия в течение 10 мин, прежде чем выбросить его. Используйте перчатки и защитные очки при манипулировании гипохлоритом натрия. Если нанолезвия вызывают гибель клеток, адаптируйте количество и общее время воздействия, чтобы снизить смертность клеток.
7. Измерение эффективности CRISPR в целевом локусе с помощью анализа эндонуклеазы Т7
- Спроектируйте праймеры ПЦР для усиления области 400-700 пар оснований (bp), охватывающей участок расщепления CRISPR.
ПРИМЕЧАНИЕ: Участок расщепления должен быть удален от края ампликона не менее чем на 200 bp и должен быть слегка смещен от центра ампликона таким образом, чтобы при расщеплении эндонуклеазы T7 высвобождались 2 фрагмента разных размеров. - Извлечение геномной ДНК из клеток, обработанных наноблонками, нацеленными на интересующий ген, и из контрольных клеток, обработанных нанолезвями, запрограммированными контрольной сгРНК (см. Таблицу материалов).
ПРИМЕЧАНИЕ: Здесь протокол можно приостановить. - Используя 150 нг геномной ДНК в качестве шаблона, запрограммируйте реакцию ПЦР объемом 30 мкл (конечный объем), следуя протоколу производителя. Убедитесь, что амплификация ПЦР дает один ампликон ожидаемого размера, используя 2% агарозный гель, окрашенный 5 мкг / мл бромида этидия (или более безопасное альтернативное окрашивание геля ДНК).
ПРИМЕЧАНИЕ: Носите соответствующее защитное снаряжение при манипулировании бромидом этидия, который подозревается в возникновении генетических дефектов. Здесь протокол можно приостановить. - Генерация и переваривание гетеродуплексов
- В пробирке ПЦР объемом 0,2 мл добавляют 5 мкл ферментного буфера (снабженного эндонуклеазой T7 I), 20 мкл воды и 24 мкл продукта ПЦР со стадии 7.3. Допускается образование гетеродуплекса путем нагревания образцов до 94 °C в течение 3 мин, а затем путем снижения температуры (2 °C в минуту) до 40 °C.
- Добавляют 0,5 мкл T7-эндонуклеазы I при комнатной температуре в каждую гетеродуплексную трубку, включая контрольную. Инкубировать при 37 °C в течение 15 мин. Нагрузите полученную реакцию 2,5% (массой/объемом) агарозным гелем, окрашенным бромидом этидия. После миграции визуализируйте гель на УФ-трансиллюминаторе.
ПРИМЕЧАНИЕ: Носите соответствующее защитное снаряжение при манипулировании бромидом этидия, который подозревается в возникновении генетических дефектов. Используйте УФ-защитные очки при использовании УФ-трансиллюминатора. - Измерьте эффективность расщепления путем анализа изображения, полученного в результате реакции пищеварения, чтобы количественно оценить интенсивность каждой полосы с помощью соответствующего программного обеспечения (см. Таблицу материалов).
8. Измерение эффективности CRISPR в целевом локусе с помощью секвенирования Сэнгера и анализа TIDE
ПРИМЕЧАНИЕ: В качестве альтернативы анализу эндонуклеазы T7 эффективность CRISPR может контролироваться путем анализа и деконволюции следов секвенирования Сэнгера на основе протокола TIDE15.
- Выполните секвенирование ПЦР-ампликонов Сэнгера с шага 7.3 (включите контрольное условие, соответствующее необработанным клеткам) с использованием либо прямого, либо обратного праймера ПЦР.
- Анализируйте следы секвенирования Сэнгера контрольного состояния (необработанные клетки) и образцы, обработанные Nanoblade, с помощью сервера TIDE (https://tide.nki.nl) и следуя их рекомендациям по анализу.
9. Формирование комплекса Наноблок с донорами ssODN для гомологического восстановления (процедура трансдукции в 12-луночной пластине)
ПРИМЕЧАНИЕ: Руководство по проектированию ssODN для эффективного редактирования, направленного на восстановление гомологии, было описано ранее16.
- В 12-луночной пластине посеять 100 000-200 000 клеток на лунку в 1 мл соответствующей клеточной культуральной среды. Позвольте клеткам прилипнуть к поверхности пластины перед трансдукцией.
- Готовят 100 мкл раствора катионного полимера (см. Таблицу материалов) по 8 мкг/мл в 1x PBS.
- Смешайте 19 мкл раствора катионного полимера со 100 пмолью шаблона ssODN. Добавьте 20 мкл концентрированных нанобелей (из стадии 3.5.1 или 4.4) и инкубируйте в течение 15 мин на льду.
- Удалите сложные нанобелки/ssODN изо льда и добавьте 500 мкл клеточной культуральной среды (при 37 °C). Удалите среду из клеток-мишеней (из шага 9.1) и добавьте 500 мкл среды, содержащей комплексированные нанобелки/ssODN. Дайте клеткам размножиться в течение 48 ч перед генотипированием.
- Извлеките геномную ДНК из части клеточной популяции с помощью специального набора для экстракции (см. Таблицу материалов).
- Спроектируйте праймеры ПЦР для усиления области 400-700 bp, охватывающей место выбивания.
ПРИМЕЧАНИЕ: Праймеры ПЦР не должны перекрываться с гомологическими рукавами ssODN, чтобы избежать ложноположительных результатов, полученных в результате амплификации ПЦР любого остаточного ssODN, все еще присутствующего в клетках-мишенях. - Используя 150 нг геномных ДНК из контрольных клеток (необработанных) или клеток, обработанных nanoblade, в качестве шаблона, запрограммируйте реакцию ПЦР 30 мкл в соответствии с протоколом производителя.
ПРИМЕЧАНИЕ: следы ssODN могут присутствовать в клеточной среде через несколько дней после трансдукции комплексом. Этот ssODN может служить частичным шаблоном для ПЦР-анализов, пытающихся проверить правильную интеграцию. Следовательно, желательно проходить клетки по крайней мере дважды после трансдукции, чтобы избежать возможных ложноположительных анализов. - Нагрузка 5 мкл реакций контрольной и обработанной Наноблонками ПЦР в 1% (вес/объем) агарозный гель, окрашенный бромидом этидия. После миграции визуализируйте гель на УФ-трансиллюминаторе.
ПРИМЕЧАНИЕ: Если рекомбинация гомологии успешна и соответствует введению более 1 бп генетического материала, должна быть разница в молекулярной массе ампликонов ПЦР между контрольным и обработанным Nanoblade образцом. Поскольку эффективность HDR не достигает 100%, в образце, обработанном Nanoblade, должны быть видны две полосы (одна из которых имеет размер, аналогичный контрольному ампликону ПЦР, соответствующему неотредактированному аллелю, и одна с более высокой молекулярной массой, соответствующая аллелю, см. рисунок 3B средней панели).
- Спроектируйте праймеры ПЦР для усиления области 400-700 bp, охватывающей место выбивания.
- Выполните секвенирование Сэнгера контрольных и обработанных Nanoblade ПЦР-ампликонов.
- Оцените эффективность вбивания с помощью протокола TIDER17.
10. Доставка наноблейдов in vivo
- Доставляют до 25 мкл концентрированных нанобелков со стадии 3.5.1 через ретроорбитальную инъекцию или до 100 мкл через инъекцию хвостовой вены, как описано в 18, при работе с мышами.
ПРИМЕЧАНИЕ: Все процедуры, связанные с экспериментами на животных (включая инъекции Nanoblade для целей редактирования генома), требуют утвержденного протокола от местного комитета по этике. - Для генерации трансгенных мышей используйте микроинъектор для доставки от 1 пл до 10 пл концентрированных нанобелков со стадии 4.4 в перивителиновое пространство мышиных ооцитов, как описано ранее18.
ПРИМЕЧАНИЕ: Для инъекций перивителлина важно очистить и сконцентрировать нанобелки на сахарозной подушке, чтобы избежать засорения микроинжектора.
Результаты
Протокол приготовления Nanoblade довольно прост и требует простого лабораторного оборудования, помимо доступа к вытяжке для культивирования тканей, инкубатору CO2 и центрифуге с качающимся ведром или ультрацентрифуге. Однако некоторые этапы требуют особого внимания, такие как источник и обработка клеток-продуцентов, а также условия трансдукции. Как показано на фиг.1А, важно засеять клетки так, чтобы они были однородно распределены в пластине и достигали ~70-80% конфюляции в день трансфекции (избегайте скоплений клеток). Через двадцать четыре часа после трансфекции (рисунок 1B, C) клетки-продуценты образуют синцитию, ведущую к клеткам большего размера с несколькими ядрами. Через сорок часов после трансфекции (рисунок 1D) большинство ячеек в пластине сформируют синцитию и начнут отделяться от пластины.
Это совершенно нормально и вызвано экспрессией гликопротеина оболочки, который индуцирует слияние между соседними клетками. При концентрации путем центрифугирования (или даже непосредственно из супернатанта клеток-продуцентов) количество Cas9, загруженного в Nanoblades, может быть количественно определено абсолютным образом путем точечного пятна на нитроцеллюлозной мембране с использованием рекомбинантного Cas9 в качестве эталона (рисунок 2). Этот шаг важен для определения правильного количества nanoblades для использования для трансдукции клеток-мишеней. При выполнении анализа точечного пятна важно учитывать только показания, которые попадают в линейный диапазон стандартной кривой. Однако, независимо от количества Cas9, присутствующего в Nanoblades, важно проверить эффективность редактирования генома непосредственно на клетках-мишенях с использованием анализа эндонуклеазы T7 (рисунок 3) или секвенирования Сэнгера.
Как показано на рисунке 3, эффективность Nanoblades может отличаться от партии к партии, хотя обычно она коррелирует с количеством Cas9. В примере, показанном на рисунке 3, партия из полосы 1 приводит к 20% общей эффективности редактирования, в то время как партия из полосы 3 приводит к эффективности 60%. В этом случае можно увеличить объем нанолезков, используемых из партии 1, для достижения эффективности редактирования, аналогичной эффективности из партии 3. На рисунке 4 показана максимальная эффективность редактирования, полученная с помощью Nanoblades в различных типах первичных ячеек. Важно отметить, что эффективность может варьироваться в зависимости от последовательности используемой сгРНК и целевой доступности.
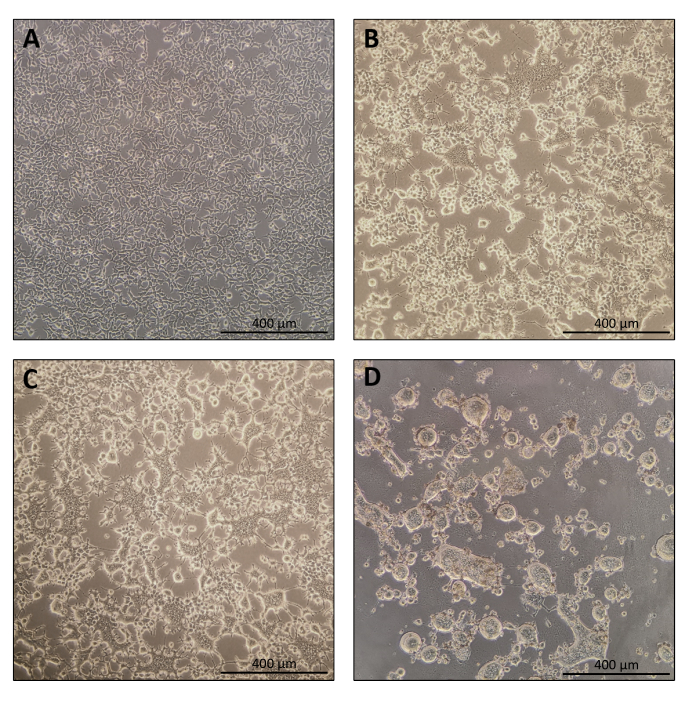
Рисунок 1: Морфология клеток-продуцентов при производстве nanoblade. (A) HEK293T-клетки при 70-80% слиянии через 24 ч после нанесения покрытия. (B и C) Морфология клеток HEK293T через 24 ч после трансфекции. (D) Морфология клеток HEK293T через 40 ч после трансфекции. Шкала = 400 мкм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
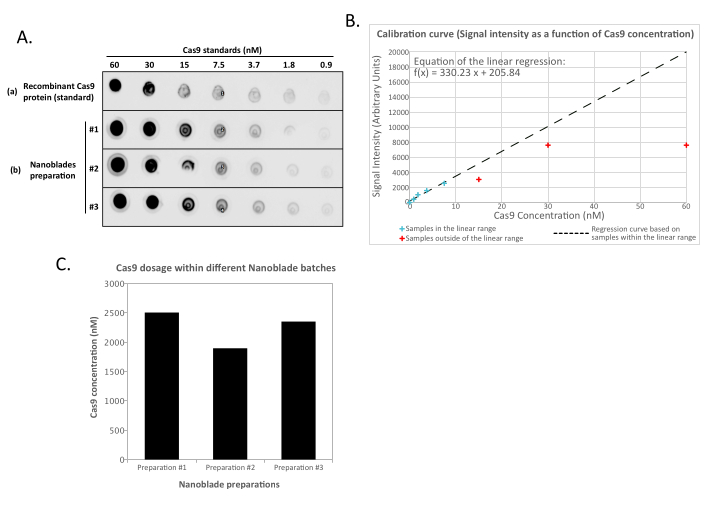
Рисунок 2: Количественная оценка нагрузки Cas9 в Nanoblades с помощью dot-blot. (A) Рекомбинантные Cas9 или 100x концентрированные (ультрацентрифугированием) образцы Nanoblade (#1, #2 и #3) разбавляют в 2 раза последовательно и обнаруживают на нитроцеллюлозной мембране перед инкубацией с анти-Cas9 HRP-связанными антителами. Сигнал выявляется усиленной хемилюминесценцией. (B) Сигнал хемилюминесценции получают и количественно определяют для рекомбинантных разбавлений Cas9 и интенсивности сигнала, построенных по отношению к известному количеству Cas9, обнаруженного на нитроцеллюлозной мембране. Кривая регрессии рассчитывается для разбавлений, находящихся в пределах линейного диапазона (см. синие крестики), исключая все концентрации, находящиеся за пределами линейного диапазона (см. красные крестики). (C) Концентрацию Cas9 (nM) в каждом препарате Nanoblade экстраполировали с использованием уравнения из линейной регрессии, полученной в (B). Для этого важно использовать только количественный сигнал от разбавлений Nanoblade, которые попадают в линейный диапазон кривой регрессии. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 3: Мониторинг эффективности редактирования при трансдукции. (A) Анализ эндонуклеазы Т7, измеряющий эффективность расщепления в клетках, обработанных нанолезвием. Клетки, трансдуцированные nanoblades, нацеленные на ген EMX1 , были проанализированы с помощью анализа эндонуклеазы Т7. Участок 1: Партия подготовки наноблоков No1 (эффективность расщепления 20%); Полоса 2: Контрольные ячейки; Участок 3: Партия подготовки наноблоков No2 (эффективность расщепления 60%). (B) Постукивание последовательности тегов Flag в открытой рамке чтения DDX3 . Концентрированные нанобелки, запрограммированные с помощью sgRNA, нацеленной на локус DDX3 , были получены из различных клонов HEK293T (#1, #2) и комплексированы с увеличением доз шаблона Flag-DDX3 ssODN и полученных комплексов, используемых для трансдукции клеток-мишеней HEK293T. После трансдукции клетки выращивали в течение трех дней, прежде чем собирать их для извлечения геномной ДНК и общих белков. Белки Flag-DDX3 были иммунопреципитированы с использованием бусин агарозы против флага с последующим анализом восстановленных белков с использованием антитела против флага (верхняя панель). Локальная вставка тега Flag в локус Ddx3 также анализировалась с помощью ПЦР с использованием либо грунтовок, фланкирующих сайт вставки (средняя панель), либо с использованием прямого грунтовки, который распознает последовательность тегов Flag, и обратного праймера, специфичного для локуса Ddx3 ниже по течению от сайта вставки флага (нижняя панель). Сокращения: EMX1 = Пустые дыхальца гомеобокс 1; DDX3 = геликаза РНК МЕРТВОЙ КОРОБКИ 3; ПЦР = полимеразная цепная реакция; ODN = олигодезоксинуклеотид; ssODN = пеструщий ODN; sgRNA = однонаправленная РНК; ИП = иммунопреципитация. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
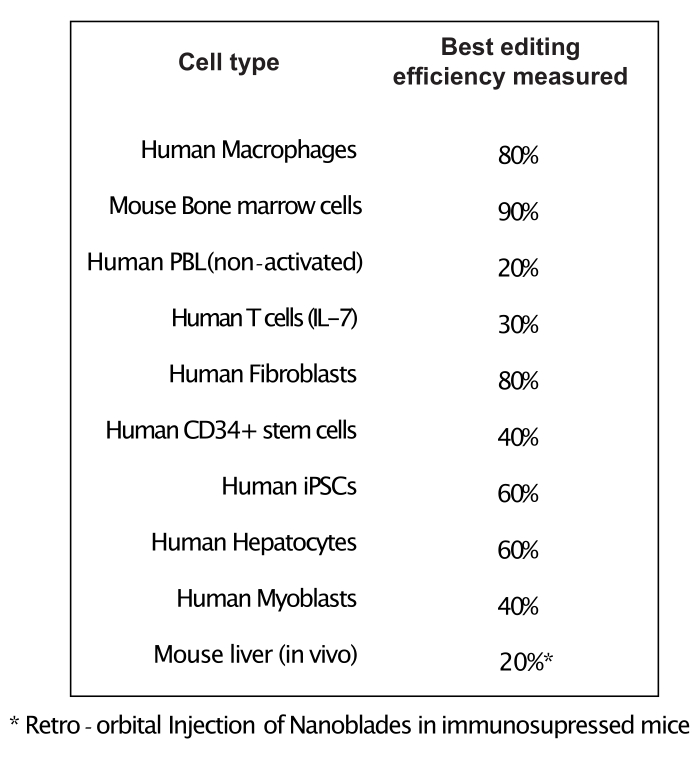
Рисунок 4: Эффективность редактирования, достигнутая в различных типах первичных клеток с использованием Nanoblades. Сокращения: PBL = лимфоцит периферической крови; IL = интерлейкин; CD = кластер дифференциации; iPSC = индуцированная плюрипотентная стволовая клетка. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Обсуждение
Нанолезвища обеспечивают быструю и дозозависимую доставку комплекса Cas9/sgRNA RNP в клеточные линии и первичные клетки. В отличие от классической трансфекции и других векторов вирусной доставки, но, как и электропорация белка, Nanoblades имеют преимущество переходной доставки Cas9 / sgRNA RNP без трансгенов. Nanoblades предлагают очень универсальную, простую и недорогую платформу для доставки белка, которая может быть легко и быстро адаптирована к постоянно расширяющемуся семейству вариантов CRISPR. Нанобелки могут быть получены в клеточной линии HEK293T или ее производных. Клеточные линии HEK293T, используемые здесь, были разработаны для максимизации производства ретровирусных и лентивирусных частиц (см. Таблицу материалов). Однако, хотя другие источники клеток HEK293T могут быть подходящими, пользователи должны тестировать и сравнивать клетки HEK293T из разных источников, поскольку наблюдались значительные различия в производстве частиц в зависимости от источника клеток HEK293T. Клетки также должны часто проверяться на загрязнение микоплазмой и проходить каждые три дня (классически 1/8 разбавления), чтобы избежать чрезмерного воздействия, которое оказывает негативное влияние на производство частиц.
Ячейки не должны поддерживаться более 20 проходов. DMEM, дополненный глюкозой, пенициллином / стрептомицином, глутамином и 10% декомплементированной фетальной бычьей сывороткой, использовался для клеточной культуры. Поскольку происхождение сыворотки может повлиять на качество препарата Nanoblade, различные партии сыворотки должны быть протестированы перед крупномасштабным производством. Нанобелки могут быть эффективно произведены в других средах, таких как RPMI или безсывороточные модификации минимально необходимой среды, которые могут заменить DMEM на следующий день после трансфекции. Как указано ниже, хотя замена среды после трансфекции некоторыми реагентами трансфекции ДНК является необязательной, может быть полезно модифицировать среду, в которую высвобождаются VLP, особенно для ограничения следов сыворотки в препарате частиц. Однако культивирование клеток в восстановленной сывороточной минимально необходимой среде за день до трансфекции еще не предпринималось.
Как уже упоминалось, нанолезвия образуются при сверхэкспрессии смеси плазмид в клетках-продуцентах. Сверхэкспрессия, по-видимому, необходима для оптимального производства. Действительно, эта лаборатория разработала клеточную линию-продуцента, где конструкция Gag-Pol-экспрессировки была стабилизирована путем отбора антибиотиков; однако эта система не смогла произвести значительное количество nanoblades. Аналогичное наблюдение было сделано, когда конструкция, кодирующая сгРНК, была стабильно интегрирована в геном клеток-продуцентов. Как описано для других систем производства частиц, стабильная клеточная линия, экспрессирующая, по меньшей мере, некоторые конструкции, участвующие в производстве нанолезв, может быть полезной; однако это, безусловно, потребует обработки больших объемов супернатанта и соответствующего метода очистки частиц. В приведенном выше протоколе описана предпочтительная процедура получения нанолезв, которая использует специфические трансфекционные реагенты (см. Таблицу материалов).
Хотя трансфекционные реагенты от других производителей также были успешно протестированы, подавляющее большинство результатов этой группы с Nanoblades следуют процедуре, описанной здесь. Недорогая трансфекция может быть достигнута с использованием реагентов фосфата кальция и дает хорошую эффективность производства; однако этот метод абсолютно требует замены трансфекционной среды на следующий день после трансфекции и может оставить остатки фосфата кальция в осажденном препарате частиц. В соответствии с необходимостью высоких уровней экспрессии компонентов Nanoblade в клетках-продуцентах наблюдается, что количество sgRNAs, связанных с белком Cas9, может быть ограничивающим фактором для эффективного редактирования генома. Чтобы улучшить нагрузку на sgRNA, недавно независимыми группами были разработаны два технических подхода, использующих векторы доставки белка, аналогичные Nanoblades. Они основаны на использовании Т7-полимеразно-зависимой цитоплазматической экспрессии sgRNA6 или путем добавления сигнала ретровирусной инкапсидации к последовательности sgRNA для опосредования связывания с полипротеином Gag6. Эти подходы действительно могут улучшить нагрузку сгРНК в Nanoblades, хотя они еще не были протестированы.
Трансдукция клеток-мишеней является критическим этапом процедуры. В большинстве увековеченных клеточных линий трансдукция с nanoblades имеет мало или вообще не имеет цитопатический эффект. Тем не менее, в первичных клетках токсичность может быть проблемой. Поэтому трансдукция должна быть оптимизирована для каждого типа клеток. В частности, время воздействия Nanoblades является важным фактором, который необходимо изменить при оптимизации протокола трансдукции. Для чувствительных клеток, таких как первичные нейроны или клетки костного мозга, 4-6 ч инкубации с nanoblades перед заменой среды позволяет эффективно доставлять белок Cas9 при минимизации клеточной токсичности. Кроме того, адъюванты, такие как катионные полимеры, среди прочих, могут значительно повысить эффективность трансдукции в некоторых клетках (см. Таблицу материалов). Важно отметить, что нанобелки являются VLP и могут вызывать иммуногенный ответ. Это может быть ограничением при работе с определенными типами первичных клеток, такими как макрофаги или дендритные клетки, в которых инкубация с nanoblades может вызвать важные изменения в экспрессии генов и фенотипе клеток. Если макрофаги и дендритные клетки получены из предшественников гемопоэтических стволовых клеток (таких как клетки костного мозга мыши), предпочтительно трансдуцировать клетки с помощью nanoblades до того, как они будут полностью дифференцированы, чтобы избежать индуцирования клеточного ответа против Nanoblades. В противном случае электропорация белка Cas9 может представлять собой жизнеспособную альтернативу при работе с дифференцированными иммунными клетками.
Нанобелки могут быть использованы in vivo для трансдукции зигот мыши или эмбрионов для генерации трансгенных животных. Подобно классическим ретровирусным или лентивирусным векторам, они также могут быть введены непосредственно в ткани взрослых животных. Однако нанобелки (похожие на ретровирусные и лентивирусные векторы) могут быть инактивированы иммунным ответом животного-хозяина; следовательно, доза, подлежащая введению, должна быть оптимизирована для каждого применения. Этот иммунный ответ также может ограничивать распределение функциональных VLP в тканях, близких к месту инъекции. Наконец, в отличие от лентивирусных векторов, nanoblades не содержат трансгенов и доставляют Cas9 в ограниченные сроки. Поэтому они не могут быть использованы для выполнения общегеномных функциональных скринингов, которые требуют высокопроизводительного секвенирования sgRNAs при отборе клеток. Нанобелки полезны, когда требуется быстрое, дозозависимое и не содержащее трансгенов редактирование генома20. Кроме того, подобно электропорации белка, nanoblades приводят к меньшему количеству нецелевых эффектов, чем длительная экспрессия Cas9 / sgRNA через трансфекцию ДНК или классические вирусные векторы3. Будущее развитие Nanoblades сосредоточено на включении вариантов Cas9 для различных технологических применений, таких как редактирование оснований и нацеливание на РНК.
Раскрытие информации
Филипп Э. Манжо и Эмилиано. Риччи названы изобретателями патента, относящегося к технологии Nanoblades (заявители на патенты: Национальный институт здравоохранения и медицинских исследований (INSERM), Национальный центр научных исследований (CNRS), Высшая нормальная школа Лиона, Университет Клода Бернара Лиона 1, Villeurbanne Cedex; номер заявки: WO 2017/068077 Al; патентный статус: опубликовано 27 апреля 2017 г.; все аспекты рукописи охватываются патентной заявкой. Остальные авторы заявляют об отсутствии конкурирующих интересов.
Благодарности
Эта работа финансировалась Labex Ecofect (ANR-11-LABX-0048) Лионского университета, в рамках программы Investissements d'Avenir (ANR-11-IDEX-0007), управляемой Французским национальным исследовательским агентством (ANR), Фондом FINOVI, Национальным агентством исследований в области СИДА и гепатитов вирусов (ANRS-ECTZ3306) и Европейским исследовательским советом (ERC-StG-LS6-805500 to E.P.R.) в рамках исследовательских и инновационных программ Европейского союза Horizon 2020.
Материалы
| Name | Company | Catalog Number | Comments |
| 13.2 mL, Thinwall Polypropylene Tubes, 14 x 89 mm - 50Pk | Beckman Coulter Life Sciences | 331372 | Ultracentrifugation tubes for Nanoblades purification |
| Amersham Protran Premium Western blotting membranes, nitrocellulose | Merck | GE10600004 | Nitrocellulose membrane for quantifying Cas9 levels within purified Nanoblades |
| BIC-Gag-CAS9 | Addgene | 119942 | Encodes a GAG (F-MLV)-CAS9(sp) fusion. Allows the production of GAG-CAS9 Virus like particles from producer cells in association with over expressed gRNA(s) and appropriate envelopes |
| BICstim-Gag-dCAS9-VPR | Addgene | 120922 | Encodes a GAG-dCAS9-VPR fusion for targeted transcriptional activation |
| BLADE | Addgene | 134912 | Empty backbone for cloning sgRNA sequence to be used in Nanoblades system |
| BsmBI-v2 | New England Biolabs | R0739S | Restriction enzyme to digest the BLADE and SUPERBLADES vectors for sgRNA cloning |
| Cas9 (7A9-3A3) Mouse mAb (HRP Conjugate) #97982 | Cell Signaling Technology | 97982S | Anti-Cas9 antibody for Cas9 quantification by dot-blot |
| Cas9 Nuclease, S. pyogenes | New England Biolabs | M0386T | Recombinant Cas9 protein to be used as a reference for absolute quantification of the amount of Cas9 loaded within Nanoblades |
| Ethidium bromide solution (10 mg/mL in H2O) | Sigma-Aldrich | E1510-10ML | For staining agarose gels and visualize DNA |
| Fisherbrand Wave Motion Shakers | Fisher Scientific | 88-861-028 | Agitation table to resuspend Nanoblades upon centrifugation |
| gelAnalyzer | http://www.gelanalyzer.com; quantifying band intensity after digestion | ||
| Gesicle Producer 293T | Takara | 632617 | Nanoblades producer cell line |
| Gibco DMEM, high glucose, pyruvate | ThermoFisher Scientific | 41966052 | Cell culture medium for Gesicle Producer 293T cells |
| GoTaq G2 DNA Polymerase | Promega | M7848 | Taq polymerase for amplification of genomic DNA before T7 endonuclease assays |
| jetPRIME Transfection Reagent kit for DNA and DNA/siRNA | Polyplus | POL114-15 | Transfection reagent for Nanoblade production in Gesicle Producer 293T cells |
| Millex-AA, 0.80 µm, syringe filter | Millipore | SLAA033SS | Syringe filter to remove cellular debris before concentration of Nanoblades |
| Millex-GS, 0.22 µm, syringe filter | Millipore | SLGS033SS | Syringe filter to sterilise the sucrose cushion solution |
| Millex-HP, 0.45 µm, polyethersulfone, syringe filter | Millipore | SLHP033RS | Syringe filter to remove cellular debris before Nanoblades concentration |
| Monarch DNA Gel Extraction Kit | New England Biolabs | T1020L | DNA gel extraction kit for purification of the pBLADES or pSUPERBLADES plasmid fragment upon digestion with BsmBI |
| NEB Stable Competent E. coli (High Efficiency) | New England Biolabs | C3040I | Competent bacteria for plasmid transformation and amplification |
| NucleoBond Xtra Midi kit for transfection-grade plasmid DNA | Macherey-Nagel | 740410.50 | Maxipreparation kit for purification of plasmid DNA from cultured bacteria |
| Nucleospin gDNA extraction kit | Macherey-Nagel | 740952.50 | Extraction of genomic DNA from transduced cells |
| NucleoSpin Plasmid, Mini kit for plasmid DNA | Macherey-Nagel | 740588.50 | Minipreparation kit for purification of plasmid DNA from cultured bacteria |
| NucleoSpin Tissue, Mini kit for DNA from cells and tissue | Macherey-Nagel | 740952.5 | Genomic DNA extraction kit |
| Optima XE-90 | Beckman Coulter Life Sciences | A94471 | Ultracentrifuge |
| pBaEVRless | Els Verhoeyen (Inserm U1111) | Personnal requests have to be sent to: els.verhoyen@ens-lyon.fr | Baboon Endogenous retrovirus Rless glycoprotein described in Girard-Gagnepain, A. et al. Baboon envelope pseudotyped LVs outperform VSV-G-LVs for gene transfer into early-cytokine-stimulated and resting HSCs. Blood 124, 1221–1231 (2014) |
| pBS-CMV-gagpol | Addgene | 35614 | Enocdes the Murine Leukemia Virus gag and pol genes |
| pCMV-VSV-G | Addgene | 8454 | Envelope protein for producing lentiviral and MuLV retroviral particles |
| Phosphate-Buffered Saline (PBS) | ThermoFisher Scientific | 14200091 | 10X PBS to dilute in millipore water |
| Polybrene Transfection Reagent | Millipore Sigma | TR-1003-G | Cationic polymer that enhances the efficiency of retroviral transduction in specific mammalian cells. It can also allow viral-dependent entry of an Oligodeoxynucleotide (ODN) for homology-directed repair |
| Sucrose,for molecular biology, ≥99.5% (GC) | Sigma-Aldrich | S0389-5KG | Sucrose to prepare a cushion for Nanoblade purification through ultracentrifugation |
| SUPERBLADE5 | Addgene | 134913 | Empty backbone for cloning sgRNA sequence to be used in nanoblades system (Optimized for increased genome editing efficiency via Chen B et al., 2013) |
| SuperSignal West Dura Extended Duration Substrate | ThermoFisher Scientific | 34076 | Enhanced chemiluminescence (ECL) HRP substrate for Cas9 dot blots |
| SW 41 Ti Swinging-Bucket Rotor | Beckman Coulter Life Sciences | 331362 | Rotor for ultracentrifugation |
| SYBR Safe DNA Gel Stain | ThermoFisher Scientific | S33102 | Alternative to ethidium bromide for staining agarose gels and visualize DNA |
| T4 DNA Ligase | New England Biolabs | M0202S | DNA ligase to ligate the BLADE or SUPERBLADES vectors with the duplexed DNA oligos corresponding to the variable region of the sgRNA |
| T7 Endonuclease I | New England Biolabs | M0302S | T7 Endonuclease I recognizes and cleaves non-perfectly matched DNA. Allows to monitor the extent of genome editing at a specific locus |
| Triton-containing lysis buffer | Promega | E291A | Lysis buffer to disrupt Nanoblades and allow Cas9 quantification |
| TWEEN 20 | Sigma-Aldrich | P9416 | For the preparation of TBST |
Ссылки
- Jinek, M., et al. A programmable dual-RNA-guided DNA endonuclease in adaptive bacterial immunity. Science. 337 (6096), 816-821 (2012).
- Zuris, J. A., et al. Cationic lipid-mediated delivery of proteins enables efficient protein-based genome-editing in vitro and in vivo. Nature Biotechnology. 33, 73-80 (2015).
- Mangeot, P. E., et al. Genome editing in primary cells and in vivo using viral-derived Nanoblades loaded with Cas9-sgRNA ribonucleoproteins. Nature Communications. 10 (1), 45 (2019).
- Cai, Y., Bak, R. O., Mikkelsen, J. G. Targeted genome editing by lentiviral protein transduction of zinc-finger and TAL-effector nucleases. eLife. 3, 01911 (2014).
- Choi, J. G., et al. Lentivirus pre-packed with Cas9 protein for safer gene editing. Gene Therapy. 23 (7), 627-633 (2016).
- Gee, P., et al. Extracellular nanovesicles for packaging of CRISPR-Cas9 protein and sgRNA to induce therapeutic exon skipping. Nature Communications. 11, 1334 (2020).
- Indikova, I., Indik, S. Highly efficient 'hit-and-run' genome editing with unconcentrated lentivectors carrying Vpr.Prot.Cas9 protein produced from RRE-containing transcripts. Nucleic Acids Research. 48 (14), 8178-8187 (2020).
- Lyu, P., Javidi-Parsijani, P., Atala, A., Lu, B. Delivering Cas9/sgRNA ribonucleoprotein (RNP) by lentiviral capsid-based bionanoparticles for efficient 'hit-and-run' genome editing. Nucleic Acids Research. 47 (17), 99 (2019).
- Gheysen, D., Jacobs, E., de Foresta, F., Thiriart, C. Assembly and release of HIV-1 precursor Pr55gag virus-like particles from recombinant baculovirus-infected insect cells. Cell. 59 (1), 103-112 (1989).
- Hanna, R. E., Doench, J. G. Design and analysis of CRISPR-Cas experiments. Nature Biotechnology. 38 (7), 813-823 (2020).
- Sambrook, J. . Molecular cloning a laboratory manual. Third edition. , (2001).
- Jiang, W., et al. An optimized method for high-titer lentivirus preparations without ultracentrifugation. Scientific Reports. 5, 13875 (2015).
- Rueden, C. T., et al. ImageJ2: ImageJ for the next generation of scientific image data. BMC Bioinformatics. 18 (1), 529 (2017).
- O'Doherty, U., Swiggard, W. J., Malim, M. H. Human immunodeficiency virus type 1 spinoculation enhances infection through virus binding. Journal of Virology. 74 (21), 10074-10080 (2000).
- Brinkman, E. K., Chen, T., Amendola, M., van Steensel, B. Easy quantitative assessment of genome editing by sequence trace decomposition. Nucleic Acids Research. 42 (22), 168 (2014).
- Bollen, Y., Post, J., Koo, B. -. K., Snippert, H. J. G. How to create state-of-the-art genetic model systems: strategies for optimal CRISPR-mediated genome editing. Nucleic Acids Research. 46 (13), 6435-6454 (2018).
- Brinkman, E. K., et al. Easy quantification of template-directed CRISPR/Cas9 editing. Nucleic Acids Research. 46 (10), 58 (2018).
- Dussaud, S., Pardanaud-Glavieux, C., Sauty-Colace, C., Ravassard, P. Lentiviral mediated production of transgenic mice: a simple and highly efficient method for direct study of founders. Journal of Visualized Experiments. (140), e57609 (2018).
- Montagna, C., et al. VSV-G-enveloped vesicles for traceless delivery of CRISPR-Cas9. Molecular Therapy. Nucleic Acids. 12, 453-462 (2018).
- Marnef, A., et al. A cohesin/HUSH- and LINC-dependent pathway controls ribosomal DNA double-strand break repair. Genes & Development. 33 (17-18), 1175-1190 (2019).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены