Method Article
جمع البيانات المجهرية للإضاءة المهيكلة بالتبريد من الخلايا المحفوظة بالتبريد
* These authors contributed equally
In This Article
Summary
يوضح هذا البروتوكول كيفية تصوير العينات البيولوجية المحفوظة بالتبريد باستخدام المجهر الإضاءة منظم التبريد. نحن نثبت المنهجية من خلال تصوير الهيكل الخلوي لخلايا U2OS.
Abstract
يسمح المجهر ثلاثي الأبعاد (ثلاثي الأبعاد) المجسم للإضاءة (SIM) بتصوير الهياكل الخلوية ذات العلامات الفلورية بدقة أعلى من المجهر الفلوري التقليدي. هذه التقنية فائقة الدقة (SR) تمكن من تصور العمليات الجزيئية في خلايا كاملة ولديها القدرة على استخدامها جنبا إلى جنب مع المجهر الإلكتروني والتصوير المقطعي بالأشعة السينية لربط المعلومات الهيكلية والوظيفية. تم مؤخرا تشغيل مجهر SIM للعينات المحفوظة بالتبريد (cryoSIM) في خط الحزمة المترابط للتصوير بالتبريد B24 في السنكروترون في المملكة المتحدة.
وقد صمم خصيصا للتصوير ثلاثي الأبعاد للعينات البيولوجية في درجات حرارة المبردة بطريقة تتوافق مع التصوير اللاحق لنفس العينات عن طريق طرق الفحص المجهري بالأشعة السينية مثل التصوير المقطعي بالأشعة السينية الناعمة. توفر هذه المقالة الفيديو أساليب مفصلة وبروتوكولات التصوير الناجح باستخدام cryoSIM. بالإضافة إلى التعليمات المتعلقة بتشغيل مجهر cryoSIM ، تم تضمين توصيات بشأن اختيار العينات والفلوروفوريس وإعدادات المعلمة. يتم عرض البروتوكول في عينات خلايا U2OS التي تم وضع علامة فلورية على الميتوكوندريا والتوبيولين.
Introduction
أصبحت تقنيات التصوير ريال على نطاق واسع في متناول علماء الأحياء على مدى العقد الماضي1. وهي تسمح بتصوير عالي الدقة للعينات الموسومة بالفلورسنت بما يتجاوز حد الحيود. ومع ذلك ، فقد كان من الصعب تكييف طرق الفحص المجهري SR للعمل مع العينات في درجات الحرارة المبردة2. وهذا سيكون مفيدا للتصوير المترابط بالاشتراك مع التصوير المقطعي للإلكترون أو الأشعة السينية. في الآونة الأخيرة ، تم تكييف SIM للاستخدام مع عينات التبريد ، وقد ثبت بنجاح لتمكين الدراسات المترابطة للخلايا البيولوجية بالتزامن مع التصوير المقطعي بالأشعة السينية الناعمة (SXT)3 في خط الحزمة المترابط للتصوير بالتبريد B24 في مصدر الضوء الماسي Synchrotron (https://www.diamond.ac.uk/Instruments/Biological-Cryo-Imaging/B24.html). يمكن لبطاقة SIM مضاعفة دقة المجهر التقليدي واسع المجال من خلال إضاءة العينة بأنماط مخططة للضوء (هامش Moiré) في ثلاث زوايا وعلى خمس مراحل. التداخل بين هذه الأنماط الخفيفة وفلورسينس عينة يمكن استخدامها لكشف حسابيا معلومات إضافية حول هياكل تحت الحيود4،5.
هناك العديد من مزايا SIM على تقنيات SR الأخرى للتطبيقات المبردة. أولا، يمكن أن تعمل دون الفلوروفورات وامض مصممة خصيصا. يمكن استخدام الفلوروفوريس التقليدية، مما يتيح الوصول إلى مجموعة واسعة من عوامل وضع العلامات الفلورية المحتملة6. بالإضافة إلى ذلك ، فإنه يتطلب فقط 15 صورة لكل شريحة z (في 3D ؛ 9 صور ل2D) ، في حين أن أساليب SR الأخرى تأخذ ما يقرب من 1000 صورة لكل شريحة ، مما يزيد من فرصة تسخين العينة وبالتالي يزيد من خطر تكوين بلورة الجليد ، والتي يمكن أن تسبب القطع الأثرية. وأخيرا، يمكن لهذه التقنية صورة عينات بيولوجية أكثر سمكا من أكثر من 10 ميكرومتر، مما يسمح للخلايا بأكملها أن تكون مصورة في حالتها شبه الأصلية6. وقد تم بناء cryoSIM باستخدام المكونات البصرية القياسية ومع برنامج مفتوح الوصول للتصوير، مما يجعل من السهل توثيق وتكرار إذا رغبتفي 6. و cryoSIM لديه 100x/0.9 هدف الفتحة العددية (انظر جدول المواد)؛ مزيد من المعلومات حول مكوناته البصرية، معلمات التصميم، والأداء وقد وصفت فيليبس وآخرون6 هنا، هذا البروتوكول يوضح كيفية استخدام المجهر cryoSIM بما في ذلك كيفية تحميل وتفريغ العينات على مرحلة التبريد، وكيفية جمع البيانات على المجهر، وكيفية إعادة بناء الصور SIM.
Protocol
ملاحظة: يتعلق هذا البروتوكول بالعينات التي تحتوي على خلايا نمت أو أودعت على شبكات الذهب المسطحة 3 مم (TEM) التابعة للإلكترون المنقول مع فيلم دعم كربوني مثقوب تم تزجيجه عن طريق التجميد أو التجميد عالي الضغط. يفترض هذا البروتوكول أن العينات قد تم تصويرها بالفعل باستخدام المجهر التقليدي وشعاع الحقل لرسم خرائط للمواقع ذات الأهمية للتصوير في cryoSIM. راجع الشكل 1 للحصول على نظرة عامة حول البروتوكول بأكمله.
1. إعداد مرحلة التبريد
- إعداد النيتروجين السائل الخالي من الجليد (LN2)عن طريق تمرير LN 2 من خلال قمع مبطن بأيمناديل ورقية جافة علمية قياسية.
ملاحظة: بما أن LN2 يسبب حروقا، ارتد معدات الحماية الشخصية المناسبة، بما في ذلك قفازات واقية من التبريد ونظارات واقية، عند التعامل معها. قد تحل هذه السوائل محل الأكسجين وتسبب الاختناق السريع وينبغي التعامل معها في منطقة التهوية بشكل صحيح. - إزالة الغبار السطحي من مرحلة التبريد مع الهواء المضغوط. طرد السائل من وعاء الهواء المضغوط قبل استخدامه.
- تأكد من وجود خرطوشة تحميل العينة مع حامل العينة ذات الحجرة المناسبة (تحقق من عدم وجود شبكة متبقية في حامل العينة من تجربة سابقة) (الشكل 2).
- إزالة الغطاء من dewar الخارجية للمرحلة التبريد، وصب LN تصفيتها2 حتى ما يقرب من 1/4th كامل. انتظر حتى تهدأ الغليان الأولية قبل صب أكثر; ملء السفينة إلى حوالي 2/3rd كامل. استبدال الغطاء بعناية، مشيرا فوهة بعيدا عن معالج والمرحلة / البصريات في حين LN2 يغلي من منفذ.
- مرة واحدة LN2 قد توقفت عن الخروج من منفذ، ووضع أنبوب منفذ على مرحلة dewar على مرحلة التبريد.
- المكونات في مصدر الطاقة للمرحلة، وتوصيل كابل USB إلى مرحلة التبريد. تأكد من توصيل غطاء غرفة العينة الساخن. سد العجز في dewar الخارجية للمرحلة.
ملاحظة: لا تقم بتوصيل dewar الخارجية حتى تم وضع أنبوب منفذ على مرحلة dewar على مرحلة التبريد. إذا تجاوز LN2 (أو لمنعه من الفيضان)، اسحب كبل USB لمدة 10 s تقريبا، واسمح له بالتوازن، وأعد توصيل كابل USB لإعادة تنشيط المستشعر. - بعد تسليم LN2 إلى مرحلة dewar ، اضغط على زر الإصدار على مرحلة التبريد للسماح ل LN2 بدخول غرفة العينة.
ملاحظة: لا تترك النظام دون مراقبة أثناء ملء LN2 للغرفة. - انتظر ~ 30-45 دقيقة للسماح للنظام لتبرد والاستقرار قبل البدء في الحصول على الصورة. تحقق دوريا من dewar الخارجية، وأعلى المتابعة مع LN2 تصفيتها إذا كان أقل من ربع كامل (كل ساعة تقريبا).
2. نقل مربع تخزين العينة إلى مرحلة التبريد
ملاحظة: غمر مربع تخزين العينة وحاملها ونصائح أي أدوات (مثل ملقط) داخل LN2 المصفاة لتبريدها قبل لمس أي أسطح باردة مثل العينة أو أي كائنات داخل غرفة العينة. ارتداء معطف المختبر والقفازات عند التعامل مع العينات البيولوجية.
- تأكد من وجود عينات مهززة في حاوية متوافقة مع التبريد، وأحضرها إلى المجهر. اضغط على الزر المقابل على مرحلة التبريد لتشغيل الضوء في غرفة العينة.
- استخدم مفتاح سداسي ال اكس على أداة كاسيت لفتح لوحتين من كاسيت نقل العينة. افتح اللوحات على نطاق واسع بما يكفي لإسقاطها في الشبكة بين الطبقين، ولكن تجنب الفتح إلى أقصى وضع مفتوح لمنع سقوط الشبكة من خلال الجانب الآخر.
- استخدام ملقط طويلة لرفع مربع الشبكة عينة من LN2، وتحويله حيث الشق محاذاة مع موقف موقف التخزين داخل المرحلة ، ووضعه على خشبة المسرح. استخدم الجهاز المناسب (مثل مفك البراغي) لفتح غطاء صندوق التخزين إلى موضع العينة الصحيح.
- باستخدام ملقط مقلوب (أو أي ملقط جراحي ذو طرف رفيع)، قم بإزالة شبكة TEM من حامل العينة، واغمرها داخل LN2،وأسقطها في موضعها في كاسيت نقل العينة، مع الحفاظ على مقربة من LN2 أثناء عملية النقل. ضمان وضع الجانب فيلم الكربون بحيث أنها سوف تواجه في نهاية المطاف الهدف على جسر العينة.
- أغلق خرطوشة العينة باستخدام مفتاح سداسي الهيكس الموجود على أداة الكاسيت. أغلق صندوق التخزين وأزله مع أي عينات متبقية.
- استخدم نقطة المغناطيس الموجودة على أداة الكاسيت لرفع الخرطوشة التي تحتوي على الشبكة وتركيبها على جسر العينة. أبقه مغمورا/قريبا من LN2 أثناء عملية النقل. تأكد من أن التوجه مناسب للجسر (سيقوم المغناطيسان بالاتصال بالمغناطيس على الجسر). ضع كاسيت مسطح داخل دبابيس تحديد المواقع للجسر، ودفع بلطف لضمان إصلاحه.
ملاحظة: يتوفر أيضا نموذج كاسيت لشبكات مقطوعة تم إعدادها لطحن شعاع الأيونات المركزة اللاحقة في مرفق CryoSIM في الحزمة B24.
3. مرحلة الالتحام والتركيز
- حرك فتحة غطاء مرحلة التبريد إلى موضع التصوير، ثم قم بإيقاف تشغيل ضوء غرفة العينة. الشريحة المرحلة نحو البصريات لمحاذاته تحت العدسة الهدف. إسقاط بلطف الهدف في الموقف باستخدام رافعة، وضمان أنه يقع داخل غطاء مرحلة التبريد، ولكن لا تلمسه.
ملاحظة: تأكد من أن أنبوب منفذ Dewar الخارجي لا يلمس مرحلة dewar على مرحلة التبريد في أي وقت أثناء جمع البيانات. - تغطية المرحلة والبصريات مع ستارة سوداء مبهمة. بدء تشغيل برنامج التحكم قمرة القيادة على جهاز الكمبيوتر cryoSIM (الشكل 3 والشكل 4).
- انقر على زر وضع القراءة لكل كاميرا، وتعيينه إلى CONV 3 ميغاهرتز. تأكد من أن درجة حرارة كل كاميرا هي -80 درجة مئوية، ومروحة الكاميرا مطفأة.
- قم بتشغيل الكاميرا المنعكسة. تحت أضواء، اختر المحيطة (التعرض 20 مللي ثانية) ، وتحت linkam، انقر على المكثف. انقر على زر وضع الفيديو.
- في إطار طريقة عرض الفسيفساء، قم بالتصغير (تمرير الماوس) لرؤية مخطط الشبكة. انقر على البحث عن مرحلة إذا كان لا يمكن أن ينظر إليها. توسيط الشبكة بالنقر المزدوج الأيسر في منتصف الدائرة.
- ركز العينة حتى يصبح فيلم دعم الشبكة (أو أي ميزة عينة أخرى ذات صلة) في بؤرة التركيز، باستخدام المفاتيح لأعلى ولون لتحريك مرحلة التبريد صعودا وهبوطا، واستخدام مفتاحي 9 و3 على اللوحة الرقمية لتغيير الخطوة z (تعيينها إلى 20 ميكرومتر للتركيز الأولي).
ملاحظة: إذا كان المستخدم نفاد السفر في z، يمكن نقل المرحلة يدويا لأعلى أو لأسفل باستخدام العجلة تحت مرحلة التبريد. قم بتشغيله بمقدار درجة واحدة في كل مرة، وتحقق مما إذا كانت العينة ضمن نطاق العرض. تغيير الاتجاه مرة أخرى إذا تفاقم التركيز.
4. برايتفيلد اقتناء الفسيفساء
- بمجرد أن يتم توسيط المرحلة ، قم بإيقاف تشغيل وضع الفيديو، وجمع فسيفساء ضوئية مرئية (انقر على تشغيل الفسيفساء في عرض الفسيفساء لإنتاج بلاط من صور الضوء المرئي التي تتصاعد إلى الخارج من المركز). إذا كانت الشبكة عازمة، حاول مواقف مختلفة على الشبكة (انقر نقرا مزدوجا اليسار داخل عرض الفسيفساء)،وإعادة التركيز، وانقر على تشغيل الفسيفساء مرة أخرى لجمع الفسيفساء الجزئية. بدلا من ذلك، قطرة في صورة مركزة على رأس الفسيفساء (الشكل 3).
- حفظ طريقة العرض عن طريق النقر على حفظ الفسيفساء. أعطه اسم ملف قصير يحتوي على معلومات حول مربع التخزين ورقم الشبكة المعني (سيتم إلحاق الطابع الزمني تلقائيا باسم الملف).
5. تحديد مجالات الاهتمام
- تفقد فسيفساء برايتفيلد جنبا إلى جنب مع أي صور "خريطة" مضانة سابقة عن مكان وجود الخلايا أو السمات البيولوجية المثيرة للاهتمام من قبل. تحقق مما إذا كانت هذه المناطق تنتج مضان مناسب.
- قم بإيقاف تشغيل الضوء المحيط والمكثف بالإضافة إلى وضع الفيديو إذا كان نشطا. قم بتشغيل ليزر الإثارة المطلوب (405 أو 488 أو 561 أو 647) واختر الكاميرا والتصفية المقابلة، في البداية عند 50 ميجاوات ، لمدة 50 مللي ثانية.
ملاحظة: قم بزيادة/تقليل إعدادات الكاميرا والتصفية هذه اعتمادا على إشارة الفلورسينس. - اضغط على 0 لالتقاط صورة و * إلى التباين التلقائي. بدلا من ذلك، قم بضبط التباين يدويا باستخدام شريط التمرير في أسفل الصورة.
ملاحظة: قم بتشغيل الليزر على علامة للغرفة. - مرة واحدة تم العثور على خلايا مثيرة للاهتمام بيولوجيا مع مضان مناسبة، ووضع علامة على مواقعها باستخدام زر موقع علامة في عرض الفسيفساء.
ملاحظة: هذه المواقع المميزة ستظهر في القائمة المرفقة ويمكن الوصول إليها بالنقر المزدوج فوق الإحداثيات. عند العودة إلى موقع مميز، قم بتكبير المنطقة قبل النقر المزدوج. - استمر في وضع علامة على جميع المواقع المحتملة قبل البدء في الحصول على الصور. إعادة حفظ الفسيفساء مع المواقع المميزة؛ انقر على حفظ المواقع لملف.
- لخياطة الصور الفسيفساء معا باستخدام برنامج StitchM (وضعت في المنزل في بي 24 الحزمة)، سحب وإسقاط ملف الفسيفساء .txt في ملف StitchM مع تمديد .bat وحفظ صورة tiff مجتمعة من البلاط الفسيفساء في نفس المجلد. لحفظ صورة مع المواقع التي تم وضع علامة عليها، اسحب ملف الفسيفساء .txt والعلامات وأسقطها.txt الملف في الرمز في نفس الوقت.
ملاحظة: توازن جمع البيانات مع احتياجات المشروع (على سبيل المثال، إذا كان سيتم إجراء التصوير المترابط، تحقق من عدد الصور التي يمكن التقاطها باستخدام طريقة تصوير الشريك، واختر العدد المناسب من المواقع للتصوير بالتبريد). بالإضافة إلى ذلك، إذا كان dewar الخارجية يتطلب إعادة تعبئة مع LN2، فإن نظام مرحلة التبريد تغيير الموقف، والمواقع ملحوظ من المرجح أن لا يعود إلى نفس المواقع؛ لذلك ضع هذا في اعتبارك عند اختيار عدد المواقع التي سيتم تصويرها.
- لخياطة الصور الفسيفساء معا باستخدام برنامج StitchM (وضعت في المنزل في بي 24 الحزمة)، سحب وإسقاط ملف الفسيفساء .txt في ملف StitchM مع تمديد .bat وحفظ صورة tiff مجتمعة من البلاط الفسيفساء في نفس المجلد. لحفظ صورة مع المواقع التي تم وضع علامة عليها، اسحب ملف الفسيفساء .txt والعلامات وأسقطها.txt الملف في الرمز في نفس الوقت.
- قم بإيقاف تشغيل الضوء المحيط والمكثف بالإضافة إلى وضع الفيديو إذا كان نشطا. قم بتشغيل ليزر الإثارة المطلوب (405 أو 488 أو 561 أو 647) واختر الكاميرا والتصفية المقابلة، في البداية عند 50 ميجاوات ، لمدة 50 مللي ثانية.
6. استراتيجية جمع البيانات
- تعيين وقت التعرض بالليزر استنادا إلى التهم في النطاق الديناميكي في صورة مضان (في الجزء السفلي من نافذة وجهات النظر الكاميرا). اختر أي مرشح لتطبيقه، وتحسين هذه الإعدادات لكل طول موجي من ضوء الإثارة لاستخدامها، وتحول كل ليزر على حدة.
ملاحظة: على الرغم من أن عدد 10,000-20,000 الأمثل، عدد أقل مقبولة إذا كان هناك تباين جيد. من الناحية المثالية، تحقق من إعدادات التصفية قبل الحصول على كل مكدس صور لأن الخلايا في مناطق مختلفة من الشبكة يمكن أن يكون لها مستويات مضان متغيرة.
7. جمع البيانات
- انقر على كل من الكاميرات لتشغيلها. العودة إلى أحد المواقع ملحوظ، والتركيز على العمق المطلوب مرة أخرى. مرة واحدة في التركيز في مجال الاهتمام، انتقل من التركيز صعودا (↑ مفتاح) في إطار XY في مرحلة الماكرو لاختيار ارتفاع المكدس ض للحصول على، وانقر على حفظ أعلى. الخروج من التركيز إلى أسفل(↓ مفتاح)، انقر على حفظ أسفل ومن ثم على الذهاب إلى المركز،والتحقق من أن الصورة لا تزال في التركيز.
ملاحظة: سيتم عرض ارتفاع العينة في الإطار. - انقر بزر الماوس الأيمن على slm (معامل الضوء المكاني) في نافذة Cockpit، وتأكد من تعيين الزاوية عند 0.41. في إطار Cockpit، حدد تجربة الموقع الواحد.
ملاحظة: لا تنقر فوق slm على; سيتم تشغيل Cockpit تلقائيا أثناء الحصول على الصورة.- من القائمة المنسدلة، حدد إضاءة منظمة. تغيير ارتفاع المكدس بحيث يساوي ارتفاع z + 1 ميكرومتر.
ملاحظة: إضافة 1 ميكرومتر يضمن التقاط العينة بأكملها في z ويقلل من القطع الأثرية إعادة الإعمار. - أدخل أوقات التعرض (مللي ثانية) لليزر 405 نانومتر و 488 نانومتر في الصف العلوي (للكاميرا المنعكسة) وأوقات التعرض لليزر 561 نانومتر و 647 نانومتر في الصف السفلي (للكاميرا المرسلة).
ملاحظة: يجب أن تتطابق قيم وقت التعريض الضوئي مع القيم التي تم تحديدها مسبقا والمبينة في إطار Cockpit الرئيسي. - إدخال اسم ملف (اصطلاح التسمية: المربع number_grid area_filters_FL) (FL (مضان) أو BF (برايتفيلد) اعتمادا على نوع التصوير الذي يتم القيام به). انقر على تحديث لإنتاج ملف جديد يحتوي على التاريخ والوقت دون الكتابة فوق الملفات السابقة. ثم انقر على ابدأ.
- من القائمة المنسدلة، حدد إضاءة منظمة. تغيير ارتفاع المكدس بحيث يساوي ارتفاع z + 1 ميكرومتر.
- تحقق من طريقة عرض الكاميرا أثناء تجميع البيانات. إعادة التقاط الصور إذا كان هناك أي تشريد xy. إذا كان ديوار LN2 يعيد تعبئة مرحلة التبريد أثناء الحصول على الصورة، قم بإجهاض العملية بالنقر على زر إحباط في برنامج Cockpit.
- بمجرد انتهاء dewar الخارجية إعادة ملء مرحلة ديوار، كرر التجربة لأن إعادة التعبئة تحل محل العينة عموديا. أعد تركيز الصورة لإعادة توسيطها في z، وكرر تجربة الموقع الواحد. كرر تجربة الموقع الواحد لجميع تركيبات الليزر والمرشحات اللازمة.
ملاحظة: يستغرق حوالي 30 s-1 دقيقة لإنهاء إعادة التعبئة. أثناء تصوير شبكة واحدة ، سوف يحدث إعادة التعبئة ~ 4-8x.
- بمجرد انتهاء dewar الخارجية إعادة ملء مرحلة ديوار، كرر التجربة لأن إعادة التعبئة تحل محل العينة عموديا. أعد تركيز الصورة لإعادة توسيطها في z، وكرر تجربة الموقع الواحد. كرر تجربة الموقع الواحد لجميع تركيبات الليزر والمرشحات اللازمة.
- في كل موقف، وجمع كومة ض باستخدام الضوء المرئي.
- قم بإيقاف تشغيل الليزر، ثم قم بتشغيل الضوء المحيط والمكثف. ضمن تجربة موقع واحد، حدد Z-stack، تعيين الضوء المحيط إلى التعرض 20 مللي ثانية ، والحفاظ على ارتفاع z كما هو أعلاه.
- كرر الخطوات من 7.2 إلى 7.4 لجميع المواقع التي تم وضع علامة عليها على الشبكة.
- قبل الانتقال إلى عينة أخرى، حذف الفسيفساء بالنقر على حذف البلاط.
- رسم مربع حول جميع البلاط لحذفها. حذف علامات كذلك عن طريق تحديد كل منهم في القائمة ومن ثم النقر على حذف المواقع المحددة.
- قم بإيقاف تشغيل الضوء المحيط والمكثف قبل الشروع في تغيير الشبكة. اتبع الخطوات الواردة في القسم 4 في الاتجاه المعاكس لإلغاء إرساء المرحلة من تحت الهدف وتغيير الشبكة.
8. بعد التصوير
- بعد الانتهاء من التصوير، قم بإلغاء إرساء المرحلة، وإزالة جميع العينات. إيقاف ضوء غرفة العينة. افصل ديوار الخارجي، وتخلص من أي LN2 متبقي في حاوية أخرى متوافقة مع التبريد، مما يسمح للدوار بالعودة بأمان إلى درجة حرارة طبيعية.
- وضع غطاء المكونات على مرحلة التبريد. انتظر حتى يصبح خيار الخبز التدريجي لعرض مرحلة التبريد متاحا بعد عدم بقاء LN2 في مرحلة dewar. اضغط على زر الخبز التدريجي للدخول في وضع التدفئة، وإزالة أي رطوبة من مرحلة التبريد لتجنب تكوين الجليد.
9. إعادة الإعمار
- نقل ملفات بيانات SIM الأولية إلى محطة العمل المناسبة لإعادة البناء. تشغيل المعالجة على دفعات من خلال نافذة منشئ مهمة المعالجة باستخدام وظائف النقل البصري الخاصة بالقناة (OTFS) (محسوبة من وظائف انتشار نقطة الخرز متعدد الفلورسنت) وزوايا K0 (0.29278 و-1.8028 و 2.3786) مع فلتر Wiener ثابت لجميع قنوات 0.004 وإزاحة تحيز من 200.
- في لوحة خيارات إضافية، تأكد من التخلص من الكثافات السالبة عن طريق الاحتفاظ بخيارات أخرى دون رادع. حفظ الصور SIR في مجلد اسمه"معالجتها".
ملاحظة: عادة ما ينتج برنامج إعادة إنشاء SIM التجاري بيانات SIM المعاد بناؤها ويحتفظ باسم الملف، ولكنه يلحق SIR.dv في النهاية. يتم إنشاء ملف سجل أيضا يحتوي على بروتوكول المعالجة والخطوات والمعلومات الإحصائية حول نجاح إعادة الإعمار.
10. تصحيح التحول اللوني
- تحميل البرنامج Chromagnon7 لتصحيح التحول اللوني.
- استخدم مصفوفة مرجع التحول اللوني التي تتوافق مع الأطوال الموجية الفلورية للبيانات التي تم جمعها (التي يوفرها خط الحزم).
ملاحظة: الملف المرجعي هو ملف "chromagnon.csv" الذي يحتوي على معلمات المحاذاة وتم الحصول عليه من صور المعايرة باستخدام جسيمات نانوية متعددة الفلورسنت. يمكن استخدامه لمعالجة مجموعات بيانات متعددة دفعة واحدة.- اختر الملف المرجعي المناسب الذي يطابق الطول الموجي الليزري والفلتر المستخدم لتصوير العينة، ثم أضفه إلى الحقل المرجعي. إضافة بيانات السير المعاد بناؤها لتكون محاذاة في حقل المصدر، وانقر على تشغيل.
- تأكد من أن إشارة الفلورسينس متوائمة الآن في الصور. لمعالجة الدفعات، ضع كافة صور SIR ليتم محاذاتها في الحقل المصدر والملف المرجعي في الحقل المرجعي، واضغط على تشغيل الكل.
النتائج
كانت عينة تحتوي على خلايا U2OS ملطخة بمزيج من صبغ الهيكل الخلوي الأخضر microtubule وصبغ الميتوكوندريا الحمراء ، مما أدى إلى تلطيخ مكون microtubule من الهيكل الخلوي (الأخضر) والميتوكوندريا (الأحمر). أظهر التصوير اللاحق توطين الميتوكوندريا داخل الخلية وكذلك ترتيب الخلايا الدقيقة ، مما يسلط الضوء على الإطار الهيكلي الذي توفره للخلية وتجميع الهيكل الخلوي حول العضيات مثل النواة. القرار في cryoSIM أعلى بكثير من ذلك في المجهر epifluorescence القياسية (الشكل 5). يوضح الشكل 6 كيف يمكن استخدام "الخريطة" الفلورية من المجهر الفلوروري التقليدي لتحديد المناطق ذات الأهمية للتصوير والصورة المقابلة التي أعيد بناؤها بالتبريد من موقع على الشبكة.
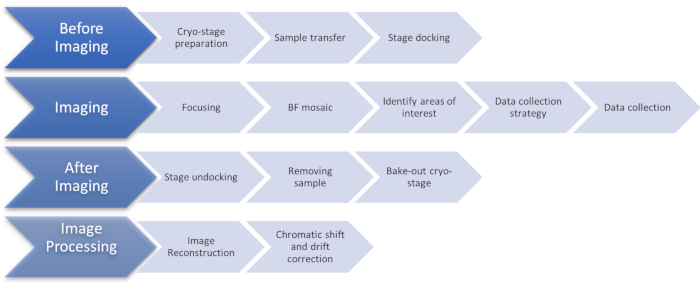
الشكل 1:مخطط تدفق يوضح مراحل بروتوكول التصوير cryoSIM. اختصار: cryoSIM = المجهر الإضاءة منظم كريو. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 2: مرحلة التبريد. (أ) الإعداد مرحلة التبريد. (ب) شبكة عينة تظهر التي تحتفظ بها ملقط مقلوب. (ج) مكونات مرحلة التبريد. وصفت منافذ الاتصال، مع الألوان المقابلة للبرتقالي: إمدادات الطاقة، الأصفر: غطاء المرحلة ساخنة، الأزرق: ديوار الخارجية، الأخضر: اتصال إلى جهاز الكمبيوتر. الاختصارات: PC = الكمبيوتر الشخصي; LN2 = النيتروجين السائل. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
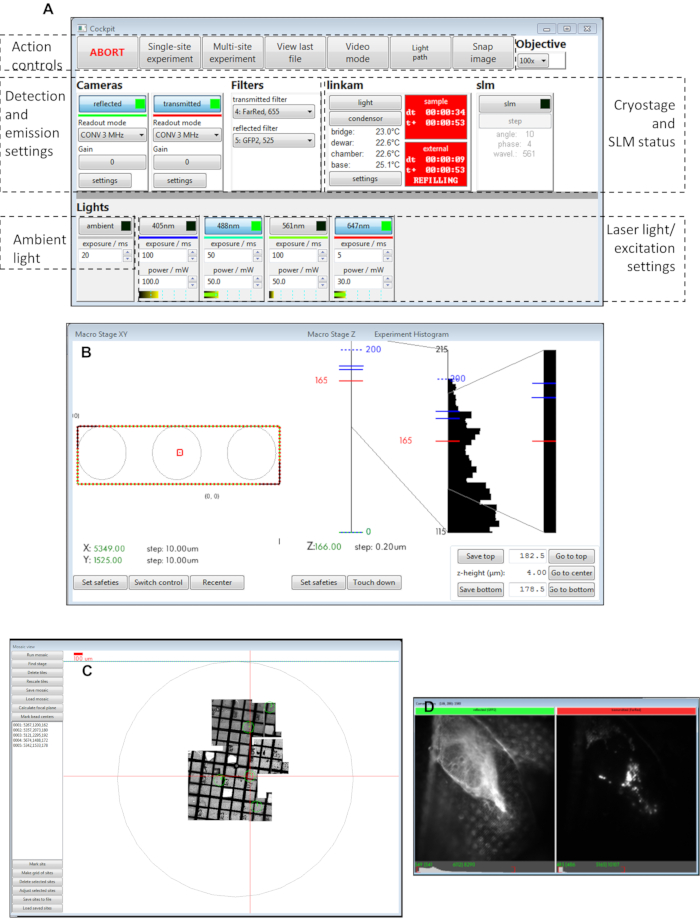
الشكل 3: وجهات النظر من لوحات برنامج قمرة القيادة. (أ) لوحة رئيسية, (ب) الماكرو المرحلة XY, (C) عرض الفسيفساء, (D) مشاهدات الكاميرا. اختصار: SLM = المغير الضوء المكاني. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
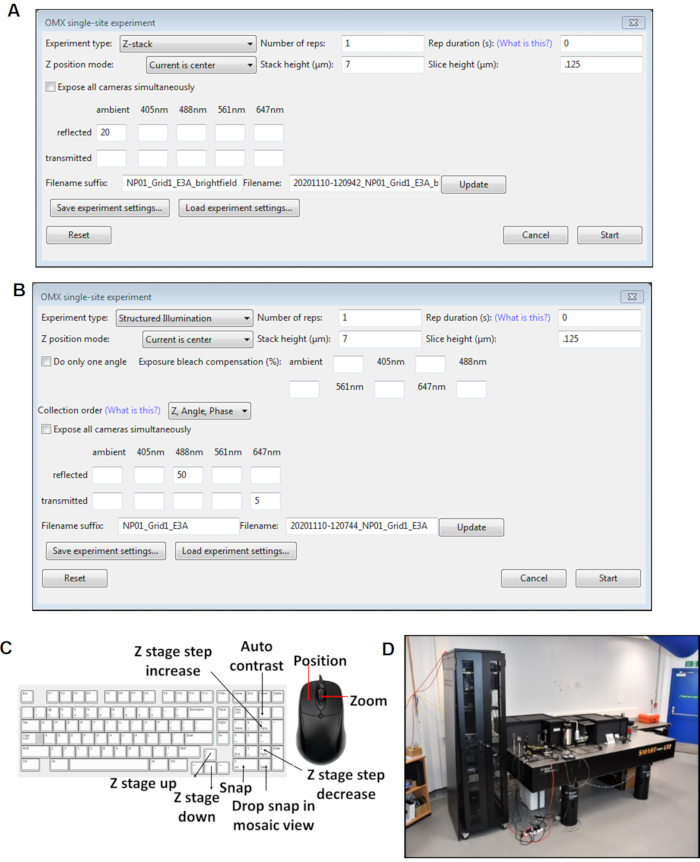
الشكل 4: وجهات النظر من لوحات برنامج قمرة القيادة. (أ) Z كومة تجربة موقع واحد. (ب) تجربة موقع واحد SI. (C) اختصارات لوحة المفاتيح لبرنامج cockpit المستخدم أثناء الحصول على الصورة. (د)المجهر cryoSIM في الموقع في بي 24 الحزمة في سينكروترون مصدر الضوء الماس. اختصار: cryoSIM = المجهر الإضاءة منظم كريو. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
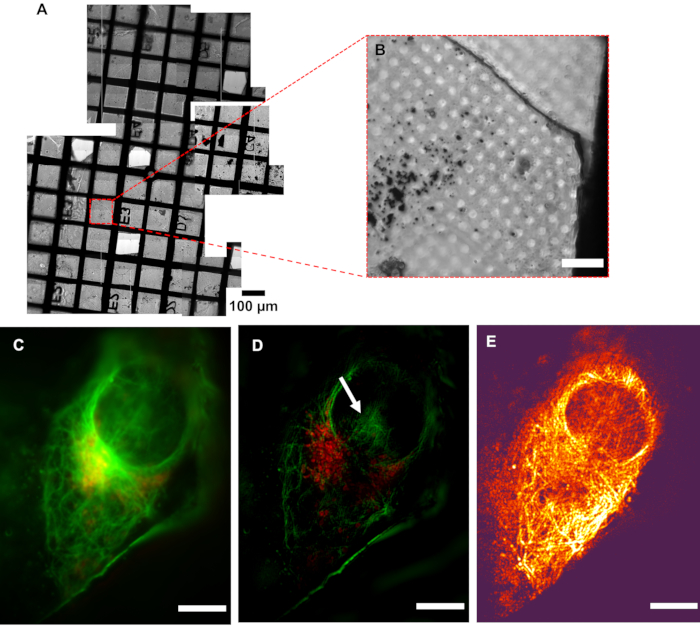
الشكل 5: قرار cryoSIM. (أ) عرض الفسيفساء لشبكة قيد الفحص. (ب) صورة برايتفيلد لمنطقة الاهتمام (AOI). (ج) صورة عريضة النطاق مقارنة مع صورة(D)SIM التي تظهر الزيادة في الدقة. يشير السهم الأبيض إلى قطع SIM اليدوية لإعادة الإعمار. (E) خريطة التباين التشكيل الجمع بين المعلومات كثافة بكسل من الصورة المعاد بناؤها مع معلومات اللون من نسبة التباين إلى الضوضاء التشكيل المعنية (MCNR) قيم البيانات الخام التي تم إنشاؤها بواسطة SIMCheck2. المناطق الساطعة والمظلمة تظهر تباينا عاليا ومنخفضا على التوالي. شريط المقياس = 10 ميكرومتر. إعدادات التصوير CryoSIM: أطوال موجية مثيرة /انبعاثات: 488/525 نانومتر، قوة ليزر 50 ميجاوات، 50 مللي ثانية وقت التعرض و647/655 نانومتر، طاقة ليزر 20 ميجاوات، 5 مللي ثانية وقت التعرض. اختصار: cryoSIM = المجهر الإضاءة منظم كريو. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 6:إعادة بناء الصورة في cryoSIM من موقع على الشبكة في خريطة مضان من خريطة الفلورة التقليدية. (A، B) تراكب من خرائط الصور مشرق ومضان ولدت مع المجهر epifluorescence التقليدية. تستخدم هذه الخريطة لتحديد المناطق التي تهم الصورة لاحقا في cryoSIM. (ج)صورة cryoSIM المعاد بناؤها التي تم الحصول عليها في الموقع المبين في (B). اختصار: cryoSIM = المجهر الإضاءة منظم كريو. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
Discussion
3D SIM في درجات الحرارة المبردة لديها العديد من المزايا على تقنيات التصوير ريال أخرى لتصوير المواد البيولوجية المهزوسة. فإنه يتطلب صورا أقل بكثير لكل شريحة ض مقارنة مع غيرها من أساليب ريال، مما أدى إلى تشعيع أقل وفرصة أقل لتشكيل الكريستال الجليدي للعينات تهتز. كما أنها قادرة على تصوير خلايا كاملة ويمكن ربطها بالتصوير المقطعي بالأشعة السينية لمطابقة الهيكل مع الوظيفة. ومن المثير للاهتمام، أن معظم الفلوروفوريس المتاحة تجاريا وعلامات الفلورسينس تبيض أقل في ظل ظروف التبريد مما كانت عليه في درجة حرارة الغرفة. ومع ذلك ، نظرا لارتفاع غلة الكم من الفلوروفوريس الأكثر شيوعا في درجة حرارة الغرفة (أكثر من 80 ٪ في بعض الحالات) ، فإن الكسب المطلق الذي تم اكتشافه في الفوتونات لا يرجع إلى التغيرات في غلة الكم ، ولكن بسبب انخفاض في عمليات التبييض المعقدة. ويمكن الاطلاع على مزيد من المعلومات حول غلة الفلوروفوريس في درجات الحرارة المبردة في 8.
ومن الأهمية بمكان أن العينات التي تصل إلى cryoSIM قد تم premapped باستخدام المجهر التبريد التقليدية مع قدرة brightfield لإنتاج شبكة "خريطة" التي تشمل تسليط الضوء على جميع AOIs المحتملة لمزيد من التصوير (الشكل 5). يتم تخصيص وقت الوصول في cryoSIM من خلال عملية تنافسية تنطوي على تقديم اقتراح ، والذي يتم تقييمه لاحقا لجدوى التقنية والتأثير الطبي الحيوي. الوقت في المعدات، لذلك، هو دائما "في قسط"، والشبكات premapped تسمح باستخدام الأكثر كفاءة من التخصيص. ومن الضروري أيضا أن تبقى العينة مهززة، لا سيما أثناء نقل العينة من حامل العينة إلى منصة التصوير، لتقليل تكوين بلورات الجليد والأضرار اللاحقة للعينة. يجب أن تكون العينة ذات نوعية جيدة لإنتاج أفضل صور SIM. وتتميز عينة معدة إعدادا جيدا بالسمات التالية: (أ) لن يكون لها تلوث بلوري جليدي، (ب) الشبكة المستخدمة ستكون شبكة مكتشف، (ج) الناقل سيكون مسطحا، (د) شبكة الشبكة وسطح الركيزة لن يكونا فلوريين تلقائيا، و(ه) لن تكون هناك فواصل في غشاء الدعم. ويمكن تحقيق هذه الشروط المسبقة عن طريق المعالجة الدقيقة للعينات وضمان بقاء العينات دائما في حيرة من العمر.
من المهم التحقق مسبقا مما إذا كانت عينات الفلوروفور المقترحة ستعطي إشارة كافية في مجهر cryoSIM. أدوات مثل SPEKCheck9 يمكن أن تساعد مع اختيار الفلوروفور الأمثل وتركيبات التصفية. إذا كانت هناك مشاكل في جمع البيانات الخام أو عملية إعادة الإعمار، يمكن أن تظهر القطع الأثرية في الصور بعد إعادة الإعمار. تم توثيق أمثلة من القطع الأثرية المختلفة من قبل Demmerle et al.10 يمكن مراجعة معلمات إعادة بناء الصورة في ملف سجل SoftWoRx إذا لم يكن إعادة الإعمار الأمثل عن طريق فتح ملف ملخص إعادة الإعمار. يجب أن يكون هناك تباعد أسطر متناسق عبر زوايا في قناة معينة واتساع متناسق نسبيا. يجب إجراء تحقيق أكثر وثيقة في التباين الذي يزيد عن 30٪ والقيم التي تزيد بشكل كبير عن 1 (إذا تم تطبيق تعويض حجم الخرز) ومن المرجح أن يشير إلى فشل عمليات إعادة الإعمار. وبالإضافة إلى ذلك، يمكن أيضا استخدام برنامج SIMcheck2 في فيجي لإجراء فحوصات مختلفة على البيانات الخام وإعادة بنائها لتشخيص سبب الأخطاء في إعدادات معلمة التصوير أو إعادة البناء. يمكن أن يساعد فحص SIM وخريطة تباين التشكيل الخاصة به أيضا في تقييم جودة البيانات المعاد بناؤها من خلال تفسير المناطق التي من المرجح أن تكون هياكل حقيقية مقابل قطع أثرية.
انخفاض تباين التشكيل (يظهر بالألوان الداكنة، في الشكل 5E)داخل المنطقة النووية يعني أن هذه المنطقة ستكون أكثر عرضة للقطع الأثرية إعادة الإعمار، مما يعني أن أنماط التجزئة المبينة في النواة يمكن تصنيفها(الشكل 5D)كمصنوع فني. ومن الأرجح أن تعكس مناطق الإشارات الفلورية القوية بدقة الهياكل الأصلية في البيانات المجهزة. وفي المناطق ذات الإشارات الضعيفة التي توزع فيها الفلوروفوريس على مناطق أوسع، مثل السطح الكلي للحوزة، من المرجح أن تتعايش الإشارة الحقيقية مع تجهيز القطع الأثرية، وينبغي توخي الحذر في تفسير تلك البيانات. بعد فحص البيانات المعاد بناؤها كاملة المدى للتأكد من عدم وجود قطع أثرية غريبة ، وأن الخلفية هي غاوسية بشكل عام وتتركز بالقرب من الصفر ، يتم قص البيانات بشكل عام عند الصفر ، أو يجب أن تكون القيمة مشروطة - ذروة إشارة الخلفية - قريبة جدا من الصفر. وهذا يضمن أن النطاق الديناميكي للصورة المعروضة لا تهيمن عليه القطع الأثرية الخلفية السلبية. عندما يتوقع إشارة أضعف، ينبغي توخي المزيد من الحذر في تحليل الميزات وضمان أنها هياكل حقيقية بدلا من التحف إعادة الإعمار.
هناك بعض القيود على نظام التصوير. لأن مرحلة العينة مسطحة، فإن العينات ذات السماكة المتغيرة أو الشبكات غير المسطحة ليست مواضيع مثالية للتصوير. بالإضافة إلى ذلك، إذا كان سيتم التصوير المترابط باستخدام التصوير المقطعي بالأشعة السينية الناعمة، لا ينبغي تصوير الخلايا القريبة من حدود الشبكة لأن هذه لن تكون مرئية في مجهر الأشعة السينية أثناء اكتساب سلسلة الميل. وأخيرا، فإن كمية النشاف للعينة قبل الهبوط في التجميد لها تأثير كبير على جودة التصوير؛ نتائج النشاف القليل جدا في العينات التي هي سميكة جدا، وإعطاء صور SIM دون المستوى الأمثل مع الضوضاء الخلفية العالية، في حين أن الكثير من النشاف يمكن أن يسبب الخلايا لتصبح مشوهة، وبالتالي أكثر عرضة للتلف الحرارة من شعاع الليزر الحادث. وباختصار، فإن cryoSIM هي أداة مجهرية مضانة قوية لتصوير العينات البيولوجية في مرحلة شبه أصلية ولها تطبيقات واسعة النطاق في العديد من المناطق.
Disclosures
ولا يعلن صاحبا البلاغ عن وجود مصالح مالية متنافسة.
Acknowledgements
وقد تلقى هذا المشروع تمويلا من مشروع أفق المفوضية الأوروبية 2020 iNEXT-Discovery. ويعترف .M دوبي بتمويل صندوق ويلكوم الاستئماني (107457/Z/15/Z). وقد نفذ هذا العمل بدعم من مصدر ضوء الماس، الصك B24 (الاقتراح BI25512). شكرنا لموظفي Micron وجميع مستخدمينا ومتعاونينا الممتازين لمساعدتنا في إنشاء cryoSIM وإمكاناته المترابطة.
Materials
| Name | Company | Catalog Number | Comments |
| Auto grids | FEI | ||
| Autogrids | Thermo Fisher Scientific | 1036173 | |
| BioTracker 488 Green Microtubule Cytoskeleton Dye | Sigma-Aldrich | SCT142 | |
| Cockpit Software | Oxford University | https://github.com/MicronOxford/cockpit | |
| cryo compatible polyurethane container | Jena bioscience | CC-FD-800 | |
| Cryo TEM grid storage box | Thermo Fisher Scientific | Model#AutoGrid | |
| cryo-SIM microscope | Custom made | N/A | Custom made, see following reference for the design: Michael A. Phillips, Maria Harkiolaki, David Miguel Susano Pinto, Richard M. Parton, Ana Palanca, Manuel Garcia-Moreno, Ilias Kounatidis, John W. Sedat, David I. Stuart, Alfredo Castello, Martin J. Booth, Ilan Davis, and Ian M. Dobbie, "CryoSIM: super-resolution 3D structured illumination cryogenic fluorescence microscopy for correlated ultrastructural imaging," Optica 7, 802-812 (2020). Has a Nikon TU Plan Apo 100x/0.9 NA. |
| Cryostage system | Linkam Scientific Instruments | CMS196 | |
| Fine tip surgical forceps | Ted Pella | 38125 | |
| MitoTracker Deep Red FM | Thermo Fisher Scientific | M22426 | |
| Python Microscope Software | Oxford University | https://www.python-microscope.org/ | |
| Scientific dry paper wipes | Kimberly-Clark 7551 | 2 | |
| SIM Reconstruction Software | softWoRx, GE Healthcare | Version 6.5.2 | |
| StitchM Software | Diamond Light Source | https://github.com/DiamondLightSource/StitchM | |
| TEM grids for samples | Quantifoil Micro Tools | G200F1 |
References
- Schermelleh, L., et al. Super-resolution microscopy demystified. Nature Cell Biology. 21 (1), 72-84 (2019).
- Ball, G., Demmerle, J., Kaufmann, R., Davis, I., Dobbie, I. M., Schermelleh, L. SIMcheck: A toolbox for successful super-resolution structured illumination microscopy. Scientific Reports. 5 (1), 15915 (2015).
- Kounatidis, I., et al. 3D Correlative cryo-structured illumination fluorescence and soft X-ray microscopy elucidates reovirus intracellular release pathway. Cell. 182 (2), 515-530 (2020).
- Gustafsson, M. G. L. Surpassing the lateral resolution limit by a factor of two using structured illumination microscopy. Journal of Microscopy. 198 (2), 82-87 (2000).
- Rego, E. H., Shao, L., Rego, E. H. Practical structured illumination microscopy. Methods in Molecular Biology. 1251, 1251 (2015).
- Phillips, M. A., et al. CryoSIM: super-resolution 3D structured illumination cryogenic fluorescence microscopy for correlated ultrastructural imaging. Optica. 7 (7), 802 (2020).
- Matsuda, A., Schermelleh, L., Hirano, Y., Haraguchi, T., Hiraoka, Y. Accurate and fiducial-marker-free correction for three-dimensional chromatic shift in biological fluorescence microscopy. Scientific Reports. 8, 7583 (2018).
- Kaufmann, R., Hagen, C., Grünewald, K. Fluorescence cryo-microscopy: current challenges and prospects. Current Opinion in Chemical Biology. 20, 86-91 (2014).
- Phillips, M. A., Pinto, D. M. S., Dobbie, I. M. SPEKcheck-fluorescence microscopy spectral visualisation and optimisation: a web application, javascript library, and data resource. Wellcome Open Research. 3, 92 (2018).
- Demmerle, J., et al. Strategic and practical guidelines for successful structured illumination microscopy. Nature Protocols. 12 (5), 988-1010 (2017).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved