Method Article
극저온 보존 된 세포에서 극저온 구조 조명 현미경 데이터 수집
* 이 저자들은 동등하게 기여했습니다
요약
이 프로토콜은 극저온 구조조명 현미경을 사용하여 생물학적 냉동 보존 샘플을 이미지화하는 방법을 보여줍니다. 우리는 U2OS 세포의 세포 골격을 화상 진찰하여 방법론을 보여줍니다.
초록
3차원(3D) 구조화 조명 현미경 검사법(SIM)은 기존의 형광 현미경 검사법보다 더 높은 해상도로 형광 라벨이 부착된 세포 구조의 이미징을 허용합니다. 이 초분해능(SR) 기술은 전체 세포에서 분자 공정을 시각화할 수 있으며 구조적 및 기능적 정보를 상호 연관시키기 위해 전자 현미경 검사법 및 X선 단층 촬영과 함께 사용될 가능성이 있습니다. 극저온 보존 샘플(cryoSIM)에 대한 SIM 현미경은 최근 영국 싱크로트론의 상질화 빔 라인 B24에서 의뢰되었습니다.
극저온 연질 X선 단층 촬영과 같은 X선 현미경 검사법에 의한 동일한 샘플의 후속 이미징과 호환되는 방식으로 극저온 온도에서 생물학적 샘플의 3D 이미징을 위해 특별히 설계되었습니다. 이 비디오 문서에서는 cryoSIM을 사용하여 성공적인 이미징을 위한 자세한 방법과 프로토콜을 제공합니다. 극저온심 현미경의 작동에 대한 지침 외에도 시료, 형광및 파라미터 설정의 선택에 관한 권장 사항이 포함되어 있습니다. 프로토콜은 그의 미토콘드리아와 tubulin가 형광으로 표시된 U2OS 세포 견본에서 입증됩니다.
서문
SR 화상 진찰 기술은 지난 10년간 생물학자들에게 널리 접근할 수 있게되었습니다. 그들은 회절 한계를 넘어 형광 태그 샘플의 고해상도 이미징을 허용합니다. 그러나, 극저온 온도2에서시료와 함께 작동 하기 위해 SR 현미경 검사 법을 적응 하는 도전 하고있다. 이것은 전자 또는 엑스레이 단층 촬영과 조합하여 상관 화상 진찰을 위해 유리할 것입니다. 최근에는 극저온 시료와 함께 사용하기 위해 SIM이 적응되어 다이아몬드 광원 싱크로트론(https://www.diamond.ac.uk/Instruments/Biological-Cryo-Imaging/B24.html)에서 상상대극 극저온 빔라인 B24에서 연약한 X선 단층 촬영(SXT)3과 함께 생물학적 세포의 상관관계 연구를 가능하게 하는 것으로 나타났다. SIM은 3개의 각도와 5단계로 줄무늬 빛(Moiré 변두리)으로 샘플을 조명하여 기존의 광야 현미경 검사법의 해상도를 두 배로 늘릴 수 있습니다. 이러한 광 패턴과 샘플 형광 사이의 간섭을 사용하여 서브 회절 구조4,5에대한 추가 정보를 계산적으로 발견할 수 있다.
극저온 응용 프로그램에 대한 다른 SR 기술에 비해 SIM의 몇 가지 장점이 있습니다. 첫째, 특별히 설계된 깜박임 형광없이 작동 할 수 있습니다; 종래의 형광은 잠재적인 형광 태깅 제6의넓은 범위에 접근할 수 있게 하여 사용될 수 있다. 또한 z 슬라이스당 15개의 이미지(3D, 2D의 9개 이미지)만 필요한 반면, 다른 SR 메서드는 슬라이스당 약 1,000개의 이미지를 취하므로 시료가 가열될 확률이 높아서 얼음 결정 형성의 위험이 증가하여 유물을 유발할 수 있습니다. 마지막으로, 이 기술은 10 μm 이상의 두꺼운 생물학적 샘플을 이미지화하여 전체 세포가 거의 네이티브 상태6에서이미지화될 수 있도록 할 수 있습니다. cryoSIM은 표준 광학 부품과 이미징용 개방형 소프트웨어로 제작되어 원하는 경우6을쉽게 문서화하고 복제할 수 있습니다. 저온심은 100x/0.9 숫자 조리개 목표를 가지고 있습니다(재료 표참조) 광학 성분, 설계 파라미터 및 성능에 대한 추가 정보는 필립스 외6에 의해 설명되었으며, 이 프로토콜은 극저온 단계에서 샘플을 적재하고 내리는 방법, 현미경에 대한 데이터를 수집하는 방법 및 SIM 이미지를 재구성하는 방법을 포함하여 극저온 현미경을 사용하는 방법을 보여줍니다.
프로토콜
참고: 이 프로토콜은 플런지 동결 또는 고압 동결에 의해 유리화된 구멍이 있는 탄소 지지 필름을 가진 송신 전자 현미경 검사법(TEM) 3mm 플랫 골드 그리드에 재배되거나 증착된 세포를 포함하는 견본에 관한 것입니다. 이 프로토콜은 샘플이 이미 기존의 과형 및 밝은 필드 현미경을 사용하여 저온심에서 이미징에 대한 관심있는 위치를 매핑했다고 가정합니다. 전체 프로토콜에 대한 개요는 그림 1을 참조하십시오.
1. 저온 스테이지 준비
- 표준 과학적 드라이 페이퍼 물티슈가 늘어선 깔때기를 통해 LN2를 통과하여 얼음이 없는 액체 질소(LN2)를준비합니다.
참고: LN2가 화상을 입으면 저온 보호 장갑과 고글을 포함한 적절한 개인 보호 장비를 착용하십시오. 이러한 액체는 산소를 대체하고 급속한 질식을 일으킬 수 있으며 제대로 환기 된 지역에서 처리해야합니다. - 가압 공기로 극저온 스테이지에서 표면 먼지를 제거합니다. 사용 하기 전에 가압 된 공기 용기에서 액체를 추방.
- 샘플 로딩 카트리지가 적절한 챔버 샘플 홀더와 함께 제자리에 있는지 확인합니다(이전 실험에서 샘플 홀더에 그리드가 남아 있지 않은지 확인)(그림 2).
- 극저온 스테이지의 외부 탈전에서 뚜껑을 제거하고 여과된 LN2를 약 1/4번째 풀까지 붓습니다. 초기 끓는 것이 가라앉을 때까지 기다렸다가 더 많이 붓습니다. 선박을 약 2/3rd 로 채웁니다. 뚜껑을 조심스럽게 교체하고, 손잡이와 스테이지/광학에서 노즐을 가리키며 LN2는 콘센트에서 끓입니다.
- LN2가 출구에서 나오지 못하게 되면, 극저온 스테이지에 출구 파이프를 배치합니다.
- 스테이지의 전원을 연결하고 USB 케이블을 극저온 스테이지에 연결합니다. 가열된 샘플 챔버 뚜껑이 연결되어 있는지 확인합니다. 외부 디워를 스테이지에 연결합니다.
참고: 출구 파이프가 극저온 스테이지의 스테이지 디워드 위에 배치될 때까지 외부 드와드를 연결하지 마십시오. LN 2오버플로우(또는 오버플로방지)가 있는 경우 USB 케이블을 ~10초 동안 꺼내서 보정하고 USB 케이블을 다시 연결하여 센서를 다시 활성화합니다. - LN2가 스테이지 디워로 전달된 후 극저온 스테이지의 릴리즈 버튼을 눌러 LN2가 샘플 챔버에 들어갈 수 있도록 합니다.
참고: LN2가 챔버를 채우는 동안 시스템을 방치하지 마십시오. - 이미지 수집을 시작하기 전에 시스템이 냉각되고 안정화될 수 있도록 ~30-45분 기다립니다. 외부 드워를 주기적으로 확인하고, 전체 분기 미만인 경우 필터링된 LN2(약 시간마다)로 상향식합니다.
2. 샘플 저장 상자의 극저온 스테이지로 전송
참고: 샘플링 저장 상자, 홀더 및 필터링된 LN2 내부의 모든 계측기(예: 집게)의 팁을 침수하여 샘플 또는 샘플 챔버 내부의 물체와 같은 차가운 표면을 만지기 전에 냉각시하십시오. 생물학적 샘플을 취급할 때 실험실 외투와 장갑을 착용하십시오.
- 유리화 된 샘플이 극저온 호환 용기에 있는지 확인하고 현미경으로 가져 오십시오. 극저온 스테이지의 해당 버튼을 눌러 샘플 챔버의 빛을 켭니다.
- 카세트 도구의 육각 키를 사용하여 샘플 이송 카세트의 두 플레이트를 엽니다. 두 플레이트 사이에 그리드에 떨어질 만큼 넓게 플레이트를 열지만, 그리드가 다른 쪽을 통해 떨어지는 것을 방지하기 위해 최대 열린 위치로 열지 마십시오.
- 긴 집게를 사용하여 샘플 그리드 박스를 LN2에서들어 올리고 노치가 스테이지 내부의 저장소 위치의 위치와 일치하는 위치를 켜고 스테이지에 배치합니다. 적절한 장치(예: 드라이버)를 사용하여 저장 상자 뚜껑을 올바른 샘플 위치로 엽니다.
- 반전된 집게(또는 임의의 미세 팁 수술 용 집게)를 사용하여 샘플 홀더에서 TEM 그리드를 제거하고 LN2내부에 침수하고, 시료 전달 카세트의 위치에 떨어뜨리고, 전송 과정에서 LN2에 가깝게 유지한다. 탄소 막 측이 배치되어 궁극적으로 샘플 브리지의 목표에 직면하게 됩니다.
- 카세트 도구의 육각 키를 사용하여 샘플 카트리지를 닫습니다. 남은 샘플과 함께 저장 상자를 닫고 제거합니다.
- 카세트 도구의 자석 점을 사용하여 그리드가 포함된 카트리지를 샘플 브리지에 들어 올리고 장착합니다. 전송 프로세스 중에 LN2에 침지/가까이 보관하십시오. 방향이 브리지에 적합한지 확인합니다(두 자석이 다리의 자석과 접촉합니다). 카세트를 다리의 위치 핀 내에 평평하게 놓고 부드럽게 움직이기 때문에 고정됩니다.
참고: 빔 라인 B24의 CryoSIM 시설에서후속 집중 이온 빔 밀링을 위해 준비된 클리핑 그리드용 샘플 카세트도 사용할 수 있습니다.
3. 무대 도킹 및 초점
- 극저온 스테이지 뚜껑을 이미징 위치로 이동하고 샘플 챔버 라이트를 끕니다. 스테이지를 광학쪽으로 밀어 목표 렌즈 아래에 정렬합니다. 공을 사용하여 목표를 제자리에 부드럽게 떨어뜨려 극저온 스테이지의 뚜껑 내에 있지만 만지지 않도록 합니다.
참고: 외부 Dewar의 출구 파이프가 데이터 수집 중 어느 지점에서나 극저온 스테이지의 스테이지 디워를 만지지 않도록 합니다. - 불투명한 블랙 커튼으로 무대와 광학을 덮습니다. 극저온SIMPC(그림 3 및 도 4)에서제어 소프트웨어 조종석을 시작합니다.
- 각 카메라의 판독 모드 버튼을 클릭하고 CONV 3 MHz로 설정합니다. 각 카메라의 온도가 -80 °C이고 카메라 팬이 꺼져 있는지 확인하십시오.
- 반사된 카메라를 켭니다. 조명아래에서 주변(노출 20ms)을 선택하고 linkam에서 응축기클릭합니다. 비디오 모드 버튼을 클릭합니다.
- 모자이크 뷰 창에서 축소(마우스 스크롤)를 눌러 그리드 윤곽선을 확인합니다. 보이지 않는 경우 스테이지 찾기를 클릭합니다. 원 중앙에서 왼쪽을 두 번 클릭하여 그리드를 중앙에 둘러볼 수 있습니다.
- 그리드 서포트 필름(또는 기타 관련 샘플 피쳐)이 초점을 맞추고, 위아래 키를 사용하여 저온 스테이지를 위아래로 이동하고, 숫자 패드의 9 및 3 키를 사용하여 z-스텝을 변경합니다(초기 초점에 대해 20 μm로 설정).
참고: 사용자가 z로 여행이 부족한 경우 극저온 스테이지 아래의 휠을 사용하여 스테이지를 수동으로 위 또는 아래로 이동할 수 있습니다. 한 번에 하나씩 돌리고 샘플이 보기 범위 내에 있는지 확인합니다. 포커스가 악화되면 방향을 다시 변경합니다.
4. 브라이트필드 모자이크 인수
- 스테이지가 중심이 되면 비디오 모드를끄고 가시광선 모자이크를 수집합니다(모자이크 뷰에서 모자이크 실행을 클릭하여 중앙에서 바깥쪽으로 나선형으로 보이는 가시광선 이미지의 타일을 생성하십시오). 그리드가 구부러지면 그리드에서 다른 위치(모자이크 보기내에서 두 번 왼쪽 클릭)를 시도하고 다시 포커스를 클릭하고 다시 실행 모자이크를 클릭하여 부분 모자이크를 수집합니다. 또는 모자이크 위에 초점을 맞춘 이미지를 드롭인(도 3).
- 모자이크 저장을클릭하여 뷰를 저장합니다. 저장소 상자와 각 그리드 번호에 정보가 포함된 짧은 파일 이름을 지정합니다(타임스탬프가 파일 이름에 자동으로 추가됩니다).
5. 관심 분야 식별
- 이전 형광 "지도" 이미지와 함께 브라이트필드 모자이크를 검사하여 세포 또는 생물학적 관심있는 특징이 이전에 어디에 있었는지 확인합니다. 해당 부위가 적절한 형광을 생성하는지 확인합니다.
- 활성화된 경우 주변 광및 응축기뿐만 아니라 비디오 모드를 끕니다. 필요한 여기 레이저(405, 488, 561 또는 647)를 켜고 50ms 노출 시간에 대해 처음에 50mW에서 해당 카메라 및 필터를선택합니다.
참고: 형광 신호에 따라 이러한 카메라 및 필터 설정을 증가/축소합니다. - 0을 눌러 이미지를 스냅하고 * 자동 대비합니다. 또는 이미지 하단의 슬라이더를 사용하여 콘트라스트를 수동으로 조정합니다.
참고 : 방에 대한 기호에 레이저켜 켭타. - 적절한 형광을 가진 생물학적으로 흥미로운 세포가 발견되면, 모자이크 보기에서 마크 사이트 버튼을 사용하여 자신의 위치를 표시.
참고: 이러한 표시된 사이트는 밀폐된 목록에 표시되며 좌표를 두 번 클릭하여 액세스할 수 있습니다. 표시된 사이트로 돌아갈 때 두 번 클릭하기 전에 영역을 확대합니다. - 이미지 수집을 시작하기 전에 모든 잠재적 사이트를 계속 표시합니다. 표시된 사이트로 모자이크를 다시 저장합니다. 사이트 저장을 클릭하여 파일을 제출합니다.
- StitchM 소프트웨어(빔라인 B24에서 개발된 집)를 사용하여 모자이크 이미지를 함께 꿰매려면 확장 .bat .txt 모자이크 파일을 StitchM 파일에 드래그앤드롭하고 동일한 폴더에 모자이크 타일의 결합된 티프 이미지를 저장합니다. 표시된 사이트와 함께 이미지를 저장하려면 모자이크.txt 파일 및 마커.txt 파일을 동시에 아이콘에 드래그앤드롭합니다.
참고: 프로젝트 요구 와 데이터 수집의 균형(예: 상관 관계 이미징이 수행될 경우 파트너 이미징 양식으로 얼마나 많은 이미지를 촬영할 수 있는지 확인하고 cryoSIM 이미징에 적합한 사이트 수를 선택). 또한 외부 탈파가 LN2로 리필해야 하는 경우, 극저온 스테이지 시스템은 위치를 변경하고 표시된 사이트는 동일한 위치로 돌아오지 않을 가능성이 높습니다. 따라서 이미지할 사이트 수를 선택할 때 이 점을 고려하십시오.
- StitchM 소프트웨어(빔라인 B24에서 개발된 집)를 사용하여 모자이크 이미지를 함께 꿰매려면 확장 .bat .txt 모자이크 파일을 StitchM 파일에 드래그앤드롭하고 동일한 폴더에 모자이크 타일의 결합된 티프 이미지를 저장합니다. 표시된 사이트와 함께 이미지를 저장하려면 모자이크.txt 파일 및 마커.txt 파일을 동시에 아이콘에 드래그앤드롭합니다.
- 활성화된 경우 주변 광및 응축기뿐만 아니라 비디오 모드를 끕니다. 필요한 여기 레이저(405, 488, 561 또는 647)를 켜고 50ms 노출 시간에 대해 처음에 50mW에서 해당 카메라 및 필터를선택합니다.
6. 데이터 수집 전략
- 형광 이미지의 동적 범위(카메라 뷰 창 하단)의 동적 범위의 개수를 기반으로 레이저 노출 시간을 설정합니다. 적용할 필터를 선택하고 각 레이저를 별도로 켜고 사용할 각 파장에 맞게 이러한 설정을 최적화합니다.
참고: 10,000-20,000개의 카운트가 최적이지만, 대조가 좋은 경우 더 낮은 수의 수를 허용합니다. 그리드의 다른 영역에 있는 셀이 가변 형광 수준을 가질 수 있기 때문에 각 이미지 스택을 획득하기 전에 필터 설정을 확인하는 것이 좋습니다.
7. 데이터 수집
- 두 카메라를 클릭하여 켭니다. 표시된 사이트 중 하나로 돌아가 원하는 깊이에 다시 초점을 맞춥니다. 관심 영역에 초점을 맞춘 후 매크로 스테이지의 XY 창에서 포커스 위쪽(↑ 키)에서 포커스를 위로 이동하여 획득할 z 스택의 높이를 선택하고 저장 상단을 클릭합니다. 초점 에서 아래로 이동(↓ 키), 저장 바닥을 클릭한 다음 센터로 이동,이미지가 여전히 초점되어 있는지 확인합니다.
참고: 샘플 높이가 창에 표시됩니다. - 조종석 창에서 슬m(공간 광 변조기)을 마우스 오른쪽 버튼으로 클릭하고 각도가 0.41로 설정되어 있는지 확인합니다. 조종석 창에서 단일 사이트 실험을선택합니다.
참고: 슬렘을 클릭하지 마십시오. 조종석은 이미지 수집 중에 자동으로 켜집니다.- 드롭다운 목록에서 구조화 된 조명을 선택합니다. 스택 높이를 변경하여 z 높이 + 1 μm과 같을 수 있습니다.
참고: 1μm를 첨가하면 z에서 전체 샘플을 포획하고 재건 유물을 최소화합니다. - 상부 행의 405 nm 및 488 nm 레이저(반사 카메라용)에 대한 노출 시간(ms)과 하부 행의 561 nm 및 647 nm 레이저에 대한 노출 시간(전송된 카메라용)을 입력합니다.
참고: 노출 시간 값은 이전에 결정되고 주 조종석 창에 표시된 값과 일치해야 합니다. - 어떤 유형의 이미징이 수행되고 있는지에 따라 파일 이름(명명 규칙: 상자 number_grid area_filters_FL) (FL(형광) 또는 BF(브라이트필드)를 입력합니다. 업데이트를 클릭하여 이전 파일을 덮어쓰지 않고 날짜와 시간이 포함된 새 파일을 생성합니다. 그런 다음 시작을클릭합니다.
- 드롭다운 목록에서 구조화 된 조명을 선택합니다. 스택 높이를 변경하여 z 높이 + 1 μm과 같을 수 있습니다.
- 데이터가 수집되는 동안 카메라 보기를 확인합니다. xy 변위가 있는 경우 이미지를 다시 가져 가라. LN2 데워가 이미지 수집 중에 극저온 스테이지를 다시 채우는 경우 조종석 소프트웨어의 중단 버튼을 클릭하여 프로세스를 중단합니다.
- 외부 탈전이 스테이지 디워를 다시 채우면 리필이 샘플을 수직으로 변위하기 때문에 실험을 반복합니다. 이미지를 다시 초점을 맞추고 z로 다시 초점을 맞추고 단일 사이트 실험을반복합니다. 필요한 레이저와 필터의 모든 조합에 대한 단일 사이트 실험을 반복합니다.
참고: 리필을 완료하는 데 약 30 s-1 분이 걸립니다. 하나의 그리드의 이미징 동안 리필은 ~ 4-8배발생합니다.
- 외부 탈전이 스테이지 디워를 다시 채우면 리필이 샘플을 수직으로 변위하기 때문에 실험을 반복합니다. 이미지를 다시 초점을 맞추고 z로 다시 초점을 맞추고 단일 사이트 실험을반복합니다. 필요한 레이저와 필터의 모든 조합에 대한 단일 사이트 실험을 반복합니다.
- 각 위치에서 가시광선을 사용하여 z 스택을 수집합니다.
- 레이저를 끄고 주변 광및 응축기에서 전환합니다. 단일 사이트 실험에서 Z 스택을선택하고 주변 광을 20ms 노출로 설정하고 z 높이를 위와 같이 유지합니다.
- 그리드에 표시된 모든 사이트에 대해 7.2에서 7.4 단계를 반복합니다.
- 다른 샘플로 이동하기 전에 타일 삭제를 클릭하여 모자이크를 삭제합니다.
- 모든 타일 주위에 사각형을 그려 삭제합니다. 목록에서 모든 마커를 선택한 다음 선택한 사이트 삭제를 클릭하여 마커를 삭제합니다.
- 그리드를 변경하기 전에 주변 광및 응축기를 끕니다. 4절의 단계를 역으로 따라 스테이지를 반대로 해독하고 그리드를 변경합니다.
8. 이미징 후
- 이미징이 완료되면 스테이지를 해독하고 모든 샘플을 제거합니다. 샘플 챔버 라이트를 끕니다. 외부 디워를 분리하고 남은 LN2를 다른 저온 호환 용기에 데니크하여 분해가 정상 온도로 안전하게 돌아갈 수 있도록 합니다.
- 냉동 스테이지에 뚜껑 플러그를 놓습니다. 더 이상 LN2가 스테이지 디워에 남아 있지 않은 후에 냉동 스테이지 디스플레이를 굽는 옵션이 제공될 때까지 기다립니다. 베이킹 아웃 버튼을 눌러 가열 모드로 들어가얼음형성을 피하기 위해 저온 스테이지에서 습기를 제거합니다.
9. 재건
- 원시 SIM 데이터 파일을 재구성을 위한 적절한 워크스테이션으로 전송합니다. 채널별 광학 전송 기능(OTFS)과 K0 각도(0.29278, -1.8028, 2.3786)를 사용하여 처리 작업 빌더 창을 통해 처리를 연속하여 0.004 및 200의 간격띄우기의 모든 채널에 대해 일정한 Wiener 필터를 사용한다.
- 추가 옵션 패널에서는 다른 옵션을 선택하지 않고 유지하여 음수 강도를 삭제해야 합니다. SIR 이미지를"처리"라는폴더에 저장합니다.
참고: 상용 SIM 재구성 소프트웨어는 일반적으로 재구성된 SIM 데이터를 생성하고 파일 이름을 유지하지만 마지막에 SIR.dv를 더합니다. 또한 재구성 성공에 대한 처리 프로토콜, 단계 및 통계 정보가 포함된 로그 파일도 만들어집니다.
10. 색채 변속 보정
- 소프트웨어 크로마뇽7을 다운로드하여 색도 변이를 수정합니다.
- 수집된 데이터의 형광 파장에 해당하는 색소 시프트 기준 매트릭스를 사용합니다(빔라인에서 제공).
참고: 참조 파일은 정렬 매개 변수를 포함하고 다중 형광 나노 입자를 사용하여 교정 이미지에서 얻은 '크로마뇽.csv' 파일입니다. 여러 데이터 집합을 한 번에 일괄 처리하는 데 사용할 수 있습니다.- 샘플 이미징에 사용되는 레이저 파장 및 필터와 일치하는 적절한 참조 파일을 선택하고 참조 필드에 추가합니다. 소스 필드에 정렬할 재구성된 SIR 데이터를 추가하고 실행을 클릭합니다.
- 형광 신호가 이제 이미지에 정렬되어 있는지 확인합니다. 일괄 처리의 경우 모든 SIR 이미지를 원본 필드와 참조 필드에 정렬하도록 배치하고 모든 실행을누릅니다.
결과
U2OS 세포를 함유한 샘플은 녹색 미세투불 사이토켈레톤 염료와 적색 미토콘드리아 염료의 혼합물로 염색되어 세포골격(green)과 미토콘드리아(red)의 미세투벌 성분이 염색되었다. 후속 화상 진찰은 세포 내의 미토콘드리아의 국소화뿐만 아니라 마이크로 투튜의 배열을 보여주었으며, 핵과 같은 세포 세포 주위의 세포 골격 및 세포 골격의 조립에 제공하는 구조적 프레임 워크를 강조했다. 극저온심의 해상도는 표준 형광 현미경 검사법(도5)보다현저히 높다. 도 6은 기존의 상피형 현미경으로부터의 형광 "맵"이 그리드의 위치에서 이미징 및 해당 극저온 재구성 된 이미지에 대한 관심 영역및 해당 극저온 재구성 이미지를 찾는 데 어떻게 사용될 수 있는지 보여줍니다.
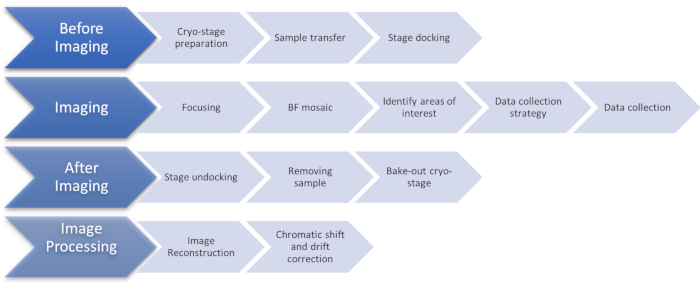
그림 1: 극저온심 이미징 프로토콜의 단계를 보여주는 플로우 차트. 약어 : 냉동심 = 저온 구조조명 현미경 검사법. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 2: 극저온 스테이지. (A)저온 스테이지 설정. (B)반전된 집게에 의해 개최된 샘플 그리드. (C)저온 스테이지의 구성 요소입니다. 연결 포트는 주황색에 해당하는 색상으로 표시되어 있으며, 전원 공급 장치, 노란색: 가열된 스테이지 뚜껑, 파란색: 외부 드와르, 녹색: PC연결. 약어 : PC = 개인용 컴퓨터; LN2 = 액체 질소. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
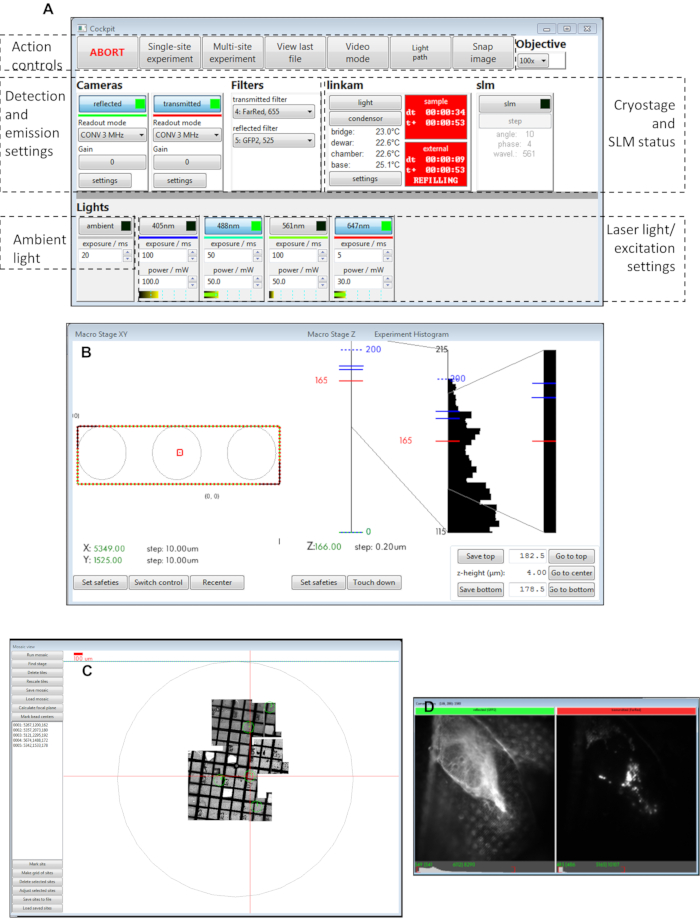
그림 3: 조종석 소프트웨어 패널의 보기. (A)메인 패널,(B)매크로 스테이지 XY,(C)모자이크 뷰,(D)카메라 보기. 약어: SLM = 공간 광 변조기. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
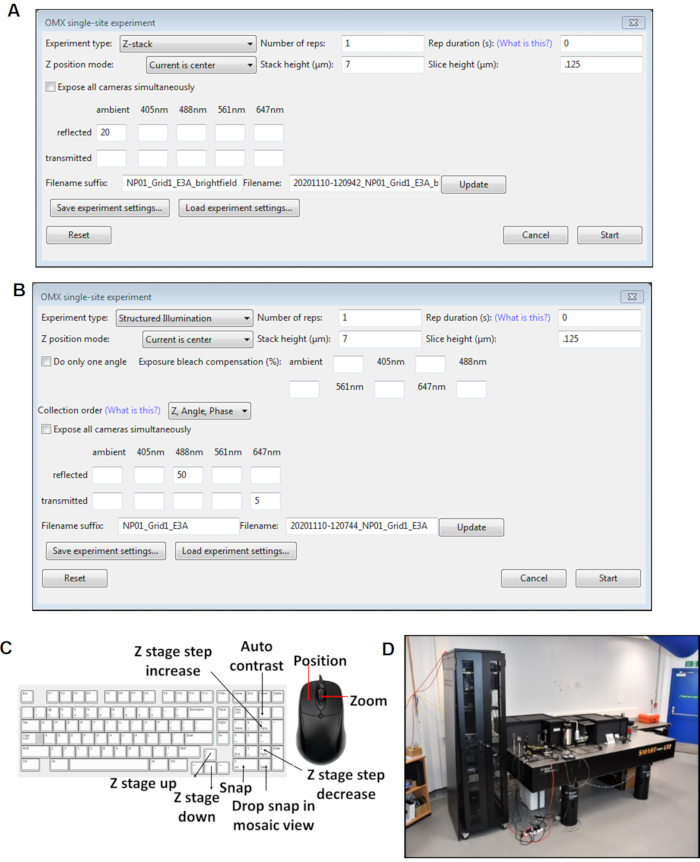
그림 4: 조종석 소프트웨어 패널의 보기. (A)Z 스택 단일 사이트 실험. (B)SI 단일 사이트 실험. (C)이미지 수집 중에 사용되는 조종석 소프트웨어에 대한 키보드 단축키. (D)극저온심 현미경은 다이아몬드 광원 싱크로트론의 빔라인 B24에서 현장에 있습니다. 약어 : 냉동심 = 저온 구조조명 현미경 검사법. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
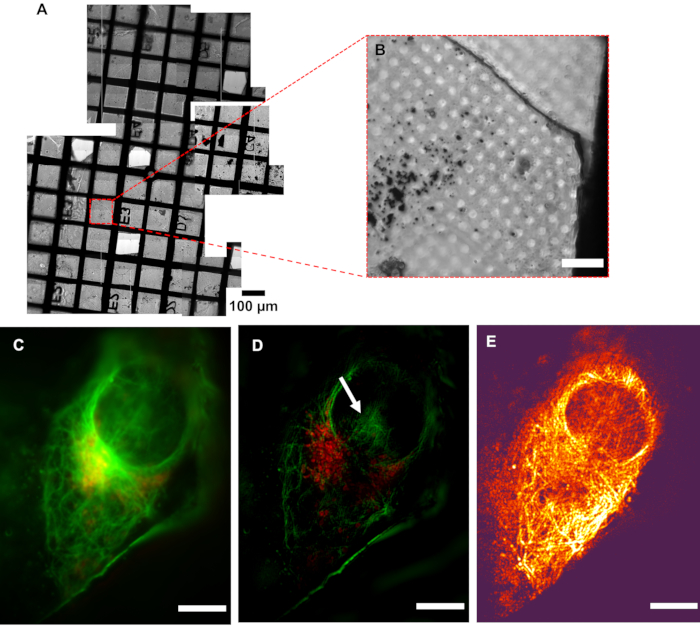
그림 5: 극저온심의 해상도. (A)검사 중인 그리드의 모자이크 뷰. (B)관심 영역 (AOI)의 밝은 필드 이미지. (C)의사 와이드필드 이미지는 해상도의 증가를 보여주는(D)SIM 영상에 비해. 흰색 화살표는 SIM 재구성 아티팩트를 나타냅니다. (E)재구성된 이미지의 픽셀 강도 정보를 SIMCheck2에의해 생성된 원시 데이터의 각각변조 대비 잡음비율(MCNR) 값의 색상 정보와 결합한 변조 대비 맵. 밝고 어두운 영역은 각각 높고 낮은 대비를 보여줍니다. 스케일 바 = 10 μm. CryoSIM 이미징 설정: 여기/방출 파장: 488/525 nm, 50 mW 레이저 파워, 50 ms 노출 시간 및 647/655 nm, 20 mW 레이저 전원, 5 ms 노출 시간. 약어 : 냉동심 = 저온 구조조명 현미경 검사법. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 6: 종래의 형광맵에서 형광지도에서 그리드의 위치에서 극저온심에서 의 이미지 재구성. (A, B)기존의 상피 현미경으로 생성된 밝은 필드 및 형광 이미지 맵의 오버레이. 이 맵은 cryoSIM에서 이후에 이미지에 대한 관심 영역을 찾는 데 사용됩니다. (C)(B)에도시된 위치에서 얻어진 재구성된 극저온심 영상. 약어 : 냉동심 = 저온 구조조명 현미경 검사법. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
토론
극저온 온도에서 3D SIM은 유리화 된 생물학적 물질을 이미징하기위한 다른 SR 이미징 기술에 비해 많은 장점이 있습니다. 다른 SR 방법에 비해 z 슬라이스당 이미지가 현저히 줄어들어 조사 횟수가 줄어들고 진동시 얼음 결정이 형성될 확률이 낮습니다. 또한 전체 세포를 이미지화할 수 있으며 기능과 구조와 일치하도록 X선 단층 촬영과 상관관계가 있을 수 있습니다. 흥미롭게도, 대부분의 상업적으로 이용 가능한 형광및 형광태그는 실온보다 극저온 조건에서 표백제보다 적습니다. 그러나 실온에서 가장 흔한 형광의 높은 양자 수율(경우에 따라 80% 이상)을 감안할 때, 광자에서 검출되는 절대 이득은 양자 수율의 변화 때문이 아니라 복잡한 표백 과정의 감소로 인한 것이다. 극저온 온도에서 형광의 수율에 대한 자세한 내용은 8에서찾을 수 있습니다.
극저온심에 도착하는 샘플은 밝은 시야 기능을 갖춘 기존의 극저온 현미경을 사용하여 사전 매핑되어 추가 이미징을 위한 모든 잠재적 AOIs의 하이라이트를 포함하는 그리드 "맵"을 생성하는 것이중요합니다(그림 5). cryoSIM의 액세스 시간은 제안서 제출을 포함하는 경쟁 적인 프로세스를 통해 할당되며, 이는 이후 기술 타당성 및 생체 의학 영향에 대해 평가됩니다. 따라서 장비의 시간은 항상 "프리미엄"이며 사전 매핑된 그리드를 사용하면 할당을 가장 효율적으로 사용할 수 있습니다. 또한 시료가 유리화되어, 특히 샘플 홀더에서 이미징 플랫폼으로 샘플 전송 중에 얼음 결정의 형성과 후속 시료 손상을 최소화하는 것이 필수적입니다. 샘플은 최상의 SIM 이미지를 생성하기에 좋은 품질이어야 합니다. 잘 준비된 시료는 다음과 같은 특징을 특징으로 한다: (a) 얼음 결정 오염이 없고, (b) 사용되는 그리드는 파인더 그리드가 될 것이고, (c) 캐리어는 평평할 것이고, (d) 그리드 메쉬및 기판 표면은 자동 형광이 아니며, (e) 지지막에는 파손이 없을 것이다. 이러한 전제 조건은 신중한 샘플 처리및 샘플이 항상 유리화 상태를 유지하도록 함으로써 달성될 수 있습니다.
제안된 샘플 형광료가 극저온심 현미경에서 충분한 신호를 줄 수 있는지 여부를 미리 확인하는 것이 중요합니다. SPEKCheck9와 같은 도구는 최적의 플루오로포어 및 필터 조합을 선택하는 데 도움이 될 수 있습니다. 원시 데이터 수집 또는 재구성 프로세스에 문제가 있는 경우 재구성 후 이미지에 아티팩트가 나타날 수 있습니다. 다양한 유물의 예는 Demmerle et al.10 에 의해 문서화되었습니다. 10 재구성 요약 파일을 열어 재구성이 최적이 아닌 경우 SoftWoRx 로그 파일에서 이미지 재구성 매개 변수를 검토할 수 있다. 주어진 채널의 각도와 비교적 일관된 진폭의 간격을 일관되게 조정해야 합니다. 30% 이상의 변화와 1(비드 크기 보상이 적용되는 경우) 값을 크게 상회하여 보다 면밀하게 조사해야 하며, 실패한 재건을 나타낼 가능성이 높습니다. 또한, 피지의 SIMcheck2 소프트웨어는 또한 이미징 또는 재구성 파라미터 설정에서 오류의 원인을 진단하기 위해 원시 및 재구성 된 데이터에 대한 다양한 검사를 수행하는 데 사용할 수 있습니다. SIM-check 및 변조 대비 맵은 이미지의 실제 구조와 유물이 될 가능성이 있는 영역을 해석하여 재구성된 데이터의 품질 평가를 도왔습니다.
핵 영역 내에서 낮은 변조 대비(어두운 색으로 도시됨, 도 5E)는이 영역이 재건 유물에 더 취약할 것이라는 것을 의미하므로 핵에 표시된 해시 패턴(도5D)을유물로 분류할 수 있음을 암시한다. 강력한 형광 신호 영역은 처리된 데이터에서 기본 구조를 정확하게 반영할 가능성이 높습니다. 소포의 전체 표면과 같이 형광이 더 넓은 영역에 분포되는 약한 신호 영역에서실제 신호가 처리 아티팩트와 공존할 가능성이 높으며 해당 데이터의 해석에 주의를 기울여야 합니다. 전체 범위 의 재구성 된 데이터를 검사하여 이상한 아티팩트가 없고 배경이 일반적으로 가우시안이고 0에 가깝게 중심이되도록 하면 데이터는 일반적으로 0으로 잘리거나 배경 신호의 모달 값 피크는 매우 0에 가깝습니다. 이렇게 하면 표시된 이미지의 동적 범위가 음수 배경 아티팩트에 의해 지배되지 않습니다. 약한 신호가 예상되는 경우, 특징을 분석하고 재구성 유물이 아닌 실제 구조임을 확인하는 데 각별한 주의를 기울여야 합니다.
이미징 시스템의 몇 가지 제한이 있습니다. 샘플 스테이지가 평평하기 때문에 가변 두께 또는 그리드가 평평한 샘플은 이미징에 이상적인 피험자가 아닙니다. 또한, 코르상대성 이미징이 부드러운 X선 단층 촬영을 사용하여 수행될 경우, 기울기 시리즈 수집 중에 X선 현미경에서 볼 수 없는 그리드 경계 근처의 세포를 이미지화해서는 안 됩니다. 마지막으로, 급락 동결 전에 샘플의 블로팅의 양은 이미징 품질에 상당한 영향을 미친다; 너무 적은 블로팅은 너무 두꺼운 샘플의 결과로 인해 배경 소음이 많은 최적이 아닌 SIM 이미지를 제공하며, 너무 많은 블로팅으로 인해 세포가 잘못 형성되어 사고 레이저 빔의 열 손상에 더 취약해질 수 있습니다. 요약하자면, cryoSIM은 거의 네이티브 단계에서 3D로 생물학적 샘플을 이미징하기 위한 강력한 형광 현미경 도구이며 많은 분야에서 광범위한 응용 분야를 가지고 있습니다.
공개
저자는 경쟁 적인 재정적 이익을 선언하지 않습니다.
감사의 말
이 프로젝트는 유럽 위원회 호라이즌 2020 iNEXT-Discovery 프로젝트에서 자금을 받았습니다. I.M. Dobbie는 웰컴 트러스트 (107457/Z/15/Z)의 자금 지원을 인정합니다. 이 작품은 다이아몬드 광원, 악기 B24 (제안 BI25512)의 지원으로 수행되었다. 마이크론의 직원과 냉동 SIM과 그 상관 관계 잠재력을 확립하는 데 도움을 준 모든 우수한 사용자와 협력자 덕분에 감사드립니다.
자료
| Name | Company | Catalog Number | Comments |
| Auto grids | FEI | ||
| Autogrids | Thermo Fisher Scientific | 1036173 | |
| BioTracker 488 Green Microtubule Cytoskeleton Dye | Sigma-Aldrich | SCT142 | |
| Cockpit Software | Oxford University | https://github.com/MicronOxford/cockpit | |
| cryo compatible polyurethane container | Jena bioscience | CC-FD-800 | |
| Cryo TEM grid storage box | Thermo Fisher Scientific | Model#AutoGrid | |
| cryo-SIM microscope | Custom made | N/A | Custom made, see following reference for the design: Michael A. Phillips, Maria Harkiolaki, David Miguel Susano Pinto, Richard M. Parton, Ana Palanca, Manuel Garcia-Moreno, Ilias Kounatidis, John W. Sedat, David I. Stuart, Alfredo Castello, Martin J. Booth, Ilan Davis, and Ian M. Dobbie, "CryoSIM: super-resolution 3D structured illumination cryogenic fluorescence microscopy for correlated ultrastructural imaging," Optica 7, 802-812 (2020). Has a Nikon TU Plan Apo 100x/0.9 NA. |
| Cryostage system | Linkam Scientific Instruments | CMS196 | |
| Fine tip surgical forceps | Ted Pella | 38125 | |
| MitoTracker Deep Red FM | Thermo Fisher Scientific | M22426 | |
| Python Microscope Software | Oxford University | https://www.python-microscope.org/ | |
| Scientific dry paper wipes | Kimberly-Clark 7551 | 2 | |
| SIM Reconstruction Software | softWoRx, GE Healthcare | Version 6.5.2 | |
| StitchM Software | Diamond Light Source | https://github.com/DiamondLightSource/StitchM | |
| TEM grids for samples | Quantifoil Micro Tools | G200F1 |
참고문헌
- Schermelleh, L., et al. Super-resolution microscopy demystified. Nature Cell Biology. 21 (1), 72-84 (2019).
- Ball, G., Demmerle, J., Kaufmann, R., Davis, I., Dobbie, I. M., Schermelleh, L. SIMcheck: A toolbox for successful super-resolution structured illumination microscopy. Scientific Reports. 5 (1), 15915 (2015).
- Kounatidis, I., et al. 3D Correlative cryo-structured illumination fluorescence and soft X-ray microscopy elucidates reovirus intracellular release pathway. Cell. 182 (2), 515-530 (2020).
- Gustafsson, M. G. L. Surpassing the lateral resolution limit by a factor of two using structured illumination microscopy. Journal of Microscopy. 198 (2), 82-87 (2000).
- Rego, E. H., Shao, L., Rego, E. H. Practical structured illumination microscopy. Methods in Molecular Biology. 1251, 1251 (2015).
- Phillips, M. A., et al. CryoSIM: super-resolution 3D structured illumination cryogenic fluorescence microscopy for correlated ultrastructural imaging. Optica. 7 (7), 802 (2020).
- Matsuda, A., Schermelleh, L., Hirano, Y., Haraguchi, T., Hiraoka, Y. Accurate and fiducial-marker-free correction for three-dimensional chromatic shift in biological fluorescence microscopy. Scientific Reports. 8, 7583 (2018).
- Kaufmann, R., Hagen, C., Grünewald, K. Fluorescence cryo-microscopy: current challenges and prospects. Current Opinion in Chemical Biology. 20, 86-91 (2014).
- Phillips, M. A., Pinto, D. M. S., Dobbie, I. M. SPEKcheck-fluorescence microscopy spectral visualisation and optimisation: a web application, javascript library, and data resource. Wellcome Open Research. 3, 92 (2018).
- Demmerle, J., et al. Strategic and practical guidelines for successful structured illumination microscopy. Nature Protocols. 12 (5), 988-1010 (2017).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유