Method Article
Криоструктурированное освещение Микроскопический сбор данных из криогенно сохраненных клеток
* Эти авторы внесли равный вклад
В этой статье
Резюме
Этот протокол демонстрирует, как получить изображения биологических криоконсервированных образцов с помощью криоструктурированной микроскопии освещения. Мы демонстрируем методологию путем визуализации цитоскелета клеток U2OS.
Аннотация
Трехмерная (3D) структурированная микроскопия освещения (SIM) позволяет визуализировать флуоресцентно меченые клеточные структуры с более высоким разрешением, чем обычная флуоресцентная микроскопия. Этот метод сверхвысокого разрешения (SR) позволяет визуализировать молекулярные процессы в целых клетках и может использоваться в сочетании с электронной микроскопией и рентгеновской томографией для корреляции структурной и функциональной информации. Sim-микроскоп для криогенно сохраненных образцов (cryoSIM) недавно был введен в эксплуатацию на коррелятивной криовизующей лучевой линии B24 в синхротроне Великобритании.
Он был разработан специально для 3D-визуализации биологических образцов при криогенных температурах способом, совместимым с последующей визуализацией тех же образцов методами рентгеновской микроскопии, такими как криомягмягкая рентгеновская томография. В этой видеостатье представлены подробные методы и протоколы для успешной визуализации с использованием cryoSIM. В дополнение к инструкциям по эксплуатации микроскопа cryoSIM были включены рекомендации относительно выбора образцов, флуорофоров и настроек параметров. Протокол продемонстрирован в образцах клеток U2OS, чьи митохондрии и тубулин были флуоресцентно помечены.
Введение
Методы визуализации SR стали широко доступными для биологов за последнее десятилетие1. Они позволяют визуализы с высоким разрешением флуоресцентно помеченных образцов за пределами дифракционного предела. Тем не менее, было сложно адаптировать методы SR-микроскопии для работы с образцами при криогенных температурах2. Это было бы выгодно для коррелятивной визуализации в сочетании с электронной или рентгеновской томографией. Недавно SIM-карта была адаптирована для использования с криогенными образцами и успешно показала, что позволяет проводить корреляционные исследования биологических клеток в сочетании с мягкой рентгеновской томографией (SXT)3 на коррелятивной криовизующей лучевой линии B24 на синхротроне с алмазным источником света (https://www.diamond.ac.uk/Instruments/Biological-Cryo-Imaging/B24.html). SIM-карта может удвоить разрешение обычной широкоугольной микроскопии, освещая образец полосатыми узорами света (муаровые бахромы) под тремя углами и в пять фаз. Интерференция между этими световыми паттернами и флуоресценцией образца может быть использована для вычислительного раскрытия дополнительной информации о субдифракционных структурах4,5.
Существует несколько преимуществ SIM-карты перед другими методами SR для криогенных приложений. Во-первых, он может работать без специально разработанных мигающих флуорофоров; можно использовать обычные флуорофоры, дающие доступ к более широкому спектру потенциальных флуоресцентных меток6. Кроме того, требуется только 15 изображений на z-срез (в 3D; 9 изображений для 2D), тогда как другие методы SR принимают около 1000 изображений на срез, увеличивая вероятность нагрева образца и, следовательно, увеличивая риск образования кристаллов льда, что может вызвать артефакты. Наконец, этот метод может визуалить более толстые биологические образцы более 10 мкм, что позволяет визуалить целые клетки в их почти родном состоянии6. CryoSIM был построен с использованием стандартных оптических компонентов и программного обеспечения открытого доступа для визуализации, что позволяет легко документировать и дублировать при желании6. КриоСИМ имеет объектив с числовой диафрагмой 100x/0.9 (см. Таблицу материалов); Дополнительная информация о его оптических компонентах, конструктивных параметрах и производительности была описана Phillips et al.6 Здесь этот протокол демонстрирует, как использовать микроскоп cryoSIM, включая как загружать и выгружать образцы на криогенной стадии, как собирать данные на микроскопе и как реконструировать изображения SIM-карты.
протокол
ПРИМЕЧАНИЕ: Этот протокол относится к образцам, содержащим клетки, выращенные или нанесенные на просвечивающую электронную микроскопию (ТЭМ) 3 мм плоские золотые решетки с дырявой углеродной опорной пленкой, которые были остеклоищны погружным замораживанием или замораживанием под высоким давлением. Этот протокол предполагает, что образцы уже были получены с использованием обычной эпифлуоресценции и микроскопа Brightfield для отображения мест, представляющих интерес для визуализации в cryoSIM. Обзор всего протокола см. на рисунке 1.
1. Подготовка крио-сцены
- Приготовьте жидкий азот без льда(LN 2),пропуская LN2 через воронку, выстлоненный любыми стандартными научными сухими бумажными салфетками.
ПРИМЕЧАНИЕ: Поскольку LN2 вызывает ожоги, при обращении с ним носите соответствующие средства индивидуальной защиты, включая криозащитные перчатки и очки. Такие жидкости могут вытеснять кислород и вызывать быстрое удушье и должны обрабатываться в правильно проветриваемом помещении. - Удалите поверхностную пыль с криоступенчатой с помощью сжатого воздуха. Перед использованием выталкивать жидкость из баллона с воздухом под давлением.
- Убедитесь, что картридж с загрузкой образца установлен с соответствующим патроном для образцов (убедитесь, что в держателе образца не осталось сетки от предыдущего эксперимента)(рисунок 2).
- Снимите крышку с внешнего дьюара криоступенчаты, и залейте фильтрованный LN2 примерно до 1/4-й полноты. Подождите, пока первоначальное кипение не спадет, прежде чем наливать еще; заполнить сосуд примерно до2/3-го полного. Осторожно замените крышку, отведя сопло в сторону от обработчика и сцены/оптики, в то время как LN2 выкипает из розетки.
- Как только LN2 перестанет выходить из розетки, поместите выходную трубу над сценой dewar на крио-сцену.
- Подключите источник питания рабочей стадии и подключите USB-кабель к криоаэсхе. Убедитесь, что крышка камеры с подогревом проб подключена. Подключите внешний дьюар к рабочей стадии.
ПРИМЕЧАНИЕ: Не подключайте внешний дьюар до тех пор, пока выходная труба не будет расположена над ступенью дьюара на крио-сцене. Если LN2 переполняется (или чтобы предотвратить его переполнение), вытащите кабель USB на ~ 10 с, дайте ему уравновесить и снова подключите кабель USB для повторной активации датчика. - После того, как LN2 будет доставлен в стадию dewar, нажмите кнопку отпуска на крио-сцене, чтобы позволить LN2 войти в камеру образца.
ПРИМЕЧАНИЕ: Не оставляйте систему без присмотра, пока LN2 заполняет камеру. - Подождите ~30-45 минут, чтобы система остыла и стабилизировала, прежде чем начать сбор изображения. Периодически проверяйте внешний дьюар и пополняйте его отфильтрованным LN2, если он заполнен менее чем на четверть (примерно каждый час).
2. Перенос ящика для хранения образцов в криоступенчатую
ПРИМЕЧАНИЕ: Погрузите ящик для хранения образцов, держатель и наконечники любых инструментов (например, щипцов) внутрь отфильтрованного LN2 для их охлаждения перед прикосновением к любым холодным поверхностям, таким как образец или любые объекты внутри камеры для отбора проб. Надевайте лабораторное пальто и перчатки при обращении с биологическими образцами.
- Убедитесь, что остеклованные образцы находятся в крио-совместимом контейнере, и поднесите их к микроскопу. Нажмите соответствующую кнопку на крио-сцене, чтобы включить свет в камере для отбора проб.
- Используйте шестигранную клавишу на кассетном инструменте, чтобы открыть две пластины кассеты для передачи образцов. Открывайте пластины достаточно широко, чтобы упасть в сетку между двумя пластинами, но избегайте открытия в максимально открытом положении, чтобы предотвратить падение сетки через другую сторону.
- Используйте длинные щипцы, чтобы поднять ящик сетки образцов из LN2,повернуть его там, где выемка выравнивается с положением места хранения внутри сцены, и поместить его на сцену. Используйте соответствующее устройство (например, отвертку), чтобы открыть крышку ящика для хранения в правильном положении образца.
- Используя перевернутые щипцы (или любые хирургические щипцы с тонким наконечником), снимите сетку TEM с держателя образца, погрузите ее внутрь LN2и опустите ее в положение в кассете передачи образца, сохраняя близко к LN2 во время процесса передачи. Убедитесь, что сторона углеродной пленки размещена так, чтобы она в конечном итоге была обращена к цели на мосту образца.
- Закройте картридж для образцов с помощью шестигранного ключа на кассетном инструменте. Закройте и извлеките ящик для хранения вместе со оставшимися образцами.
- Используйте магнитную точку на кассетном инструменте, чтобы поднять и установить картридж, содержащий сетку, на мостик образца. Держите его погруженным / близким к LN2 во время процесса передачи. Убедитесь, что ориентация соответствует мосту (два магнита будут контактировать с магнитами на мосту). Поместите кассету плашмя в позиционные штифты моста и осторожно толкните, чтобы убедиться, что она закреплена.
ПРИМЕЧАНИЕ: Образец кассеты для обрезанных сеток, которые были подготовлены для последующего фрезерования сфокусированного ионного пучка, также доступен на установке CryoSIM на линии луча B24.
3. Стыковка и фокусировка сцены
- Переместите отверстие крышки криоступенчатых в положение изображения и выключите свет камеры образца. Сдвиньте сцену к оптике, чтобы выровнять ее под объективом. Осторожно опустите объектив в нужное положение с помощью рычага, следя за тем, чтобы он лежал внутри крышки криоступенчаты, но не касался ее.
ПРИМЕЧАНИЕ: Убедитесь, что внешняя выходная труба Дьюара не касается стадии дьюара на крио-стадии в любой момент во время сбора данных. - Накройте сцену и оптику непрозрачным черным занавесом. Запустите управляя программным обеспечением Cockpit на ПК cryoSIM(рисунок 3 и рисунок 4).
- Нажмите на кнопку режима считывания для каждой камеры и установите для нее CONV 3 МГц. Убедитесь, что температура каждой камеры составляет -80 °C, а вентилятор камеры выключен.
- Включите отраженную камеру. В разделе Освещениевыберите окружающую среду (экспозиция 20 мс), а в разделе linkamнажмите на конденсатор. Нажмите на кнопку Режим видео.
- В окне Представления мозаики уменьшите масштаб (прокрутите мышью), чтобы увидеть контур сетки. Нажмите на Найти сцену, если она не видна. Центрирование сетки двойным щелчком левой кнопкой мыши в середине круга.
- Сфокусировать образец до тех пор, пока пленка поддержки сетки (или любая другая соответствующая функция образца) не будет в фокусе, используя клавиши вверх и вниз крио-сцену для перемещения крио-сцены вверх и вниз и используя клавиши 9 и 3 на цифровой панели для изменения z-шага (установите его на 20 мкм для начальной фокусировки).
ПРИМЕЧАНИЕ: Если у пользователя заканчивается ход в z, ступень может быть вручную перемещена вверх или вниз с помощью колеса под крио-ступенькой. Поворачивайте его на одну выемку за раз и проверяйте, находится ли образец в пределах диапазона обзора. Измените направление снова, если фокусировка ухудшается.
4. Приобретение мозаики Брайтфилд
- Как только сцена будет центрирована, отключите режим видеои соберите мозаику видимого света (нажмите «Запустить мозаику» в представлении «Мозаика», чтобы создать плитки изображений видимого света, которые спирально выходят наружу от центра). Если сетка изогнута, попробуйте использовать различные положения на сетке (двойной щелчок левой кнопкой мыши в представлении мозаики),перефокусировать и снова щелкнуть Запустить мозаику, чтобы собрать частичные мозаики. Кроме того, можно вставить сфокусированное изображение поверх мозаики(рисунок 3).
- Сохраните представление, нажав на Кнопку Сохранить мозаику. Присвойте ему короткое имя файла, содержащее информацию о ящике хранилища и соответствующий номер сетки (к имени файла будет автоматически добавлена метка времени).
5. Определение областей, представляющих интерес
- Осмотрите мозаику яркого поля вместе с любыми предыдущими изображениями флуоресцентной «карты» на предмет того, где ранее находились клетки или биологические объекты, представляющие интерес. Проверьте, производят ли эти области подходящую флуоресценцию.
- Выключите окружающий свет и конденсатор, а также видеорежим, если он активен. Включите требуемый лазер возбуждения (405, 488, 561 или 647) и выберите соответствующую камеру и фильтр,первоначально на 50 мВт, для времени экспозиции 50 мс.
ПРИМЕЧАНИЕ: Увеличение/уменьшение этих настроек камеры и фильтра в зависимости от флуоресцентного сигнала. - Нажмите 0, чтобы сделать снимок изображения, и * для автоматической контрастности. Кроме того, можно вручную настроить контрастность с помощью ползунка в нижней части изображения.
ПРИМЕЧАНИЕ: Включите знак Laser on для комнаты. - Как только биологически интересные клетки с подходящей флуоресценцией будут найдены, отметьте их положение с помощью кнопки «Пометить участок» в представлении Mosaic.
ПРИМЕЧАНИЕ: Эти отмеченные сайты появятся во вложенном списке и могут быть доступны, дважды щелкнув по координатам. При возврате на отмеченный сайт увеличьте масштаб области, прежде чем дважды щелкнуть. - Продолжайте отмечать все потенциальные участки, прежде чем начать сбор изображений. Повторно сохраните мозаику с отмеченными сайтами; нажмите Сохранить сайты в файл.
- Чтобы сшить мозаичные изображения вместе с помощью программного обеспечения StitchM (разработанного в Beamline B24), перетащите файл мозаики .txt в файл StitchM с расширением .bat и сохраните объединенное изображение мозаики в той же папке. Чтобы сохранить изображение с отмеченными сайтами, перетащите файл мозаики.txt и маркеры.txt файл в значок одновременно.
ПРИМЕЧАНИЕ: Сбалансируйте сбор данных с потребностями проекта (например, если будет выполнена корреляционная визуализация, проверьте, сколько изображений может быть сделано с помощью метода визуализации партнера, и выберите соответствующее количество сайтов для визуализации cryoSIM). Кроме того, если внешний дьюар требует заправки LN2, криоступенчатая система изменит положение, и отмеченные участки, скорее всего, не вернутся в те же места; поэтому учитывайте это при выборе количества сайтов, которые будут изображены.
- Чтобы сшить мозаичные изображения вместе с помощью программного обеспечения StitchM (разработанного в Beamline B24), перетащите файл мозаики .txt в файл StitchM с расширением .bat и сохраните объединенное изображение мозаики в той же папке. Чтобы сохранить изображение с отмеченными сайтами, перетащите файл мозаики.txt и маркеры.txt файл в значок одновременно.
- Выключите окружающий свет и конденсатор, а также видеорежим, если он активен. Включите требуемый лазер возбуждения (405, 488, 561 или 647) и выберите соответствующую камеру и фильтр,первоначально на 50 мВт, для времени экспозиции 50 мс.
6. Стратегия сбора данных
- Установите время лазерной экспозиции на основе счетчиков в динамическом диапазоне флуоресцентного изображения (в нижней части окна просмотра камеры). Выберите, какой фильтр применить, и оптимизируйте эти настройки для каждой длины волны используемого света возбуждения, включив каждый лазер отдельно.
ПРИМЕЧАНИЕ: Хотя 10 000-20 000 подсчетов являются оптимальными, более низкие показатели приемлемы, если есть хороший контраст. В идеале, проверьте настройки фильтра перед получением каждого стека изображений, поскольку ячейки в разных областях сетки могут иметь переменные уровни флуоресценции.
7. Сбор данных
- Нажмите на обе камеры, чтобы включить их. Вернитесь на один из отмеченных участков, и снова сосредоточьтесь на нужной глубине. Оказавшись в фокусе в интересуемой области, переместите фокус из фокуса вверх (клавиша↑ ) в окне XY в макросхеме, чтобы выбрать высоту стека z для получения, и нажмите Сохранить сверху. Переместите фокус с фокуса вниз (↓ клавиша), нажмите Сохранить внизу, а затем на Перейти к центруи проверьте, что изображение все еще в фокусе.
ПРИМЕЧАНИЕ: Высота образца будет показана в окне. - Щелкните правой кнопкой мыши на slm (пространственный модулятор света) в окне кабины и убедитесь, что угол установлен на уровне 0,41. В окне Cockpit выберите Эксперимент с одним сайтом.
ПРИМЕЧАНИЕ: Не нажимайте на slm на; Кабина автоматически включит его во время получения изображения.- В раскрывающемся списке выберите Структурированное освещение. Измените высоту стека таким образом, чтобы она равняется высоте z + 1 мкм.
ПРИМЕЧАНИЕ: Добавление 1 мкм обеспечивает захват всего образца в z и сводит к минимуму артефакты реконструкции. - Введите время экспозиции (мс) для лазеров 405 нм и 488 нм в верхнем ряду (для отраженной камеры) и время экспозиции для лазеров 561 нм и 647 нм в нижнем ряду (для передаваемой камеры).
ПРИМЕЧАНИЕ: Значения времени экспозиции должны совпадать со значениями, указанными ранее и показанными в главном окне кабины. - Введите имя файла (соглашение об именовании: box number_grid area_filters_FL) (FL (флуоресценция) или BF (brightfield) в зависимости от типа выполняемой визуализации). Нажмите «Обновить», чтобы создать новый файл, содержащий дату и время, без перезаписи предыдущих файлов. Затем нажмите кнопку Пуск.
- В раскрывающемся списке выберите Структурированное освещение. Измените высоту стека таким образом, чтобы она равняется высоте z + 1 мкм.
- Проверьте представление камеры во время сбора данных. Повторно сделайте снимки, если есть смещение xy. Если LN2 dewar заправляет крио-стадию во время получения изображения, прервайте процесс, нажав кнопку «Аборт» в программном обеспечении Cockpit.
- Как только внешний дьюар закончит заправку ступени дьюара, повторите эксперимент, потому что заправка смещает образец вертикально. Перефокусируйте изображение, чтобы перецентрировать его в z, и повторите эксперимент с одним сайтом. Повторите эксперимент с одним сайтом для всех необходимых комбинаций лазеров и фильтров.
ПРИМЕЧАНИЕ: Для завершения заправки требуется около 30 с-1 мин. Во время визуализации одной сетки, заправка будет происходить ~4-8x.
- Как только внешний дьюар закончит заправку ступени дьюара, повторите эксперимент, потому что заправка смещает образец вертикально. Перефокусируйте изображение, чтобы перецентрировать его в z, и повторите эксперимент с одним сайтом. Повторите эксперимент с одним сайтом для всех необходимых комбинаций лазеров и фильтров.
- В каждой позиции соберите z-стек, используя видимый свет.
- Выключите лазеры и включите окружающий свет и конденсатор. В разделе Эксперимент с одним сайтомвыберите Z-стек, установите для параметра Окружающий свет значение экспозиции 20 мс и сохраните высоту z, как указано выше.
- Повторите шаги с 7.2 по 7.4 для всех сайтов, отмеченных в сетке.
- Перед переходом к другому образцу удалите мозаику, щелкнув Удалить плитки.
- Нарисуйте квадрат вокруг всех плиток, чтобы удалить их. Удалите маркеры, выбрав их все в списке, а затем нажав на Удалить выбранные сайты.
- Выключите окружающий свет и конденсатор, прежде чем приступить к смене сетки. Выполните действия, описанные в разделе 4, в обратном порядке, чтобы отстыковывать сцену из-под цели и изменить сетку.
8. После визуализации
- После завершения обработки изображения отстыкуйте этап и удалите все образцы. Выключите свет камеры для отбора проб. Отключите внешний дьюар и декантировать оставшийся LN2 в другой крио-совместимый контейнер, что позволит дьюалю безопасно вернуться к нормальной температуре.
- Поместите заглушку крышки на крио-сцену. Подождите, пока опция выпекания крио-сценического дисплея станет доступной после того, как в стадии dewar больше не останетсяLN 2. Нажмите кнопку выпекания, чтобы войти в режим нагрева, и удалите влагу из крио-стадии, чтобы избежать образования льда.
9. Реконструкция
- Передача необработанных файлов данных SIM-карты на соответствующую рабочую станцию для реконструкции. Запускайте обработку пакетами через окно Processing Task builder с использованием специфических для канала оптических передаточных функций (OTFS) (вычисляемых из многофлуоресцентных функций разброса точек бусин) и углов K0 (0,29278, -1,8028, 2,3786) с постоянным фильтром Винера для всех каналов 0,004 и смещением смещения 200.
- На панели Дополнительные параметры убедитесь, что отрицательные интенсивности отброшены, не удерживая других параметров. Сохраните изображения SIR в папку с именем "обработано".
ПРИМЕЧАНИЕ: Коммерческое программное обеспечение для реконструкции SIM-карты обычно производит реконструированные ДАННЫЕ SIM-карты и сохраняет имя файла, но добавляет SIR.dv в конце. Также создается файл журнала, содержащий протокол обработки, шаги и статистическую информацию об успешном восстановлении.
10. Коррекция хроматического сдвига
- Скачайте программное обеспечение Chromagnon7 для коррекции хроматического сдвига.
- Используйте эталонную матрицу хроматического сдвига, которая соответствует длинам волн флуоресценции собранных данных (обеспечиваемых линией луча).
ПРИМЕЧАНИЕ: Справочный файл представляет собой файл 'chromagnon.csv', который содержит параметры выравнивания и был получен из калибровочных изображений с использованием мультифлуоресцентных наночастиц. Его можно использовать для пакетной обработки нескольких наборов данных одновременно.- Выберите соответствующий файл ссылок, который соответствует длине волны лазера и фильтру, используемому для визуализации образца, и добавьте его в поле ссылки. Добавьте восстановленные данные SIR для выравнивания в исходное поле и нажмите кнопку Выполнить.
- Убедитесь, что флуоресцентный сигнал теперь выровнен на изображениях. Для пакетной обработки поместите все изображения SIR, которые должны быть выровнены, в исходное поле и файл ссылки в поле ссылки и нажмите Выполнить все.
Результаты
Образец, содержащий клетки U2OS, окрашивали смесью зеленого микротрубочного цитоскелетного красителя и красного красителя митохондрий, в результате чего окрашивался компонент микротрубочек цитоскелета (зеленый) и митохондрий (красный). Последующая визуализация показала локализацию митохондрий внутри клетки, а также расположение микротрубочек, подчеркнув структурный каркас, который они обеспечивают клетке, и сборку цитоскелета вокруг органелл, таких как ядро. Разрешение в cryoSIM значительно выше, чем в стандартной эпифлуоресцентной микроскопии(рисунок 5). На рисунке 6 показано, как флуоресцентная «карта» из обычного эпифлуоресцентного микроскопа может быть использована для определения местоположения областей, представляющих интерес для визуализации, и соответствующего криоСИМ-реконструированного изображения из места на сетке.
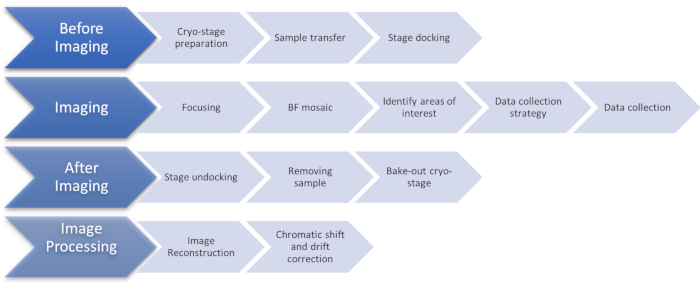
Рисунок 1:Блок-схема, показывающая этапы протокола визуализации cryoSIM. Аббревиатура: cryoSIM = Криоструктурированная микроскопия освещения. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 2:Криоступенчатая установка. (A) Установка крио-ступени. (B)Сетка образцов, показанная на перевернутых щипцах. (C)Компоненты криоступенчатой. Порты подключения маркированы цветами, соответствующими оранжевому: блок питания, желтый: нагретая крышка сцены, синий: внешний дьюар, зеленый: подключение к ПК. Сокращения: ПК = персональный компьютер; LN2 = жидкий азот. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
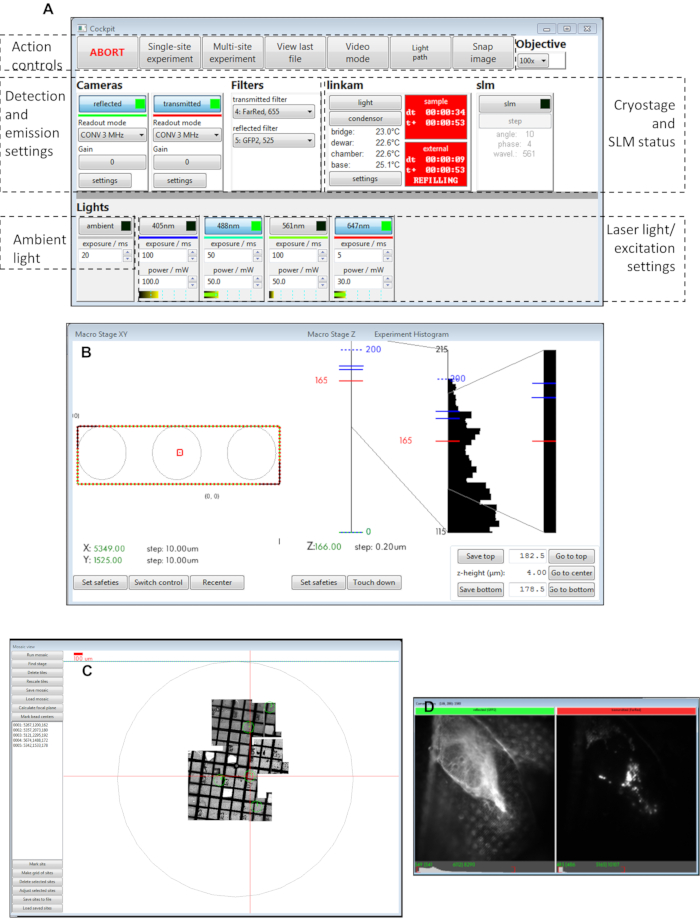
Рисунок 3:Виды программных панелей кабины пилотов. (A) Основная панель, (B) макроступенчата XY, (C) мозаичный вид, (D) вид камеры. Аббревиатура: SLM = пространственный модулятор света. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
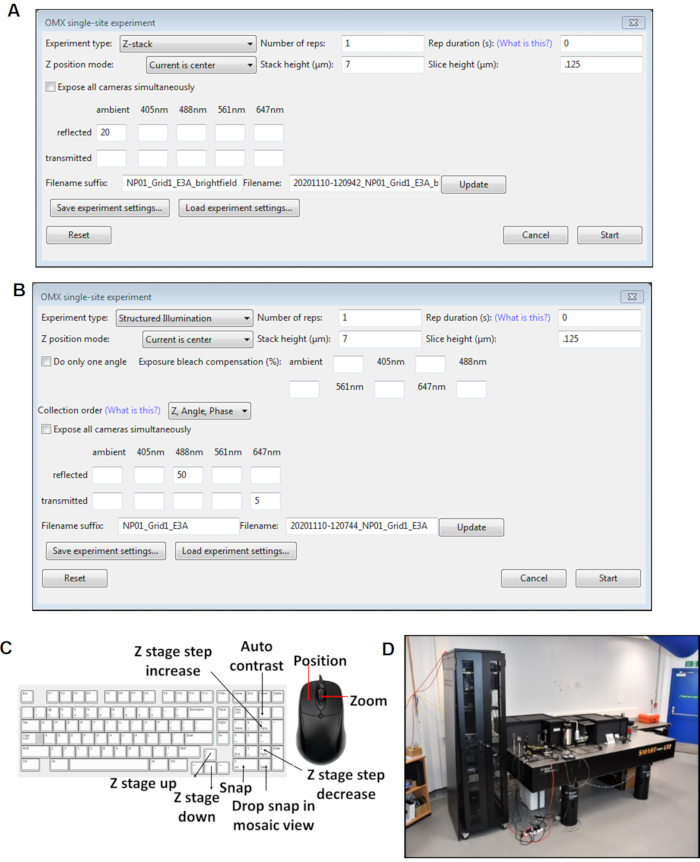
Рисунок 4:Виды программных панелей Cockpit. (A) Z стек один сайт эксперимент. (B) Эксперимент с одним сайтом СИ. (C) Сочетания клавиш для программного обеспечения кабины, используемого во время получения изображения. (D)Микроскоп cryoSIM находится на месте на линии луча B24 на синхротроне Diamond Light Source. Аббревиатура: cryoSIM = Криоструктурированная микроскопия освещения. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
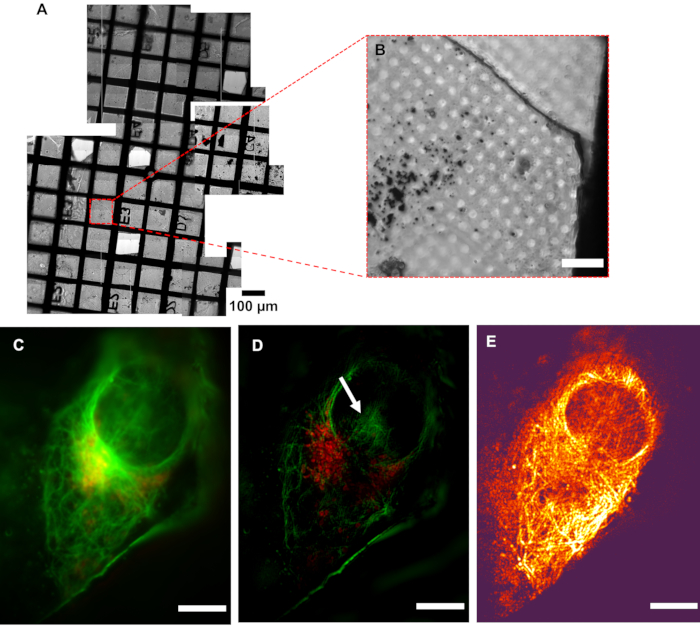
Рисунок 5:Разрешение криоСИМ. (А) Мозаичный вид рассматриваемой сетки. (B)Брайтфилд изображение области интересов (AOI). (C) Псевдоширокополевое изображение по сравнению с его(D)SIM-изображением, показывающим увеличение разрешения. Белая стрелка указывает на артефакты реконструкции SIM-карты. (E) Контрастная карта модуляции, объединяющая информацию об интенсивности пикселей реконструированного изображения с цветовой информацией соответствующих значений коэффициента контрастности модуляции к шуму (MCNR) необработанных данных, генерируемых SIMCheck2. Светлые и темные области показывают высокую и низкую контрастность соответственно. Шкала шкалы = 10 мкм. Настройки визуализации CryoSIM: длины волн возбуждения/излучения: 488/525 нм, мощность лазера 50 мВт, время экспозиции 50 мс и 647/655 нм, мощность лазера 20 мВт, время экспозиции 5 мс. Аббревиатура: cryoSIM = Криоструктурированная микроскопия освещения. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 6:Реконструкция изображения в криоСИМ из места на сетке в флуоресцентной карте из обычной карты эпифлуоресценции. (A,B) Наложение карт изображений яркого поля и флуоресценции, сгенерированных с помощью обычного эпифлуоресцентного микроскопа. Эта карта используется для определения местоположения областей, представляющих интерес для последующего изображения в cryoSIM. (C) Реконструированное изображение cryoSIM, полученное в месте, указанном в (B). Аббревиатура: cryoSIM = Криоструктурированная микроскопия освещения. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Обсуждение
3D SIM при криогенных температурах имеет много преимуществ перед другими методами визуализации SR для визуализации остеклованного биологического материала. Это требует значительно меньше изображений на z-срез по сравнению с другими методами SR, что приводит к меньшему облучению и более низкой вероятности образования кристаллов льда для остеклованных образцов. Он также способен визуать целые клетки и может быть коррелирован с рентгеновской томографией, чтобы сопоставить структуру с функцией. Интересно, что большинство коммерчески доступных флуорофоров и флуоресцентных меток отбеливают меньше при криогенных условиях, чем при комнатной температуре. Однако, учитывая высокий квантовый выход наиболее распространенных флуорофоров при комнатной температуре (более 80% в некоторых случаях), абсолютный прирост, обнаруженный в фотонах, обусловлен не изменениями квантового выхода, а снижением сложных процессов отбеливания. Более подробную информацию об урожайности флуорофоров при криогенных температурах можно найти в 8.
Крайне важно, чтобы образцы, поступающие на криоСИМ, были предварительно отображены с использованием обычного криофлуоресцентного микроскопа с возможностью яркого поля для создания «карты» сетки, которая включает в себя выделение всех потенциальных АОИ для дальнейшей визуализации(рисунок 5). Время доступа к cryoSIM распределяется через конкурсный процесс, который включает в себя подачу предложения, которое впоследствии оценивается на осуществимость техники и биомедицинский эффект. Таким образом, время на оборудование всегда «на высоте», а предварительно нанесенные на карту сетки позволяют наиболее эффективно использовать распределение. Также важно, чтобы образец поддерживался остеклованным, особенно во время передачи образца от держателя образца к платформе визуализации, чтобы свести к минимуму образование кристаллов льда и последующее повреждение образца. Образец должен быть хорошего качества, чтобы получить лучшие изображения SIM-карты. Хорошо подготовленный образец будет характеризоваться следующими признаками: а) он не будет загрязнен кристаллами льда, b) используемая сетка будет представлять собой сетку искателя, в) носитель будет плоским, г) сетка сетки и поверхность подложки не будут автофлуоресцентными и е) не будет разрывов в опорной мембране. Эти предпосылки могут быть достигнуты путем тщательного обращения с образцами и обеспечения того, чтобы образцы всегда оставались остеклованными.
Важно заранее проверить, будет ли предлагаемый образец флуорофоров давать достаточный сигнал в микроскопе cryoSIM. Такие инструменты, как SPEKCheck9, могут помочь в выборе оптимальных комбинаций флуорофоров и фильтров. Если есть проблемы со сбором необработанных данных или процессом реконструкции, артефакты могут появиться на изображениях после реконструкции. Примеры различных артефактов были задокументированы Demmerle et al.10 Параметры реконструкции изображения можно просмотреть в файле журнала SoftWoRx, если реконструкция не является оптимальной, открыв файл сводки реконструкции. В данном канале должно быть последовательное расстояние между линиями между углами и относительно постоянная амплитуда. Вариация более 30% и значения значительно выше 1 (если применяется компенсация размера бусины) должны быть более тщательно изучены и, вероятно, будут указывать на неудачные реконструкции. Кроме того, программное обеспечение SIMcheck2 на Фиджи также может использоваться для выполнения различных проверок необработанных и реконструированных данных для диагностики причин ошибок в настройках параметров визуализации или реконструкции. SIM-проверка и ее контрастная карта модуляции также могут помочь в оценке качества реконструированных данных, интерпретируя, какие области изображения могут быть реальными структурами по сравнению с артефактами.
Низкий контраст модуляции (показанный темным цветом на рисунке 5E)в ядерной области означает, что эта область будет более восприимчива к артефактам реконструкции, что подразумевает, что хэш-паттерны, показанные в ядре, могут быть классифицированы(рисунок 5D)как артефакт. Сильные области флуоресцентного сигнала с большей вероятностью точно отражают собственные структуры в обрабатываемых данных. В областях слабого сигнала, где флуорофоры распределены по более широким областям, таким как общая поверхность везикулы, вполне вероятно, что реальный сигнал сосуществует с артефактами обработки, и следует проявлять осторожность при интерпретации этих данных. После проверки полнодиагнальных реконструированных данных, чтобы убедиться, что нет странных артефактов, и что фон, как правило, гауссов и центрирован около нуля, данные обычно обрезаются при нуле, или модальное значение - пик фонового сигнала - должно быть очень близко к нулю. Это гарантирует, что в динамическом диапазоне отображаемого изображения не будут доминировать артефакты отрицательного фона. Когда ожидается более слабый сигнал, следует проявлять особую осторожность при анализе признаков и обеспечении того, чтобы они были реальными структурами, а не артефактами реконструкции.
Существуют некоторые ограничения системы визуализации. Поскольку стадия выборки плоская, образцы с переменной толщиной или сетками, которые не являются плоскими, не являются идеальными объектами для визуализации. Кроме того, если коррелятивная визуализация будет выполнена с использованием мягкой рентгеновской томографии, клетки вблизи границ сетки не должны быть изображены, поскольку они не будут видны в рентгеновском микроскопе во время получения серии наклона. Наконец, количество промокания образца перед погружением замерзания оказывает значительное влияние на качество изображения; слишком малое пятно приводит к слишком толстым образцам, дающим неоптимальные SIM-изображения с высоким фоновым шумом, в то время как слишком большое пятно может привести к деформированию клеток и, следовательно, более восприимчивы к тепловому повреждению от падающего лазерного луча. Таким образом, cryoSIM является мощным инструментом флуоресцентной микроскопии для визуализации биологических образцов в 3D на почти нативной стадии и имеет широкий спектр применения во многих областях.
Раскрытие информации
Авторы заявляют об отсутствии конкурирующих финансовых интересов.
Благодарности
Этот проект получил финансирование от проекта Европейской комиссии Horizon 2020 iNEXT-Discovery. И.M. Добби признает финансирование от Wellcome Trust (107457/Z/15/Z). Эта работа проводилась при поддержке Diamond Light Source, прибора B24 (предложение BI25512). Мы благодарим сотрудников Micron и всех наших превосходных пользователей и сотрудников за помощь в создании cryoSIM и его коррелятивного потенциала.
Материалы
| Name | Company | Catalog Number | Comments |
| Auto grids | FEI | ||
| Autogrids | Thermo Fisher Scientific | 1036173 | |
| BioTracker 488 Green Microtubule Cytoskeleton Dye | Sigma-Aldrich | SCT142 | |
| Cockpit Software | Oxford University | https://github.com/MicronOxford/cockpit | |
| cryo compatible polyurethane container | Jena bioscience | CC-FD-800 | |
| Cryo TEM grid storage box | Thermo Fisher Scientific | Model#AutoGrid | |
| cryo-SIM microscope | Custom made | N/A | Custom made, see following reference for the design: Michael A. Phillips, Maria Harkiolaki, David Miguel Susano Pinto, Richard M. Parton, Ana Palanca, Manuel Garcia-Moreno, Ilias Kounatidis, John W. Sedat, David I. Stuart, Alfredo Castello, Martin J. Booth, Ilan Davis, and Ian M. Dobbie, "CryoSIM: super-resolution 3D structured illumination cryogenic fluorescence microscopy for correlated ultrastructural imaging," Optica 7, 802-812 (2020). Has a Nikon TU Plan Apo 100x/0.9 NA. |
| Cryostage system | Linkam Scientific Instruments | CMS196 | |
| Fine tip surgical forceps | Ted Pella | 38125 | |
| MitoTracker Deep Red FM | Thermo Fisher Scientific | M22426 | |
| Python Microscope Software | Oxford University | https://www.python-microscope.org/ | |
| Scientific dry paper wipes | Kimberly-Clark 7551 | 2 | |
| SIM Reconstruction Software | softWoRx, GE Healthcare | Version 6.5.2 | |
| StitchM Software | Diamond Light Source | https://github.com/DiamondLightSource/StitchM | |
| TEM grids for samples | Quantifoil Micro Tools | G200F1 |
Ссылки
- Schermelleh, L., et al. Super-resolution microscopy demystified. Nature Cell Biology. 21 (1), 72-84 (2019).
- Ball, G., Demmerle, J., Kaufmann, R., Davis, I., Dobbie, I. M., Schermelleh, L. SIMcheck: A toolbox for successful super-resolution structured illumination microscopy. Scientific Reports. 5 (1), 15915 (2015).
- Kounatidis, I., et al. 3D Correlative cryo-structured illumination fluorescence and soft X-ray microscopy elucidates reovirus intracellular release pathway. Cell. 182 (2), 515-530 (2020).
- Gustafsson, M. G. L. Surpassing the lateral resolution limit by a factor of two using structured illumination microscopy. Journal of Microscopy. 198 (2), 82-87 (2000).
- Rego, E. H., Shao, L., Rego, E. H. Practical structured illumination microscopy. Methods in Molecular Biology. 1251, 1251 (2015).
- Phillips, M. A., et al. CryoSIM: super-resolution 3D structured illumination cryogenic fluorescence microscopy for correlated ultrastructural imaging. Optica. 7 (7), 802 (2020).
- Matsuda, A., Schermelleh, L., Hirano, Y., Haraguchi, T., Hiraoka, Y. Accurate and fiducial-marker-free correction for three-dimensional chromatic shift in biological fluorescence microscopy. Scientific Reports. 8, 7583 (2018).
- Kaufmann, R., Hagen, C., Grünewald, K. Fluorescence cryo-microscopy: current challenges and prospects. Current Opinion in Chemical Biology. 20, 86-91 (2014).
- Phillips, M. A., Pinto, D. M. S., Dobbie, I. M. SPEKcheck-fluorescence microscopy spectral visualisation and optimisation: a web application, javascript library, and data resource. Wellcome Open Research. 3, 92 (2018).
- Demmerle, J., et al. Strategic and practical guidelines for successful structured illumination microscopy. Nature Protocols. 12 (5), 988-1010 (2017).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены