Method Article
低温结构照明微观数据收集来自低温保存细胞
* 这些作者具有相同的贡献
摘要
该协议演示了如何使用低温结构照明显微镜对生物低温保存样品进行成像。我们通过成像 U2OS 细胞的细胞骨骼来演示该方法。
摘要
三维 (3D) 结构照明显微镜 (SIM) 允许以高于传统荧光显微镜的高分辨率成像荧光标记的细胞结构。这种超分辨率 (SR) 技术能够可视化整个细胞中的分子过程,并有可能与电子显微镜和 X 射线断层扫描相结合,将结构和功能信息关联在一起。英国同步加速器的相关低温成像光束线B24最近委托了一台用于低温保存样品(cryoSIM)的SIM显微镜。
它专为低温下生物样本的3D成像而设计,其方式与随后通过X射线显微镜(如低温X射线断层扫描)对相同样本的成像相容。本视频文章提供了使用低温SIM成功成像的详细方法和协议。除了关于低温SIM显微镜操作的说明外,还就样品的选择、荧光和参数设置提出了建议。该协议在U2OS细胞样本中得到证明,这些细胞样本的线粒体和管蛋白被荧光标记。
引言
在过去的十年里,SR成像技术已经为生物学家们广泛所接受。它们允许对荧光标记的样品进行高分辨率成像,使其超过衍射极限。然而,在低温温度2下调整SR显微镜方法与样品配合工作是一项艰巨的工作。这将有利于与电子或X射线断层扫描相结合的相关成像。最近,SIM已适应低温样品的使用,并已成功证明能够结合软X射线断层扫描(SXT)3在钻石光源同步加速器(https://www.diamond.ac.uk/Instruments/Biological-Cryo-Imaging/B24.html)的相关低温成像光束线B24对生物细胞进行相关研究。SIM 可以通过在三个角度和五个阶段用条纹光模式(Moiré 边缘)照亮样品,使传统广域显微镜的分辨率翻倍。这些光模式和样品荧光之间的干扰可以用来计算发现关于亚衍射结构4,5的额外信息。
与其他低温应用 SR 技术相比,SIM 有几个优点。首先,它可以工作,没有专门设计的闪烁荧光:传统的荧光剂可以使用,使访问更广泛的潜在的荧光标记剂6。此外,它只需要每 z 切片 15 张图像(3D 中;2D 中 9 张图像),而其他 SR 方法每片需要大约 1000 张图像,从而增加样品被加热的机会,从而增加冰晶形成的风险,从而导致人工制品。最后,这项技术可以成像超过10μm的更厚的生物样本,使整个细胞在其近原生状态6成像。低温SIM是使用标准光学元件和开放访问软件构建的成像,因此,如果需要,可以轻松记录和复制。低温SIM具有100x/0.9数值孔径目标(参见 材料表):Phillips 等人介绍了有关其光学元件、设计参数和性能的进一步信息。 在此,本协议演示了如何使用低温SIM显微镜,包括如何在低温舞台上装载和卸载样品、如何收集显微镜上的数据以及如何重建 SIM 图像。
研究方案
注:本协议涉及包含在传输电子显微镜 (TEM) 3 mm 平金网格上生长或沉积的细胞的样本,该样本带有孔碳支持膜,通过骤降冻结或高压冻结进行细化。该协议假定样品已经使用传统的表观和亮场显微镜进行成像,以绘制低温SIM成像感兴趣的位置。有关整个协议的概述,请参阅图 1。
1. 低温阶段的准备
- 通过任何标准科学干纸湿巾衬砌的漏斗,通过 LN2来制备无冰液氮 (LN2)。
注意:由于 LN2导致烧伤,在处理时应佩戴适当的个人防护设备,包括防冻手套和护目镜。这种液体可能会取代氧气并导致快速窒息,应在适当通风的区域处理。 - 用加压空气从低温阶段去除表面灰尘。使用前将液体从加压空气容器中排出。
- 确保样品加载盒与适当的室装样品支架(检查之前实验中的样品支架中是否留有网格)(图2)。
- 从低温阶段的外部去瓦尔中取出盖子,倒入过滤过的 LN2,直到大约满 1/4。 等到最初的沸腾消退,然后再浇注更多;将容器填充到大约2/3 满。小心地更换盖子,将喷嘴指向远离处理器和舞台/光学,而 LN2则从插座中沸腾出来。
- 一旦 LN2停止从出口中流出,将出口管放在低温舞台上的舞台上。
- 插入舞台电源,将 USB 电缆连接到低温级。确保加热的样品室盖插入。将外部德瓦尔插入舞台。
注意:在出口管被放置在低温舞台上的舞台脱瓦尔之前,不要插入外部去瓦尔。如果 LN2 溢流(或防止其溢出),请取出 USB 电缆 10 s,使其平衡,并重新连接 USB 电缆以重新激活传感器。 - LN2送入分战阶段后,按低温阶段的释放按钮,允许 LN2进入样品室。
注意:当 LN2 充满腔室时,不要让系统无人看管。 - 等待 +30-45 分钟,让系统冷却和稳定,然后再开始图像采集。定期检查外部去战,并充值过滤LN2, 如果它少于四分之一满(大约每小时)。
2. 将样品存储盒转移到低温阶段
注:将样品存储盒、支架和任何仪器(如钳子)的尖端浸入过滤过的 LN2 中,在接触样品或样品室内的任何物体等冷表面之前冷却它们。处理生物样本时,应穿一件实验室外套和手套。
- 确保体格化样品在一个与低温相容的容器中,并将它们带到显微镜中。按低温台上的相应按钮,打开样品室中的灯。
- 使用盒式磁带工具上的六角钥匙打开样品转移盒的两个板。打开足够宽的板,以落在两个板之间的网格中,但避免打开到最大打开位置,以防止网格从另一侧下降。
- 使用长钳将样品网格盒从 LN2中取出,将其转到与舞台内存储位置位置对齐的位置的位置,并将其放置在舞台上。使用适当的设备(例如螺丝刀)将存储箱盖打开至正确的样品位置。
- 使用倒置钳(或任何细尖手术钳),从样本支架中取出 TEM 网格,将其浸入 LN2中,并将其放入样品转移盒中的位置,在转移过程中保持接近 LN2的位置。确保碳膜侧放置,使其最终面对样品桥上的目标。
- 使用盒式磁带工具上的六边形键关闭样品盒。关闭并取出存储箱以及任何剩余的样品。
- 使用盒式工具上的磁点将装有网格的墨盒提升到样板桥上并安装到样品桥上。在传输过程中,使其沉浸/接近 LN2。确保方向适合桥(两块磁铁将与桥上的磁铁接触)。将盒式磁带平放在桥的定位别针内,轻轻轻推以确保其固定。
注:在光束线 B24 的 CryoSIM 设施中还提供用于为后续聚焦离子束铣削准备的剪裁网格的示例盒式磁带。
3. 阶段对接和对焦
- 将低温相位盖打开到成像位置,并关闭样品室灯。将舞台滑向光学元件,使其在客观镜头下对齐。使用杠杆轻轻地将目标放入位置,确保目标位于低温阶段的盖子内,但不会碰到它。
注意:确保外部 Dewar 的插座管道在数据收集过程中的任何时候不会在低温阶段接触舞台德瓦尔。 - 用不透明的黑色窗帘覆盖舞台和光学元件。启动低温SIM PC上的控制软件驾驶舱(图3和图4)。
- 单击每个摄像机的 读取模式 按钮,并将其设置为 CONV 3 MHz。检查每台摄像机的温度是否为 -80 °C,相机风扇是否关闭。
- 打开 反射 相机。在 灯光下,选择 环境 (曝光20ms),并在 linkam下,点击 冷凝器。单击 "视频模式 "按钮。
- 在 马赛克视窗 中,缩小(鼠标滚动)以查看网格轮廓。如果无法看到,请单击 "查找"阶段 。在圆圈中间通过双左单击来中心网格。
- 将样本对焦,直到网格支持膜(或任何其他相关示例功能)处于对焦位置,使用上下键上下移动低温阶段,并使用数字垫上的9和3键更改 z 步(将其设置为 20 μm 以用于初始对焦)。
注:如果用户在 z 中旅行用完,则可以使用低温阶段下的车轮手动向上或向下移动舞台。一次按一个档次转动,并检查样品是否在视图范围内。如果焦点恶化,再次更改方向。
4. 布莱特菲尔德马赛克收购
- 一旦舞台以中心为中心,关闭视频模式,并收集可见光马赛克(点击马赛克视图中的运行马赛克,生成从中心向外螺旋的可见光图像瓷砖)。如果网格弯曲,请尝试网格上的不同位置(马赛克视图内双左单击),重新对焦,然后再次单击"运行马赛克"以收集部分马赛克。或者,在马赛克顶部投入一个聚焦图像(图3)。
- 点击" 保存马赛克"可保存视图。给它一个包含存储框和相应网格编号信息的简短文件名(时间戳将自动附加到文件名中)。
5. 确定感兴趣领域
- 检查明亮的场马赛克与任何以前的荧光"地图"图像,以找出以前感兴趣的细胞或生物特征的位置。检查这些区域是否产生合适的荧光。
- 如果处于活动状态,请关闭 环境光 和 冷凝器 以及 视频模式。打开所需的激发激光器(405、488、561 或 647),选择相应的 摄像头 和 滤镜,最初为 50 mW,曝光时间为 50 ms。
注意:根据荧光信号增加/减少这些摄像机和滤镜设置。 - 按 0 捕捉图像和 * 自动对比。或者,使用图像底部的滑块手动调整对比度。
注:打开房间标志 上的激光 。 - 一旦找到具有适当荧光的生物有趣的细胞,在马赛克视图中使用标记站点按钮标记它们的位置。
注:这些标记的站点将显示在封闭列表中,并且可以通过双击坐标来访问。返回标记站点时,在双击前放大区域。 - 在开始图像采集之前,请继续标记所有潜在站点。重新保存带有标记站点的马赛克;点击 保存网站文件。
- 要使用 StitchM 软件(在光束线 B24 的内屋开发)将马赛克图像拼接在一起,将 .txt马赛克 文件拖入缝合文件,并 延长.bat 并保存同一文件夹中马赛克瓷砖的组合 tiff 图像。要保存带有标记站点的图像,请同时将 马赛克.txt 文件和 标记.txt 文件拖入图标。
注:平衡数据收集与项目需要(例如,如果将进行相关成像,检查可以使用合作伙伴成像方式拍摄多少图像,并选择适当数量的低温SIM成像站点)。此外,如果外部除战需要补充 LN2, 低温阶段系统将更改位置,标记的站点可能不会返回到相同位置:因此,在选择要成像的站点数量时考虑这一点。
- 要使用 StitchM 软件(在光束线 B24 的内屋开发)将马赛克图像拼接在一起,将 .txt马赛克 文件拖入缝合文件,并 延长.bat 并保存同一文件夹中马赛克瓷砖的组合 tiff 图像。要保存带有标记站点的图像,请同时将 马赛克.txt 文件和 标记.txt 文件拖入图标。
- 如果处于活动状态,请关闭 环境光 和 冷凝器 以及 视频模式。打开所需的激发激光器(405、488、561 或 647),选择相应的 摄像头 和 滤镜,最初为 50 mW,曝光时间为 50 ms。
6. 数据收集策略
- 根据荧光图像动态范围(在相机视窗底部)中的计数设置激光曝光时间。选择应用哪个滤镜,并针对要使用的每个波长的激发光优化这些设置,将每个激光单独打开。
注意:虽然 10,000-20,000 计数是最佳的,但如果有良好的对比度,较低的计数是可以接受的。理想情况下,在获取每个图像堆栈之前检查滤镜设置,因为网格不同区域的单元格可能具有可变荧光水平。
7. 数据收集
- 单击两个摄像机以打开它们。返回标记的站点之一,并再次关注所需的深度。一旦在感兴趣的区域集中,在宏阶段的XY窗口中向上移动焦点+ (键),以选择要获取的 z 堆栈的高度,然后单击"保存顶部"。向下移动(+键),单击"保存底部",然后转到"转到中心",检查图像是否仍处于对焦位置。
注:样品高度将显示在窗口中。 - 右键单击驾驶舱窗口中的slm(空间光调制器),并确保角度设置为 0.41。在驾驶舱窗口中,选择单个站点实验。
注:不要单击 slm;驾驶舱将在图像采集期间自动打开它。- 从降压列表中,选择 结构照明。更改 堆栈高度 ,使其等于 z 高度 = 1 μm。
注:添加 1 μm 可确保捕获 z 中的整个样品,并最大限度地减少重建文物。 - 输入上排(反射相机)的 405 nm 和 488 nm 激光器的曝光时间(ms),以及下排(传输相机)的 561 nm 和 647 nm 激光器的曝光时间。
注:曝光时间的值应与之前确定并在主 驾驶舱 窗口中显示的值相匹配。 - 输入文件名称(命名约定:框number_grid area_filters_FL)(FL(荧光)或 BF(亮场),具体取决于正在执行的成像类型)。单击 "更新" 以生成包含日期和时间的新文件,而不会覆盖以前的文件。然后,单击 "开始"。
- 从降压列表中,选择 结构照明。更改 堆栈高度 ,使其等于 z 高度 = 1 μm。
- 在收集数据时检查相机视图。如果有任何 xy 位移,请重新拍摄图像。如果 LN2 dewar 在图像采集期间重新填充低温阶段,请单击驾驶舱软件中的中止按钮来中止过程。
- 一旦外部去瓦尔完成补充阶段去瓦尔,重复实验,因为重新填充垂直取代样品。重新调整图像以 z 重新集中图像,并重复 单个站点实验。对于所需的所有激光和滤光片组合,重复 单点实验 。
注:完成加注大约需要 30 s-1 分钟。在一个网格成像过程中,将发生 +4-8 倍的重新填充。
- 一旦外部去瓦尔完成补充阶段去瓦尔,重复实验,因为重新填充垂直取代样品。重新调整图像以 z 重新集中图像,并重复 单个站点实验。对于所需的所有激光和滤光片组合,重复 单点实验 。
- 在每个位置,使用可见光收集 z 堆栈。
- 关闭激光,并打开 环境光 和 冷凝器。 在 单个站点实验下,选择 Z 堆栈,将 环境光 设置为 20 ms 曝光,并将 Z 高度保持在上。
- 对于网格上标记的所有站点重复步骤 7.2 到 7.4。
- 在移动到另一个示例之前,点击" 删除"磁贴删除马赛克。
- 在所有瓷砖周围绘制一个正方形以将其删除。删除标记,以及通过选择所有这些在列表中,然后点击 删除选定的网站。
- 在继续更换网格之前,先关闭环境光和冷凝器。按照第 4 节中的步骤反向操作,以便从目标下撤除阶段并更改网格。
8. 成像后
- 成像完成后,解开舞台,并删除所有样品。关闭样品室灯。拔下外部去瓦尔插头,将剩余的 LN2倒入另一个与低温兼容的容器中,使脱温安全返回正常温度。
- 将盖子插头放在低温舞台上。等待,直到烘 烤 低温阶段显示选项变得可用后,没有更多的LN2留在舞台德瓦尔。按 下烘烤 按钮进入加热模式,并从低温阶段去除任何水分,以避免结冰。
9. 重建
- 将原始 SIM 数据文件传输到相应的工作站进行重建。使用通道特定的光传输函数 (OTFS)(从多荧光珠点扩散功能计算)和 K0角度(0.29278、-1.8028、2.3786)分批运行处理,所有通道的 Wiener 滤清器为 0.004,偏移偏移为 200。
- 在 其他选项 面板中,通过保持其他选项不受约束,确保丢弃负强度。将 SIR 图像保存到名为"处理"的文件夹中。
注:商用SIM重建软件通常生成重建的SIM数据并保留文件名,但最后会附加 SIR.dv。 还创建了一个日志文件,其中包含有关重建成功的处理协议、步骤和统计信息。
10. 色移校正
- 下载软件色谱7, 以纠正色变。
- 使用与所收集数据的荧光波长相对应的色移参考矩阵(由光束线提供)。
注:参考文件是一个"色粒体.csv"文件,其中包含对齐参数,并且是使用多荧光纳米粒子从校准图像中获取的。它可用于一次批量处理多个数据集。- 选择与激光波长相匹配的适当参考文件和用于成像样品的过滤器,并将其添加到 参考 字段。添加重建的 SIR 数据以在源字段中对齐,然后单击 "运行"。
- 检查荧光信号是否在图像中对齐。对于批量处理,将所有 SIR 图像放在源字段中对齐,在参考字段中对齐参考文件,并按下"运行"。
结果
含有 U2OS 细胞的样品被绿色微管细胞骨质染料和红色线粒体染料的混合物弄脏,导致细胞骨骼(绿色)和线粒体(红色)的微管成分染色。随后的成像显示细胞内线粒体的定位以及微管的排列,突出了线粒体为细胞提供的结构框架,以及细胞骨架围绕细胞核等细胞细胞的组装。低温SIM的分辨率明显高于标准表观显微镜(图5)。图6演示了如何利用传统表光显微镜的荧光"地图"从网格上的位置定位感兴趣的成像区域和相应的低温SIM重建图像。
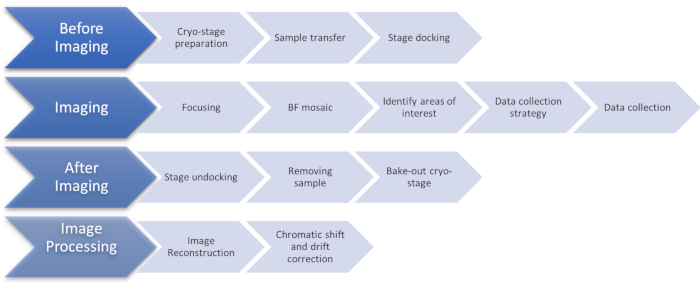
图1: 显示低温SIM成像协议阶段的流量图。 缩写:低温SIM = 冷冻结构照明显微镜。 请单击此处查看此图的较大版本。

图2:低温阶段。 (A) 低温阶段设置。(B) 倒置钳子所示的样本网格。(C) 低温阶段的组件。连接端口标记,颜色对应橙色:电源,黄色:加热舞台盖,蓝色:外部去瓦尔,绿色:连接到PC。缩写:PC = 个人电脑;LN2 = 液氮。 请单击此处查看此图的较大版本。
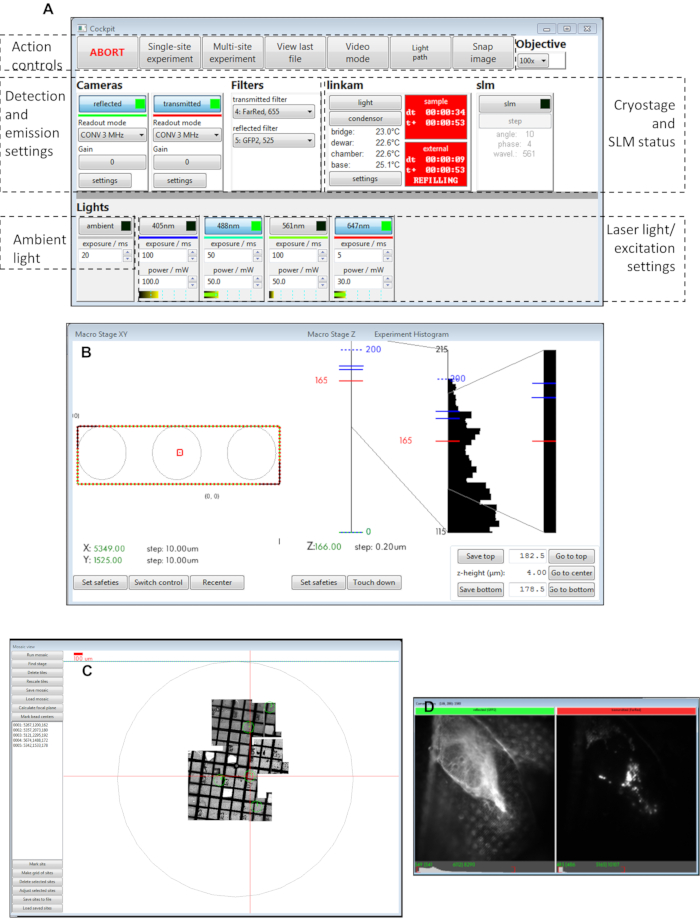
图3:驾驶舱软件面板的视图。(A)主面板,(B) 宏级XY,(C ) 马赛克视图,(D) 相机视图。缩写:SLM = 空间光调制器。请单击此处查看此图的较大版本。
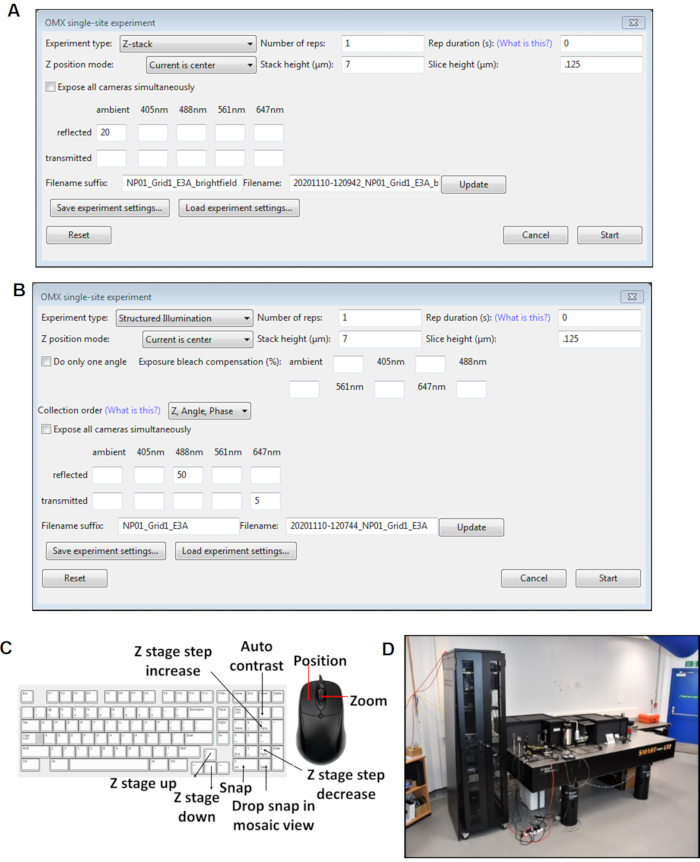
图4:驾驶舱软件面板的视图。 (A) Z 堆栈单站点实验。(B) SI 单站点实验。(C) 图像采集过程中使用的驾驶舱软件的键盘快捷方式。(D) 低温SIM显微镜位于钻石光源同步加速器的光束线B24现场。缩写:低温SIM = 冷冻结构照明显微镜。 请单击此处查看此图的较大版本。
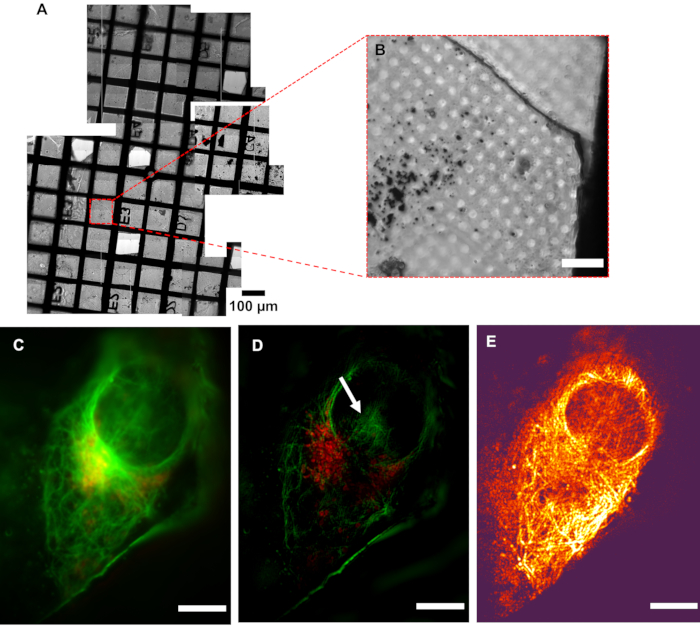
图5: 低温的分辨率。 (A) 正在检查的网格马赛克视图。(B) 兴趣区 (AOI) 的光明场图像。(C) 伪宽场图像与其(D) SIM 图像相比,显示分辨率增加。白色箭头表示 SIM 重建文物。(E) 调制对比图将重建图像的像素强度信息与 SIMCheck2生成的原始数据的相应调制对比比 (MCNR) 值的颜色信息相结合。明亮和黑暗区域分别表现出高对比度和低对比度。秤杆 = 10μm。CryoSIM 成像设置:激发/发射波长:488/525 nm、50mW 激光功率、50 ms 曝光时间和 647/655 nm、20mW 激光功率、5 ms 曝光时间。缩写:低温SIM = 冷冻结构照明显微镜。 请单击此处查看此图的较大版本。

图6:从常规表观显微镜生成的亮场和荧光图像图的覆盖,从荧光图中网格上的位置进行低温SIM图像重建。此地图用于定位随后在低温SIM中映射感兴趣的区域。(C) 在(B)中显示的位置获得的重建低温图像。缩写:低温SIM =冷冻结构照明显微镜。请单击此处查看此图的较大版本。
讨论
低温下的 3D SIM 比其他 SR 成像技术在成像化生物材料方面有许多优势。与其他 SR 方法相比,它要求每 z 切片的图像显著减少,因此对受病毒化样品的辐照更少,形成冰晶的几率也更低。它还能够对整个细胞进行成像,并且可以与 X 射线断层扫描相关联,使结构与功能相匹配。有趣的是,大多数市售的荧光和荧光标签在低温条件下漂白的比在室温下少。然而,鉴于大多数常见氟在室温下的量子产量高(在某些情况下超过80%),光子中检测到的绝对增益不是由于量子产量的变化,而是由于复杂漂白过程的减少。有关低温下氟的产量的更多信息,可在 8月份找到。
至关重要的是,到达低温SIM的样品已经使用传统的低温发光显微镜进行了预制,具有亮场能力,以生成一个网格"地图",其中包括突出显示所有潜在的OOIs进行进一步成像(图5)。冷冻SIM的进入时间通过一个涉及提交提案的竞争性流程分配,随后对该提案的技术可行性和生物医学影响进行评估。因此,设备上的时间总是"高得无比",预制网格允许最有效地使用分配。样品也必须保持病毒化,特别是在样品从样品持有人转移到成像平台期间,以尽量减少冰晶的形成和随后的样品损害。样品的质量应该很好,以产生最好的SIM图像。准备充分的样品将具有以下特征:(a) 它将没有冰晶污染,(b) 使用的网格将是一个查找器网格,(c) 载体将是平的,(d) 网格网格和基板表面不会是自动荧光的,(e) 支撑膜不会断裂。这些先决条件可以通过仔细的样品处理和确保样品始终保持病毒化来实现。
提前检查提议的氟氟样品是否会在低温显微镜中发出足够的信号,这一点很重要。诸如SPEKCheck9 这样的工具可以帮助选择最佳的荧光和滤光片组合。如果原始数据收集或重建过程出现问题,重建后图像中可能会出现人工制品。Demmerle 等人记录了各种文物的示例10 如果重建不是最佳,可以通过打开重建摘要文件在 SoftWoRx 日志文件中查看图像重建参数。在给定通道中,应有一致的跨角度线间距和相对一致的振幅。应更密切地调查超过 30% 和显著高于 1 值(如果应用珠子大小补偿)的变异,并可能表示重建失败。此外,斐济的SIMCheck2 软件还可用于对原始和重建数据进行各种检查,以诊断成像或重建参数设置中错误的原因。SIM 检查及其调制对比图还可以通过解释图像的哪些区域可能是真实结构与人工制品,从而有助于评估重建数据的质量。
核区内低调制对比度(图 5E以深色显示)意味着该区域将更容易受到重建文物的影响,因此意味着核中显示的哈希图案可以归类为人工制品(图5D)。强荧光信号区更有可能在处理数据中准确反映本地结构。在荧光素分布在较广区域(如囊泡总表面)的弱信号区域,真正的信号很可能与处理人工制品并存,在解释该数据时应小心谨慎。在检查了全方位的重建数据以确保没有奇怪的文物,并且背景一般是高斯和中心接近零,数据一般被剪辑为零,或模式值 - 背景信号的峰值 - 应该非常接近零。这可确保显示图像的动态范围不被负面背景文物所支配。当预期信号较弱时,应格外小心地分析这些特征,并确保它们是真正的结构,而不是重建文物。
成像系统存在一些局限性。由于样品阶段是平的,因此厚度可变或网格不平的样品不是理想的成像对象。此外,如果使用软 X 射线断层扫描进行相关成像,则不应对网格边界附近的细胞进行成像,因为在倾斜系列采集期间,这些细胞在 X 射线显微镜中是看不到的。最后,在暴跌冻结前样品的印迹量对成像质量有显著影响:太少的印迹会导致样品太厚,给低背景噪音的次优 SIM 图像,而太多的印迹会导致细胞出现错误,因此更容易受到事件激光束的热损伤。总之,CryoSIM 是一种强大的荧光显微镜工具,用于在近本地阶段对 3D 生物样本进行成像,并在许多领域具有广泛的应用。
披露声明
作者声明没有相互竞争的经济利益。
致谢
该项目已获得欧盟委员会地平线2020 iNEXT-发现项目的资金。一.M多比承认来自韦康信托基金(107457/Z/15/Z)的资金。这项工作是在钻石光源B24仪器(建议BI25512)的支持下进行的。我们感谢美光的员工以及我们所有优秀的用户和合作者帮助我们建立低温SIM及其相关潜力。
材料
| Name | Company | Catalog Number | Comments |
| Auto grids | FEI | ||
| Autogrids | Thermo Fisher Scientific | 1036173 | |
| BioTracker 488 Green Microtubule Cytoskeleton Dye | Sigma-Aldrich | SCT142 | |
| Cockpit Software | Oxford University | https://github.com/MicronOxford/cockpit | |
| cryo compatible polyurethane container | Jena bioscience | CC-FD-800 | |
| Cryo TEM grid storage box | Thermo Fisher Scientific | Model#AutoGrid | |
| cryo-SIM microscope | Custom made | N/A | Custom made, see following reference for the design: Michael A. Phillips, Maria Harkiolaki, David Miguel Susano Pinto, Richard M. Parton, Ana Palanca, Manuel Garcia-Moreno, Ilias Kounatidis, John W. Sedat, David I. Stuart, Alfredo Castello, Martin J. Booth, Ilan Davis, and Ian M. Dobbie, "CryoSIM: super-resolution 3D structured illumination cryogenic fluorescence microscopy for correlated ultrastructural imaging," Optica 7, 802-812 (2020). Has a Nikon TU Plan Apo 100x/0.9 NA. |
| Cryostage system | Linkam Scientific Instruments | CMS196 | |
| Fine tip surgical forceps | Ted Pella | 38125 | |
| MitoTracker Deep Red FM | Thermo Fisher Scientific | M22426 | |
| Python Microscope Software | Oxford University | https://www.python-microscope.org/ | |
| Scientific dry paper wipes | Kimberly-Clark 7551 | 2 | |
| SIM Reconstruction Software | softWoRx, GE Healthcare | Version 6.5.2 | |
| StitchM Software | Diamond Light Source | https://github.com/DiamondLightSource/StitchM | |
| TEM grids for samples | Quantifoil Micro Tools | G200F1 |
参考文献
- Schermelleh, L., et al. Super-resolution microscopy demystified. Nature Cell Biology. 21 (1), 72-84 (2019).
- Ball, G., Demmerle, J., Kaufmann, R., Davis, I., Dobbie, I. M., Schermelleh, L. SIMcheck: A toolbox for successful super-resolution structured illumination microscopy. Scientific Reports. 5 (1), 15915 (2015).
- Kounatidis, I., et al. 3D Correlative cryo-structured illumination fluorescence and soft X-ray microscopy elucidates reovirus intracellular release pathway. Cell. 182 (2), 515-530 (2020).
- Gustafsson, M. G. L. Surpassing the lateral resolution limit by a factor of two using structured illumination microscopy. Journal of Microscopy. 198 (2), 82-87 (2000).
- Rego, E. H., Shao, L., Rego, E. H. Practical structured illumination microscopy. Methods in Molecular Biology. 1251, 1251 (2015).
- Phillips, M. A., et al. CryoSIM: super-resolution 3D structured illumination cryogenic fluorescence microscopy for correlated ultrastructural imaging. Optica. 7 (7), 802 (2020).
- Matsuda, A., Schermelleh, L., Hirano, Y., Haraguchi, T., Hiraoka, Y. Accurate and fiducial-marker-free correction for three-dimensional chromatic shift in biological fluorescence microscopy. Scientific Reports. 8, 7583 (2018).
- Kaufmann, R., Hagen, C., Grünewald, K. Fluorescence cryo-microscopy: current challenges and prospects. Current Opinion in Chemical Biology. 20, 86-91 (2014).
- Phillips, M. A., Pinto, D. M. S., Dobbie, I. M. SPEKcheck-fluorescence microscopy spectral visualisation and optimisation: a web application, javascript library, and data resource. Wellcome Open Research. 3, 92 (2018).
- Demmerle, J., et al. Strategic and practical guidelines for successful structured illumination microscopy. Nature Protocols. 12 (5), 988-1010 (2017).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。