Method Article
إعداد و Cryo-FIB micromachining من Saccharomyces cerevisiae للتصوير المقطعي كريو إلكترون
In This Article
Summary
نقدم بروتوكولا لإعداد اللاميلا للعينات البيولوجية المجمدة من خلال التصوير الدقيق لشعاع الأيونات الذي يركز على التبريد للدراسات الهيكلية عالية الدقة للجزيئات الكبيرة في الموقع مع التصوير المقطعي للإلكترونات المبردة. يوفر البروتوكول المقدم مبادئ توجيهية لإعداد lamellae عالية الجودة مع استنساخ عالية لتوصيف الهيكلية للجزيئات الكلية داخل Cerevisiae Saccharomyces.
Abstract
اليوم ، التصوير المقطعي للإلكترونات المبردة (cryo-ET) هو التقنية الوحيدة التي يمكن أن توفر بيانات هيكلية شبه ذرية حول المجمعات الجزيئية الكلية في الموقع. نظرا للتفاعل القوي للإلكترون مع المادة ، تقتصر دراسات cryo-ET عالية الدقة على عينات يقل سمكها عن 200 نانومتر ، مما يحد من إمكانية تطبيق cryo-ET فقط على المناطق الطرفية من الخلية. تم إدخال سير عمل معقد يتضمن إعداد مقاطع عرضية خلوية رقيقة بواسطة الميكروماشين الحزمة الأيونية التي تركز على التبريد (cryo-FIBM) خلال العقد الماضي لتمكين الحصول على بيانات cryo-ET من المناطق الداخلية للخلايا الكبيرة. نقدم بروتوكولا لإعداد lamellae الخلوية من عينة تهتز عن طريق الهبوط تجميد باستخدام Saccharomyces cerevisiae كمثال نموذجي لخلية eukaryotic مع استخدام واسع في البحوث البيولوجية الخلوية والجزيئية. نحن نصف بروتوكولات لتزجيج S. cerevisiae إلى بقع معزولة من عدد قليل من الخلايا أو أحادية مستمرة من الخلايا على شبكة TEM وتوفير بروتوكول لإعداد اللاميلا عن طريق cryo-FIB لهذين العينين.
Introduction
جعلت التطورات التكنولوجية والبرمجيات الأخيرة الإلكترون التبريد المجهري (cryo-EM) من العينات البيولوجية التزجيج واحدة من التقنيات الرئيسية في بحوث البيولوجيا الهيكلية في العقد الماضي1،2. عادة ما يتكون إعداد عينة ل cryo-EM من تطبيق بروتين منقى أو مجمع من البروتين مع حمض النوى على حامل العينة (شبكة TEM) ، يليه إزالة معظم السائل بورق تصفية ، وإغراق تجميد الشبكة مع الطبقة الرقيقة المتبقية من العينة في الإيثان السائل أو البروبان3 . وبالتالي يتم إصلاح العينة في طبقة رقيقة (عادة <80 نانومتر) من العازلة غير المتبلورة في حالة رطبة بالكامل ، في ظروف شبه أصلية ، ودون الحاجة إلى أي تثبيت كيميائي أو تباين المعادن الثقيلة. تصوير العينة المتجانسة هيكليا في المجهر الإلكتروني انتقال ثم النتائج في البيانات التي يمكن استخدامها لتحديد بنية ثلاثية الأبعاد من الجزيئات الكبيرة في القرار شبه الذري باستخدام بروتوكول تحليل الجسيمات واحد2. ويتوافق هذا الهيكل في المختبر مع تمثيل الجزيئات الكلية في ظل الظروف والعلاج الذي يستخدم أثناء إعداد العينة. وعلى الرغم من أن الهياكل التي تحدد في ظل الظروف المختبرية عادة ما تتوافق مع الحالة الوظيفية الكاملة للجزيئ الكلي، فإن القدرة على تصوير العلاقات المكانية بين مختلف الجزيئات الكبيرة داخل الخلية ستوفر سياقا وظيفيا إضافيا للبيانات الهيكلية.
يستخدم التصوير المقطعي للإلكترونات الكريو (cryo-ET) لإعادة بناء وحدات التخزين ثلاثية الأبعاد للأجسام متعددة الأشكال أو المجمعات الجزيئية الكلية في الموقع4،5. ميزة cryo-ET هي أن المعلومات ثلاثية الأبعاد يتم الحصول عليها عن طريق تصوير كيان واحد. ومع ذلك، فإن الدقة التي يتم بها ملاحظة المجمعات الجزيئية الكلية الفردية أو العضيات محدودة للغاية. لذلك، فإن متوسط الجزيئات الكبيرة (متوسط مخطط الطوغرام الفرعي، STA) بنفس البنية من عدد أكبر من مخططات الطوغرام ضروري للوصول إلى نماذج دقة 4-8 Å من بيانات cryo-ET6،7. وقد تبين مؤخرا أن cryo-ET وSTA يمكن أيضا أن تطبق لتحديد هياكل عالية الدقة من الآلات الجزيئية الكبيرة مثل ريبوسومات في سياق البيئة الخلوية7. ومع ذلك ، فإن استخدام المجهر الإلكتروني انتقال محدودة من سمك العينة. بشكل عام ، هذه ليست مشكلة لجسيمات واحدة cryo-EM حيث يمكن أن يؤدي تحسين ظروف التزجيج في نهاية المطاف إلى تضمين العينة في طبقة رقيقة من الجليد. من ناحية أخرى، فإن معظم الخلايا ليست في الواقع الإلكترون شفافة لشعاع الإلكترون 300 كيلوفولت. المسار الحر المتوسط غير الممرون في العينات البيولوجية المهزوسة للإلكترونات 300 كيلوفولت هو حوالي 395 نانومتر8، مما يعني أن دراسات cryo-ET تقتصر على المحيط الخلوي لمعظم الخلايا.
تم تطوير تقنيات مختلفة لرقيقة العينة وصولا الى سمك كاف لالتبريد ET. يستخدم استئصال التبريد الفائق التقطيع الميكانيكي للعينة بسكين ألماس في درجة حرارة النيتروجين السائل (-196 درجة مئوية) لتوفير أقسام سميكة 60-80 نانومتر مناسبة ل cryo-ET9و10و11. يمكن إعداد أقسام متعددة من خلية واحدة ويمكن لتحليل البيانات في نهاية المطاف إنتاج معلومات هيكلية ثلاثية الأبعاد للجزء الأكبر من الخلية. ومع ذلك ، يمكن أن يسبب تشريح الميكانيكية العديد من القطع الأثرية مثل المقاطع المنحنية ، الشقوق ، أو ضغط العينة ، والتي قد تؤثر على الهيكل الناتج والتحيز البيانات cryo-ET10،11،12. يمثل المعالج الدقيق لشعاع الأيونات الذي يركز على التبريد (cryo-FIBM) نهجا بديلا حيث يتم إعداد قسم خلوي رقيق عن طريق الاستئصال التدريجي للعينة باستخدام شعاع مركز من أيونات Ga+ (FIB) في عملية متعددة الخطوات ، والتي يمكن أن تؤدي إلى 80-300 نانومتر سميكة المقطع العرضي الخلوي (lamella)13،14،15 . على النقيض من استئصال الشعر المبرد الفائق ، يتم إعداد لاميلا واحدة فقط من خلية واحدة ، والتي تمثل ~ 0.3-3٪ من حجمها ، وعادة ما يكون من الضروري إنشاء خلايا متعددة لإيجاد منطقة اهتمام بالمقطع العرضي المطحون. بالإضافة إلى ذلك ، فإن إنتاجية سير العمل بأكمله لا تزال منخفضة في الوقت الحاضر إلى حد ما ، وغالبا ما تقتصر على 6-8 lamellae عالية الجودة من جلسة cryo-FIBM لمدة 8 ساعات. من ناحية أخرى، فإن المقاطع العرضية cryo-FIBM خالية من أي قطع أثرية ضغط وتوفر مدخلات مناسبة ل cryo-ET عالية الدقة. وعلاوة على ذلك، نقل اللاميلا إلى الناقل عينة ل CRYO-ET ليست ضرورية كما يتم الاحتفاظ العينة على شبكة TEM خلال عملية إعداد lamella كله ويمكن نقل نفس الشبكة في وقت لاحق إلى TEM. نتوقع أن الإنتاجية من cryo-FIBM سيتم تحسينها بشكل كبير قريبا، في المقام الأول من توافر البرمجيات لطحن lamella غير خاضعة للرقابة16،17 واستخدام FIBs تعمل على مبدأ البلازما تهمة الزوجين، والتي سوف تحمل أسرع استئصال المواد.
Saccharomyces cerevisiae (الخميرة) هي خلايا eukaryotic من شكل كروي وقطر ~ 2-5 ميكرومتر. بفضل حجمها، وسهولة الوصول إليها، وعلم الوراثة، ووقت الجيل، والتلاعب بسيطة، ودرس الخميرة على نطاق واسع ككائن حي نموذج eukaryotic في البحوث البيولوجية الخلوية والجزيئية مماثلة لEscherichia القولونية، والتي تدرس بشكل جيد ككائن حي نموذج prokaryotic في علم الجراثيم. الخميرة يمكن أن تكون مثقفة بسهولة في تعليق ويتم إنشاء كمية عالية من الخلايا في وقت قصير (مضاعفة الوقت 1 - 2 ساعات). والأهم من ذلك، تشترك الخميرة في بنية خلوية داخلية معقدة مع الخلايا الحيوانية والنباتية مع الاحتفاظ بجينوم صغير يتألف من محتوى منخفض من الحمض النووي غير الترميزي. وبالتالي فإن التوصيف الهيكلي لبروتيوم الخميرة من البيانات الموقعية عالية الدقة يمكن أن يساعد على توفير وصف ميكانيكي للكمية الواسعة من البيانات الوظيفية المتاحة في الأدبيات.
هنا، ونحن نقدم بروتوكول شامل للحصول على البيانات في الموقع cryo-ET على عينة الخميرة، والتي تغطي جميع الخطوات من زراعة العينة وصولا الى إعداد اللاميلا cryo-FIBM، ونقل العينة إلى TEM للحصول على البيانات cryo-ET.
Protocol
1. زراعة وإعداد خلايا المخافر Saccharomyces للتزجيج
- إعداد المتوسطة نمو السائل لSaccharomyces cerevisiae.
- أوتوكلاف زجاجة 500 مل لإعداد متوسط النمو.
- تزن 2.2 غرام من استخراج الخميرة (1.1٪) و 4.4 غرام من بيبتون (2.2٪) وتخلط في 200 مل من الماء.
- تعقيم عن طريق الالاستعباد التلقائي لمدة 15 دقيقة في 121 درجة مئوية.
- وزن 10 غرام من مسحوق الجلوكوز ومزيج في 50 مل من الماء للحصول على محلول الجلوكوز 20٪. تمرير الحل من خلال مرشح 0.2 ميكرومتر وتخزينه في 4 درجة مئوية.
- إعداد وسط صلب لSaccharomyces cerevisiae.
- تزن 4 غرام من مسحوق أجار وتخلط مع 200 مل من متوسط النمو.
- تعقيم في الأوتوكلاف لمدة 15 دقيقة في 121 درجة مئوية.
- تبريد المتوسطة إلى 40-50 درجة مئوية وإضافة 20 مل من الجلوكوز المعقم 20٪ (أعدت في الخطوة السابقة). صب ~ 20 مل من المتوسطة كاملة في طبق بيتري والسماح لها ترسيخ في درجة الحرارة المحيطة.
- التفاف لوحات أجار في بارا فيلم للحماية من التجفيف وتخزينها في 4 °C.
- الثقافة Saccharomyces cerevisiae في تعليق
ملاحظة: تم تحسين البروتوكول لإعداد عينة ل cryo-FIBM من تعليق خط الخلية Saccharomyces cerevisiae سلالة BY4741 [ATCC 4040002] أو سلالات مماثلة.- أوتوكلاف قارورة إرلينماير 50 مل (أو ما شابه ذلك).
- العمل في غطاء محرك السيارة أو مربع تدفق صفح. ماصة 10 مل من متوسط النمو إلى قارورة Erlenmeyer 50 مل معقمة.
- تكملة المتوسطة مع 1 مل من الجلوكوز 20٪ تصفيتها. اختيار مستعمرة واحدة من الخميرة من لوحة أجار مع العقيمة، حلقة التطعيم المتاح (1-10 ميكرولتر).
- ضع قارورة إرلينماير في الحاضنة والثقافة عند 30 درجة مئوية مع الهياج (150-200 دورة في الدقيقة) حتى يتم الوصول إلى المرحلة الأسية (حوالي 7 ساعة).
ملاحظة: لاحظنا أن المرحلة الأسية يتم الوصول إليها بعد ~ 15 ساعة عندما يتم اختيار المستعمرات من لوحات أجار التي تم استزراعها في درجة الحرارة المحيطة لمدة 4 أسابيع. انظر أيضا ملاحظة أدناه.
- ثقافة Saccharomyces cerevisiae على لوحة أجار من مخزون الجلسرين.
- استخدم طبق أجار جديد من مساحة التخزين 4 درجات مئوية.
- خذ مخزون S. cerevisiae من الفريزر العميق -80 درجة مئوية وضعه في موقف تجميد لتجنب ذوبان كامل للمخزون.
- كشط ونقل ثقافة صغيرة مع حلقة تلقيح معقمة (1-10 ميكرولتر) إلى 50 ميكرولتر من متوسط النمو. مزيج بشكل صحيح.
- نقل الحجم الكامل للثقافة S. cerevisiae مختلطة وتفريق مع عصا انتشار عقيمة على سطح لوحة أجار.
- احتضان في 30 درجة مئوية لمدة 48 ساعة تقريبا حتى تتشكل مستعمرات قطرها 1.5-2 ملم.
ملاحظة: من المستحسن زراعة المستعمرات حديثا قبل التجربة. المستعمرات التي يزيد عمرها عن أسبوع واحد سوف تتطلب فترة طويلة للزراعة في وسائل الإعلام السائلة للوصول إلى مرحلة النمو الأسي.
- الثقافة Saccharomyces cerevisiae على لوحة أجار.
- استخدام لوحات أجار المعدة مع مستعمرات S. cerevisiae نمت.
- ماصة 10 مل من متوسط النمو العقيم و 1 مل من الجلوكوز 20٪ المصفاة إلى قارورة إرلينماير 50 مل.
- اختيار مستعمرة واحدة من الثقافة S. cerevisiae مع حلقة التطعيم العقيمة وتخلط مع وسيط النمو في قارورة.
- احتضان 50 دقيقة في 30 درجة مئوية مع التحريض (150-200 دورة في الدقيقة).
- تمييع ثقافة التعليق عشر مرات مع متوسط النمو وتفريق 50 ميكرولتر من التعليق على لوحة أجار مع عصا نشر معقمة.
- حضانة في 30 درجة مئوية لمدة 48 ساعة تقريبا حتى 1.5-2 لاحظ مستعمرات مم.
- لف حواف طبق بيتري مع البارافيلم لمنعه من التجفيف. يخزن في درجة حرارة الغرفة ويستخدم لمدة أقصاها 4 أسابيع.
- إعداد Saccharomyces cerevisiae للهبوط تجميد في مجموعات الخلايا.
- إعداد S. cerevisiae خلية الثقافة وفقا للبروتوكول في قسم زراعة Saccharomyces cerevisiae في تعليق (القسم 1.3) واحتضان ~ 7 ساعة في 30 درجة مئوية مع التحريض (150-200 دورة في الدقيقة).
- قياس OD S. cerevisiae خلية تعليق الثقافة في 600 نانومتر باستخدام الأشعة فوق البنفسجية / فيس مطياف.
- تركيز تعليق الخلية إلى OD600 = 1.
- إعداد S. cerevisiae لإغراق تجميد في أحادية الخلية.
- إعداد S. cerevisiae خلية الثقافة وفقا للبروتوكول في قسم زراعة Saccharomyces cerevisiae تعليق ثقافة الخلية واحتضان ~ 7 ح في 30 درجة مئوية مع التحريض (150-200 دورة في الدقيقة).
- قياس OD S. cerevisiae ثقافة تعليق الخلية في 600 نانومتر باستخدام الأشعة فوق البنفسجية / فيس مطياف.
- نقل الخلايا في المتوسط إلى أنبوب الطرد المركزي وتدور بلطف لمدة 2 دقيقة في قوة الطرد المركزي النسبية (900 × ز).
- تجاهل المتوسطة من بيليه الخلية عن طريق pipetting.
- إضافة متوسطة جديدة إلى بيليه الخلية. حساب حجم المتوسطة للحصول على تعليق الخلية من OD600 يساوي 30 إلى 60.
- إضافة الجلسرين (50٪ محلول المخزون) إلى تعليق الخلية إلى تركيز نهائي من 5٪ قبل وقت قصير من التزجيج.
ملاحظة: يعمل الجلسرين كعامل وقائي، مما يحسن نوعية الجليد في المناطق بين الخلايا. يضاف الجلسرين إلى الخلايا قبل فترة وجيزة فقط من التزجيج لتقليل امتصاصه إلى الخلية.
2. فيتريفيكيشن من عينة Cerevisiae Saccharomyces
- توهج الشبكات TEM التفريغ مع الجانب فيلم الكربون التي تواجه ما يصل ل30-45 ق (الضغط: 6-9 السلطة الفلسطينية، الحالية: 7 MA).
- تعيين الروبوت التزجيج إلى المعلمات التالية: درجة الحرارة: 18 درجة مئوية، والرطوبة: 100٪، وقت لطخة: 6 ق، وقت الانتظار: 5 ق، دورة النشاف: 1x، وقوة لطخة: 5.
ملاحظة: Blot force هي قيمة خاصة بالأدوات وقد تختلف قيم القوة اللطخة المثلى بين الأجهزة المختلفة. يجب تأكيد القيمة المثلى لمغطس معين تجريبيا. - إعداد الإيثان السائل للتزجيج.
- قم بتركيب لوحة السطح غير الماصة إلى لوحة النشاف التي تواجه العينة. استخدم ورق التصفية للوحة النشاف الأخرى.
- اختيار توهج تفريغ الشبكة مع ملاقط وجبل ملاقط إلى صك تجميد يغرق.
- تطبيق 3.5 ميكرولتر من S. تعليق cerevisiae إلى الجانب الكربوني من الشبكة داخل غرفة المناخ المكبس. مزيج بشكل صحيح قبل كل تطبيق على الشبكة.
- يغرق تجميد الشبكة في الإيثان السائل.
- نقل الشبكة من الإيثان السائل إلى LN2. قم بتخزين الشبكات ذات الخلايا المهترئ تحت ظروف LN2 أو قم بتركيبها في خرطوشة شبكة TEM لتحميلها في مجهر FIB-SEM.
3. تركيب شبكات TEM في خرطوشة الشبكة
ملاحظة: يستخدم سير العمل الموضح هنا شبكات TEM المثبتة في خرطوشة الشبكة لتسهيل معالجة العينة ونقلها بين مجاهر SEM وTEM. يتكون تجميع الخرطوشة من حلقة C وشبكة TEM وحلقة C-clip. تتوفر خيارات أخرى عند العمل مع أجهزة من مصنعي المجهر الآخرين. يتم تعبئة محطة عمل تجميع خرطوشة الشبكة مع LN2. يغطي مستوى LN2 مربع الشبكة مع شبكات TEM ، ولكن يتم تنفيذ تركيب شبكات TEM في الخرطوشة في أبخرة LN2. يوصى بشدة بارتداء قناع وجه أو درع واقي أثناء إجراء التزجيج لمنع التلوث من التنفس للعينة. لا تعمل مع الأدوات التي تراكمت تلوث الجليد.
- وضع محطة عمل تجميع خرطوشة الشبكة معا وإعداد أدوات جافة للقص.
- تبريد محطة عمل التجميع لأسفل مع LN2. تبريد أدوات لقطة لدرجة حرارة LN2.
- ضع مربع شبكة مع نموذج vitrified في محطة عمل التجميع.
- ضع شبكة TEM مع العينة مع الخلايا التي تواجه وصولا الى C-حلقة وآمنة مع مقطع C.
- ضع الخراطيش المقطوعة في مربع الشبكة واغلقها بشكل صحيح.
- تخزين خراطيش في ديوار LN2 أو تحميلها في المجهر FIB-SEM.
4. تحميل وتلاعب العينة إلى المجهر FIB-SEM
ملاحظة: تمت كتابة التعليمات لاستخدام المجهر ثنائي الحزم Versa 3D المجهز بنظام إعداد PP3010 cryo-FIB/SEM. وقد تتطلب الحلول البديلة معلمات محددة مختلفة؛ ومع ذلك، يجب أن يكون المفهوم العام لسير العمل صالحا.
- تبريد المجهر وصولا الى درجة حرارة النيتروجين السائل.
- ضخ غرفة المجهر وغرفة التحضير (إذا كان موجودا) إلى فراغ عال قبل بدء التبريد (< 4 × 10-4 باسكال) لمنع نمو التلوث.
- تعيين تدفق غاز النيتروجين إلى 5 لتر / دقيقة لغرفة التحضير، مرحلة المجهر، والمجهر المضادة للمطهر. انتظر حتى تصل درجة حرارة جميع المكونات إلى < -180 درجة مئوية.
ملاحظة: يستخدم إعداد مجهر FIB-SEM المستخدم في هذه الدراسة غاز النيتروجين المبرد لتهدئة مرحلته ومضاد الحشرات. قد تستخدم أنظمة أخرى طريقة مختلفة لتبريد المرحلة. ضغط الغرفة تصل ~ 3 × 10-5 السلطة الفلسطينية مرة واحدة في المرحلة ومضاد للتكون في -190 درجة مئوية على الصك المستخدم هنا. معدل نمو طبقة تلويث الهيدروكربون على سطح اللاميلا مع الإعداد التجريبي المستخدم في هذه الدراسة هو ~ 15 نانومتر / ساعة.
- قم بتحميل خرطوشة الشبكة مع العينة إلى المجهر.
- تجميع وتبريد محطة التحميل إلى درجة حرارة LN2.
- ضع المكوك (حامل العينة) ، مربع الشبكة مع العينة ، فتاحة مربع الشبكة ، وملاقط في محطة التحميل المبردة.
- نقل بعناية خرطوشة الشبكة مع العينة التي تواجه ما يصل الى المكوك.
- اقلب المكوك داخل محطة التحميل إلى موضع التحميل.
- تحميل في المجهر.
- اختياريا، معطف العينة مع طبقات واقية معدنية.
ملاحظة: يمكن ملاحظة تأثير شحن قوي عند تصوير المواد البيولوجية المجمدة المائية SEM. بالإضافة إلى ذلك ، فإن تصوير العينات البيولوجية مع FIB (حتى في التيارات المنخفضة) يؤدي إلى تلف العينة بسرعة. لذلك ، قد يتم إجراء طلاء إضافي للعينة داخل مجهر FIB-SEM ، لحماية سطح العينة.- إيداع طبقة واقية مع البلاتين العضوي عن طريق نظام حقن الغاز (GIS).
- تعيين العينة إلى ارتفاع eucentric (نقطة صدفة للتصوير مع الإلكترونات والأيونات).
- إمالة المرحلة مرة أخرى إلى 45 درجة (عينة مائلة 90 درجة بالنسبة لشعاع الإلكترون).
- نقل المرحلة في المحور z-4 مم تحت ارتفاع eucentric.
- تعيين إبرة نظم المعلومات الجغرافية إلى 26-30 درجة مئوية.
- إيداع ~ 300-1000 نانومتر من طبقة البلاتين العضوي إلى الشبكة مع العينة البيولوجية (يتوافق مع 30-120 ق من ترسب نظم المعلومات الجغرافية).
ملاحظة: نحن عادة ما تطبق نظم المعلومات الجغرافية ل 30 ق لعينات مع مجموعات خلوية صغيرة و 45 ق لعينات مع طبقة أحادية من الخلايا.
- معطف سبوتر سطح العينة مع طبقة معدنية موصلة.
- إيداع ~ 10 نانومتر من الطبقة المعدنية (الأشعة تحت الحمراء ، الاتحاد الافريقي ، حزب العمال) إلى الشبكة مع عينة البيولوجية.
- إيداع طبقة واقية مع البلاتين العضوي عن طريق نظام حقن الغاز (GIS).
- تعيين معلمات المجهر لإعداد اللاميلا
- بالنسبة إلى FIB، استخدم المعلمات التالية: الجهد العالي = 30 كيلو فولت، التيار = 10 pA (التصوير)، 10 pA-3 nA (FIB-milling)
- بالنسبة إلى SEM، استخدم المعلمات التالية: الجهد العالي = 2-5 كيلو فولت، حجم البقعة = 4.5، الحالي = 8-27 pA.
- تعيين دوران المسح الضوئي إلى 180 درجة لكلا الحزم.
- تعيين إمالة المرحلة: زاوية الطحن 6-11 درجة (يتوافق مع إمالة المرحلة من 13 درجة إلى 18 درجة لمكوك العينة مع الميل المسبق من 45 درجة ومجهر FIB / SEM مع زاوية 52 درجة بين SEM وعمود FIB).
5. إعداد سيرفيسيا لاميلا Saccharomyces
- تحقق من جودة الشبكة وحدد مجموعة مناسبة من Saccharomyces cerevisiae.
- تأكد من أن شبكة TEM تم مسحها بشكل صحيح من كلا الجانبين دون وجود مياه إضافية حول كتلة الخلية أو في الجانب الخلفي من الشبكة.
ملاحظة: للتحقق من الجانب الخلفي للشبكة، قم بتدوير المرحلة إلى -10° وصور الشبكة باستخدام FIB. - حدد مجموعات الخلايا الأمثل لإعداد اللاميلا وفقا للتوصيات التالية.
- ضع كتل الخلايا في مركز الشبكة. يجب ألا تمتد منطقة الطحن خارج المربع مع أبعاد 1100 × 1100 ميكرومتر متمركزة في وسط الشبكة (550 ميكرومتر في كل اتجاه من مركز الشبكة).
- ضع كتل الخلايا في الجزء المركزي من مربع الشبكة بدون تداخل مع شريط الشبكة.
- ضع مجموعات الخلايا في مربع الشبكة مع احباط الكربون هولي المدمجة دون الشقوق.
- تأكد من أن الكتلة ليست محاطة بالتلوث الجليدي.
- تأكد من أن شبكة TEM تم مسحها بشكل صحيح من كلا الجانبين دون وجود مياه إضافية حول كتلة الخلية أو في الجانب الخلفي من الشبكة.
- حدد وضع الطحن الأمثل في طبقة ساكروميس سيريفيسيا الأحادية.
- تأكد من أن أشرطة الشبكة المحيطة أحادية الطبقة الخلية على مربع الشبكة المحدد مرئية.
- حدد الموضع الأمثل في الطبقة الأحادية الخلوية وفقا للتوصيات التالية. يجب أن تفي المناطق المحددة للطحن بالمعايير التالية:
- أن يكون لديك منطقة الاهتمام في مركز الشبكة. يجب ألا تمتد منطقة الطحن خارج مربع الأبعاد 1100 × 1100 ميكرومتر المتمركزة في مركز الشبكة (550 ميكرومتر في كل اتجاه من وسط الشبكة).
- أن يكون لديك منطقة الاهتمام في الجزء المركزي من مربع الشبكة مع عدم وجود تداخل مع شريط الشبكة.
- لا تحيط أحادية الخلية مع تلوث الجليد.
- إعداد S. cerevisiae lamella مع cryo-FIB.
ملاحظة: يتم إنشاء نمط الطحن وتوسيطه نسبة إلى منطقة الاهتمام. يتم تنفيذ Cryo-FIBM بشكل تسلسلي مع خطوات طحن متعددة يتم تنفيذها في إعدادات FIB مختلفة. يتم طحن اللاميلا ذات سمك 2 ميكرومتر تقريبا في البداية باستخدام تيار مرتفع (0.3-3 nA). ثم يتم تخفيف اللاميلا تدريجيا إلى 500 نانومتر. يتم استخدام خطوة الطحن الدقيق عند التيارات المنخفضة (10-30 pA) لوضع اللمسات الأخيرة على اللاميلا إلى سمك ~100-200 نانومتر.- تعيين منطقة الاهتمام (ROI) إلى ارتفاع eucentric وحفظ هذا الموقف.
ملاحظة: نقطة صدفة يحتاج إلى تحديد وحفظها لكل موقف على حدة. يتم تعيين ارتفاع eucentric عن طريق إمالة المرحلة إلى 0 درجة والتوسيط على عائد الاستثمار عن طريق تحريك المرحلة في اتجاه س و ص. ثم يميل المرحلة إلى 25 درجة ويتم جلب العائد على الاستثمار مرة أخرى إلى وسط المنطقة الممسوحة ضوئيا عن طريق تغيير موقف المرحلة z-المحور. وأخيرا، تميل المرحلة مرة أخرى إلى 13°-18° للطحن. - حدد نمط طحن مستطيل فوق عائد الاستثمار مع اتجاه مسح من أعلى إلى أسفل.
- حدد نمط طحن مستطيل أسفل عائد الاستثمار مع اتجاه مسح من أسفل إلى أعلى.
- حدد نمط الطحن المستطيل غير النشط الذي يغطي منطقة الاهتمام لتقدير تقريبي لسمك اللاميلا. لا يتم طحن هذا النمط أثناء إعداد اللاميلا.
- وضع علامة على جميع الأنماط وتعيين عرض اللاميلا(س البعد). يجب ألا يتجاوز عرض نمط الطحن 2/3 من عرض الكتلة. وهذا يعادل 8-15 ميكرومتر في معظم الحالات.
- تعيين معلمات لخطوات الطحن التقريبية
- FIB الحالي: 0.3-3.0 nA ; سمك اللاميلا النهائي: 1.5-2 ميكرومتر؛ عرض منطقة FIBM: 8-12 um; مرحلة الميل: 13-17 درجة; المدة: 8 دقائق; أنماط الطحن النشطة: العلوي والسفلي.
- FIB الحالي: 0.3-1.0 nA; سمك اللاميلا النهائي: 1 ميكرومتر؛ عرض منطقة FIBM: 7.5-11.5 ميكرومتر؛ مرحلة الميل: 13-17 درجة; المدة: 8 دقائق; أنماط الطحن النشطة: العلوي والسفلي.
- FIB الحالي: 100-300 pA; سمك اللاميلا النهائي: 0.5 ميكرومتر ; عرض منطقة FIBM: 7.5-11.5 ميكرومتر؛ مرحلة الميل: 13-17 درجة; المدة: 8 دقائق; أنماط الطحن النشطة: العلوي والسفلي.
- FIB الحالي: 30-100 pA; سمك اللاميلا النهائي: 0.3 ميكرومتر ; عرض منطقة FIBM: 7.5-11.5 ميكرومتر؛ مرحلة الميل: 13-17 درجة; المدة: 8 دقائق; أنماط الطحن النشطة: العلوي والسفلي.
- تعيين معلمات لخطوة الطحن الدقيق:
- FIB الحالي: 10-30 pA; سمك اللاميلا النهائي: <0.2 um; عرض منطقة FIBM: 7-11 ميكرومتر؛ مرحلة الميل: 13-17 درجة (+1°); المدة: 12 دقيقة; أنماط الطحن النشطة: العلوي.
ملاحظة: يتم تنفيذ خطوات الطحن الخام (5.3.6) بشكل تسلسلي لكل lamella. في المقابل، فإن خطوة الطحن الدقيق (5.3.7) لا تتبع مباشرة الطحن الخام، ولكن يتم تنفيذ خطوات الطحن الدقيقة بشكل تسلسلي لجميع اللاميلا في نهاية الجلسة لتقليل التلوث الهيدروكربوني على سطح اللاميلا. يتم استخدام إمالة المرحلة +1 درجة إضافية أثناء خطوة الطحن الدقيقة لزيادة تجانس سمك اللاميلا عبر طوله.
- FIB الحالي: 10-30 pA; سمك اللاميلا النهائي: <0.2 um; عرض منطقة FIBM: 7-11 ميكرومتر؛ مرحلة الميل: 13-17 درجة (+1°); المدة: 12 دقيقة; أنماط الطحن النشطة: العلوي.
- تعيين منطقة الاهتمام (ROI) إلى ارتفاع eucentric وحفظ هذا الموقف.
6. نقل Saccharomyces cerevisiae لاميلا إلى cryo-TEM
- إعداد ديوار المجففة بشكل صحيح وملئه مع LN2.
- تفريغ العينات مع lamellae من المجهر FIB / SEM تحت ظروف التبريد، ونقلها إلى مربع الشبكة، وتخزينها في مخزن LN2 ديوار للتخزين على المدى الطويل. بدلا من ذلك، قم بتحميل الشبكات مباشرة في cryo-TEM.
- التوجه الصحيح للاميلا بالنسبة لمحور الميل مرحلة cryo-TEM مهم (انظر الفيديو المصاحب في 8:10 لمزيد من التفاصيل). تأكد من أن اتجاه الطحن من lamellae المعدة عمودي على محور الميل مرحلة cryo-TEM.
- قبل إمالة مرحلة cryo-TEM للتعويض عن الميل lamella بالنسبة إلى شبكة الطائرة وجمع الميل سلسلة باستخدام مخطط جرعة متماثل19.
ملاحظة: يتم تحديد حجم الميل المسبق (عادة 6-8 درجات) من خلال الزاوية بين مستوى شبكة TEM واتجاه FIB أثناء المعالجة الدقيقة. يمكن استخدام موضع الحافة الأمامية اللاميلا في الصورة في cryo-TEM لتحديد علامة زاوية ما قبل الميل. لذلك ، يجب معرفة الشعور بتناوب مرحلة المجهر. في الإعداد التجريبي لدينا، فإن موضع الحافة الأمامية لللاميلا على الجانب الأيمن من الصورة التي تم التقاطها في وضع nanoprobe SA يتوافق مع الميل السلبي المسبق.
النتائج
تم حصاد ثقافة الساككروميس سيريفيسيا في منتصف مرحلة النمو الأسي. أعددنا نوعين من العينات التي تم فيها توزيع الخلايا إما كتجمعات صغيرة من عدة خلايا على سطح شبكة TEM (الشكل 1A، C) أو شكلت طبقة أحادية مستمرة فوق مربعات الشبكة الفردية لشبكة TEM ( الشكل1B، D). العامل التمييزي لإعداد العينة إما مع الجزر الخلية متميزة أو أحادية الطبقة الخلوية هو تركيز ثقافة الخلية المطبقة على شبكة TEM. وتركزت زراعة الخلايا المحصودة على OD600 = 1.0 للحالة الأولى، أو على OD600 = 30 إلى 60 للحالة الأخيرة، على التوالي. تم استكمال العينة لإعداد أحادي الطبقة الخلوية كذلك مع 5٪ v/v الجلسرين قبل التزجيج. الجلسرين أمر بالغ الأهمية لهزة الحل العازلة، الذي يملأ المسافة بين الخلايا(الشكل 2)كما يمكن أن تكون انعكاسات من العازلة البلورية ضارة لتتبع الموضعية المناسبة والتركيز أثناء جمع البيانات cryo-ET.
بالإضافة إلى ذلك ، تم لطخ ثقافة تعليق الخميرة ضد المواد غير الماصة مثل لوحة النشاف PTFE أو لوحة مطبوعة ثلاثية الأبعاد مخصصة مصنوعة من مواد FlexFill 98A. تم وضع ورقة النشاف فقط على الجانب الخلفي من الشبكة فيما يتعلق بتطبيق العينة (النشاف الخلفي). ينصح استراتيجية النشاف الخلفي لثقافة تعليق يغرق تجميد كما النشاف مع ورقة مرشح من كلا الجانبين يؤدي إلى التصاق الخلايا إلى ورقة النشاف (الشكل 1E).
يستخدم البروتوكول الموصوف هنا شبكات TEM المقطوعة في خرطوشة الشبكة ، والتي تشكل دعما مستقرا للشبكة وتيسر معالجة العينة للعينة بعد التزجيج. وهذا يفرض ضرورة أن أصحاب العينات الأخرى والمكوكات في FIB / SEM والمجهر TEM يمكن أن تقبل مثل هذه خرطوشة الشبكة.
عند نقل العينة إلى مجهر FIB /SEM ، تم طلاء العينة لأول مرة بطبقة 0.3-1.0 ميكرومتر من البلاتين الميثيليكلوبينتادينيل باستخدام نظام حقن غاز المجهر (GIS). وطبقة إضافية من الإيريديوم غير العضوي قد تم بصقها على سطح العينة لتصلب طبقة نظم المعلومات الجغرافية وجعل السطح موصلا. تم طحن اللاميلاي في خطوات متعددة(الشكل 3)حيث (I) تيار الطحن ، (II) عرض اللاميلا ، و (III) تم تقليل مسافة منطقة الطحن فوق وتحت العينات بطريقة تدريجية. تم تنفيذ الخطوة الطحن النهائي ("تلميع") في التيار المنخفض (10-30 pA) فقط من الجانب العلوي من lamella ومع العينة يميل من قبل 1 درجة إضافية نحو شعاع Ga + . وقد أدى استخدام البروتوكول الموصوف في المتوسط إلى إعداد 8-10 lamellae على شبكتين TEM في غضون جلسة واحدة مدتها 6-8 ساعات.
تم نقل شبكات TEM مع lamellae في وقت لاحق إلى المجهر الإلكتروني انتقال. تم فحص اللاميلا لأول مرة وتم اختيار فقط تلك التي أظهرت الحد الأدنى من الستائر (القطع الأثرية الناجمة عن الطحن غير المتكافئ عبر سطح اللاميلا) ، وانخفاض مستوى التلوث السطحي ، والتباين الخلوي الجيد (الذي لوحظ عادة لللاميلاي مع سمك <200 نانومتر) للحصول على بيانات cryo-ET. وبالإضافة إلى ذلك، تم التخلص من اللاميلاي الذي يحتوي على شقوق على طول كامل من جمع البيانات. بشكل عام، كان حوالي 50٪ من اللاميلاي المنقول إلى TEM مناسبا للحصول على البيانات. تم جمع سلسلة الميل على كاشف الإلكترون المباشر K2 بعد GIF مع فتحة اختيار الطاقة التي تم تعيينها إلى 20 eV. تم جمع البيانات في برنامج SerialEM18 وتم جمع سلسلة الميل باستخدام مخطط متماثل الجرعة19 مع نطاق الميل من ±60 درجة وزيادة 3 درجات. تم الحصول على البيانات في التكبير المقابل لحجم بكسل من 3.47 A / px. تم توزيع الجرعة الإجمالية من 65 e/Å2 بشكل موحد على الإطارات الفرعية الفردية. تم جمع صور الميل ك مجموعة من ثلاثة إطارات ، والتي تم تصحيحها لاحقا للحركة وتلف الإشعاع أثناء الحصول على البيانات باستخدام برنامج MotionCor220. تم تقدير معلمات وظيفة نقل التباين باستخدام Ctffind421. تمت معالجة سلسلة الميل في eTomo18. تم استخدام روتين تتبع التصحيح لمحاذاة الصور. تم إعادة بناء مخطط ال توموغرام باستخدام خوارزمية إسقاط الظهر المرجحة بعد 2x binning من الصور ، ثم تمت تصفيتها بعد ذلك باستخدام مرشح يشبه SIRT (تم تعيينه إلى 8 تكرارات) في IMOD18. تم تنفيذ تقسيم مخطط الكائنات يدويا في برنامج أميرة22. توفر مخططات التوجرام المعاد بناؤها تمثيلا عالي الدقة للخليلة الداخلية الخميرية وتمكننا من مراقبة العضيات مثل الفاكوليس أو الميتوكوندريا على مستوى عال من التفاصيل أو دراسة المجمعات الجزيئية الكلية مثل microtubules ، أو مجمعات المسام النووية في الموقع وفي ظل ظروف قريبة من السكان الأصليين (الشكل 4).

الشكل 1: صور FIB و SEM ل S. cerevisiae المبهمة
FIB (A) و SEM (C) صور لمجموعات الخميرة الصغيرة المهزوسة على شبكة TEM. FIB (B) و SEM (D) صور الخميرة تشكيل monolayer مستمر على سطح الشبكة. كانت العينة مغلفة بطبقة GIS وIridium قبل التصوير. أشرطة المقياس في لوحات A-B يتوافق مع 10 ميكرومتر. عينة الخميرة ملطخة ضد المواد غير الماصة مثل PTFE أو FlexFill 98A (أخضر) ومع ورقة النشاف المتمركزة من الجانب الخلفي للشبكة (أبيض، E). يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
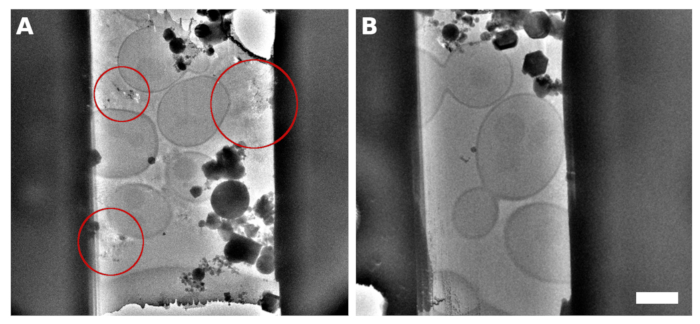
الشكل 2: س. سيريفيسياي لاميلاي
صورة TEM لميكروماشيند اللاميلا من العينة مع خميرة أحادية الطبقة مستمرة على سطح الشبكة. تحتوي الانعكاسات التي لوحظت بين الخلايا على متوسط/عازل مهزوم بشكل غير صحيح (A، تم تمييزه بدوائر حمراء). صورة TEM من lamella ولدت على الخميرة تهتز في monolayer المستمر مع إضافة 5٪ الجلسرين في المتوسط / العازلة (B). شريط المقياس يتوافق مع 2 ميكرومتر. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
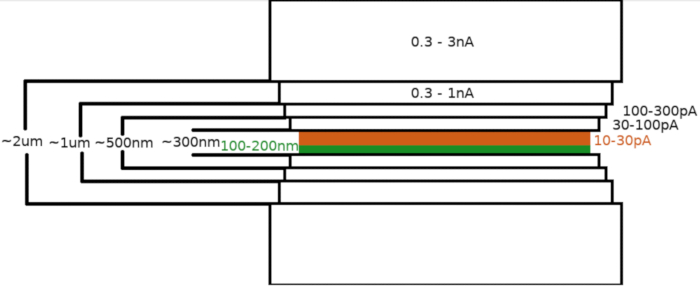
الشكل 3: سير عمل Cryo-FIBM
تصوير تخطيطي لعملية طحن اللاميلا. يتم تنفيذ خطوات الطحن الخام الأولية في التيارات FIB عالية من كلا الجانبين من موقف lamella مؤقتة (أبرز باللون الأخضر) في حين يتم تنفيذ الخطوة النهائية تلميع فقط من الجانب العلوي وعلى انخفاض FIB الحالي (أبرز باللون البرتقالي، انظر الفيديو المصاحبة في 6:33). يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
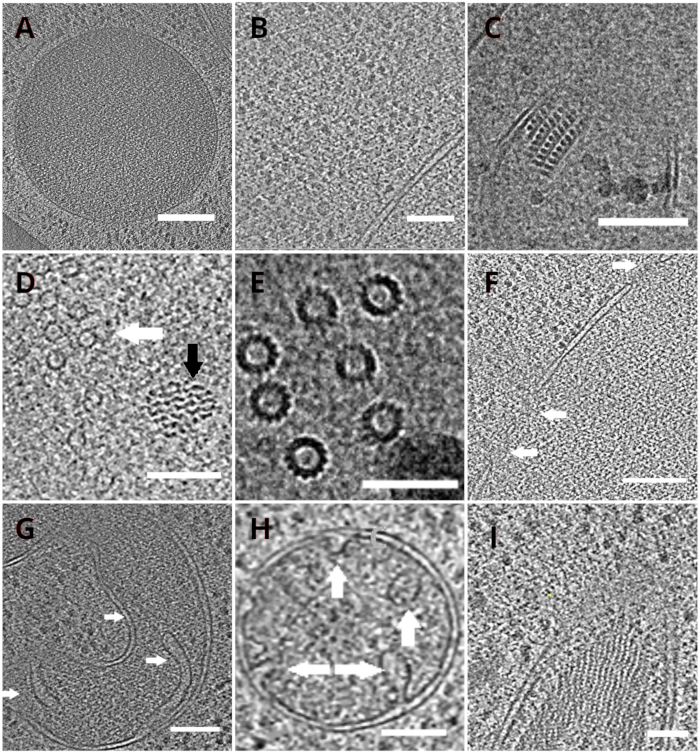
الشكل 4: عضويات الخميرة والمجمعات الجزيئية الكلية التي يصورها cryo-ET
شرائح من توموجرام أعيد بناؤها تصور vacuole (A، شريط مقياس : 200 نانومتر) ، ribosomes (باء ، شريط مقياس: 200 نانومتر), نواة البلورات من بيروكسيسوم(C, شريط مقياس: 100 نانومتر), ميكروتبول (السهم الأبيض) في القرب من بنية ليفية مجهولة (السهم الأسود, D, شريط مقياس: 100 نانومتر), تفاصيل microtubules متعددة (E, شريط مقياس: 50 نانومتر), غشاء نووي مع المسام المشار إليها بالسهام (F, مقياس شريط 200nm), ميتوشوندريون (G, H, شريط مقياس: 100 نانومتر, تشير الأسهم كريستا الفردية), حزمة من الهياكل خيوط مجهولة الهوية (أنا, شريط مقياس: 100 نانومتر). لوحات B، C، D، E، G تحتوي على قسم من توموجرام أعدت من مجموعات صغيرة من الخلايا في حين يتم عرض أقسام توموجرامات التي تم جمعها على lamellae من طبقة واحدة من الخلايا في لوحات A، F، H، I. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
Discussion
إعداد العينات الخلوية لالتبريد ET هو سير عمل معقد يتطلب استخدام العديد من الأدوات الراقية. يمكن اختراق جودة العينة أثناء كل خطوة إعداد تؤثر على إنتاجية البروتوكول بأكمله. وبالإضافة إلى ذلك، فإن ضرورة نقل العينة بين فرادى الأدوات تشكل خطرا إضافيا من تلوث العينة أو إزالة الحتمية. لذلك، التحسين من الخطوات الفردية في سير العمل إعداد العينة ذات أهمية عالية لزيادة الإنتاجية وإعادة إنتاج سير العمل إعداد lamella. يصف البروتوكول المعروض هنا الإعداد الأمثل ل Saccharomyces cerevisiae لتوصيف هيكلي للمجمعات الجزيئية الكلية في الموقع بواسطة cryo-ET.
يصف البروتوكول إعداد نوعين من عينات الخميرة التي تختلف بشكل رئيسي في تركيز الخلايا على شبكة TEM. كل من عينات الخميرة أسفرت عن lamellae عالية الجودة لكريو ET واختيار نوع العينة يمكن أن يتم وفقا لأهداف الدراسة خاصة. الخميرة تشكل مجموعات معزولة من عدد قليل من الخلايا المنتشرة عشوائيا على سطح الشبكة في الحالة الأولى، في حين أن طبقة أحادية مستمرة من الخلايا موجودة على سطح الشبكة TEM لنوع العينة الثانية. الأول هو مناسبة لإعداد lamella سريع بفضل حجم صغير من المواد التي يجب طحنها بعيدا. لاميلا النهائي قصيرة إلى حد ما، وبالتالي، يحتوي فقط 2-4 المقاطع العرضية الخلوية. يتم توزيع المناطق المناسبة لإعداد العينة بشكل عشوائي على سطح الشبكة بما في ذلك مربعات الشبكة ، مما قد يحد جزئيا من أتمتة سير عمل إعداد lamella. يتطلب النوع الأخير من العينة استخدام تيارات أكبر خلال مرحلة الطحن الأولية للاحتفاظ بوقت الطحن الإجمالي. بالإضافة إلى ذلك ، فإن هذا النوع من العينة أكثر عرضة للقطع الأثرية التي تنبع من الطحن غير المتكافئ (الستائر). لذلك ، يتم رش نظام المعلومات الجغرافية على سطح العينة لفترة أطول بنسبة 50٪ مما كانت عليه في حالة العينة ذات المجموعات الخلوية الصغيرة لتشكيل طبقة واقية أكثر سمكا. بعد ذلك ، يتم بصق العينة بطبقة إضافية من الإيريديوم (بدلا من البلاتين أو الذهب) لعلاج طبقة GIS ، وجعلها أكثر صلابة ، وزيادة الموصلية السطحية للعينة. FIBM من مناطق إضافية على كل جانب من lamella (~ 2-5 ميكرومتر من حافة lamella) خلال الخطوة الأولى من الطحن lamella الخام وجد مفيدا لتقليل عدد lamellae مكسورة على الأرجح بسبب انخفاض التوتر في المقطع العرضي النهائي23. لاميلا النهائي طويل ويحتوي على ~ 10 المقاطع العرضية الخلوية، مما يزيد من عدد المناطق المناسبة ل CRYO-ET. يمكن تخفيف التزجيج غير السليم للوسط أو العازلة بين الخلايا بسهولة عن طريق إضافة المبرد إلى محلول العازلة (5٪ الجلسرين المستخدمة في هذه الدراسة). نظرا لأن معظم المربعات مناسبة لإعداد اللاميلا ، فإن العينة ذات الخلايا المنظمة في طبقة أحادية مستمرة مناسبة تماما لإعداد اللاميلا غير الخاضع للرقابة.
جانب آخر مهم في سير العمل إعداد lamella هو نقل إلى المجهر الإلكتروني انتقال وتحديد المواقع المناسبة من lamella إلى محور الميل مرحلة المجهر. على النحو الأمثل، محور اللاميلا الرئيسي عمودي على محور الميل من المجهر الذي يتيح تتبع والتركيز في ذروة المنطقة المصورة ويمنع حواف اللاميلا من حماية مجال الرؤية في زوايا الميل العالي. عند جمع بيانات cryo-ET باستخدام مخطط الجرعة المتماثلة ، يجب تدوير18 العينة في البداية في المجهر للتعويض عن ميل اللاميلا فيما يتعلق بالطائرة الشبكة.
Disclosures
وليس لدى صاحبي البلاغ ما يكشفان عنه.
Acknowledgements
تم دعم هذا العمل من خلال برنامج Instruct-Ultra (منحة 731005) وiNEXT-Discovery (منحة 871037) الممول من برنامج Horizon 2020 التابع للمفوضية الأوروبية والبنية التحتية للأبحاث في CIISB، وهو مركز Instruct-ERIC (LM2018127). ونحن نعترف بالدعم الذي تم الحصول عليه من ثيرمو فيشر العلمية برنو.
Materials
| Name | Company | Catalog Number | Comments |
| Agar | Himedia | MB053 | |
| Glucose | PENTA | 12020-31000 | |
| Glycerol | Merck | G5516-1L | |
| ethane | Messer | 1007 | |
| LN2 | Lineq | LN2-1L | |
| Peptone | Merck | P5905-1KG | |
| Saccharomyces cerevisiae | ATCC | 201388 | strain BY4741 |
| Tweezers | Dumont | T539 | |
| Yeast extract | Duchefa Biochemie | Y1333.1000 | |
| Disposable | |||
| Blotting papers | Ted Pella | 47000-10 | |
| C-clip | ThermoScientific | 9432 909 97551 | |
| C-clip ring | ThermoScientific | 9432 909 97561 | |
| Spreading sticks | Merck | Z376779-1PAK | |
| Sterile inoculation loops | BRAND | BR452201-1000EA | |
| Sterile plastic Petri dishes | Sigma | SIAL0166 | |
| TEM grids | Quantifoil | 4420G-XA | |
| Equipment | |||
| Autoclave | Systec | 101291545 | |
| balances | BEL | M124A | |
| Cryo-FIB/SEM microscope | ThermoScientific | 1006123 | |
| Cryo-TEM microscope | ThermoScientific | 9432 057 03301 | |
| Laminar flow box | Telstar | AH5 | |
| Plasma cleaner | Gatan | 955.82001 | |
| Shaking incubator | New Brunswick | M1282-0002 | |
| UV/VIS spectrophotometer | WPA | S800 | |
| Vitrification robot | ThermoScientific | 9432 053 50621 |
References
- McMullan, G., Faruqi, A., Clare, D., Henderson, R. Comparison of optimal performance at 300keV of three direct electron detectors for use in low dose electron microscopy. Ultramicroscopy. 147, 156-163 (2014).
- Zivanov, J., et al. New tools for automated high-resolution cryo-EM structure determination in RELION-3. eLife. 7, (2018).
- Dubochet, J., McDowall, A. W. Vitrification of pure water for electron microscopy. Journal of Microscopy. 124, 3-4 (1981).
- Villa, E., Schaffer, M., Plitzko, J. M., Baumeister, W. Opening windows into the cell: focused-ion-beam milling for cryo-electron tomography. Current Opinion in Structural Biology. 23, 771-777 (2013).
- Mahamid, J., et al. Visualizing the molecular sociology at the HeLa cell nuclear periphery. Science. 351 (6276), 969-972 (2016).
- Schur, F. K. Toward high-resolution in situ structural biology with cryo-electron tomography and subtomogram averaging. Current Opinion in Structural Biology. 58, 1-9 (2019).
- O'Reilly, F. J., et al. In-cell architecture of an actively transcribing-translating expressome. Science. 369, 554-557 (2020).
- Rice, W. J., et al. Routine determination of ice thickness for cryo-EM grids. Journal of Structural Biology. 204, 38-44 (2018).
- Al-Amoudi, A., Norlen, L. P. O., Dubochet, J. Cryo-electron microscopy of vitreous sections of native biological cells and tissues. Journal of Structural Biology. 148, 131-135 (2004).
- Al-Amoudi, A., Studer, D., Dubochet, J. Cutting artefacts and cutting process in vitreous sections for cryo-electron microscopy. Journal of Structural Biology. 150, 109-121 (2005).
- Pierson, J., et al. Improving the technique of vitreous cryo-sectioning for cryo-electron tomography: electrostatic charging for section attachment and implementation of an anti-contamination glove box. Journal of Structural Biology. 169, 219-225 (2010).
- Dubochet, J., et al. How to "read" a vitreous section. Methods in Cell Biology. 79, 385-406 (2007).
- Rigort, A., et al. Focused ion beam micromachining of eukaryotic cells for cryoelectron tomography. Proceedings of the National Academy of Sciences. 109, 4449-4454 (2012).
- Schaffer, M., et al. Cryo-focused Ion Beam Sample Preparation for Imaging Vitreous Cells by Cryo-electron Tomography. Bio-protocol. 5, (2015).
- Wagner, F. R., et al. Preparing samples from whole cells using focused-ion-beam milling for cryo-electron tomography. Nature Protocols. 15 (6), 2041-2070 (2020).
- Buckley, G., et al. Automated cryo-lamella preparation for high-throughput in-situ structural Biology. Journal of Structural Biology. 210 (2), 107488 (2020).
- Zachs, T., et al. Fully automated, sequential focused ion beam milling for cryo-eletron tomography. eLife. e52286, (2020).
- Mastronarde, D. N. Automated electron microscope tomography using robust prediction of specimen movements. Journal of Structural Biology. 152, 36-51 (2005).
- Hagen, W. J., Wan, W., Briggs, J. A. Implementation of a cryo-electron tomography tilt-scheme optimized for high resolution subtomogram averaging. Journal of Structural Biology. 197, 191-198 (2017).
- Zheng, S. Q., et al. MotionCor2: anisotropic correction of beam-induced motion for improved cryo-electron microscopy. Nature Methods. 14, 331-332 (2017).
- Rohou, A., Grigorieff, N. CTFFIND4: Fast and accurate defocus estimation from electron micrographs. Journal of Structural Biology. 192, 216-221 (2015).
- Stalling, D., Westerhoff, M., Hege, H. -. C. Amira: A highly interactive system for visual data analysis. The Visualization Handbook. , 749-767 (2005).
- Wolff, G., et al. Mind the gap: Micro-expansion joints drastically decrease the bending of FIB-milled cryo-lamellae. Journal of Structural Biology. 208, 107389 (2019).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved