Method Article
Подготовка и крио-FIB микрообработка Saccharomyces cerevisiae для криоэлектронной томографии
В этой статье
Резюме
Представлен протокол приготовления ламельных пленок замороженных биологических образцов крио-сфокусированной ионно-лучевой микрообработкой для структурных исследований макромолекул in situ с высоким разрешением с помощью криоэлектроно-томографии. Представленный протокол содержит рекомендации по получению высококачественных ламелл с высокой воспроизводимостью для структурной характеристики макромолекул внутри Saccharomyces cerevisiae.
Аннотация
На сегодняшний день криоэлектронная томография (крио-ЭТ) является единственным методом, который может обеспечить структурные данные о макромолекулярных комплексах in situ с почти атомным разрешением. Из-за сильного взаимодействия электрона с веществом исследования крио-ET высокого разрешения ограничиваются образцами толщиной менее 200 нм, что ограничивает применимость крио-ET только к периферическим областям клетки. Сложный рабочий процесс, который включает в себя подготовку тонких клеточных поперечных сечений с помощью крио-сфокусированной ионно-лучевой микрообработки (крио-FIBM), был введен в течение последнего десятилетия, чтобы обеспечить получение крио-ET данных изнутри более крупных ячеек. Представлен протокол получения клеточных ламелл из образца, остеклованного погружной заморозкой с использованием Saccharomyces cerevisiae в качестве прототипа эукариотической клетки с широким использованием в исследованиях клеточной и молекулярной биологии. Мы описываем протоколы витрификации S. cerevisiae в изолированные участки нескольких клеток или непрерывный монослой клеток на сетке ТЭМ и предоставляем протокол получения ламелей крио-FIB для этих двух образцов.
Введение
Последние технологические и программные разработки сделали электронную криомикроскопию (крио-ЭМ) остеклованных биологических образцов одним из ключевых методов в исследованиях структурной биологии в последнее десятилетие1,2. Подготовка образца для крио-ЭМ обычно состоит из нанесения очищенного белка или комплекса белка с нуклеиновой кислотой на носитель образца (сетку ТЭМ) с последующим удалением большей части жидкости фильтровальной бумагой и погружением замораживания сетки остаточным тонким слоем образца в жидкий этан или пропан3 . Таким образом, образец фиксируется в тонком слое (обычно <80 нм) аморфного буфера в полностью гидратированном состоянии, в почти нативных условиях и без необходимости какой-либо химической фиксации или контрастирования тяжелых металлов. Визуализация структурно однородного образца в просвечиваемом электронном микроскопе затем приводит к данным, которые могут быть использованы для определения трехмерной структуры макромолекулы при околоатомном разрешении с использованием протокола анализа одиночных частиц2. Такая структура in vitro соответствует представлению макромолекулы в условиях и обработке, используемых во время пробоподготовки. Хотя структуры, определенные в условиях in vitro, обычно соответствуют полностью функциональному состоянию макромолекулы, способность изображать пространственные отношения между различными макромолекулами внутри клетки обеспечит дополнительный функциональный контекст к структурным данным.
Криоэлектроно-томография (крио-ЭТ) используется для реконструкции 3D объемов плеоморфных объектов или макромолекулярных комплексов in situ4,5. Преимущество крио-ИНОПЛАНЕТЯН заключается в том, что трехмерная информация получается путем визуализации единого объекта. Однако разрешение, при котором наблюдаются отдельные высокомолекулярные комплексы или органеллы, очень ограничено. Поэтому усреднение макромолекул (усреднение субтомограмм, STA) с одинаковой структурой из большего числа томограмм необходимо для достижения моделей с разрешением 4-8 Å из крио-ET данных6,7. Недавно было показано, что крио-ET и STA также могут быть применены для определения структур высокого разрешения макромолекулярных машин, таких как рибосомы, в контексте клеточной среды7. Однако использование просвечивающих электронных микроскопий ограничено толщиной образца. В целом, это не проблема для крио-ЭМ с одной частицей, где оптимизация условий витрификации может в конечном итоге привести к встраиванию образца в тонкий слой льда. С другой стороны, большинство ячеек на самом деле не являются электронными прозрачными для электронного пучка 300 кэВ. Неупругой средний свободный путь в остеклованных биологических образцах для электронов 300 кэВ составляет приблизительно 395 нм8,что означает, что крио-ET исследования ограничены клеточной периферией для большинства клеток.
Были разработаны различные методы для разбавливания образца до достаточной толщины для крио-ET. Крио-ультрамикротомия использует механическую нарезку образца алмазным ножом при температуре жидкого азота (-196 °C) для обеспечения сечений толщиной 60-80нм,пригодных для крио-ET9,10,11. Несколько секций могут быть подготовлены из одной ячейки, и анализ данных может в конечном итоге получить 3D-структурную информацию для большей части ячейки. Однако механическая нарезка может вызвать несколько артефактов, таких как изогнутые срезы, трещины или сжатие образца, которые могут влиять на результирующую структуру и смещение крио-ET данных10,11,12. Криофокусированная микрообработка ионного пучка (крио-FIBM) представляет собой альтернативный подход, при котором тонкое клеточное сечение получают путем постепенной абляции образца с использованием сфокусированного пучка ионов Ga+ (FIB) в многоступенчатом процессе, что может привести к клеточному поперечному сечению (ламелла) толщиной 80–300 нм (ламелла)13,14,15 . В отличие от крио-ультрамикротомии, из одной ячейки получают только одну ламель, которая составляет ~0,3–3% ее объема, и микрообработка нескольких клеток обычно необходима для нахождения интересующей области в измельченном поперечном сечении. Кроме того, пропускная способность всего рабочего процесса в настоящее время все еще довольно низкая, часто ограниченная 6-8 высококачественными ламеллами из 8-часового сеанса крио-FIBM. С другой стороны, поперечные сечения крио-FIBM лишены каких-либо артефактов сжатия и обеспечивают подходящий вход для крио-ET высокого разрешения. Кроме того, перенос ламели на носитель образца для крио-ЭТ не является необходимым, поскольку образец удерживается на сетке ТЕА в течение всего процесса подготовки ламеля, и эта же сетка может быть впоследствии перенесена в ТЕА. Мы ожидаем, что пропускная способность крио-FIBM будет значительно улучшена в ближайшее время, в первую очередь за счет наличия программного обеспечения для неконтролируемого фрезерования ламелей16,17 и использования FIB, работающих по принципу плазмы зарядовой пары, что позволит быстрее абляцию материала.
Saccharomyces cerevisiae (дрожжи) представляют собой эукариотические клетки сферической формы и диаметром ~2-5 мкм. Благодаря своему размеру, доступности, генетике, времени генерации и простым манипуляциям, дрожжи широко изучаются как эукариотический модельный организм в исследованиях клеточной и молекулярной биологии, аналогичных кишечной палочке,которая хорошо изучена как прокариотический модельный организм в бактериологии. Дрожжи можно легко культивируемы в суспензии, и за короткое время образуется большое количество клеток (время удвоения 1 - 2 часа). Что еще более важно, дрожжи разделяют сложную внутреннюю клеточную структуру с клетками животных и растений, сохраняя при этом небольшой геном, состоящий из низкого содержания некодирующей ДНК. Структурная характеристика протеома дрожжей на основе данных in situ с высоким разрешением может помочь обеспечить механистическое описание обширного объема функциональных данных, доступных в литературе.
В настоящем документе мы предоставляем комплексный протокол для получения данных in situ cryo-ET о образце дрожжей, который охватывает все этапы от культивирования образца до подготовки крио-FIBM ламелей и передачи образца в TEM для сбора крио-ET данных.
протокол
1. Культивирование и подготовка клеток Saccharomyces cerevisiae для витрификации
- Приготовьте жидкую питательную среду для Saccharomyces cerevisiae.
- Автоклав стеклянной бутылки объемом 500 мл для приготовления питательной среды.
- Взвесьте 2,2 г дрожжевого экстракта (1,1%) и 4,4 г Пептона (2,2%) и смешайте в 200 мл воды.
- Стерилизуют автоклавами в течение 15 мин при 121 °C.
- Взвесите 10 г порошка глюкозы и смешайте в 50 мл воды, чтобы получить 20% раствор глюкозы. Пропустите раствор через фильтр 0,2 мкм и храните при 4 °C.
- Приготовьте твердую среду для Saccharomyces cerevisiae.
- Взвесите 4 г порошка агара и смешайте с 200 мл питательной среды.
- Стерилизуют в автоклаве в течение 15 мин при 121 °C.
- Охладить среду до 40-50 °C и добавить 20 мл 20% стерильной глюкозы (приготовленной на предыдущем этапе). Налейте ~20 мл полной среды в чашку Петри и дайте ей затвердеть при температуре окружающей среды.
- Оберните агаровые пластины в парапленку для защиты от высыхания и храните при 4 °C.
- Культура Saccharomyces cerevisiae в суспензии
ПРИМЕЧАНИЕ: Протокол оптимизирован для получения образца крио-FIBM из суспензии клеточной линии Saccharomyces cerevisiae штамма BY4741 [ATCC 4040002] или аналогичных штаммов.- Автоклав 50 мл колбы Эрленмейера (или аналогичной).
- Работайте в вытяжке или ламинарной блоке. Пипетка 10 мл питательной среды в стерильную 50 мл колбу Эрленмейера.
- Дополнить среду 1 мл отфильтроированной 20% глюкозы. Выберите одну колонию дрожжей из агаровой пластины стерильной, одноразовой петлей прививки (1-10 мкл).
- Поместите колбу Эрленмайера в инкубатор и культивируем при 30 °C с перемешиванием (150-200 об/мин) до достижения экспоненциальной фазы (приблизительно 7 ч).
ПРИМЕЧАНИЕ: Мы заметили, что экспоненциальная фаза достигается через ~ 15 ч, когда колонии собираются из агаровых пластин, которые культивировались при температуре окружающей среды в течение 4 недель. См. также Примечание ниже.
- Культура Saccharomyces cerevisiae на агаровой тарелке из глицеринового бульона.
- Используйте новую агаровую пластину из хранилища при 4 °C.
- Возьмите запас S. cerevisiae из морозильной камеры с температурой -80 °C и поместите его в морозильную стойку, чтобы избежать полного оттаивания запаса.
- Соскоблить и перенести небольшую культуру стерильной петлей инокуляции (1-10 мкл) в 50 мкл питательной среды. Правильно перемешать.
- Переложить весь объем смешанной культуры S. cerevisiae и диспергировать стерильной палочкой по поверхности агаровой пластины.
- Инкубируют при 30 °C в течение приблизительно 48 часов до образования колоний диаметром 1,5-2 мм.
ПРИМЕЧАНИЕ: Перед экспериментом рекомендуется культивировать колонии заново. Колониям старше 1 недели потребуется длительный период для выращивания в жидких средах, чтобы достичь фазы экспоненциального роста.
- Культура Saccharomyces cerevisiae на агаровидной тарелке.
- Используйте подготовленные агариные пластины с выращенными колониями S. cerevisiae.
- Пипетка 10 мл стерильной питательной среды и 1 мл отфильтрования 20% глюкозы в колбу Эрленмейера 50 мл.
- Выберите одну колонию культуры S. cerevisiae со стерильной петлей прививки и смешайте со питательной средой в колбе.
- Инкубировать 50 минут при 30 °C с перемешиванием (150-200 об/мин).
- Разбавить культуру суспензии в десять раз питательной средой и диспергировать 50 мкл суспензии на агаровой пластине стерильной палочкой для разбрасывания.
- Инкубируют при 30 °C в течение приблизительно 48 часов до 1,5-2 мм колоний.
- Оберните края чашки Петри парапленкой, чтобы она не высохела. Хранить при комнатной температуре и использовать максимум 4 недели.
- Подготовьте Saccharomyces cerevisiae для погружения в клеточные кластеры.
- Готовят культуру клеток S. cerevisiae согласно протоколу в разделе Культивирование Saccharomyces cerevisiae во суспензии (раздел 1.3) и инкубируют ~7 ч при 30 °C с перемешиванием (150-200 об/мин).
- Измерьте OD культуры суспензии клеток S. cerevisiae при 600 нм с помощью спектрофотометра UV/Vis.
- Сконцентрируйте клеточную суспензию до OD600 = 1.
- Подготовьте S. cerevisiae для погружной заморозки в клеточном монослое.
- Готовят культуру клеток S. cerevisiae по протоколу в разделе Культивирование культуры суспензии Saccharomyces cerevisiae и инкубируют ~7 ч при 30 °C с перемешиванием (150-200 об/мин).
- Измерьте OD культуры суспензии клеток S. cerevisiae при 600 нм с помощью спектрофотометра UV/Vis.
- Перенесите ячейки в среде в трубку центрифуги и осторожно вращайте в течение 2 минут с относительной центробежной силой (900 х г).
- Выбросьте среду из ячейки гранулы путем пипетки.
- Добавьте свежую среду в ячейку гранулы. Рассчитайте объем среды, чтобы получить ячейку суспензии OD600, равную 30 - 60.
- Добавляют глицерин (50% стоковый раствор) в клеточную суспензию до конечной концентрации 5% незадолго до витрификации.
ПРИМЕЧАНИЕ: Глицерин работает как защитное средство, которое улучшает качество льда в областях между клетками. Глицерин добавляют в клетки только незадолго до витрификации, чтобы свести к минимуму его поглощение клеткой.
2. Витрификация образца Saccharomyces cerevisiae
- Сетки ТЭМ нагнетательного разряда со стороной углеродной пленки, обращенной вверх на 30-45 с (давление: 6-9 Па, ток: 7 мА).
- Установите для витрификации робота следующие параметры: температура: 18 °C, влажность: 100%, время промоктовки: 6 с, время ожидания: 5 с, цикл блоттинга: 1x, и сила пятна: 5.
ПРИМЕЧАНИЕ: Сила пятна является специфичной для прибора величиной, и оптимальные значения силы пятна могут отличаться в разных машинах. Оптимальное значение для конкретного плунжера должно быть экспериментально подтверждено. - Подготовьте жидкий этан для витрификации.
- Установите неабсорбировочную поверхностную подушку на прокладку для промоктирования, обращенную к образцу. Используйте фильтровальную бумагу для другой блокнота.
- Выберите сетку с разряженным свечением с пинцетом и установите пинцет на инструмент погружной заморозки.
- Нанесите 3,5 мкл суспензии S. cerevisiae на углеродную сторону сетки внутри плунжерной климатической камеры. Правильно перемешайте перед каждым нанесением на сетку.
- Погрузите сетку в жидкий этан.
- Перенесите сетку с жидкого этана на LN2. Храните сетки с остеклованными ячейками в условияхLN 2 или устанавливайте их в картридж сетки TEM для загрузки в микроскоп FIB-SEM.
3. Монтаж сеток TEM в картридж сетки
ПРИМЕЧАНИЕ: В описанном здесь рабочем процессе используются сетки ТЕА, установленные в картридж сетки, для облегчения обработки образцов и передачи между микроскопами SEM и TEM. Картридж состоит из C-кольца, сетки TEM и кольца C-clip. Другие опции доступны при работе с приборами других производителей микроскопов. Рабочая станция сборки сетчатого картриджа заполнена LN2. Уровень LN2 покрывает сетку сетками TEM, но монтаж сеток TEM в картридж выполняется в парах LN2. Настоятельно рекомендуется носить защитную маску для лица или щиток во время процедуры витрификации, чтобы предотвратить загрязнение от дыхания образца. Не работайте с инструментами, которые накопили ледяное загрязнение.
- Соберите рабочую станцию для сборки картриджа сетки и подготовьте сухие инструменты для обрезки.
- Охладите сборочную рабочую станцию с помощью LN2. Охладите обтравочные инструменты до температурыLN 2.
- Поместите коробку сетки с остеклованным образцом на сборочную рабочую станцию.
- Поместите сетку ТЭМ с образцом с ячейками, обращенными вниз к С-кольцу, и закрепите С-зажимом.
- Поместите обрезанные картриджи в сетку и закройте их должным образом.
- Храните картриджи в LN2 Dewar или загружайте их в микроскоп FIB-SEM.
4. Загрузка и манипуляция образца в микроскоп FIB-SEM
ПРИМЕЧАНИЕ: Инструкция была написана для использования двухлучевого микроскопа Versa 3D, оснащенного системой подготовки крио-FIB/SEM PP3010. Альтернативные решения могут потребовать различных специфических параметров; однако общая концепция рабочего процесса должна по-прежнему быть актуальной.
- Охладите микроскоп до температуры жидкого азота.
- Накачайте камеру микроскопа и подготовительный блок (если они присутствуют) в высокий вакуум перед началом охлаждения (< 4 х 10-4 Па), чтобы предотвратить рост загрязнения.
- Установите расход газообразного азота на 5 л/мин для подготовительной камеры, ступени микроскопа и микроскопического антиконтаминатора. Подождите, пока все компоненты не достигнут температуры < -180 °C.
ПРИМЕЧАНИЕ: Установка микроскопа FIB-SEM, используемая в этом исследовании, использует охлажденный газообразный азот для охлаждения своей стадии и антиконтаминатора. Другие системы могут использовать другой метод охлаждения ступеней. Давление в камере достигает ~3 х 10-5 Па, как только ступень и антиконтаминатор находятся при -190 °C на используемом здесь приборе. Скорость роста загрязняющего углеводороды слоя на поверхности ламели с экспериментальной установкой, используемой в этом исследовании, составляет ~ 15 нм / час.
- Загрузите сетчатый картридж вместе с образцом в микроскоп.
- Соберите и охладите погрузочную станцию до температурыLN 2.
- Поместите шаттл (держатель образца), сетчатый ящик с образцом, открывалку для коробки сетки и пинцет в охлаждаемую погрузочную станцию.
- Осторожно переложите сетчатый картридж с образцом лицом вверх в шаттл.
- Переверните шаттл внутри погрузочной станции в положение погрузки.
- Загрузите в микроскоп.
- Опционально покрыть образец металлическими защитными слоями.
ПРИМЕЧАНИЕ: Сильный зарядный эффект можно наблюдать при визуализации замороженного гидратированного биологического материала SEM. Кроме того, визуализация биологических образцов с помощью FIB (даже при низких токах) вызывает быстрое повреждение образца. Поэтому дополнительное покрытие образца может быть выполнено внутри микроскопа FIB-SEM для защиты поверхности образца.- Нанесите защитный слой металлоорганической платины с помощью системы впрыска газа (ГИС).
- Установите образец на эйцентрическую высоту (точка совпадения для визуализации с электронами и ионами).
- Наклоните сцену обратно на 45° (образец наклоняется на 90° относительно электронного пучка).
- Переместите сцену по оси z на4 мм ниже высоты эйцентрика.
- Установите иглу ГИС на 26–30 °C.
- Нанесение ~300-1000 нм металлоорганического платинового слоя на сетку с биологическим образцом (соответствует 30–120 с ГИС-осаждения).
ПРИМЕЧАНИЕ: Мы обычно применяем ГИС для 30 с для образцов с небольшими клеточными кластерами и 45 с для образцов с монослоем ячеек.
- Напыление покрывает поверхность образца проводящим металлическим слоем.
- Нанесите ~10 нм металлического слоя (Ir, Au, Pt) на сетку с биологическим образцом.
- Нанесите защитный слой металлоорганической платины с помощью системы впрыска газа (ГИС).
- Установка параметров микроскопа для приготовления ламели
- Для FIB используют следующие параметры: высокое напряжение = 30 кВ, ток = 10 пА (визуализация), 10 пА–3 нА (FIB-фрезерование)
- Для SEM используют следующие параметры: высокое напряжение = 2–5 кВ, размер пятна = 4,5, ток = 8–27 пА.
- Установите поворот сканирования на 180° для обоих лучей.
- Установка наклона сцены: угол фрезерования 6-11° (соответствует наклону ступени 13°–18° для челнока образца с предварительным наклоном 45° и микроскопа FIB/SEM с углом 52° между SEM и колонкой FIB).
5. Приготовление ламели Saccharomyces cerevisiae
- Проверьте качество сетки и выберите подходящий кластер Saccharomyces cerevisiae.
- Убедитесь, что сетка ТЭМ правильно промокта с обеих сторон без дополнительной воды вокруг кластера ячеек или на обратной стороне сетки.
ПРИМЕЧАНИЕ: Чтобы проверить заднюю сторону сетки, поверните сцену на -10° и изобразите сетку с помощью FIB. - Подбирайте оптимальные клеточные кластеры для приготовления ламели в соответствии со следующими рекомендациями.
- Расположите кластеры ячеек в центре сетки. Площадь фрезерования не должна выходить за пределы квадрата с размерами 1100 х 1100 мкм, расположенного в центре сетки (по 550 мкм в каждом направлении от центра сетки).
- Расположите кластеры ячеек в центральной части квадрата сетки без перекрытия на полосу сетки.
- Расположите кластеры ячеек в квадрате сетки с компактной дырявой углеродной фольгой без трещин.
- Убедитесь, что кластер не окружен ледяным загрязнением.
- Убедитесь, что сетка ТЭМ правильно промокта с обеих сторон без дополнительной воды вокруг кластера ячеек или на обратной стороне сетки.
- Выберите оптимальное положение фрезерования в монослое Saccharomyces cerevisiae.
- Убедитесь, что полосы сетки, окружающие монослой ячейки на выбранном квадрате сетки, видны.
- Выберите оптимальное положение в сотовом монослое согласно следующим рекомендациям. Выбранные участки для фрезерования должны удовлетворять следующим критериям:
- Имить интересуяшую область в центре сетки. Площадь фрезерования не должна выходить за пределы квадрата размеров 1100 х 1100 мкм, расположенного в центре сетки (по 550 мкм в каждую сторону от центра сетки).
- Иметь интересующую область в центральной части квадрата сетки без перекрытия с полосой сетки.
- Не окружайте монослой ячейки ледяным загрязнением.
- Приготовить ламелю S. cerevisiae с крио-FIB.
ПРИМЕЧАНИЕ: Схема фрезерования генерируется и центрируется относительно интересующей области. Крио-FIBM выполняется последовательно с несколькими этапами фрезерования, выполняемыми при различных настройках FIB. Ламелла толщиной около 2 мкм первоначально фрезеруется с использованием сильного тока (0,3–3 нА). Затем ламелла постепенно истончается до 500 нм. Этап тонкого фрезерования при малых токах (10-30 пА) используется для доработки ламели до толщины ~100–200 нм.- Установите интересуемую область (ROI) на эйцентрическую высоту и сохраните эту позицию.
ПРИМЕЧАНИЕ: Точка совпадения должна быть определена и сохранена для каждой позиции отдельно. Высота эйцентрика задается наклоном сцены до 0° и центрированием на ROI путем перемещения сцены в направлении x и y. Затем ступень наклоняется до 25°, а окупаемое окупаемое ося возвращается в центр сканируемой области путем изменения положения оси zступени. Наконец, ступень наклоняется назад до 13°–18° для фрезерования. - Определите прямоугольный фрезерный рисунок над окупаемости инвестиций с направлением сканирования сверху вниз.
- Определите прямоугольный шаблон фрезерования ниже roi с направлением сканирования снизу вверх.
- Определите неактивный прямоугольный фрезерный рисунок, охватывающий интересующую область, для приблизительной оценки толщины ламели. Этот рисунок не фрезеруется во время приготовления ламели.
- Отметьте все узоры и установите ширину ламели(размер x). Ширина фрезерной схемы не должна превышать 2/3 ширины кластера. В большинстве случаев это соответствует 8–15 мкм.
- Установка параметров для грубых этапов фрезерования
- Ток FIB: 0,3–3,0 нА; конечная толщина ламели: 1,5–2 мкм; ширина площади FIBM: 8-12 um; наклон ступени: 13-17°; продолжительность: 8 минут; активные схемы фрезерования: верхний и нижний.
- Ток FIB: 0,3–1,0 нА; конечная толщина ламели: 1 мкм; ширина площади FIBM: 7,5-11,5 мкм; наклон ступени: 13-17°; продолжительность: 8 минут; активные схемы фрезерования: верхний и нижний.
- Ток FIB: 100–300 пА; конечная толщина ламели: 0,5 мкм; ширина площади FIBM: 7,5-11,5 мкм; наклон ступени: 13-17°; продолжительность: 8 минут; активные схемы фрезерования: верхний и нижний.
- Ток FIB: 30–100 пА; конечная толщина ламели: 0,3 мкм; ширина площади FIBM: 7,5-11,5 мкм; наклон ступени: 13-17°; продолжительность: 8 минут; активные схемы фрезерования: верхний и нижний.
- Задайте параметры для этапа тонкого фрезерования:
- Ток FIB: 10–30 пА; окончательная толщина ламели: <0,2 гм; ширина площади FIBM: 7-11 мкм; наклон ступени: 13-17° (+1°); продолжительность: 12 минут; активные фрезерные схемы: верхние.
ПРИМЕЧАНИЕ: Грубые этапы фрезерования (5.3.6) проводятся последовательно для каждой ламели. Напротив, этап тонкого фрезерования (5.3.7) непосредственно не следует за грубым фрезерованием, но тонкие этапы фрезерования проводятся последовательно для всех ламелл в конце сеанса, чтобы свести к минимуму загрязнение углеводородами на поверхности ламели. Дополнительный наклон ступени +1° используется на стадии тонкого фрезерования для увеличения однородности толщины ламели по всей ее длине.
- Ток FIB: 10–30 пА; окончательная толщина ламели: <0,2 гм; ширина площади FIBM: 7-11 мкм; наклон ступени: 13-17° (+1°); продолжительность: 12 минут; активные фрезерные схемы: верхние.
- Установите интересуемую область (ROI) на эйцентрическую высоту и сохраните эту позицию.
6. Перенос ламели Saccharomyces cerevisiae в крио-ТЭМ
- Приготовьте правильно высушенный Дьюар и наполните его LN2.
- Выгрузите образцы с ламеллами из микроскопа FIB/SEM в криокуме, перенесите их в сетчатую коробку и храните в хранилище LN2 Dewar для длительного хранения. В качестве альтернативы можно загрузить сетки непосредственно в крио-ТЭМ.
- Важна правильная ориентация ламели относительно оси наклона крио-ТЭМ (подробнее см. сопроводительное видео в 8:10). Убедитесь, что направление фрезерования подготовленных ламелл перпендикулярно оси наклона крио-ТЭМ.
- Предварительно наклоните крио-ТЭМ ступень для компенсации наклона ламели относительно плоскости сетки и соберите наклонный ряд с использованием дозосимметричной схемы19.
ПРИМЕЧАНИЕ: Величина предварительного наклона (обычно 6–8°) определяется углом между плоскостью сетки ТЕА и направлением FIB во время микрообработки. Положение переднего края ламели на изображении в крио-ТЭМ может быть использовано для определения знака угла предварительного наклона. Для этого должен быть известен смысл вращения ступени микроскопа. В нашей экспериментальной установке положение переднего края ламели с правой стороны изображения, снятого в режиме nanoprobe SA, соответствует отрицательному предварительному наклону.
Результаты
Культура Saccharomyces cerevisiae была собрана в середине фазы экспоненциального роста. Мы подготовили два типа образцов, в которых ячейки были либо распределены в виде небольших кластеров из нескольких ячеек по поверхности сетки ТЕА(рисунок 1А,C),либо образовывали непрерывный монослой над отдельными квадратами сетки ТЕА(рисунок 1B,D). Дискриминативным фактором для получения образца либо с отдельными островками клеток, либо с клеточным монослоем является концентрация клеточной культуры, нанесенной на сетку ТЭМ. Собранную клеточную культуру концентрировали до OD600 = 1,0 для первого случая или до OD600 = 30-60 для второго случая, соответственно. Образец для получения клеточного монослоя дополнительно дополняли 5% v/v глицерином до витрификации. Глицерин имеет решающее значение для витрификации буферного раствора, который заполняет пространство между ячейками(рисунок 2),поскольку отражения от кристаллического буфера могут быть вредными для правильного позиционного отслеживания и фокусировки во время сбора крио-ET данных.
Кроме того, культуру дрожжевой суспензии смачивали на неабсорбирующий материал, такой как прокладка для продувки из PTFE или пользовательская 3D-печатная прокладка из материала FlexFill 98A. Промокательная бумага была расположена только на обратной стороне сетки по отношению к образцу приложения (обратное промокание). Стратегия обратного продувания рекомендуется для замораживания культуры погружения суспензии, так как промокание фильтровальной бумагой с обеих сторон приводит к сцеплению клеток с блоттинговой бумагой(рисунок 1E).
Протокол, описанный здесь, использует сетки ТЕА, обрезанные в картридже сетки, что образует стабильную опору для сетки и облегчает обработку образца образца после витрификации. Это обусловливает необходимость того, чтобы другие держатели образцов и челноки в микроскопе FIB/SEM и TEM могли принимать такой картридж с сеткой.
После переноса образца в микроскоп FIB/SEM образец сначала покрывали слоем метилциклопентадиенил платины размером 0,3–1,0 мкм с использованием системы впрыска газа микроскопа (ГИС). Дополнительный слой неорганического иридия распыляли на поверхность образца, чтобы затвердеть слой ГИС и сделать поверхность проводящей. Ламели фрезеровали в несколько этапов(фиг.3),где (I) тока фрезерования, (II) ширины ламели и (III) расстояния площади фрезерования выше и ниже образцов уменьшались поэтапно. Заключительную ступень фрезерования («полировку») проводили при слабом токе (10-30 пА) только с верхней стороны ламели и с образцом, наклонено на дополнительный 1° к балке Ga+. Использование описанного протокола в среднем привело к тому, что 8-10 ламелл готовились на двух сетках ТЕА в течение одного 6-8-часового сеанса.
Сетки ТЭМ с ламеллами впоследствии были перенесены в просвечиваюнный электронный микроскоп. Ламели были сначала просеяны, и только те, которые показали минимальную завесу (артефакты, вытекающие из неравномерного фрезерования по всей поверхности ламели), низкий уровень загрязнения поверхности и хороший клеточный контраст (обычно наблюдаемый для ламелл с толщиной <200 нм), были выбраны для получения крио-ET данных. Кроме того, ламели, содержащие трещины по всей длине, были выброшены из сбора данных. В целом около 50% ламелл, передаваемых в ТЕА, пригодны для сбора данных. Клоновые серии были собраны на пост-GIF K2 прямом электронном детекторе с щелью, выбирающей энергию, установленной на 20 эВ. Сбор данных осуществляли в программном обеспеченииSerialEM 18, а серии наклона собирали с использованием дозосимметричной схемы19 с диапазоном наклона ±60° и приращением 3°. Данные были получены при увеличении, соответствующем размеру пикселя 3,47 A/px. Общая доза 65 e/Å2 равномерно распределялась по отдельным подрамрам. Изображения наклона были собраны в виде набора из трех кадров, которые впоследствии были скорректированы на движение и радиационное повреждение во время сбора данных с помощью программы MotionCor220. Параметры функции контрастного переноса оценивались с помощью Ctffind421. Тентовая серия была обработана в eTomo18. Процедура отслеживания исправлений использовалась для выравнивания изображений. Томограмма была реконструирована с использованием взвешенного алгоритма обратной проекции после 2-кратного биннинга изображений, а затем отфильтрована с помощью SIRT-подобного фильтра (установленного на 8 итераций) в IMOD18. Сегментация томограммы проводилась вручную в программном обеспечении Amira22. Реконструированные томограммы обеспечивают представление клеточного интерьера дрожжей с высоким разрешением и позволяют нам наблюдать органеллы, такие как вакуоли или митохондрии, на высоком уровне детализации или изучать макромолекулярные комплексы, такие как микротрубочки или ядерные поровые комплексы in situ и в почти нативных условиях(рисунок 4).

Рисунок 1: Изображения FIB и SEM остеклованных S. cerevisiae
Изображения FIB(A)и SEM(C)небольших скоплений дрожжей, остекленных на сетке ТЕА. ИЗОБРАЖЕНИЯ FIB(B)и SEM(D)дрожжей, образующих непрерывный монослой на поверхности сетки. Образец был покрыт СЛОЕМ ГИС и Ирридия перед визуализацией. Шкала стержней в панелях А-В соответствует 10 мкм. Образец дрожжей смазывается от неабсорбирующего материала, такого как PTFE или FlexFill 98A (зеленый), и с помощью промокательной бумаги, расположенной с обратной стороны сетки (белый, E). Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
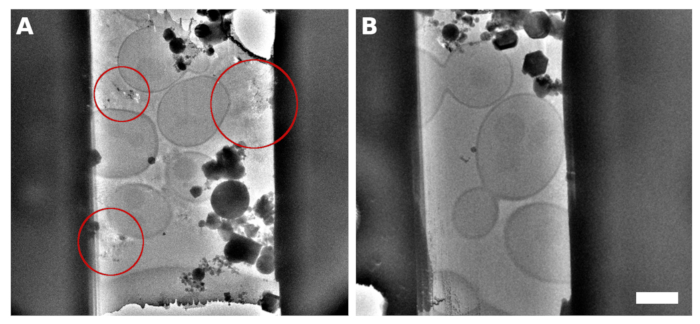
Рисунок 2: S. cerevisiae lamellae
Изображение ТЭМ ламели, микрообрабатываемой из образца с непрерывными однослойными дрожжами над поверхностью сетки. Отражения, наблюдаемые между клетками, содержали неправильно остеклованную среду/буфер(A,выделенный красными кругами). Изображение ТЭМ ламели, полученной на дрожжах, остеклованных в непрерывный монослой с добавлением 5% глицерина в среду/буфер(В). Шкала соответствует 2 мкм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
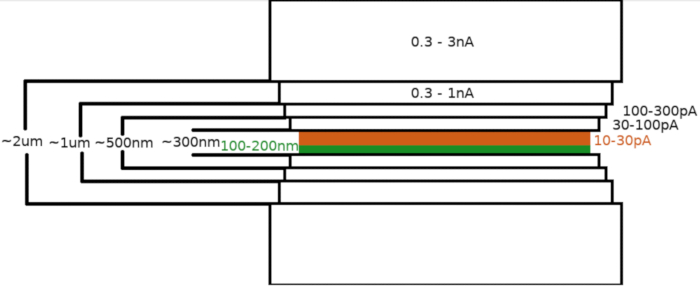
Рисунок 3: Рабочий процесс Cryo-FIBM
Схематическое изображение процесса фрезерования ламельных мишеней. Начальные этапы грубого фрезерования выполняются при высоких токах FIB с обеих сторон предварительного положения ламели (выделено зеленым цветом), тогда как заключительный этап полировки выполняется только с верхней стороны и при низком токе FIB (выделен оранжевым цветом, см. сопроводительное видео в 6:33). Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
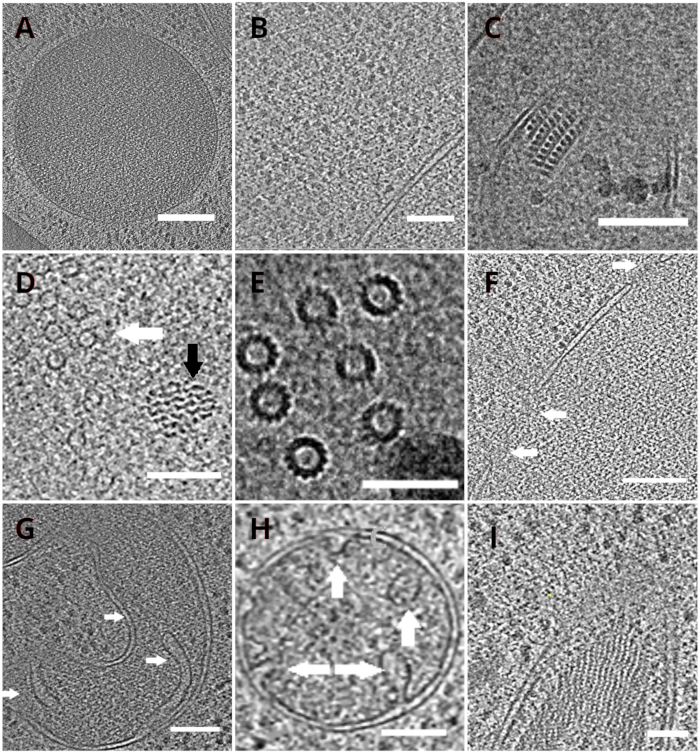
Рисунок 4: Дрожжевые органеллы и высокомолекулярные комплексы, изображенные крио-ET
Срезы реконструированных томограмм, изображающих вакуоль(A,шкала бара: 200 нм), рибосомы (B, шкала бара: 200 нм), паракристаллический стержень пероксисомы(C,шкала бара: 100 нм), микротрубочки (белая стрелка) в непосредственной близости от неопознанной волокнистой структуры (черная стрелка, D,шкала: 100 нм), детали множественных микротрубочек(E,шкала бара: 50 нм), ядерная мембрана с порами, обозначенными стрелками(F, шкала 200 нм), митохондрии(G,H,шкала бара: 100 нм, стрелки указывают на отдельные кристы), пучок неопознанных нитевидных структур (I, шкала бара: 100 нм). Панели B, C, D, E, G содержат срез томограмм, подготовленных из небольших скоплений клеток, тогда как участки томограмм, собранные на ламелях из монослоя клеток, показаны на панелях A, F, H, I. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Обсуждение
Подготовка клеточных образцов для крио-ET является сложным рабочим процессом, который требует использования нескольких высококачественных инструментов. Качество образца может быть нарушено на каждом этапе подготовки, что влияет на пропускную способность всего протокола. Кроме того, необходимость переноса проб между отдельными приборами создает дополнительный риск загрязнения или девитрификации пробы. Поэтому оптимизация отдельных этапов в рабочем процессе подготовки образцов имеет большое значение для повышения пропускной способности и воспроизводимости рабочего процесса подготовки ламельных басел. Представленный здесь протокол описывает оптимизированный препарат Saccharomyces cerevisiae для структурной характеристики макромолекулярных комплексов in situ крио-ET.
Протокол описывает получение двух типов образцов дрожжей, которые в основном различаются по концентрации клеток на сетке ТЕА. Оба образца дрожжей дали высококачественные ламели для крио-ET, и выбор типа образца может быть сделан в соответствии с целями конкретного исследования. Дрожжи образуют изолированные кластеры из нескольких клеток, случайно разбросанных по поверхности сетки в первом случае, тогда как непрерывный монослой клеток присутствует на поверхности сетки ТЭМ для второго типа образца. Первый подходит для быстрого приготовления ламели благодаря небольшому объему материала, который необходимо отшмельчить. Конечная ламелла довольно короткая, и, следовательно, содержит всего 2-4 клеточных поперечных сечения. Области, пригодные для подготовки образцов, случайным образом распределены по поверхности сетки, включая квадраты сетки, что может частично ограничить автоматизацию рабочего процесса подготовки ламеля. Последний тип образца требует использования больших токов во время начальной фазы фрезерования, чтобы сохранить общее время фрезерования. Кроме того, этот тип образца более подвержен артефактам, которые возникают в результате неравномерного фрезерования (занавески). Поэтому ГИС распыляется на поверхность образца в течение на 50% более длительного периода, чем в случае образца с небольшими клеточными кластерами, образуя более толстый защитный слой. Затем образец напыляют дополнительным слоем иридия (альтернативно платины или золота), чтобы вылечить слой ГИС, сделать его более жестким и увеличить проводимость поверхности образца. FiBM дополнительных участков с каждой стороны ламели (~2-5 мкм от края ламели) на первом этапе грубого фрезерования ламелей был признан полезным для уменьшения количества сломанных ламелей, скорее всего, из-за снижения натяжения в конечном поперечном сечении23. Конечная ламелла длинная и содержит ~10 клеточных поперечных сечений, что увеличивает количество областей, подходящих для крио-ИНОПЛАНЕТЯН. Неправильная витрификация среды или буфера между клетками может быть легко ослаблена добавлением криопротектора в буферный раствор (5% глицерин, используемый в этом исследовании). Поскольку большинство квадратов пригодны для приготовления ламелей, образец с ячейками, организованными в непрерывный монослой, хорошо подходит для приготовления ламелей без присмотра.
Другим важным аспектом в рабочем процессе подготовки ламели является перенос в просвечивающий электронный микроскоп и правильное позиционирование ламели на оси наклона ступени микроскопа. Оптимально, чтобы главная ось ламели была перпендикулярна оси наклона микроскопа, что обеспечивает отслеживание и фокусировку на высоте изображенной области и предотвращает экранирование краев ламели поля зрения под большими углами наклона. При сборе крио-ET данных с использованием дозосимметричнойсхемы 18 образец следует первоначально повернуть в микроскоп, чтобы компенсировать наклон ламели по отношению к плоскости сетки.
Раскрытие информации
Авторам нечего раскрывать.
Благодарности
Эта работа была поддержана Instruct-Ultra (Grant 731005), iNEXT-Discovery (Grant 871037), финансируемой программой Horizon 2020 Европейской комиссии, и исследовательской инфраструктурой CIISB, Центром Instruct-ERIC (LM2018127). Мы признаем поддержку, полученную от Thermo Fisher Scientific Brno.
Материалы
| Name | Company | Catalog Number | Comments |
| Agar | Himedia | MB053 | |
| Glucose | PENTA | 12020-31000 | |
| Glycerol | Merck | G5516-1L | |
| ethane | Messer | 1007 | |
| LN2 | Lineq | LN2-1L | |
| Peptone | Merck | P5905-1KG | |
| Saccharomyces cerevisiae | ATCC | 201388 | strain BY4741 |
| Tweezers | Dumont | T539 | |
| Yeast extract | Duchefa Biochemie | Y1333.1000 | |
| Disposable | |||
| Blotting papers | Ted Pella | 47000-10 | |
| C-clip | ThermoScientific | 9432 909 97551 | |
| C-clip ring | ThermoScientific | 9432 909 97561 | |
| Spreading sticks | Merck | Z376779-1PAK | |
| Sterile inoculation loops | BRAND | BR452201-1000EA | |
| Sterile plastic Petri dishes | Sigma | SIAL0166 | |
| TEM grids | Quantifoil | 4420G-XA | |
| Equipment | |||
| Autoclave | Systec | 101291545 | |
| balances | BEL | M124A | |
| Cryo-FIB/SEM microscope | ThermoScientific | 1006123 | |
| Cryo-TEM microscope | ThermoScientific | 9432 057 03301 | |
| Laminar flow box | Telstar | AH5 | |
| Plasma cleaner | Gatan | 955.82001 | |
| Shaking incubator | New Brunswick | M1282-0002 | |
| UV/VIS spectrophotometer | WPA | S800 | |
| Vitrification robot | ThermoScientific | 9432 053 50621 |
Ссылки
- McMullan, G., Faruqi, A., Clare, D., Henderson, R. Comparison of optimal performance at 300keV of three direct electron detectors for use in low dose electron microscopy. Ultramicroscopy. 147, 156-163 (2014).
- Zivanov, J., et al. New tools for automated high-resolution cryo-EM structure determination in RELION-3. eLife. 7, (2018).
- Dubochet, J., McDowall, A. W. Vitrification of pure water for electron microscopy. Journal of Microscopy. 124, 3-4 (1981).
- Villa, E., Schaffer, M., Plitzko, J. M., Baumeister, W. Opening windows into the cell: focused-ion-beam milling for cryo-electron tomography. Current Opinion in Structural Biology. 23, 771-777 (2013).
- Mahamid, J., et al. Visualizing the molecular sociology at the HeLa cell nuclear periphery. Science. 351 (6276), 969-972 (2016).
- Schur, F. K. Toward high-resolution in situ structural biology with cryo-electron tomography and subtomogram averaging. Current Opinion in Structural Biology. 58, 1-9 (2019).
- O'Reilly, F. J., et al. In-cell architecture of an actively transcribing-translating expressome. Science. 369, 554-557 (2020).
- Rice, W. J., et al. Routine determination of ice thickness for cryo-EM grids. Journal of Structural Biology. 204, 38-44 (2018).
- Al-Amoudi, A., Norlen, L. P. O., Dubochet, J. Cryo-electron microscopy of vitreous sections of native biological cells and tissues. Journal of Structural Biology. 148, 131-135 (2004).
- Al-Amoudi, A., Studer, D., Dubochet, J. Cutting artefacts and cutting process in vitreous sections for cryo-electron microscopy. Journal of Structural Biology. 150, 109-121 (2005).
- Pierson, J., et al. Improving the technique of vitreous cryo-sectioning for cryo-electron tomography: electrostatic charging for section attachment and implementation of an anti-contamination glove box. Journal of Structural Biology. 169, 219-225 (2010).
- Dubochet, J., et al. How to "read" a vitreous section. Methods in Cell Biology. 79, 385-406 (2007).
- Rigort, A., et al. Focused ion beam micromachining of eukaryotic cells for cryoelectron tomography. Proceedings of the National Academy of Sciences. 109, 4449-4454 (2012).
- Schaffer, M., et al. Cryo-focused Ion Beam Sample Preparation for Imaging Vitreous Cells by Cryo-electron Tomography. Bio-protocol. 5, (2015).
- Wagner, F. R., et al. Preparing samples from whole cells using focused-ion-beam milling for cryo-electron tomography. Nature Protocols. 15 (6), 2041-2070 (2020).
- Buckley, G., et al. Automated cryo-lamella preparation for high-throughput in-situ structural Biology. Journal of Structural Biology. 210 (2), 107488 (2020).
- Zachs, T., et al. Fully automated, sequential focused ion beam milling for cryo-eletron tomography. eLife. e52286, (2020).
- Mastronarde, D. N. Automated electron microscope tomography using robust prediction of specimen movements. Journal of Structural Biology. 152, 36-51 (2005).
- Hagen, W. J., Wan, W., Briggs, J. A. Implementation of a cryo-electron tomography tilt-scheme optimized for high resolution subtomogram averaging. Journal of Structural Biology. 197, 191-198 (2017).
- Zheng, S. Q., et al. MotionCor2: anisotropic correction of beam-induced motion for improved cryo-electron microscopy. Nature Methods. 14, 331-332 (2017).
- Rohou, A., Grigorieff, N. CTFFIND4: Fast and accurate defocus estimation from electron micrographs. Journal of Structural Biology. 192, 216-221 (2015).
- Stalling, D., Westerhoff, M., Hege, H. -. C. Amira: A highly interactive system for visual data analysis. The Visualization Handbook. , 749-767 (2005).
- Wolff, G., et al. Mind the gap: Micro-expansion joints drastically decrease the bending of FIB-milled cryo-lamellae. Journal of Structural Biology. 208, 107389 (2019).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены