Method Article
Preparação e micromaquinção Crio-FIB de Saccharomyces cerevisiae para Tomografia Crio-Elétron
Neste Artigo
Resumo
Apresentamos um protocolo para a preparação de lamella de espécimes biológicos congelados por micromaquingia de feixe de íons focado em crio-pia para estudos estruturais de alta resolução de macromoléculas in situ com tomografia crio-elétron. O protocolo apresentado fornece diretrizes para a preparação de lamellae de alta qualidade com alta reprodutibilidade para caracterização estrutural de macromoléculas dentro do Saccharomyces cerevisiae.
Resumo
Hoje, a tomografia crio-elétron (crio-ET) é a única técnica que pode fornecer dados estruturais de resolução quase atômica em complexos macromoleculares in situ. Devido à forte interação de um elétron com a matéria, estudos crio-ET de alta resolução são limitados a espécimes com uma espessura inferior a 200 nm, o que restringe a aplicabilidade do crio-ET apenas para as regiões periféricas de uma célula. Um fluxo de trabalho complexo que compreende a preparação de finas seções transversais celulares pela micromaquinção de feixe de íons focada em crio-ion (crio-FIBM) foi introduzido durante a última década para permitir a aquisição de dados crio-ET do interior de células maiores. Apresentamos um protocolo para a preparação de lamellae celular a partir de uma amostra vimentada pelo congelamento de mergulho utilizando Saccharomyces cerevisiae como um exemplo prototípico de uma célula eucariótica com ampla utilização em pesquisas de biologia celular e molecular. Descrevemos protocolos de vitrificação de S. cerevisiae em remendos isolados de algumas células ou uma monocamada contínua das células em uma grade TEM e fornecemos um protocolo para preparação de lamella por crio-FIB para essas duas amostras.
Introdução
Desenvolvimentos tecnológicos e de software recentes fizeram da crio-microscopia eletrônica (crio-EM) de espécimes biológicos vitrificados uma das principais técnicas em pesquisa de biologia estrutural na última década1,2. A preparação de um espécime para crio-EM geralmente consiste na aplicação de uma proteína purificada ou um complexo de proteína com ácido nucleico no portador da amostra (grade TEM), seguido pela remoção da maior parte do líquido com um papel filtro, e mergulho de congelamento da grade com a fina camada residual de uma amostra em etano líquido ou propano3 . A amostra é, portanto, fixada em uma camada fina (tipicamente <80 nm) de tampão amorfo em um estado totalmente hidratado, em condições quase nativas, e sem necessidade de qualquer fixação química ou contraste de metais pesados. A imagem da amostra estruturalmente homogênea no microscópio eletrônico de transmissão resulta em dados que podem ser usados para a determinação da estrutura tridimensional da macromolécula em resolução quase atômica usando um único protocolo de análise de partículas2. Tal estrutura in vitro corresponde à representação da macromolécula nas condições e tratamento utilizado durante a preparação da amostra. Embora as estruturas determinadas sob as condições in vitro geralmente correspondam ao estado totalmente funcional da macromolécula, a capacidade de imagem das relações espaciais entre várias macromoléculas dentro da célula forneceria um contexto funcional adicional aos dados estruturais.
A tomografia crio-elétron (crio-ET) é usada para reconstruir volumes 3D de objetos pleomórficos ou complexos macromoleculares in situ4,5. A vantagem do crio-ET é que as informações tridimensionais são obtidas por meio de imagens de uma única entidade. No entanto, a resolução na qual complexos macromoleculares individuais ou organelas são observados é muito limitada. Portanto, a média das macromoléculas (média do sub-tomograma, STA) com a mesma estrutura de um número maior de tomogramas é necessária para atingir modelos de resolução de 4-8 Å a partir dos dados crio-ET6,7. Recentemente foi demonstrado que crio-ET e STA também podem ser aplicados para determinar estruturas de alta resolução de máquinas macromoleculares, como ribossomos no contexto do ambiente celular7. No entanto, a utilização da microscopia eletrônica de transmissão é limitada pela espessura da amostra. Em geral, este não é um problema para crio-EM de partícula única, onde a otimização das condições de vitrificação pode eventualmente resultar na incorporação da amostra em uma fina camada de gelo. Por outro lado, a maioria das células não são de fato transparentes para o feixe de elétrons de 300 keV. O caminho livre da média inelástica nos espécimes biológicos vitrificados para os elétrons de 300 keV é de aproximadamente 395 nm8, o que significa que os estudos crio-ET estão limitados à periferia celular para a maioria das células.
Diferentes técnicas foram desenvolvidas para reduzir a amostra até uma espessura suficiente para crio-ET. A criomicrotomia utiliza o corte mecânico da amostra com uma faca de diamante na temperatura do nitrogênio líquido (-196 °C) para fornecer seções de 60-80 nm de espessura adequadas para crio-ET9,10,11. Várias seções podem ser preparadas a partir de uma única célula e a análise de dados pode eventualmente produzir informações estruturais 3D para a maior parte da célula. No entanto, o corte mecânico pode causar vários artefatos, como seções curvas, fendas ou compressão de amostra, que podem influenciar a estrutura resultante e viés dos dados crio-ET10,11,12. A micromaquintação de feixe de íons focado em crio-fibe (crio-FIBM) representa uma abordagem alternativa onde uma seção celular fina é preparada por ablação gradual da amostra usando um feixe focal de íons Ga+ (FIB) em um processo de várias etapas, o que pode resultar em 80-300 nm de espessura seção transversal celular (lamella)13,14,15 . Em contraste com a crio-ultramicrotomia, apenas uma lamella é preparada a partir de uma única célula, o que representa ~0,3-3% de seu volume, e a micromaquinção de múltiplas células geralmente é necessária para encontrar uma região de interesse na seção transversal fresada. Além disso, o throughput de todo o fluxo de trabalho ainda é hoje bastante baixo, muitas vezes limitado a lamellae de alta qualidade de 6-8 de uma sessão crio-FIBM de 8 horas. Por outro lado, as seções transversais crio-FIBM são desprovidas de quaisquer artefatos de compressão e fornecem entrada adequada para crio-ET de alta resolução. Além disso, a transferência da lamella para o portador da amostra para crio-ET não é necessária, pois a amostra é retida na grade TEM durante todo o processo de preparação da lamella e a mesma grade pode ser posteriormente transferida para o TEM. Esperamos que o rendimento do crio-FIBM seja significativamente melhorado em breve, principalmente a partir da disponibilidade de software para moagem lamella não supervisionada16,17 e utilização de FIBs operando sob o princípio do plasma de casal de carga, que irá permitir a ablação material mais rápida.
Saccharomyces cerevisiae (levedura) são células eucarióticas de forma esférica e diâmetro de ~2-5 μm. Graças ao seu tamanho, acessibilidade, genética, tempo de geração e manipulação simples, a levedura é extensivamente estudada como um organismo modelo eucariótico em pesquisas de biologia celular e molecular semelhantes à Escherichia coli,que é bem estudada como um organismo modelo procariótico em bacteriologia. A levedura pode ser facilmente cultivada em suspensão e uma alta quantidade de células é gerada em pouco tempo (dobrando o tempo de 1 a 2 horas). Mais importante, a levedura compartilha uma complexa estrutura celular interna com células animais e vegetais, mantendo um pequeno genoma composto por um baixo teor de DNA não codificado. A caracterização estrutural do proteome de levedura a partir dos dados in situ de alta resolução pode, assim, ajudar a fornecer uma descrição mecanicista para a extensa quantidade de dados funcionais disponíveis na literatura.
Aqui, fornecemos um protocolo abrangente para a aquisição de dados in situ crio-ET sobre a amostra de levedura, que abrange todas as etapas desde o cultivo da amostra até a preparação da lamella crio-FIBM, e a transferência de espécimes para TEM para aquisição de dados crio-ET.
Protocolo
1. Cultivo e preparação de células de Saccharomyces cerevisiae para vitrificação
- Prepare o meio de crescimento líquido para Saccharomyces cerevisiae.
- Autoclave uma garrafa de vidro de 500 mL para a preparação do meio de crescimento.
- Pesar 2,2 g de extrato de levedura (1,1%) e 4,4 g de Peptone (2,2%) e misturar em 200 mL de água.
- Esterilize por autoclaving por 15 min a 121 °C.
- Pesar 10 g de glicose em pó e misturar em 50 mL de água para obter 20% de solução de glicose. Passe a solução através de um filtro de 0,2 μm e armazene-a a 4 °C.
- Prepare o meio sólido para Saccharomyces cerevisiae.
- Pese 4 g de ágar em pó e misture com 200 mL de meio de crescimento.
- Esterilize em uma autoclave por 15 min a 121 °C.
- Esfrie o médio a 40-50 °C e adicione 20 mL de glicose estéril de 20% (preparada na etapa anterior). Despeje ~20 mL do meio completo na placa de Petri e deixe solidificar à temperatura ambiente.
- Enrole as placas de ágar em parafilme para proteger da secagem e armazene a 4 °C.
- Cultura Saccharomyces cerevisiae em suspensão
NOTA: O protocolo é otimizado para a preparação de uma amostra para crio-FIBM a partir de uma suspensão da linha celular Saccharomyces cerevisiae strain BY4741 [ATCC 4040002] ou cepas similares.- Autoclave um frasco de 50 mL Erlenmeyer (ou similar).
- Trabalhe em um capô ou caixa de fluxo laminar. Pipeta 10 mL do meio de crescimento a um frasco estéril de 50 mL Erlenmeyer.
- Suplemente o meio com 1 mL de glicose filtrada de 20%. Escolha uma colônia de levedura de uma placa de ágar com um laço de inoculação estéril e descartável (1-10 μL).
- Coloque o frasco de Erlenmeyer na incubadora e cultura a 30 °C com agitação (150-200 rpm) até que a fase exponencial seja atingida (aproximadamente 7h).
NOTA: Observamos que a fase exponencial é alcançada após ~15 h quando as colônias são colhidas a partir de placas de ágar que foram cultivadas à temperatura ambiente por 4 semanas. Veja também Nota abaixo.
- Cultura Saccharomyces cerevisiae em uma placa de ágar de estoque de glicerol.
- Use uma nova placa de ágar a partir do armazenamento de 4 °C.
- Pegue o estoque de S. cerevisiae do congelador profundo de -80 °C e coloque-o em uma banca de congelamento para evitar o descongelamento completo do estoque.
- Raspe e transfira uma pequena cultura com um laço de inoculação estéril (1-10 μL) a 50 μL de meio de crescimento. Misture corretamente.
- Transfira todo o volume da cultura de S. cerevisiae mista e disperse-se com uma vara de espalhamento estéril sobre a superfície da placa de ágar.
- Incubar a 30 °C por aproximadamente 48 horas até formar colônias de 1,5-2 mm de diâmetro.
NOTA: É aconselhável cultivar as colônias recentemente antes do experimento. Colônias com mais de 1 semana exigirão um período prolongado de cultivo em mídia líquida para atingir a fase de crescimento exponencial.
- Cultura Saccharomyces cerevisiae em um prato de ágar.
- Use placas de ágar preparadas com colônias de s. cerevisiae cultivadas.
- Pipeta 10 mL de meio de crescimento estéril e 1 mL de glicose filtrada de 20% a um frasco de Erlenmeyer de 50 mL.
- Escolha uma colônia de cultura S. cerevisiae com um laço de inoculação estéril e misture com um meio de crescimento em um frasco.
- Incubar 50 minutos a 30 °C com agitação (150-200 rpm).
- Diluir a cultura de suspensão dez vezes com o meio de crescimento e dispersar 50 μL de suspensão em uma placa de ágar com uma vara de espalhamento estéril.
- Incubar a 30 °C por aproximadamente 48 horas até que sejam observadas colônias de 1,5-2 mm.
- Enrole as bordas da placa de Petri com parafilm para evitar que ela seque. Armazene em temperatura ambiente e use por um máximo de 4 semanas.
- Prepare Saccharomyces cerevisiae para mergulhar em aglomerados celulares.
- Prepare a cultura celular S. cerevisiae de acordo com o protocolo na seção Cultivo de Saccharomyces cerevisiae em suspensão (Seção 1.3) e incubar ~7 h a 30 °C com agitação (150-200 rpm).
- Meça a cultura de suspensão celular S. cerevisiae a 600 nm usando um espectrômetro UV/Vis.
- Concentre a suspensão celular em OD600 = 1.
- Prepare S. cerevisiae para mergulhar congelando em uma monocamada de célula.
- Prepare a cultura celular S. cerevisiae de acordo com o protocolo na seção Cultivo de Saccharomyces cerevisiae cultura celular suspensa e incubar ~7 h a 30 °C com agitação (150-200 rpm).
- Meça a cultura de suspensão celular S. cerevisiae a 600 nm usando um espectrômetro UV/Vis.
- Transfira as células em meio para o tubo de centrífuga e gire suavemente por 2 minutos a uma força centrífuga relativa (900 x g).
- Descarte o meio da pelota da célula por pipetação.
- Adicione meio fresco à pelota de célula. Calcule o volume médio para obter uma suspensão celular de OD600 igual a 30 a 60.
- Adicione glicerol (solução de estoque de 50%) à suspensão celular a uma concentração final de 5% pouco antes da vitrificação.
NOTA: O Glicerol funciona como um agente protetor, o que melhora a qualidade do gelo nas regiões entre as células. O glicerol é adicionado às células pouco antes da vitrificação para minimizar sua absorção na célula.
2. Vitrificação do espécime saccharomyces cerevisiae
- Rede TEM de descarga de brilho com o lado do filme de carbono voltado para 30-45 s (pressão: 6-9 Pa, atual: 7 mA).
- Coloque o robô de vitrificação nos seguintes parâmetros: temperatura: 18 °C, umidade: 100%, tempo de mancha: 6 s, tempo de espera: 5 s, ciclo de manchas: 1x, e força de mancha: 5.
NOTA: A força de bolha é um valor específico do instrumento e os valores ideais de força de mancha podem diferir entre diferentes máquinas. O valor ideal para um determinado êmbolo deve ser confirmado experimentalmente. - Prepare o etano líquido para vitrificação.
- Monte a almofada de superfície não absorvente para a almofada de manchas voltada para a amostra. Use o papel filtro para a outra almofada de manchas.
- Escolha a grade descarregada com as pinças e monte a pinça no instrumento de congelamento do mergulho.
- Aplique 3,5 μL de suspensão S. cerevisiae no lado de carbono da rede dentro da câmara climática do êmbolo. Misture corretamente antes de cada aplicação na grade.
- Mergulhe a grade no etano líquido.
- Transfira a rede do etano líquido para a LN2. Armazene grades com células vitrificadas sob condições LN2 ou monte-as no cartucho de grade TEM para carregar no microscópio FIB-SEM.
3. Montagem de grades TEM no cartucho de grade
NOTA: O fluxo de trabalho descrito aqui utiliza as grades TEM montadas no cartucho de grade para facilitar o manuseio e transferência de amostras entre microscópios SEM e TEM. O conjunto do cartucho consiste em um anel C, uma grade TEM e um anel de clipe C. Outras opções estão disponíveis ao trabalhar com instrumentação de outros fabricantes de microscópio. A estação de trabalho de montagem do cartucho de grade é preenchida com LN2. O nível LN2 cobre a caixa de grade com as grades TEM, mas a montagem das grades TEM no cartucho é realizada em vapores LN2. É altamente recomendável usar uma máscara facial protetora ou escudo durante o procedimento de vitrificação para evitar que a contaminação respire para o espécime. Não trabalhe com as ferramentas que acumularam contaminação por gelo.
- Coloque a estação de trabalho de montagem do cartucho de grade e prepare ferramentas secas para o recorte.
- Esfrie a estação de trabalho de montagem com LN2. Esfrie as ferramentas de recorte à temperatura LN2.
- Coloque uma caixa de grade com uma amostra vitrificada na estação de trabalho de montagem.
- Coloque uma grade TEM com o espécime com células voltadas para baixo para o anel C e fixe com um clipe C.
- Coloque os cartuchos cortados na caixa da grade e feche corretamente.
- Armazene cartuchos no LN2 Dewar ou carregue-os no microscópio FIB-SEM.
4. Carregamento e manipulação da amostra para o microscópio FIB-SEM
NOTA: As instruções foram escritas para a utilização do microscópio de feixe duplo Versa 3D equipado com o sistema de preparação cryo-FIB/SEM PP3010. Soluções alternativas podem exigir diferentes parâmetros específicos; no entanto, o conceito geral do fluxo de trabalho ainda deve ser válido.
- Esfrie o microscópio até a temperatura do nitrogênio líquido.
- Bombeie a câmara de microscópio e a câmara de preparação (se presente) a um vácuo alto antes do início do resfriamento (< 4 x 10-4 Pa) para evitar o crescimento da contaminação.
- Defina o fluxo de gás nitrogênio para 5 L/min para a câmara de preparação, estágio de microscópio e anticontraterador de microscópio. Aguarde até que todos os componentes atinjam uma temperatura de < -180 °C.
NOTA: A configuração do microscópio FIB-SEM utilizada neste estudo utiliza gás nitrogênio resfriado para resfriar seu estágio e anticontaminador. Outros sistemas podem usar um método diferente para resfriamento de palco. A pressão da câmara atinge ~3 x 10-5 Pa uma vez que o palco e o anticontaminador estão a -190 °C no instrumento usado aqui. A taxa de crescimento da camada contaminante de hidrocarbonetos na superfície da lamella com a configuração experimental utilizada neste estudo é de ~15 nm/hora.
- Carregue o cartucho de grade com a amostra até o microscópio.
- Monte e esfrie a estação de carga até a temperatura LN2.
- Coloque o transporte (suporte de amostra), a caixa de grade com o espécime, o abridor da caixa de grade e pinças na estação de carregamento resfriada.
- Transfira cuidadosamente o cartucho de grade com a amostra voltada para a nave auxiliar.
- Vire a nave dentro da estação de carga para a posição de carregamento.
- Carregue no microscópio.
- Opcionalmente, cubra a amostra com camadas protetoras metálicas.
NOTA: Um forte efeito de carregamento pode ser observado quando a imagem congelado de material biológico hidratado SEM. Além disso, amostras biológicas de imagem com FIB (mesmo em correntes baixas) induz danos rápidos à amostra. Portanto, um revestimento adicional da amostra pode ser realizado dentro do microscópio FIB-SEM, para proteger a superfície da amostra.- Deposite a camada protetora com platina organometalólica pelo sistema de injeção de gás (SIG).
- Ajuste a amostra à altura eucêntrica (ponto de coincidência para imagem com elétrons e íons).
- Incline o palco para trás para 45° (amostra inclinada 90° em relação ao feixe de elétrons).
- Mova o estágio no eixo z4 mm abaixo da altura eucêntrica.
- Coloque a agulha GIS entre 26-30 °C.
- Deposite ~300-1000 nm da camada organometalólica de platina à grade com o espécime biológico (corresponde a 30-120 s da deposição GIS).
NOTA: Geralmente aplicamos SIG para 30 s para amostras com pequenos aglomerados celulares e 45 s para amostras com uma monocamada das células.
- Sputter reveste a superfície do espécime com uma camada metálica condutora.
- Deposite ~10 nm da camada metálica (Ir, Au, Pt) na grade com um espécime biológico.
- Deposite a camada protetora com platina organometalólica pelo sistema de injeção de gás (SIG).
- Definir parâmetros de microscópio para a preparação de lamella
- Para FIB, utilize os seguintes parâmetros: alta tensão = 30 kV, corrente = 10 pA (imagem), 10 pA-3 nA (fresagem FIB)
- Para SEM, utilize os seguintes parâmetros: alta tensão = 2-5 kV, tamanho da mancha = 4,5, corrente = 8-27 pA.
- Defina a rotação da varredura para 180° para ambas as vigas.
- Defina a inclinação do palco: ângulo de fresagem 6-11° (corresponde à inclinação do estágio de 13°-18° para o transporte de amostra com pré-inclinação de 45° e microscópio FIB/SEM com ângulo de 52° entre a coluna SEM e FIB).
5. Preparação do Saccharomyces cerevisiae lamella
- Verifique a qualidade da grade e selecione um cluster adequado de Saccharomyces cerevisiae.
- Verifique se a grade TEM está devidamente manchada de ambos os lados sem água adicional ao redor do aglomerado celular ou na parte de trás da grade.
NOTA: Para verificar a parte traseira da grade, gire o palco para -10° e imagem a grade com FIB. - Selecione os clusters de células ideais para a preparação de lamella de acordo com as seguintes recomendações.
- Posicione os aglomerados celulares no centro da grade. A área de fresagem não deve se estender fora da praça com dimensões 1100 x 1100 μm posicionadas no centro da grade (550 μm em cada direção do centro da grade).
- Posicione os aglomerados celulares na parte central do quadrado da grade sem sobreposição à barra de grade.
- Posicione os aglomerados celulares no quadrado da grade com folha de carbono orifada compacta sem rachaduras.
- Certifique-se de que o aglomerado não está cercado por contaminação de gelo.
- Verifique se a grade TEM está devidamente manchada de ambos os lados sem água adicional ao redor do aglomerado celular ou na parte de trás da grade.
- Selecione a posição de moagem ideal no monocamada Saccharomyces cerevisiae.
- Certifique-se de que as barras de grade ao redor da monocamada celular no quadrado da grade selecionada estejam visíveis.
- Selecione a posição ideal na monocameira celular de acordo com as seguintes recomendações. As áreas selecionadas para moagem devem satisfazer os seguintes critérios:
- Tenha a região de interesse no centro da rede. A área de fresagem não deve se estender fora do quadrado das dimensões 1100 x 1100 μm posicionadas no centro da grade (550 μm em cada direção do centro da grade).
- Tenha a região de interesse na parte central da grade quadrada sem sobreposição com a barra de grade.
- Não cerque a monocamada celular com contaminação por gelo.
- Prepare S. cerevisiae lamella com crio-FIB.
NOTA: O padrão de fresagem é gerado e centrado em relação à região de interesse. O Crio-FIBM é realizado sequencialmente com várias etapas de fresagem realizadas em diferentes configurações de FIB. A lamella com aproximadamente 2 μm de espessura é inicialmente moída usando alta corrente (0,3-3 nA). A lamella é então gradualmente diluída para 500 nm. O passo de moagem fina em correntes baixas (10-30 pA) é usado para finalizar a lamella para ~100-200 nm de espessura.- Estabeleça uma região de interesse (ROI) à altura eucêntrica e salve essa posição.
NOTA: O ponto de coincidência precisa ser determinado e guardado para cada posição separadamente. A altura eucêntrica é definida inclinando o palco para 0° e centralizando-se no ROI movendo o palco na direção x e y. O estágio é então inclinado para 25° e o ROI é trazido de volta ao centro da área digitalizada alterando a posição do estágio z-eixo. Finalmente, o palco é inclinado de volta para 13°-18° para fresagem. - Defina um padrão de fresagem retangular acima do ROI com uma direção de varredura de cima para baixo.
- Defina um padrão de fresagem retangular abaixo do ROI com uma direção de varredura de Fundo para Cima.
- Defina o padrão de fresagem retangular inativo que cobre a região de interesse para uma estimativa aproximada da espessura da lamella. Este padrão não é fresado durante a preparação de lamella.
- Marque todos os padrões e defina a largura da lamella(dimensão x). A largura do padrão de fresagem não deve exceder 2/3 da largura do cluster. Isso corresponde a 8-15 μm na maioria dos casos.
- Definir parâmetros para etapas de fresagem áspera
- Corrente FIB: 0.3-3.0 nA ; espessura final da lamella: 1,5-2 μm; largura da área FIBM: 8-12 hum; inclinação do palco: 13-17°; duração: 8 minutos; padrões de fresagem ativos: superior e inferior.
- Corrente FIB: 0,3-1.0 nA; espessura final da lamella: 1 μm; largura da área FIBM: 7,5-11,5 μm; inclinação do palco: 13-17°; duração: 8 minutos; padrões de fresagem ativos: superior e inferior.
- Corrente FIB: 100-300 pA; espessura final de lamella: 0,5 μm ; largura da área FIBM: 7,5-11,5 μm; inclinação do palco: 13-17°; duração: 8 minutos; padrões de fresagem ativos: superior e inferior.
- Corrente FIB: 30-100 pA; espessura final de lamella: 0,3 μm ; largura da área FIBM: 7,5-11,5 μm; inclinação do palco: 13-17°; duração: 8 minutos; padrões de fresagem ativos: superior e inferior.
- Definir parâmetros para a etapa de moagem fina:
- Corrente FIB: 10-30 pA; espessura lamella final: <0.2 hum; largura da área FIBM: 7-11 μm; inclinação de estágio: 13-17° (+1°); duração: 12 minutos; padrões de fresagem ativos: superior.
NOTA: As etapas de fresagem áspera (5.3.6) são realizadas sequencialmente para cada lamella. Em contrapartida, a etapa de moagem fina (5.3.7) não segue diretamente a fresagem áspera, mas as etapas de fresagem fina são realizadas sequencialmente para todos os lamellae no final da sessão para minimizar a contaminação por hidrocarbonetos na superfície lamella. Uma inclinação extra +1° é usada durante a etapa de moagem fina para aumentar a uniformidade da espessura lamella em todo o seu comprimento.
- Corrente FIB: 10-30 pA; espessura lamella final: <0.2 hum; largura da área FIBM: 7-11 μm; inclinação de estágio: 13-17° (+1°); duração: 12 minutos; padrões de fresagem ativos: superior.
- Estabeleça uma região de interesse (ROI) à altura eucêntrica e salve essa posição.
6. Transferência de Saccharomyces cerevisiae lamella para crio-TEM
- Prepare um Dewar devidamente seco e encha-o com LN2.
- Descarregue as amostras com lamellae do microscópio FIB/SEM sob condições crio-suficientes, transfira-as para uma caixa de grade e armazene-as em um Dewar de armazenamento LN2 para armazenamento a longo prazo. Alternativamente, carregue as grades diretamente no crio-TEM.
- A orientação correta da lamella em relação ao eixo de inclinação do estágio crio-TEM é importante (veja o vídeo que acompanha às 8:10 para mais detalhes). Certifique-se de que a direção de fresagem de lamellae preparada seja perpendicular ao eixo de inclinação do estágio crio-TEM.
- Pré-incline o estágio crio-TEM para compensar a inclinação lamella em relação ao plano de grade e coletar a série de inclinação usando o esquema simétrico de dose19.
NOTA: A magnitude da pré-inclinação (tipicamente de 6 a 8°) é determinada pelo ângulo entre o plano de grade TEM e a direção FIB durante a micromaquinação. A posição da borda dianteira lamella na imagem em crio-TEM pode ser usada para determinar o sinal do ângulo pré-inclinação. Para isso, o sentido da rotação do estágio do microscópio deve ser conhecido. Em nossa configuração experimental, a posição da borda frontal da lamella no lado direito da imagem tirada no modo SA nanoprobe corresponde a pré-inclinação negativa.
Resultados
A cultura saccharomyces cerevisiae foi colhida em meio à fase de crescimento exponencial. Preparamos dois tipos de espécimes nos quais as células foram distribuídas como pequenos aglomerados de várias células sobre a superfície da grade TEM (Figura 1A,C) ou formaram uma monocamada contínua sobre quadrados de grade individuais da grade TEM(Figura 1B,D). O fator discriminatório para a preparação da amostra com ilhotas celulares distintas ou a monocamada celular é a concentração da cultura celular aplicada à grade TEM. A cultura celular colhida concentrou-se em OD600 = 1,0 para o primeiro caso, ou para OD600 = 30 a 60 para este último caso, respectivamente. A amostra para a preparação da monocamada celular foi ainda complementada com 5% v/v glicerol antes da vitrificação. O glicerol é fundamental para a vitrificação da solução tampão, que preenche o espaço entre as células (Figura 2), pois as reflexões do tampão cristalino podem ser prejudiciais para o rastreamento posicional adequado e o foco durante a coleta de dados crio-ET.
Além disso, a cultura de suspensão de levedura foi manchada contra o material não absorvente, como o bloco de manchas PTFE ou a almofada impressa 3D personalizada feita de material FlexFill 98A. O papel de mancha foi posicionado apenas na parte traseira da grade com relação à aplicação da amostra (back-blotting). A estratégia de desinchar as costas é recomendada para a cultura de suspensão mergulhar congelando como mancha com o papel filtro de ambos os lados resulta em adesão das células ao papel de mancha(Figura 1E).
O protocolo descrito aqui utiliza grades TEM cortadas no cartucho de grade, que forma suporte estável para a grade e facilita o manuseio amostral da amostra após a vitrificação. Isso impõe a necessidade de que outros porta-amostras e os transportes no microscópio FIB/SEM e TEM possam aceitar tal cartucho de grade.
Após a transferência da amostra para o microscópio FIB/SEM, a amostra foi revestida pela primeira vez com uma camada de platina metilcyclopentadienyl de 0,3-1,0 μm usando o sistema de injeção de gás microscópio (SIG). Uma camada adicional do irídio inorgânico foi sputtered na superfície da amostra para endurecer a camada GIS e tornar a superfície condutora. Os lamellae foram moídos em múltiplas etapas (Figura 3) onde (I) a corrente de fresagem, (II) a largura da lamella, e (III) a distância da área de fresagem acima e abaixo das amostras foram diminuídas de forma stepwise. A etapa final de fresagem ("polimento") foi realizada em baixa corrente (10-30 pA) apenas do lado superior da lamella e com a amostra inclinada por um adicional de 1° em direção ao feixe Ga+. A utilização do protocolo descrito resultou, em média, em lamellae de 8 a 10 preparadas em duas grades TEM dentro de uma sessão de 6 a 8 horas.
As redes TEM com o lamellae foram posteriormente transferidas para um microscópio eletrônico de transmissão. Os lamellae foram primeiro examinados e apenas aqueles que apresentavam cortinas mínimas (artefatos decorrentes de fresagem irregular em toda a superfície lamella), baixo nível de contaminação superficial e bom contraste celular (geralmente observado para lamellae com espessura de < 200 nm) foram selecionados para a aquisição dos dados crio-ET. Além disso, lamellae contendo rachaduras em toda a extensão foram descartadas da coleta de dados. Em geral, cerca de 50% dos lamellae transferidos para a TEM foram adequados para aquisição de dados. As séries tilt foram coletadas no detector de elétrons diretos pós-GIF K2 com a fenda de seleção de energia definida para 20 eV. A coleta de dados foi realizada no software SerialEM18 e a série inclinação foi coletada utilizando uma dose simétrica esquema19 com a faixa de inclinação de ±60° e o incremento de 3°. Os dados foram adquiridos na ampliação correspondente ao tamanho do pixel de 3,47 A/px. A dose total de 65 e/Å2 foi distribuída uniformemente sobre os subquadrados individuais. As imagens de inclinação foram coletadas como um conjunto de três quadros, que foram posteriormente corrigidos para o dano de movimento e radiação durante a aquisição de dados usando o programa MotionCor220. Os parâmetros da função de transferência de contraste foram estimados utilizando Ctffind421. A série de inclinação foi processada no eTomo18. A rotina de rastreamento de patches foi usada para alinhar as imagens. O tomograma foi reconstruído usando um algoritmo de projeção traseira ponderado após binning 2x das imagens e, posteriormente, filtrado usando filtro sirt -like (definido para 8 iterações) em IMOD18. A segmentação do tomograma foi realizada manualmente no software Amira22. Os tomogramas reconstruídos fornecem uma representação de alta resolução do interior celular da levedura e nos permitem observar organelas como vacuoles ou mitocôndrias em alto nível de detalhes ou estudar complexos macromoleculares, como microtúbulos, ou complexos de poros nucleares in situ e sob condições quase nativas(Figura 4).

Figura 1: Imagens FIB e SEM de S. cerevisiae vitrificado
Imagens FIB (A) e SEM(C)dos pequenos aglomerados de levedura vitrificados na grade TEM. Imagens FIB (B) e SEM(D)da levedura formando uma monocamada contínua na superfície da grade. A amostra foi revestida com camada de SIG e Irridium antes da imagem. As barras de escala nos painéis A-B correspondem a 10 μm. A amostra de levedura é borrada contra material não absorvente como PTFE ou FlexFill 98A (verde) e com o papel de mancha posicionado na parte traseira da grade (branco, E). Clique aqui para ver uma versão maior desta figura.
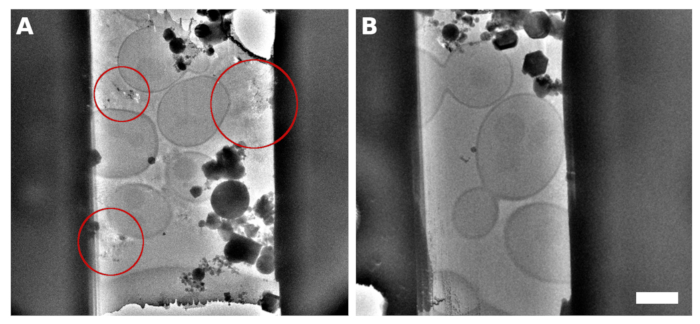
Figura 2: S. cerevisiae lamellae
Uma imagem TEM de uma lamella micromaquinada da amostra com levedura monocamada contínua sobre a superfície da grade. As reflexões observadas entre as células continham meio/tampão indevidamente vitrificado(A,destacado com círculos vermelhos). Uma imagem TEM de lamella gerada no fermento vitrificada em uma monocamada contínua com a adição de 5% de glicerol no médio/tampão(B). A barra de escala corresponde a 2 μm. Clique aqui para ver uma versão maior desta figura.
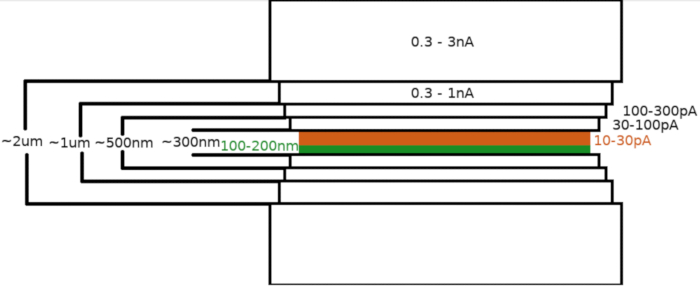
Figura 3: Fluxo de trabalho Crio-FIBM
Representação esquemática do processo de moagem lamella. As etapas iniciais de fresagem áspera são realizadas em altas correntes FIB de ambos os lados da posição lamella provisória (destacada em verde) enquanto a etapa final de polimento é realizada apenas a partir do lado superior e na baixa corrente FIB (destacada em laranja, veja vídeo de acompanhamento às 6:33). Clique aqui para ver uma versão maior desta figura.
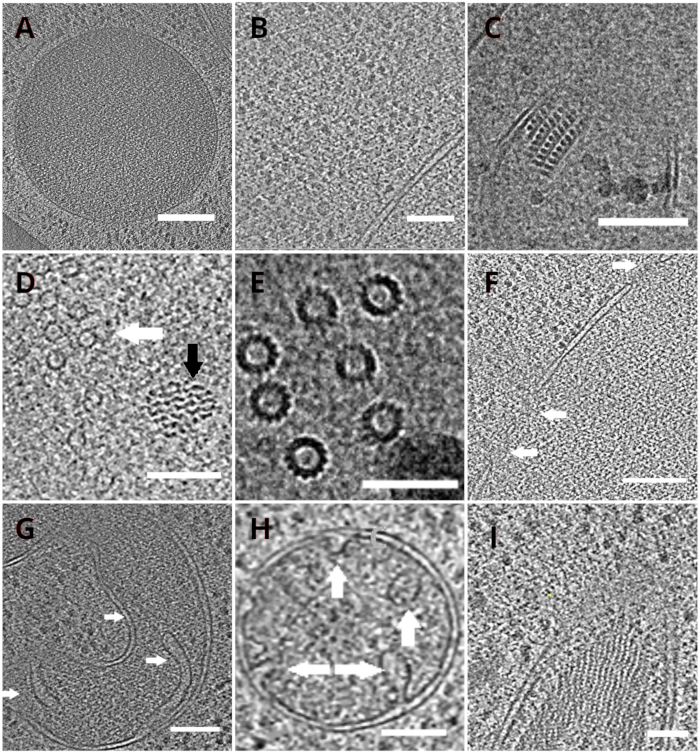
Figura 4: Organelas de levedura e complexos macromoleculares retratados por crio-ET
Fatias dos tomogramas reconstruídos representando um vacuole (A, barra de escala: 200 nm), ribossomos (B, barra de escala: 200 nm), um núcleo paracristallino de peroxisome(C, barra de escala: 100 nm), microtúbulo (seta branca) na proximidade de estrutura fibrosa não identificada (seta preta, D,barra de escala: 100 nm), detalhes de microtúbulos múltiplos(E, barra de escala: 50 nm), uma membrana nuclear com poros indicados por setas (F, barra de escala 200nm), mitocondrion(G,H, barra de escala: 100 nm, as setas indicam cristae individual), um feixe de estruturas filamentosas não identificadas(I, barra de escala: 100 nm). Os painéis B, C, D, E, G contêm uma seção de tomogramas preparados a partir de pequenos aglomerados de células, enquanto as seções de tomogramas coletadas em lamellae de uma monocamada das células são mostradas nos painéis A, F, H, I. Clique aqui para ver uma versão maior desta figura.
Discussão
A preparação das amostras celulares para crio-ET é um fluxo de trabalho complexo que requer a utilização de vários instrumentos high-end. A qualidade da amostra pode ser comprometida durante cada etapa de preparação que influencia o throughput de todo o protocolo. Além disso, a necessidade da transferência de amostras entre instrumentos individuais representa um risco adicional de contaminação ou desvitarificação da amostra. Portanto, a otimização das etapas individuais no fluxo de trabalho de preparação da amostra é de alta importância para aumentar o rendimento e a reprodutibilidade do fluxo de trabalho de preparação lamella. O protocolo aqui apresentado descreve a preparação otimizada de Saccharomyces cerevisiae para caracterização estrutural de complexos macromoleculares in situ por crio-ET.
O protocolo descreve a preparação de dois tipos de amostras de levedura que diferem principalmente na concentração das células na grade TEM. Ambas as amostras de levedura produziram lamellae de alta qualidade para crio-ET e a seleção do tipo de espécime pode ser feita de acordo com os objetivos do estudo em particular. A levedura forma aglomerados isolados de poucas células espalhadas aleatoriamente sobre a superfície da rede no primeiro caso, enquanto uma monocamada contínua de células está presente na superfície da grade TEM para o segundo tipo de amostra. O primeiro é adequado para a preparação rápida de lamella graças ao pequeno volume do material que deve ser fresado. A lamella final é bastante curta e, portanto, contém apenas 2-4 seções transversais celulares. As áreas adequadas para a preparação da amostra são distribuídas aleatoriamente sobre a superfície da rede, incluindo os quadrados da grade, o que pode restringir parcialmente a automação do fluxo de trabalho de preparação lamella. Este último tipo de amostra requer a utilização de correntes maiores durante a fase inicial de moagem para manter o tempo total de moagem. Além disso, este tipo de amostra é mais propensa a artefatos que decorrem de fresagem desigual (cortinas). Portanto, o SIG é sputtered na superfície da amostra por um período 50% maior do que no caso da amostra com pequenos aglomerados celulares para formar uma camada de proteção mais espessa. Em seguida, a amostra é sputtered com uma camada adicional de Iridium (alternativamente platina ou ouro) para curar a camada GIS, torná-la mais rígida e aumentar a condutividade da superfície da amostra. FIBM de áreas adicionais em cada lado da lamella (~2-5 μm da borda lamella) durante a primeira etapa da fresagem lamella áspera foi considerado benéfico para diminuir o número de lamellae quebrada provavelmente devido à diminuição da tensão na seção transversal final23. A lamella final é longa e contém ~10 seções transversais celulares, o que aumenta o número de regiões adequadas para crio-ET. A vitrificação inadequada do meio ou tampão entre as células pode ser facilmente atenuada pela adição do crio-protetor à solução tampão (5% de glicerol utilizado neste estudo). Como a maioria dos quadrados são adequados para a preparação de lamella, a amostra com células organizadas em uma monocamada contínua é bem adequada para a preparação de lamella não supervisionada.
Outro aspecto importante no fluxo de trabalho de preparação da lamella é a transferência para o microscópio eletrônico de transmissão e o posicionamento adequado da lamella para o eixo de inclinação do estágio do microscópio. Na melhor das hipóteses, o eixo principal lamella é perpendicular ao eixo de inclinação do microscópio que permite o rastreamento e o foco na altura da região imagem e impede que as bordas lamella protejam o campo de visão em ângulos de inclinação alta. Ao coletar os dados crio-ET usando o esquema simétrico de dose,18 a amostra deve ser inicialmente girada no microscópio para compensar a inclinação da lamella em relação ao plano de grade.
Divulgações
Os autores não têm nada a revelar.
Agradecimentos
Este trabalho foi apoiado instruct-ultra (Grant 731005), iNEXT-Discovery (Grant 871037) financiado pelo programa Horizon 2020 da Comissão Europeia, e a infraestrutura de pesquisa CIISB, um Centro Instruct-ERIC (LM2018127). Reconhecemos o apoio obtido da Thermo Fisher Scientific Brno.
Materiais
| Name | Company | Catalog Number | Comments |
| Agar | Himedia | MB053 | |
| Glucose | PENTA | 12020-31000 | |
| Glycerol | Merck | G5516-1L | |
| ethane | Messer | 1007 | |
| LN2 | Lineq | LN2-1L | |
| Peptone | Merck | P5905-1KG | |
| Saccharomyces cerevisiae | ATCC | 201388 | strain BY4741 |
| Tweezers | Dumont | T539 | |
| Yeast extract | Duchefa Biochemie | Y1333.1000 | |
| Disposable | |||
| Blotting papers | Ted Pella | 47000-10 | |
| C-clip | ThermoScientific | 9432 909 97551 | |
| C-clip ring | ThermoScientific | 9432 909 97561 | |
| Spreading sticks | Merck | Z376779-1PAK | |
| Sterile inoculation loops | BRAND | BR452201-1000EA | |
| Sterile plastic Petri dishes | Sigma | SIAL0166 | |
| TEM grids | Quantifoil | 4420G-XA | |
| Equipment | |||
| Autoclave | Systec | 101291545 | |
| balances | BEL | M124A | |
| Cryo-FIB/SEM microscope | ThermoScientific | 1006123 | |
| Cryo-TEM microscope | ThermoScientific | 9432 057 03301 | |
| Laminar flow box | Telstar | AH5 | |
| Plasma cleaner | Gatan | 955.82001 | |
| Shaking incubator | New Brunswick | M1282-0002 | |
| UV/VIS spectrophotometer | WPA | S800 | |
| Vitrification robot | ThermoScientific | 9432 053 50621 |
Referências
- McMullan, G., Faruqi, A., Clare, D., Henderson, R. Comparison of optimal performance at 300keV of three direct electron detectors for use in low dose electron microscopy. Ultramicroscopy. 147, 156-163 (2014).
- Zivanov, J., et al. New tools for automated high-resolution cryo-EM structure determination in RELION-3. eLife. 7, (2018).
- Dubochet, J., McDowall, A. W. Vitrification of pure water for electron microscopy. Journal of Microscopy. 124, 3-4 (1981).
- Villa, E., Schaffer, M., Plitzko, J. M., Baumeister, W. Opening windows into the cell: focused-ion-beam milling for cryo-electron tomography. Current Opinion in Structural Biology. 23, 771-777 (2013).
- Mahamid, J., et al. Visualizing the molecular sociology at the HeLa cell nuclear periphery. Science. 351 (6276), 969-972 (2016).
- Schur, F. K. Toward high-resolution in situ structural biology with cryo-electron tomography and subtomogram averaging. Current Opinion in Structural Biology. 58, 1-9 (2019).
- O'Reilly, F. J., et al. In-cell architecture of an actively transcribing-translating expressome. Science. 369, 554-557 (2020).
- Rice, W. J., et al. Routine determination of ice thickness for cryo-EM grids. Journal of Structural Biology. 204, 38-44 (2018).
- Al-Amoudi, A., Norlen, L. P. O., Dubochet, J. Cryo-electron microscopy of vitreous sections of native biological cells and tissues. Journal of Structural Biology. 148, 131-135 (2004).
- Al-Amoudi, A., Studer, D., Dubochet, J. Cutting artefacts and cutting process in vitreous sections for cryo-electron microscopy. Journal of Structural Biology. 150, 109-121 (2005).
- Pierson, J., et al. Improving the technique of vitreous cryo-sectioning for cryo-electron tomography: electrostatic charging for section attachment and implementation of an anti-contamination glove box. Journal of Structural Biology. 169, 219-225 (2010).
- Dubochet, J., et al. How to "read" a vitreous section. Methods in Cell Biology. 79, 385-406 (2007).
- Rigort, A., et al. Focused ion beam micromachining of eukaryotic cells for cryoelectron tomography. Proceedings of the National Academy of Sciences. 109, 4449-4454 (2012).
- Schaffer, M., et al. Cryo-focused Ion Beam Sample Preparation for Imaging Vitreous Cells by Cryo-electron Tomography. Bio-protocol. 5, (2015).
- Wagner, F. R., et al. Preparing samples from whole cells using focused-ion-beam milling for cryo-electron tomography. Nature Protocols. 15 (6), 2041-2070 (2020).
- Buckley, G., et al. Automated cryo-lamella preparation for high-throughput in-situ structural Biology. Journal of Structural Biology. 210 (2), 107488 (2020).
- Zachs, T., et al. Fully automated, sequential focused ion beam milling for cryo-eletron tomography. eLife. e52286, (2020).
- Mastronarde, D. N. Automated electron microscope tomography using robust prediction of specimen movements. Journal of Structural Biology. 152, 36-51 (2005).
- Hagen, W. J., Wan, W., Briggs, J. A. Implementation of a cryo-electron tomography tilt-scheme optimized for high resolution subtomogram averaging. Journal of Structural Biology. 197, 191-198 (2017).
- Zheng, S. Q., et al. MotionCor2: anisotropic correction of beam-induced motion for improved cryo-electron microscopy. Nature Methods. 14, 331-332 (2017).
- Rohou, A., Grigorieff, N. CTFFIND4: Fast and accurate defocus estimation from electron micrographs. Journal of Structural Biology. 192, 216-221 (2015).
- Stalling, D., Westerhoff, M., Hege, H. -. C. Amira: A highly interactive system for visual data analysis. The Visualization Handbook. , 749-767 (2005).
- Wolff, G., et al. Mind the gap: Micro-expansion joints drastically decrease the bending of FIB-milled cryo-lamellae. Journal of Structural Biology. 208, 107389 (2019).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoExplore Mais Artigos
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados