Method Article
冷冻电子断层扫描 的糖核 酸的准备和冷冻-FIB微加工
摘要
我们提出了一个协议,通过以低温为中心的离子束微加工,为大分子 进行高 分辨率结构研究,现场用低温电子断层扫描制备小型冷冻生物标本。提交的协议为制备高质量的拉梅莱提供了指导方针,具有高可重复性,用于在萨查罗米切斯宫内进行大分子的结构特征。
摘要
今天,低温电子断层扫描(cryo-ET)是唯一能够提供近原子分辨率结构数据 的原位大分子复合物的技术。由于电子与物质的强烈相互作用,高分辨率低温-ET研究仅限于厚度小于200纳米的标本,这限制了低温ET只对细胞外围区域的适用性。在过去十年中,引入了一个复杂的工作流程,包括通过以低温为中心的离子束微加工(cryo-FIBM)制备薄细胞横截面,以便从较大细胞内部获取低温-ET数据。我们提出了一个协议,从样品中制备细胞跛脚菌,通过暴跌冷冻,利用 糖 核糖核酸作为真核细胞的原型例子,在细胞和分子生物学研究中具有广泛的利用。我们描述了将 S. cerevisiae 病毒化为几个细胞的隔离斑块或 TEM 网格上的细胞的连续单层的方案,并为这两个样本的低温 FIB 制备拉梅拉提供了协议。
引言
最近的技术和软件发展使紫光生物标本的电子低温显微镜(Cryo-EM)成为过去十年结构生物学研究的关键技术之一。冷冻-EM标本的制备通常包括将纯化蛋白或含有核酸的复合蛋白应用于样品载体(TEM网格),然后用滤纸去除大部分液体,然后用样品的残余薄层将网格冻结成液乙烷或丙烷3.因此,样品固定在一层薄薄的无定形缓冲层(通常为<80纳米),处于完全水合状态,处于接近原生状态,无需任何化学固定或重金属对比。然后,通过单个粒子分析协议2,对传输电子显微镜中的结构均匀标本进行成像,然后生成可用于确定近原子分辨率大分子三维结构的数据。这种体外结构与样品制备过程中所使用的条件和处理条件下的巨分子的表示相对应。虽然在体外条件下确定的结构通常与大分子的功能状态相对应,但成像细胞内各种大分子之间的空间关系的能力将为结构数据提供额外的功能背景。
低温电子断层扫描(cryo-ET)用于重建原位4、5的多态物体或大分子复合体的3D卷。低温ET的优点是三维信息是通过成像单个实体获得的。然而,观察单个大分子复合物或细胞器的分辨率非常有限。因此,从大量图中得出分辨率模型(亚图平均值、STA)的平均值与较大数量的图光图结构相同,因此需要达到 4-8 + 分辨率模型,从低温-ET 数据6、7。最近已经表明,低温ET和STA也可以应用于确定大分子机器的高分辨率结构,如核糖体在细胞环境7的背景下。然而,传输电子显微镜的利用受到标本厚度的限制。一般来说,对于单粒子低温 EM 来说,这不是问题,因为优化的化色条件最终会导致样品嵌入薄薄的冰层中。另一方面,大多数细胞实际上对300keV电子束不透明。300 keV电子的玻璃化生物标本中的无弹性平均自由路径约为395纳米8,这意味着冷冻-ET研究仅限于大多数细胞的细胞外围。
开发了不同的技术,将样品稀释到足够厚度,用于低温 ET。冷冻超微切除术利用在液氮温度(-196 °C)下用金刚石刀对样品进行机械切片,提供适合低温ET9、10、11的60-80纳米厚的切片。可以从单个单元格中准备多个部分,数据分析最终可以为单元格的较大部分生成 3D 结构信息。然而,机械切片可能会导致一些文物,如弯曲的部分,裂缝,或样品压缩,这可能会影响产生的结构和偏向低温ET数据10,11,12。以冷冻为中心的离子束微加工(cryo-FIBM)是一种替代方法,即通过在多步过程中使用Ga+离子(FIB)的聚焦光束逐渐消融来制备薄细胞段,从而产生80×300纳米厚的细胞横截面(拉梅拉)13、14、15.与低温超微切除术相比,只有一个拉梅拉是由单个细胞制备的,该细胞占其体积的+0.3+3%,而多细胞的微加工通常是必要的,以找到对碾磨横截面感兴趣的区域。此外,整个工作流程的吞吐量现在仍然相当低,通常限制在 8 小时低温 -FIBM 会话中的 6 到 8 个高质量的跛脚。另一方面,低温-FIBM横截面没有任何压缩伪件,为高分辨率低温ET提供了合适的输入。此外,没有必要将拉梅拉转移到冷冻ET的样品载体,因为在整个拉梅拉制备过程中,样品被保留在 TEM 网格上,随后可以将相同的网格转移到 TEM。我们预计,低温-FIBM的吞吐量将很快得到显著改善,主要来自无监督拉梅拉铣削16、17软件的可用性,以及基于充电耦合等离子体原理的FIB的使用,这将提供更快的材料消融。
糖精 (酵母)是球形真核细胞,直径为+2-5 μm。由于其大小,可访问性,遗传学,生成时间,和简单的操作,酵母被广泛研究为真核模型生物体在细胞和分子生物学研究类似于 Escherichia大肠杆菌,这是在细菌学中作为一个原生模型有机体进行了很好的研究。酵母可以很容易地在悬浮培养和大量的细胞在短时间内产生(加倍时间1 - 2小时)。更重要的是,酵母与动植物细胞共享复杂的内部细胞结构,同时保留由低含量的非编码DNA组成的小基因组。因此,从高分辨率 原位数据对 酵母蛋白组进行结构特征描述,有助于对文献中大量可用的功能数据进行机械描述。
在此,我们提供了一个全面的协议,用于获取酵母样品 的原位 低温-ET数据,涵盖从样品培养到低温-FIBM拉梅拉制备的所有步骤,以及将样品转移到 TEM 进行低温-ET 数据采集的所有步骤。
研究方案
1. 培养和制备 糖体细胞 ,用于化
- 为 糖精切塞雷维西亚准备液体生长介质。
- 自动将一个 500 mL 玻璃瓶用于制备生长介质。
- 重2.2克酵母提取物(1.1%)和4.4克Peptone(2.2%),混合在200ml的水中。
- 在 121 °C 下自动夹紧 15 分钟进行消毒。
- 重10克葡萄糖粉,混合在50mL的水,以获得20%的葡萄糖溶液。通过 0.2 μm 过滤器传递解决方案,并将它存储在 4 °C 下。
- 为 圣餐切西雷维西亚准备固体介质。
- 重4克的醋粉,与200ml的生长介质混合。
- 在 121 °C 的高压灭菌中消毒 15 分钟。
- 冷却介质至 40-50 °C,并添加 20 mL 的 20% 无菌葡萄糖(前一步准备)。将整个介质的 ±20 mL 倒入培养皿中,使其在环境温度下凝固。
- 将茄子板包裹在副膜中,以防止干燥,并在 4 °C 下存放。
- 文化 圣餐在 暂停
注:该协议是优化的,以准备从暂停的细胞线 S丙烯酸酯脑层 菌株BUB4741 [ATCC 4040002]或类似的菌株的低温-FIBM样品。- 高压灭菌 50 mL 埃伦迈尔 (或类似) 烧瓶。
- 在引擎盖或层压流箱中工作。皮佩特 10 mL 的生长介质到无菌 50 mL 埃伦迈尔烧瓶。
- 用1 mL过滤20%葡萄糖补充介质。从带有无菌一次性接种环(1-10 μL)的亚加板中挑选一团酵母。
- 将 Erlenmeyer 烧瓶放在孵化器和文化中,在 30 °C 处搅拌(150-200 rpm),直到达到指数阶段(约 7 小时)。
注:我们观察到,当从在环境温度下培养了 4 周的人造黄油板中采摘菌落时,指数阶段在 ±15 小时后达到。另请参阅下面注释。
- 文化糖精从甘油库存的阿加板上切除。
- 使用 4 °C 存储中的新加糖板。
- 从 -80 °C 的深冰柜中取出 S. Cerevisiae 库存,并将其放入冷冻支架中,以避免库存完全解冻。
- 刮掉并转移具有无菌接种循环(1-10 μL)到 50 μL 生长介质的小培养物。正确混合。
- 将混合 的塞雷维西亚 文化的整个体积转移,并用无菌的蔓延棒在阿加板表面分散。
- 在 30 °C 下孵育约 48 小时,直到形成直径为 1.5-2 mm 的菌落。
注:建议在实验前对殖民地进行新培养。超过1周的菌落需要较长时间的液体介质培养才能达到指数增长阶段。
- 文化 糖精在 阿加盘子里。
- 使用预制的阿加板与种植 的塞雷维西亚 殖民地。
- 派佩特 10 mL 的无菌生长介质和 1 mL 过滤 20% 葡萄糖到 50 mL 埃伦迈尔烧瓶。
- 选择一个带有无菌接种循环的 S. cerevisiae 培养物的殖民地,并与烧瓶中的生长介质混合。
- 在 30 °C 下孵育 50 分钟,搅拌(150-200 转转)。
- 用生长介质稀释悬浮培养物十次,用无菌扩散棒将 50 μL 的悬浮物分散在茄板上。
- 在30°C下孵育约48小时,直到观察到1.5-2毫米菌落。
- 用副膜包裹培养皿的边缘,以防止其干燥。在室温下存放,最多使用4周。
- 准备 糖精切塞雷维西亚 在细胞簇中暴跌冻结。
- 根据暂停(第 1.3 节)中糖核酸培养部分的协议准备S. cerevisiae细胞培养,并在 30 °C 下以激动(150-200 rpm)孵育 +7 h。
- 使用紫外线/Vis 光谱仪测量 600 nm 的 S. cerevisiae 细胞悬浮培养的 OD。
- 将细胞悬架集中到 OD600 = 1。
- 准备 S. 塞雷维西亚 在细胞单层中暴跌冻结。
- 根据糖核酸细胞培养部分的规程准备S. Cerevisiae细胞培养,并在 30 °C 下以激动(150-200 rpm)孵育 +7 h。
- 使用紫外线/Vis 光谱仪测量 600 nm 的 S. cerevisiae 细胞悬浮培养的 OD。
- 将中等细胞转移到离心机管中,以相对离心力(900 x g)轻轻旋转2分钟。
- 通过管道将介质从细胞颗粒中丢弃。
- 在细胞颗粒中加入新鲜的介质。计算介质体积,获得OD600 的细胞悬浮,等于30至60。
- 在细胞悬浮中加入甘油(50% 库存溶液),在玻璃化前不久最终浓度达到 5%。
注:甘油作为保护剂,可提高细胞之间区域的冰的质量。甘油被添加到细胞中,直到玻璃化前不久,以尽量减少其吸收到细胞。
2. 萨 查罗米切斯塞雷维西亚 标本的维他化
- 发光放电 TEM 网格,碳膜侧朝上 30-45 s(压力:6-9 Pa,电流:7 mA)。
- 将 Vitr 化机器人设置为以下参数:温度:18 °C,湿度:100%,污点时间:6s,等待时间:5s,印迹周期:1倍,污点力:5。
注:斑点力是一种特定于仪器的值,不同机器之间可能有不同的最佳斑点力值。特定柱塞的最佳值必须通过实验确认。 - 准备液体乙烷进行化。
- 将非吸水表面垫安装到面向样品的印迹垫上。将滤纸用于其他印迹垫。
- 用钳子拾取发光放电网格,并将钳子安装到跳水冷冻仪器上。
- 将 3.5 微升 S. cerevisiae 悬浮件应用于柱塞气候室内电网的碳侧。在网格上的每个应用程序之前正确混合。
- 将网格冻结到液态乙烷中。
- 将网格从液态乙烷转移到LN2。在 LN2 条件下存储带细化细胞的网格,或将其安装到 TEM 网格墨盒中,以加载到 FIB-SEM 显微镜中。
3. 将 TEM 网格安装到网格墨盒中
注:此处描述的工作流程利用安装在网格墨盒中的 TEM 网格,以方便 SEM 和 TEM 显微镜之间的样品处理和传输。墨盒组件由 C 环、TEM 网格和 C 夹环组成。使用其他显微镜制造商的仪器时,还有其他选择。网格墨盒装配工作站充满了 LN2。LN2 级别用 TEM 网格覆盖网格盒,但将 TEM 网格安装到墨盒中是在 LN2 蒸汽中执行的。强烈建议在病毒化过程中佩戴保护面罩或防护罩,以防止污染对标本的呼吸。不要使用累积冰污染的工具。
- 将网格墨盒装配工作站放在一起,并准备用于剪报的干工具。
- 用 LN2冷却装配工作站。将剪贴工具冷却至 LN2 温度。
- 将带有体格样品的网格盒放入装配工作站。
- 放置一个 TEM 网格,标本的细胞朝下到 C 环,然后用 C 夹固定。
- 将夹紧的墨盒放入网格盒中并正确关闭。
- 将墨盒存放在 LN2 德瓦尔或将其加载到 FIB-SEM 显微镜中。
4. 将样品加载和操作到 FIB-SEM 显微镜
注:编写了用于使用双光束显微镜 Versa 3D 的说明,该显微镜配备了 PP3010 低温-FIB/SEM 制备系统。替代解决方案可能需要不同的特定参数;但是,工作流程的总体概念仍然有效。
- 将显微镜冷却到液氮温度。
- 冷却开始前将显微镜室和制备室(如果存在)泵送至高真空(< 4 x 10-4 Pa),以防止污染增长。
- 将氮气流量设置为 5 L/min,用于制备室、显微镜阶段和显微镜防污染器。等待,直到所有组件达到< -180 °C 的温度。
注:本研究中使用的FIB-SEM显微镜设置利用冷却的氮气冷却其阶段和防污染剂。其他系统可能使用不同的方法进行阶段冷却。一旦舞台和防污染器位于此处使用的仪器上的 -190 °C,腔室压力达到 +3 x 10-5 Pa。本研究中使用的实验设置中,拉梅拉表面碳氢化合物污染层的生长速度为 ±15 nm/小时。
- 将带标本的网格墨盒加载到显微镜上。
- 将装载站组装并冷却至 LN2 温度。
- 将穿梭机(样品支架)、带标本的网格盒、网格盒开瓶器和钳子放入冷却装载站。
- 小心地将网格盒与标本朝上转移到航天飞机上。
- 将装载站内的穿梭车翻转到装载位置。
- 装入显微镜。
- 可选,为标本涂上金属保护层。
注:当成像冷冻水合生物材料SEM时,可以观察到强烈的充电效果。此外,使用 FIB 成像生物样品(即使在低电流下)会诱发快速的样品损伤。因此,在 FIB-SEM 显微镜内可以进行额外的样品涂层,以保护标本表面。- 气体喷射系统 (GIS) 将保护层与有机铂沉积。
- 将样品设置为以欧为中心的高度(电子和离子成像的巧合点)。
- 将舞台向后倾斜至 45°(相对于电子束倾斜 90°)。
- 将 z 轴中的舞台移动到 4 mm 以下的 eu 中心高度。
- 将 GIS 针设置为 26+30 °C。
- 将 300-1000 nm 的有机铂层与生物标本(相当于 GIS 沉积物的 30+120 s)一起沉积到网格中。
注:我们通常应用GIS为30s的样本与小细胞簇和45s的样本与细胞的单层。
- 溅射物用导电金属层涂抹标本表面。
- 用生物标本将 10 纳米的金属层(Ir、Au、Pt)沉积到网格中。
- 气体喷射系统 (GIS) 将保护层与有机铂沉积。
- 为拉梅拉制备设置显微镜参数
- 对于 FIB,请使用以下参数:高压 = 30 kV,电流 = 10 pA(成像),10 pA+3 nA (FIB 铣削)
- 对于 SEM,请使用以下参数:高压 = 2+5 kV,点大小 = 4.5,电流 = 8+27 pA。
- 将两个光束的扫描旋转设置为 180°。
- 设置舞台倾斜度:铣削角度 6-11°(对应 13°18° 的舞台倾斜,用于预倾斜 45° 的样品穿梭和在 SEM 和 FIB 列之间具有 52° 角度的 FIB/SEM 显微镜)。
5. 准备 圣餐切丽舍·拉梅拉
- 检查网格质量,并选择合适的糖精集群。
- 检查 TEM 网格是否从两侧正确擦除,而细胞群周围或网格后侧没有额外的水。
注:为了检查网格的背面,将舞台旋转到 -10°,然后用 FIB 对网格进行成像。 - 根据以下建议选择最佳细胞组进行拉梅拉制备。
- 将单元格组放置在网格中心。铣削区域不应延伸到正方形外,尺寸为 1100 x 1100 μm,位于网格中心(从网格中心向每个方向扩展 550 μm)。
- 将单元格聚类放置在网格方块的中心部分,与网格条没有重叠。
- 将电池簇放置在网格方块中,用紧凑的孔碳箔,无裂缝。
- 确保聚类不会被冰污染包围。
- 检查 TEM 网格是否从两侧正确擦除,而细胞群周围或网格后侧没有额外的水。
- 选择 糖浆切片单 层的最佳铣削位置。
- 确保选定网格正方形上的单元格单层周围的网格条可见。
- 根据以下建议选择细胞单层的最佳位置。选定的铣削区域应满足以下标准:
- 在网格中心拥有感兴趣的区域。铣削区域不应延伸到位于网格中心的尺寸 1100 x 1100 μm 的正方形之外(从网格中心向每个方向延伸 550 μm)。
- 在网格方块的中央部分有感兴趣的区域,与网格条没有重叠。
- 不要将细胞单层包围在冰污染中。
- 准备 S. 塞雷维西亚 拉梅拉与低温 - Fib 。
注:铣削模式相对于感兴趣区域生成并以中心为中心。冷冻-FIBM 按顺序执行,在不同的 FIB 设置下执行多个铣削步骤。厚度约为 2 μm 的拉梅拉最初使用高电流 (0.3 3 nA) 进行铣削。然后,拉梅拉逐渐变薄到500纳米。低电流(10-30 pA)的精细铣削步骤用于将拉梅拉最终确定为 ±100+200 nm 厚度。- 将感兴趣的区域 (ROI) 设置为以 eu 中心高度为中心,并保存此位置。
注:需要分别确定和保存每个位置的巧合点。以欧心高度为设置,将舞台倾斜至 0°,并通过在 x 和 y 方向移动舞台来以 ROI 为中心。然后将舞台倾斜至 25°,通过更改阶段 z轴位置将投资回报率带回扫描区域的中心。最后,舞台向后倾斜至 13°+18° 进行铣削。 - 使用从上到下的扫描方向定义 ROI 上方的矩形铣削模式。
- 使用从下到上扫描方向定义 ROI 下方的矩形铣削模式。
- 定义覆盖感兴趣区域的非活动矩形铣削模式,粗略估计拉梅拉厚度。这种模式不是在拉梅拉准备过程中磨制的。
- 标记所有图案并设置拉梅拉宽度(x 维度)。铣削模式的宽度不应超过聚类宽度的 2/3。在大多数情况下,这相当于 8°15 μm。
- 为粗加工步骤设置参数
- FIB 电流: 0.3+3.0 nA:最后的拉梅拉厚度: 1.5+2 μm;FIBM 区域的宽度: 8-12 um:舞台倾斜: 13-17°;持续时间:8分钟:主动铣削模式:上部和下部。
- FIB 电流: 0.3+1.0 nA;最后的拉梅拉厚度:1微米;FIBM 面积宽度:7.5-11.5 μm;舞台倾斜: 13-17°;持续时间:8分钟:主动铣削模式:上部和下部。
- FIB 电流: 100+300 pA;最后的拉梅拉厚度:0.5μm:FIBM 面积宽度:7.5-11.5 μm;舞台倾斜: 13-17°;持续时间:8分钟:主动铣削模式:上部和下部。
- FIB 电流: 30+100 pA;最后的拉梅拉厚度:0.3μm:FIBM 面积宽度:7.5-11.5 μm;舞台倾斜: 13-17°;持续时间:8分钟:主动铣削模式:上部和下部。
- 为精细铣削步骤设置参数:
- FIB 电流: 10+30 pA;最后的拉梅拉厚度:<0.2 um:FIBM 区域的宽度:7-11 μm;舞台倾斜: 13-17° (+1°);持续时间:12分钟;主动铣削模式:上部。
注:粗铣削步骤(5.3.6)按顺序为每个拉梅拉进行。相比之下,精细铣削步(5.3.7)并不直接遵循粗加工,但精细铣削步骤在会话结束时会连续执行所有拉梅拉,以尽量减少拉梅拉表面的碳氢化合物污染。在精细铣削步骤中,使用额外的 +1° 阶段倾斜,以增加拉梅拉厚度的均匀性。
- FIB 电流: 10+30 pA;最后的拉梅拉厚度:<0.2 um:FIBM 区域的宽度:7-11 μm;舞台倾斜: 13-17° (+1°);持续时间:12分钟;主动铣削模式:上部。
- 将感兴趣的区域 (ROI) 设置为以 eu 中心高度为中心,并保存此位置。
6. 将 糖精切塞雷维西亚 拉梅拉转移到低温 - Tem
- 准备一个适当干燥的德瓦尔,并填补它与LN2。
- 在低温条件下,用从 FIB/SEM 显微镜中取出带有跛脚的样品,将其转移到网格盒中,并储存在 LN2 存储 Dewar 中,以便长期存储。或者,将网格直接加载到低温-TEM 中。
- 拉梅拉相对于低温-TEM 舞台倾斜轴的正确方向很重要(请参阅 8:10 的随附视频,了解更多详情)。确保制备拉梅拉的铣削方向与低温-TEM 舞台倾斜轴垂直。
- 预倾斜低温-TEM阶段,以补偿拉梅拉倾斜相对于网格平面,并收集倾斜系列使用剂量对称方案19。
注:预倾斜(通常为 6+8°)的大小由 TEM 网格平面和 FIB 方向在微加工过程中的角度决定。拉梅拉前缘在图像中的位置在低温-TEM中可用于确定预倾斜角度的标志。为此,必须知道显微镜阶段旋转的感觉。在我们的实验设置中,在纳米probe SA 模式拍摄的图像右侧的拉梅拉前缘位置对应于负预倾斜。
结果
在指数增长阶段中期收获了糖精文化。我们准备了两种类型的标本,其中细胞要么作为几个细胞的小簇分布在 TEM 网格表面(图 1A,C),要么在 TEM 网格的单个网格方块上形成连续单层(图 1B,D)。用不同的细胞胰岛或细胞单层来制备样品的歧视性因素是应用于 TEM 网格的细胞培养物的浓度。收获的细胞培养集中在OD600 = 1.0 为前一种情况,或OD600 = 30 至 60 为后一种情况,分别。细胞单层制备样品在玻璃化前进一步补充了5%v/v甘油。甘油对缓冲液的振动至关重要,缓冲液填补了细胞之间的空间(图2),因为晶体缓冲器的反射可能不利于低温ET数据收集过程中的正确位置跟踪和聚焦。
此外,酵母悬浮培养物被抹在非吸水材料上,如 PTFE 印迹垫或由 FlexFill 98A 材料制成的定制 3D 打印垫。印迹纸仅位于网格背面的样品应用(反印)。建议使用悬浮培养液进行背印策略,因为用两侧的滤纸进行印迹会导致细胞粘附到印迹纸(图1E)。
此处描述的协议利用网格盒中夹紧的 TEM 网格,从而对网格形成稳定的支持,并便于在电气化后对样品进行样品处理。这强制要求 FIB/SEM 和 TEM 显微镜中的其他样品持有人和穿梭器可以接受这样的网格墨盒。
将样品转移到FIB/SEM显微镜后,该样品首先使用显微镜气体喷射系统(GIS)涂上0.3±1.0μm的甲基环丙苯二甲基铂层。样品表面又溅出一层无机虹膜,使GIS层变硬,使表面导电。拉梅拉被铣削成多个步骤(图3),其中(I)铣削电流,(II)拉梅拉宽度,(三)样品上方和下方铣削面积的距离以步进方式减少。最后的铣削步骤("抛光")仅在低电流(10-30 pA)下进行,从拉梅拉的顶部和样品向 Ga+ 光束倾斜 1°。使用上述协议平均导致在一个 6-8 小时内在两个 TEM 网格上准备了 8-10 个跛脚。
带有跛脚的 TEM 网格随后被转移到传输电子显微镜中。首先筛选了跛脚,只有那些显示最小的窗帘(由拉梅拉表面的不均匀铣削产生的人工制品)、低表面污染水平和良好的细胞对比度(通常观察到的拉梅拉厚度为 200 < nm)才用于获取低温-ET 数据。此外,从数据收集中丢弃了包含整个长度裂缝的跛脚。一般来说,转移到 TEM 的跛脚菌中约有 50% 适合数据采集。倾斜系列收集在后 GIF K2 直接电子探测器上,能量选择缝隙设置为 20 eV。数据收集在 SerialEM 软件18中进行,倾斜系列使用剂量对称方案19进行收集,倾斜范围为 ±60°,增量为 3°。数据以与 3.47 A/px 像素大小对应的放大倍率获取。65 e/+2的总剂量在单个子帧上均匀分布。倾斜图像被收集为三帧,随后使用 MotionCor220程序对数据采集过程中的运动和辐射损坏进行了更正。对比转移函数的参数是使用Ctffind421估计的。倾斜系列在eTomo18中处理。修补程序跟踪程序用于对齐图像。在图像的 2 倍装箱后,使用加权背投影算法重建了图,随后在 IMOD18中使用类似 SIRT 的滤镜(设置为 8 次迭代)进行了筛选。图解分割是在阿米拉软件22手动进行的。重建的图光片提供了酵母细胞内部的高分辨率表示,使我们能够在高水平的细节下观察细胞,如真空或线粒体,或研究大分子复合物,如微管,或核孔复合物就地和近本地条件(图4)。

图1:FIB和SEM图像的维他制 S.塞雷维西亚
FIB(A) 和 SEM(C)在 TEM 网格上振动的小酵母簇图像。FIB(B) 和 SEM(D)酵母在网格表面形成连续单层的图像。样品在成像前涂有GIS和虹膜层。面板 A-B 中的刻度条对应于 10 μm。酵母样品被印在非吸水材料上,如PTFE或FlexFill 98A(绿色),并且从网格背面(白色 、E)定位的印迹纸。 请单击此处查看此图的较大版本。
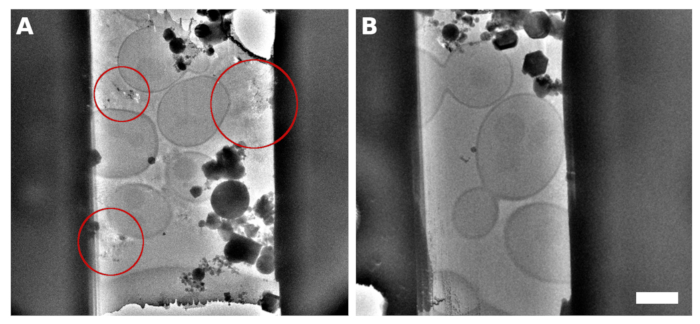
图2: 塞雷维西亚· 拉梅拉
从样品中分离出的拉梅拉微加工的 TEM 图像,在网格表面具有连续的单层酵母。观察到的细胞之间的反射包含不当的振动介质/缓冲器(A,突出显示为红色圆圈)。酵母上产生的拉梅拉的 TEM 图像被破坏成连续的单层,在中/缓冲器中加入 5% 甘油(B)。比例尺对应于 2 μm。 请单击此处查看此图的较大版本。
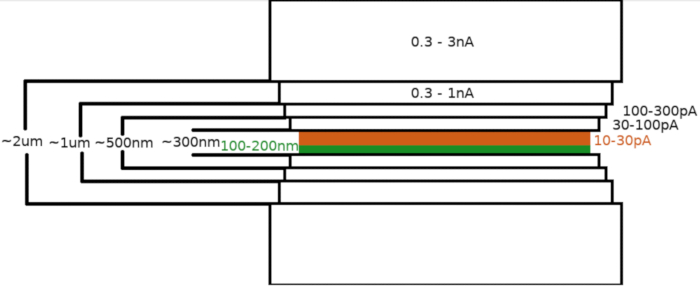
图3:冷冻-FIBM工作流程
拉梅拉铣削工艺的原理图描述。最初的粗加工步骤是在试探性拉梅拉位置(以绿色突出显示)两侧的高 FIB 电流下执行,而最终抛光步骤仅从顶部侧和低 FIB 电流下执行(以橙色突出显示,请参阅 6:33 的伴随视频)。 请单击此处查看此图的较大版本。
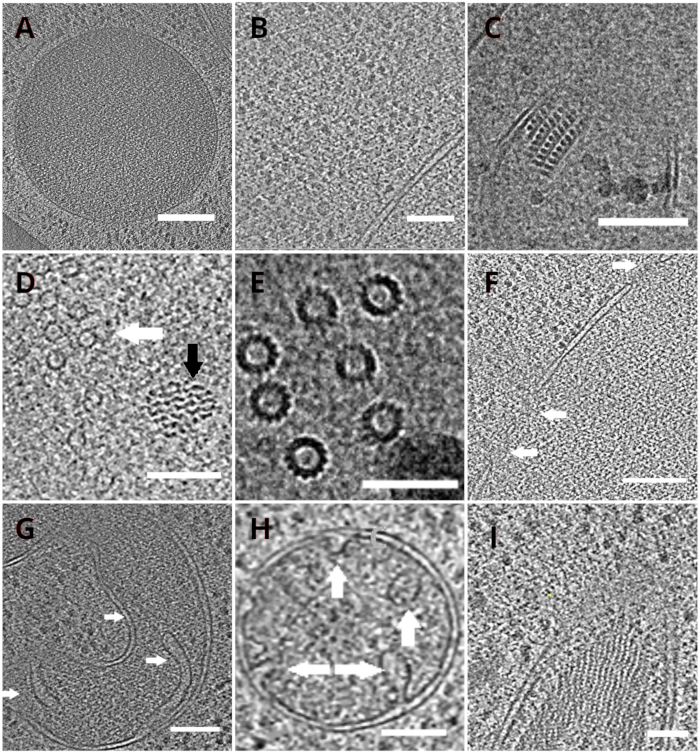
图4:低温ET描绘的酵母细胞器和大分子复合物
重建的图光片描绘了真空(A,比例栏:200纳米),核糖体(B, 比例杆:200 nm),超氧化物的准晶体核心(C,刻度杆:100 nm),微管(白箭头)在不明纤维结构附近(黑箭头 ,D,刻度杆:100纳米),多个微管的细节(E,比例杆:50纳米),一个核膜与箭头指示的毛孔(F, 比例杆200nm),线粒体(G,H,刻度杆:100纳米,箭头表示个别克里斯泰),一束不明的细丝结构(I,刻度条:100纳米)。 面板 B、C、D、E、G 包含从小细胞簇中制备的托图部分,而从细胞单层收集的托盘图部分则显示在 面板 A、F、H、I中。 请单击此处查看此图的较大版本。
讨论
低温ET细胞样本的制备是一个复杂的工作流程,需要使用几个高端仪器。在影响整个协议吞吐量的每个准备步骤中,样品质量都会受到影响。此外,单个仪器之间的样品转移的必要性还增加了样品污染或毁损的风险。因此,优化样品制备工作流程中的各个步骤对于提高拉梅拉制备工作流程的吞吐量和可重复性具有十分重要的意义。这里提出的协议描述了通过低温ET对大分子复合物进行原位结构特征的优化制备。
该协议描述了两种酵母样本的制备,它们主要不同于TEM网格上细胞的浓度。两个酵母样品都为低温ET生产了高质量的拉梅拉,并且可以根据特定研究的目标选择标本类型。酵母形成孤立的细胞簇,在第一种情况下随机分散在网格表面,而在第二个样本类型的 TEM 网格表面存在一个连续的单层细胞。前者是适合快速拉梅拉准备,由于小体积的材料,必须磨掉。最后的拉梅拉是相当短的,因此,只包含2-4个细胞横截面。适合样品制备的区域随机分布在网格表面,包括网格方块,这可能部分限制拉梅拉制备工作流程的自动化。后一种类型的标本要求在初始铣削阶段利用较大的电流来保留整体铣削时间。此外,这种类型的样品更容易产生不均匀铣削(窗帘)产生的工件。因此,GIS 溅到样品表面的时间比带小细胞簇的样品长 50%,从而形成更厚的保护层。接下来,样品溅出额外的一层虹膜(或铂金或黄金),以治愈GIS层,使其更硬,并增加样品表面的导电性。在粗糙的拉梅拉铣削的第一步中,拉梅拉(从拉梅拉边缘2-5μm)两侧的额外区域的FIBM被发现有利于减少破碎的拉梅拉的数量最有可能由于在最后的横截面23的张力下降。最后的拉梅拉很长,包含 +10 细胞横截面,这增加了适合低温 ET 的区域数量。在缓冲液中加入低温保护剂(本研究中使用的5%甘油),细胞之间介质或缓冲器的不当振动很容易减弱。由于大多数正方形适合拉梅拉制备,带细胞的样品可组织成连续单层,非常适合在无人监督的情况下进行拉梅拉制备。
拉梅拉制备工作流程的另一个重要方面是向透电电子显微镜的传输和拉梅拉到显微镜阶段倾斜轴的正确定位。最理想的情况是,拉梅拉主轴垂直于显微镜的倾斜轴,可在成像区域的高度进行跟踪和聚焦,并防止拉梅拉边缘以高倾斜角度遮挡视野。在使用剂量对称方案收集低温ET数据时,18样本应首先在显微镜中旋转,以补偿拉梅拉对网格平面的倾斜。
披露声明
作者没有什么可透露的。
致谢
这项工作得到了欧盟委员会 Horizon 2020 计划资助的"指示-Ultra"(赠款731005)、iNEXT-Discovery(赠款871037)以及由指示-ERIC 中心 (LM2018127) 资助的 CIISB 研究基础设施的支持。我们感谢从热费舍尔科学布尔诺获得的支持。
材料
| Name | Company | Catalog Number | Comments |
| Agar | Himedia | MB053 | |
| Glucose | PENTA | 12020-31000 | |
| Glycerol | Merck | G5516-1L | |
| ethane | Messer | 1007 | |
| LN2 | Lineq | LN2-1L | |
| Peptone | Merck | P5905-1KG | |
| Saccharomyces cerevisiae | ATCC | 201388 | strain BY4741 |
| Tweezers | Dumont | T539 | |
| Yeast extract | Duchefa Biochemie | Y1333.1000 | |
| Disposable | |||
| Blotting papers | Ted Pella | 47000-10 | |
| C-clip | ThermoScientific | 9432 909 97551 | |
| C-clip ring | ThermoScientific | 9432 909 97561 | |
| Spreading sticks | Merck | Z376779-1PAK | |
| Sterile inoculation loops | BRAND | BR452201-1000EA | |
| Sterile plastic Petri dishes | Sigma | SIAL0166 | |
| TEM grids | Quantifoil | 4420G-XA | |
| Equipment | |||
| Autoclave | Systec | 101291545 | |
| balances | BEL | M124A | |
| Cryo-FIB/SEM microscope | ThermoScientific | 1006123 | |
| Cryo-TEM microscope | ThermoScientific | 9432 057 03301 | |
| Laminar flow box | Telstar | AH5 | |
| Plasma cleaner | Gatan | 955.82001 | |
| Shaking incubator | New Brunswick | M1282-0002 | |
| UV/VIS spectrophotometer | WPA | S800 | |
| Vitrification robot | ThermoScientific | 9432 053 50621 |
参考文献
- McMullan, G., Faruqi, A., Clare, D., Henderson, R. Comparison of optimal performance at 300keV of three direct electron detectors for use in low dose electron microscopy. Ultramicroscopy. 147, 156-163 (2014).
- Zivanov, J., et al. New tools for automated high-resolution cryo-EM structure determination in RELION-3. eLife. 7, (2018).
- Dubochet, J., McDowall, A. W. Vitrification of pure water for electron microscopy. Journal of Microscopy. 124, 3-4 (1981).
- Villa, E., Schaffer, M., Plitzko, J. M., Baumeister, W. Opening windows into the cell: focused-ion-beam milling for cryo-electron tomography. Current Opinion in Structural Biology. 23, 771-777 (2013).
- Mahamid, J., et al. Visualizing the molecular sociology at the HeLa cell nuclear periphery. Science. 351 (6276), 969-972 (2016).
- Schur, F. K. Toward high-resolution in situ structural biology with cryo-electron tomography and subtomogram averaging. Current Opinion in Structural Biology. 58, 1-9 (2019).
- O'Reilly, F. J., et al. In-cell architecture of an actively transcribing-translating expressome. Science. 369, 554-557 (2020).
- Rice, W. J., et al. Routine determination of ice thickness for cryo-EM grids. Journal of Structural Biology. 204, 38-44 (2018).
- Al-Amoudi, A., Norlen, L. P. O., Dubochet, J. Cryo-electron microscopy of vitreous sections of native biological cells and tissues. Journal of Structural Biology. 148, 131-135 (2004).
- Al-Amoudi, A., Studer, D., Dubochet, J. Cutting artefacts and cutting process in vitreous sections for cryo-electron microscopy. Journal of Structural Biology. 150, 109-121 (2005).
- Pierson, J., et al. Improving the technique of vitreous cryo-sectioning for cryo-electron tomography: electrostatic charging for section attachment and implementation of an anti-contamination glove box. Journal of Structural Biology. 169, 219-225 (2010).
- Dubochet, J., et al. How to "read" a vitreous section. Methods in Cell Biology. 79, 385-406 (2007).
- Rigort, A., et al. Focused ion beam micromachining of eukaryotic cells for cryoelectron tomography. Proceedings of the National Academy of Sciences. 109, 4449-4454 (2012).
- Schaffer, M., et al. Cryo-focused Ion Beam Sample Preparation for Imaging Vitreous Cells by Cryo-electron Tomography. Bio-protocol. 5, (2015).
- Wagner, F. R., et al. Preparing samples from whole cells using focused-ion-beam milling for cryo-electron tomography. Nature Protocols. 15 (6), 2041-2070 (2020).
- Buckley, G., et al. Automated cryo-lamella preparation for high-throughput in-situ structural Biology. Journal of Structural Biology. 210 (2), 107488 (2020).
- Zachs, T., et al. Fully automated, sequential focused ion beam milling for cryo-eletron tomography. eLife. e52286, (2020).
- Mastronarde, D. N. Automated electron microscope tomography using robust prediction of specimen movements. Journal of Structural Biology. 152, 36-51 (2005).
- Hagen, W. J., Wan, W., Briggs, J. A. Implementation of a cryo-electron tomography tilt-scheme optimized for high resolution subtomogram averaging. Journal of Structural Biology. 197, 191-198 (2017).
- Zheng, S. Q., et al. MotionCor2: anisotropic correction of beam-induced motion for improved cryo-electron microscopy. Nature Methods. 14, 331-332 (2017).
- Rohou, A., Grigorieff, N. CTFFIND4: Fast and accurate defocus estimation from electron micrographs. Journal of Structural Biology. 192, 216-221 (2015).
- Stalling, D., Westerhoff, M., Hege, H. -. C. Amira: A highly interactive system for visual data analysis. The Visualization Handbook. , 749-767 (2005).
- Wolff, G., et al. Mind the gap: Micro-expansion joints drastically decrease the bending of FIB-milled cryo-lamellae. Journal of Structural Biology. 208, 107389 (2019).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。