Method Article
クライオ電子断層撮影のための サッカロミセス・セレビシエ の調製とクライオFIBマイクロマシニング
要約
クライオに焦点を当てたイオンビームマイクロマシニングによる、凍結した生体試料のラメラ調製プロトコルを提示し 、その場で の高解像構造研究をクライオ電子断層撮影で行う。提示されたプロトコルは、サッカロミセス・セレビシエ内の高分子の構造特性化に対して、高い再現性を備えた高品質のラメラを調製するためのガイドラインを提供する。
要約
今日、クライオ電子断層撮影(cryo-ET)は、 その場での高分子複合体に近原子分解能構造データを提供できる唯一の技術です。電子と物質の強い相互作用のために、高解像度のcryo-ET研究は、細胞の末梢領域にのみcryo-ETの適用性を制限する200nm未満の厚さの標本に限定されています。この10年間に、細胞の内部からクライオETデータを取得できるように、クライオに焦点を当てたイオンビームマイクロマシニング(cryo-FIBM)による薄い細胞断面の調製を構成する複雑なワークフローが導入されました。細胞生物学および分子生物学研究において広く利用されている真核細胞の原型例として 、サッカロミセス・セレビシエ を利用したプランジ凍結によりガラス化された試料から細胞ラメラを調製するためのプロトコルを提示する。我々は 、S.cerevisiae を数個の細胞の単離されたパッチまたはTEMグリッド上の細胞の連続的な単層にガラス化するためのプロトコルを記述し、これら2つのサンプルに対してcryo-FIBによるラメラ調製のためのプロトコルを提供する。
概要
最近の技術・ソフトウェア開発により、ガラス化生物標本の電子クライオ顕微鏡(クライオEM)は、過去1年の構造生物学研究における重要な技術の1つとなった。クライオEMの標本の調製は、通常、精製タンパク質または核酸を有するタンパク質複合体をサンプルキャリア(TEMグリッド)に塗布し、その後、濾過紙で液体の大部分を除去し、サンプルの残りの薄い層を用いて液体エタンまたはプロパン3に凍結する。.したがって、サンプルは、完全に水和状態のアモルファスバッファーの薄い層(典型的には<80 nm)に固定され、ほぼネイティブ状態で、化学的固定または重金属の対比を必要としません。透過型電子顕微鏡における構造的に均質な標本のイメージングは、単一粒子分析プロトコル2を用いて、原子分解能に近い原子分解能で高分子の三次元構造の決定に使用できるデータを得る。このような インビトロ 構造は、試料調製中に利用される条件および治療の下での高分子の表現に対応する。 インビトロ条件下で 決定される構造は、通常、高分子の完全に機能的な状態に対応するが、細胞内の様々な高分子間の空間的関係を画像化する能力は、構造データに追加の機能的文脈を提供するであろう。
クライオ電子断層撮影(cryo-ET)は、4,5の多形性物体または高分子錯体の3D体積を再構築するために使用される。cryo-ETの利点は、単一の実体を撮像することによって三次元情報が得られる点である。しかし、個々の高分子複合体や小器官が観察される分解能は非常に限られています。したがって、より多くのトモグラムから同じ構造を有する高分子(サブトモグラム平均化、STA)の平均化は、cryo-ETデータ6,7から4-8Å分解能モデルに到達する必要がある。最近では、細胞環境7の文脈で、リボソームなどの高分子機械の高解像構造を決定するためにcryo-ETおよびSTAを適用できることが示されている。しかし、透過型電子顕微鏡の利用は、試料の厚さによって制限される。一般に、ガラス化条件の最適化が最終的に氷の薄い層にサンプルを埋め込むことがある単粒子クライオEMにとって、これは問題ではありません。一方、細胞の大部分は、実際には300keV電子ビームに対して電子透過性を有していない。300 keV電子のガラス化生物学的標本における非弾性平均自由経路は約395 nm8であり、これはクライオ-ETの研究が細胞の大部分の細胞周辺に限定されることを意味する。
異なる技術は、cryo-ETのための十分な厚さにサンプルを薄くするために開発されました。クライオ-ウルトラミクロトミーは、液体窒素温度(-196°C)でダイヤモンドナイフを用いたサンプルの機械的スライスを利用して、cryo-ET9、10、11に適した60〜80 nmの厚いセクションを提供する。複数のセクションを単一のセルから作成でき、データ解析によって、最終的にセルの大部分の 3D 構造情報を生成できます。しかし、機械的スライスは、曲線部分、クレバス、またはサンプル圧縮などのいくつかのアーティファクトを引き起こし、結果として生じる構造に影響を与え、cryo-ETデータ10、11、12にバイアスを与える可能性がある。クライオに焦点を当てたイオンビームマイクロマシニング(cryo-FIBM)は、多段階プロセスでGa+イオン(FIB)の集化ビームを使用して試料の薄い細胞断面を徐々にアブレーションすることによって調製する代替アプローチを表し、80〜300 nmの厚さの細胞断面(ラメラ)13、14、15 .クライオ・ウルトラミクロミクトミーとは対照的に、体積の0.3~3%を占める単一の細胞から1つのラメラのみが調製され、粉砕された断面の関心領域を見つけるためには、通常、複数の細胞の微量化が必要です。さらに、ワークフロー全体のスループットは現在でもかなり低く、8時間のクライオFIBMセッションから6〜8の高品質のラメラに制限されることがよくあります。一方、cryo-FIBMの断面には圧縮アーティファクトが欠け、高解像度のcryo-ETに適した入力を提供します。さらに、サンプルが全体のラメラ調製プロセスの間にTEMグリッドに保持され、同じグリッドがTEMに移すことができるので、cryo-ET用のサンプルキャリアへのラメラの転送は必要ありません。クライオFIBMのスループットは、主に教師なしラメラミリング16、17のソフトウェアの可用性と、より速い材料アブレーションを可能にする電荷カップルプラズマの原理で動作するFIBの利用から、すぐに大幅に改善されると予想しています。
サッカロミセス・セレビシエ (酵母)は、球状の真核細胞であり、直径は〜2〜5μmである。酵母は、その大きさ、アクセス性、遺伝学、生成時間、および単純な操作のおかげで、細菌学の原核生物としてよく研究されている 大腸菌と同様の細胞および分子生物学の研究で真核生物として広く研究されています。酵母は、懸濁液で容易に培養することができ、大量の細胞は短時間(倍加時間1〜2時間)で生成されます。さらに重要なことに、酵母は、非コードDNAの含有量が低い小さなゲノムを保持しながら、動物および植物細胞と複雑な内部細胞構造を共有しています。このようにして 、situデータにおける 高解像からの酵母プロテオームの構造的特徴付けは、文献で利用可能な機能データの広範な量に対する機械学的記述を提供するのに役立つ。
ここでは、サンプル培養からクライオFIBMラメラ製剤までの全ステップをカバーする酵母サンプル上の in situ cryo-ETデータの取得と、クライオETデータ取得のためのTEMへの検体転送のための包括的なプロトコルを提供します。
プロトコル
1. ガラス化のための サッカロミセス・セレビシエ細胞 の培養と調製
- サッカロミセス・セレビシエ用の液体成長培地を準備する。
- 成長培地の調製のための500 mLガラス瓶をオートクレーブ。
- 2.2gの酵母エキス(1.1%)と4.4gのペプトン(2.2%)を秤量し、200mLの水で混ぜます。
- 121°Cで15分間オートクレーブで殺菌する。
- 10gのグルコース粉末を秤量し、50mLの水で混ぜて20%のグルコース溶液を得る。0.2 μmのフィルターを通して溶液を渡し、4 °Cで保存します。
- サッカロミセスセレビシエのための固体培地を準備します。
- 寒天粉末の4gを量り、200mLの成長培地と混ぜます。
- オートクレーブで121°Cで15分間殺菌します。
- 培地を40〜50°Cに冷却し、20%無菌グルコース(前のステップで調製)の20 mLを加えます。ペトリ皿に完全な媒体の約20 mLを注ぎ、周囲温度で固めます。
- 乾燥から保護するためにパラフィルムで寒天プレートを包み、4°Cで保存します。
- 懸濁液の文化サッカロミセスセレビシエ
注:プロトコルは、細胞株 Sアカロマイセスセレビシエ 株BY4741[ATCC 4040002]または同様の株の懸濁液からのクライオFIBM用サンプルの調製のために最適化されています。- 50 mL のエルレンマイヤー (または類似の) フラスコをオートクレーブします。
- フードまたはラミナーフローボックスで作業します。ピペット10mLの増殖培地を無菌50mLのエルレンマイヤーフラスコにする。
- 20%のグルコースを濾過した1 mLで培地を補う。無菌、使い捨て接種ループ(1-10 μL)を有する寒天プレートから酵母のコロニーを1つ選びます。
- インキュベーターにエルレンマイヤーフラスコを入れ、30°Cで培養し、指数相(約7時間)に達するまで攪拌(150〜200rpm)を行います。
注:周囲温度で4週間培養された寒天プレートからコロニーを摘み取ると、指数相が〜15時間後に到達することが観察されました。以下の「注」も参照してください。
- グリセロールストックから寒天プレート上の文化 サッカロミセスセレビシエ 。
- 4°Cのストレージから新しい寒天プレートを使用してください。
- S.セレビシエのストックを-80°Cの深い冷凍庫から取り出し、ストックの完全な解凍を避けるために凍結スタンドに置きます。
- 滅菌接種ループ(1-10 μL)を用いた小さな培養物を50μLの成長培地に移します。適切に混ぜます。
- 混合 S.セレビシエ 培養の全容を移し、寒天板の表面に無菌の広がった棒で分散させる。
- 直径1.5~2mmのコロニーが形成されるまで約48時間、30°Cでインキュベートする。
注:実験の前にコロニーを新たに培養することをお勧めします。1週間を経過したコロニーは、指数成長期に到達するために液体培地での培養に長期間を要する。
- 寒天プレート 上の文化サッカロミセスセレビシエ 。
- 成長した S.セレビシエ コロニーで準備された寒天プレートを使用してください。
- ピペット10mLの無菌増殖培地と1mLの20%グルコースを50mLのエルレンマイヤーフラスコに濾過した。
- 無菌接種ループを有する S.セレビシエ 培養のコロニーを1つ選び、フラスコで成長培地と混合する。
- 30°Cで50分間、撹拌(150~200rpm)でインキュベートする。
- 懸濁液培養液を増殖培地で10回希釈し、無菌の広がった棒で寒天プレートに50μLの懸濁液を分散させます。
- 30°Cで約48時間、1.5〜2mmのコロニーが観察されるまでインキュベートする。
- ペトリ皿の端をパラフィルムで包み、乾燥を防ぎます。室温で保存し、最大4週間使用してください。
- 細胞クラスターでの急落凍結のために サッカロミセスセレビシエ を準備します。
- 懸濁液中のサッカロミセス・セレビシエの栽培(セクション1.3)のセクションのプロトコルに従ってS.セレビシエ細胞培養を調製し、30°Cで〜7時間を攪拌(150〜200rpm)でインキュベートする。
- UV/Vis分光光度計を用いて、600nmで のS.セレビシエ 細胞懸濁液培養液のODを測定する。
- 細胞懸濁液をOD600 = 1に濃縮する。
- 細胞単層で凍結する急落のために S.セレビシエ を準備します。
- S.セレビシエ細胞培養のセクションでのプロトコルに従ってセレビシエ細胞培養を調製し、攪拌(150〜200rpm)で30°Cで〜7時間をインキュベートする。
- UV/Vis分光光度計を用いて、600nmで のS.セレビシエ 細胞懸濁液培養液のODを測定する。
- 培地中の細胞を遠心管に移し、相対遠心力(900 x g)で2分間軽く回転させます。
- ピペット処理により細胞ペレットから培地を廃棄します。
- 新鮮な培地を細胞ペレットに加えます。30〜60 に等しいOD 600の細胞懸濁液を得るために媒体の体積を計算する。
- グリセロール(50%ストック溶液)を細胞懸濁液に加え、ガラス化の直前に5%の最終濃度にします。
注:グリセロールは、細胞間の領域内の氷の品質を向上させる保護剤として動作します。グリセロールは、細胞への取り込みが最小限に抑えるために、ガラス化の直前に細胞に添加されます。
2. サッカロミセス・セレビシエ標本のガラス化
- カーボンフィルム側を30-45 s(圧力:6-9 Pa、電流:7 mA)に向けてグロー放電TEMグリッド。
- ガラス化ロボットを次のパラメータに設定します:温度:18°C、湿度:100%、ブロット時間:6 s、待ち時間:5 s、ブロッティングサイクル:1x、ブロット力:5。
注: ブロットフォースは機器固有の値であり、最適なブロット力の値はマシンによって異なる場合があります。特定のプランジャの最適値は、実験的に確認する必要があります。 - ガラス化のために液体エタンを準備する。
- 非吸収性表面パッドを、サンプルに面したブロッティングパッドに取り付けます。他のブロッティングパッドにはフィルター用紙を使用します。
- ピンセットでグロー排出グリッドを選び、ピンセットをプランジ冷凍器具に取り付けます。
- プランジャ気候室内のグリッドのカーボン側に、3.5 μLの S.cerevisiae 懸濁液を塗布します。グリッド上のすべてのアプリケーションの前に適切に混合します。
- 液体エタンにグリッドを凍結します。
- 液体エタンからLN2にグリッドを転送します。ガラス化セルをLN2 の条件で保管するか、TEMグリッドカートリッジに取り付けてFIB-SEM顕微鏡にローディングします。
3. TEM グリッドをグリッドカートリッジに取り付ける
注: ここで説明するワークフローでは、SEM と TEM の顕微鏡間でのサンプル処理と転送を容易にするために、グリッド カートリッジに取り付けられた TEM グリッドを使用します。カートリッジ・アセンブリーは、C リング、TEM グリッド、および C クリップ・リングから構成されます。他の顕微鏡メーカーの計測を行う場合は、他のオプションを使用できます。グリッド・カートリッジ・アセンブリー・ワークステーションは、LN2で満たされます。LN2 レベルは TEM グリッドを備えたグリッド ボックスをカバーしますが、カートリッジへの TEM グリッドの取り付けは LN2 蒸気で行われます。ガラス化手順では、試料への呼吸による汚染を防ぐために、保護フェイスマスクまたはシールドを着用することを強くお勧めします。氷の汚染を蓄積したツールでは動作しません。
- グリッドカートリッジアセンブリワークステーションを一緒に入れ、クリッピング用のドライツールを準備します。
- LN2でアセンブリ ワークステーションを冷却します。切り取りツールを LN2 の温度まで冷却します。
- ガラス化サンプルを含むグリッドボックスをアセンブリワークステーションに配置します。
- Cリングに向けて細胞を持つ標本とTEMグリッドを配置し、Cクリップで固定します。
- 切り取ったカートリッジをグリッドボックスに入れ、適切に閉じます。
- LN2 デュワーにカートリッジを保管するか、FIB-SEM 顕微鏡にロードします。
4. FIB-SEM顕微鏡へのサンプルのロードと操作
注:指示はPP3010クライオFIB/SEM準備システムが装備されている二重ビーム顕微鏡Versa 3Dの使用のために書かれた。代替ソリューションでは、異なる特定のパラメータが必要な場合があります。ただし、ワークフローの一般的な概念は、まだ有効である必要があります。
- 顕微鏡を液体窒素温度まで冷やします。
- マイクロスコープチャンバーと準備室(存在する場合)を冷却開始前に高真空(<4 x10-4 Pa)にポンプで送り、汚染の成長を防ぎます。
- 準備室、顕微鏡ステージ、および顕微鏡用の5 L/minに窒素ガスの流れを設定します。すべてのコンポーネントが-180 °Cの温度<するまで待ちます。
注:この研究で使用されるFIB-SEM顕微鏡のセットアップは、その段階および除染剤を冷却するために冷却された窒素ガスを利用する。他のシステムは、ステージ冷却のために別の方法を使用することができます。チャンバー圧力は、ステージとアンチ汚染物質がここで使用される器具の-190°Cで一度〜3 x10-5 Paに達します。この研究で使用した実験設定を用いたラメラ表面上の炭化水素汚染層の成長率は、〜15nm/時間である。
- グリッドカートリッジを試料と一緒に顕微鏡に積み込みます。
- 積載ステーションをLN2 温度まで組み立てて冷却します。
- シャトル(サンプルホルダー)、試料付きのグリッドボックス、グリッドボックスオープナー、ピンセットを冷却されたローディングステーションに配置します。
- 試料を上に向けて慎重に送り込みます。
- 積み込みステーション内のシャトルをローディング位置に反転させます。
- 顕微鏡に負荷を入します。
- 必要に応じて、金属保護層で試料をコーティングします。
注:凍結水和された生物材料SEMをイメージングする際に、強い充電効果を観察することができます。さらに、(低電流でも)FIBを用いた生物学的サンプルのイメージングは、速いサンプル損傷を誘発する。したがって、試料の追加コーティングは、試料表面を保護するために、FIB-SEM顕微鏡の内部で行われる可能性があります。- ガス注入システム(GIS)によって有機金属白金で保護層を付着する。
- サンプルをユーセント高(電子とイオンでのイメージングの偶然点)に設定します。
- ステージを 45°まで傾けます(サンプルは電子ビームに対して 90° 傾けます)。
- z 軸のステージを、ユーセントリック高さより 4 mm 下に移動します。
- GIS針を26~30°Cに設定します。
- 有機金属白金層の約300〜1000nmを生物学的標本と共にグリッドに堆積する(GIS堆積物の30〜120 sに相当)。
注: 通常、セルの単層を持つサンプルには、小さなセルラー クラスターを持つサンプルに 30 s の GIS を適用します。
- スパッタは、導電性金属層で試料表面をコーティングします。
- 金属層(Ir、Au、Pt)の10nmを生体試料でグリッドに付着させる。
- ガス注入システム(GIS)によって有機金属白金で保護層を付着する。
- ラメラ調製のための設定顕微鏡のパラメーター
- FIBの場合、高電圧= 30kV、電流= 10 pA(イメージング)、10 pA-3 nA(FIB-ミリング)のパラメータを使用します。
- SEMの場合は、高電圧 = 2~5 kV、スポットサイズ = 4.5、電流 = 8~27 pAのパラメータを使用します。
- 両方のビームのスキャン回転を 180° に設定します。
- ステージの傾きを設定:フライディング角度6-11°(45°のプレチルトとFIB /SEM顕微鏡でサンプルシャトルのステージチルトに対応し、SEMとFIBカラムの間に52°の角度を持つ)。
5. サッカロミセス・セレビシエ・ラメラの調製
- グリッドの品質を確認し、 サッカロミセスセレビシエの適切なクラスターを選択します。
- TEM グリッドが、セル クラスタの周りまたはグリッドの裏側に水を追加せずに、両側から適切にブロットされていることを確認します。
注: グリッドの裏側を確認するには、ステージを -10 度回転させ、FIB でグリッドをイメージします。 - 次の推奨事項に従って、ラメラ調製に最適なセル クラスターを選択します。
- セルのクラスターをグリッド中央に配置します。切削領域は、グリッドの中心に位置する寸法1100 x 1100 μm(グリッド中心から各方向に550 μm)の正方形の外側に広がるべきではありません。
- グリッド バーに重なり合うグリッドの中央部にセル のクラスターを配置します。
- セルクラスターをグリッドスクエアに配置し、亀裂のないコンパクトな穴のあいたカーボンホイルを使用します。
- クラスターが氷の汚染に囲まれていないことを確認します。
- TEM グリッドが、セル クラスタの周りまたはグリッドの裏側に水を追加せずに、両側から適切にブロットされていることを確認します。
- サッカロミセス・セレビシエ単層で最適な粉砕位置を選択します。
- 選択したグリッド四角形のセルの単一レイヤーを囲むグリッド バーが表示されていることを確認します。
- 以下の推奨事項に従って、セルラー単層内の最適な位置を選択します。切削用に選択した領域は、次の基準を満たす必要があります。
- グリッドの中心に関心のある地域を持ちます。切削領域は、グリッド中心に配置された寸法1100 x 1100 μm(グリッドの中心から各方向に550 μm)の正方形の外側に広がるべきではありません。
- グリッド バーと重ならないグリッドの中央部分に関心のある領域を配置します。
- 細胞単層を氷の汚染で囲まないでください。
- クライオFIBで S.セレビシエ ラメラを準備します。
注: ミリング パターンは、対象領域を基準にして生成され、中央に配置されます。Cryo-FIBMは、異なるFIB設定で複数のミリングステップを実行して順次実行されます。厚さ約2μmのラメラは、最初は高電流(0.3~3 nA)を使用して粉砕されます。その後、ラメラは500nmに徐々に薄くなります。低電流(10-30 pA)での微細加工工程を使用して、ラメラを~100~200 nmの厚さに完成します。- 関心領域(ROI)をユーセント高に設定し、この位置を保存します。
注: 一致点は、各位置ごとに個別に決定および保存する必要があります。ユーセントリック高さは、ステージを 0°に傾け、ステージを x 方向と y 方向に移動して ROI を中心にして設定します。ステージは25°に傾き、ROIはステージ z軸位置を変更することによってスキャン領域の中心に戻されます。最後に、ステージは、粉砕のために13°-18°に傾いています。 - ROI の上に矩形のミリング パターンを定義し、スキャン方向を上から下にします。
- 下部から上部までのスキャン方向を使用して、ROI の下にある長方形のミリング パターンを定義します。
- 薄板厚の大まかな推定のために、対象領域をカバーする非アクティブな矩形の粉砕パターンを定義します。このパターンは、ラメラ調製中に粉砕されません。
- すべてのパターンをマークし、ラメラ幅(x 次元)を設定します。フライスパターンの幅は、クラスター幅の 2/3 を超えないようにしてください。これは、ほとんどの場合、8~15 μm に相当します。
- 粗いミリングステップのパラメータを設定する
- FIB電流: 0.3 –3.0 nA;最終ラメラ厚さ:1.5~2μm。FIBMエリアの幅:8-12 um;ステージチルト:13-17°;所要時間:8分;アクティブなミリングパターン:上下。
- FIB電流:0.3-1.0 nA;最終的なラメラの厚さ:1 μm;FIBMエリアの幅:7.5-11.5 μm;ステージチルト:13-17°;所要時間:8分;アクティブなミリングパターン:上下。
- FIB電流:100~300 pA;最終ラメラ厚さ:0.5 μm;FIBMエリアの幅:7.5-11.5 μm;ステージチルト:13-17°;所要時間:8分;アクティブなミリングパターン:上下。
- FIB電流:30-100 pA;最終ラメラ厚さ:0.3 μm;FIBMエリアの幅:7.5-11.5 μm;ステージチルト:13-17°;所要時間:8分;アクティブなミリングパターン:上下。
- 細かいミリングステップのパラメータを設定します。
- FIB電流:10-30 pA;最終的なラメラ厚さ:<0.2 um;FIBM領域の幅:7-11 μm;ステージチルト:13-17°(+1°);所要時間:12分。アクティブなミリングパターン:上部。
注: 粗いミリングステップ(5.3.6)は、各ラメラに対して順番に実行されます。対照的に、微細な製粉工程(5.3.7)は、ラフミリングに直接従いませんが、ラメラ表面の炭化水素汚染を最小限に抑えるために、セッション終了時にすべてのラメラに対して細かい粉砕ステップが順次行われます。余分な +1° ステージの傾斜は、その長さ全体のラメラ厚さの均一性を高めるために、細かい製粉工程中に使用されます。
- FIB電流:10-30 pA;最終的なラメラ厚さ:<0.2 um;FIBM領域の幅:7-11 μm;ステージチルト:13-17°(+1°);所要時間:12分。アクティブなミリングパターン:上部。
- 関心領域(ROI)をユーセント高に設定し、この位置を保存します。
6. サッカロミセス・セレビシエ・ ラメラのクライオ-TEMへの移送
- 適切に乾燥したデュワーを準備し、LN2でそれを埋める.
- 凍結条件下でFIB/SEM顕微鏡からラメラでサンプルをアンロードし、グリッドボックスに移し、LN2 ストレージデュワーに保管して長期保存します。または、グリッドを直接 cryo-TEM にロードします。
- クライオ-TEM ステージの傾き軸に対するラメラの正しい向きは重要です(詳細については、8:10 に付随するビデオを参照)。準備されたラメラのフライス方向がクライオ-TEMステージの傾き軸に垂直であることを確認します。
- クライオTEMステージを事前に傾けて、グリッド平面に対するラメラチルトを補正し、線量対称方式19を用いてチルトシリーズを収集する。
注: プリチルトの大きさ(通常は 6 ~8°)は、マイクロマシニング中の TEM グリッド平面と FIB 方向の間の角度によって決まります。クライオ-TEMのイメージのラメラの前縁の位置は、前傾きの角度の符号を決定するために使用することができる。そのためには、顕微鏡ステージ回転の感覚が知られなければならない。実験では、ナノプローブSAモードで撮影した画像の右側にあるラメラの前縁の位置が負の前傾に相当します。
結果
サッカロミセス・セレビシエ培養は、指数成長期の真ん中で収穫された。細胞がTEMグリッドの表面上に複数の細胞の小さなクラスターとして分布するか(図1A,C)、またはTEMグリッドの個々のグリッド四角形上に連続単層を形成した2種類の標本を調製した(図1B,D)。別個の細胞小島または細胞単層のいずれかを用いたサンプルの調製のための識別因子は、TEMグリッドに適用される細胞培養の濃度である。採取した細胞培養物を、前者の場合はOD600=1.0、後者の場合はOD600=30〜60にそれぞれ濃縮した。細胞単層の調製用試料は、ガラス化前に5%v/vグリセロールでさらに補充した。グリセロールは、結晶バッファーからの反射が適切な位置追跡およびクライオ-ET データ収集中の焦点を合わせ得るため、細胞間の空間を満たすバッファー溶液のガラス化に重要です(図 2) 。
また、酵母懸濁液培養液は、PTFEブロッティングパッドやFlexFill 98A材料からなるカスタム3Dプリントパッドなどの非吸収性材料に対してブロットした。ブロッティングペーパーは、サンプルアプリケーション(バックブロッティング)に対してグリッドの裏側にのみ配置されました。両側の濾紙でブロッティングすると、細胞がブロッティング紙に接着するので、懸濁液凍結の場合はバックブロッティング戦略が推奨されます(図1E)。
ここで説明するプロトコルは、グリッドカートリッジにクリップされたTEMグリッドを利用し、グリッドの安定したサポートを形成し、ガラス化後のサンプルの取り扱いを容易にします。これはFIB/SEMおよびTEM顕微鏡の他のサンプルホールダーおよびシャトルがそのような格子カートリッジを受け入れることができることを要求する。
サンプルをFIB/SEM顕微鏡に移した後、標本はまず、顕微鏡ガス注入システム(GIS)を用いて0.3~1.0μmのメチルシクロペンタジエニル白金層でコーティングされました。サンプル表面に無機イリジウムの追加層をスパッタリングしてGIS層を硬化させ、表面を導電性にします。このラメラを、(I)粉砕電流、(II)ラメラ幅、および(III)試料の上下のフライス領域の距離を段階的に減少させた複数のステップ(図3)で粉砕した。最終製粉工程(「研磨」)は、ラメラの上面から低電流(10-30pA)で、Ga+ビームに向かってさらに1°ずつ傾斜したサンプルで行った。記載されたプロトコルの利用は、平均して1つの6-8時間のセッション内の2つのTEMグリッド上で調製された8-10ラメを生じさせた。
ラメラを持つTEMグリッドは、その後、透過型電子顕微鏡に移された。ラメラは最初にスクリーニングされ、クライオETデータの取得には、最小限のカーテン(ラメラ表面を横切る不均一な粉砕に起因するアーティファクト)、低表面汚染レベル、良好な細胞コントラスト(通常は<200nm厚さのラメラに対して観察される)のみを示したもののみが選択されました。また、全長にわたる亀裂を含むラメラは、データ収集から廃棄された。一般に、TEMに転化したラメラの約50%は、データ取得に適していた。傾斜系列は、エネルギー選択スリットを20eVに設定したポストGIF K2直接電子検出器上で収集した。データ収集は、シリアルEMソフトウェア18で行われ、傾斜系列は、±60°の傾斜範囲と3°の増分を有する線量対称スキーム19を用いて収集した。データは、3.47 A/pxのピクセルサイズに対応する倍率で取得されました。65 e/Å2の全体的な線量は、個々のサブフレーム上に均一に分布した。傾斜画像は3つのフレームのセットとして収集され、その後MotionCor220プログラムを使用してデータ取得中の動きと放射線損傷を修正しました。コントラスト伝達関数のパラメータは、Ctffind421を用いて推定した。傾斜シリーズは、eTomo18で処理されました。パッチ追跡ルーチンは、画像を整列するために使用されました。トモグラムは、画像の2倍の後に重み付けされた逆投影アルゴリズムを使用して再構築し、その後、IMOD18でSIRT様フィルタ(8回の反復に設定)を使用してフィルタリングした。トモグラムセグメンテーションは、アミラソフトウェア22で手動で行った。再構築されたモグラムは、酵母細胞内部の高解像度表現を提供し、真空胞体やミトコンドリアなどの細胞小器官を高いレベルで観察したり、微小管などの高分子複合体、または内在性およびほぼネイティブの条件下で核毛穴複合体を研究することを可能にする(図4)。

図1:ガラス化S.セレビシエのFIBおよびSEM画像
TEMグリッド上にガラス化された小さな酵母クラスターのFIB(A)およびSEM(C)画像。FIB(B)およびSEM(D)の画像は、グリッド表面に連続した単層を形成する。サンプルは、イメージングの前にGISとイリジウム層でコーティングされました。パネルA-Bのスケールバーは10 μmに相当します。イーストサンプルはPTFEやFlexFill 98A(緑色)などの非吸収性材料に対して、かつグリッドの裏側(白、E)から配置されたブロッティングペーパーで発色されます。この図の大きなバージョンを表示するには、ここをクリックしてください。
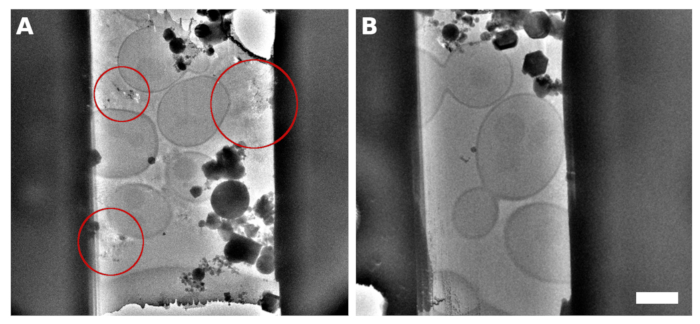
図2: セレビシエ ・ラメラ
グリッド表面上に連続した単層酵母を使用してサンプルから加工されたラメラマイクロのTEM画像。細胞間で観察された反射には、不適切にガラス化された媒体/バッファ(A、赤い円で強調表示)が含まれていました。酵母上に生成されたラメラのTEM画像は、培地/緩衝液(B)に5%グリセロールを添加して連続的な単層にガラス化した。スケールバーは2μmに相当します。 この図の大きなバージョンを表示するには、ここをクリックしてください。
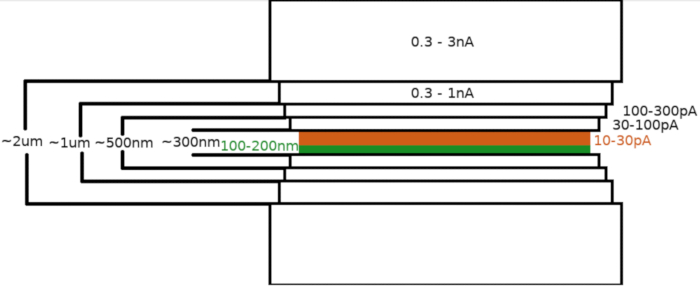
図 3: Cryo-FIBM ワークフロー
ラメラミリングプロセスの概略描写。最初の粗いミッシングステップは、仮のラメラ位置(緑色でハイライト表示)の両側からの高いFIB電流で行われますが、最終的な研磨ステップは上面と低いFIB電流(オレンジ色で強調表示され、6:33の付随ビデオを参照)からのみ実行されます。 この図の大きなバージョンを表示するには、ここをクリックしてください。
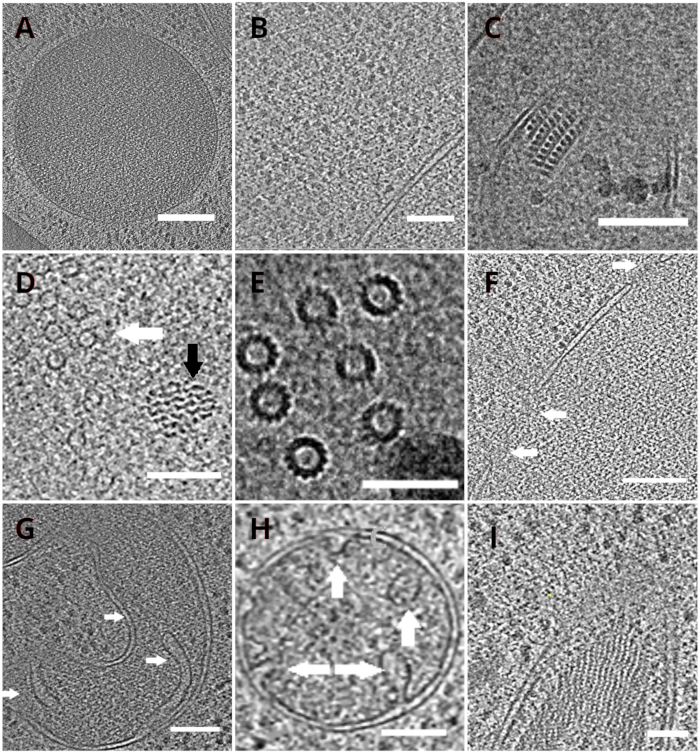
図4 クライオETが描く酵母小器官と高分子錯体
液胞(A、スケールバー:200nm)、リボソーム(B、リボソーム)を描いた再構築された断層のスライス スケールバー:200nm)、ペルオキシソーム(C、スケールバー:100nm)の副結晶性コア、未確認の線維構造(黒矢印 、D、スケールバー:100nm)の近接における微小管(白矢印)、複数の微小管の詳細(E、スケールバー:50nm)、矢印(F、F)で示される孔を有する核膜 スケールバー200nm)、ミトコンドリア(G、H、スケールバー:100nm、矢印は個々のクリスタ)を示し、未確認の糸状構造体の束(I、スケールバー:100nm)。パネル B、C、D、E、G は細胞の小さなクラスターから調製されたトモグラムのセクションを含む一方、細胞の単層から層状に集められたトモグラムのセクションは、パネル A、F、H、Iに示されている。 この図の大きなバージョンを表示するには、ここをクリックしてください。
ディスカッション
cryo-ET用の細胞サンプルの調製は、いくつかのハイエンド機器の利用を必要とする複雑なワークフローです。サンプルの品質は、プロトコル全体のスループットに影響を与える各準備ステップで損なわれる可能性があります。さらに、個々の機器間のサンプル転送の必要性は、サンプル汚染や逸脱のリスクを追加します。したがって、サンプル調製ワークフローにおける個々のステップの最適化は、ラメラ調製ワークフローのスループットと再現性を高めることが重要です。ここで提示されるプロトコルは、cryo-ETによるその場での高分子複合体の構造的特徴化のためのサッカロミセス・セレビシエの最適化された調製について述べている。
プロトコルは、主にTEMグリッド上の細胞の濃度が異なる2種類の酵母標本の調製を記述する。両方の酵母サンプルは、クライオETのための高品質のラメラを生み出し、標本タイプの選択は、特定の研究の目標に従って作ることができます。酵母は、第1の場合にグリッド表面にランダムに散らばった少数の細胞の単離クラスターを形成し、細胞の連続単層は第2のサンプルタイプのTEMグリッド表面に存在する。前者は、粉砕されなければならない材料の少量のおかげで速いラメラの準備のために適している。最終的なラメラはかなり短く、したがって、わずか2-4細胞の断面が含まれています。サンプル調製に適した領域は、グリッドの正方形を含むグリッド表面上にランダムに分布し、これは、ラメラ調製ワークフローの自動化を部分的に制限する可能性があります。標本の後者のタイプは、全体的な製粉時間を保持するために、最初の製粉段階の間に大きな電流の利用を必要とする。さらに、このタイプのサンプルは、不均一なミリング(カーテン)に起因するアーティファクトが発生しやすくなります。したがって、GISは、小さな細胞クラスターを持つサンプルの場合よりも50%長い期間、サンプル表面にスパッタリングされ、より厚い保護層を形成する。次に、サンプルを Iridium (代わりにプラチナまたはゴールド) のレイヤーでスパッタリングして GIS レイヤーを硬化させ、より硬くし、サンプルサーフェスの伝導率を高めます。ラメラの各側に追加領域のFIBM(ラメラ縁から〜2〜5μm)の粗いラメラミリングの最初のステップの間に、最終的な断面23の緊張低下に起因する最も破損したラメラの数を減少させることが有益であると判明した。最終的なラメラは長く、10個の細胞の断面が含まれており、cryo-ETに適した領域の数が増えます。細胞間の培地または緩衝液の不適切なガラス化は、バッファー溶液に凍結保護剤を添加することによって容易に減衰することができる(この研究で使用されるグリセロール5%)。正方形のほとんどは、ラメラ調製に適しているので、連続単層に組織された細胞を有するサンプルは、教師なしラメラ製剤に適している。
ラメラ調製ワークフローにおけるもう一つの重要な側面は、透過型電子顕微鏡への移動と、ラメラを顕微鏡ステージの傾き軸に適切に配置することです。最適には、ラメラの主軸は、画像領域の高さで追跡と焦点を与え、ラメラエッジが高い傾斜角で視野を遮るのを防ぐ顕微鏡の傾き軸に垂直です。線量対称方式を用いてcryo-ETデータを収集する場合、18サンプルは、グリッド面に対するラメラの傾きを補償するために、最初に顕微鏡で回転させるべきです。
開示事項
著者らは開示するものは何もない。
謝辞
この研究は、欧州委員会のHorizon 2020プログラムが資金を提供する「指示ウルトラ(グラント731005)」、iNEXT-discovery(グラント・871037)、CIISB研究インフラ、指示ERICセンター(LM2018127)を支援しました。我々は、サーモフィッシャーサイエンティフィックブルノから得られた支援を認める。
資料
| Name | Company | Catalog Number | Comments |
| Agar | Himedia | MB053 | |
| Glucose | PENTA | 12020-31000 | |
| Glycerol | Merck | G5516-1L | |
| ethane | Messer | 1007 | |
| LN2 | Lineq | LN2-1L | |
| Peptone | Merck | P5905-1KG | |
| Saccharomyces cerevisiae | ATCC | 201388 | strain BY4741 |
| Tweezers | Dumont | T539 | |
| Yeast extract | Duchefa Biochemie | Y1333.1000 | |
| Disposable | |||
| Blotting papers | Ted Pella | 47000-10 | |
| C-clip | ThermoScientific | 9432 909 97551 | |
| C-clip ring | ThermoScientific | 9432 909 97561 | |
| Spreading sticks | Merck | Z376779-1PAK | |
| Sterile inoculation loops | BRAND | BR452201-1000EA | |
| Sterile plastic Petri dishes | Sigma | SIAL0166 | |
| TEM grids | Quantifoil | 4420G-XA | |
| Equipment | |||
| Autoclave | Systec | 101291545 | |
| balances | BEL | M124A | |
| Cryo-FIB/SEM microscope | ThermoScientific | 1006123 | |
| Cryo-TEM microscope | ThermoScientific | 9432 057 03301 | |
| Laminar flow box | Telstar | AH5 | |
| Plasma cleaner | Gatan | 955.82001 | |
| Shaking incubator | New Brunswick | M1282-0002 | |
| UV/VIS spectrophotometer | WPA | S800 | |
| Vitrification robot | ThermoScientific | 9432 053 50621 |
参考文献
- McMullan, G., Faruqi, A., Clare, D., Henderson, R. Comparison of optimal performance at 300keV of three direct electron detectors for use in low dose electron microscopy. Ultramicroscopy. 147, 156-163 (2014).
- Zivanov, J., et al. New tools for automated high-resolution cryo-EM structure determination in RELION-3. eLife. 7, (2018).
- Dubochet, J., McDowall, A. W. Vitrification of pure water for electron microscopy. Journal of Microscopy. 124, 3-4 (1981).
- Villa, E., Schaffer, M., Plitzko, J. M., Baumeister, W. Opening windows into the cell: focused-ion-beam milling for cryo-electron tomography. Current Opinion in Structural Biology. 23, 771-777 (2013).
- Mahamid, J., et al. Visualizing the molecular sociology at the HeLa cell nuclear periphery. Science. 351 (6276), 969-972 (2016).
- Schur, F. K. Toward high-resolution in situ structural biology with cryo-electron tomography and subtomogram averaging. Current Opinion in Structural Biology. 58, 1-9 (2019).
- O'Reilly, F. J., et al. In-cell architecture of an actively transcribing-translating expressome. Science. 369, 554-557 (2020).
- Rice, W. J., et al. Routine determination of ice thickness for cryo-EM grids. Journal of Structural Biology. 204, 38-44 (2018).
- Al-Amoudi, A., Norlen, L. P. O., Dubochet, J. Cryo-electron microscopy of vitreous sections of native biological cells and tissues. Journal of Structural Biology. 148, 131-135 (2004).
- Al-Amoudi, A., Studer, D., Dubochet, J. Cutting artefacts and cutting process in vitreous sections for cryo-electron microscopy. Journal of Structural Biology. 150, 109-121 (2005).
- Pierson, J., et al. Improving the technique of vitreous cryo-sectioning for cryo-electron tomography: electrostatic charging for section attachment and implementation of an anti-contamination glove box. Journal of Structural Biology. 169, 219-225 (2010).
- Dubochet, J., et al. How to "read" a vitreous section. Methods in Cell Biology. 79, 385-406 (2007).
- Rigort, A., et al. Focused ion beam micromachining of eukaryotic cells for cryoelectron tomography. Proceedings of the National Academy of Sciences. 109, 4449-4454 (2012).
- Schaffer, M., et al. Cryo-focused Ion Beam Sample Preparation for Imaging Vitreous Cells by Cryo-electron Tomography. Bio-protocol. 5, (2015).
- Wagner, F. R., et al. Preparing samples from whole cells using focused-ion-beam milling for cryo-electron tomography. Nature Protocols. 15 (6), 2041-2070 (2020).
- Buckley, G., et al. Automated cryo-lamella preparation for high-throughput in-situ structural Biology. Journal of Structural Biology. 210 (2), 107488(2020).
- Zachs, T., et al. Fully automated, sequential focused ion beam milling for cryo-eletron tomography. eLife. e52286, (2020).
- Mastronarde, D. N. Automated electron microscope tomography using robust prediction of specimen movements. Journal of Structural Biology. 152, 36-51 (2005).
- Hagen, W. J., Wan, W., Briggs, J. A. Implementation of a cryo-electron tomography tilt-scheme optimized for high resolution subtomogram averaging. Journal of Structural Biology. 197, 191-198 (2017).
- Zheng, S. Q., et al. MotionCor2: anisotropic correction of beam-induced motion for improved cryo-electron microscopy. Nature Methods. 14, 331-332 (2017).
- Rohou, A., Grigorieff, N. CTFFIND4: Fast and accurate defocus estimation from electron micrographs. Journal of Structural Biology. 192, 216-221 (2015).
- Stalling, D., Westerhoff, M., Hege, H. -C. Amira: A highly interactive system for visual data analysis. The Visualization Handbook. , 749-767 (2005).
- Wolff, G., et al. Mind the gap: Micro-expansion joints drastically decrease the bending of FIB-milled cryo-lamellae. Journal of Structural Biology. 208, 107389(2019).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved