Method Article
استكشاف m6A و m5C Epitranscriptomes على العدوى الفيروسية: مثال مع فيروس نقص المناعة البشرية
In This Article
Summary
دور تعديلات الحمض النووي الريبي في العدوى الفيروسية بدأت للتو لاستكشاف ويمكن تسليط الضوء على آليات جديدة للتفاعل الفيروسي المضيف. في هذا العمل، ونحن نقدم خط أنابيب للتحقيق في M6A و M5C التعديلات الحمض النووي الريبي في سياق العدوى الفيروسية.
Abstract
كان دور تعديلات الحمض النووي الريبي في العمليات البيولوجية محور عدد متزايد من الدراسات في السنوات القليلة الماضية ويعرف في الوقت الحاضر باسم epitranscriptomics. من بين أمور أخرى، تم وصف N6-ميثيلادينوسين (m6A) و 5-ميثيلسيتوسين (m5C) تعديلات الحمض النووي الريبي على جزيئات مرنا، وربما يكون لها دور في تحوير العمليات الخلوية. وبالتالي فإن Epitranscriptomics هو طبقة جديدة من التنظيم التي يجب النظر فيها بالإضافة إلى التحليلات النسخية ، حيث يمكن أيضا تغييرها أو تعديلها عن طريق التعرض لأي عامل كيميائي أو بيولوجي ، بما في ذلك العدوى الفيروسية.
هنا، نقدم سير عمل يسمح بتحليل المشهد الخلوي والفيروسية المشتركة epitranscriptomic من علامات M6A و m5C في وقت واحد، في الخلايا المصابة أو غير المصابة بفيروس نقص المناعة البشرية (HIV). عند عزل الحمض النووي الريبي وتجزؤه من الخلايا المصابة بفيروس نقص المناعة البشرية وغير المصابة، استخدمنا إجراءين مختلفين: MeRIP-Seq، وهي تقنية تعتمد على المناعة الحمض النووي الريبي، لإثراء شظايا الحمض النووي الريبي التي تحتوي على علامة M6A وBS-Seq، وهي تقنية تعتمد على تحويل البيسلفيت، لتحديد علامة m5C بدقة نوكليوتيد واحدة. عند التقاط الميثيل الخاصة، يتم إعداد مكتبات الحمض النووي الريبي لتسلسل الإنتاجية العالية. كما قمنا بتطوير خط أنابيب المعلوماتية الحيوية مخصص لتحديد النصوص الميثيلية التفاضلية (DM) بشكل مستقل عن ملف التعبير القاعدي الخاص بهم.
وعموما، تسمح المنهجية باستكشاف علامات epitranscriptomic متعددة في وقت واحد وتوفر أطلسا لنصوص DM عند العدوى الفيروسية أو أي اضطراب آخر في الخلايا. ويوفر هذا النهج فرصا جديدة لتحديد اللاعبين الجدد والآليات الجديدة للاستجابة للخلايا، مثل العوامل الخلوية التي تعزز أو تقيد تكرار الفيروس.
Introduction
ومن المعروف منذ فترة طويلة أنه يمكن تعديل جزيئات الحمض النووي الريبي، وقد تم وصف أكثر من 150 تعديلا بعد النسخ حتى الآن1. وهي تتكون في إضافة مجموعات كيميائية، وأساسا مجموعات الميثيل، إلى أي موقف تقريبا من حلقات البيريميدين والبوريين من جزيئات الحمض النووي الريبي2. وقد ثبت بالفعل أن مثل هذه التعديلات بعد النسخ غنية للغاية في نقل الحمض النووي الريبي (tRNA) والحمض النووي الريبي الريبوسومي (rRNA) وقد وصفت مؤخرا على جزيئات مرنا كذلك.
وقد أتاح ظهور تكنولوجيات جديدة، مثل تسلسل الجيل التالي، وإنتاج أجسام مضادة محددة تعترف بتعديلات كيميائية محددة، لأول مرة، التحقيق في الموقع وتواتر التعديلات الكيميائية المحددة على مستوى النص. وقد أدت هذه التطورات إلى فهم أفضل لتعديلات الحمض النووي الريبي ورسم خرائط لعدة تعديلات على جزيئات الحمض النووي الريبي3،4.
في حين أن علم الوراثة اللاجينية يحقق في دور تعديلات الحمض النووي والهستون في تنظيم النسخ ، يركز epitranscriptomics بطريقة مماثلة على تعديلات الحمض النووي الريبي ودورها. ويتيح التحقيق في التعديلات epitranscriptomic فرصا جديدة لتسليط الضوء على آليات جديدة للتنظيم قد تصل قيمتها إلى مجموعة متنوعة من العمليات الخلوية (أي الربط بين الحمض النووي الريبي والتصدير والاستقرار والترجمة)5. وبالتالي لم يكن من المستغرب أن الدراسات الحديثة كشفت عن العديد من التعديلات epitranscriptomic على العدوى الفيروسية في كل من RNAs6 الخلوية والفيروسية. وتشمل الفيروسات التي تم التحقيق فيها حتى الآن كلا من فيروسات الحمض النووي والحمض النووي الريبي؛ وفيروسات الحمض النووي ومن بين هذه الجهات، يمكن اعتبار فيروس نقص المناعة البشرية مثالا رائدا. وإجمالا، فإن اكتشاف ميثيل الحمض النووي الريبي في سياق العدوى الفيروسية قد يسمح بالتحقيق في آليات غير موصوفة بعد للتعبير الفيروسي أو التكرار الفيروسي، مما يوفر أدوات وأهدافا جديدة للسيطرة عليها7.
وفي مجال علم الفيروس، تم على نطاق واسع إجراء تحقيقات في تعديلات النصوص الفيروسية وأظهرت أن وجود هذا التعديل كان مفيدا للنسخ الفيروسي المتماثل8,9,10,11,12,13. حتى الآن يمكن استخدام تقنيات مختلفة للكشف عن علامات epitranscriptomic على مستوى النسخ على نطاق واسع. تعتمد التقنيات الأكثر استخداما لتحديد M6A على تقنيات هطول الأمطار المناعية مثل MeRIP-Seq و miCLIP. في حين تعتمد MeRIP-Seq على تجزئة الحمض النووي الريبي لالتقاط الشظايا التي تحتوي على بقايا ميثيليتات ، يستند miCLIP على توليد طفرات توقيع محددة للأجسام المضادة α-m6A على ربط الأشعة فوق البنفسجية بالأجسام المضادة للجيش الملكي النيبالي ، مما يسمح برسم خرائط أكثر دقة.
يمكن تحقيق الكشف عن تعديل M5C إما عن طريق تقنيات تعتمد على الأجسام المضادة مماثلة للكشف عن m6A (m5C RIP) ، أو عن طريق تحويل بيسوليت أو بواسطة AZA-IP أو بواسطة miCLIP. يستخدم كل من Aza-IP و m5C miCLIP ميثيل ترانسفيراز محدد كطعم لاستهداف الحمض النووي الريبي أثناء المرور بالمثيلة الحمض النووي الريبي. في Aza-IP ، تتعرض الخلايا المستهدفة إلى 5-azacytidine ، مما يؤدي إلى إدخال عشوائي لمواقع cytidine التناظرية 5-azacytidine في الحمض النووي الريبي الوليد. في miCLIP، يتم تعديل ميثيل ترانسفيراز NSun2 وراثيا لإيواء طفرة C271A14،15.
في هذا العمل، نركز على التوصيف المزدوج لتعديلات m6A و m5C في الخلايا المصابة، باستخدام فيروس نقص المناعة البشرية كنموذج. عند التحسين المنهجي ، قمنا بتطوير سير عمل يجمع بين السهد المناعي الحمض النووي الريبي الميثيلي (MeRIP) وتحويل بيسوليت الحمض النووي الريبي (BS) ، مما يسمح بالاستكشاف المتزامن للعلامات epitranscriptomic m6A و m5C على مستوى النص على مستوى واسع ، في السياقين الخلوي والفيروسية. يمكن تنفيذ سير العمل هذا على مستخلصات الحمض النووي الريبي الخلوي وكذلك على الحمض النووي الريبي المعزول عن الجسيمات الفيروسية.
إن نهج إعادة التأهيل المناعي الحمض النووي الريبي الميثيلي (MeRIP)16 الذي يسمح بالتحقيق في m6A على مستوى النسخ على مستوى النسخ راسخ ومجموعة من الأجسام المضادة الخاصة ب m6A متاحة تجاريا حتى الآن17. وتتكون هذه الطريقة من التقاط انتقائي لقطع الحمض النووي الريبي المحتوية على M6A باستخدام الأجسام المضادة الخاصة ب m6A. وعيبان رئيسيان لهذه التقنية هما:1) الدقة المحدودة، التي تعتمد اعتمادا كبيرا على حجم شظايا الحمض النووي الريبي، وبالتالي توفر موقعا ومنطقة تقريبيتين تحتويان على بقايا الميثيل، و'2' الكمية الكبيرة من المواد اللازمة لإجراء التحليل. في البروتوكول الأمثل التالي، قمنا بتوحيد حجم الجزء إلى حوالي 150 nt وخفضنا كمية المواد الأولية من 10 ميكروغرام من الحمض النووي الريبي متعدد الاختر، وهو حاليا المبلغ الموصى به من مواد البداية، إلى 1 ميكروغرام فقط من الحمض النووي الريبي متعدد الاختر. كما قمنا بتعظيم كفاءة استرداد شظايا الحمض النووي الريبي m6A المرتبطة بأجسام مضادة محددة باستخدام elution من خلال نهج المنافسة مع الببتيد m6A بدلا من طرق elution أكثر تقليدية وأقل تحديدا باستخدام تقنيات القائمة على الفينول أو البروتين K. ومع ذلك، يبقى القيد الرئيسي لهذا المقايسة المستندة إلى RIP هو الدقة دون المستوى الأمثل التي لا تسمح بتحديد النيوكليوتيدات A المعدلة بدقة.
يمكن حاليا إجراء تحليل لعلامة m5C باستخدام نهجين مختلفين: طريقة تستند إلى RIP مع أجسام مضادة خاصة ب m5C وتحويل بيسوليت الحمض النووي الريبي. وبما أن RIP لا يقدم سوى دقة محدودة بشأن تحديد بقايا الميثيل، استخدمنا تحويل البيسلفيت الذي يمكن أن يوفر دقة واحدة للنيوكليوتيدات. التعرض الحمض النووي الريبي إلى بيسلفيت (BS) يؤدي إلى إزالة السمية السيتوزين، وبالتالي تحويل بقايا السيتوزين إلى uracil. وهكذا، خلال تفاعل تحويل بيسوليت الحمض النووي الريبي، يتم إزالة السمية من كل سيتوسين غير ميثيلي وتحويله إلى أوراكيل، في حين أن وجود مجموعة الميثيل في الموضع 5 من السيتوزين له تأثير وقائي، مما يمنع التخلص من السمية الناجمة عن BS والحفاظ على بقايا السيتوستين. ويتيح النهج القائم على نظام BS الكشف عن النيوكليوتيدات المعدلة M5C بدقة قاعدة واحدة وتقييم تردد الميثيل لكل نسخة، مما يوفر رؤى حول ديناميات تعديل M5C18. ومع ذلك، يعتمد القيد الرئيسي لهذه التقنية على المعدل الإيجابي الزائف للمخلفات الميثيلية. في الواقع ، تحويل BS فعال على الحمض النووي الريبي أحادية تقطعت بهم السبل مع بقايا C يمكن الوصول إليها. ومع ذلك، فإن وجود هيكل ثانوي ضيق للجيش الملكي النيبالي يمكن أن يخفي موضع N5C ويعوق تحويل BS، مما يؤدي إلى بقايا C غير الميثيلية التي لا يتم تحويلها إلى بقايا U، وبالتالي إيجابيات كاذبة. للتحايل على هذه المشكلة وتقليل معدل إيجابي كاذبة، طبقنا 3 جولات من دورات تحويل التشبع والبيسلفيت19. كما قدمنا عنصري تحكم في العينات لتمكين تقدير كفاءة تحويل البيسلفيت: نحن نطبق ضوابط تسلسل ERCC (تسلسلات قياسية وغير مثيلة ومتاحة تجاريا)20 بالإضافة إلى RNAs متعددة الاستنفاد لتقييم معدل تحويل البيسوليت من ناحية، وللتحقق من وجود موقع ميثيليت معروف ومحفظ جيدا، C4447، على 28S الحمض النووي الريبي ريبوسومال من ناحية أخرى21.
في مجال علم الفيروسات، اقتران هاتين الطريقتين التحقيق epitranscriptomic مع تسلسل الجيل القادم وتحليل المعلوماتية الحيوية دقيقة يسمح لدراسة متعمقة من ديناميات M6A و M5C (أي، التغيرات الزمنية تعديل الحمض النووي الريبي التي يمكن أن تحدث عند العدوى الفيروسية ويمكن أن تكشف عن مجموعة من الأهداف العلاجية ذات الصلة الجديدة للاستخدام السريري).
Protocol
1. إعداد الخلية
ملاحظة: اعتمادا على نوع الخلية ومحتوى RNA الخاص به، يمكن أن يختلف عدد الخلايا التي تبدأ.
- لديك ما يكفي من الخلايا للحصول على ما بين 200-500 ميكروغرام من إجمالي الحمض النووي الريبي أو 5-7 ميكروغرام من الحمض النووي الريبي متعدد الاختر. على سبيل المثال، 50 × 106 خلايا SupT1 يجب أن تسفر عن حوالي 500 ميكروغرام من إجمالي الحمض النووي الريبي عند استخراجها مع الكواشف القائمة على الفينول، وبالتالي مطلوب لكل حالة على حدة اختبارها.
- إعداد العدد المطلوب من الخلايا وفقا للتصميم التجريبي، وبالتالي وفقا لعدد الحالات التي تم اختبارها (العدوى، النقاط الزمنية، العلاج). وإذا كانت التجربة تهدف إلى الحصول على خلايا غير مصابة وخلايا مصابة بفيروس نقص المناعة البشرية عند 24 ساعة بعد العدوى، فإن هناك حاجة إلى ما مجموعه 100 × 106 خلايا، نصفها للحالة غير المصابة والنصف الآخر للحالة المصابة.
2. استخراج الحمض النووي الريبي
- من الخلايا: استخراج الحمض النووي الريبي مع الفينول-الكلوروفورم
- لكل حالة، جمع الخلايا (على سبيل المثال، 50 × 106) عن طريق الطرد المركزي والتخلص من supernatant.
- إضافة 5 مل من كاشف القائم على الفينول إلى كل 50 × 106 بيليه الخلية ومزيج عن طريق pipetting صعودا وهبوطا عدة مرات.
- احتضان لمدة 5 دقائق في درجة حرارة الغرفة للسماح تحلل كامل. يمكن تخزين الخلايا المهوسة عند -80 درجة مئوية أو معالجتها مباشرة.
ملاحظة: إذا لزم الأمر، يمكن أيضا تقسيم الخلايا في aliquots من 10 × 106 خلايا لكل أنبوب في أنابيب 1.5 مل وlysed في 1 مل من كاشف القائم على الفينول لتخزين أكثر ملاءمة. - إضافة 1 مل من الكلوروفورم ومزيج عن طريق الانعكاس.
- حضانة لمدة 3 دقائق في درجة حرارة الغرفة.
- جهاز طرد مركزي لمدة 15 دقيقة عند 2000 × ز و 4 درجات مئوية.
- ماصة خارج المرحلة المائية (المرحلة العليا) ونقلها إلى أنبوب جديد. الانتهاء من نقل المرحلة المائية عن طريق الصيد الأنبوب في 45 درجة وpipetting بعناية الحل.
ملاحظة: قد تختلف كمية المرحلة المائية بين العينات ولكن ينبغي أن تكون قريبة من كمية الكلوروفورم المضافة إلى العينة (أي 1 مل). لا نقل أي طبقة بين المراحل أو العضوية! ويمكن أن يسهل استخدام أنابيب الطور أو صانع المرحلة هذه العملية. - إضافة 0.5 مل من 100٪ الصف الجزيئي isopropanol إلى المرحلة المائية.
- حضانة لمدة 1 ساعة في -80 درجة مئوية للسماح إرنا هطول الأمطار.
- الطرد المركزي لمدة 10 دقائق في 12000 س ز و 4 درجة مئوية لبيليه الجيش الملكي النيبالي عجلت.
- تجاهل supernatant وإعادة إنفاق بيليه الحمض النووي الريبي في 1 مل من 75٪ البيولوجيا الجزيئية الصف الإيثانول. دوامة لفترة وجيزة.
- جهاز الطرد المركزي لمدة 5 دقائق في 7500 × ز و 4 درجة مئوية والتخلص من supernatant.
- الهواء الجاف بيليه لمدة 15 دقيقة.
- Resuspend بيليه في 20 ميكرولتر من المياه الخالية من RNase ونقلها إلى أنبوب جديد.
- اغسل الأنبوب الفارغ مع 20 ميكرولتر إضافية من الماء لزيادة استرداد الحمض النووي الريبي إلى أقصى حد، وتجمع مع أول 20 ميكرولتر من الحجم.
- قياس إجمالي الحمض النووي الريبي مع مطياف وتقييم جودة الحمض النووي الريبي مع محلل شظايا.
- من الجسيمات الفيروسية: استخراج الحمض النووي الريبي مع العمود القائم على مجموعة استخراج الحمض النووي الريبي الفيروسية
ملاحظة: استخراج الحمض النووي الريبي من الجسيمات الفيروسية مع كاشف القائم على الفينول النتائج في الحمض النووي الريبي الفيروسية منخفضة الجودة وفي مكتبات ذات جودة أقل. وبالتالي ينبغي تفضيل استخراج الحمض النووي الريبي القائم على العمود. RNA استخراج مجموعات باستخدام الحمض النووي الريبي الناقل لرنا elution والانتعاش ليست مناسبة لهذا الإجراء، وينبغي تجنبها. وبما أن الحمض النووي الريبي لفيروس نقص المناعة البشرية متعدد الخلايا، فإن استخراج الحمض النووي الريبي المباشر دون مزيد من العزلة من الحمض النووي الريبي يكفي لدخول خط أنابيب MeRIP-Seq وBS-Seq. عادة 1-2 مل من الخلايا الفيروسية الفائقة من الخلايا المصابة عالميا ينبغي أن توفر ما يكفي من الحمض النووي الريبي لأداء سير العمل بأكمله.- إعداد المخزن المؤقت بإضافة 150 ميكرولتر من بيتا ميركابتوثانول إلى 30 مل من العازلة تحلل. إعادة تشكيل المخزن المؤقت للغسيل الفيروسي بإضافة 96 مل من الإيثانول بنسبة 100٪.
- جمع المضادات المحتوية على الفيروسات والطرد المركزي لحطام خلايا بيليه لتقليل التلوث الخلوي الحمض النووي الريبي.
- نقل 1 مل من الناسخ الفيروسي إلى أنبوب 15 مل.
- إضافة 3 مل من الفيروسية الجيش الملكي النيبالي العازلة إلى 1 مل من عينة الفيروسية ومزيج من دوامة.
- نقل 700 ميكرولتر من العينة في عمود، إدراجها في أنبوب جمع.
- جهاز طرد مركزي لمدة دقيقتين عند 13,000 × غرام في درجة حرارة الغرفة.
- تجاهل توسط التدفق.
- كرر الخطوات السابقة 3 حتى تتم معالجة العينة بأكملها، وبالتالي تم القبض على جميع الجيش الملكي النيبالي على عمود مصفوفة السيليكا القائمة.
- إضافة 500 ميكرولتر من الفيروسية غسل المخزن المؤقت إلى العمود.
- جهاز طرد مركزي لمدة دقيقة واحدة عند 10,000 × غرام في درجة حرارة الغرفة. تجاهل توسط التدفق.
- إضافة 200 ميكرولتر من الفيروسية غسل المخزن المؤقت إلى العمود.
- جهاز طرد مركزي لمدة دقيقة واحدة عند 10,000 × غرام في درجة حرارة الغرفة. تجاهل توسط التدفق.
- ضع العمود في أنبوب تجميع فارغ.
- جهاز طرد مركزي لمدة دقيقة واحدة عند 10,000 × غرام في درجة حرارة الغرفة لمواصلة التخلص من أي ملوث عازل للغسيل المتبقي.
- نقل العمود بعناية إلى أنبوب 1.5 مل.
- أضف 20 ميكرولتر من المياه الخالية من DNase/RNase مباشرة إلى مركز مصفوفة العمود والطرد المركزي عند 10,000 × غرام لمدة 30 ثانية في درجة حرارة الغرفة.
- إضافة إضافية 10 ميكرولتر من المياه الخالية من DNase/ RNase مباشرة إلى وسط مصفوفة العمود والطرد المركزي مرة أخرى لمدة 30 ثانية.
- قياس إجمالي الحمض النووي الريبي مع مطياف وتقييم جودة الحمض النووي الريبي مع محلل شظايا.
ملاحظة: يمكن تنفيذ استخراج الحمض النووي الريبي مع أي طريقة، إذا كانت نوعية الحمض النووي الريبي المستردة عالية، مع سلامة الجيش الملكي النيبالي / عدد الجودة > 9. يمكن تخزين إجمالي الحمض النووي الريبي عند -80 درجة مئوية حتى يتم إجراء المزيد من المعالجة.
3. MRNA العزلة عن طريق اختيار بولي-A مع أوليغو (dT)25
ملاحظة: نظرا لوجود الحمض النووي الريبي ريبوسومال الميثيلي للغاية في المستخلصات الخلوية، فمن المستحسن جدا لعزل الحمض النووي الريبي متعدد الأضلاع إما عن طريق استنفاد rRNA أو بشكل تفضيلي عن طريق اختيار إيجابي متعدد-A. هذه الخطوة اختيارية وينبغي أن يتم ذلك لعينات الحمض النووي الريبي الخلوية فقط، للحصول على نتائج التسلسل بدقة أعلى. إذا كان تحليل ميثيل الحمض النووي الريبي الفيروسي غير متعدد الغدد ، يفضل استنفاد الحمض النووي الريبي بدلا من اختيار البولي أ أو في نهاية المطاف إجراء التحليل على إجمالي الحمض النووي الريبي.
-
إعداد حبة لالتقاط بولي-A
- Resuspend أوليغو (dT)25 قارورة مخزون الخرز المغناطيسي عن طريق الدوامة ل30 > s.
- نقل 200 ميكرولتر من الخرز المغناطيسي إلى أنبوب 1.5 مل. إعداد عدد الأنابيب مع الخرز المغناطيسي وفقا للكمية الإجمالية لعينات الحمض النووي الريبي التي سيتم معالجتها.
ملاحظة: أنبوب واحد مع 200 ميكرولتر من محلول مخزون دينابيد يتوافق مع 1 ملغ من الخرز ويمكن أن تستوعب عينة من 75 ميكروغرام من إجمالي الحمض النووي الريبي. - ضع الأنابيب على مغناطيس لمدة دقيقة واحدة وتجاهل الفائقة. إزالة الأنابيب من المغناطيس.
- إضافة 1 مل من "المخزن المؤقت الربط" (20 mM تريس-HCl، pH 7.5، 1.0 M LiCl، 2 mM EDTA)، وإعادة الإنفاق بواسطة الدوامة. ضع الأنابيب على المغناطيس لمدة دقيقة واحدة وتجاهل supernatant. إزالة الأنابيب من المغناطيس. كرر.
- Resuspend الخرز المغناطيسي غسلها في 100 ميكرولتر من العازلة ملزمة.
-
إعداد إجمالي الحمض النووي الريبي
- تمييع إجمالي الحمض النووي الريبي بتركيز نهائي قدره 0.75 ميكروغرام/ميكرولتر مع مياه خالية من الرناسي، وهو ما يعادل 75 ميكروغرام/100 ميكرولتر.
ملاحظة: إذا كان الحمض النووي الريبي بتركيز أقل، فانتقل كما هو موضح أدناه دون تعديل وحدات التخزين. - Aliquot مجموع الحمض النووي الريبي في أنابيب متعددة عن طريق الاستغناء عن 100 ميكرولتر من عينة الحمض النووي الريبي لكل أنبوب.
- إضافة 100 ميكرولتر من المخزن المؤقت الربط إلى كل عينة RNA.
- سخني إجمالي الحمض النووي الريبي إلى 65 درجة مئوية لمدة دقيقتين لتعطيل الهياكل الثانوية.
- ضعه على الجليد على الفور حتى يصبح جاهزا للمتابعة إلى الخطوة التالية.
ملاحظة: قد يختلف وقت الحضانة وفقا لعدد العينات التي سيتم معالجتها ولكن يجب ألا يتجاوز ساعة واحدة لتجنب أي تدهور الحمض النووي الريبي.
- تمييع إجمالي الحمض النووي الريبي بتركيز نهائي قدره 0.75 ميكروغرام/ميكرولتر مع مياه خالية من الرناسي، وهو ما يعادل 75 ميكروغرام/100 ميكرولتر.
-
تحديد متعدد-A
- لكل أنبوب الحمض النووي الريبي (من الخطوة 3.2)، إضافة 100 ميكرولتر من الخرز المغناطيسي غسلها (من الخطوة 3.1).
- تخلط جيدا عن طريق pipetting صعودا وهبوطا والسماح ملزمة على عجلة الدورية في درجة حرارة الغرفة لمدة 15 دقيقة.
- فتح جميع الأنابيب، ووضعها على المغناطيس لمدة 1 دقيقة، وإزالة بعناية كل supernatant.
- استعادة supernatant في أنبوب جديد والحفاظ جانبا لجولة ثانية من التقاط الحمض النووي الريبي (الخطوة 3.3.14)، من أجل تحسين الانتعاش النهائي بولي-A.
- إزالة أنبوب من المغناطيس وإضافة 200 ميكرولتر من المخزن المؤقت الغسيل (10 م تريس-HCl، درجة الحموضة 7.5، 0.15 م لى كل، 1 م EDTA). مزيج عن طريق pipetting بعناية 4 إلى 5 مرات.
- ضع الأنبوب على المغناطيس لمدة دقيقة واحدة وتجاهل الفائقة.
- كرر خطوة الغسيل مرة واحدة (كرر الخطوتين 3.3.5 و 3.3.6).
- إضافة 20 ميكرولتر من الجليد الباردة 10 mM تريس-HCl إلى elute بولي-A الجيش الملكي النيبالي من الخرز.
- حضانة عند 80 درجة مئوية لمدة 2 دقيقة.
- ضع الأنبوب على المغناطيس ونقل بسرعة supernatant التي تحتوي على الحمض النووي الريبي بولي-A إلى أنبوب جديد خالية من RNase. ضع الأنبوب على الثلج.
- كرر خطوة elution (الخطوات 3.3.8 إلى 3.3.10) لزيادة العائد.
- غسل نفس الخرز مرة واحدة مع 200 ميكرولتر من العازلة الغسيل. مزيج عن طريق pipetting بعناية 4 إلى 5 مرات.
- ضعه على المغناطيس لمدة دقيقة واحدة وتجاهل مخزن الغسيل المؤقت.
- إضافة التدفق من الخطوة 3.3.4 إلى الخرز وتكرار الإجراء من الربط إلى elution (الخطوات 3.3.2 إلى 3.3.10). الحفاظ على اليرنا eluates في أنابيب منفصلة في الوقت الراهن.
ملاحظة: اختياريا، مرة أخرى الاحتفاظ بما يعادل supernatant إلى الخطوة 3.3.4 في أنبوب جديد كما يمكن استخدامه كعنصر تحكم. في نهاية الإجراء، تنقية وتركيز الحمض النووي الريبي عن طريق هطول الأمطار الإيثانول أو مع طريقة الاختيار القائمة على العمود (أي، الحمض النووي الريبي نظيفة والمكثف). تتوافق هذه العينة مع عينة الحمض النووي الريبي المنضب متعدد الأضلاع ويمكن استخدامها كعنصر تحكم لتحويل البيسلفيت (الخطوة 8.2.2). - قياس الحمض النووي الريبي eluted مع مطياف والحفاظ على aliquot 2 ميكرولتر لمزيد من تقييم جودة الحمض النووي الريبي مع محلل جزء.
ملاحظة: يمكن تخزين الحمض النووي الريبي متعدد الأضلاع عند -80 درجة مئوية حتى الحاجة.
4. سير العمل الجيش الملكي النيبالي
- تقسيم الخلوية بولي-A الجيش الملكي النيبالي (مرنا) وعينات الحمض النووي الريبي الفيروسية إلى 2 aliquots, مخصصة لخط أنابيب تحليل epitranscriptomic كل من:
'1' 5 ميكروغرام من الحمض النووي الريبي الخلوي أو 1 ميكروغرام من الحمض النووي الريبي الفيروسي لعناصر التحكم MeRIP-Seq والمدخلات (انتقل إلى الخطوات من 5 إلى 7، والخطوة 9).
'2' 1 ميكروغرام من الحمض النووي الريبي الخلوي أو 500 نانوغرام من الحمض النووي الريبي الفيروسي ل BS-Seq (انتقل إلى الخطوتين 8 و 9).
5. تشظي الحمض النووي الريبي
ملاحظة: يتم إجراء تجزئة الحمض النووي الريبي مع كاشف تجزئة الحمض النووي الريبي وهو مخصص لعينات MeRIP-Seq والتحكم في الحمض النووي الريبي. هذه خطوة هامة جدا تتطلب تحسين دقيق من أجل الحصول على الأجزاء التي تتراوح بين 100-200 NT.
- تقسيم الحجم الإجمالي من مرنا إلى أنابيب PCR 0.2 مل مع 18 ميكرولتر من مرنا / أنبوب.
ملاحظة: العمل بسرعة. لا تعمل مع أكثر من 8 عينات في وقت واحد للحصول على نتائج قابلة للاستنساخ. لن يضمن توسيع حجم وحدة التخزين تجزئة قابلة للاستنساخ وموحدة. - الاحماء thermocycler في 70 درجة مئوية.
- إضافة 2 ميكرولتر من كاشف التجزئة على حافة كل أنبوب PCR.
- أغلق الأنبوب وتدور لأسفل (بحيث يحصل على اتصال مع الكاشف RNA في نفس الوقت للأنابيب 8).
- احتضان العينات 15 دقيقة في 70 درجة مئوية في دراجة حرارية مسخنة.
- بمجرد أن ينتهي الحضانة ، أضف بسرعة 2 ميكرولتر من محلول Stop في كل أنبوب.
- تدور أسفل والسماح للجلوس على الجليد حتى على استعداد للمضي قدما إلى الخطوة التالية.
ملاحظة: قد يختلف وقت الحضانة وفقا لعدد العينات التي سيتم معالجتها ولكن يجب ألا يتجاوز ساعة واحدة لتجنب أي تدهور الحمض النووي الريبي. - كرر الإجراء لجميع العينات (إذا كان هناك أكثر من 8 aliquots).
- تجمع أنابيب معا والمضي قدما لتنقية الجيش الملكي النيبالي مع RNA نظيفة والمكثف كيت (الخطوة 6) أو أي مجموعة مخصصة على أساس العمود للتخلص من المخازن المؤقتة واستعادة الحمض النووي الريبي نظيفة مجزأة في الماء.
6. تنقية الحمض النووي الريبي
ملاحظة: يمكن تنفيذ هذه الخطوة عن طريق هطول الأمطار الإيثانول أو مع أي نوع من الأعمدة القائمة على الحمض النووي الريبي تنقية وتركيز الأسلوب (أي RNA نظيفة ومكثف).
- Elute أو resuspend RNA المنقى في حجم إجمالي قدره 50-75 ميكرولتر من المياه الخالية من DNase / RNase.
ملاحظة: إذا تم استخدام أسلوب يستند إلى عمود، ينصح بشدة جولتين من elution لضمان أقصى قدر من الاسترداد. - قياس الحمض النووي الريبي المجزأ المنقى مع مطياف وتقييم جودة الحمض النووي الريبي مع محلل شظايا.
- احتفظ ب 100 نانوغرام من الحمض النووي الريبي المجزأ كتحكم في الإدخال لإعداد المكتبة وتسلسلها (انتقل إلى الخطوة 9). ويمكن استخدام الرنا المجزأ المتبقي (2.5 ميكروغرام كحد أدنى) ل MeRIP (انتقل إلى الخطوة 7.2).
7. MeRIP
ملاحظة: مطلوب ما لا يقل عن 2.5 ميكروغرام من الحمض النووي الريبي المجزأ لكل مناعة (IP)، إما باستخدام الأجسام المضادة المحددة المضادة لل m6A (حالة الاختبار) أو استخدام الأجسام المضادة ل IgG (التحكم السلبي).
- إعداد حبة مغناطيسية للانفقاد المناعي
- لكل عينة، وإعداد 4 مل من العازلة IP 1x في أنبوب مخروطي جديد عن طريق تمييع 800 ميكرولتر من الحمض النووي الريبي IP العازلة 5x (50 mM تريس-HCl درجة الحموضة 7.4، 750 mM NaCl، 0.5٪ Igepal CA-630، والمياه الخالية من النيوكلياز) مع 3.2 مل من المياه الخالية من النيوكليز.
ملاحظة: هناك حاجة إلى 2 ردود فعل على الأقل (اختبار واحد وتحكم IgG واحد). - ضع الأنبوب على الثلج.
- تسمية العدد المناسب من أنابيب الطرد المركزي الدقيق 1.5 مل لعدد ردود الفعل IP المطلوبة:
ن أنابيب (اختبار) للأجسام المضادة m6A.
ن أنابيب (التحكم السلبي) ل IgG الماوس العادي. - Resuspend الخرز المغناطيسي (على سبيل المثال، ماجنا ChIP بروتين A / G) عن طريق عكس ودوامة. لا ينبغي أن تكون كتل من الخرز مرئية.
- لكل رد فعل مخطط له، نقل 25 ميكرولتر من الخرز المغناطيسي إلى أنبوب الطرد المركزي الدقيق.
- إضافة عشر مرات أكثر 1x IP المخزن المؤقت (من الخطوة 7.1.1) فيما يتعلق بالحجم الأصلي من الخرز المستخدمة (أي 250 ميكرولتر من 1x IP المخزن المؤقت لكل 25 ميكرولتر من الخرز المغناطيسي).
- خلط الخرز عن طريق الأنابيب بلطف صعودا وهبوطا عدة مرات لإعادة الإنفاق الكامل.
- ضع الأنبوب على الفاصل المغناطيسي لمدة دقيقة واحدة.
- إزالة وتجاهل supernatant، والتأكد من عدم يستنشق أي حبات المغناطيسي. إزالة أنبوب من المغناطيس.
- كرر خطوة الغسيل (الخطوات 7.1.6 إلى 7.1.9).
- Resuspend الخرز في 100 ميكرولتر من 1x IP العازلة لكل 25 ميكرولتر من الحجم الأصلي من الخرز المغناطيسي.
- أضف 5 ميكرولتر من الأجسام المضادة (1 ميكروغرام/ميكرولتر) لكل 25 ميكرولتر من الحجم الأصلي للخرزات المغناطيسية.
ن أنابيب (اختبار) مع الأجسام المضادة m6A (استنساخ 17-3-4-1) [1 ميكروغرام / μL].
ن أنابيب (التحكم السلبي) مع الماوس العادي IgG (1 ميكروغرام / ميكرولتر). - احتضان على عجلة دوارة لمدة 30 دقيقة في درجة حرارة الغرفة للسماح اقتران الأجسام المضادة مع الخرز المغناطيسي.
- ضع الأنبوب على الفاصل المغناطيسي لمدة دقيقة واحدة. تجاهل الناتنات الفائق. إزالة أنبوب من المغناطيس وإعادة إنفاق خليط الأجسام المضادة حبة في 100 ميكرولتر من 1x IP العازلة.
- لكل عينة، وإعداد 4 مل من العازلة IP 1x في أنبوب مخروطي جديد عن طريق تمييع 800 ميكرولتر من الحمض النووي الريبي IP العازلة 5x (50 mM تريس-HCl درجة الحموضة 7.4، 750 mM NaCl، 0.5٪ Igepal CA-630، والمياه الخالية من النيوكلياز) مع 3.2 مل من المياه الخالية من النيوكليز.
- النا المناعي (RIP)
- إعداد 500 ميكرولتر من خليط رد الفعل RIP لكل عينة مرنا 2.5 ميكروغرام على النحو التالي: 2.5 ميكروغرام في 100 ميكرولتر من الحمض النووي الريبي المجزأ (من الخطوة 6.12)؛ 295 ميكرولتر من المياه الخالية من النيوكليز؛ 5 ميكرولتر من 40 U/μL RNase المانع; و 100 ميكرولتر من المخزن المؤقت IP 5x.
- إضافة 500 ميكرولتر من خليط رد فعل RIP إلى كل خليط حبة الأجسام المضادة (~ 100 ميكرولتر من الخطوة 7.1.14). مزيج عن طريق الأنابيب بلطف عدة مرات لإعادة إنفاق الخرز تماما. ضعه على الثلج
- احتضان جميع أنابيب RIP على عجلة دوارة لمدة ساعتين عند 4 درجة مئوية.
- الطرد المركزي ردود فعل MeRIP لفترة وجيزة لتدور أسفل قطرات السائل من الجانبين الغطاء وأنبوب. ضع الأنابيب على فاصل مغناطيسي لمدة دقيقة واحدة.
- نقل supernatant في أنبوب الطرد المركزي الجديد، مع الحرص على عدم تعكير صفو الخرز المغناطيسي .
ملاحظة: يمكن الاحتفاظ Flowthrough كعنصر تحكم للتحقق من كفاءة RIP (انتقل إلى الخطوة 7.3.9). - إزالة أنابيب من المغناطيس. غسل الخرز بإضافة 500 ميكرولتر من البارد 1x IP المخزن المؤقت. مزيج الخرز عن طريق الأنابيب بلطف عدة مرات لإعادة إنفاق الخرز تماما.
- ضع الأنابيب على فاصل مغناطيسي لمدة دقيقة واحدة وتخلص من النافورة.
- كرر إجراء الغسيل (الخطوات 7.2.6-7.2.7) مرتين لما مجموعه 3 يغسل.
- ضع الأنابيب على الجليد واذهب فورا إلى elution.
- إلوتيون
- إعداد 20 mM m6A الحل عن طريق حل 10 ملغ من N6-Methyladenosine, 5′-أحادي الفوسفات ملح الصوديوم (M6A) في 1.3 مل من المياه الخالية من النيوكليز. إعداد 150 ميكرولتر aliquots وتخزينها في -20 درجة مئوية.
- لكل عينة (اختبار وعناصر تحكم): إعداد 225 ميكرولتر من المخزن المؤقت elution عن طريق خلط المكونات التالية: 45 ميكرولتر من 5x IP Buffer، و75 ميكرولتر من 20 مللي متر m6A، و3.5 ميكرولتر من مثبط RNase 40U/μL، و101.5 ميكرولتر من المياه الخالية من النيوكليز.
- إضافة 100 ميكرولتر من المخزن المؤقت elution (من الخطوة 7.3.2) إلى الخرز (من الخطوة 7.2.9). مزيج عن طريق الأنابيب بلطف عدة مرات إلى حبات resuspend تماما.
- احتضان جميع الأنابيب لمدة 1 ساعة مع اهتزاز مستمر على الروك في 4 درجة مئوية.
- الطرد المركزي ردود الفعل RIP لفترة وجيزة لتدور أسفل قطرات السائل من الغطاء والجانبين أنبوب. ضع الأنابيب على فاصل مغناطيسي لمدة دقيقة واحدة.
- نقل supernatant التي تحتوي على شظايا الحمض النووي الريبي eluted إلى أنبوب جديد 1.5 مل الطرد المركزي الدقيق. يجب الحرص على عدم يستنشق الخرز، كما أنه سيزيد من الضوضاء الخلفية.
- كرر خطوات elution (7.3.3 إلى 7.3.6) عن طريق إضافة مرة أخرى 100 ميكرولتر من العازلة elution، واحتضان 1 ساعة في 4 درجة مئوية، وجمع eluate بعد الفصل المغناطيسي.
- اجمع جميع الملوات من نفس العينة (يجب أن يكون إجمالي حجم الغضوء 200 ميكرولتر).
- تنقية الحمض النووي الريبي eluted و flowthrough (اختياري، من الخطوة 7.2.5) عن طريق هطول الأمطار الإيثانول أو عن طريق طريقة الاختيار القائمة على العمود (أي، RNA نظيفة والمكثف).
- تقييم كمية الحمض النووي الريبي وجودة عينات flowthrough و eluted مع محلل جزء باستخدام مجموعة عالية الكشف عن الحساسية. إذا كانت جودة الحمض النووي الريبي مرضية، انتقل إلى إعداد المكتبة وتسلسل عالي الإنتاجية (الخطوة 9).
ملاحظة: كمية الحمض النووي الريبي المستردة على MeRIP منخفضة جدا، ويتطلب بالضرورة مجموعات الكشف عن حساسية عالية لضمان القياس الكمي. إذا لم يكن هناك بيواناليزر متاح، فمن الممكن المضي قدما بشكل أعمى لإعداد المكتبة.
8. تحويل RNA بيسلفيت
- التحكم وإعداد الكاشف
- ERCC مزيج ارتفاع في السيطرة: إضافة مزيج ERCC اتباع تعليمات الشركة المصنعة، والتي توصي بإضافة 0.5 ميكرولتر من مزيج ERCC غير مخفف إلى 500 نانوغرام من مرنا. ويمكن أن تساعد هذه السيطرة على تقييم كفاءة تحويل البيسوليت.
- سبايك بولي-A-المنضب الجيش الملكي النيبالي (من الخطوة 3.3.14) بنسبة 1/1000 (أي، 500 pg من الحمض النووي الريبي بولي-A-المنضب ل 500 نانوغرام من مرنا). يتم إثراء هذه العينة في الحمض النووي الريبي ريبوسومال، وبالتالي ينبغي أن تحتوي على 28S rRNA، وهو عنصر تحكم إيجابي لتحويل بيسلفيت.
ملاحظة: يمكن أيضا استخدام إجمالي الحمض النووي الريبي كتحكم إيجابي بدلا من الحمض النووي الريبي المنضب بولي-أ. - إجراء تحويل بيسلفايت مع مجموعة ميثيل الحمض النووي الريبي (على سبيل المثال، زيمو EZ).
- مخزن غسل الحمض النووي الريبي: أضف 48 مل من الإيثانول بنسبة 100٪ (أو 52 مل من الإيثانول بنسبة 95٪) إلى 12 مل من تركيز مخزن غسل الحمض النووي الريبي قبل الاستخدام.
- تحويل بيسلفيت
ملاحظة: تم تحويل بيسلفيت مع مجموعة تحويل بيسوليت الحمض النووي الريبي المتاحة تجاريا بعد إجراء الشركة المصنعة على النحو المذكور أدناه.- في أنابيب PCR 0.2 مل، إضافة 1000 نانوغرام من مرنا (أو بين 300 و 1000 نانوغرام). إضافة عناصر تحكم ذات ارتفاع: 1 ميكرولتر من مزيج ERCC (الخطوة 8.1.1) و1000 pg من الحمض النووي الريبي المنضب بولي -A (الخطوة 8.1.2). حجم كامل يصل إلى 20 ميكرولتر مع مياه خالية من DNase/ RNase.
- إضافة 130 ميكرولتر من كاشف تحويل الحمض النووي الريبي إلى كل عينة RNA 20 ميكرولتر.
- خلط العينة عن طريق pipetting صعودا وهبوطا.
- قم بالدوران لفترة وجيزة للتأكد من عدم وجود قطرات في الغطاء أو جوانب الأنبوب.
- ضع أنابيب PCR في دورة حرارية واجر الخطوات التالية: التشبع عند 70 درجة مئوية لمدة 5 دقائق؛ التحويل عند 54 درجة مئوية لمدة 45 دقيقة؛ تكرار خطوات التشبع والتحويل لما مجموعه 3 دورات؛ ثم عقد في 4 درجة مئوية إلى أجل غير مسمى.
ملاحظة: ثلاث دورات من التشبع وتحويل البيسلفيت ضمان تحويل بيسلفيت كاملة للعينة. يمكن تخزين العينات عند -80 درجة مئوية أو معالجتها مباشرة. - تابع عملية إلغاء الاتصال في العمود. ضع عمودا في أنبوب تجميع فارغ وأضف 250 ميكرولتر من مخزن RNA الملزم إلى العمود.
- تحميل العينة (~ 150 ميكرولتر من الخطوة 8.2.5) في العمود الذي يحتوي على مخزن الارتباط RNA وخلط عن طريق pipetting صعودا وهبوطا.
- إضافة 400 ميكرولتر من الإيثانول 95-100٪ إلى خليط عينة الحمض النووي الريبي العازلة ملزمة في العمود. أغلق الغطاء واخلطه فورا عن طريق عكس العمود عدة مرات.
- جهاز طرد مركزي بأقصى سرعة (≥ 10,000 × غرام) لمدة 30 s. تجاهل توسط التدفق.
- أضف 200 ميكرولتر من مخزن غسيل الحمض النووي الريبي إلى العمود والطرد المركزي بأقصى سرعة لمدة 30 ثانية.
- إضافة 200 ميكرولتر من الحمض النووي الريبي إزالة الاتصال العازلة إلى العمود واحتضان في درجة حرارة الغرفة لمدة 30 دقيقة. بعد الحضانة، والطرد المركزي بأقصى سرعة لمدة 30 s. تجاهل توسط التدفق.
- أضف 400 ميكرولتر من مخزن غسيل الحمض النووي الريبي إلى العمود والطرد المركزي بأقصى سرعة لمدة 30 ثانية. كرر خطوة الغسيل مع 400 ميكرولتر إضافية من مخزن غسيل الحمض النووي الريبي. تجاهل توسط التدفق.
- طرد العمود في أنبوب التجميع الفارغ بأقصى سرعة لمدة دقيقتين. نقل العمود إلى أنبوب خالية من RNase.
- أضف ≥ 10 ميكرولتر من المياه الخالية من DNase/RNase مباشرة إلى مصفوفة العمود، واحتضن لمدة دقيقة واحدة في درجة حرارة الغرفة. جهاز طرد مركزي بأقصى سرعة لمدة 30 s.
ملاحظة: نحن عادة ما يسيل في حجم 20 ميكرولتر. يمكن استخدام الحمض النووي الريبي الملوت على الفور أو تخزينه عند -20 درجة مئوية لمدة تصل إلى 3 أشهر. للتخزين طويل الأجل، احتفظ به عند -80 درجة مئوية. - أخرج 2.5 ميكرولتر لتقييم محلل الأجزاء لنوعية وكمية الحمض النووي الريبي واذهب إلى إعداد المكتبة وتسلسل عالي الإنتاجية (الخطوة 9).
- خذ 4 ميكرولتر من الحمض النووي الريبي المحول للتحكم في تحويل البيسوليت للكفاءة (الخطوة 8.3).
- التحكم في تحويل بيسوليت بواسطة RT-PCR
ملاحظة: هذه الخطوة تضمن نجاح تحويل بيسلفيت قبل المتابعة إلى التسلسل . 28S ريبوسومال الجيش الملكي النيبالي من الإنسان العاقل سوف تستخدم كسيطرة إيجابية لتحليل ميثيل الحمض النووي الريبي، كما تم وصف بقايا C في موقف 4447 (جينبانك الانضمام # NR_003287) بأنها 100٪ ميثيل.
تسلسلات التمهيدي:
H 28SF التمهيدي: 5'-GGGGTTTTAYTTTTTTTTTTTTGGG-3'
H 28SR التمهيدي: 5'-CCAACTCACRTTCCCTATAATAAAAC-3'- إعداد النسخ العكسي (RT) مزيج رد الفعل باستخدام عالية القدرة cDNA النسخ العكسي كيت. إذابة مكونات عدة على الجليد وإعداد مزيج RT الرئيسي على الجليد على النحو التالي:
4 ميكرولتر من بيسوليت تحويل الحمض النووي الريبي (من الخطوة 8.2.14):
2 ميكرولتر من المخزن المؤقت 10xRT
0.8 ميكرولتر من 25x dNTP ميكس [100 mM]
2 ميكرولتر من 10x RT التمهيديات العشوائية
1 ميكرولتر من النسخ العكسي متعدد الكتب
1 ميكرولتر من مثبط RNase
9.2 ميكرولتر من H2O الخالي من النيوكليز
ملاحظة: يجب أن يحتوي كل رد فعل RT على وحدة تخزين نهائية 20 ميكرولتر في أنابيب PCR 0.2 مل. - وضع الأنابيب في دورة الحرارية مع برنامج RT التالية: 25 درجة مئوية لمدة 10 دقيقة. 37 درجة مئوية لمدة 120 دقيقة؛ 85 درجة مئوية لمدة 5 دقائق؛ ثم عند 4 درجة مئوية إلى أجل غير مسمى.
- إعداد تفاعل PCR لتضخيم على وجه التحديد 28S rRNA مع إنزيم التدقيق PCR. إذابة مكونات عدة على الجليد، دوامة بلطف وطارد مركزي لفترة وجيزة. إعداد مزيج PCR الرئيسي على الجليد أو على حامل لوحة معدنية باردة الجليد على النحو التالي:
0.6 ميكرولتر من 10 ميكرومتر H 28SF التمهيدي
0.6 ميكرولتر من 10 ميكرومتر H 28SF التمهيدي
6.5 ميكرولتر من قالب cDNA
22.5 ميكرولتر من مزيج DNA بوليمراز الرئيسي
ملاحظة: يجب أن يحتوي كل تفاعل PCR على وحدة تخزين نهائية 20 ميكرولتر في أنابيب PCR 0.2 مل. - وضع الأنابيب في دورة الحرارية مع برنامج PCR التالية: التشبع الأولي في 95 درجة مئوية لمدة 5 دقائق; 45 دورة من التشبع (95 درجة مئوية لمدة 15 ق)، والعلوان (57 درجة مئوية لمدة 30 s)، والاطالة (72 درجة مئوية لمدة 15 s)، استطالة النهائي في 72 درجة مئوية لمدة 10 دقيقة، ومن ثم عقد في 4 درجة مئوية إلى أجل غير مسمى.
- تشغيل 10 ميكرولتر من رد الفعل على هلام agarose 2٪. حجم النطاق المتوقع هو 130 - 200 نقطة أساس.
- إعداد النسخ العكسي (RT) مزيج رد الفعل باستخدام عالية القدرة cDNA النسخ العكسي كيت. إذابة مكونات عدة على الجليد وإعداد مزيج RT الرئيسي على الجليد على النحو التالي:
- تسلسل منتجات PCR
- تنقية منتجات PCR مع طريقة الاختيار القائمة على العمود لإزالة الإنزيمات ومخلفات dNTP وelute الحمض النووي تضخيمها في ما لا يقل عن 20 ميكرولتر من المياه الخالية من DNase / RNase.
- قياس الحمض النووي المنقى مع مطياف.
- رد فعل التسلسل
- استخدام 40 نانوغرام من تفاعل المنتج PCR / التسلسل.
- تسلسل في كلا الاتجاهين مع H 28SF وH 28SR التمهيديات.
- محاذاة التسلسلات مع التسلسل غير المحولة المعروفة (28S ريبوسومال N5 (RNA28SN5). تحقق من وجود بقايا C في الموضع C4447، ومن وجود بقايا T بدلا من C في مكان آخر.
9. إعداد المكتبة وتسلسل الإنتاجية العالية
- إعداد المكتبات للتسلسل باستخدام مجموعات مرنا (على سبيل المثال، Illumina TruSeq Stranded)، وبدء البروتوكول في خطوة Elute-Prime-Fragment واتباع إرشادات الشركة المصنعة.
- ومع ذلك، بالنسبة لعينات المدخلات RNA-Seq و MeRIP-Seq، احتضن العينات عند 80 درجة مئوية لمدة دقيقتين إلى رئيس الوزراء فقط ولكن ليس المزيد من تجزئة لهم.
- تنفيذ التسلسل باستخدام منصات Illumina. يمكن تنفيذ ردود الفعل التسلسل وفقا لتفضيلات والتصميم التجريبي، إما نهايات واحدة أو مقترنة، مع الحد الأدنى من طول 100 NT.
10. تحليلات المعلوماتية الحيوية
- m6A معالجة البيانات
- تشغيل FASTQC24 لتقييم جودة القراءة في M6A وإدخال ملفات FASTQ من التسلسل.
- تشغيل Atropos25 لتقليم نهاية منخفضة الجودة ومحول تسلسلات من القراءات. تعيين المعلمات التالية في تشغيل Atropos.
- إزالة تسلسل المحول التالي: AGATCGGAAGAG, CTCTTCCGATCT, AACACTCTTTCCCT, AGATCGGAAGAGCG, AGGGAAAGAGTGTT, CGCTCTTCCGATCT.
- استخدم قطع جودة Phred التالي: 5، لتقليم النهايات منخفضة الجودة كما هو محدد من قبل الشركة المصنعة (https://support.illumina.com/downloads/illumina-adapter-sequences-document-1000000002694.html).
- استخدم الحد الأدنى التالي من طول القراءة بعد التشذيب: 25 زوجا أساسيا.
- دمج الجينوم البشري GRh38 وفيروس نقص المناعة البشرية [المتكاملة الخطية pNL4-3Env-GFP] المرجع في شكل FASTA.
- فهرسة المرجع المدمج مع HISAT226.
- تشغيل HISAT2 على القراءات المشذبة لمحاذاة إلى المرجع المفهرس. استخدام معلمات HISAT الافتراضية.
- فرز وفهرسة قراءات المحاذاة مع SAMtools27.
- تشغيل SAMtools احصائيات وQualimap 228 ، لفحص جودة ما بعد المحاذاة للمكتبات تسلسل.
- اختياريا، جمع وتلخيص مقاييس الجودة من الخطوة السابقة مع multiQC29.
- فيروس نقص المناعة البشرية الجينوم لديه تسلسل 634 نقطة أساس متجانسة في 5 'LTR و 3 ' LTR: إعادة تنظيم قراءات متعددة من 5 'LTR إلى المنطقة المقابلة 3 'LTR مع SAMtools.
- من أجل تحديد قمم M6A، قم بتشغيل برنامج استدعاء الذروة MACS230 (v 2.1.2). حدد بعناية معلمات تشغيل MACS2 ، من أجل ضمان الأداء الصحيح على بيانات RNA-Seq حيث يمكن أن يتأثر استدعاء الذروة بمستوى التعبير الجيني ، وقد يساء تسمية exons القصيرة كقمم. وبالتالي، يجب طرح إشارة الإدخال من إشارة m6A، دون التجانس الذي يطبقه MACS2 بشكل روتيني على البيانات المستندة إلى الحمض النووي. تطبيق المعلمات التالية إلى الأمر الفرعي 'callpeak' من MACS2:
-keep-dup السيارات (يتحكم في سلوك MACS2 نحو قراءات مكررة، 'السيارات' يسمح MACS لحساب الحد الأقصى لعدد القراءات في نفس الموقع بالضبط على أساس التوزيع الثنائي باستخدام 1e-5 كما قطع قيمة ف)
-g 2.7e9 (حجم الجينوم البشري في نقطة أساس)
-q 0.01 (الحد الأدنى لقطع FDR لاستدعاء قمم كبيرة)
-nomodel (لتجاوز بناء نموذج التحول، والتي تم تصميمها لتجارب ChIP-Seq)
-slocal 0
-llocal 0 (تعيين هذا والمعلمة السابقة إلى 0 يسمح MACS2 لطرح مباشرة، دون تنعيم، يقرأ الإدخال من يقرأ M6A)
-extsize 100 (متوسط طول شظايا في نقطة أساس)
-B - تشغيل الذروة التفاضلية استدعاء الأمر الفرعي من MACS2، 'bdgdiff' لمقارنة العينات المصابة مقابل غير المصابة. يأخذ 'bdgdiff' كمدخلات ملفات bedGraph التي تم إنشاؤها بواسطة 'callpeak' في الخطوة السابقة. لكل نقطة زمنية، قم بتشغيل مقارنة العينات المصابة مقابل العينات غير المصابة ب "bdgdiff"، وطرح إشارة الإدخال المعنية من إشارة m6A وتوفير المعلمات الإضافية: -g 60 -l 120.
- m5C معالجة البيانات
- تشغيل Cutadapt31 لتقليم تسلسل محول من القراءات الخام، مع المعلمات التالية:
محول "أغاتشاغاغاغاغاكاجاككتغاك"
-الحد الأدنى للطول = 25. - عكس تكملة القراءات قلصت باستخدام seqkit32، كما ينتج بروتوكول التسلسل يقرأ من حبلا العكسي.
- تشغيل FastQC لفحص جودة القراءة.
- دمج الجينوم البشري GRh38 وفيروس نقص المناعة البشرية [المتكاملة الخطية pNL4-3Env-GFP] مرجع في شكل FASTA.
- فهرسة المرجع المدمج مع تطبيق meRanGh من حزمة meRanTK33.
- محاذاة مع meRanGh مع المعلمات التالية:
-UN تمكين قراءات غير معمد أن تكون مكتوبة لإخراج الملفات
-MM تمكين قراءات متعددة المعينة إلى كتابتها إلى ملف الإخراج
-bg للإخراج في bedGraph
-mbgc 10 مرشح المنطقة المبلغ عنها من خلال التغطية (ما لا يقل عن 10 قراءات من التغطية) - فيروس نقص المناعة البشرية الجينوم لديه تسلسل 634 نقطة أساس متجانسة في 5 'LTR و 3 ' LTR: إعادة تنظيم قراءات متعددة من 5 'LTR إلى المنطقة المقابلة 3 'LTR مع SAMtools.
- تشغيل استدعاء المثيلة عبر أداة meRanCall، التي توفرها meRanTK، مع المعلمات التالية:
-rl = 126، قراءة طول
-ei = 0.1، فاصل الخطأ لحساب معدل الميثيل p-value
-cr = 0.99، التحويل المتوقع - تشغيل الأداة المساعدة MeRanTK estimateSizeFactors.pl لتقدير حجم العوامل من كل عينة. سيتم استخدام عوامل الحجم كمعلمات في الخطوة التالية.
- تشغيل MeRanCompare لتحليل الميثيل التفاضلي لغير المصابين مقابل المصابين عبر النقاط الزمنية 12 و 24 و 36h. يتم تطبيق المعلمات التالية: قيمة أهمية 0.01 ك الحد الأدنى لعوامل التقارير والحجم من الخطوة السابقة.
- تشغيل Cutadapt31 لتقليم تسلسل محول من القراءات الخام، مع المعلمات التالية:
النتائج
وقد ثبت أن سير العمل هذا مفيد في التحقيق في دور ميثيل M6A و m5C في سياق الإصابة بفيروس نقص المناعة البشرية. لهذا، استخدمنا CD4 + T نموذج خط الخلية (SupT1) أننا إما المصابين بفيروس نقص المناعة البشرية أو تركت دون علاج. بدأنا سير العمل مع 50 مليون خلية لكل حالة وحصلنا على متوسط 500 ميكروغرام من إجمالي الحمض النووي الريبي مع عدد جودة الحمض النووي الريبي من 10 (الشكل 1A-B). عند اختيار البولي-أ استعدنا ما بين 10 و12 ميكروغرام من الحمض النووي الريبي لكل حالة (تمثل حوالي 2٪ من إجمالي الحمض النووي الريبي) (الشكل 1B). عند هذه النقطة، استخدمنا 5 ميكروغرام من الحمض النووي الريبي متعدد الاختر لخط أنابيب MeRIP-Seq و 1 ميكروغرام لخط أنابيب BS-Seq. وبما أن الحمض النووي الريبي لفيروس نقص المناعة البشرية متعدد الغدد، فلا حاجة إلى اتخاذ أي إجراء آخر، ويمكن تطبيق إجراءات MeRIP-Seq و BS-Seq مباشرة.
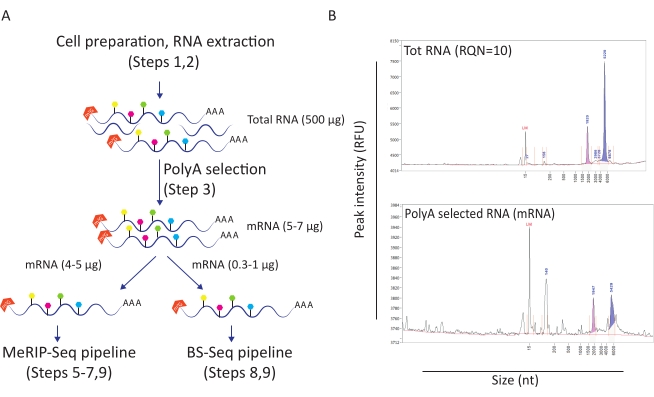
الشكل 1: إعداد الحمض النووي الريبي لتطبيقات المصب. أ) سير العمل الذي يصور إعداد الجيش الملكي النيبالي وتوزيعه لخطوط أنابيب MeRIP-Seq و BS-Seq المتزامنة. يمثل كل شكل سداسي مملوء نوع تعديل الحمض النووي الريبي، مثل m6A (أخضر) أو m5C (وردي). ويشار إلى كميات من مواد الحمض النووي الريبي اللازمة لتنفيذ التجربة. ب) النتائج التمثيلية التي تصور ملامح توزيع الحمض النووي الريبي المتوقع (الحجم والمبلغ) عند إجمالي استخراج الحمض النووي الريبي (اللوحة العليا) واختيار البولي-أ (اللوحة السفلية). تم تحميل العينات على محلل الشظايا مع مجموعة الحساسية القياسية من أجل تقييم جودة الحمض النووي الريبي قبل إدخال إجراءات محددة MeRIP-Seq و BS-Seq. RQN: رقم جودة الحمض النووي الريبي؛ nt: النيوكليوتيدات. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
خط أنابيب MeRIP-Seq هو تقنية تعتمد على مناعة الحمض النووي الريبي تسمح بالتحقيق في تعديل m6A على طول جزيئات الحمض النووي الريبي. لهذا، يتم تجزئة الحمض النووي الريبي أولا ثم احتضانه بأجسام مضادة خاصة ب m6A إلى جانب الخرز المغناطيسي للانشاء المناعي والالتقاط. ثم يتم تسلسل أجزاء الحمض النووي الريبي المخصب MeRIP والكسر (الإدخال) الذي لم يمسه ومقارنة لتحديد مناطق الحمض النووي الريبي المعدلة m6A وبالتالي النصوص الميثيلية m6A (الشكل 2A). يعتمد حل هذه التقنية على كفاءة تجزئة الحمض النووي الريبي. والواقع أن الشظايا الأقصر تسمح بتوطين أكثر دقة لبقايا M6A. هنا، تعرضت الحمض النووي الريبي الخلوي متعدد الاختر والحمى الريبية الفيروسية للتجزؤ القائم على الأيونات مع مخزن تجزئة الحمض النووي الريبي خلال 15 دقيقة في حجم نهائي 20 ميكرولتر للحصول على شظايا الحمض النووي الريبي من 100-150 nt. بدءا من 5 ميكروغرام من الحمض النووي الريبي، استعدنا 4.5 ميكروغرام من الحمض النووي الريبي المجزأ، وهو ما يقابل معدل استرداد قدره 90٪ (الشكل 2B). استخدمنا 100 نانوغرام من الحمض النووي الريبي المجزأ المنقى كتحكم في المدخلات ، وتعرض مباشرة لإعداد المكتبة وتسلسلها. تمت معالجة الحمض النووي الريبي المتبقي (~ 4.4 ميكروغرام) وفقا لخط أنابيب MeRIP-Seq ، الذي يبدأ باحتضان الحمض النووي الريبي المجزأ مع حبات مرتبطة إما بأجسام مضادة محددة مضادة M6A أو بأجسام مضادة مضادة ل IgG كتحكم. M6A محددة RIP (MeRIP) من 2.5 ميكروغرام من الحمض النووي الريبي مجزأة سمحت استرجاع حوالي 15 نانوغرام من المواد المخصب M6A التي خضعت لإعداد المكتبة وتسلسل (الشكل 2B). لم RIP مع مكافحة IgG السيطرة، كما هو متوقع، لم تسفر عن ما يكفي من الحمض النووي الريبي للسماح بمزيد من التحليل (الشكل 2B).
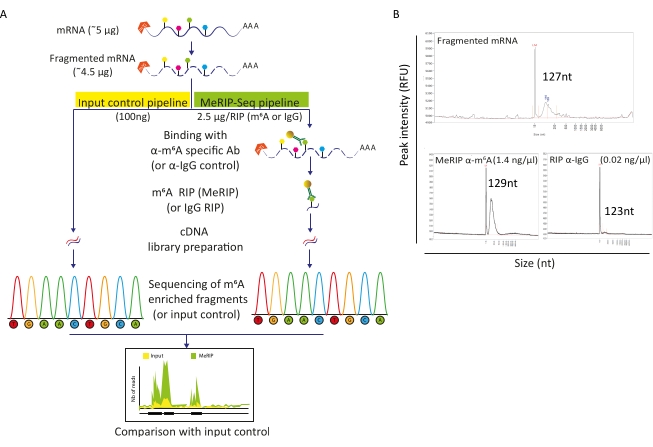
الشكل 2: خط أنابيب MeRIP-Seq. أ) التمثيل التخطيطي لسير عمل MeRIP-Seq والتحكم في الإدخال. عند اختيار البولي-أ، تم تجزئة العينات إلى 120-150 قطعة NT، وإما تخضع مباشرة للتسلسل (100 نانوغرام، التحكم في الإدخال)، أو تستخدم ل RNA المناعي (2.5 ميكروغرام، RIP) مع الأجسام المضادة المضادة M6A محددة أو الأجسام المضادة IgG كسيطرة سلبية قبل التسلسل. ب) النتائج التمثيلية التي تظهر ملامح توزيع الحمض النووي الريبي المتوقع (الحجم والمبلغ) عند التجزئة (اللوحة العليا) وRIP (اللوحات السفلية، MeRIP: اليسار، التحكم IgG: يمين). تم تحميل العينات على محلل الشظايا لتقييم جودة وتركيز الحمض النووي الريبي قبل إجراء مزيد من المعالجة لإعداد المكتبة وتسلسلها. تم إجراء تحليل الحمض النووي الريبي المجزأ باستخدام مجموعة الحساسية القياسية للجيش الملكي النيبالي في حين استخدم الحمض النووي الريبي عالي النسيلة مجموعة الحساسية العالية. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
يسمح خط أنابيب BS-Seq باستكشاف تعديل الحمض النووي الريبي m5C بدقة النيوكليوتيدات ويؤدي إلى تحديد النصوص الميثيلية m5C. عند تحويل البيسلفيت، يتم تحويل السيتوستينات غير الميثيلية إلى أوراسيل، في حين تبقى السيتوستينات الميثيلية دون تغيير (الشكل 3A). ونظرا للظروف القاسية لإجراء تحويل البيسوليت (أي ارتفاع درجة الحرارة وانخفاض درجة الحموضة)، فإن الرنانات المحولة متدهورة بدرجة عالية (الشكل 3B)، ولكن هذا لا يتعارض مع إعداد المكتبة وتسلسلها. تحويل بيسلفيت فعالة فقط على الحمض النووي الريبي واحد تقطعت بهم السبل، وبالتالي يمكن أن يعوقها هياكل الحمض النووي الريبي مزدوجة تقطعت بهم السبل الثانوية. لتقييم كفاءة تحويل C-U قدمنا عنصري تحكم. كتحكم إيجابي، استفدنا من وجود السيتوسين الميثيلي للغاية الموصوف سابقا في الموضع C4447 من rRNA23 28S. عند تضخيم RT-PCR وتسلسلها من جزء 200 bp المحيطة بالموقع الميثيلي يمكننا أن نلاحظ أن جميع السيتوستينات تم تحويلها بنجاح إلى uracils، وبالتالي تظهر كما thymidines في تسلسل الحمض النووي، باستثناء السيتوزين في الموقف 4447 التي ظلت دون تغيير. كتحكم في معدل تحويل بيسلفيت ، استخدمنا تسلسل الحمض النووي الريبي الاصطناعي المتاح تجاريا. يتكون هذا الخليط في مجموعة من تسلسلات الحمض النووي الريبي المعروفة وغير الميثيلية والمليئة بال أدينلاتيد ، مع مجموعة متنوعة من الهياكل والأطوال الثانوية. وعند إعداد المكتبة وتسلسلها، ركزنا على تسلسلات ERCC هذه لحساب معدل التحويل، والذي يمكن إجراؤه عن طريق حساب عدد C المحول بين إجمالي بقايا C في جميع تسلسلات ERCC وفي كل عينة. حصلنا على معدل تحويل 99.5٪، مما يؤكد كفاءة ونجاح تفاعل تحويل بيسلفيت (الشكل 3D).
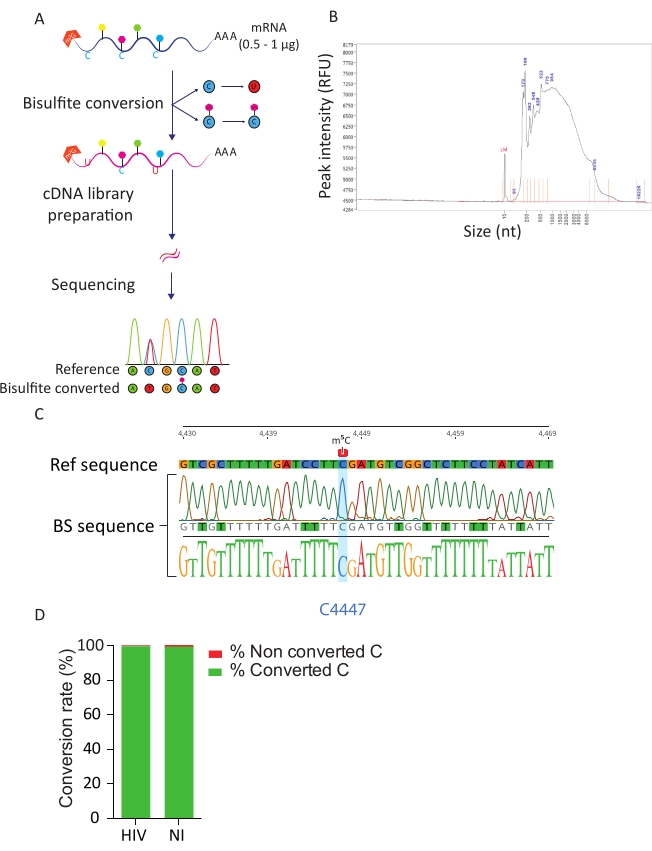
الشكل 3: خط أنابيب BS-Seq. أ) التمثيل التخطيطي لسير عمل BS-Seq. عند اختيار البولي-أ، تتعرض العينات للبيسلفيت، مما يؤدي إلى تحويل C إلى U (بسبب إزالة البروم) لمخلفات C غير الميثيلية. وعلى النقيض من ذلك، لا تتأثر بقايا C الميثيلية (m5C) بمعالجة البيسوليت وتظل دون تغيير. ب) النتيجة التمثيلية للبيسوليت تحويل ملف توزيع الحمض النووي الريبي (حجم وكمية) عند تحليل على محلل جزء مع مجموعة حساسية القياسية. ج) Electropherogram تظهر نتيجة تسلسل ممثل من أمبليكون RT-PCR للمنطقة المحيطة 100٪ ميثيل C في موقف 4447 في 28S rRNA (أبرز باللون الأزرق). وعلى النقيض من ذلك، تم تحديد بقايا C من التسلسل المرجعي كمخلفات T في تسلسل الأمبليكون بسبب نجاح تحويل البيسلفيت. د) تقييم معدل التحويل C-U من خلال تحليل تسلسل ارتفاع ERCC في الخلايا المصابة بفيروس نقص المناعة البشرية وغير المصابة. متوسط معدل التحويل هو 99.5٪. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
كما يجري تجهيز العينات المخصبة بال M6A، والعينات المحولة من البيسوليت، وضوابط الإدخال لإعداد المكتبة وتسلسلها وتحليلها المعلوماتية الحيوية (الشكل 4). ووفقا للتصميم التجريبي والسؤال (الأسئلة) البيولوجية التي عولجت، يمكن تطبيق تحليلات المعلوماتية الحيوية المتعددة. وكدليل على المبدأ هنا، نعرض نتائج تمثيلية من تطبيق محتمل واحد (أي تحليل الميثيل التفاضلي)، الذي يركز على تحديد النصوص المثيلة بشكل متفاوت الناجمة عن الإصابة بفيروس نقص المناعة البشرية. باختصار، قمنا بالتحقيق في مستوى ميثيل M6A أو m5C من النصوص، بشكل مستقل عن مستوى التعبير الجيني، في كل من الخلايا غير المصابة والمصابة بفيروس نقص المناعة البشرية، من أجل زيادة فهم دور ميثيل الحمض النووي الريبي خلال دورة الحياة الفيروسية. عند تطبيع التعبير الجيني، حددنا أن نسخة ZNF469 كانت مثيلة m6A بشكل متفاوت وفقا لحالة العدوى، في الواقع لم يتم ميثيل هذا النص في الخلايا غير المصابة بينما عرض العديد من القمم الميثيلية عند الإصابة بفيروس نقص المناعة البشرية (الشكل 5A). وكشف تحليل تفاضلي مماثل للمثيلة على M5C أن نسخة PHLPP1 تحتوي على العديد من المخلفات الميثيلية، والتي تميل إلى أن تكون أكثر تكرارا ميثيلية في حالة فيروس نقص المناعة البشرية (الشكل 5B). وفي هذا السياق، يشير التحليلان إلى أن عدوى فيروس نقص المناعة البشرية تؤثر على الإبترانوسكريبتوم الخلوي.
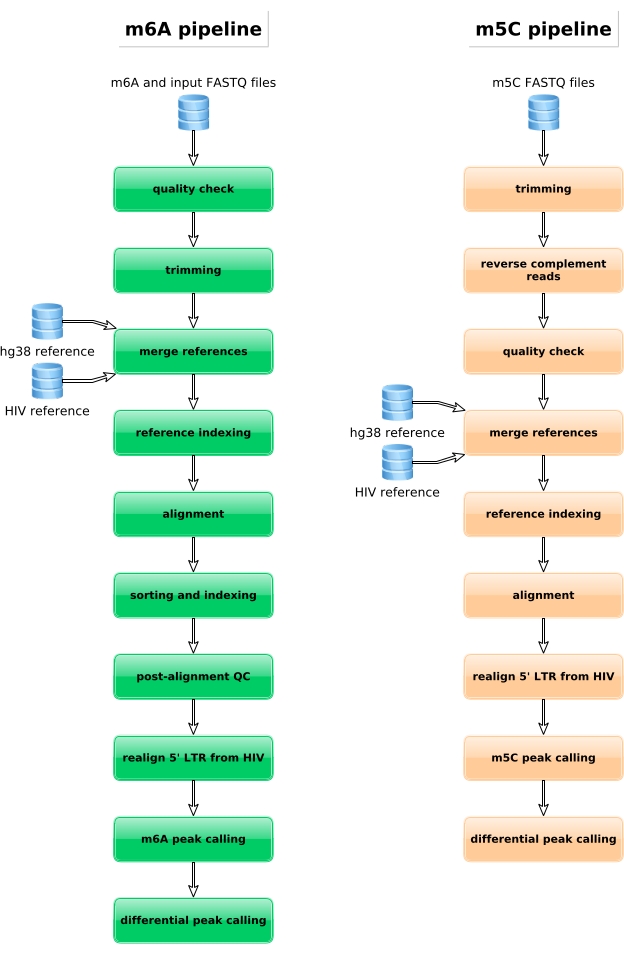
الشكل 4: التمثيل التخطيطي لسير العمل المعلوماتية الحيوية لتحليل بيانات M6A و m5C. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
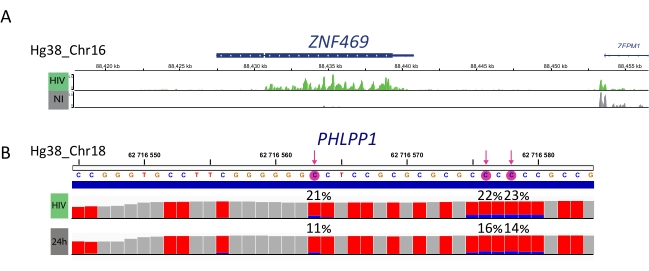
الشكل 5: مثال على النصوص المثيلية التفاضلية عند العدوى. أ) النتيجة التمثيلية التي تظهر ميثيل M6A من ZNF459 نسخة في المصابين بفيروس نقص المناعة البشرية (الأخضر) وغير المصابة (الرمادية) الخلايا. تظهر كثافة الذروة (عند طرح تعبير الإدخال) على المحور ص والموضع في الكروموسوم على طول المحور س. يكشف تحليل الميثيل التفاضلي أن نسخة ZFN469 يتم تضخيمها بشكل مفرط عند الإصابة بفيروس نقص المناعة البشرية. ب) النتيجة التمثيلية للجين المثيل M5C في الخلايا المصابة بفيروس نقص المناعة البشرية (الممر العلوي) وغير المصابة (الممر السفلي). ارتفاع كل شريط يمثل عدد القراءات لكل نيوكليوتيد ويسمح بتقييم التغطية. كل بقايا C ممثلة باللون الأحمر، ونسبة المثيلة C ممثلة باللون الأزرق. يتم الإبلاغ عن معدل الميثيل الدقيق (٪) فوق كل بقايا C. الأسهم تسليط الضوء على ذات دلالة إحصائية مثيلة بشكل متفاوت C. تم تصور عينات باستخدام عارض IGV. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
Discussion
دور تعديلات الحمض النووي الريبي في العدوى الفيروسية لا يزال غير معروف إلى حد كبير. ويمكن أن يسهم فهم أفضل لدور التعديلات العلاجية في سياق العدوى الفيروسية في السعي إلى تحقيق أهداف جديدة للعلاج المضاد للفيروسات.
في هذا العمل، ونحن نقدم سير العمل الكامل الذي يسمح التحقيق في epitranscriptomes M6A و M5C من الخلايا المصابة. اعتمادا على المسألة البيولوجية، ونحن ننصح باستخدام الحمض النووي الريبي متعدد-A-اختيار كمادة البداية. وعلى الرغم من أن خط الأنابيب اختياري، حيث يمكن استخدامه مع إجمالي الحمض النووي الريبي، فمن المهم أن نضع في اعتبارنا أن الحمض النووي الريبي وكذلك الحمض النووي الريبي الصغير معدلان بدرجة عالية ويحتويان على عدد مهم من المخلفات الميثيلية. وقد يؤدي ذلك إلى انخفاض نوعية وكمية بيانات التسلسل المجدية.
ومع ذلك ، إذا كان تركيز الدراسة هو الحمض النووي الريبي غير متعدد adenylated ، ينبغي تكييف خطوة استخراج الحمض النووي الريبي من أجل تجنب التخلص من الحمض النووي الريبي الصغيرة (في حالة استخراج الحمض النووي الريبي القائم على العمود) وامتياز تقنيات استنفاد الريبوسوم بدلا من اختيار البولي ألف لدخول خط الأنابيب.
من أجل ضمان جودة عالية RNA، تجزئة الصحيح ومناسبة M6A المخصب وBS تحويل جودة الحمض النووي الريبي لإعداد المكتبة ننصح بشدة لاستخدام محلل جزء أو محلل حيوي. ومع ذلك، هذه المعدات غير متوفرة دائما. كبديل، يمكن أيضا تقييم جودة الحمض النووي الريبي، ميرنا وحجم الحمض النووي الريبي المجزأة من خلال التصور على هلام الآغاروز. بدلا من ذلك، يمكن إجراء إعداد المكتبة دون تقييم سابق لكمية الحمض النووي الريبي.
استخدمنا تقنية MeRIP-Seq16 المستندة إلى الأجسام المضادة لاستكشاف المناظر الطبيعية epitranscriptomic m6A. وتستند هذه التقنية على الريبي النووي الريبي المناعية وناجحة; ومع ذلك، تحتاج بعض الخطوات التحسين دقيق ويمكن أن تكون حاسمة. على الرغم من أن ميثيل M6A قد وصف بأنه يحدث بشكل رئيسي ضمن تسلسل التوافق RRA * CH ، إلا أن هذا الشعار متكرر للغاية على طول جزيئات مرنا ولا يسمح بتحديد دقيق للموقع الميثيلي. ومن ثم، من الأهمية بمكان تحقيق تجزؤ الحمض النووي الريبي القابل للاستنساخ ومتسق، وتوليد شظايا صغيرة من الحمض النووي الريبي، لتحسين القرار القائم على RIP. في هذا البروتوكول، نوصي بإجراء محسن، يوفر نتائج قابلة للاستنساخ ومتسقة في إطارنا التجريبي؛ ومع ذلك، قد تحتاج هذه الخطوة التجزئة تحسين إضافية وفقا لميزات عينة معينة.
في الآونة الأخيرة تم وصف تقنية جديدة تسمح تسلسل مباشر M6A. وهو يستند إلى استخدام متغيرات محددة للنسخ العكسي التي تعرض توقيعات RT الفريدة كرد على مواجهة تعديل الحمض النووي الريبي M6A24. هذه التكنولوجيا ، عند التحسين الدقيق ، يمكن أن تتحايل على القيود الرئيسية التي تواجهها MeRIP-Seq (تقليل كمية المواد الأولية والسماح بدقة أعلى). لاستكشاف تعديل M5C قررنا استخدام تقنية تحويل بيسلفايت من أجل الكشف في قرار النيوكليوتيدات بقايا C المعدلة. من أجل الحد من معدل إيجابي كاذبة بسبب وجود هياكل ثانوية الجيش الملكي النيبالي، قمنا بإجراء 3 دورات من تحويل التشبع / bisulfite ومزيد من التحكم bisulfite أداء معدل التحويل بفضل استخدام ERCC ارتفاع في الضوابط. أحد القيود المرتبطة بهذه التقنية هو أن تحويل البيسلفيت قاسي للغاية وثلاث دورات من تحويل التشبع / البيسلفيت يمكن أن تتحلل بعض الحمض النووي الريبي وبالتالي تقليل الدقة. ومع ذلك، اخترنا في إطارنا أن نرضى بدقة أقل قليلا من أجل زيادة جودة مجموعة البيانات.
وبفضل هذه التحسينات والضوابط، تمكنا من توفير سير عمل موثوق وسليم يمكن استغلاله للتحقيق في المشهد epitranscriptomic وتغييره في سياق العدوى الفيروسية، والتفاعلات المضيفة الممرضة، أو أي التعرض لعلاجات محددة.
Disclosures
وليس لدى صاحبي البلاغ ما يكشفان عنه.
Acknowledgements
وقد دعمت هذا العمل المؤسسة الوطنية السويسرية للعلوم (المنح 31003A_166412 و314730_188877).
Materials
| Name | Company | Catalog Number | Comments |
| AccuPrime Pfx SuperMix | Invitrogen | 12344-040 | |
| anti-m6A antibody _Clone 17-3-4-1 | Millipore | MABE1006 | |
| Chloroform | Merck | 67-66-3 | |
| ERCC | Invitrogen | 4456740 | |
| EZ RNA Methylation Kit | Zymo Research | EZR5001 | |
| Fragment analyzer RNA Kit - HS RNA Kit | Agilent | DNF-472-0500 | |
| Fragment analyzer RNA Kit - RNA Kit | Agilent | DNF-471-0500 | |
| High-Capacity cDNA Reverse Transcription Kit | Applied Biosystem | 4368814 | |
| Illumina TruSeq Stranded mRNA | Illumina | 20020594 | |
| Magnetic Beads A/G Blend | Merck | 16-663 | |
| N6-Methyladenosine, 5′-monophosphate sodium salt (m6A) | Sigma Aldrich | M2780-10MG | |
| Normal Mouse IgG | Merk | 12371 | |
| Oligo(dT)25 | Life Technologies | 61005, | |
| PCRapace | Stratec | 1020220300 | |
| Quick RNA Viral Kit | Zymo Research | 1034 | |
| RNA Clean & Concentrator | Zymo Research | R1015 | |
| RNA Fragmentation Reagent | Ambion | AM8740 | |
| RNase Inhibitor | Ambion | AM2684 | |
| Trizol | TRIzol Reagent | 15596026 |
References
- Machnicka, M. A., et al. MODOMICS: a database of RNA modification pathways--2013 update. Nucleic Acids Research. 41, 262-267 (2013).
- Zaccara, S., Ries, R. J., Jaffrey, S. R. Reading, writing and erasing mRNA methylation. Nature Reviews Molecular Cell Biology. 20 (10), 608-624 (2019).
- Davalos, V., Blanco, S., Esteller, M. SnapShot: Messenger RNA Modifications. Cell. 174 (2), 498 (2018).
- Saletore, Y., et al. The birth of the Epitranscriptome: deciphering the function of RNA modifications. Genome Biology. 13 (10), 175 (2012).
- Zhao, B. S., Roundtree, I. A., He, C. Post-transcriptional gene regulation by mRNA modifications. Nature Reviews Molecular Cell Biology. 18 (1), 31-42 (2017).
- Netzband, R., Pager, C. T. Epitranscriptomic marks: Emerging modulators of RNA virus gene expression. Wiley Interdisciplinary Reviews: RNA. 11 (3), 1576 (2020).
- Pereira-Montecinos, C., Valiente-Echeverria, F., Soto-Rifo, R. Epitranscriptomic regulation of viral replication. Biochimica et Biophysica Acta. 1860 (4), 460-471 (2017).
- Lichinchi, G., et al. Dynamics of the human and viral m(6)A RNA methylomes during HIV-1 infection of T cells. Nature Microbiology. 1, 16011 (2016).
- Courtney, D. G., et al. Epitranscriptomic Addition of m(5)C to HIV-1 Transcripts Regulates Viral Gene Expression. Cell Host & Microbe. 26 (2), 217-227 (2019).
- Kennedy, E. M., et al. Posttranscriptional m(6)A Editing of HIV-1 mRNAs Enhances Viral Gene Expression. Cell Host & Microbe. 19 (5), 675-685 (2016).
- Tirumuru, N., Wu, L. HIV-1 envelope proteins up-regulate N (6)-methyladenosine levels of cellular RNA independently of viral replication. Journal of Biological Chemistry. 294 (9), 3249-3260 (2019).
- Tirumuru, N., et al. N(6)-methyladenosine of HIV-1 RNA regulates viral infection and HIV-1 Gag protein expression. Elife. 5, (2016).
- Cristinelli, S., Angelino, P., Janowczyk, A., Delorenzi, M., Ciuffi, A. HIV Modifies the m6A and m5C Epitranscriptomic Landscape of the Host Cell. Frontiers in Virology. 1 (11), (2021).
- Khoddami, V., Cairns, B. R. Transcriptome-wide target profiling of RNA cytosine methyltransferases using the mechanism-based enrichment procedure Aza-IP. Nature Protocols. 9 (2), 337-361 (2014).
- Hussain, S., Aleksic, J., Blanco, S., Dietmann, S., Frye, M. Characterizing 5-methylcytosine in the mammalian epitranscriptome. Genome Biology. 14 (11), 215 (2013).
- Dominissini, D., Moshitch-Moshkovitz, S., Salmon-Divon, M., Amariglio, N., Rechavi, G. Transcriptome-wide mapping of N6-methyladenosine by m6A-seq based on immunocapturing and massively parallel sequencing. Nature Protocols. 8 (1), 176-189 (2013).
- Dominissini, D., et al. Topology of the human and mouse m6A RNA methylomes revealed by m6A-seq. Nature. 485 (7397), 201-206 (2012).
- Shobbir Hussain, J. A., Blanco, S., Dietmann, S., Frye, M. Characterizing 5-methylcytosine in the mammalian epitranscriptome. Genome Biology. 14 (215), (2013).
- Amort, T., et al. Distinct 5-methylcytosine profiles in poly(A) RNA from mouse embryonic stem cells and brain. Genome Biology. 18 (1), 1 (2017).
- Endrullat, C., Glökler, J., Franke, P., Frohme, M. Standardization and quality management in next-generation sequencing. Applied & Translational Genomics. 10, 2-9 (2016).
- Schaefer, M., Pollex, T., Hanna, K., Lyko, F. RNA cytosine methylation analysis by bisulfite sequencing. Nucleic Acids Research. 37 (2), 12 (2009).
- Cristinelli, S., Angelino, P., Janowczyk, A., Delorenzi, M., Ciuffi, A. HIV Modifies the m6A and m5C Epitranscriptomic Landscape of the Host Cell. biorxiv. 1 (11), (2021).
- Squires, J. E., et al. Widespread occurrence of 5-methylcytosine in human coding and noncoding RNA. Nucleic Acids Research. 40 (11), 5023-5033 (2012).
- Aschenbrenner, J., et al. Engineering of a DNA Polymerase for Direct m(6) A Sequencing. Angewandte Chemie (International ed. in English). 57 (2), 417-421 (2018).
- Didion, J. P., Martin, M., Collins, F. S. Atropos: specific, sensitive, and speedy trimming of sequencing reads. PeerJ. 5, 3720 (2017).
- Kim, D., Langmead, B., Salzberg, S. L. HISAT: a fast spliced aligner with low memory requirements. Nature Methods. 12 (4), 357-360 (2015).
- Li, H., et al. The Sequence Alignment/Map format and SAMtools. Bioinformatics. 25 (16), 2078-2079 (2009).
- Okonechnikov, K., Conesa, A., García-Alcalde, F. Qualimap 2: advanced multi-sample quality control for high-throughput sequencing data. Bioinformatics. 32 (2), 292-294 (2016).
- Ewels, P., Magnusson, M., Lundin, S., Käller, M. MultiQC: summarize analysis results for multiple tools and samples in a single report. Bioinformatics. 32 (19), 3047-3048 (2016).
- Zhang, Y., et al. Model-based Analysis of ChIP-Seq (MACS). Genome Biology. 9 (9), 137 (2008).
- Martin, M. Cutadapt removes adapter sequences from high-throughput sequencing reads. EMBnet Journal. 17 (1), (2011).
- Shen, W., Le, S., Li, Y., Hu, F. SeqKit: A Cross-Platform and Ultrafast Toolkit for FASTA/Q File Manipulation. PLOS ONE. 11 (10), 0163962 (2016).
- Rieder, D., Amort, T., Kugler, E., Lusser, A., Trajanoski, Z. meRanTK: methylated RNA analysis ToolKit. Bioinformatics. 32 (5), 782-785 (2015).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved