Method Article
Explorando los epitrancrismos de m6A y m5C sobre la infección viral: un ejemplo con el VIH
En este artículo
Resumen
El papel de las modificaciones del ARN en las infecciones virales apenas está comenzando a explorarse y podría resaltar nuevos mecanismos de interacción virus-huésped. En este trabajo, proporcionamos una tubería para investigar las modificaciones de ARN m6A y m5C en el contexto de las infecciones virales.
Resumen
El papel de las modificaciones del ARN en los procesos biológicos ha sido el foco de un número creciente de estudios en los últimos años y se conoce hoy en día como epitranscriptómica. Entre otros, se han descrito modificaciones del ARN de N6-metiladenosina (m6A) y 5-metilcitosina (m5C) en moléculas de ARNm y pueden tener un papel en la modulación de los procesos celulares. La epitranscriptómica es, por lo tanto, una nueva capa de regulación que debe considerarse además de los análisis transcriptómicos, ya que también puede ser alterada o modulada por la exposición a cualquier agente químico o biológico, incluidas las infecciones virales.
Aquí, presentamos un flujo de trabajo que permite analizar el paisaje epitranscriptómico celular y viral conjunto de las marcas m6A y m5C simultáneamente, en células infectadas o no con el virus de la inmunodeficiencia humana (VIH). Tras el aislamiento y la fragmentación del ARNm de células infectadas y no infectadas por el VIH, utilizamos dos procedimientos diferentes: MeRIP-Seq, una técnica basada en la inmunoprecipitación de ARN, para enriquecer fragmentos de ARN que contienen la marca m6A y BS-Seq, una técnica basada en la conversión de bisulfito, para identificar la marca m5C a una resolución de nucleótido único. Tras la captura específica de metilación, las bibliotecas de ARN se preparan para la secuenciación de alto rendimiento. También desarrollamos una línea de bioinformática dedicada para identificar transcripciones diferencialmente metiladas (DM) independientemente de su perfil de expresión basal.
En general, la metodología permite la exploración de múltiples marcas epitranscriptómicas simultáneamente y proporciona un atlas de transcripciones de DM sobre infección viral o cualquier otra perturbación celular. Este enfoque ofrece nuevas oportunidades para identificar nuevos actores y nuevos mecanismos de respuesta celular, como los factores celulares que promueven o restringen la replicación viral.
Introducción
Desde hace tiempo se sabe que las moléculas de ARN pueden modificarse, y hasta la fecha se han descrito más de 150 modificaciones post-transcripcionales1. Consisten en la adición de grupos químicos, principalmente grupos metilo, a prácticamente cualquier posición de los anillos de pirimidina y purina de las moléculas de ARN2. Ya se ha demostrado que tales modificaciones post-transcripcionales están altamente enriquecidas en ARN de transferencia (ARNt) y ARN ribosómico (ARNr) y recientemente también se han descrito en moléculas de ARNm.
El auge de las nuevas tecnologías, como la secuenciación de próxima generación (NGS), y la producción de anticuerpos específicos que reconocen modificaciones químicas definidas permitieron, por primera vez, la investigación de la ubicación y la frecuencia de modificaciones químicas específicas a nivel de transcriptoma. Estos avances han llevado a una mejor comprensión de las modificaciones de ARN y al mapeo de varias modificaciones en moléculas de ARNm3,4.
Mientras que la epigenética investiga el papel de las modificaciones del ADN y las histonas en la regulación del transcriptoma, la epitranscriptómica de manera similar se centra en las modificaciones del ARN y su papel. La investigación de las modificaciones epitranscriptómicas ofrece nuevas oportunidades para destacar nuevos mecanismos de regulación que pueden sintonizar una variedad de procesos celulares (es decir, empalme de ARN, exportación, estabilidad y traducción)5. Por lo tanto, no fue una gran sorpresa que estudios recientes descubrieran muchas modificaciones epitranscriptómicas sobre la infección viral en ARN celulares y virales6. Los virus investigados hasta ahora incluyen virus de ADN y ARN; entre ellos, el VIH puede considerarse como un ejemplo pionero. En conjunto, el descubrimiento de la metilación del ARN en el contexto de las infecciones virales puede permitir la investigación de mecanismos aún no descritos de expresión o replicación viral, proporcionando así nuevas herramientas y dianas para controlarlos7.
En el campo de la epitranscriptómica del VIH, las modificaciones de las transcripciones virales han sido ampliamente investigadas y han demostrado que la presencia de esta modificación fue beneficiosa para la replicación viral8,9,10,11,12,13. Hasta la fecha se pueden utilizar varias técnicas para detectar marcas epitranscriptómicas a nivel de transcriptoma. Las técnicas más utilizadas para la identificación de m6A se basan en técnicas de precipitación inmune como MeRIP-Seq y miCLIP. Mientras que MeRIP-Seq se basa en la fragmentación de ARN para capturar fragmentos que contienen residuos metilados, miCLIP se basa en la generación de mutaciones de firma específicas de anticuerpos α-m6A sobre la reticulación UV arn-anticuerpo, lo que permite un mapeo más preciso.
La detección de la modificación de m5C se puede lograr mediante tecnologías basadas en anticuerpos similares a la detección de m6A (m5C RIP), o mediante conversión de bisulfito o por AZA-IP o por miCLIP. Tanto Aza-IP como m5C miCLIP utilizan una metiltransferasa específica como cebo para atacar el ARN mientras pasan por la metilación del ARN. En Aza-IP, las células diana están expuestas a la 5-azacitidina, lo que resulta en la introducción aleatoria de sitios análogos de citidina 5-azacitidina en el ARN naciente. En miCLIP, la metiltransferasa NSun2 está modificada genéticamente para albergar la mutación C271A14,15.
En este trabajo, nos centramos en la caracterización dual de las modificaciones m6A y m5C en células infectadas, utilizando el VIH como modelo. Tras la optimización metodológica, hemos desarrollado un flujo de trabajo que combina la inmunoprecipitación de ARN metilado (MeRIP) y la conversión de bisulfito de ARN (BS), lo que permite la exploración simultánea de marcas epitranscriptómicas m6A y m5C a nivel de transcriptoma, tanto en contextos celulares como virales. Este flujo de trabajo se puede implementar en extractos de ARN celular, así como en ARN aislado de partículas virales.
El enfoque de Inmunoprecipitación de ARN Metilado (MeRIP)16 que permite la investigación de m6A a nivel de transcriptoma está bien establecido y una serie de anticuerpos específicos de m6A están disponibles comercialmente hasta la fecha17. Este método consiste en la captura selectiva de piezas de ARN que contienen m6A utilizando un anticuerpo específico de m6A. Los dos principales inconvenientes de esta técnica son (i) la resolución limitada, que depende en gran medida del tamaño de los fragmentos de ARN y, por lo tanto, proporciona una ubicación y región aproximadas que contienen el residuo metilado, y (ii) la gran cantidad de material necesario para realizar el análisis. En el siguiente protocolo optimizado, estandarizamos el tamaño del fragmento a aproximadamente 150 nt y redujimos la cantidad de material de partida de 10 μg de ARN seleccionado poli-A, que actualmente es la cantidad recomendada de material de partida, a solo 1 μg de ARN seleccionado poli-A. También maximizamos la eficiencia de recuperación de fragmentos de ARN m6A unidos a anticuerpos específicos utilizando una elución mediante un enfoque de competencia con un péptido m6A en lugar de métodos de elución más convencionales y menos específicos utilizando técnicas basadas en fenol o proteinasa K. La principal limitación de este ensayo basado en RIP, sin embargo, sigue siendo la resolución subóptima que no permite la identificación del nucleótido A modificado con precisión.
El análisis de la marca m5C se puede realizar actualmente utilizando dos enfoques diferentes: un método basado en RIP con anticuerpos específicos de m5C y la conversión de bisulfito de ARN. Como RIP ofrece solo una resolución limitada en la identificación del residuo metilado, utilizamos la conversión de bisulfito que puede ofrecer una resolución de un solo nucleótido. La exposición de ARN al bisulfito (BS) conduce a la desaminación de citosina, convirtiendo así el residuo de citosina en uracilo. Por lo tanto, durante la reacción de conversión de bisulfito de ARN, cada citosina no metilada se desamina y se convierte en uracilo, mientras que la presencia de un grupo metilo en la posición 5 de la citosina tiene un efecto protector, previniendo la desaminación inducida por BS y preservando el residuo de citosina. El enfoque basado en BS permite la detección de un nucleótido modificado m5C a una resolución de base única y la evaluación de la frecuencia de metilación de cada transcripción, proporcionando información sobre la dinámica de modificación de m5C18. Sin embargo, la principal limitación de esta técnica se basa en la tasa de falsos positivos de residuos metilados. De hecho, la conversión de BS es efectiva en ARN monocatenario con residuos de C accesibles. Sin embargo, la presencia de una estructura secundaria de ARN apretada podría enmascarar la posición de N5C y dificultar la conversión de BS, lo que resulta en residuos de C no metilados que no se convierten en residuos de U y, por lo tanto, falsos positivos. Para eludir este problema y minimizar la tasa de falsos positivos, aplicamos 3 rondas de ciclos de desnaturalización y conversión de bisulfito19. También introdujimos 2 controles en las muestras para permitir la estimación de la eficiencia de conversión de bisulfito: incorporamos controles de secuenciación ERCC (secuencias estandarizadas no metiladas y disponibles comercialmente)20, así como ARN poli-A-agotados para evaluar la tasa de conversión de bisulfito por un lado, y para verificar mediante RT-PCR la presencia de un sitio metilado conocido y bien conservado, C4447, en el ARN ribosómico 28S por otro lado21.
En el campo de la virología, el acoplamiento de estos dos métodos de investigación epitranscriptómica con la secuenciación de próxima generación y el análisis bioinformático preciso permite el estudio en profundidad de la dinámica m6A y m5C (es decir, los cambios temporales de modificación del ARN que podrían ocurrir en la infección viral y podrían descubrir una serie de nuevos objetivos terapéuticamente relevantes para uso clínico).
Protocolo
1. Preparación celular
NOTA: Dependiendo del tipo de célula y su contenido de ARN, el número inicial de células puede variar.
- Tener suficientes células para obtener entre 200-500 μg de ARN total o 5-7 μg de ARN poli-A seleccionado. Por ejemplo, 50 x 106 células SupT1 deben producir alrededor de 500 μg de ARN total tras la extracción con reactivos a base de fenol, y por lo tanto se requiere para cada condición individual probada.
- Prepare el número requerido de células de acuerdo con el diseño experimental y, por lo tanto, de acuerdo con el número de afecciones probadas (infección, puntos de tiempo, tratamiento). Si el experimento tiene como objetivo obtener células no infectadas y células infectadas por el VIH a las 24 horas después de la infección, se necesita un total de 100 x 106 células, la mitad para la condición no infectada y la otra mitad para la condición infectada.
2. Extracción de ARN
- De células: extracción de ARN con fenol-cloroformo
- Para cada condición, recolectar células (por ejemplo, 50 x 106) por centrifugación y desechar el sobrenadante.
- Agregue 5 ml de reactivo a base de fenol a cada gránulo de 50 x 106 células y mezcle canalizando hacia arriba y hacia abajo varias veces.
- Incubar durante 5 min a temperatura ambiente para permitir una lisis completa. Las células lisadas pueden almacenarse a -80 °C o procesarse directamente.
NOTA: Si es necesario, las células también se pueden dividir en alícuotas de 10 x 106 células por tubo en tubos de 1,5 ml y lisarse en 1 ml de reactivo a base de fenol para un almacenamiento más conveniente. - Añadir 1 ml de cloroformo y mezclar por inversión.
- Incubar durante 3 min a temperatura ambiente.
- Centrifugadora durante 15 min a 2.000 x g y 4 °C.
- Pipetear la fase acuosa (fase superior) y transferirla a un nuevo tubo. Termine de transferir la fase acuosa inclinando el tubo a 45 ° y canalizando cuidadosamente la solución.
NOTA: La cantidad de fase acuosa puede variar entre las muestras, pero debe estar cerca de la cantidad de cloroformo agregado a la muestra (es decir, 1 ml). ¡No transfiera ninguna capa interfase u orgánica! El uso de tubos de bloqueo de fase o de fabricación de fase puede facilitar este proceso. - Añadir 0,5 ml de isopropanol de grado molecular 100% a la fase acuosa.
- Incubar durante 1 h a -80 °C para permitir la precipitación de ARN.
- Centrifugar durante 10 min a 12.000 x g y 4 °C para granular el ARN precipitado.
- Deseche el sobrenadante y resuspenda el gránulo de ARN en 1 ml de etanol de grado de biología molecular al 75%. Vórtice brevemente.
- Centrifugar durante 5 min a 7.500 x g y 4 °C y desechar el sobrenadante.
- Seque al aire el pellet durante 15 min.
- Resuspend el pellet en 20 μL de agua libre de RNasa y transfiéralo a un nuevo tubo.
- Lave el tubo vacío con 20 μL adicionales de agua para maximizar la recuperación de ARN y acumule con el primer volumen de 20 μL.
- Cuantificar el ARN total con un espectrofotómetro y evaluar la calidad del ARN con un analizador de fragmentos.
- De partículas virales: extracción de ARN con kit de extracción de ARN viral basado en columna
NOTA: La extracción de ARN de partículas virales con reactivo a base de fenol da como resultado un ARN viral de baja calidad y bibliotecas de menor calidad. Por lo tanto, se debe favorecer una extracción de ARN basada en columnas. Los kits de extracción de ARN que utilizan ARN portador para la elución y recuperación de ARN no son apropiados para este procedimiento y deben evitarse. Dado que el ARN del VIH es poliadenilado, la extracción directa de ARN sin aislamiento adicional de ARNm es suficiente para ingresar a las tuberías MeRIP-Seq y BS-Seq. Normalmente, 1-2 ml de sobrenadante viral de células infectadas universalmente debería proporcionar suficiente ARN para realizar todo el flujo de trabajo.- Prepare el tampón agregando 150 μL de beta-mercaptoetanol a 30 ml de tampón de lisis. Reconstituir el Tampón de Lavado Viral agregando 96 mL de etanol 100%.
- Recolectar sobrenadantes que contienen virus y centrifugar para granular los desechos celulares para minimizar la contaminación del ARN celular.
- Transfiera 1 ml de sobrenadante viral a un tubo de 15 ml.
- Agregue 3 ml de tampón de ARN viral a 1 ml de muestra viral y mezcle por vórtice.
- Transfiera 700 μL de muestra en una columna, insertada en un tubo de recolección.
- Centrifugadora durante 2 min a 13.000 x g a temperatura ambiente.
- Descarta el flujo.
- Repita los 3 pasos anteriores hasta que se haya procesado toda la muestra y, por lo tanto, todo el ARN se haya capturado en la columna de matriz basada en sílice.
- Agregue 500 μL de tampón de lavado viral a la columna.
- Centrifugadora durante 1 min a 10.000 x g a temperatura ambiente. Descarta el flujo.
- Agregue 200 μL de tampón de lavado viral a la columna.
- Centrifugadora durante 1 min a 10.000 x g a temperatura ambiente. Descarta el flujo.
- Coloque la columna en un tubo de recolección vacío.
- Centrifugar durante 1 min a 10.000 x g a temperatura ambiente para desechar aún más cualquier contaminante tampón de lavado restante.
- Transfiera cuidadosamente la columna a un tubo de 1,5 ml.
- Añadir 20 μL de agua libre de DNasa/RNasa directamente al centro de la matriz de columna y centrifugar a 10.000 x g durante 30 s a temperatura ambiente.
- Agregue 10 μL adicionales de agua libre de DNasa/RNasa directamente al centro de la matriz de columna y centrífique nuevamente durante 30 s.
- Cuantificar el ARN total con un espectrofotómetro y evaluar la calidad del ARN con un analizador de fragmentos.
NOTA: La extracción de ARN se puede llevar a cabo con cualquier método, si la calidad del ARN recuperado es alta, con un número de integridad / calidad de ARN > 9. El ARN total se puede almacenar a -80 °C hasta su posterior procesamiento.
3. Aislamiento de ARNm por selección de poli-A con Oligo(dT)25
NOTA: Debido a la presencia de ARN ribosómico altamente metilado en extractos celulares, es muy recomendable aislar arn poli-A ya sea por agotamiento de ARNr o preferentemente por selección positiva de poli-A. Este paso es opcional y debe realizarse solo para muestras de ARN celular, para obtener resultados de secuenciación a mayor resolución. Si se analiza la metilación de arnes virales no poliadenilados, favorezca el agotamiento del ARNr en lugar de la selección de poli-A o eventualmente realice el análisis sobre el ARN total.
-
Preparación de perlas para la captura de poli-A
- Resuspend el vial de stock de perlas magnéticas Oligo(dT)25 mediante vórtice durante >30 s.
- Transfiera 200 μL de perlas magnéticas a un tubo de 1,5 ml. Preparar el número de tubos con perlas magnéticas según la cantidad total de muestras de ARN a procesar.
NOTA: Un tubo con 200 μL de solución madre de Dynabead corresponde a 1 mg de perlas y puede acomodar una muestra de 75 μg de ARN total. - Coloque los tubos en un imán durante 1 minuto y deseche el sobrenadante. Retire los tubos del imán.
- Agregue 1 ml de tampón de unión (20 mM Tris-HCl, pH 7.5, 1.0 M LiCl, 2 mM EDTA) y resuspenda por vórtice. Coloque los tubos en el imán durante 1 minuto y deseche el sobrenadante. Retire los tubos del imán. Repetir.
- Resuspend las perlas magnéticas lavadas en 100 μL de Binding Buffer.
-
Preparación total de ARN
- Diluir el ARN total a una concentración final de 0,75 μg/μL con agua libre de RNasa, que corresponde a 75 μg/100 μL.
NOTA: Si el ARN está en una concentración más baja, proceda como se describe a continuación sin modificar los volúmenes. - Alícuota el ARN total en múltiples tubos dispensando 100 μL de muestra de ARN por tubo.
- Agregue 100 μL de tampón de unión a cada muestra de ARN.
- Calentar el ARN total a 65 °C durante 2 min para interrumpir las estructuras secundarias.
- Coloque inmediatamente sobre hielo hasta que esté listo para continuar con el siguiente paso.
NOTA: El tiempo de incubación puede variar según el número de muestras a procesar, pero no debe exceder de 1 h para evitar cualquier degradación del ARN.
- Diluir el ARN total a una concentración final de 0,75 μg/μL con agua libre de RNasa, que corresponde a 75 μg/100 μL.
-
Selección Poly-A
- A cada tubo de ARN (a partir del paso 3.2), agregue 100 μL de perlas magnéticas lavadas (a partir del paso 3.1).
- Mezclar bien mediante pipeteo hacia arriba y hacia abajo y dejar encuadernar en una rueda giratoria a temperatura ambiente durante 15 min.
- Abra todos los tubos, colóquelos en el imán durante 1 minuto y retire cuidadosamente todo el sobrenadante.
- Recuperar el sobrenadante en un nuevo tubo y mantenerlo a un lado para una segunda ronda de captura de ARN (paso 3.3.14), con el fin de mejorar la recuperación final de poli-A.
- Retire el tubo del imán y agregue 200 μL de tampón de lavado (10 mM Tris-HCl, pH 7.5, 0.15 M LiCl, 1 mM EDTA). Mezclar pipeteando cuidadosamente de 4 a 5 veces.
- Coloque el tubo en el imán durante 1 minuto y deseche el sobrenadante.
- Repita el paso de lavado una vez (repita los pasos 3.3.5 y 3.3.6).
- Agregue 20 μL de Tris-HCl 10 mM helado para eluir el ARN poli-A de las perlas.
- Incubar a 80 °C durante 2 min.
- Coloque el tubo en el imán y transfiera rápidamente el sobrenadante que contiene el ARN poli-A a un nuevo tubo libre de RNasa. Coloque el tubo sobre hielo.
- Repita el paso de elución (pasos 3.3.8 a 3.3.10) para aumentar el rendimiento.
- Lave las mismas perlas una vez con 200 μL de tampón de lavado. Mezclar pipeteando cuidadosamente de 4 a 5 veces.
- Coloque en el imán durante 1 minuto y deseche el tampón de lavado.
- Agregue el flujo a través del paso 3.3.4 a las cuentas y repita el procedimiento de enlace a elución (pasos 3.3.2 a 3.3.10). Mantenga los eluidos de ARN en tubos separados por ahora.
NOTA: Opcionalmente, mantenga de nuevo el sobrenadante equivalente al paso 3.3.4 en un tubo nuevo, ya que se puede utilizar como control. Al final del procedimiento, purifique y concentre el ARN por precipitación de etanol o con un método de elección basado en columnas (es decir, ARN limpio y concentrador). Esta muestra corresponde a una muestra de ARN empobrecido de poli-A y puede utilizarse como control para la conversión de bisulfito (paso 8.2.2). - Cuantificar el ARN eluido con un espectrofotómetro y mantener una alícuota de 2 μL para evaluar aún más la calidad del ARN con un analizador de fragmentos.
NOTA: El ARN poli-A se puede almacenar a -80 °C hasta que sea necesario.
4. Flujo de trabajo de ARN
- Divida las muestras de ARN poli-A celular (ARNm) y ARN viral en 2 alícuotas, dedicadas a la respectiva tubería de análisis epitranscriptómico:
i) 5 μg de ARNm celular o 1 μg de ARN viral para MeRIP-Seq y controles de entrada (vaya a los pasos 5 a 7 y 9).
(ii) 1 μg de ARNm celular o 500 ng de ARN viral para BS-Seq (ir a los pasos 8 y 9).
5. Fragmentación del ARN
NOTA: La fragmentación de ARN se lleva a cabo con el reactivo de fragmentación de ARN y está destinada a Muestras de ARN MeRIP-Seq y control. Este es un paso muy importante que requiere una optimización cuidadosa para obtener fragmentos que oscilan entre 100-200 nt.
- Divida el volumen total de ARNm en tubos de PCR de 0,2 ml con 18 μL de ARNm/tubo.
NOTA: Trabaje rápidamente. No trabaje con más de 8 muestras a la vez para tener resultados reproducibles. Ampliar el volumen no garantizará una fragmentación reproducible y uniforme. - Calentar un termociclador a 70 °C.
- Añadir 2 μL de reactivo de fragmentación en el borde de cada tubo de PCR.
- Cierre el tubo y gire hacia abajo (para que el reactivo entre en contacto con el ARN al mismo tiempo para los 8 tubos).
- Incubar las muestras 15 min a 70 °C en el termociclador precalentado.
- Tan pronto como termine la incubación, agregue rápidamente 2 μL de solución Stop en cada tubo.
- Gire hacia abajo y deje reposar sobre hielo hasta que esté listo para continuar con el siguiente paso.
NOTA: El tiempo de incubación puede variar según el número de muestras a procesar, pero no debe exceder de 1 h para evitar cualquier degradación del ARN. - Repita el procedimiento para todas las muestras (si hay más de 8 alícuotas).
- Agrupe los tubos y proceda a la purificación de ARN con un kit de limpieza y concentrador de ARN (paso 6) o cualquier kit personalizado basado en columna para deshacerse de los tampones y recuperar el ARN fragmentado limpio en agua.
6. Purificación de ARN
NOTA: Este paso se puede llevar a cabo mediante precipitación de etanol o con cualquier tipo de método de purificación y concentración de ARN basado en columna (es decir, RNA Clean and Concentrator).
- Eluir o resuspendir el ARN purificado en un volumen total de 50-75 μL de agua libre de DNasa/RNasa.
NOTA: Si se utiliza un método basado en columnas, se recomienda encarecidamente dos rondas de elución para garantizar la máxima recuperación. - Cuantificar el ARNm fragmentado purificado con un espectrofotómetro y evaluar la calidad del ARN con un analizador de fragmentos.
- Mantenga 100 ng de ARNm fragmentado como control de entrada para la preparación y secuenciación de la biblioteca (vaya al paso 9). El ARNm fragmentado restante (mínimo 2,5 μg) se puede utilizar para MeRIP (vaya al paso 7.2).
7. MeRIP
NOTA: Se requiere un mínimo de 2,5 μg de ARNm fragmentado para cada inmunoprecipitación (IP), ya sea utilizando un anticuerpo anti-m6A específico (condición de prueba) o utilizando un anticuerpo anti-IgG (control negativo).
- Preparación de perlas magnéticas para inmunoprecipitación
- Para cada muestra, prepare 4 ml de 1x tampón IP en un nuevo tubo cónico diluyendo 800 μL de tampón IP de ARNm 5x (50 mM Tris-HCl pH 7.4, 750 mM NaCl, 0.5% Igepal CA-630 y agua libre de nucleasa) con 3.2 ml de agua libre de nucleasas.
NOTA: Se necesitan al menos 2 reacciones (una prueba y un control de IgG). - Coloque el tubo sobre hielo.
- Etiquete el número apropiado de tubos de microcentrífuga de 1,5 ml para el número de reacciones IP deseadas:
n tubos (prueba) para anticuerpos anti-m6A.
n tubos (control negativo) para IgG normal de ratón. - Resuspend las perlas magnéticas (por ejemplo, Magna ChIP Protein A/G) invirtiendo y vórtice. No deben ser visibles grupos de cuentas.
- Para cada reacción planificada, transfiera 25 μL de perlas magnéticas a un tubo de microcentrífuga.
- Agregue diez veces más 1x búfer IP (a partir del paso 7.1.1) con respecto al volumen original de perlas utilizadas (es decir, 250 μL de 1 búfer IP por 25 μL de perlas magnéticas).
- Mezcle las cuentas pipeteando suavemente hacia arriba y hacia abajo varias veces para una resuspensión completa.
- Coloque el tubo en el separador magnético durante 1 min.
- Retire y deseche el sobrenadante, asegurándose de no aspirar ninguna perla magnética. Retire el tubo del imán.
- Repita el paso de lavado (pasos 7.1.6 a 7.1.9).
- Resuspend las perlas en 100 μL de 1x IP Buffer por 25 μL de volumen original de perlas magnéticas.
- Añadir 5 μL de anticuerpo (1 μg/μL) por 25 μL de volumen original de perlas magnéticas.
n tubos (prueba) con anticuerpo anti-m6A (clon 17-3-4-1) [1 μg/μL].
n tubos (control negativo) con IgG normal de ratón (1 μg/μL). - Incubar en la rueda giratoria durante 30 min a temperatura ambiente para permitir la conjugación de los anticuerpos con las perlas magnéticas.
- Coloque el tubo en el separador magnético durante 1 min. Deseche el sobrenadante. Retire el tubo del imán y vuelva a suspender la mezcla de anticuerpos y perlas en 100 μL de 1x IP Buffer.
- Para cada muestra, prepare 4 ml de 1x tampón IP en un nuevo tubo cónico diluyendo 800 μL de tampón IP de ARNm 5x (50 mM Tris-HCl pH 7.4, 750 mM NaCl, 0.5% Igepal CA-630 y agua libre de nucleasa) con 3.2 ml de agua libre de nucleasas.
- Inmunoprecipitación de ARN (RIP)
- Preparar 500 μL de mezcla de reacción RIP para cada muestra de ARNm de 2,5 μg de la siguiente manera: 2,5 μg en 100 μL de ARN fragmentado (a partir de la etapa 6.12); 295 μL de agua libre de nucleasas; 5 μL de inhibidor de la RNasa de 40 U/μL; y 100 μL de búfer IP 5x.
- Añadir 500 μL de mezcla de reacción RIP a cada mezcla de anticuerpos y perlas (~100 μL del paso 7.1.14). Mezcle pipeteando suavemente varias veces para resuspendir completamente las cuentas. Colocar sobre hielo.
- Incubar todos los tubos RIP en una rueda giratoria durante 2 horas a 4 °C.
- Centrifugar las reacciones de MeRIP brevemente para hacer girar gotas líquidas desde los lados de la tapa y el tubo. Coloque los tubos en un separador magnético durante 1 min.
- Transfiera el sobrenadante en un nuevo tubo de centrífuga, teniendo cuidado de no perturbar las perlas magnéticas.
NOTA: El flujo se puede mantener como control para verificar la eficiencia de RIP (vaya al paso 7.3.9). - Retire los tubos del imán. Lave las perlas agregando 500 μL de búfer IP frío 1x. Mezcle las cuentas pipeteando suavemente varias veces para resuspendir completamente las cuentas.
- Coloque los tubos en un separador magnético durante 1 minuto y deseche el sobrenadante.
- Repita el procedimiento de lavado (pasos 7.2.6-7.2.7) dos veces para un total de 3 lavados.
- Coloque los tubos sobre hielo e inmediatamente proceda a la elución.
- Elución
- Preparar una solución de 20 mM m6A disolviendo 10 mg de N6-metiladenosina, sal sódica de 5′-monofosfato (m6A) en 1,3 ml de agua libre de nucleasa. Preparar alícuotas de 150 μL y conservar a -20 °C.
- Para cada muestra (prueba y controles): Preparar 225 μL de tampón de elución mezclando los siguientes componentes: 45 μL de 5x IP Buffer, 75 μL de 20 mM m6A, 3,5 μL de inhibidor de la RNasa 40U/μL y 101,5 μL de agua libre de nucleasa.
- Añadir 100 μL de tampón de elución (desde el paso 7.3.2) a las perlas (desde el paso 7.2.9). Mezcle pipeteando suavemente varias veces para resuspendir completamente las cuentas.
- Incubar todos los tubos durante 1 h con agitación continua en un balancín a 4 °C.
- Centrifugar las reacciones RIP brevemente para hacer girar las gotas líquidas de los lados de la tapa y el tubo. Coloque los tubos en un separador magnético durante 1 min.
- Transfiera el sobrenadante que contiene fragmentos de ARN eluidos a un nuevo tubo de microcentrífuga de 1,5 ml. Tenga cuidado de no aspirar las cuentas, ya que aumentará el ruido de fondo.
- Repita los pasos de elución (7.3.3 a 7.3.6) añadiendo de nuevo 100 μL de tampón de elución, incubando 1 h a 4 °C y recogiendo el eluido después de la separación magnética.
- Combine todos los eluidos de la misma muestra (el volumen total de elución debe ser de 200 μL).
- Purificar el ARN eluido y el flujo (opcional, a partir del paso 7.2.5) mediante precipitación de etanol o mediante un método de elección basado en columnas (es decir, ARN Limpio y Concentrador).
- Evalúe la cantidad y calidad de ARN de las muestras fluidas y eluidas con un analizador de fragmentos utilizando un kit de detección de alta sensibilidad. Si la calidad del ARN es satisfactoria, proceda a la preparación de la biblioteca y a la secuenciación de alto rendimiento (paso 9).
NOTA: La cantidad de ARN recuperado en MeRIP es muy baja e imperativamente requiere kits de detección de alta sensibilidad para garantizar la cuantificación. Si no hay un bioanalizador disponible, es posible proceder a ciegas a la preparación de la biblioteca.
8. Conversión de BISULFITO DE ARN
- Control y preparación de reactivos
- Control de pico de mezcla ERCC: Agregue la mezcla ERCC siguiendo las instrucciones del fabricante, que recomiendan la adición de 0.5 μL de mezcla ERCC sin diluir a 500 ng de ARNm. Este control puede ayudar a evaluar la eficiencia de la conversión de bisulfito.
- ESPIGA de ARN empobrecido poli-A (desde el paso 3.3.14) en una proporción 1/1000 (es decir, 500 pg de ARN empobrecido poli-A para 500 ng de ARNm). Esta muestra está enriquecida en ARN ribosómico y, por lo tanto, debe contener el ARNr 28S, un control positivo para la conversión de bisulfito.
NOTA: El ARN total también se puede utilizar como control positivo en lugar del ARN empobrecido de poli-A. - Realice la conversión de bisulfito con un kit de metilación de ARN (por ejemplo, Zymo EZ).
- Tampón de lavado de ARN: Agregue 48 ml de etanol al 100% (o 52 ml de etanol al 95%) a 12 ml de concentrado tampón de lavado de ARN antes de su uso.
- Conversión de bisulfito
NOTA: La conversión de bisulfito se llevó a cabo con un kit de conversión de bisulfito de ARN disponible comercialmente siguiendo el procedimiento del fabricante como se indica a continuación.- En tubos de PCR de 0,2 ml, añadir 1000 ng de ARNm (o entre 300 y 1000 ng). Añadir controles de pico: 1 μL de mezcla ERCC (paso 8.1.1) y 1000 pg de ARN empobrecido poli-A (paso 8.1.2). Volumen completo de hasta 20 μL con agua libre de DNasa/RNasa.
- Agregue 130 μL de reactivo de conversión de ARN a cada muestra de ARN de 20 μL.
- Mezclar la muestra mediante pipeteo hacia arriba y hacia abajo.
- Gire hacia abajo brevemente para asegurarse de que no haya gotas en la tapa o los lados del tubo.
- Coloque los tubos de PCR en un termociclador y realice los siguientes pasos: desnaturalización a 70 °C durante 5 min; conversión a 54 °C durante 45 min; repetir los pasos de desnaturalización y conversión durante un total de 3 ciclos; y luego mantener a 4 °C indefinidamente.
NOTA: Tres ciclos de desnaturalización y conversión de bisulfito aseguran la conversión completa de bisulfito de la muestra. Las muestras pueden almacenarse a -80 °C o procesarse directamente. - Proceda con la desulfonación en columna. Coloque una columna en un tubo de recolección vacío y agregue 250 μL de tampón de unión de ARN a la columna.
- Cargue la muestra (~150 μL del paso 8.2.5) en la columna que contiene el búfer de unión de ARN y mezcle mediante pipeteo hacia arriba y hacia abajo.
- Agregue 400 μL de etanol al 95-100% a la mezcla de tampón de unión de muestra-ARN en la columna. Cierre la tapa e inmediatamente mezcle invirtiendo la columna varias veces.
- Centrífuga a toda velocidad (≥ 10.000 x g) durante 30 s. Descarta el flujo.
- Agregue 200 μL de ARN Wash Buffer a la columna y centrífuga a toda velocidad durante 30 s.
- Añadir 200 μL de tampón de desulfonación de ARN a la columna e incubar a temperatura ambiente durante 30 min. Después de la incubación, centrífuga a toda velocidad durante 30 s. Descarta el flujo.
- Agregue 400 μL de tampón de lavado de ARN a la columna y centrífuga a toda velocidad durante 30 s. Repita el paso de lavado con 400 μL adicionales de RNA Wash Buffer. Descarta el flujo.
- Centrifugar la columna en el tubo de recolección vaciado a toda velocidad durante 2 min. Transfiera la columna a un tubo sin RNasa.
- Añadir ≥ 10 μL de agua libre de DNasa/RNasa directamente a la matriz de la columna e incubar durante 1 min a temperatura ambiente. Centrífuga a toda velocidad durante 30 s.
NOTA: Solemos eluir en un volumen de 20 μL. El ARN eluido se puede utilizar inmediatamente o almacenar a -20 °C durante un máximo de 3 meses. Para el almacenamiento a largo plazo, mantener a -80 °C. - Saque 2,5 μL para la evaluación del analizador de fragmentos de la calidad y cantidad de ARN y proceda a la preparación de la biblioteca y la secuenciación de alto rendimiento (paso 9).
- Tome 4 μL de ARN convertido para el control de la eficiencia de conversión de bisulfito (paso 8.3).
- Control de conversión de bisulfito por RT-PCR
NOTA: Este paso garantiza que la conversión de bisulfito se haya realizado correctamente antes de proceder a la secuenciación. El ARN ribosómico 28S de Homo sapiens se utilizará como control positivo para el análisis de metilación del ARN, ya que el residuo C en la posición 4447 (genbank de acceso # NR_003287) se ha descrito como 100% metilado.
Secuencias de imprimación:
Imprimación H 28SF: 5'-GGGGTTTTAYGATTTTTTTTTGATTTTTTGGG-3'
Imprimación H 28SR: 5'-CCAACTCACRTTCCCTATTAATAAATAAAC-3'- Prepare la mezcla de reacción de transcripción inversa (RT) utilizando un kit de transcripción inversa de CDNA de alta capacidad. Descongele los componentes del kit en hielo y prepare la mezcla maestra RT sobre hielo de la siguiente manera:
4 μL de ARN convertido en bisulfito (a partir del paso 8.2.14):
2 μL de búfer de 10xRT
0,8 μL de mezcla de 25x dNTP [100 mM]
2 μL de 10x RT Random Primers
1 μL de transcriptasa inversa MultiScribe
1 μL de inhibidor de la RNasa
9,2 μL de H2O libre de nucleasa
NOTA: Cada reacción RT debe contener un volumen final de 20 μL en tubos de PCR de 0,2 ml. - Coloque los tubos en el termociclador con el siguiente programa RT: 25 °C durante 10 min; 37 °C durante 120 min; 85 °C durante 5 min; luego a 4 °C indefinidamente.
- Preparar la reacción de PCR para amplificar específicamente el ARNr 28S con una enzima de corrección de PCR. Descongele los componentes del kit en hielo, vórtice suavemente y centrífique brevemente. Prepare la mezcla maestra de PCR sobre hielo o sobre un soporte de placa de metal helado de la siguiente manera:
0,6 μL de imprimación 10 μM H 28SF
0,6 μL de imprimación 10 μM H 28SF
6,5 μL de CDNA de plantilla
22,5 μL de mezcla maestra de ADN polimerasa
NOTA: Cada reacción de PCR debe contener un volumen final de 20 μL en tubos de PCR de 0,2 ml. - Coloque los tubos en el termociclador con el siguiente programa de PCR: desnaturalización inicial a 95 °C durante 5 min; 45 ciclos de desnaturalización (95 °C durante 15 s), recocido (57 °C durante 30 s) y elongación (72 °C durante 15 s), elongación final a 72 °C durante 10 min, y luego mantener a 4 °C indefinidamente.
- Ejecute 10 μL de la reacción en un gel de agarosa al 2%. El tamaño de banda esperado es de 130 - 200 pb.
- Prepare la mezcla de reacción de transcripción inversa (RT) utilizando un kit de transcripción inversa de CDNA de alta capacidad. Descongele los componentes del kit en hielo y prepare la mezcla maestra RT sobre hielo de la siguiente manera:
- Secuenciación de productos de PCR
- Purificar los productos de PCR con un método de elección basado en columnas para eliminar enzimas y residuos de dNTP y eluir el ADN amplificado en al menos 20 μL de agua libre de DNasa/RNasa.
- Cuantificar el ADN purificado con espectrofotómetro.
- Reacción de secuenciación
- Utilice 40 ng de producto de PCR/reacción de secuenciación.
- Secuencia en ambas direcciones con los cebadores H 28SF y H 28SR.
- Alinear las secuencias con la secuencia conocida no convertida (28S ribosómico N5 (RNA28SN5). Compruebe la presencia de un residuo C en la posición C4447 y de residuos T en lugar de C en otro lugar.
9. Preparación de bibliotecas y secuenciación de alto rendimiento
- Prepare bibliotecas para la secuenciación utilizando kits de ARNm (por ejemplo, Illumina TruSeq Stranded), iniciando el protocolo en el paso Elute-Prime-Fragment y siguiendo las instrucciones del fabricante.
- Sin embargo, para las muestras de entrada RNA-Seq y MeRIP-Seq, incube las muestras a 80 °C durante 2 minutos para cebarlas solo pero no fragmentarlas más.
- Realizar secuenciación utilizando plataformas Illumina. Las reacciones de secuenciación se pueden llevar a cabo de acuerdo con las preferencias y el diseño experimental, ya sea de extremos simples o pareados, con una longitud mínima de 100 nt.
10. Análisis bioinformáticos
- m6A Procesamiento de datos
- Ejecute FASTQC24 para evaluar la calidad de lectura en m6A e ingrese archivos FASTQ desde la secuenciación.
- Ejecute Atropos25 para recortar secuencias de extremos y adaptadores de baja calidad de las lecturas. Establezca los siguientes parámetros en la ejecución de Atropos.
- Extraiga las siguientes secuencias de adaptadores: AGATCGGAAGAG, CTCTTCCGATCT, AACACTCTTTCCCT, AGATCGGAAGAGCG, AGGGAAAGAGTGTT, CGCTCTTCCGATCT.
- Utilice el siguiente límite de calidad Phred: 5, para recortar extremos de baja calidad según lo especificado por el fabricante (https://support.illumina.com/downloads/illumina-adapter-sequences-document-1000000002694.html).
- Utilice la siguiente longitud mínima de lectura después del recorte: 25 pares de bases.
- Fusionar el genoma humano GRh38 y la referencia VIH [Integrated linear pNL4-3Env-GFP] en formato FASTA.
- Indexe la referencia fusionada con HISAT226.
- Ejecute HISAT2 en lecturas recortadas para alinearlas con la referencia indexada. Utilice los parámetros HISAT predeterminados.
- Ordene e indexe las lecturas alineadas con SAMtools27.
- Ejecute SAMtools stat y Qualimap 228, para la comprobación de calidad posterior a la alineación de las bibliotecas secuenciadas.
- Opcionalmente, recopile y resuma las medidas de calidad del paso anterior con multiQC29.
- El genoma del VIH tiene secuencias homólogas de 634 pb en la LTR de 5' y la LTR de 3': reasignar lecturas de multimapeo de 5' LTR a la región correspondiente de 3' LTR con SAMtools.
- Para identificar los picos m6A, ejecute el software de llamadas pico MACS230 (v 2.1.2). Seleccione cuidadosamente los parámetros de ejecución de MACS2, con el fin de garantizar el correcto funcionamiento de los datos de RNA-Seq, ya que la llamada máxima puede verse afectada por el nivel de expresión génica, y los exones cortos pueden llamarse erróneamente picos. Por lo tanto, la señal de entrada debe restarse de la señal m6A, sin el suavizado aplicado rutinariamente por MACS2 a los datos basados en ADN. Aplique los siguientes parámetros al subcomando 'callpeak' de MACS2:
-keep-dup auto (controla el comportamiento de MACS2 hacia lecturas duplicadas, 'auto' permite a MACS calcular el número máximo de lecturas en la misma ubicación exacta basada en la distribución binomial utilizando 1e-5 como punto de corte de valor p)
-g 2.7e9 (tamaño del genoma humano en pb)
-q 0.01 (corte mínimo de FDR para llamar picos significativos)
-nomodel (para evitar la construcción del modelo de desplazamiento, que se adapta a los experimentos ChIP-Seq)
-slocal 0
-llocal 0 (establecer este y el parámetro anterior en 0 permite a MACS2 restar directamente, sin suavizar, las lecturas de entrada de las lecturas m6A)
-extsize 100 (longitud media de fragmentos en bp)
-B - Ejecute el subcomando de llamada de pico diferencial de MACS2, 'bdgdiff' para comparar muestras infectadas vs no infectadas. 'bdgdiff' toma como entradas los archivos bedGraph generados por 'callpeak' en el paso anterior. Para cada punto de tiempo, ejecute la comparación de muestras infectadas versus no infectadas con 'bdgdiff', restando la señal de entrada respectiva de la señal m6A y proporcionando los parámetros adicionales: -g 60 -l 120.
- m5C Procesamiento de datos
- Ejecute Cutadapt31 para recortar las secuencias del adaptador a partir de las lecturas sin procesar, con los siguientes parámetros:
adaptador "AGATCGGAAGAGCACACGTCTGAAC"
-longitud mínima=25. - Complementar inversamente las lecturas recortadas usando seqkit32, ya que el protocolo de secuenciación produce lecturas de la hebra inversa.
- Ejecute FastQC para examinar la calidad de lectura.
- Fusionar el genoma humano de GRh38 y la referencia del VIH [Integrated linear pNL4-3Env-GFP] en formato FASTA.
- Indexe la referencia combinada con la aplicación meRanGh desde el paquete meRanTK33.
- Alinear con meRanGh con los siguientes parámetros:
-ONU que permite que las lecturas no asignadas se escriban en los archivos de salida
-MM que permite escribir lecturas multiasignadas en el archivo de salida
-bg para salida en bedGraph
-mbgc 10 filtrar la región reportada por cobertura (al menos 10 lecturas de cobertura) - El genoma del VIH tiene secuencias homólogas de 634 pb en la LTR de 5' y ltR de 3': realinea las lecturas multimapeo de 5' LTR a la región correspondiente de 3' LTR con SAMtools.
- Ejecute llamadas de metilación a través de la herramienta meRanCall, proporcionada por meRanTK, con los siguientes parámetros:
-rl = 126, longitud de lectura
-ei = 0,1, intervalo de error para el cálculo del valor p de la tasa de metilación
-cr = 0,99, conversión esperada - Ejecute el estimateSizeFactors.pl de utilidad de MeRanTK para estimar los factores de tamaño de cada muestra. Los factores de tamaño se utilizarán como parámetros en el siguiente paso.
- Ejecute MeRanCompare para el análisis de metilación diferencial de no infectados vs infectados en los puntos de tiempo 12, 24 y 36h. Se aplican los siguientes parámetros: un valor de significación de .01 como umbral mínimo para los factores de informe y tamaño del paso anterior.
- Ejecute Cutadapt31 para recortar las secuencias del adaptador a partir de las lecturas sin procesar, con los siguientes parámetros:
Resultados
Este flujo de trabajo ha demostrado ser útil para investigar el papel de la metilación de m6A y m5C en el contexto de la infección por VIH. Para esto, utilizamos un modelo de línea de células T CD4 + (SupT1) que infectamos con VIH o dejamos sin tratar. Comenzamos el flujo de trabajo con 50 millones de células por condición y obtuvimos un promedio de 500 μg de ARN total con un número de calidad de ARN de 10 (Figura 1A-B). Tras la selección de poli-A se recuperaron entre 10 y 12 μg de ARNm por condición (lo que representa aproximadamente el 2% del ARN total) (Figura 1B). En este punto, utilizamos 5 μg de ARN seleccionado poli-A para la tubería MeRIP-Seq y 1 μg para la tubería BS-Seq. Dado que el ARN del VIH está poliadenilado, no se necesita ninguna acción adicional y los procedimientos MeRIP-Seq y BS-Seq se pueden aplicar directamente.
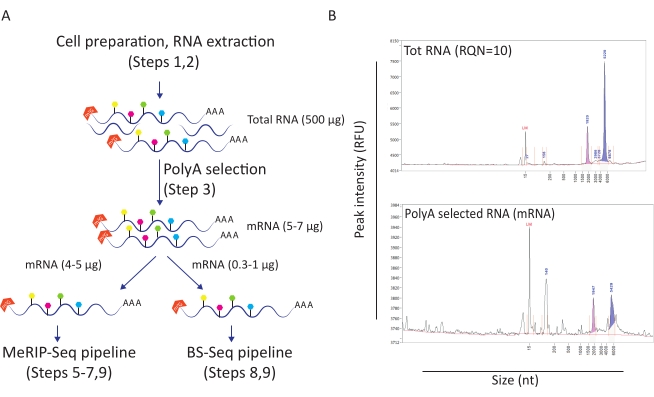
Figura 1: Preparación de ARN para aplicaciones posteriores. A) Flujo de trabajo que representa la preparación y distribución de ARN para tuberías simultáneas MeRIP-Seq y BS-Seq. Cada forma hexagonal rellena representa un tipo de modificación de ARN, como m6A (verde) o m5C (rosa). Se indican las cantidades de material de ARN necesarias para llevar a cabo el experimento. B) Resultados representativos que representan los perfiles de distribución de ARN esperados (tamaño y cantidad) en la extracción total de ARN (panel superior) y la selección de poli-A (panel inferior). Las muestras se cargaron en el analizador de fragmentos con un kit de sensibilidad estándar para evaluar la calidad del ARN antes de ingresar a procedimientos específicos de MeRIP-Seq y BS-Seq. RQN: número de calidad de ARN; nt: nucleótidos. Haga clic aquí para ver una versión más grande de esta figura.
La tubería MeRIP-Seq es una técnica basada en la inmunoprecipitación de ARN que permite la investigación de la modificación de m6A a lo largo de las moléculas de ARN. Para esto, el ARN se fragmenta primero y luego se incuba con anticuerpos específicos de m6A acoplados a perlas magnéticas para la inmunoprecipitación y captura. Los fragmentos de ARN enriquecidos con MeRIP y la fracción intacta (entrada) se secuencian y comparan para identificar regiones de ARN modificadas con m6A y, por lo tanto, transcripciones metiladas con m6A (Figura 2A). La resolución de la técnica se basa en la eficiencia de la fragmentación del ARN. De hecho, los fragmentos más cortos permiten una localización más precisa del residuo m6A. Aquí, los ARN celulares seleccionados poli-A y los ARN virales se sometieron a fragmentación basada en iones con tampón de fragmentación de ARN durante 15 min en un volumen final de 20 μL para obtener fragmentos de ARN de 100-150 nt. A partir de 5 μg de ARNm, recuperamos 4,5 μg de ARN fragmentado, lo que corresponde a una tasa de recuperación del 90% (Figura 2B). Utilizamos 100 ng de ARN fragmentado y purificado como control de entrada, sometido directamente a la preparación y secuenciación de la biblioteca. El ARN restante (~4,4 μg) se procesó de acuerdo con la tubería MeRIP-Seq, que comienza con la incubación de ARN fragmentado con perlas unidas a anticuerpos específicos anti-m6A o a anticuerpos anti-IgG como control. El RIP específico de m6A (MeRIP) de 2,5 μg de ARN fragmentado permitió recuperar alrededor de 15 ng de material enriquecido con m6A que se sometió a preparación y secuenciación de bibliotecas (Figura 2B). Rip con control anti-IgG, como se esperaba, no produjo suficiente ARN para permitir un análisis adicional (Figura 2B).
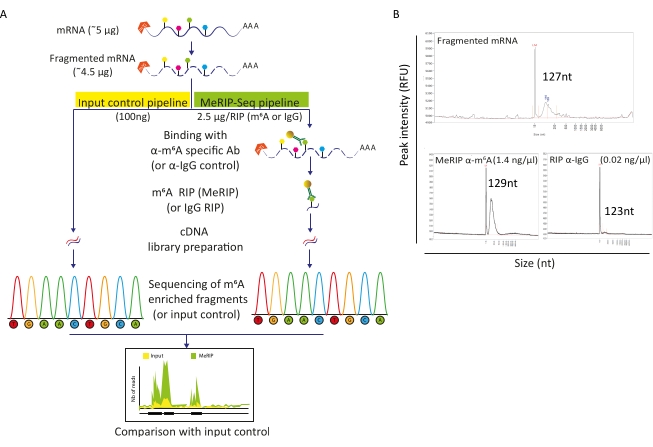
Figura 2: Canalización MeRIP-Seq. A) Representación esquemática del flujo de trabajo MeRIP-Seq y control de entrada. Tras la selección de poli-A, las muestras se fragmentaron en piezas de 120-150 nt y, ya sea directamente sometidas a secuenciación (100 ng, control de entrada), o utilizadas para inmunoprecipitación de ARN (2,5 μg, RIP) con anticuerpos específicos anti-m6A o anticuerpos anti-IgG como control negativo antes de la secuenciación. B) Resultados representativos que muestran perfiles de distribución de ARN esperados (tamaño y cantidad) sobre fragmentación (panel superior) y RIP (paneles inferiores, MeRIP: izquierda, control IgG: derecha). Las muestras se cargaron en el analizador de fragmentos para evaluar la calidad y la concentración de ARN antes de su posterior procesamiento para la preparación y secuenciación de la biblioteca. El análisis de ARN fragmentado se realizó utilizando el kit de sensibilidad estándar de ARN, mientras que el ARN inmunoprecipitado utilizó el kit de alta sensibilidad. Haga clic aquí para ver una versión más grande de esta figura.
La tubería BS-Seq permite la exploración de la modificación del ARN m5C a resolución de nucleótidos y conduce a la identificación de transcripciones metiladas m5C. Tras la conversión de bisulfito, las citosinas no metiladas se convierten en uracilo, mientras que las citosinas metiladas permanecen sin cambios (Figura 3A). Debido a las duras condiciones del procedimiento de conversión de bisulfito (es decir, alta temperatura y bajo pH), los ARNm convertidos están altamente degradados (Figura 3B), sin embargo, esto no interfiere con la preparación y secuenciación de la biblioteca. La conversión de bisulfito es eficiente solo en ARN de cadena simple y, por lo tanto, puede verse obstaculizada potencialmente por estructuras secundarias de ARN de doble cadena. Para evaluar la eficiencia de la conversión C-U se introdujeron dos controles. Como control positivo, aprovechamos la presencia previamente descrita de una citosina altamente metilada en la posición C4447 del ARNr 28S23. Tras la amplificación y secuenciación por RT-PCR de un fragmento de 200 pb que rodea el sitio metilado, pudimos observar que todas las citosinas se convirtieron con éxito en uracilos, apareciendo así como timidinas en la secuencia de ADN, excepto la citosina en la posición 4447 que permaneció sin cambios. Como control de la tasa de conversión de bisulfito, utilizamos secuencias de ARN ERCC sintéticas disponibles comercialmente. Esta mezcla consiste en un conjunto de secuencias de ARN conocidas, no metiladas y poliadeniladas, con una variedad de estructuras secundarias y longitudes. Tras la preparación y secuenciación de la biblioteca, nos centramos en estas secuencias ERCC para calcular la tasa de conversión, que se puede realizar contando el número de C convertidos entre los residuos C totales en todas las secuencias ERCC y en cada muestra. Obtuvimos una tasa de conversión del 99,5%, confirmando la eficiencia y el éxito de la reacción de conversión de bisulfito (Figura 3D).
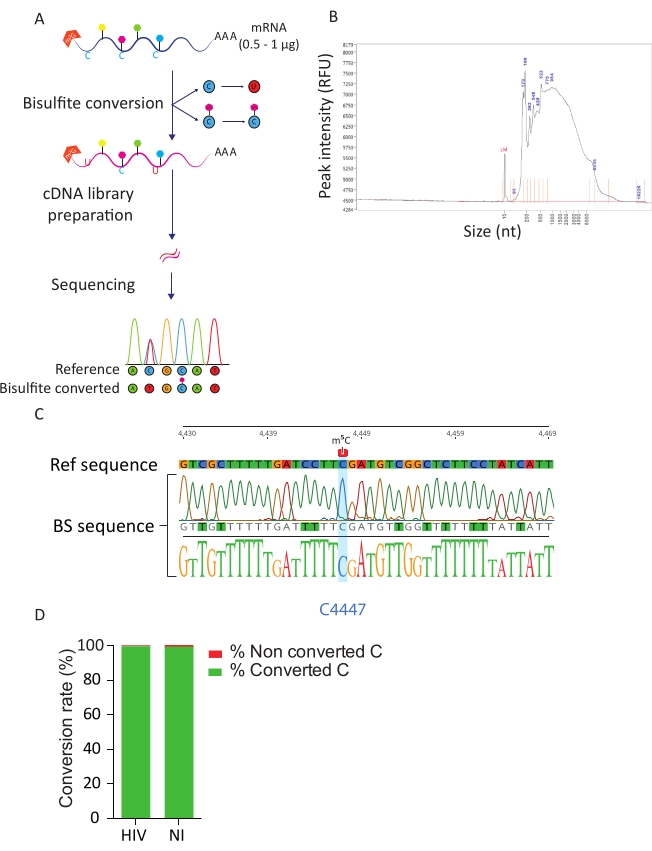
Figura 3: Tubería BS-Seq. A) Representación esquemática del flujo de trabajo de BS-Seq. Tras la selección de poli-A, las muestras se exponen al bisulfito, lo que resulta en la conversión de C a U (debido a la desaminación) para residuos de C no metilados. Por el contrario, los residuos de C metilado (m5C) no se ven afectados por el tratamiento con bisulfito y permanecen sin cambios. B) Resultado representativo del perfil de distribución de ARN convertido en bisulfito (tamaño y cantidad) tras el análisis en el analizador de fragmentos con un kit de sensibilidad estándar. C) Electroferograma que muestra el resultado de secuenciación representativo del amplicón RT-PCR de la región que rodea el C 100% metilado en la posición 4447 en el ARNr 28S (resaltado en azul). Por el contrario, los residuos de C de la secuencia de referencia se identificaron como residuos T en la secuencia de amplicón debido al éxito de la conversión de bisulfito. D) Evaluación de la tasa de conversión de C-U mediante el análisis de secuencias de picos de ERCC en células infectadas y no infectadas por el VIH. La tasa de conversión media es del 99,5%. Haga clic aquí para ver una versión más grande de esta figura.
Las muestras enriquecidas con M6A, las muestras convertidas en bisulfito y los controles de entrada se procesan para la preparación de la biblioteca, la secuenciación y el análisis bioinformático (Figura 4). De acuerdo con el diseño experimental y la(s) pregunta(s) biológica(s) abordada(s), se pueden aplicar múltiples análisis bioinformáticos. Como prueba de principio aquí, mostramos resultados representativos de una aplicación potencial (es decir, el análisis de metilación diferencial), que se centra en la identificación de transcripciones diferencialmente metiladas inducidas por la infección por VIH. Brevemente, investigamos el nivel de metilación m6A o m5C de las transcripciones, independientemente de su nivel de expresión génica, tanto en células no infectadas como infectadas por el VIH, con el fin de comprender mejor el papel de las metilaciones de ARN durante el ciclo de vida viral. Tras la normalización de la expresión génica, identificamos que la transcripción ZNF469 estaba diferencialmente metilada por m6A de acuerdo con el estado de la infección, de hecho, esta transcripción no estaba metilada en células no infectadas, mientras que mostraba varios picos metilados en la infección por VIH (Figura 5A). Un análisis de metilación diferencial similar en m5C reveló que la transcripción de PHLPP1 contenía varios residuos metilados, que tienden a ser metilados con mayor frecuencia en la condición de VIH (Figura 5B). En este contexto, ambos análisis sugieren que la infección por VIH afecta al epitranscriptoma celular.
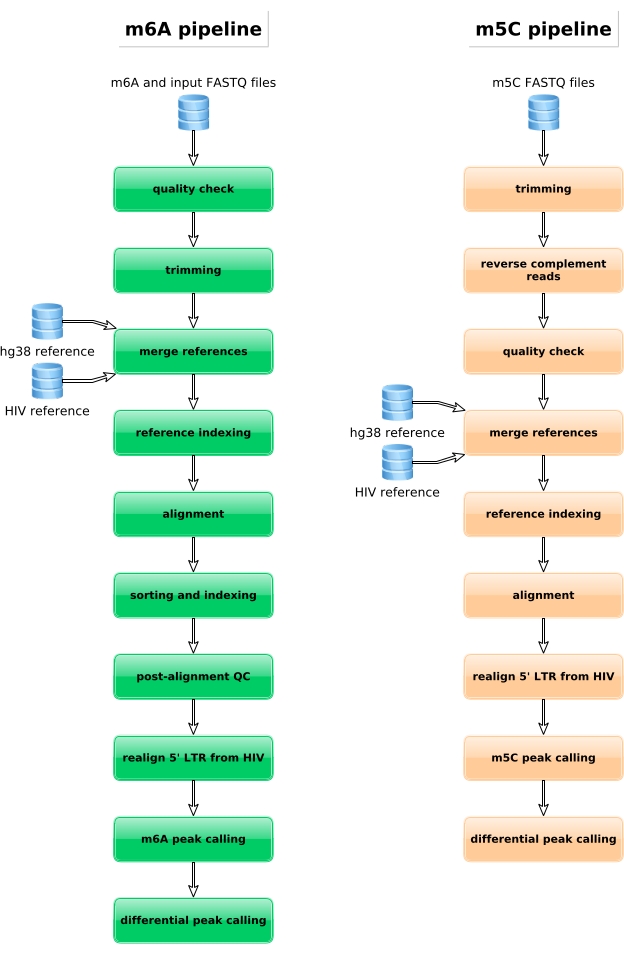
Figura 4: Representación esquemática del flujo de trabajo bioinformático para el análisis de datos m6A y m5C. Haga clic aquí para ver una versión más grande de esta figura.
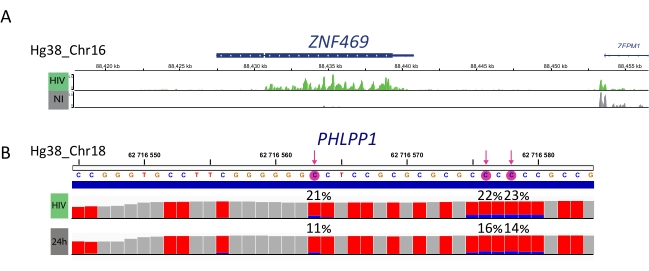
Figura 5: Ejemplo de transcripciones diferencialmente metiladas tras la infección. A) Resultado representativo que muestra la metilación m6A de la transcripción de ZNF459 en células infectadas por VIH (verdes) y no infectadas (grises). La intensidad máxima (tras la sustracción de la expresión de entrada) se muestra en el eje y y la posición en el cromosoma a lo largo del eje x. El análisis de metilación diferencial revela que la transcripción de ZFN469 está hipermetilada tras la infección por VIH. B) Resultado representativo del gen metilado m5C en células infectadas por VIH (carril superior) y no infectadas (carril inferior). La altura de cada barra representa el número de lecturas por nucleótido y permite la evaluación de la cobertura. Cada residuo de C se representa en rojo, y la proporción de C metilado se representa en azul. La tasa exacta de metilación (%) se informa por encima de cada residuo de C. Las flechas resaltan C diferencialmente metilada estadísticamente significativa. Las muestras se visualizaron utilizando el visor IGV. Haga clic aquí para ver una versión más grande de esta figura.
Discusión
El papel de las modificaciones del ARN en la infección viral aún se desconoce en gran medida. Una mejor comprensión del papel de las modificaciones epitranscriptómicas en el contexto de la infección viral podría contribuir a la búsqueda de nuevos objetivos de tratamiento antiviral.
En este trabajo, proporcionamos un flujo de trabajo completo que permite la investigación de los epitranscriptomas m6A y m5C de las células infectadas. Dependiendo de la cuestión biológica, aconsejamos utilizar ARN seleccionado poli-A como material de partida. Aunque es opcional, ya que la tubería podría usarse con ARN total, es importante tener en cuenta que los ARNr, así como los ARN pequeños, están altamente modificados y contienen un número importante de residuos metilados. Esto podría resultar en una disminución de la calidad y cantidad de datos de secuenciación significativos.
Sin embargo, si el enfoque del estudio es el ARN no poliadenilado, la etapa de extracción de ARN debe adaptarse para evitar descartar el ARN pequeño (en caso de extracción de ARN basado en columna) y para privilegiar las técnicas de agotamiento de ribosomas en lugar de la selección de poli-A para ingresar a la tubería.
Con el fin de garantizar un ARN de alta calidad, una fragmentación correcta y una calidad adecuada de ARN enriquecido con m6A y convertido en BS para la preparación de la biblioteca, recomendamos encarecidamente utilizar un analizador de fragmentos o un bioanalizador. Sin embargo, este equipo no siempre está disponible. Como alternativa, la calidad del ARN, el ARNm y el tamaño del ARN fragmentado también podrían evaluarse mediante visualización en gel de agarosa. Alternativamente, la preparación de la biblioteca se puede realizar sin una evaluación previa de la cantidad de ARN.
Utilizamos la técnica MeRIP-Seq16 basada en anticuerpos para explorar el panorama epitranscriptómico m6A. Esta técnica se basa en la inmunoprecipitación de ARN y tiene éxito; sin embargo, algunos pasos necesitan una optimización cuidadosa y pueden ser críticos. Aunque se ha descrito que la metilación m6A ocurre principalmente dentro de la secuencia de consenso RRA*CH, este motivo es muy frecuente a lo largo de las moléculas de ARNm y no permite la identificación precisa del sitio metilado. Por lo tanto, es fundamental lograr una fragmentación de ARN reproducible y consistente, generando pequeños fragmentos de ARN, para mejorar la resolución basada en RIP. En este protocolo, recomendamos un procedimiento optimizado, proporcionando resultados reproducibles y consistentes en nuestro entorno experimental; sin embargo, este paso de fragmentación puede necesitar una mayor optimización de acuerdo con características de muestra específicas.
Recientemente se describió una nueva técnica que permite la secuenciación directa m6A. Se basa en el uso de variantes específicas de transcriptasa inversa que exhiben firmas RT únicas como respuesta a la modificación del ARN m6A encontrada24. Esta tecnología, tras una cuidadosa optimización, podría eludir la principal limitación que enfrenta MeRIP-Seq (disminuir la cantidad de material inicial y permitir una mayor resolución). Para explorar la modificación m5C decidimos utilizar la técnica de conversión de bisulfito para detectar a resolución de nucleótidos los residuos de C modificados. Con el fin de reducir la tasa de falsos positivos debido a la presencia de estructuras secundarias de ARN, realizamos 3 ciclos de desnaturalización/ conversión de bisulfito y controlamos aún más el rendimiento de la tasa de conversión de bisulfito gracias al uso de controles de pico ERCC. Una de las limitaciones relacionadas con esta técnica es que la conversión de bisulfito es muy dura y tres ciclos de desnaturalización / conversión de bisulfito podrían degradar parte del ARN y, por lo tanto, reducir la resolución. Sin embargo, en nuestra configuración, elegimos conformarnos con una resolución potencialmente ligeramente más baja para aumentar la calidad del conjunto de datos.
Gracias a estas optimizaciones y controles, pudimos proporcionar un flujo de trabajo confiable y sólido que puede ser explotado para investigar el panorama epitranscriptómico y su alteración en el contexto de infecciones virales, interacciones huésped-patógeno o cualquier exposición a tratamientos específicos.
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Este trabajo fue apoyado por la Fundación Nacional Suiza para la Ciencia (subvenciones 31003A_166412 y 314730_188877).
Materiales
| Name | Company | Catalog Number | Comments |
| AccuPrime Pfx SuperMix | Invitrogen | 12344-040 | |
| anti-m6A antibody _Clone 17-3-4-1 | Millipore | MABE1006 | |
| Chloroform | Merck | 67-66-3 | |
| ERCC | Invitrogen | 4456740 | |
| EZ RNA Methylation Kit | Zymo Research | EZR5001 | |
| Fragment analyzer RNA Kit - HS RNA Kit | Agilent | DNF-472-0500 | |
| Fragment analyzer RNA Kit - RNA Kit | Agilent | DNF-471-0500 | |
| High-Capacity cDNA Reverse Transcription Kit | Applied Biosystem | 4368814 | |
| Illumina TruSeq Stranded mRNA | Illumina | 20020594 | |
| Magnetic Beads A/G Blend | Merck | 16-663 | |
| N6-Methyladenosine, 5′-monophosphate sodium salt (m6A) | Sigma Aldrich | M2780-10MG | |
| Normal Mouse IgG | Merk | 12371 | |
| Oligo(dT)25 | Life Technologies | 61005, | |
| PCRapace | Stratec | 1020220300 | |
| Quick RNA Viral Kit | Zymo Research | 1034 | |
| RNA Clean & Concentrator | Zymo Research | R1015 | |
| RNA Fragmentation Reagent | Ambion | AM8740 | |
| RNase Inhibitor | Ambion | AM2684 | |
| Trizol | TRIzol Reagent | 15596026 |
Referencias
- Machnicka, M. A., et al. MODOMICS: a database of RNA modification pathways--2013 update. Nucleic Acids Research. 41, 262-267 (2013).
- Zaccara, S., Ries, R. J., Jaffrey, S. R. Reading, writing and erasing mRNA methylation. Nature Reviews Molecular Cell Biology. 20 (10), 608-624 (2019).
- Davalos, V., Blanco, S., Esteller, M. SnapShot: Messenger RNA Modifications. Cell. 174 (2), 498 (2018).
- Saletore, Y., et al. The birth of the Epitranscriptome: deciphering the function of RNA modifications. Genome Biology. 13 (10), 175 (2012).
- Zhao, B. S., Roundtree, I. A., He, C. Post-transcriptional gene regulation by mRNA modifications. Nature Reviews Molecular Cell Biology. 18 (1), 31-42 (2017).
- Netzband, R., Pager, C. T. Epitranscriptomic marks: Emerging modulators of RNA virus gene expression. Wiley Interdisciplinary Reviews: RNA. 11 (3), 1576 (2020).
- Pereira-Montecinos, C., Valiente-Echeverria, F., Soto-Rifo, R. Epitranscriptomic regulation of viral replication. Biochimica et Biophysica Acta. 1860 (4), 460-471 (2017).
- Lichinchi, G., et al. Dynamics of the human and viral m(6)A RNA methylomes during HIV-1 infection of T cells. Nature Microbiology. 1, 16011 (2016).
- Courtney, D. G., et al. Epitranscriptomic Addition of m(5)C to HIV-1 Transcripts Regulates Viral Gene Expression. Cell Host & Microbe. 26 (2), 217-227 (2019).
- Kennedy, E. M., et al. Posttranscriptional m(6)A Editing of HIV-1 mRNAs Enhances Viral Gene Expression. Cell Host & Microbe. 19 (5), 675-685 (2016).
- Tirumuru, N., Wu, L. HIV-1 envelope proteins up-regulate N (6)-methyladenosine levels of cellular RNA independently of viral replication. Journal of Biological Chemistry. 294 (9), 3249-3260 (2019).
- Tirumuru, N., et al. N(6)-methyladenosine of HIV-1 RNA regulates viral infection and HIV-1 Gag protein expression. Elife. 5, (2016).
- Cristinelli, S., Angelino, P., Janowczyk, A., Delorenzi, M., Ciuffi, A. HIV Modifies the m6A and m5C Epitranscriptomic Landscape of the Host Cell. Frontiers in Virology. 1 (11), (2021).
- Khoddami, V., Cairns, B. R. Transcriptome-wide target profiling of RNA cytosine methyltransferases using the mechanism-based enrichment procedure Aza-IP. Nature Protocols. 9 (2), 337-361 (2014).
- Hussain, S., Aleksic, J., Blanco, S., Dietmann, S., Frye, M. Characterizing 5-methylcytosine in the mammalian epitranscriptome. Genome Biology. 14 (11), 215 (2013).
- Dominissini, D., Moshitch-Moshkovitz, S., Salmon-Divon, M., Amariglio, N., Rechavi, G. Transcriptome-wide mapping of N6-methyladenosine by m6A-seq based on immunocapturing and massively parallel sequencing. Nature Protocols. 8 (1), 176-189 (2013).
- Dominissini, D., et al. Topology of the human and mouse m6A RNA methylomes revealed by m6A-seq. Nature. 485 (7397), 201-206 (2012).
- Shobbir Hussain, J. A., Blanco, S., Dietmann, S., Frye, M. Characterizing 5-methylcytosine in the mammalian epitranscriptome. Genome Biology. 14 (215), (2013).
- Amort, T., et al. Distinct 5-methylcytosine profiles in poly(A) RNA from mouse embryonic stem cells and brain. Genome Biology. 18 (1), 1 (2017).
- Endrullat, C., Glökler, J., Franke, P., Frohme, M. Standardization and quality management in next-generation sequencing. Applied & Translational Genomics. 10, 2-9 (2016).
- Schaefer, M., Pollex, T., Hanna, K., Lyko, F. RNA cytosine methylation analysis by bisulfite sequencing. Nucleic Acids Research. 37 (2), 12 (2009).
- Cristinelli, S., Angelino, P., Janowczyk, A., Delorenzi, M., Ciuffi, A. HIV Modifies the m6A and m5C Epitranscriptomic Landscape of the Host Cell. biorxiv. 1 (11), (2021).
- Squires, J. E., et al. Widespread occurrence of 5-methylcytosine in human coding and noncoding RNA. Nucleic Acids Research. 40 (11), 5023-5033 (2012).
- Aschenbrenner, J., et al. Engineering of a DNA Polymerase for Direct m(6) A Sequencing. Angewandte Chemie (International ed. in English). 57 (2), 417-421 (2018).
- Didion, J. P., Martin, M., Collins, F. S. Atropos: specific, sensitive, and speedy trimming of sequencing reads. PeerJ. 5, 3720 (2017).
- Kim, D., Langmead, B., Salzberg, S. L. HISAT: a fast spliced aligner with low memory requirements. Nature Methods. 12 (4), 357-360 (2015).
- Li, H., et al. The Sequence Alignment/Map format and SAMtools. Bioinformatics. 25 (16), 2078-2079 (2009).
- Okonechnikov, K., Conesa, A., García-Alcalde, F. Qualimap 2: advanced multi-sample quality control for high-throughput sequencing data. Bioinformatics. 32 (2), 292-294 (2016).
- Ewels, P., Magnusson, M., Lundin, S., Käller, M. MultiQC: summarize analysis results for multiple tools and samples in a single report. Bioinformatics. 32 (19), 3047-3048 (2016).
- Zhang, Y., et al. Model-based Analysis of ChIP-Seq (MACS). Genome Biology. 9 (9), 137 (2008).
- Martin, M. Cutadapt removes adapter sequences from high-throughput sequencing reads. EMBnet Journal. 17 (1), (2011).
- Shen, W., Le, S., Li, Y., Hu, F. SeqKit: A Cross-Platform and Ultrafast Toolkit for FASTA/Q File Manipulation. PLOS ONE. 11 (10), 0163962 (2016).
- Rieder, D., Amort, T., Kugler, E., Lusser, A., Trajanoski, Z. meRanTK: methylated RNA analysis ToolKit. Bioinformatics. 32 (5), 782-785 (2015).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados