Method Article
Explorer les épitranscriptomes m6A et m5C lors d’une infection virale : un exemple avec le VIH
Dans cet article
Résumé
Le rôle des modifications de l’ARN dans les infections virales commence tout juste à être exploré et pourrait mettre en évidence de nouveaux mécanismes d’interaction viral-hôte. Dans ce travail, nous fournissons un pipeline pour étudier les modifications de l’ARN m6A et m5C dans le contexte des infections virales.
Résumé
Le rôle des modifications de l’ARN dans les processus biologiques a fait l’objet d’un nombre croissant d’études au cours des dernières années et est aujourd’hui connu sous le nom d’épitranscriptomique. Entre autres, des modifications de l’ARN de la N6-méthyladénosine (m6A) et de la 5-méthylcytosine (m5C) ont été décrites sur des molécules d’ARNm et pourraient jouer un rôle dans la modulation des processus cellulaires. L’épitranscriptomique est donc une nouvelle couche de régulation qui doit être envisagée en plus des analyses transcriptomiques, car elle peut également être altérée ou modulée par l’exposition à tout agent chimique ou biologique, y compris les infections virales.
Nous présentons ici un flux de travail qui permet d’analyser le paysage épitranscriptomique cellulaire et viral articulaire des marques m6A et m5C simultanément, dans des cellules infectées ou non par le virus de l’immunodéficience humaine (VIH). Lors de l’isolement et de la fragmentation de l’ARNm à partir de cellules infectées et non infectées par le VIH, nous avons utilisé deux procédures différentes : MeRIP-Seq, une technique basée sur l’immunoprécipitation de l’ARN, pour enrichir les fragments d’ARN contenant la marque m6A et BS-Seq, une technique basée sur la conversion du bisulfite, pour identifier la marque m5C à une résolution nucléotidique unique. Lors de la capture spécifique à la méthylation, les bibliothèques d’ARN sont préparées pour le séquençage à haut débit. Nous avons également développé un pipeline bioinformatique dédié pour identifier les transcriptions méthylées différentiellement (DM) indépendamment de leur profil d’expression basale.
Dans l’ensemble, la méthodologie permet d’explorer plusieurs marques épitranscriptomiques simultanément et fournit un atlas des transcriptions DM sur une infection virale ou toute autre perturbation cellulaire. Cette approche offre de nouvelles possibilités d’identifier de nouveaux acteurs et de nouveaux mécanismes de réponse cellulaire, tels que des facteurs cellulaires favorisant ou limitant la réplication virale.
Introduction
On sait depuis longtemps que les molécules d’ARN peuvent être modifiées, et plus de 150 modifications post-transcriptionnelles ont été décrites à ce jour1. Ils consistent en l’ajout de groupes chimiques, principalement des groupes méthyle, à pratiquement n’importe quelle position des cycles pyrimidine et purine des molécules d’ARN2. De telles modifications post-transcriptionnelles se sont déjà avérées très enrichies en ARN de transfert (ARNt) et en ARN ribosomique (ARNr) et ont récemment été décrites sur des molécules d’ARNm.
L’essor de nouvelles technologies, telles que le séquençage de nouvelle génération (NGS), et la production d’anticorps spécifiques reconnaissant des modifications chimiques définies ont permis, pour la première fois, l’étude de l’emplacement et de la fréquence de modifications chimiques spécifiques à l’échelle du transcriptome. Ces avancées ont permis de mieux comprendre les modifications de l’ARN et de cartographier plusieurs modifications sur les molécules d’ARNm3,4.
Alors que l’épigénétique étudie le rôle des modifications de l’ADN et des histones dans la régulation du transcriptome, l’épitranscriptomique se concentre de manière similaire sur les modifications de l’ARN et leur rôle. L’étude des modifications épitranscriptomiques offre de nouvelles occasions de mettre en évidence de nouveaux mécanismes de régulation qui peuvent ajuster une variété de processus cellulaires (c.-à-d. l’épissage, l’exportation, la stabilité et la traduction de l’ARN)5. Il n’était donc pas très surprenant que des études récentes aient révélé de nombreuses modifications épitranscriptomiques lors d’une infection virale dans les ARN cellulaires et viraux6. Les virus étudiés jusqu’à présent comprennent à la fois des virus à ADN et à ARN; parmi eux, le VIH peut être considéré comme un exemple pionnier. Dans l’ensemble, la découverte de la méthylation de l’ARN dans le contexte des infections virales peut permettre d’étudier des mécanismes encore non décrits d’expression ou de réplication virale, fournissant ainsi de nouveaux outils et cibles pour les contrôler7.
Dans le domaine de l’épitranscriptomique du VIH, les modifications des transcriptions virales ont été largement étudiées et ont montré que la présence de cette modification était bénéfique pour la réplication virale8,9,10,11,12,13. À ce jour, diverses techniques peuvent être utilisées pour détecter les marques épitranscriptomiques à l’échelle du transcriptome. Les techniques les plus utilisées pour l’identification m6A reposent sur des techniques de précipitation immunitaire telles que MeRIP-Seq et miCLIP. Alors que MeRIP-Seq s’appuie sur la fragmentation de l’ARN pour capturer des fragments contenant des résidus méthylés, miCLIP est basé sur la génération de mutations de signature spécifique d’anticorps α-m6A lors de la réticulation ARN-anticorps UV, permettant ainsi une cartographie plus précise.
La détection de la modification m5C peut être réalisée soit par des technologies à base d’anticorps similaires à la détection m6A (m5C RIP), soit par conversion de bisulfites ou par AZA-IP ou par miCLIP. Aza-IP et m5C miCLIP utilisent une méthyltransférase spécifique comme appât pour cibler l’ARN tout en passant par la méthylation de l’ARN. Dans Aza-IP, les cellules cibles sont exposées à la 5-azacytidine, ce qui entraîne l’introduction aléatoire de sites de 5-azacytidine analogues à la cytidine dans l’ARN naissant. Dans miCLIP, la méthyltransférase NSun2 est génétiquement modifiée pour héberger la mutation C271A14,15.
Dans ce travail, nous nous concentrons sur la double caractérisation des modifications m6A et m5C dans les cellules infectées, en utilisant le VIH comme modèle. Après optimisation méthodologique, nous avons développé un flux de travail qui combine l’immunoprécipitation de l’ARN méthylé (MeRIP) et la conversion de l’ARN bisulfite (BS), permettant l’exploration simultanée des marques épitranscriptomiques m6A et m5C à un niveau transcriminal à l’échelle du transcriptome, dans des contextes cellulaires et viraux. Ce flux de travail peut être mis en œuvre sur des extraits d’ARN cellulaires ainsi que sur des ARN isolés à partir de particules virales.
L’approche MeRIP (Methylated ARN ImmunoPrecipitation)16 permettant d’étudier m6A à l’échelle du transcriptome est bien établie et un ensemble d’anticorps spécifiques de m6A est disponible dans le commerce à ce jour17. Cette méthode consiste en la capture sélective de morceaux d’ARN contenant du m6A à l’aide d’un anticorps spécifique au m6A. Les deux inconvénients majeurs de cette technique sont (i) la résolution limitée, qui dépend fortement de la taille des fragments d’ARN et fournit donc un emplacement approximatif et une région contenant le résidu méthylé, et (ii) la grande quantité de matériau nécessaire pour effectuer l’analyse. Dans le protocole optimisé suivant, nous avons normalisé la taille du fragment à environ 150 nt et réduit la quantité de matière première de 10 μg d’ARN poly-A-sélectionné, qui est actuellement la quantité recommandée de matière de départ, à seulement 1 μg d’ARN poly-A-sélectionné. Nous avons également maximisé l’efficacité de récupération des fragments d’ARN m6A liés à des anticorps spécifiques en utilisant une élution par une approche de compétition avec un peptide m6A au lieu de méthodes d’élution plus conventionnelles et moins spécifiques utilisant des techniques à base de phénol ou de protéinase K. La principale limite de ce test basé sur RIP reste cependant la résolution sous-optimale qui ne permet pas l’identification du nucléotide A modifié précis.
L’analyse de la marque m5C peut actuellement être effectuée à l’aide de deux approches différentes: une méthode basée sur RIP avec des anticorps spécifiques à m5C et une conversion de bisulfite d’ARN. Comme RIP n’offre qu’une résolution limitée sur l’identification du résidu méthylé, nous avons utilisé la conversion de bisulfite qui peut offrir une résolution nucléotidique unique. L’exposition de l’ARN au bisulfite (BS) entraîne une désamination de la cytosine, convertissant ainsi le résidu de cytosine en uracile. Ainsi, lors de la réaction de conversion de l’ARN bisulfite, chaque cytosine non méthylée est déminée et convertie en uracile, tandis que la présence d’un groupe méthyle en position 5 de la cytosine a un effet protecteur, empêchant la désamination induite par la BS et préservant le résidu de cytosine. L’approche basée sur BS permet la détection d’un nucléotide modifié m5C à une résolution de base unique et l’évaluation de la fréquence de méthylation de chaque transcription, fournissant des informations sur la dynamique de modification m5C18. La principale limitation de cette technique repose cependant sur le taux de faux positifs des résidus méthylés. En effet, la conversion BS est efficace sur l’ARN simple brin avec des résidus C accessibles. Cependant, la présence d’une structure secondaire d’ARN serrée pourrait masquer la position N5C et entraver la conversion BS, entraînant des résidus C non méthylés qui ne sont pas convertis en résidus U, et donc des faux positifs. Pour contourner ce problème et minimiser le taux de faux positifs, nous avons appliqué 3 cycles de dénaturation et de conversion de bisulfites19. Nous avons également introduit 2 contrôles dans les échantillons pour permettre l’estimation de l’efficacité de conversion des bisulfites : nous introduisons des contrôles de séquençage ERCC (séquences normalisées et disponibles dans le commerce non méthylées)20 ainsi que des ARN appauvris en poly-A pour évaluer le taux de conversion des bisulfites d’une part, et pour vérifier par RT-PCR la présence d’un site méthylé connu et bien conservé, C4447, sur l’ARN ribosomique 28S d’autre part21.
Dans le domaine de la virologie, le couplage de ces deux méthodes d’investigation épitranscriptomique avec le séquençage de nouvelle génération et l’analyse bioinformatique précise permet d’étudier en profondeur la dynamique m6A et m5C (c’est-à-dire les changements temporels de modification de l’ARN qui pourraient se produire lors d’une infection virale et pourraient découvrir un éventail de nouvelles cibles thérapeutiquement pertinentes pour une utilisation clinique).
Protocole
1. Préparation des cellules
REMARQUE: Selon le type de cellule et sa teneur en ARN, le nombre de cellules de départ peut varier.
- Avoir suffisamment de cellules pour obtenir entre 200-500 μg d’ARN total ou 5-7 μg d’ARN poly-A-sélectionné. Par exemple, 50 x 106 cellules SupT1 devraient produire environ 500 μg d’ARN total lors de l’extraction avec des réactifs à base de phénol, et sont donc nécessaires pour chaque condition individuelle testée.
- Préparer le nombre requis de cellules selon le plan expérimental, et donc selon le nombre de conditions testées (infection, timepoints, traitement). Si l’expérience vise à obtenir des cellules non infectées et des cellules infectées par le VIH 24 heures après l’infection, un total de 100 x 106 cellules est nécessaire, la moitié pour l’état non infecté et l’autre moitié pour l’état infecté.
2. Extraction de l’ARN
- À partir de cellules : Extraction d’ARN avec phénol-chloroforme
- Pour chaque condition, prélever des cellules (p. ex., 50 x 106) par centrifugation et jeter le surnageant.
- Ajouter 5 mL de réactif à base de phénol à chaque pastille de cellule 50 x 106 et mélanger en pipetant plusieurs fois.
- Incuber pendant 5 min à température ambiante pour permettre une lyse complète. Les cellules lysées peuvent être stockées à -80 °C ou traitées directement.
REMARQUE: Si nécessaire, les cellules peuvent également être divisées en aliquotes de 10 x 106 cellules par tube dans des tubes de 1,5 mL et lysées dans 1 mL de réactif à base de phénol pour un stockage plus pratique. - Ajouter 1 mL de chloroforme et mélanger par inversion.
- Incuber pendant 3 min à température ambiante.
- Centrifuger pendant 15 min à 2 000 x g et 4 °C.
- Pipette la phase aqueuse (phase supérieure) et transfert dans un nouveau tube. Terminez le transfert de la phase aqueuse en inclinant le tube à 45° et en tuyautant soigneusement la solution.
REMARQUE : La quantité de phase aqueuse peut varier d’un échantillon à l’autre, mais elle doit être proche de la quantité de chloroforme ajoutée à l’échantillon (c.-à-d. 1 mL). Ne transférez aucune couche interphasée ou organique! L’utilisation de tubes à verrouillage de phase ou de déphaseur peut faciliter ce processus. - Ajouter 0,5 mL d’isopropanol de qualité moléculaire à 100 % à la phase aqueuse.
- Incuber pendant 1 h à -80 °C pour permettre la précipitation de l’ARN.
- Centrifuger pendant 10 min à 12 000 x g et 4 °C pour granuler l’ARN précipité.
- Jeter le surnageant et remettre en suspension la pastille d’ARN dans 1 mL d’éthanol de qualité biologie moléculaire à 75 %. Vortex brièvement.
- Centrifuger pendant 5 min à 7 500 x g et 4 °C et jeter le surnageant.
- Sécher la pastille à l’air libre pendant 15 min.
- Remettre la pastille dans 20 μL d’eau sans RNase et la transférer dans un nouveau tube.
- Lavez le tube vide avec 20 μL d’eau supplémentaire pour maximiser la récupération de l’ARN et mettez en commun avec le premier volume de 20 μL.
- Quantifiez l’ARN total avec un spectrophotomètre et évaluez la qualité de l’ARN avec un analyseur de fragments.
- À partir de particules virales: extraction d’ARN avec kit d’extraction d’ARN viral à base de colonne
REMARQUE: L’extraction de l’ARN à partir de particules virales avec un réactif à base de phénol entraîne un ARN viral de mauvaise qualité et des bibliothèques de qualité inférieure. Une extraction d’ARN en colonne devrait donc être privilégiée. Les kits d’extraction d’ARN utilisant de l’ARN porteur pour l’élution et la récupération de l’ARN ne sont pas appropriés pour cette procédure et doivent être évités. Étant donné que l’ARN du VIH est poly-adénylé, l’extraction directe de l’ARN sans autre isolement de l’ARNm est suffisante pour pénétrer dans les pipelines MeRIP-Seq et BS-Seq. Normalement, 1 à 2 mL de surnageant viral provenant de cellules universellement infectées devraient fournir suffisamment d’ARN pour effectuer l’ensemble du flux de travail.- Préparer le tampon en ajoutant 150 μL de bêta-mercaptoéthanol à 30 mL de tampon de lyse. Reconstituer le tampon de lavage viral en ajoutant 96 mL d’éthanol à 100 %.
- Recueillir les surnageants contenant des virus et centrifuger les débris cellulaires en granulés afin de minimiser la contamination de l’ARN cellulaire.
- Transférer 1 mL de surnageant viral dans un tube de 15 mL.
- Ajouter 3 mL de tampon d’ARN viral à 1 mL d’échantillon viral et mélanger par vortex.
- Transférer 700 μL d’échantillon dans une colonne, inséré dans un tube de prélèvement.
- Centrifuger pendant 2 min à 13 000 x g à température ambiante.
- Ignorez le flowthrough.
- Répétez les 3 étapes précédentes jusqu’à ce que l’échantillon entier ait été traité, et ainsi tout l’ARN a été capturé sur la colonne de matrice à base de silice.
- Ajouter 500 μL de tampon de lavage viral à la colonne.
- Centrifuger pendant 1 min à 10 000 x g à température ambiante. Ignorez le flowthrough.
- Ajoutez 200 μL de tampon de lavage viral à la colonne.
- Centrifuger pendant 1 min à 10 000 x g à température ambiante. Ignorez le flowthrough.
- Placez la colonne dans un tube de collecte vide.
- Centrifuger pendant 1 min à 10 000 x g à température ambiante pour éliminer davantage tout contaminant tampon de lavage restant.
- Transférer délicatement la colonne dans un tube de 1,5 mL.
- Ajouter 20 μL d’eau sans DNase/RNase directement au centre de la matrice de la colonne et centrifuger à 10 000 x g pendant 30 s à température ambiante.
- Ajouter 10 μL supplémentaires d’eau sans DNase/RNase directement au centre de la matrice de colonne et centrifuger à nouveau pendant 30 s.
- Quantifiez l’ARN total avec un spectrophotomètre et évaluez la qualité de l’ARN avec un analyseur de fragments.
REMARQUE: L’extraction de l’ARN peut être effectuée avec n’importe quelle méthode, si la qualité de l’ARN récupéré est élevée, avec un nombre d’intégrité / qualité de l’ARN > 9. L’ARN total peut être stocké à -80 °C jusqu’à un traitement ultérieur.
3. Isolement de l’ARNm par sélection poly-A avec Oligo(dT)25
REMARQUE: En raison de la présence d’ARN ribosomique hautement méthylé dans les extraits cellulaires, il est fortement recommandé d’isoler l’ARN poly-A soit par épuisement de l’ARNr, soit préférentiellement par sélection positive poly-A. Cette étape est facultative et doit être effectuée uniquement pour les échantillons d’ARN cellulaire, afin d’obtenir des résultats de séquençage à une résolution plus élevée. Si vous analysez la méthylation d’ARN viraux non poly-adénylés, privilégiez l’épuisement de l’ARNr plutôt que la sélection poly-A ou effectuez éventuellement l’analyse sur l’ARN total.
-
Préparation de perles pour la capture poly-A
- Remettre en suspension le flacon stock de billes magnétiques Oligo(dT)25 en tourbillonnant pendant >30 s.
- Transférer 200 μL de billes magnétiques dans un tube de 1,5 mL. Préparer le nombre de tubes avec des billes magnétiques en fonction de la quantité totale d’échantillons d’ARN à traiter.
REMARQUE: Un tube avec 200 μL de solution mère Dynabead correspond à 1 mg de perles et peut accueillir un échantillon de 75 μg d’ARN total. - Placez les tubes sur un aimant pendant 1 min et jetez le surnageant. Retirez les tubes de l’aimant.
- Ajouter 1 mL de tampon de liaison (20 mM Tris-HCl, pH 7,5, 1,0 M LiCl, 2 mM EDTA) et remettre en suspension par vortex. Placez les tubes sur l’aimant pendant 1 min et jetez le surnageant. Retirez les tubes de l’aimant. Répéter.
- Remettre en suspension les billes magnétiques lavées dans 100 μL de tampon de liaison.
-
Préparation de l’ARN total
- Diluer l’ARN total à une concentration finale de 0,75 μg/μL avec de l’eau sans RNase, ce qui correspond à 75 μg/100 μL.
REMARQUE: Si l’ARN est à une concentration plus faible, procédez comme décrit ci-dessous sans modifier les volumes. - Aliquoter l’ARN total dans plusieurs tubes en distribuant 100 μL d’échantillon d’ARN par tube.
- Ajouter 100 μL de tampon de liaison à chaque échantillon d’ARN.
- Chauffer l’ARN total à 65 °C pendant 2 min pour perturber les structures secondaires.
- Placer immédiatement sur la glace jusqu’à ce qu’il soit prêt à passer à l’étape suivante.
NOTE: Le temps d’incubation peut varier en fonction du nombre d’échantillons à traiter, mais ne doit pas dépasser 1 h pour éviter toute dégradation de l’ARN.
- Diluer l’ARN total à une concentration finale de 0,75 μg/μL avec de l’eau sans RNase, ce qui correspond à 75 μg/100 μL.
-
Sélection Poly-A
- À chaque tube d’ARN (à partir de l’étape 3.2), ajouter 100 μL de billes magnétiques lavées (à partir de l’étape 3.1).
- Bien mélanger en pipetant de haut en bas et laisser se fixer sur une roue tournante à température ambiante pendant 15 min.
- Ouvrez tous les tubes, placez-les sur l’aimant pendant 1 min et retirez soigneusement tout le surnageant.
- Récupérer le surnageant dans un nouveau tube et le garder de côté pour une deuxième série de capture d’ARN (étape 3.3.14), afin d’améliorer la récupération finale du poly-A.
- Retirez le tube de l’aimant et ajoutez 200 μL de tampon de lavage (10 mM de Tris-HCl, pH 7,5, 0,15 M LiCl, 1 mM EDTA). Mélanger en pipetant soigneusement 4 à 5 fois.
- Placez le tube sur l’aimant pendant 1 min et jetez le surnageant.
- Répétez l’étape de lavage une fois (répétez les étapes 3.3.5 et 3.3.6).
- Ajouter 20 μL de Tris-HCl glacé de 10 mM pour éluer l’ARN poly-A des perles.
- Incuber à 80 °C pendant 2 min.
- Placez le tube sur l’aimant et transférez rapidement le surnageant contenant l’ARN poly-A dans un nouveau tube sans RNase. Placez le tube sur de la glace.
- Répétez l’étape d’élution (étapes 3.3.8 à 3.3.10) pour augmenter le rendement.
- Lavez les mêmes billes une fois avec 200 μL de tampon de lavage. Mélanger en pipetant soigneusement 4 à 5 fois.
- Placer sur l’aimant pendant 1 min et jeter le tampon de lavage.
- Ajoutez le flux de l’étape 3.3.4 aux billes et répétez la procédure de liaison à l’élution (étapes 3.3.2 à 3.3.10). Gardez l’ARN élué dans des tubes séparés pour l’instant.
REMARQUE: En option, conservez à nouveau le surnageant équivalent à l’étape 3.3.4 dans un nouveau tube car il peut être utilisé comme contrôle. À la fin de la procédure, purifier et concentrer l’ARN par précipitation d’éthanol ou avec une méthode de choix à base de colonne (c.-à-d. ARN propre et concentrateur). Cet échantillon correspond à un échantillon d’ARN poly-A-appauvri et peut être utilisé comme témoin de la conversion des bisulfites (étape 8.2.2). - Quantifiez l’ARN élué à l’aide d’un spectrophotomètre et conservez une aliquote de 2 μL pour évaluer davantage la qualité de l’ARN à l’aide d’un analyseur de fragments.
REMARQUE: L’ARN Poly-A peut être stocké à -80 ° C jusqu’à ce que nécessaire.
4. Flux de travail de l’ARN
- Divisez les échantillons d’ARN poly-A cellulaire (ARNm) et d’ARN viral en 2 aliquotes, dédiées au pipeline d’analyse épitranscriptomique respectif :
(i) 5 μg d’ARNm cellulaire ou 1 μg d’ARN viral pour meRIP-Seq et les contrôles d’entrée (passez aux étapes 5 à 7 et à l’étape 9).
(ii) 1 μg d’ARNm cellulaire ou 500 ng d’ARN viral pour BS-Seq (voir les étapes 8 et 9).
5. Fragmentation de l’ARN
REMARQUE: La fragmentation de l’ARN est effectuée avec le réactif de fragmentation de l’ARN et est destinée aux échantillons MeRIP-Seq et d’ARN de contrôle. Il s’agit d’une étape très importante qui nécessite une optimisation minutieuse afin d’obtenir des fragments compris entre 100 et 200 nt.
- Divisez le volume total d’ARNm en tubes PCR de 0,2 mL avec 18 μL d’ARNm/tube.
REMARQUE: Travaillez rapidement. Ne travaillez pas avec plus de 8 échantillons à la fois pour avoir des résultats reproductibles. La mise à l’échelle du volume ne garantira pas une fragmentation reproductible et uniforme. - Réchauffez un thermocycleur à 70 °C.
- Ajouter 2 μL de réactif de fragmentation sur le bord de chaque tube PCR.
- Fermez le tube et tournez vers le bas (de sorte que le réactif entre en contact avec l’ARN en même temps pour les 8 tubes).
- Incuber les échantillons 15 min à 70 °C dans le thermocycleur préchauffé.
- Dès que l’incubation est terminée, ajouter rapidement 2 μL de solution Stop dans chaque tube.
- Tournez vers le bas et laissez reposer sur la glace jusqu’à ce que vous soyez prêt à passer à l’étape suivante.
NOTE: Le temps d’incubation peut varier en fonction du nombre d’échantillons à traiter, mais ne doit pas dépasser 1 h pour éviter toute dégradation de l’ARN. - Répétez la procédure pour tous les échantillons (s’il y a plus de 8 aliquotes).
- Regroupez les tubes et procédez à la purification de l’ARN avec un kit de nettoyage et de concentrateur d’ARN (étape 6) ou tout kit personnalisé à base de colonne pour se débarrasser des tampons et récupérer de l’ARN fragmenté propre dans l’eau.
6. Purification de l’ARN
REMARQUE: Cette étape peut être effectuée par précipitation d’éthanol ou avec tout type de méthode de purification et de concentration d’ARN sur colonne (c.-à-d. nettoyage et concentrateur d’ARN).
- Éluez ou remettez en suspension l’ARN purifié dans un volume total de 50 à 75 μL d’eau sans DNase/RNase.
REMARQUE: Si une méthode basée sur des colonnes est utilisée, deux cycles d’élution sont fortement recommandés pour assurer une récupération maximale. - Quantifiez l’ARNm fragmenté purifié à l’aide d’un spectrophotomètre et évaluez la qualité de l’ARN à l’aide d’un analyseur de fragments.
- Conservez 100 ng d’ARNm fragmenté comme contrôle d’entrée pour la préparation et le séquençage de la bibliothèque (passez à l’étape 9). L’ARNm fragmenté restant (minimum 2,5 μg) peut être utilisé pour la MERIP (passez à l’étape 7.2).
7. MeRIP
REMARQUE : Un minimum de 2,5 μg d’ARNm fragmenté est requis pour chaque immunoprécipitation (IP), soit en utilisant un anticorps anti-m6A spécifique (condition de test), soit en utilisant un anticorps anti-IgG (contrôle négatif).
- Préparation de billes magnétiques pour l’immunoprécipitation
- Pour chaque échantillon, préparer 4 mL de tampon IP 1x dans un nouveau tube conique en diluant 800 μL de tampon IP d’ARNm 5x (50 mM Tris-HCl pH 7,4, 750 mM NaCl, 0,5% Igepal CA-630 et eau sans nucléase) avec 3,2 mL d’eau sans nucléase.
REMARQUE: Au moins 2 réactions sont nécessaires (un test et un contrôle IgG). - Placez le tube sur de la glace.
- Étiqueter le nombre approprié de tubes de microcentrifugation de 1,5 mL pour le nombre de réactions IP souhaitées:
n tubes (test) pour anticorps anti-m6A.
n tubes (contrôle négatif) pour les IgG normales de souris. - Remettre en suspension les billes magnétiques (p. ex. Magna ChIP Protein A/G) en les inversant et en les vortexant. Aucune touffe de perles ne doit être visible.
- Pour chaque réaction prévue, transférer 25 μL de billes magnétiques dans un tube de microcentrifugation.
- Ajouter dix fois plus de tampon IP 1x (à partir de l’étape 7.1.1) par rapport au volume initial de billes utilisées (c’est-à-dire 250 μL de 1x tampon IP pour 25 μL de billes magnétiques).
- Mélanger les perles en piquant doucement de haut en bas plusieurs fois pour une remise en suspension complète.
- Placez le tube sur le séparateur magnétique pendant 1 min.
- Retirez et jetez le surnageant, en veillant à ne pas aspirer de perles magnétiques. Retirez le tube de l’aimant.
- Répétez l’étape de lavage (étapes 7.1.6 à 7.1.9).
- Remettre en suspension les billes dans 100 μL de 1x tampon IP par 25 μL de volume d’origine de billes magnétiques.
- Ajouter 5 μL d’anticorps (1 μg/μL) par 25 μL de volume initial de billes magnétiques.
n tubes (test) avec anticorps anti-m6A (clone 17-3-4-1) [1 μg/μL].
n tubes (témoin négatif) avec IgG normale de souris (1 μg/μL). - Incuber sur la roue tournante pendant 30 min à température ambiante pour permettre la conjugaison des anticorps avec les billes magnétiques.
- Placez le tube sur le séparateur magnétique pendant 1 min. Jetez le surnageant. Retirez le tube de l’aimant et remettez en suspension le mélange anticorps-billes dans 100 μL de 1x tampon IP.
- Pour chaque échantillon, préparer 4 mL de tampon IP 1x dans un nouveau tube conique en diluant 800 μL de tampon IP d’ARNm 5x (50 mM Tris-HCl pH 7,4, 750 mM NaCl, 0,5% Igepal CA-630 et eau sans nucléase) avec 3,2 mL d’eau sans nucléase.
- Immunoprécipitation de l’ARN (RIP)
- Préparer 500 μL de mélange réactionnel RIP pour chaque échantillon d’ARNm de 2,5 μg comme suit : 2,5 μg dans 100 μL d’ARN fragmenté (à partir de l’étape 6.12); 295 μL d’eau sans nucléase; 5 μL d’inhibiteur de la RNase 40 U/μL; et 100 μL de tampon IP 5x.
- Ajouter 500 μL de mélange réactionnel RIP à chaque mélange anticorps-billes (~100 μL à partir de l’étape 7.1.14). Mélanger en pipetant doucement plusieurs fois pour remettre complètement en suspension les perles. Placer sur la glace.
- Incuber tous les tubes RIP sur une roue rotative pendant 2 heures à 4 °C.
- Centrifugez brièvement les réactions MeRIP pour faire tourner les gouttelettes de liquide des côtés du bouchon et du tube. Placez les tubes sur un séparateur magnétique pendant 1 min.
- Transférer le surnageant dans un nouveau tube de centrifugeuse, en prenant soin de ne pas perturber les billes magnétiques.
REMARQUE: Flowthrough peut être conservé comme contrôle pour vérifier l’efficacité RIP (passez à l’étape 7.3.9). - Retirez les tubes de l’aimant. Lavez les billes en ajoutant 500 μL de tampon IP froid 1x. Mélangez les perles en piquant doucement plusieurs fois pour les remettre complètement en suspension.
- Placez les tubes sur un séparateur magnétique pendant 1 min et jetez le surnageant.
- Répétez la procédure de lavage (étapes 7.2.6 à 7.2.7) deux fois pour un total de 3 lavages.
- Placez les tubes sur de la glace et procédez immédiatement à l’élution.
- Élution
- Préparer une solution de 20 mM m6A en dissolvant 10 mg de N6-méthyladénosine, sel de sodium 5′-monophosphate (m6A) dans 1,3 mL d’eau sans nucléase. Préparer des aliquotes de 150 μL et conserver à -20 °C.
- Pour chaque échantillon (essai et témoins) : Préparer 225 μL de tampon d’élution en mélangeant les composants suivants : 45 μL de 5x tampon IP, 75 μL de 20 mM m6A, 3,5 μL d’inhibiteur de RNase 40U/μL et 101,5 μL d’eau sans nucléase.
- Ajouter 100 μL de tampon d’élution (à partir de l’étape 7.3.2) aux billes (à partir de l’étape 7.2.9). Mélanger en pipetant doucement plusieurs fois pour remettre complètement en suspension les perles.
- Incuber tous les tubes pendant 1 h en secouant continuellement sur une bascule à 4 °C.
- Centrifugez brièvement les réactions RIP pour faire tourner les gouttelettes de liquide des côtés du bouchon et du tube. Placez les tubes sur un séparateur magnétique pendant 1 min.
- Transférer le surnageant contenant des fragments d’ARN élués dans un nouveau tube de microcentrifugation de 1,5 mL. Veillez à ne pas aspirer les perles, car cela augmentera le bruit de fond.
- Répétez les étapes d’élution (7.3.3 à 7.3.6) en ajoutant à nouveau 100 μL de tampon d’élution, en incubant 1 h à 4 °C et en recueillant l’éluat après séparation magnétique.
- Combiner tous les éluats du même échantillon (le volume total d’élution doit être de 200 μL).
- Purifier l’ARN élué et le flux (facultatif, à partir de l’étape 7.2.5) par précipitation de l’éthanol ou par une méthode de choix basée sur la colonne (c.-à-d. ARN propre et concentrateur).
- Évaluez la quantité et la qualité de l’ARN des échantillons traversants et élués à l’aide d’un analyseur de fragments à l’aide d’un kit de détection à haute sensibilité. Si la qualité de l’ARN est satisfaisante, passez à la préparation de la bibliothèque et au séquençage à haut débit (étape 9).
REMARQUE: La quantité d’ARN récupérée sur MeRIP est très faible et nécessite impérativement des kits de détection à haute sensibilité pour assurer la quantification. Si aucun bioanalyseur n’est disponible, il est possible de procéder aveuglément à la préparation de la bibliothèque.
8. Conversion de l’ARN bisulfite
- Contrôle et préparation des réactifs
- Contrôle des pics de mélange ERCC : Ajouter le mélange ERCC en suivant les instructions du fabricant, qui recommandent l’ajout de 0,5 μL de mélange ERCC non dilué à 500 ng d’ARNm. Ce contrôle peut aider à évaluer l’efficacité de la conversion du bisulfite.
- Spike Poly-A-pleted RNA (à partir de l’étape 3.3.14) à un rapport 1/1000 (c’est-à-dire 500 pg d’ARN poly-A-appauvri pour 500 ng d’ARNm). Cet échantillon est enrichi en ARN ribosomique et devrait donc contenir l’ARNr 28S, un contrôle positif de la conversion au bisulfite.
REMARQUE: L’ARN total peut également être utilisé comme témoin positif au lieu de l’ARN appauvri en poly-A. - Effectuer une conversion de bisulfite avec un kit de méthylation de l’ARN (par exemple, Zymo EZ).
- Tampon de lavage d’ARN : Ajouter 48 mL d’éthanol à 100 % (ou 52 mL d’éthanol à 95 %) à 12 mL de concentré de tampon de lavage d’ARN avant utilisation.
- Bisulfite Conversion
REMARQUE: La conversion du bisulfite a été effectuée avec un kit de conversion de bisulfite d’ARN disponible dans le commerce en suivant la procédure du fabricant comme indiqué ci-dessous.- Dans les tubes PCR de 0,2 mL, ajoutez 1000 ng d’ARNm (ou entre 300 et 1000 ng). Ajouter des témoins d’épilation : 1 μL de mélange ERCC (étape 8.1.1) et 1000 pg d’ARN poly-A-appauvri (étape 8.1.2). Volume complet jusqu’à 20 μL avec de l’eau sans DNase/RNase.
- Ajouter 130 μL de réactif de conversion d’ARN à chaque échantillon d’ARN de 20 μL.
- Mélanger l’échantillon en pipetant de haut en bas.
- Tournez brièvement vers le bas pour vous assurer qu’il n’y a pas de gouttelettes dans le capuchon ou les côtés du tube.
- Placez les tubes PCR dans un cycleur thermique et effectuez les étapes suivantes: dénaturation à 70 °C pendant 5 min; conversion à 54 °C pendant 45 min; répéter les étapes de dénaturation et de conversion pour un total de 3 cycles; puis maintenir à 4 °C indéfiniment.
REMARQUE: Trois cycles de dénaturation et de conversion au bisulfite assurent une conversion complète du bisulfite de l’échantillon. Les échantillons peuvent être conservés à -80 °C ou directement traités. - Procéder à la désulfonation en colonne. Placez une colonne dans un tube collecteur vide et ajoutez 250 μL de tampon de liaison à l’ARN à la colonne.
- Chargez l’échantillon (~150 μL à partir de l’étape 8.2.5) dans la colonne contenant le tampon de liaison à l’ARN et mélangez-le en pipetant de haut en bas.
- Ajouter 400 μL d’éthanol à 95-100 % au mélange tampon de liaison de l’échantillon et de l’ARN dans la colonne. Fermez le capuchon et mélangez immédiatement en inversant la colonne plusieurs fois.
- Centrifugeuse à pleine vitesse (≥ 10 000 x g) pendant 30 s. Ignorez le flowthrough.
- Ajouter 200 μL de tampon de lavage d’ARN à la colonne et centrifuger à pleine vitesse pendant 30 s.
- Ajouter 200 μL de tampon de désulfonation de l’ARN à la colonne et incuber à température ambiante pendant 30 min. Après l’incubation, centrifuger à pleine vitesse pendant 30 s. Ignorez le flowthrough.
- Ajouter 400 μL de tampon de lavage à ARN à la colonne et centrifuger à pleine vitesse pendant 30 s. Répétez l’étape de lavage avec 400 μL supplémentaires de tampon de lavage à ARN. Ignorez le flowthrough.
- Centrifugez la colonne dans le tube de collecte vidé à pleine vitesse pendant 2 min. Transférez la colonne dans un tube sans RNase.
- Ajouter ≥ 10 μL d’eau sans DNase/RNase directement dans la matrice de la colonne et incuber pendant 1 min à température ambiante. Centrifuger à pleine vitesse pendant 30 s.
REMARQUE: Nous éluons généralement dans un volume de 20 μL. L’ARN élué peut être utilisé immédiatement ou stocké à -20 °C jusqu’à 3 mois. Pour un stockage à long terme, conserver à -80 °C. - Retirez 2,5 μL pour l’évaluation de la qualité et de la quantité d’ARN par analyseur de fragments et passez à la préparation de la bibliothèque et au séquençage à haut débit (étape 9).
- Prendre 4 μL d’ARN converti pour le contrôle de l’efficacité de la conversion de bisulfite (étape 8.3).
- Contrôle de la conversion des bisulfites par RT-PCR
REMARQUE: Cette étape garantit que la conversion du bisulfite a réussi avant de procéder au séquençage . L’ARN ribosomique 28S d’Homo sapiens sera utilisé comme témoin positif pour l’analyse de méthylation de l’ARN, car le résidu C à la position 4447 (accession GenBank # NR_003287) a été décrit comme étant méthylé à 100%.
Séquences d’amorce :
Apprêt H 28SF: 5'-GGGGTTTTAYGATTTTTTTGATTTTTTGGG-3'
Apprêt H 28SR: 5'-CCAACTCACRTTCCCTATTAATAAATAAATAAAC-3'- Préparez le mélange de réactions de transcription inverse (RT) à l’aide d’un kit de transcription inverse de l’ADNc haute capacité. Décongelez les composants du kit sur de la glace et préparez le mélange maître RT sur glace comme suit :
4 μL d’ARN converti au bisulfite (à partir de l’étape 8.2.14) :
2 μL de tampon 10xRT
0,8 μL de 25x dNTP Mix [100 mM]
2 μL de 10x RT Random Primers
1 μL de transcriptase inverse MultiScribe
1 μL d’inhibiteur de la RNase
9,2 μL de H2O sans nucléase
REMARQUE: Chaque réaction RT doit contenir un volume final de 20 μL dans des tubes PCR de 0,2 mL. - Mettez les tubes dans le cycleur thermique avec le programme RT suivant: 25 °C pendant 10 min; 37 °C pendant 120 min; 85 °C pendant 5 min; puis à 4 °C indéfiniment.
- Préparez la réaction PCR pour amplifier spécifiquement l’ARNr 28S avec une enzyme de relecture PCR. Décongelez les composants du kit sur de la glace, vortexez doucement et centrifugez brièvement. Préparez le mélange maître PCR sur de la glace ou sur un support de plaque métallique glacée comme suit :
0,6 μL d’apprêt H 28SF de 10 μM
0,6 μL d’apprêt H 28SF de 10 μM
6,5 μL d’ADNc modèle
22,5 μL de mélange maître d’ADN polymérase
REMARQUE: Chaque réaction de PCR doit contenir un volume final de 20 μL dans des tubes pcR de 0,2 mL. - Mettez les tubes dans le cycleur thermique avec le programme PCR suivant: dénaturation initiale à 95 °C pendant 5 min; 45 cycles de dénaturation (95 °C pendant 15 s), de recuit (57 °C pendant 30 s) et d’allongement (72 °C pendant 15 s), allongement final à 72 °C pendant 10 min, puis maintien à 4 °C indéfiniment.
- Exécutez 10 μL de la réaction sur un gel d’agarose à 2%. La taille de bande attendue est de 130 à 200 pb.
- Préparez le mélange de réactions de transcription inverse (RT) à l’aide d’un kit de transcription inverse de l’ADNc haute capacité. Décongelez les composants du kit sur de la glace et préparez le mélange maître RT sur glace comme suit :
- Séquençage des produits PCR
- Purifier les produits de PCR avec une méthode de choix basée sur la colonne pour éliminer les enzymes et les résidus de dNTP et éluer l’ADN amplifié dans au moins 20 μL d’eau sans DNase/RNase.
- Quantifiez l’ADN purifié avec un spectrophotomètre.
- Réaction de séquençage
- Utilisez 40 ng de produit PCR/ réaction de séquençage.
- Séquence dans les deux sens avec les amorces H 28SF et H 28SR.
- Aligner les séquences avec la séquence non convertie connue (28S ribosomal N5 (RNA28SN5). Vérifiez la présence d’un résidu C à la position C4447 et les résidus T au lieu de C ailleurs.
9. Préparation de la bibliothèque et séquençage à haut débit
- Préparez les bibliothèques pour le séquençage à l’aide de kits d’ARNm (par exemple, Illumina TruSeq Stranded), en démarrant le protocole à l’étape Elute-Prime-Fragment et en suivant les instructions du fabricant.
- Cependant, pour les échantillons d’entrée RNA-Seq et MeRIP-Seq, incuber les échantillons à 80 °C pendant 2 min pour les amorcer mais pas les fragmenter davantage.
- Effectuer le séquençage à l’aide des plateformes Illumina. Les réactions de séquençage peuvent être effectuées selon les préférences et la conception expérimentale, à une extrémité ou à une extrémité appariée, avec une longueur minimale de 100 nt.
10. Analyses bioinformatiques
- m6A Traitement des données
- Exécutez FASTQC24 pour évaluer la qualité de lecture en m6A et entrez des fichiers FASTQ à partir du séquençage.
- Exécutez Atropos25 pour découper les séquences d’extrémité et d’adaptateur de mauvaise qualité à partir des lectures. Définissez les paramètres suivants lors de l’exécution d’Atropos.
- Supprimez les séquences d’adaptateurs suivantes : AGATCGGAAGAG, CTCTTCCGATCT, AACACTCTTTCCCT, AGATCGGAAGAGCG, AGGGAAAGAGTGTT, CGCTCTTCCGATCT.
- Utilisez la limite de qualité Phred suivante : 5, pour couper les extrémités de mauvaise qualité comme spécifié par le fabricant (https://support.illumina.com/downloads/illumina-adapter-sequences-document-1000000002694.html).
- Utilisez la longueur de lecture minimale suivante après le rognage : 25 paires de bases.
- Fusionner le génome humain GRh38 et la référence VIH [Integrated linear pNL4-3Env-GFP] au format FASTA.
- Indexez la référence fusionnée avec HISAT226.
- Exécutez HISAT2 sur des lectures ajustées pour l’aligner sur la référence indexée. Utilisez les paramètres HISAT par défaut.
- Triez et indexez les lectures alignées avec SAMtools27.
- Exécutez SAMtools stat et Qualimap 228, pour le contrôle de la qualité post-alignement des bibliothèques séquencées.
- Si vous le souhaitez, collectez et résumez les mesures de qualité de l’étape précédente avec multiQC29.
- Le génome du VIH a des séquences homologues de 634 pb dans le LTR 5' et le LTR 3' : Réalignez les lectures multimapping de 5' LTR à la région LTR 3' correspondante avec SAMtools.
- Afin d’identifier les pics m6A, exécutez le logiciel d’appel de pointe MACS230 (v 2.1.2). Sélectionnez soigneusement les paramètres d’exécution MACS2, afin d’assurer le bon fonctionnement des données RNA-Seq, car les appels de pointe peuvent être affectés par le niveau d’expression des gènes, et les exons courts peuvent être appelés à tort comme pics. Par conséquent, le signal d’entrée doit être soustrait du signal m6A, sans le lissage systématiquement appliqué par MACS2 aux données basées sur l’ADN. Appliquez les paramètres suivants à la sous-commande 'callpeak' de MACS2 :
-keep-dup auto (contrôle le comportement MACS2 vers les lectures en double, 'auto' permet à MACS de calculer le nombre maximal de lectures au même emplacement en fonction de la distribution binomiale en utilisant 1e-5 comme seuil de valeur p)
-g 2,7e9 (taille du génome humain en pb)
-q 0,01 (seuil FDR minimum pour appeler des pics significatifs)
-nomodel (pour contourner la construction du modèle de décalage, qui est adapté aux expériences ChIP-Seq)
-slocal 0
-llocal 0 (le réglage de ce paramètre et du paramètre précédent sur 0 permet à MACS2 de soustraire directement, sans lissage, les lectures d’entrée des lectures m6A)
-extiser 100 (longueur moyenne des fragments en pb)
-B - Exécutez la sous-commande d’appel de crête différentielle de MACS2, 'bdgdiff' pour comparer les échantillons infectés et non infectés. 'bdgdiff' prend comme entrées les fichiers bedGraph générés par 'callpeak' à l’étape précédente. Pour chaque point temporel, effectuez la comparaison des échantillons infectés par rapport aux échantillons non infectés avec 'bdgdiff', en soustrayant le signal d’entrée respectif du signal m6A et en fournissant les paramètres supplémentaires: -g 60 -l 120.
- Traitement des données m5C
- Exécutez Cutadapt31 pour découper des séquences d’adaptateurs à partir des lectures brutes, avec les paramètres suivants :
adaptateur « AGATCGGAAGAGCACACGTCTGAAC »
-longueur-minimum=25. - Complétez les lectures ajustées à l’aide de seqkit32, car le protocole de séquençage produit des lectures à partir du brin inverse.
- Exécutez FastQC pour examiner la qualité de lecture.
- Fusionner le génome humain GRh38 et la référence VIH [Integrated linear pNL4-3Env-GFP] au format FASTA.
- Indexez la référence fusionnée avec l’application meRanGh à partir du package meRanTK33.
- Alignez-vous avec meRanGh avec les paramètres suivants :
-ONU permettant d’écrire des lectures non mappées dans des fichiers de sortie
-MM permettant d’écrire des lectures multi-mappées dans le fichier de sortie
-bg pour la sortie dans bedGraph
-mbgc 10 filtrer la région signalée par couverture (au moins 10 lectures de couverture) - Le génome du VIH a des séquences homologues de 634 pb dans le LTR de 5' et le LTR de 3' : réalignez les lectures de multicartographie de 5' LTR vers la région LTR de 3' correspondante avec des outils SAM.
- Exécutez l’appel de méthylation via l’outil meRanCall, fourni par meRanTK, avec les paramètres suivants:
-rl = 126, longueur de lecture
-ei = 0,1, intervalle d’erreur pour le calcul de la valeur p du taux de méthylation
-cr = 0,99, conversion attendue - Exécutez l’utilitaire MeRanTK estimateSizeFactors.pl pour estimer les facteurs de taille de chaque échantillon. Les facteurs de taille seront utilisés comme paramètres à l’étape suivante.
- Exécutez MeRanCompare pour l’analyse de méthylation différentielle des non-infectés par rapport aux infectés sur les points de temps 12, 24 et 36h. Les paramètres suivants sont appliqués : une valeur de signification de 0,01 comme seuil minimal pour les facteurs de déclaration et de taille de l’étape précédente.
- Exécutez Cutadapt31 pour découper des séquences d’adaptateurs à partir des lectures brutes, avec les paramètres suivants :
Résultats
Ce flux de travail s’est avéré utile pour étudier le rôle de la méthylation m6A et m5C dans le contexte de l’infection par le VIH. Pour cela, nous avons utilisé un modèle de lignée cellulaire T CD4+ (SupT1) que nous infectons avec le VIH ou que nous ne traitons pas. Nous avons commencé le flux de travail avec 50 millions de cellules par condition et obtenu une moyenne de 500 μg d’ARN total avec un nombre de qualité d’ARN de 10 (Figure 1A-B). Lors de la sélection poly-A, nous avons récupéré entre 10 et 12 μg d’ARNm par condition (représentant environ 2 % de l’ARN total) (Figure 1B). À ce stade, nous avons utilisé 5 μg d’ARN poly-A sélectionné pour le pipeline MeRIP-Seq et 1 μg pour le pipeline BS-Seq. Étant donné que l’ARN du VIH est polyadénylé, aucune autre action n’est nécessaire et les procédures MeRIP-Seq et BS-Seq peuvent être directement appliquées.
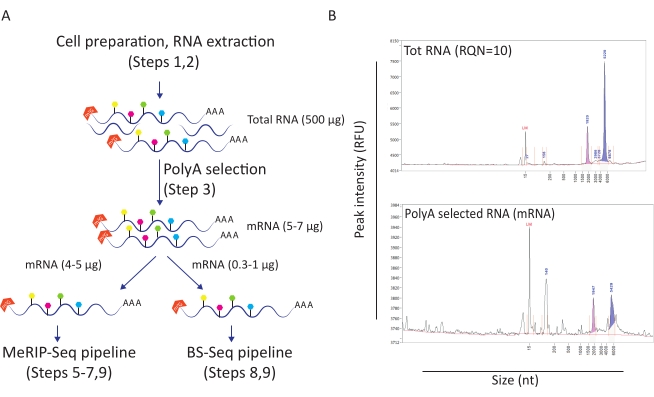
Figure 1 : Préparation de l’ARN pour les applications en aval. A) Flux de travail décrivant la préparation et la distribution de l’ARN pour les pipelines MeRIP-Seq et BS-Seq simultanés. Chaque forme hexagonale remplie représente un type de modification de l’ARN, tel que m6A (vert) ou m5C (rose). Les quantités de matériel d’ARN nécessaires à la réalisation de l’expérience sont indiquées. B) Résultats représentatifs décrivant les profils de distribution d’ARN attendus (taille et quantité) lors de l’extraction totale de l’ARN (panneau supérieur) et de la sélection poly-A (panneau inférieur). Les échantillons ont été chargés sur l’analyseur de fragments avec un kit de sensibilité standard afin d’évaluer la qualité de l’ARN avant d’entrer dans des procédures MeRIP-Seq et BS-Seq spécifiques. RQN : numéro de qualité de l’ARN; nt: nucléotides. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Le pipeline MeRIP-Seq est une technique basée sur l’immunoprécipitation de l’ARN qui permet d’étudier la modification m6A le long des molécules d’ARN. Pour cela, l’ARN est d’abord fragmenté puis incubé avec des anticorps spécifiques à m6A couplés à des billes magnétiques pour l’immunoprécipitation et la capture. Les fragments d’ARN enrichis en MeRIP et la fraction intacte (entrée) sont ensuite séquencés et comparés pour identifier les régions d’ARN modifiées m6A et donc les transcriptions méthylées m6A (Figure 2A). La résolution de la technique repose sur l’efficacité de la fragmentation de l’ARN. En effet, des fragments plus courts permettent une localisation plus précise du résidu m6A. Ici, les ARN cellulaires poly-A-sélectionnés et les ARN viraux ont été soumis à une fragmentation à base d’ions avec tampon de fragmentation de l’ARN pendant 15 minutes dans un volume final de 20 μL pour obtenir des fragments d’ARN de 100-150 nt. En partant de 5 μg d’ARNm, nous avons récupéré 4,5 μg d’ARN fragmenté, ce qui correspond à un taux de récupération de 90 % (Figure 2B). Nous avons utilisé 100 ng d’ARN fragmenté et purifié comme contrôle d’entrée, soumis directement à la préparation et au séquençage de la bibliothèque. L’ARN restant (~4,4 μg) a été traité selon le pipeline MeRIP-Seq, qui commence par l’incubation d’ARN fragmenté avec des billes liées soit à des anticorps spécifiques anti-m6A, soit à des anticorps anti-IgG comme témoin. Un RIP spécifique à m6A (MeRIP) de 2,5 μg d’ARN fragmenté a permis de récupérer environ 15 ng de matériel enrichi en m6A qui a subi une préparation et un séquençage en bibliothèque (Figure 2B). La RIP avec contrôle anti-IgG, comme prévu, n’a pas produit suffisamment d’ARN pour permettre une analyse plus approfondie (Figure 2B).
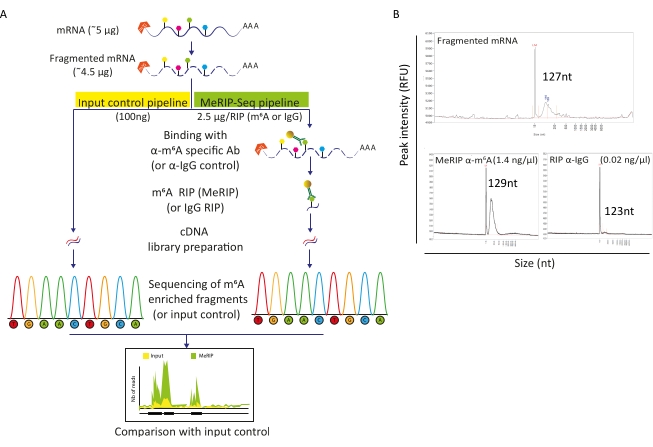
Figure 2 : Pipeline MeRIP-Seq. A) Représentation schématique du flux de travail MeRIP-Seq et du contrôle d’entrée. Lors de la sélection poly-A, les échantillons ont été fragmentés en morceaux de 120 à 150 nt et, soit directement soumis au séquençage (100 ng, contrôle d’entrée), soit utilisés pour l’immunoprécipitation de l’ARN (2,5 μg, RIP) avec un anticorps spécifique anti-m6A ou un anticorps anti-IgG comme témoin négatif avant le séquençage. B) Résultats représentatifs montrant les profils de distribution d’ARN attendus (taille et quantité) lors de la fragmentation (panneau supérieur) et RIP (panneaux inférieurs, MeRIP: à gauche, contrôle IgG: à droite). Les échantillons ont été chargés sur un analyseur de fragments pour évaluer la qualité et la concentration de l’ARN avant d’être traités ultérieurement pour la préparation et le séquençage de la bibliothèque. L’analyse de l’ARN fragmenté a été effectuée à l’aide du kit de sensibilité standard de l’ARN tandis que l’ARN immunoprécipité a utilisé le kit de haute sensibilité. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Le pipeline BS-Seq permet d’explorer la modification de l’ARN m5C à la résolution nucléotidique et conduit à l’identification de transcriptions méthylées m5C. Lors de la conversion au bisulfite, les cytosines non méthylées sont converties en uracile, tandis que les cytosines méthylées restent inchangées (figure 3A). En raison des conditions difficiles de la procédure de conversion des bisulfites (c.-à-d. température élevée et faible pH), les ARNm convertis sont fortement dégradés (figure 3B), mais cela n’interfère pas avec la préparation et le séquençage de la bibliothèque. La conversion du bisulfite n’est efficace que sur l’ARN simple brin et peut donc potentiellement être entravée par des structures secondaires d’ARN double brin. Pour évaluer l’efficacité de la conversion C-U, nous avons introduit deux contrôles. En tant que témoin positif, nous avons profité de la présence précédemment décrite d’une cytosine hautement méthylée en position C4447 de l’ARNr 28S23. Lors de l’amplification RT-PCR et du séquençage d’un fragment de 200 pb entourant le site méthylé, nous avons pu observer que toutes les cytosines ont été converties avec succès en uraciles, apparaissant ainsi comme des thymidines dans la séquence d’ADN, à l’exception de la cytosine en position 4447 qui est restée inchangée. Pour contrôler le taux de conversion des bisulfites, nous avons utilisé des séquences d’ARN ERCC synthétiques disponibles dans le commerce. Ce mélange consiste en un pool de séquences d’ARN connues, non méthylées et poly-adénylées, avec une variété de structures et de longueurs secondaires. Lors de la préparation et du séquençage de la bibliothèque, nous nous sommes concentrés sur ces séquences ERCC pour calculer le taux de conversion, qui peut être effectué en comptant le nombre de C convertis parmi les résidus C totaux dans toutes les séquences ERCC et dans chaque échantillon. Nous avons obtenu un taux de conversion de 99,5%, confirmant l’efficacité et le succès de la réaction de conversion du bisulfite (Figure 3D).
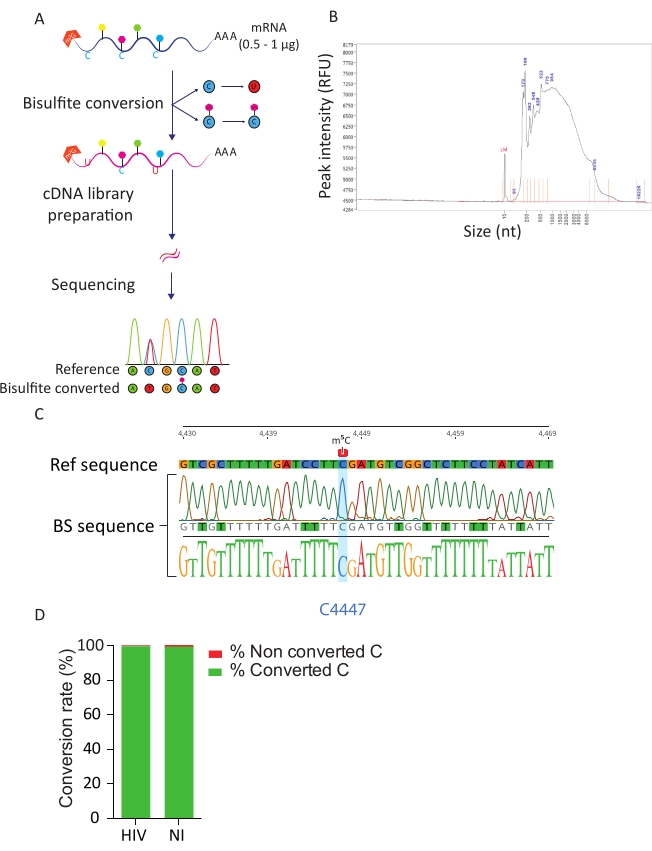
Figure 3 : Pipeline BS-Seq. A) Représentation schématique du flux de travail BS-Seq. Lors de la sélection poly-A, les échantillons sont exposés au bisulfite, ce qui entraîne une conversion de C en U (due à la désamination) pour les résidus de C non méthylés. En revanche, les résidus C méthylés (m5C) ne sont pas affectés par le traitement au bisulfite et restent inchangés. B) Résultat représentatif du profil de distribution de l’ARN converti au bisulfite (taille et quantité) lors de l’analyse sur analyseur de fragments avec un kit de sensibilité standard. C) Électrophérogramme montrant le résultat de séquençage représentatif de l’amplicon RT-PCR de la région entourant le C méthylé à 100% à la position 4447 dans l’ARNr 28S (surligné en bleu). En revanche, les résidus C de la séquence de référence ont été identifiés comme des résidus T dans la séquence amplicon en raison du succès de la conversion du bisulfite. D) Évaluation du taux de conversion C-U par analyse des séquences de pics de CCER dans les cellules infectées et non infectées par le VIH. Le taux de conversion moyen est de 99,5%. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Les échantillons enrichis en M6A, les échantillons convertis en bisulfite et les contrôles d’entrée sont ensuite traités pour la préparation de la bibliothèque, le séquençage et l’analyse bioinformatique (figure 4). Selon la conception expérimentale et la ou les questions biologiques abordées, de multiples analyses bioinformatiques peuvent être appliquées. Comme preuve de principe ici, nous montrons des résultats représentatifs d’une application potentielle (c.-à-d. l’analyse de méthylation différentielle), qui se concentre sur l’identification des transcriptions méthylées différentiellement induites lors de l’infection par le VIH. En bref, nous avons étudié le niveau de méthylation m6A ou m5C des transcriptions, indépendamment de leur niveau d’expression génique, dans les cellules non infectées et infectées par le VIH, afin de mieux comprendre le rôle des méthylations d’ARN au cours du cycle de vie viral. Lors de la normalisation de l’expression génique, nous avons identifié que le transcrit ZNF469 était différentiellement m6A-méthylé en fonction du statut d’infection, en effet ce transcrit n’était pas méthylé dans les cellules non infectées alors qu’il présentait plusieurs pics méthylés lors de l’infection par le VIH (Figure 5A). Une analyse de méthylation différentielle similaire sur m5C a révélé que le transcrit PHLPP1 contenait plusieurs résidus méthylés, qui ont tendance à être plus fréquemment méthylés dans la condition VIH (Figure 5B). Dans ce contexte, les deux analyses suggèrent que l’infection par le VIH a un impact sur l’épitranscriptome cellulaire.
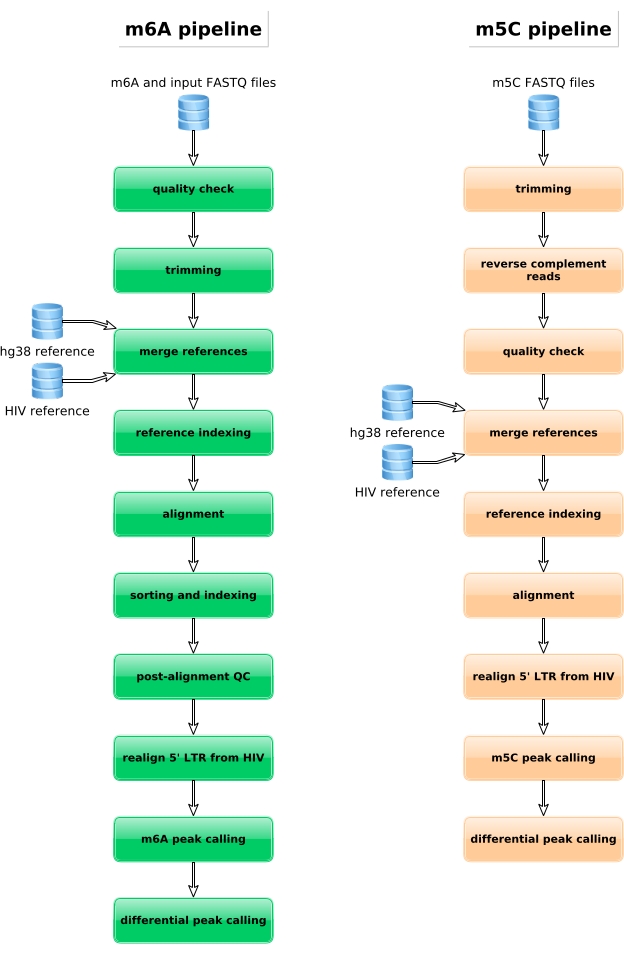
Figure 4: Représentation schématique du flux de travail bioinformatique pour l’analyse des données m6A et m5C. Veuillez cliquer ici pour voir une version plus grande de cette figure.
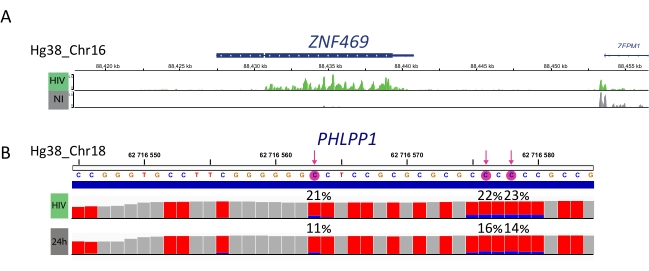
Figure 5 : Exemple de transcriptions méthylées différentiellement lors de l’infection. A) Résultat représentatif montrant une méthylation m6A du transcrit ZNF459 dans les cellules infectées par le VIH (vertes) et non infectées (grises). L’intensité maximale (lors de la soustraction de l’expression d’entrée) est indiquée sur l’axe des y et la position dans le chromosome le long de l’axe des x. L’analyse de méthylation différentielle révèle que le transcrit ZFN469 est hyperméthylé lors de l’infection par le VIH. B) Résultat représentatif du gène méthylé m5C dans les cellules infectées par le VIH (voie supérieure) et non infectées (voie inférieure). La hauteur de chaque barre représente le nombre de lectures par nucléotide et permet l’évaluation de la couverture. Chaque résidu de C est représenté en rouge, et la proportion de C méthylé est représentée en bleu. Le taux de méthylation exact (%) est rapporté au-dessus de chaque résidu C. Les flèches mettent en évidence le C méthylé différentiellement statistiquement significatif. Les échantillons ont été visualisés à l’aide de la visionneuse IGV. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Discussion
Le rôle des modifications de l’ARN dans l’infection virale est encore largement inconnu. Une meilleure compréhension du rôle des modifications épitranscriptomiques dans le contexte de l’infection virale pourrait contribuer à la recherche de nouvelles cibles de traitement antiviral.
Dans ce travail, nous fournissons un flux de travail complet qui permet d’étudier les épitranscriptomes m6A et m5C des cellules infectées. Selon la question biologique, nous vous conseillons d’utiliser de l’ARN poly-A-sélectionné comme matériau de départ. Bien qu’facultatif, car le pipeline pourrait être utilisé avec de l’ARN total, il est important de garder à l’esprit que les ARNr ainsi que les petits ARN sont fortement modifiés et contiennent un nombre important de résidus méthylés. Cela pourrait entraîner une diminution de la qualité et de la quantité de données de séquençage significatives.
Toutefois, si l’objectif de l’étude est l’ARN non poly-adénylé, l’étape d’extraction de l’ARN doit être adaptée afin d’éviter de rejeter le petit ARN (en cas d’extraction d’ARN en colonne) et de privilégier les techniques d’épuisement des ribosomes plutôt que la sélection poly-A pour entrer dans le pipeline.
Afin de garantir un ARN de haute qualité, une fragmentation correcte et une qualité d’ARN enrichi en m6A et convertie en BS appropriée pour la préparation de la bibliothèque, nous vous conseillons fortement d’utiliser un analyseur de fragments ou un bioanalyseur. Cependant, cet équipement n’est pas toujours disponible. Comme alternative, la qualité de l’ARN, de l’ARNm et la taille de l’ARN fragmenté pourraient également être évaluées par visualisation sur gel d’agarose. Alternativement, la préparation de la bibliothèque peut être effectuée sans évaluation préalable de la quantité d’ARN.
Nous avons utilisé la technique MeRIP-Seq16 à base d’anticorps pour explorer le paysage épitranscriptomique m6A. Cette technique est basée sur l’immunoprécipitation de l’ARN et est couronnée de succès; cependant, certaines étapes nécessitent une optimisation minutieuse et peuvent être critiques. Bien que la méthylation m6A ait été décrite comme se produisant principalement dans la séquence consensuelle RRA*CH, ce motif est très fréquent le long des molécules d’ARNm et ne permet pas d’identifier avec précision le site méthylé. Il est donc essentiel d’obtenir une fragmentation de l’ARN reproductible et cohérente, générant de petits fragments d’ARN, afin d’améliorer la résolution basée sur rip. Dans ce protocole, nous recommandons une procédure optimisée, fournissant des résultats reproductibles et cohérents dans notre cadre expérimental; toutefois, cette étape de fragmentation peut nécessiter une optimisation supplémentaire en fonction de fonctionnalités d’échantillon spécifiques.
Récemment, une nouvelle technique permettant le séquençage direct m6A a été décrite. Il est basé sur l’utilisation de variantes spécifiques de transcriptase inverse qui présentent des signatures RT uniques en réponse à la modification de l’ARN m6A24. Cette technologie, après une optimisation minutieuse, pourrait contourner la limitation majeure face à MeRIP-Seq (diminuer la quantité de matériau initial et permettre une résolution plus élevée). Pour explorer la modification m5C, nous avons décidé d’utiliser la technique de conversion du bisulfite afin de détecter à résolution nucléotidique les résidus C modifiés. Afin de réduire le taux de faux positifs dû à la présence de structures secondaires d’ARN, nous avons effectué 3 cycles de conversion de dénaturation / bisulfite et contrôlé davantage les performances du taux de conversion de bisulfite grâce à l’utilisation de contrôles de pointe ERCC. L’une des limites liées à cette technique est que la conversion du bisulfite est très dure et que trois cycles de conversion dénaturation/bisulfite pourraient dégrader une partie de l’ARN et donc réduire la résolution. Cependant, dans notre environnement, nous avons choisi de nous contenter d’une résolution potentiellement légèrement inférieure afin d’augmenter la qualité de l’ensemble de données.
Grâce à ces optimisations et contrôles, nous avons pu fournir un flux de travail fiable et solide qui peut être exploité pour étudier le paysage épitranscriptomique et son altération dans le contexte d’infections virales, d’interactions hôte-pathogène ou de toute exposition à des traitements spécifiques.
Déclarations de divulgation
Les auteurs n’ont rien à divulguer.
Remerciements
Ce travail a été soutenu par le Fonds national suisse de la recherche scientifique (subventions 31003A_166412 et 314730_188877).
matériels
| Name | Company | Catalog Number | Comments |
| AccuPrime Pfx SuperMix | Invitrogen | 12344-040 | |
| anti-m6A antibody _Clone 17-3-4-1 | Millipore | MABE1006 | |
| Chloroform | Merck | 67-66-3 | |
| ERCC | Invitrogen | 4456740 | |
| EZ RNA Methylation Kit | Zymo Research | EZR5001 | |
| Fragment analyzer RNA Kit - HS RNA Kit | Agilent | DNF-472-0500 | |
| Fragment analyzer RNA Kit - RNA Kit | Agilent | DNF-471-0500 | |
| High-Capacity cDNA Reverse Transcription Kit | Applied Biosystem | 4368814 | |
| Illumina TruSeq Stranded mRNA | Illumina | 20020594 | |
| Magnetic Beads A/G Blend | Merck | 16-663 | |
| N6-Methyladenosine, 5′-monophosphate sodium salt (m6A) | Sigma Aldrich | M2780-10MG | |
| Normal Mouse IgG | Merk | 12371 | |
| Oligo(dT)25 | Life Technologies | 61005, | |
| PCRapace | Stratec | 1020220300 | |
| Quick RNA Viral Kit | Zymo Research | 1034 | |
| RNA Clean & Concentrator | Zymo Research | R1015 | |
| RNA Fragmentation Reagent | Ambion | AM8740 | |
| RNase Inhibitor | Ambion | AM2684 | |
| Trizol | TRIzol Reagent | 15596026 |
Références
- Machnicka, M. A., et al. MODOMICS: a database of RNA modification pathways--2013 update. Nucleic Acids Research. 41, 262-267 (2013).
- Zaccara, S., Ries, R. J., Jaffrey, S. R. Reading, writing and erasing mRNA methylation. Nature Reviews Molecular Cell Biology. 20 (10), 608-624 (2019).
- Davalos, V., Blanco, S., Esteller, M. SnapShot: Messenger RNA Modifications. Cell. 174 (2), 498 (2018).
- Saletore, Y., et al. The birth of the Epitranscriptome: deciphering the function of RNA modifications. Genome Biology. 13 (10), 175 (2012).
- Zhao, B. S., Roundtree, I. A., He, C. Post-transcriptional gene regulation by mRNA modifications. Nature Reviews Molecular Cell Biology. 18 (1), 31-42 (2017).
- Netzband, R., Pager, C. T. Epitranscriptomic marks: Emerging modulators of RNA virus gene expression. Wiley Interdisciplinary Reviews: RNA. 11 (3), 1576 (2020).
- Pereira-Montecinos, C., Valiente-Echeverria, F., Soto-Rifo, R. Epitranscriptomic regulation of viral replication. Biochimica et Biophysica Acta. 1860 (4), 460-471 (2017).
- Lichinchi, G., et al. Dynamics of the human and viral m(6)A RNA methylomes during HIV-1 infection of T cells. Nature Microbiology. 1, 16011 (2016).
- Courtney, D. G., et al. Epitranscriptomic Addition of m(5)C to HIV-1 Transcripts Regulates Viral Gene Expression. Cell Host & Microbe. 26 (2), 217-227 (2019).
- Kennedy, E. M., et al. Posttranscriptional m(6)A Editing of HIV-1 mRNAs Enhances Viral Gene Expression. Cell Host & Microbe. 19 (5), 675-685 (2016).
- Tirumuru, N., Wu, L. HIV-1 envelope proteins up-regulate N (6)-methyladenosine levels of cellular RNA independently of viral replication. Journal of Biological Chemistry. 294 (9), 3249-3260 (2019).
- Tirumuru, N., et al. N(6)-methyladenosine of HIV-1 RNA regulates viral infection and HIV-1 Gag protein expression. Elife. 5, (2016).
- Cristinelli, S., Angelino, P., Janowczyk, A., Delorenzi, M., Ciuffi, A. HIV Modifies the m6A and m5C Epitranscriptomic Landscape of the Host Cell. Frontiers in Virology. 1 (11), (2021).
- Khoddami, V., Cairns, B. R. Transcriptome-wide target profiling of RNA cytosine methyltransferases using the mechanism-based enrichment procedure Aza-IP. Nature Protocols. 9 (2), 337-361 (2014).
- Hussain, S., Aleksic, J., Blanco, S., Dietmann, S., Frye, M. Characterizing 5-methylcytosine in the mammalian epitranscriptome. Genome Biology. 14 (11), 215 (2013).
- Dominissini, D., Moshitch-Moshkovitz, S., Salmon-Divon, M., Amariglio, N., Rechavi, G. Transcriptome-wide mapping of N6-methyladenosine by m6A-seq based on immunocapturing and massively parallel sequencing. Nature Protocols. 8 (1), 176-189 (2013).
- Dominissini, D., et al. Topology of the human and mouse m6A RNA methylomes revealed by m6A-seq. Nature. 485 (7397), 201-206 (2012).
- Shobbir Hussain, J. A., Blanco, S., Dietmann, S., Frye, M. Characterizing 5-methylcytosine in the mammalian epitranscriptome. Genome Biology. 14 (215), (2013).
- Amort, T., et al. Distinct 5-methylcytosine profiles in poly(A) RNA from mouse embryonic stem cells and brain. Genome Biology. 18 (1), 1 (2017).
- Endrullat, C., Glökler, J., Franke, P., Frohme, M. Standardization and quality management in next-generation sequencing. Applied & Translational Genomics. 10, 2-9 (2016).
- Schaefer, M., Pollex, T., Hanna, K., Lyko, F. RNA cytosine methylation analysis by bisulfite sequencing. Nucleic Acids Research. 37 (2), 12 (2009).
- Cristinelli, S., Angelino, P., Janowczyk, A., Delorenzi, M., Ciuffi, A. HIV Modifies the m6A and m5C Epitranscriptomic Landscape of the Host Cell. biorxiv. 1 (11), (2021).
- Squires, J. E., et al. Widespread occurrence of 5-methylcytosine in human coding and noncoding RNA. Nucleic Acids Research. 40 (11), 5023-5033 (2012).
- Aschenbrenner, J., et al. Engineering of a DNA Polymerase for Direct m(6) A Sequencing. Angewandte Chemie (International ed. in English). 57 (2), 417-421 (2018).
- Didion, J. P., Martin, M., Collins, F. S. Atropos: specific, sensitive, and speedy trimming of sequencing reads. PeerJ. 5, 3720 (2017).
- Kim, D., Langmead, B., Salzberg, S. L. HISAT: a fast spliced aligner with low memory requirements. Nature Methods. 12 (4), 357-360 (2015).
- Li, H., et al. The Sequence Alignment/Map format and SAMtools. Bioinformatics. 25 (16), 2078-2079 (2009).
- Okonechnikov, K., Conesa, A., García-Alcalde, F. Qualimap 2: advanced multi-sample quality control for high-throughput sequencing data. Bioinformatics. 32 (2), 292-294 (2016).
- Ewels, P., Magnusson, M., Lundin, S., Käller, M. MultiQC: summarize analysis results for multiple tools and samples in a single report. Bioinformatics. 32 (19), 3047-3048 (2016).
- Zhang, Y., et al. Model-based Analysis of ChIP-Seq (MACS). Genome Biology. 9 (9), 137 (2008).
- Martin, M. Cutadapt removes adapter sequences from high-throughput sequencing reads. EMBnet Journal. 17 (1), (2011).
- Shen, W., Le, S., Li, Y., Hu, F. SeqKit: A Cross-Platform and Ultrafast Toolkit for FASTA/Q File Manipulation. PLOS ONE. 11 (10), 0163962 (2016).
- Rieder, D., Amort, T., Kugler, E., Lusser, A., Trajanoski, Z. meRanTK: methylated RNA analysis ToolKit. Bioinformatics. 32 (5), 782-785 (2015).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon