Method Article
التصور ثلاثي الأبعاد لمجموعات الخلايا المناعية في الأنسجة المصابة بفيروس نقص المناعة البشرية عن طريق المسح المجهري ، والتلوين المناعي ، والكونكسي ، واللوح المضان الخفيف
In This Article
Summary
يسمح تطهير الأنسجة ، جنبا إلى جنب مع الفحص المجهري المناعي ، بالتصور المكاني والقياس الكمي لمجموعات الخلايا المناعية وبروتينات الفيروس داخل الأنسجة السليمة. يمكن أن يؤدي التقسيم البصري للأنسجة التي تم تطهيرها باستخدام الفحص المجهري الفلوري أحادي البؤر والضوء إلى إنشاء نماذج ثلاثية الأبعاد لبيئات الأنسجة المعقدة والكشف عن عدم التجانس المكاني الذي يظهر أثناء الإصابة بفيروس نقص المناعة البشرية.
Abstract
يعد فيروس نقص المناعة البشرية (HIV) ، العامل المسبب لمتلازمة نقص المناعة المكتسب (الإيدز) ، مصدر قلق صحي عالمي رئيسي حيث أصيب ما يقرب من 40 مليون شخص في جميع أنحاء العالم ولا يوجد علاج متاح على نطاق واسع. على الرغم من الجهود المكثفة ، لا يزال الفهم التفصيلي لتفاعلات الفيروس والخلايا المضيفة في الأنسجة أثناء الإصابة والاستجابة للعلاج غير مكتمل. لمعالجة هذه القيود ، يتم تطبيق تقنيات إزالة الأنسجة القائمة على الماء CUBIC (كوكتيلات تصوير الدماغ / الجسم الواضحة والخالية من العوائق والتحليل الحسابي) و CLARITY (التصوير الصلب المهجن بالأكريلاميد / التلوين المناعي / الأنسجة المتوافقة مع التهجين في الموقع) يتم تطبيقها لتصور تفاعلات الخلايا المضيفة للفيروس المعقدة في الأنسجة المصابة بفيروس نقص المناعة البشرية من النماذج الحيوانية والبشر باستخدام الفحص المجهري الفلوري متحد البؤر والضوء للصفائح. يسمح التقسيم البصري للأنسجة السليمة وتحليل الصور بإعادة بناء المعلومات المكانية الموجودة في الأنسجة بأكملها وتحديد أعداد الخلايا المناعية أثناء الإصابة. هذه الطرق قابلة للتطبيق على معظم مصادر الأنسجة والأسئلة البيولوجية المتنوعة ، بما في ذلك الأمراض المعدية والسرطان.
Introduction
أدت الحاجة المتزايدة للتصوير الكمي للأنسجة المكانية في البحث البيولوجي مؤخرا إلى ظهور تقنيات إزالة الأنسجة لتوليد صور أكبر حجما (مم3 سم 3) للأنسجة السليمة بدقة خلية واحدة. تشمل الأنسجة منظمات معقدة من الجزيئات الحيوية ذات الهياكل والتركيبات والوظائف المحددة بشكل فريد. لسوء الحظ ، فإن العديد من الجزيئات الحيوية الموجودة في الأنسجة (مثل الدهون والكروموفورات) تشتت أو تمتص أو تنبعث منها الضوء عند تصويرها عبر المجهر الضوئي ، مما يجعل التصوير بكميات كبيرة أمرا صعبا. علاوة على ذلك ، غالبا ما تظهر الأنسجة معامل انكسار غير متطابق مع حلول التصوير القياسية والعدسات البصرية ، مما يؤدي إلى تشوهات بصرية أثناء التصوير. يجب أن يتضمن النهج الأمثل لتصوير كميات كبيرة من الأنسجة بالمجهر الضوئي مطابقة معامل الانكسار للأنسجة ومحاليل التصوير والأهداف ، مع السماح باختراق الضوء بعمق في الأنسجة دون تعطيل السمات البيولوجية للأنسجة السليمة أثناء المعالجة. تم إجراء محاولات أولية لتقليل الاختلافات في معامل الانكسار بين الأنسجة ومحاليل التصوير من خلال إزالة عينات الأنسجة غير الشفافة من قبل عالم التشريح الألماني فيرنر سبالتهولز في أواخر القرن التاسععشر 1. تضمنت تقنية إزالة الأنسجة هذه مذيبات كيميائية قاسية ، والتي يمكن أن تلحق الضرر بعينات الأنسجة ، ولكنها مع ذلك تمثل أول تصوير أكبر حجما تم الإبلاغ عنه للأنسجة السليمة. أدت طرق الفحص المجهري الضوئي الحديثة ، جنبا إلى جنب مع قوة الحوسبة لالتقاط الصور وتحليلها ، مؤخرا إلى جعل إزالة الأنسجة رائجة مرة أخرى كطريقة لتصوير عينات الأنسجة الكبيرة السليمة بدقة الخلية الواحدة. خلال العقدين الماضيين ، ظهرت العشرات من تقنيات إزالة الأنسجة المتقدمة ، بما في ذلك كل من المركبات العضوية والمائية ، ولكل منها نقاط قوة وضعف لتطبيقات محددة.
يمكن لتصوير الأنسجة ثلاثي الأبعاد أن يحقق في تفاعلات بيولوجية أكثر تعقيدا لا يمكن استنساخها في زراعة الخلايا. على سبيل المثال ، تم تعيين أنماط إشارات الخلية2 ، والتوزيعات المكانية لأنواع الخلاياالمتميزة 3 ، واتصال الدماغ4 مسبقا بطريقة كمية باستخدام طرق تصوير الأنسجة / الأعضاء بالكامل. الموصوف هنا هو تطبيق بروتوكولات تطهير الأنسجة القائمة على الماء لإزالة ومناعة وتصور مجموعات الخلايا المستهدفة المميزة لفيروس نقص المناعة البشرية داخل الأنسجة اللمفاوية المصابة بفيروس نقص المناعة البشرية السليمة أثناء العدوى النشطة. داخل الجسم ، يصيب فيروس نقص المناعة البشرية في الغالب الخلايا التائية CD4 + ويدمج نسخة من جينومها في جينومات الخلايا المضيفة المصابة. يختطف الفيروس بعد ذلك آلية الخلية المضيفة المصابة لتكرار نفسها ، مما يؤدي إلى انتشار الفيروس ، وقتل الخلايا المضيفة ، والخلل المناعي ، والتقدم على المدى الطويل نحو الإيدز. من المهم ملاحظة أن سلوكيات الخلايا التائية المصابة في زراعة الأنسجة والخلايا متناقضة بشكل ملحوظ. يمكن أن تنتج الخلايا التائية CD4 + المستنبتة المحتضنة بفيروس نقص المناعة البشرية خلوية ضخمة ناتجة عن فيروس نقص المناعة البشرية قد تشمل العشرات من النوى5 ، في حين أن التجارب المماثلة مع الخلايا التائية الأولية CD4 + المزروعة في الهلاميات المائية ثلاثية الأبعاد خارج الخلية (ECM) أو عينات الأنسجة من الفئران المتوافقة مع البشر المصابة بفيروس نقص المناعة البشرية (الفئران) تنتج عموما خلوية مع 2-5 نوى6. من المحتمل أن يكون فهم الانتقال الموضعي من خلية إلى خلية والانتشار الجهازي للفيروس داخل الأفراد المصابين بفيروس العوز المناعي البشري أكثر تعقيدا ، حيث ينطوي على نقل الفيروس عن طريق أنواع متعددة من الخلايا المصابة من الأنسجة إلى الأوعية الدموية إلى الأنسجة الجديدة ، حيث يمكن للفيروسات الحرة والخلايا المنتجة للفيروسات الوصول إلى عدد كبير من الخلايا الليمفاويةالحساسة 7. لا يمكن حاليا تلخيص هذه السيناريوهات في أنظمة زراعة الخلايا ، وتظل الأنسجة من النماذج الحيوانية والبشر مصدرا مهما لفهم التسبب في الفيروس في سياق كائن حي معقد بنظام مناعي فعال.
تزيد العلاجات الحالية المضادة للفيروسات القهقرية (ARTs) بشكل كبير من متوسط العمر المتوقع والجودة للأشخاص المصابين بفيروس العوز المناعي البشري (PWH) عن طريق تثبيط تكاثر فيروس نقص المناعة البشرية ووقف تطور المرض نحو الإيدز. لسوء الحظ ، لا يقضي العلاج المضاد للفيروسات القهقرية على الخلايا المناعية المصابة بشكل كامن التي تحتوي على إدخال جينوم الفيروسات القهقرية الهادئة والتي لا تنتج الفيروسات بنشاط. على الرغم من أن الفيروس لا يمكن اكتشافه في دم معظم الأفراد الذين يتناولون العلاج المضاد للفيروسات القهقرية، إلا أن أحمال الفيروسات ترتد بسرعة بعد توقف العلاج المضاد للفيروسات القهقرية واستمرار تطورالمرض 8. تمثل الطبيعة المستمرة للعدوى بفيروس نقص المناعة البشرية الناجمة عن المستودع الكامن للخلايا المصابة عائقا هائلا أمام إنشاء علاج لفيروس نقص المناعة البشرية. لا تزال خزانات أنسجة فيروس العوز المناعي البشري غير مفهومة جيدا ، ومن الأهمية بمكان إنشاء فهم أعمق لهذه الخزانات في الأنسجة اللمفاوية قبل وأثناء وبعد العلاج المضاد للفيروسات القهقرية ، لتوصيف التسبب في الفيروس بشكل كامل وتقييم العلاجات الجديدة التي تقضي بشكل فعال على الخلايا المصابة الكامنة التي لا تنتج الفيروس بنشاط.
هنا ، تم تطبيق CUBIC3 و CLARITY9 ، وهما بروتوكولان لإزالة الأنسجة القائمة على الماء تم تكييفهما سابقا ، لتصوير مجموعات الخلايا المناعية داخل العديد من الأنسجة اللمفاوية السليمة من الفئران المصابة بفيروس نقص المناعة البشرية ذات الجهاز المناعي المتوافق مع البشر (الفئران البالغة الأناقة) ، والرئيسيات غير البشرية المصابة ب SIV / SHIV (NHP) ، والبشر المصابين بفيروس نقص المناعة البشرية. هذه البروتوكولات قابلة للتكيف مع كل من الفحص المجهري الفلوري للصفائح المضنية متحد البؤر والضوء اعتمادا على أهداف التصوير (دقة أعلى مقابل حجم أكبر) والأجهزة المتاحة. على الرغم من أن الفحص المجهري الضوئي لا يمكنه حل الفيروسات الفردية ، إلا أن استخدام التألق المناعي يمكن أن يحدد مناطق الأنسجة التي تحتوي على خلايا منتجة للفيروسات والفيروسات والتي يمكن تحليلها بشكل أكبر بطرق عالية الدقة. يمكن تكييف الطرق المعروضة هنا لتصور أي نسيج تقريبا في الجسم بدقة خلية واحدة من أجل تحديد العلاقات المكانية بين أنواع معينة من الخلايا في ظروف مختلفة أثناء الإصابة ويمكن ترجمتها بسهولة إلى عينات من المرضى البشريين ذات الصلة للغاية لدراسة الأمراض المعدية أو السرطان.
Protocol
أجريت جميع التجارب على وفقا لبروتوكولات رعاية المؤسسية المعتمدة. تم الحصول على جميع الأنسجة البشرية وفقا لإرشادات أخلاقيات البحث البشري المؤسسية المعتمدة.
1. حصاد الأنسجة وتثبيتها (نفس الشيء بالنسبة ل CUBIC و CLARITY)
- تحديد وتشريح الأنسجة اللمفاوية كما هو موضح سابقا10.
- استئصال الأنسجة اللمفاوية بمقص تشريح وملاقط في غضون دقائق بعد الوفاة ، عندما يكون ذلك ممكنا بأمان.
- ضع عينات الأنسجة في مخزن مؤقت مثبت مثلج طازج يحتوي على 8٪ بارافورمالدهيد (PFA) ، و 5٪ سكروز في 0.1 متر من كاكوديلات الصوديوم ثلاثي الهيدرات للحفاظ على عينات الأنسجة بشكل كاف للفحص المجهري الضوئي (LM) أو المجهر الإلكتروني (EM) أو المناعي EM. بدلا من ذلك ، قم بإصلاح عينات LM مع 4٪ PFA في 0.1 M PBS. قم بإصلاح العينات طوال الليل قبل البدء في عملية المقاصة لضمان التعطيل الكامل للفيروس.
تنبيه: بارافورمالدهيد سام عن طريق ملامسة الجلد والاستنشاق وهو أيضا مادة صلبة قابلة للاشتعال. تعامل بعناية وتخزينها في خزانة تخزين قابلة للاشتعال. ثلاثي هيدرات الكاكوديلات الصوديوم سام إذا تم ابتلاعه أو استنشاقه. - التقط صورة مرجعية للأنسجة قبل البدء في عملية التطهير.
ملاحظة: يمكن تخزين عينات LM لمدة عام واحد على الأقل في هذه الظروف. للعمل مع العينات التي تعبر عن بروتينات الفلورسنت الداخلية ، احتفظ دائما بالعينات في الظلام في الخطوات اللاحقة.
2. إزالة الأنسجة المكعبة
- اشطف عينات الأنسجة اللمفاوية في معقم 0.1 M PBS ثلاث مرات مع الرج في درجة حرارة الغرفة لمدة 15 دقيقة لضمان إزالة PFA أثناء كل تغيير في العازلة.
ملاحظة: تخلص من السوائل التي تحتوي على PFA وفقا للإرشادات المؤسسية. - اغمر عينة الأنسجة اللمفاوية في كاشف مكعب -1 (انظر جدول المواد) عند 37 درجة مئوية لمدة 3 أيام مع رج لطيف. التقط صورا مرجعية منتظمة لمراقبة عملية إزالة اللون بمرور الوقت.
- استبدل الكاشف -1 لمدة 3-4 أيام إضافية من الغمر ، أو حتى يكتمل إزالة لون الأنسجة. يعتمد الوقت اللازم للتطهير على كل من حجم ونوع الأنسجة. لتسريع عملية إزالة لون الأنسجة ، قم بتحديث كاشف CUBIC -1 يوميا واستخدم كميات أكبر.
- اغسل عينات الأنسجة اللمفاوية ثلاث مرات باستخدام 0.1 M PBS لمدة 30 دقيقة في درجة حرارة الغرفة مع رج لطيف.
- اغمر عينات الأنسجة اللمفاوية في الكاشف المكعب -2 (انظر جدول المواد) عند 37 درجة مئوية مع رج لطيف لمدة 2-7 أيام أو حتى تتحقق الشفافية الكاملة. إذا لم تحقق العينات شفافية كاملة ، كرر الخطوات 2.2-2.5 حتى لا تتقدم الإزالة بعد الآن. التقط صورا مرجعية منتظمة لمراقبة عملية المقاصة بمرور الوقت.
- اغسل عينات الأنسجة اللمفاوية ثلاث مرات باستخدام 0.1 M PBS لمدة 30 دقيقة في درجة حرارة الغرفة مع رج لطيف.
- قم بتخزين العينات في كاشف مكعب -2 مع 0.01٪ حجم / حجم (V / V) أزيد الصوديوم في الظلام (انظر جدول المواد).
ملاحظة: يمكن تخزين العينات لمدة 6 أشهر على الأقل باستخدام هذه الطريقة.
تنبيه: أزيد الصوديوم شديد السمية ويشكل خطرا خطيرا على الاستنشاق. يوصى بشراء محاليل مخففة بنسبة 5٪ أزيد الصوديوم أو أقل.
3. حجب العينات المكعبة وتلوينها المناعي
- اغسل عينات الأنسجة اللمفاوية ثلاث مرات باستخدام 0.1 M PBS لمدة 30 دقيقة لكل منها في درجة حرارة الغرفة مع رج لطيف.
- للتصوير باستخدام مجهر متحد البؤر ، قم بتقطيع الأنسجة إلى شرائح بسمك ~ 0.5-1 مم باستخدام مصفوفة تقطيع الأنسجة. لإجراء الفحص المجهري الفلوري للصفائح الضوئية (LSFM) ، قم بسد منطقة الأنسجة بأكملها.
- قم بحظر العينات ب 5 مل من محلول حجب CUBIC طوال الليل عند 4 درجات مئوية مع الاهتزاز (انظر جدول المواد). عند العمل مع NHP أو عينات بشرية ، استخدم FcR المضاد للإنسان. عند العمل مع عينات الماوس، استخدم FcR المضاد للماوس في حل الحظر.
- تلطيخ العينات ب 5 مل من الأجسام المضادة الأولية (انظر جدول المواد) في محلول مانع (بدون FcR خاص بالأنواع) لمدة 3 أيام في درجة حرارة الغرفة مع الاهتزاز (اختياري: جهاز الطرد المركزي لمخزون الأجسام المضادة المركز عند 2,300 × جم لمدة 5 دقائق قبل الاستخدام ، لتقليل إضافة الجسم المضاد المجمع).
- اغسل العينة الملطخة في درجة حرارة الغرفة مع الرج لمدة 5 ساعات على الأقل إجمالا مع خمس عمليات على الأقل من الاستبدال لمحلول الغسيل (انظر جدول المواد).
- تلطيخ العينات بالأجسام المضادة الثانوية (انظر جدول المواد) في محلول مانع (بدون FcR خاص بالأنواع) لمدة 3 أيام في درجة حرارة الغرفة مع الاهتزاز (اختياري: الطرد المركزي للأجسام المضادة عند 2,300 × جم لمدة 5 دقائق قبل الاستخدام لتقليل تراكم الأجسام المضادة).
- اغسل العينة الملطخة خمس مرات بمحلول الغسيل في درجة حرارة الغرفة مع الرج لمدة 5 ساعات على الأقل في المجموع.
- قم بتلطيخ العينات ب 5 مل من محلول تلطيخ DAPI (انظر جدول المواد) لكل عينة من الأنسجة واحتضانها لمدة 10 دقائق في درجة حرارة الغرفة. اترك العينات تبقى في محلول بقع DAPI في الظلام عند 4 درجات مئوية للتصوير لاحقا.
- اغسل عينات الأنسجة اللمفاوية بمحلول الغسيل ثلاث مرات في درجة حرارة الغرفة مع رجها لمدة 30 دقيقة لكل منها.
- اغمر العينة الملطخة في كاشف مكعب -2 طوال الليل في درجة حرارة الغرفة في الظلام قبل تركيب العينة.
4. نقاء الأنسجة
- اشطف عينات الأنسجة اللمفاوية في معقمة 0.1 M PBS ثلاث مرات مع رجها في درجة حرارة الغرفة لمدة 15 دقيقة لكل منها لإزالة PFA.
- ضع عينات الأنسجة في 15 مل من محلول الأكريلاميد الطازج واحتضنه عند 4 درجات مئوية طوال الليل مع تحريك لطيف (انظر جدول المواد).
تنبيه: الأكريلاميد غير المبلمر هو سم عصبي قوي ويتم امتصاصه بسهولة من خلال الجلد. تجنب أي ملامسة للجلد واشطفها على الفور في حالة حدوث ملامسة. - اسمح لعينات الأنسجة بالتسخين إلى درجة حرارة الغرفة.
- اختياري: قم بتفريغ عينات الأنسجة عن طريق فقاعات النيتروجين في محلول الأكريلاميد لمدة 1 دقيقة. احرص على استخدام معدل تدفق منخفض يتجنب رش مادة الأكريلاميد السامة غير المبلمرة (~ 1-2 فقاعات / ثانية).
- ضع عينات الأنسجة في حمام مائي 37 درجة مئوية لمدة 1-3 ساعات للبلمرة ، مع قلبها كل 15 دقيقة. قم بإزالة العينات بمجرد اكتشاف بلمرة ملحوظة ، كما يتضح من سائل لزج ، أو ظهور خطوط Schleren أثناء الخلط ، أو تكوين كبسولة شفافة حول الأنسجة.
ملاحظة: في حالة حدوث بلمرة كاملة لمحلول الأكريلاميد ، قم بقص الهيدروجيل الزائد من العينة واستمر في البروتوكول. - اغسل عينات الأنسجة بمعقم 0.1 M PBS ثلاث مرات لمدة 30 دقيقة لكل منها في درجة حرارة الغرفة مع رج لطيف لإزالة محلول الأكريلاميد.
- ضع عينات الأنسجة في 15 مل من 8٪ SDS في 0.1 M PBS عند 37 درجة مئوية مع هزاز لطيف لمدة 2-5+ أيام للسماح بالتخلية. قم بتحديث حل SDS بنسبة 8٪ بشكل دوري واستخدم ما يصل إلى 50 مل من المحلول لتسريع الإزالة ، إذا لزم الأمر. أوقف عملية المقاصة عندما تكون العينات شفافة بصريا أو لم تعد تتقدم. التقط صورا مرجعية منتظمة لمراقبة عملية المقاصة بمرور الوقت.
- اغسل عينات الأنسجة بمعقم 0.1 M PBS خمس مرات خلال يوم واحد في درجة حرارة الغرفة مع رج لطيف.
- احتفظ بالعينات مؤقتا في 0.1 M PBS (بالإضافة إلى 0.01٪ من الحجم / الحجم (حجم / حجم حجم) NaN3 للتخزين على المدى الطويل) في الظلام حتى تصبح جاهزة لتصوير التألق الداخلي.
- ضع الأنسجة في 5 مل من وسائط التصوير RI-2 (انظر جدول المواد). احتضن طوال الليل في درجة حرارة الغرفة في الظلام للتحقق من اكتمال عملية المقاصة قبل التلوين المناعي. التقط صورا مرجعية لمراقبة شفافية الأنسجة.
5. حجب عينات CLARITY وتلوينها المناعي
ملاحظة: تشبه هذه الخطوات حجب الأنسجة المنقحة CUBIC وتلوينها المناعي ولكنها تستخدم تركيبات مختلفة لحجب المحاليل والغسيل والتلطيخ.
- اغسل عينات الأنسجة اللمفاوية ثلاث مرات باستخدام 0.1 M PBS لمدة 30 دقيقة في كل مرة في درجة حرارة الغرفة مع رج برفق.
- للتصوير باستخدام مجهر متحد البؤر ، قم بتقطيع الأنسجة إلى شرائح بسمك ~ 0.5-1 مم باستخدام قطاعة ومصفوفة أنسجة 0.5 مم. لإجراء LSFM ، قم بحظر عينة الأنسجة بأكملها.
- قم بحظر العينات ب 5 مل من محلول حجب CLARITY (انظر جدول المواد) طوال الليل عند 4 درجات مئوية مع الرج.
- تلطيخ العينات ب 5 مل من الأجسام المضادة الأولية (انظر جدول المواد) في محلول مانع (بدون FcR خاص بالأنواع) لمدة 3 أيام في درجة حرارة الغرفة مع الاهتزاز (اختياري: الطرد المركزي للأجسام المضادة عند 2,300 × جم لمدة 5 دقائق قبل الاستخدام لتقليل تراكم الأجسام المضادة).
- اغسل العينة الملطخة خمس مرات بمحلول الغسيل في درجة حرارة الغرفة مع الرج لمدة 5 ساعات على الأقل في المجموع (انظر جدول المواد).
- تلطيخ العينات ب 5 مل من الأجسام المضادة الثانوية (انظر جدول المواد) في محلول مانع (بدون FcR خاص بالأنواع) لمدة 3 أيام في درجة حرارة الغرفة مع الاهتزاز (اختياري: الطرد المركزي للأجسام المضادة عند 2,300 × جم لمدة 5 دقائق قبل الاستخدام لتقليل تراكم الأجسام المضادة). لتقصير الطول الكلي للبروتوكول ، استخدم الأجسام المضادة الأولية المترافقة مع الفلوروفورات للتخلص من الحاجة إلى الحضانة بالأجسام المضادة الثانوية.
- اغسل العينة الملطخة خمس مرات بمحلول الغسيل في درجة حرارة الغرفة مع الرج لمدة 5 ساعات على الأقل في المجموع.
- قم بتلطيخ العينات ب 5 مل من محلول تلطيخ DAPI (انظر جدول المواد) لكل عينة من الأنسجة واحتضانها لمدة 10 دقائق في درجة حرارة الغرفة. اترك العينات تبقى عند 4 درجات مئوية في الظلام في محلول بقع DAPI للتصوير لاحقا.
- اغسل عينات الأنسجة اللمفاوية بمحلول الغسيل ثلاث مرات في درجة حرارة الغرفة مع الرج لمدة 30 دقيقة في كل مرة.
- ضع الأنسجة في 5 مل من وسائط التصوير RI-2 (R.I. = 1.46) واحتضنها طوال الليل في درجة حرارة الغرفة في الظلام قبل تركيب العينة (انظر خطوتي البروتوكول 6 و 7).
6. تركيب وتصوير عينات الأنسجة التي تم تطهيرها للفحص المجهري متحد البؤر
- انزع جانبا واحدا من الطبقة الواقية لعزل السيليكون اللاصق.
- قم بلصق زجاج غطاء المجهر (22 مم × 40 مم ، سمك 0.25 مم) على الجانب المقشر من عازل السيليكون لتشكيل مساحة مقاومة للسوائل للعينة.
- انزع الجانب الآخر من طبقة الحماية لعزل السيليكون اللاصق.
- ضع عينة التصوير في وسط عازل السيليكون، ثم أضف كاشف مكعب-2 أو وسائط التصوير RI-2 حسب الاقتضاء حتى يصل سطح السائل إلى ارتفاع حافة المعزل.
- لتقليل احتجاز فقاعات الهواء داخل عازل السيليكون ، قم بمحاذاة زجاج الغطاء الثاني ووضعه برفق لأسفل من جانب واحد باستخدام ملقط EM. امسح أي سائل زائد. اضغط برفق على زجاج الغطاء حول بئر (بئر) العينة باستخدام الجزء الخلفي من الملقط لإغلاق المادة اللاصقة. قم بتخزين العينات المركبة أفقيا في الظلام.
ملاحظة: يمكن تصوير العينات بعد أسابيع إلى شهور من تركيبها. ومع ذلك ، تنخفض جودة التصوير بشكل عام بمرور الوقت. - ضع الشريحة المثبتة على مرحلة المجهر وحدد موقع العينة باستخدام الضوء الأبيض وهدف تكبير أقل (2-10x).
- قم بإعداد ملف تعريف اكتساب التألق بناء على الفلوروفورات الفردية المختارة.
ملاحظة: يوصى بالحصول على قنوات فلوروفور منفصلة بشكل فردي. ينتج عن هذا وقت اكتساب أطول ولكنه يقلل من التداخل الطيفي واكتساب إشارة مضان غير محددة. يمكن أن يتضمن ملف تعريف الفلوروفور الشائع DAPI (450 نانومتر) و Alexa488 و Alexa594 و Alexa647 (أو المجموعات ذات الصلة) لتقليل التداخل الطيفي أثناء الحصول على الصور. - اختر هدف تكبير مناسب لتصوير المناطق ذات الاهتمام. استخدم أهداف تكبير أقل (2-10x) للتصوير الأكبر حجما أو الأنسجة الكاملة بدقة خلية واحدة واستخدم أهداف تكبير أعلى (20-63x) لتصور أعلى دقة للتفاصيل تحت الخلوية في الأنسجة التي تم تطهيرها. قم بمطابقة معامل الانكسار للأهداف ووسائط التصوير والأنسجة قدر الإمكان لتقليل إدخال التشوهات البصرية أثناء الحصول على الصورة.
- اختر حجم خطوة لاكتساب Z-stack. لأهداف التكبير المنخفضة (2-10x)، حدد حجم خطوة ~3-5 ميكرومتر للكشف عن التألق من خلية فردية في شرائح Z مستمرة متعددة للنمذجة ثلاثية الأبعاد مع تقليل إجمالي وقت الاستحواذ والحجم الكلي للملف. للحصول على أهداف تكبير أعلى (20-63x)، حدد حجم خطوة ~ 1 ميكرومتر أو أقل لتقليل فقدان المعلومات الخلوية الفرعية بين شرائح Z الفردية.
- قم بتكبير مجال الرؤية لتصور المنطقة الكاملة من الأنسجة المراد تصويرها في البعدين X و Y مع أقل مساحة شاغرة قدر الإمكان. قم بتعيين إحداثيات الاستحواذ العلوية والسفلية على المرحلة Z التي تشمل المنطقة محل الاهتمام بأكملها المراد تصويرها.
- الحصول على صور Z-stack. احفظ الملف وتصديره للمعالجة اللاحقة باستخدام أي برنامج لتحليل الصور. بالنسبة لمجموعات برامج معينة ، قم بتحويل الملفات إلى أنواع ملفات محددة (على سبيل المثال ، .tiff ، .ome-tiff ، .jpeg ، إلخ). قم بإنجاز التحويل باستخدام أي برنامج للحصول على صور المجهر أو برنامج مجاني لتحليل الصور (على سبيل المثال ، ImageJ / Fiji).
7. تركيب وتصوير العينات في غرفة LSFM أو كوفيت
- املأ غرفة التصوير ب CUBIC Reagent-2 أو RI-2 اعتمادا على البروتوكول المحدد المستخدم. تجنب تكوين الفقاعات أثناء نقل السائل. قم بإزالة الفقاعات الزائدة باستخدام ماصة.
- اغمر العينة في غرفة التصوير وقم بتقييد حركة العينة.
ملاحظة: اعتمادا على المجهر المحدد المستخدم ، يمكن أن يشمل ذلك تضمين العينة في agarose ، أو تعليق العينة من خطاف أو محول النيص ، أو طباعة حامل عينة ثلاثية الأبعاد ، أو إرفاق العينة بمادة لاصقة بطبق بلاستيكي. - ضع الهدف في محلول التصوير ، مع التركيز على العينة. اترك العينة المركبة في غرفة التصوير لعدة ساعات أو طوال الليل للسماح بالتوازن الكامل للمحاليل والأنسجة في الكوفيت.
- الحصول على Z-stack لمنطقة الاهتمام (انظر الخطوات 6.7-6.11 للحصول على الصور).
ملاحظة: يمكن أن يسمح هذا النهج بتصوير أحجام الأنسجة الأكبر من 1 سم3 بدقة خلية واحدة.
8. إعادة بناء السطح وقياس كمية الخلية باستخدام برنامج تحليل الصور Imaris
ملاحظة: هذه الخطوات خاصة ببرنامج Imaris لتحليل الصور ، ولكن يمكن إجراء خطوات معالجة صور مماثلة باستخدام مجموعات برامج أخرى (على سبيل المثال ، ImageJ / Fiji و Aivia و Arivis و Amira وما إلى ذلك).
- استخدم محول ملفات Imaris لتحويل ملف صورة Z-stack إلى تنسيق Imaris الأصلي .ims. سيؤدي ذلك إلى تسهيل تحويل الملفات بسرعة أكبر مع تقليل أخطاء التحويل ومشكلات البرامج المحتملة بمجرد فتحها.
ملاحظة: تسمح بعض LSFMs الأحدث للمستخدم بحفظ الملفات مباشرة بتنسيق .ims. - اسحب ملف .ims المراد تحليله إلى منطقة Arena في برنامج Imaris. اضبط التباين أو الكثافة لكل قناة ألوان بواسطة لوحة Display Adjustment . انقر فوق أيقونة إضافة أسطح جديدة في الجزء العلوي الأيسر.
- انقر فوق التالي: قناة المصدر (الرمز الأزرق مع سهم يشير إلى اليمين). اختر القناة المصدر للسطح المراد إنشاؤه. لا تقم بتغيير المعلمات الأخرى.
- انقر فوق التالي: عتبة (الرمز الأزرق مع سهم يشير إلى اليمين).
- لضبط العتبة (الكثافة المطلقة)، اسحب خط العتبة إلى اليسار أو اليمين. قم بتمكين تقسيم الكائنات التي تلامس وأدخل متوسط قطر الخلية بالميكرون كمعيار تقسيم للنظام لإنتاج العديد من النقاط كأصل لكل سطح على حدة.
- لا تقم بتضمين إشارات الفلورسنت الصغيرة جدا أو الساطعة جدا لأنها يمكن أن تمثل تلطيخا محتملا أو قطع أثرية مجهرية. قم فقط بتضمين النقاط ذات الأحجام المقبولة وشدة التألق عن طريق تغيير متوسط قطر الخلية وفقا لذلك.
ملاحظة: سيختلف متوسط قطر الخلية باختلاف أنسجة أو أنواع خلايا معينة ، ولكنه سيقيم بشكل عام بين 5-15 ميكرومتر.
- لا تقم بتضمين إشارات الفلورسنت الصغيرة جدا أو الساطعة جدا لأنها يمكن أن تمثل تلطيخا محتملا أو قطع أثرية مجهرية. قم فقط بتضمين النقاط ذات الأحجام المقبولة وشدة التألق عن طريق تغيير متوسط قطر الخلية وفقا لذلك.
- انقر فوق التالي: تصنيف الأسطح (الرمز الأزرق مع سهم يشير إلى اليمين). اضبط الأسطح المراد تضمينها عن طريق سحب خط العتبة إلى اليسار أو اليمين. تأكد من أن الأسطح تقترب تماما من إشارة التألق الخام ، مع فصل إشارة التألق عن الخلايا الفردية.
- انقر فوق إنهاء: قم بتنفيذ جميع خطوات الإنشاء وإنهاء المعالج (الرمز الأخضر مع سهمين يشيران إلى اليمين). تم بناء السطح رسميا.
- انقر فوق الرمز السادس المسمى إحصائيات على اللوحة اليسرى لمعرفة عدد الخلايا ، في هذه الحالة ، عدد الأسطح لقناة اللون المحددة التي تم تحليلها.
- تأكد من أن المتغيرات الأربعة عدد المكونات غير المتصلة لكل نقطة زمنية وعدد الأسطح لكل نقطة زمنية والعدد الإجمالي للمكون غير المتصل والعدد الإجمالي للأسطح لها نفس الرقم ، وهو عدد الخلايا لقناة الألوان هذه.
النتائج
يتضمن تطهير الأنسجة معالجة الأنسجة المحفوظة بالكوكتيلات الكيميائية لاستخراج الجزيئات الحيوية غير الشفافة من الأنسجة مع الحفاظ على بنية الأنسجة. تتطابق محاليل إزالة الأنسجة هذه مع معامل الانكسار للأنسجة مع وسط التصوير المحيط لتقليل التشوهات البصرية ، وتعزيز نسبة الإشارة إلى الضوضاء في أعماق الأنسجة ، وتقليل التألق الذاتي في الخلفية. تم استخدام بروتوكولين مائيين لإزالة الأنسجة البصرية ، CUBIC3 و CLARITY9 ، لمسح عينات الفئران المحفوظة المصابة بفيروس نقص المناعة البشرية / SIV ، والرئيسيات غير البشرية ، والأنسجة البشرية قبل تلطيخ التألق المناعي والتصوير باستخدام الفحص المجهري الفلوري متحد البؤر والضوء للصفائح.
بالنسبة لبروتوكول CUBIC ، تم غسل الأنسجة الثابتة باستخدام PBS لإزالة المثبتات وغمرها في كاشف CUBIC -1 ، وهو محلول أساسي مخزن من الكحول الأميني الذي يمحو الكروموفورات مثل الهيم ، مما يؤدي إلى إزالة اللون وإزالة الدهون من الأنسجة (الشكل 1 ، أعلى). يمكن إزالة لون أحجام الأنسجة الأصغر (~ مم3) بعد 3 أيام من العلاج باستخدام كاشف مكعب -1 ، لكن أحجام الأنسجة الأكبر (~ سم3) أو الأنسجة التي تحتوي على كمية كبيرة من الهيم (مثل الكبد أو الطحال أو القلب) تتطلب أوقات حضانة أطول وأحجام محلول (>1 شهر و ~ 50 مل) ، بالإضافة إلى التبادل المتكرر للمحلول كل 2-3 أيام. بعد إزالة اللون ، تم غسل الأنسجة ووضعها في كاشف مكعب -2 ، وهو محلول يحتوي على السكروز بمعامل انكسار يبلغ حوالي 1.48-1.49 ، والذي يتطابق مع معامل الانكسار للأنسجة ويزيد من نفاذية الضوء. تم تلطيخ الأنسجة التي تم تطهيرها بشكل مناعي وتركيبها في محلول كاشف مكعب -2 قبل التصوير باستخدام مجهر متحد البؤر أو صفيحة ضوئية. تم تصوير تأثيرات إجراء المقاصة CUBIC للعديد من أنسجة hu-mouse و NHP بأحجام وتركيزات مختلفة من الكروموفورات (الشكل 2). جعل المقاصة البصرية الأنسجة شفافة بشكل واضح للعين المجردة ، مما سمح برؤية الخطوط الشبكية والنصوص الموجودة على الأوراق "من خلال" الأنسجة. قد لا تتساقط الأنسجة الغنية بالكروموفور مثل الطحال والكبد ونخاع العظام والقلب تماما ، ولكنها تظل مناسبة للتلوين المناعي والتصوير (الشكل 2 والشكل 5).
بالنسبة لبروتوكول CLARITY ، تم غسل الأنسجة الثابتة باستخدام PBS لإزالة المثبتات ثم تحضينها طوال الليل عند 4 درجات مئوية في محلول أكريلاميد بنسبة 40٪ مع بادئ حراري لتشكيل روابط تساهمية بين البروتينات في العينة ومونومرات الأكريلاميد (الشكل 1 ، أسفل). في اليوم التالي ، بعد أن تم موازنة الأنسجة مع درجة حرارة الغرفة ثم تسخينها في حمام مائي 37 درجة مئوية ، بدأت بلمرة الأكريلاميد وغلفت العينة بسرعة في هيدروجيل. تمت معالجة العينة بمحلول 8٪ SDS على مدار 2-5 أيام لإزالة الدهون غير الشفافة. مباشرة قبل تلطيخ الفلورسنت ، تم غمر العينة في محلول مطابقة معامل الانكسار (RIMS) ل CLARITY (وسائط التصوير RI-2) التي تحتوي على 90٪ وسط تدرج الكثافة غير الأيونية. بالنسبة للأنسجة التي تحتوي على كميات كبيرة من الهيم ، يمكن إضافة خطوة إزالة اللون في نهاية خطوة إزالة الدهون9،11،12. تمت مقارنة تقدم CUBIC و CLARITY المقاصة على أقسام مختلفة من نفس عينة الطحال البشرية (الشكل 3). ينتج CLARITY Clearing جل بولي أكريلاميد مرئي يغلف المحلول وعادة ما يظهر تقليل إزالة اللون مقارنة بإزالة CUBIC ما لم تتم إضافة خطوة إضافية لإزالة اللون9،12.
بعد ذلك في كلا البروتوكولين ، تم تلطيخ الأنسجة النظيفة والسليمة للكشف عن مجموعات معينة من الخلايا المناعية. تم غسل العينات ، وسدها بكاشف يحتوي على α-FcR لتقليل ارتباط الأجسام المضادة غير المحددة ، وتلطيخها لمدة 3 أيام عند استخدام جسم مضاد أولي مترافق مباشرة مع الفلوروفور. بدلا من ذلك ، تم تلطيخ العينات لمدة 3 أيام بجسم مضاد أولي غير مترافق متبوعا ب 3 أيام إضافية بجسم مضاد ثانوي مترافق مع الفلوروفور. تم غسل الأنسجة مرة أخرى ، ثم احتضانها بصبغة DAPI طوال الليل عند 4 درجات مئوية للتصور النووي. تم غسل العينات واحتضانها إما في كاشف مكعب -2 لمدة 24-36 ساعة أو وسائط التصوير RI-2 (CLARITY) بين عشية وضحاها في الظلام. بالنسبة للفحص المجهري متحد البؤر ، تم تركيب الأنسجة على شريحة مجهرية في RIMS المناسبة قبل التصوير (الشكل 4). بالنسبة للفحص المجهري الفلوري للصفائح الضوئية (LSFM) ، تم غمر العينات بالكامل ب RIMS في كوفيت التصوير طوال الليل قبل التصوير.
سمح الفحص المجهري متحد البؤر للأنسجة اللمفاوية السليمة والمنقحة والملطخة بالمناعة بالتصور المتزامن لإشارات الفلورسنت المتعددة ، بما في ذلك النوى وعلامات الخلايا المناعية وبروتينات HIV / SIV CA (القفيصة) (الشكل 5). تم تحديد الخلايا المنتجة للفيروسات عن طريق التموضع الفلوري لعلامات الخلايا المناعية وبروتينات فيروس نقص المناعة البشرية. كشف الطحال البشري المصاب بفيروس نقص المناعة البشرية الذي تم تطهيره وملطخا عن العديد من الخلايا التائية CD3 + الموضعية مع فيروس نقص المناعة البشرية p24 ، مما يشير إلى وجود خلايا منتجة للفيروسات داخل منطقة من الأنسجة السليمة (الشكل 5A-D). كشفت الغدد الليمفاوية NHP المصابة ب SHIV التي تم تطهيرها وملطخة مناعية عن توزيعات الخلايا التائية CD3 + والضامة CD68 + في مناطق الأنسجة التي لم يتم اكتشاف أي فيروس فيها (الشكل 5E) بالإضافة إلى المناطق التي بها العديد من الخلايا المنتجة للفيروسات (الشكل 5F). أظهرت هذه النتائج أن الخلايا المنتجة للفيروسات من مصادر الأنسجة المتنوعة يمكن تمييزها عن الخلايا الأخرى في مجال رؤية معين وسمحت باكتشاف الأحداث البيولوجية النادرة داخل بيئة الأنسجة المعقدة.
تم تطبيق التقسيم البصري للأنسجة التي تم تطهيرها باستخدام مجهر متحد البؤر لإنشاء مداخن Z ونماذج سطحية ثلاثية الأبعاد ، والتي كشفت عن عدم التجانس الخلوي الذي ظهر أثناء الإصابة بفيروس نقص المناعة البشرية (الشكل 6). تم إعادة تجميع مداخن Z في صورة إسقاط Z باستخدام مجموعة برامج Imaris (الشكل 6 أ) وتمت إزالة قناة DAPI النووية للتصور الواضح للخلايا التائية CD3 + وبروتين القفيصة HIV (p24) الفلورة في جميع أنحاء أحجام كاملة من الأنسجة (الشكل 6 ب). تم تقسيم مضان الإسقاط Z تلقائيا باستخدام برنامج Imaris لإنشاء نموذج سطح ثلاثي الأبعاد معاد بناؤه للتصور المكاني والقياس الكمي لإشارة التألق في جميع أنحاء مكدس Z بأكمله (الشكل 6 ج). كشف تحليل النموذج السطحي ثلاثي الأبعاد عن 546 خلية CD3 + T و 218 خلية تنتج فيروس نقص المناعة البشرية p24. بشكل تراكمي ، سمح اكتساب Z-stack للتألق المناعي من الأنسجة اللمفاوية المصابة بفيروس نقص المناعة البشرية بتوليد نماذج ثلاثية الأبعاد للتركيب الخلوي داخل الأنسجة والقياس الكمي الآلي لمجموعات الخلايا المناعية داخل أحجام الأنسجة.
سمح LSFM للأنسجة اللمفاوية السليمة والمنقوحة والملطخة بالمناعة بتصوير التألق المناعي (IF) بحجم أكبر لتوزيع الخلايا المناعية والخلايا المنتجة للفيروسات في الأنسجة اللمفاوية (الشكل 7). كشف التلوين المناعي لأنسجة القولون من الفأر المصاب بفيروس نقص المناعة البشرية للخلايا التائية hCD3 + و HIV p24 عن بؤر الخلايا المنتجة للفيروسات المنتشرة بين مناطق كبيرة من الأنسجة مع عدم وجود دليل على الإصابة (الشكل 7 أ). كشفت رؤية مكبرة لبؤر الخلايا المنتجة للفيروسات عن خلايا منتجة للفيروسات متعددة على مقربة من الخلايا المستهدفة المحتملة (الشكل 7 ب). تم استخدام التألق الذاتي للأنسجة (الضباب الأحمر) لتصور بنية الأنسجة بأكملها مع التمييز بين مجموعات محددة من الخلايا المناعية داخل الأنسجة التي تلطخت بشكل أكثر إشراقا من التألق الذاتي (الأشكال البيضاوية الحمراء). أظهر نموذج ثلاثي الأبعاد لحجم LSFM Z-stack بالكامل التوزيع المكاني لبؤر الخلايا المنتجة للفيروسات داخل منطقة من الأنسجة السليمة وسمح برسم خرائط لمواقع إنتاج الفيروس بالنسبة لبنية الأنسجة الكلية (الشكل 7 ج). والمثير للدهشة أن بؤر الخلايا المنتجة للفيروسات غالبا ما كانت تتناثر بين مناطق كبيرة من الأنسجة مع عدم وجود دليل على إنتاج الفيروس. يمكن أن تسمح هذه النتائج بالقياس الكمي لمعلمات توزيع الفيروس وكثافة الخلايا المصابة داخل الأنسجة المختلفة وفي أوقات مختلفة من العدوى أو الاستجابة للعلاجات المختلفة.
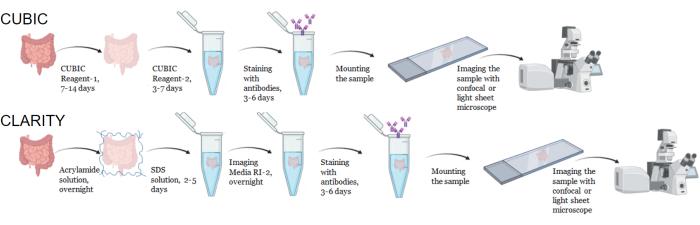
الشكل 1: سير عمل تنظيف الأنسجة النموذجية CUBIC و CLARITY والتلوين المناعي والتصوير. يمكن أن تختلف أوقات المقاصة CUBIC (العلوي) والوضوح (السفلي) بشكل كبير اعتمادا على حجم ونوع الأنسجة. لإزالة CLARITY ، يلزم إجراء خطوة حضانة إضافية مع وسائط متطابقة مع معامل الانكسار قبل التلوين المناعي للتحقق من نظافة الأنسجة. عادة ما يستغرق التلوين المناعي 3 أيام عندما تترافق الأجسام المضادة الأولية مع الفلوروفورات و 6 أيام إذا كانت هناك حاجة إلى أجسام مضادة ثانوية فلورية. يمكن تصوير العينات إما باستخدام متحد البؤر أو LSFM. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
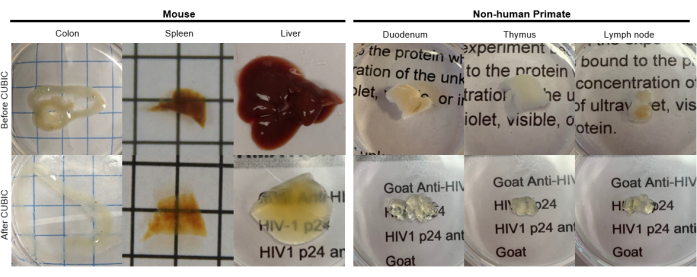
الشكل 2: التنظيف المكعب لعينات أنسجة hu-mouse و NHP. اعتمادا على الكثافة المختلفة للهيم والدهون في عينات الأنسجة ، يختلف الوقت اللازم لتنظيف كل نوع من أنواع الأنسجة. على سبيل المثال ، يتطلب القولون والاثني عشر عادة فترات قصيرة نسبيا (~ 7 أيام) ، بينما يمكن أن يستغرق الطحال والكبد وقتا أطول ليصبحا شفافين (~ 30 يوما). الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
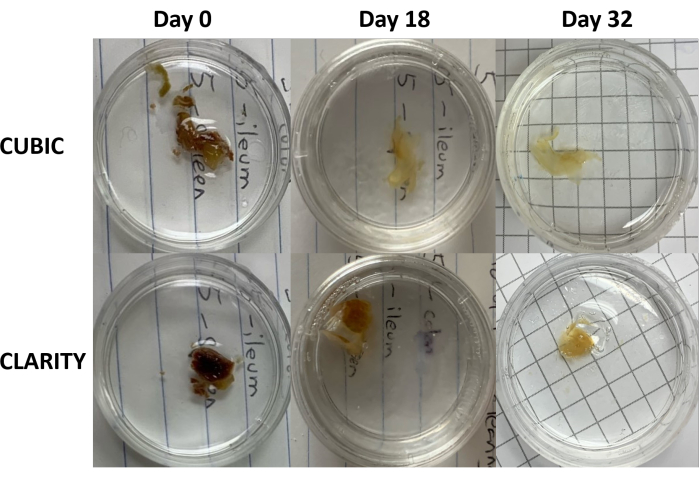
الشكل 3: مقارنة طولية لطرق إزالة الأنسجة على العينات البشرية. CUBIC (الألواح العلوية) و CLARITY (الألواح السفلية) تطهير الطحال من شخص مصاب بفيروس نقص المناعة البشرية في العلاج المضاد للفيروسات القهقرية. كلتا الطريقتين تنظف الأنسجة بشكل كاف بحلول اليوم 32 من أجل التلوين المناعي والتصوير. تقلل خطوة إزالة اللون لطريقة CUBIC بشكل واضح من التألق الذاتي الناجم عن وجود الهيم الموجود في عينات الطحال. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
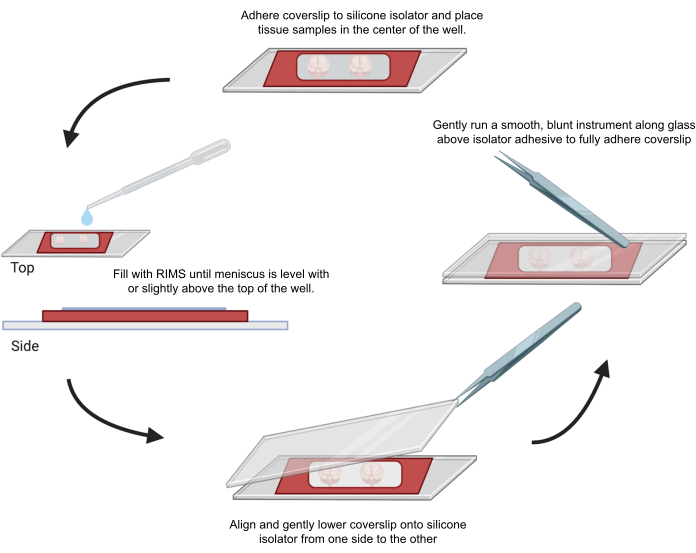
الشكل 4: تركيب العينة للفحص المجهري متحد البؤر. تم تركيب العينات بين أغطية مفصولة بعوازل سيليكون لاصقة 0.5-1 مم. تم لصق عوازل السيليكون على الغطاء الأول وتم وضع الأنسجة في وسط البئر (أعلى). امتلأت البئر ب RIMS حتى أصبح الغضروف المفصلي مستويا مع أو أعلى قليلا من أعلى البئر (على اليسار). تم إنزال الغطاء الثاني بعناية في مكانه من جانب إلى آخر ، وتجنب الفقاعات (أسفل). تم لصق أغطية الغطاء بالكامل بعزل السيليكون عن طريق تشغيل أداة غير حادة برفق حول محيط البئر (على اليمين). تم تصوير العينات في مجهر متحد البؤر القياسي. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
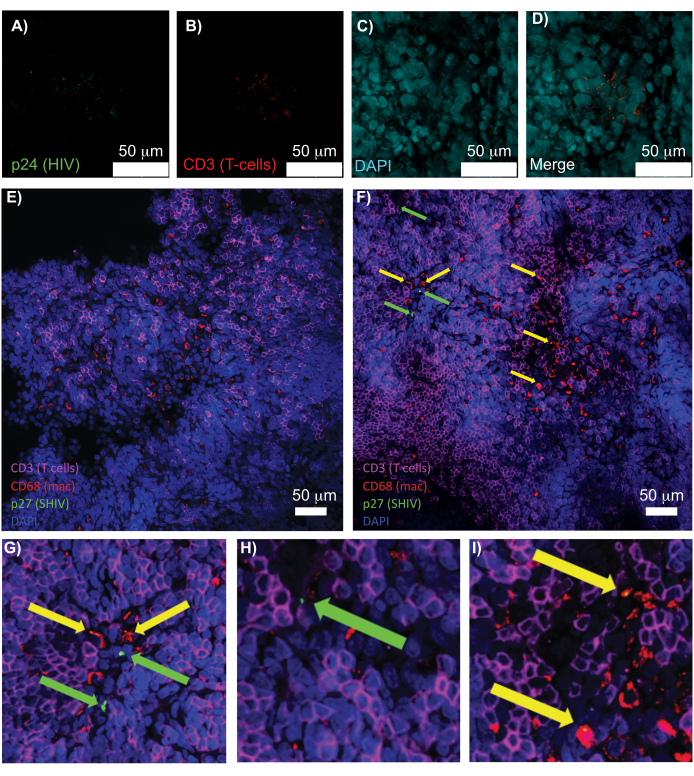
الشكل 5: الفحص المجهري متحد البؤر للطحال البشري النظيف والسليم والغدد الليمفاوية NHP. (أ-د) تم تلطيخ الأنسجة البشرية المصابة بفيروس نقص المناعة البشرية لفيروس نقص المناعة البشرية 1 p24 (أخضر) ، hCD3 + الخلايا التائية (الحمراء) ، والنوى (السماوية). (ه) شريحة Z متحدة البؤر من العقدة الليمفاوية النظيفة CUBIC من NHP المصابة ب SHIV بعد 8 أسابيع من الإصابة ملطخة مناعية للخلايا التائية CD3 + (أرجواني) ، CD68 + الضامة (ماك / أحمر) ، SHIV p27 (أخضر) ، والنوى (زرقاء). يحتوي مجال الرؤية على الخلايا التائية والضامة وأنواع الخلايا الأخرى ، ولكن لا يوجد دليل على إنتاج خلايا SHIV (أخضر). و) شريحة Z متحدة البؤر لمنطقة مجاورة من نفس العقدة الليمفاوية تظهر اختلافات في كثافة الخلايا وعددها جنبا إلى جنب مع وجود خلايا CD3 + T المنتجة للفيروس (الأسهم الخضراء) و CD68 + الضامة (الأسهم الصفراء). (G-I) عرض مكبر لمناطق محددة من تلطيخ p27 من (F). أشرطة المقياس هي 50 ميكرومتر. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
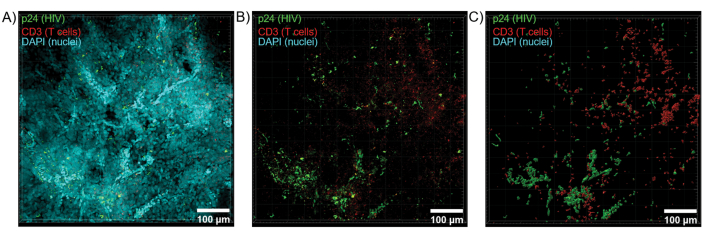
الشكل 6: حجم المكدس Z والسطح المعاد بناؤه ثلاثي الأبعاد من الطحال البشري المصاب بفيروس نقص المناعة البشرية. (أ) صورة إسقاط Z من كومة Z 600 ميكرومتر × 600 ميكرومتر × 100 ميكرومتر Z من أنسجة الطحال البشرية المصابة بفيروس العوز المناعي البشري الملطخة بخلايا فيروس نقص المناعة البشرية -1 p24 (أخضر) والخلايا التائية hCD3 + (حمراء) والنوى (السماوية). (ب) نفس صورة الإسقاط Z بدون تلطيخ DAPI النووي. (ج) نموذج سطح ثلاثي الأبعاد المعاد بناؤه من مضان CD3 (أحمر) و p24 (أخضر) من حجم المكدس Z بالكامل. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
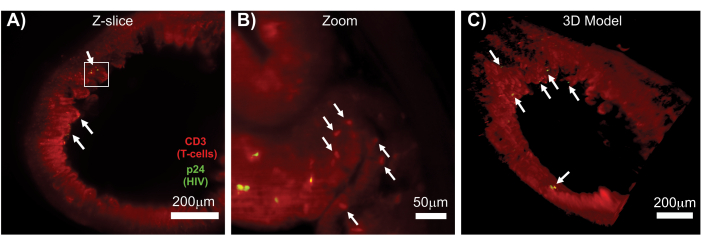
الشكل 7: إعادة بناء LSFM و 3D للأحجام السطحية من الأنسجة المصابة بفيروس نقص المناعة البشرية (A) شريحة Z (1,000 ميكرومتر × 1,000 ميكرومتر) من القولون من فأر hu-mouse مصاب بفيروس نقص المناعة البشرية ملطخ مناعي للخلايا التائية CD3 + (أحمر) و HIV p24 (أخضر). يمثل الضباب الأحمر الباهت التألق الذاتي للأنسجة ، بينما تشير النقاط الحمراء المميزة إلى الخلايا التائية. تظهر الزغابات حول المحيط ، مما يشير إلى التجويف المركزي ، مع وجود العديد من بؤر إنتاج الفيروس النشط (الأسهم البيضاء) المنتشرة بين مناطق كبيرة لا تحتوي على فيروس. يشير المربع إلى منطقة الاهتمام التقريبية للوحة B. (B) منطقة مكبرة من الأنسجة تظهر الفيروس الفردي الذي ينتج الخلايا التائية hCD3 + (صفراء) بالقرب من الخلايا التائية غير المصابة (الأحمر). تم تدوير الصورة وتغييرها إلى شريحة Z قريبة لإظهار تركيز الخلايا الموجبة p24 في مستوى Z واحد. يظهر التألق الذاتي الأحمر في الخلفية بنية الأنسجة العامة بالإضافة إلى تلطيخ الخلايا التائية hCD3 + المحدد (النقط الأحمر ؛ الأسهم البيضاء). (ج) نموذج سطح ثلاثي الأبعاد للحجم الكامل (1,000 ميكرومتر × 1,000 ميكرومتر × 200 ميكرومتر) تم إنشاؤه باستخدام برنامج Imaris الذي تم تدويره لإظهار بؤر العدوى بفيروس العوز المناعي البشري (الأصفر) في مواقع مختلفة من الأمعاء. تشير الأسهم البيضاء إلى البؤر الفردية داخل المجلد. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
Discussion
يجب جمع الأنسجة اللمفاوية ذات الأهمية بسرعة بعد الوفاة ووضعها على الفور في مخازن مثبتة مبردة مسبقا لتجنب نخر الأنسجة (الأنسجة الداكنة أو السوداء) التي يمكن أن تؤثر سلبا على التلوين والتصوير. بعد حصاد الأنسجة المرغوبة ، اغمر الأنسجة على الفور في مثلج بارد بنسبة 4٪ -8٪ بارافورمالدهيد (PFA) طوال الليل للتثبيت ، مما يؤدي أيضا إلى تعطيل مسببات الأمراض المحتملة المرتبطة بالعينات. 4٪ PFA هو الأمثل لتثبيت عينات LM ، في حين أن 8٪ PFA يمكن أن يحافظ بشكل كاف على الأنسجة لكل من LM و EM. يمكن أن يؤدي اتباع هذه الإجراءات وتخزين العينات في مثبت عند 4 درجات مئوية في الظلام إلى الحفاظ على الأنسجة بشكل فعال للتصوير المحور وراثيا لعدة سنوات. أحد التحذيرات هو أن التخزين طويل الأجل في المثبت يمكن أن يؤدي إلى إدخال القطع الأثرية الملطخة ، وخاصة إخفاء المستضد الذي ينتج عن تشابك البروتينات المجاورة بالبروتين المعني ، والذي يمكن أن يمنع إمكانية وصول الأجسام المضادة الملطخة إلى الحاتمة13،14. إذا كانت الأنسجة تحتوي على بروتينات فلورية معبر عنها داخليا ، فاتخذ تدابير لتجنب تعريض الأنسجة للضوء كلما أمكن ذلك طوال البروتوكول بأكمله. عادة ما تحتفظ البروتينات الفلورية الداخلية بالتألق لمدة 6-12 شهرا بعد التثبيت ، ولكن يمكن أن تختلف عينات الأنسجة الفردية لفترات زمنية أطول أو أقصر. في حالة فقد التألق الداخلي بسبب تدهور البروتين ، يمكن غالبا اكتشاف البروتينات الفلورية باستخدام جسم مضاد أساسي خاص بالبروتين محل الاهتمام. التروية هو خيار آخر لتثبيت الأنسجة بسرعة قبل تطهير12. ومع ذلك ، نظرا للمخاوف عند العمل مع مسببات الأمراض مثل فيروس نقص المناعة البشرية ، تم اختيار طريق تشريح الأنسجة متبوعا بالغمر في مثبت الجليد البارد لإعداد العينات بأكبر قدر ممكن من الأمان.
تتمثل إحدى مزايا بروتوكولات المقاصة القائمة على الماء الموصوفة في أنها أكثر اعتدالا بشكل عام من البروتوكولات العضوية ، والتي يمكن أن تلحق الضرر أحيانا بالأنسجة الأكثر هشاشة ، مثل الكبد. تتطلب بروتوكولات المقاصة القائمة على الماء عموما وقتا أطول لتحقيق إزالة كاملة للعينات (أسابيع مقابل أيام) مقارنة ببروتوكولات المقاصة العضوية. يمكن إجراء بروتوكولات CLARITY و CUBIC بسرعة أكبر باستخدام التروية لتنظيف جميع الأعضاء في وقت واحد داخل القوارض11،12. ومع ذلك ، لم يكن هذا خيارا ممكنا ل NHP وتشريح الجثث البشري. تميل العينات التي تمت معالجتها باستخدام CLARITY إلى إظهار بعض التوسع في الحجم ، بينما كشف CUBIC عن تأثير منخفض على حجمالعينة 9. على الرغم من أنها أكثر سرعة بشكل عام ، إلا أن العديد من بروتوكولات إزالة الأنسجة العضوية تتسبب في خضوع الأنسجة لانكماش15 ، مما قد يجعل اكتشاف تفاصيل الخلية المفردة أو دون الخلية أكثر صعوبة في الملاحظة داخل الأنسجة الكثيفة للخلايا مثل الغدد الليمفاوية والطحال. يمكن أن يؤدي التمدد الناجم عن التطهير إلى زيادة دقة التصوير بشكل فعال ، مما يسهل ملاحظة الجوانب التي يصعب ملاحظتها في الحجم الأصلي للأنسجة. بدلا من ذلك ، يمكن أن يؤدي انكماش الأنسجة إلى تقليل الحجم الكلي للعينة بشكل فعال ، مما قد يجعل تصوير الأعضاء بالكامل دون تشريح ممكنا. تتمثل إحدى فوائد كل من بروتوكول CLARITY و CUBIC في أنهما يحافظان على التألق من بروتينات الفلورسنت المعبر عنها داخليا في الأنسجة بينما يظلان عرضة لتلوين التألق المناعي11،12. يمكن إجراء التلوين المناعي باستخدام طرق إزالة الأنسجة المائية أو العضوية. ومع ذلك ، أظهرت التجربة الشخصية نسبة أعلى من توافق الأجسام المضادة باستخدام البروتوكولات القائمة على الماء مقارنة بالبروتوكولات العضوية. يحتاج الباحثون إلى التفكير في طريقة إزالة الأنسجة التي يجب استخدامها بناء على الأنسجة (الأنسجة) المصورة والأسئلة البيولوجية التي يتم تناولها (على سبيل المثال ، تصوير الأعضاء بالكامل مقابل تصوير منطقة معينة ذات أهمية). لا توجد تقنية عالمية لإزالة الأنسجة تسمح بتحليل قوي جاهز لجميع أسئلة التصوير ذات الحجم الكبير وتظهر الطرق المتاحة مزايا وعيوبا مميزة اعتمادا على التطبيق البيولوجي.
عند إجراء تلطيخ الأجسام المضادة ، يجب مراعاة العديد من الجوانب. نظرا لأن عينات CLARITY مدمجة في هيدروجيل الأكريلاميد ، فإنها تميل إلى الحاجة إلى أوقات أطول للحضانة12. يعتمد الوقت اللازم لحضانة الأجسام المضادة أيضا على حجم وسمك كل عينة. كانت معظم العينات الموصوفة هنا ~ 2-3 ملليمترات ، وكانت 3 أيام كافية للتلوين الكامل في جميع أنحاء الأنسجة. إذا كان الهدف هو تصوير دماغ فأر كامل ، فقد يستغرق وقت حضانة الأجسام المضادة أسبوعا واحدا أوأكثر 12. يمكن أن يتوقف اختيار طريقة إزالة الأنسجة المائية مقابل العضوية للتصوير المناعي الفلوري على توافق الأجسام المضادة. بشكل عام ، بالنسبة إلى CUBIC أو CLARITY ، فإن معدل الإصابة بالأجسام المضادة التي تعمل في الخلايا والأنسجة المستنبتة هو ~ 70٪. سواء كنت تستخدم طريقة إزالة الأنسجة المائية أو العضوية ، فمن الضروري تقييم توافق وفعالية جميع الأجسام المضادة مع الطريقة المحددة المستخدمة. كما هو موضح في قسم البروتوكول هذا ، يتم التلوين المناعي للعينات المعالجة CUBIC و CLARITY بعد الانتهاء من المقاصة. على العكس من ذلك ، تتم هذه الخطوة قبل إجراء المقاصة لبعض البروتوكولات العضوية ، متبوعا بإصلاح لاحق.
من المهم للغاية أن تكون الأنسجة مغمورة تماما في وسيط تصوير يطابق معامل الانكسار. سيؤدي عدم القيام بذلك إلى حدوث انحرافات كروية أثناء التصوير وتشويه الضوء الملتقط أثناء الحصول على الصورة. يجب توخي الحذر لإزالة جميع فقاعات الهواء من وسائط التصوير عند تركيب عينات لكل من متحد البؤر و LSFM ، حيث يمكن للفقاعات أن تعطل مسار الضوء إلى العينة أو بعيدا عنها. يمكن إزالة الفقاعات يدويا باستخدام ماصة قبل تركيب العينة النهائية. لتصوير عينات أكثر سمكا باستخدام مجهر متحد البؤر ، يمكن وضع فواصل سيليكون متعددة فوق بعضها البعض لاستيعاب الأنسجة التي يزيد سمكها عن 0.5 مم. تتمثل إحدى التوصيات في موازنة جميع الأنسجة في RIMS لعدة ساعات إلى بين عشية وضحاها أثناء تركيبها على المجهر دون حركة عينة إضافية. سيمنع التوازن الكامل للأنسجة ووسائط التصوير اختلاط المحاليل مع مؤشرات الانكسار غير المتطابقة التي يمكن أن تولد انحرافات أثناء التصوير. من المهم أن تتذكر أنه عند تركيب عينات من الأنسجة التي تم تطهيرها ، لا توجد طريقة تركيب واحدة جاهزة لتصوير جميع العينات في جميع المجاهر. يناقش هذا البروتوكول خيارات تركيب العينات التي عملت على النحو الأمثل في سياق واحد ، ولكن هناك العديد من الأساليب لتركيب العينات اعتمادا على المجهر الفردي المستخدم والسؤال البيولوجي الذي تمت معالجته. يمكن أن تشمل هذه الأساليب ، على سبيل المثال لا الحصر ، تضمين العينة في الاغاروز ، أو تعليق العينة من خطاف أو خط بلاستيكي متطابق مع معامل الانكسار ، أو استخدام محول النيص ، أو طباعة حامل عينة ثلاثية الأبعاد ، أو إرفاق العينة بمادة لاصقة بطبق بلاستيكي.
يمكن أن تعمل المجاهر متحدة البؤر بشكل جيد لتصوير أحجام الأنسجة ~ 1 مم3-1 سم3. بالنسبة للمجاهر متحدة البؤر ، استخدم هدفا 2-10x لتحديد المناطق ذات الأهمية في البداية واكتساب مداخن Z ذات الحجم الأكبر أو الأنسجة الكاملة بدقة خلية واحدة. قم بالتبديل إلى أهداف 20-63x للحصول على صور عالية الدقة لمناطق معينة ذات أهمية مع معلومات تحت الخلوية. الهدف المثالي لتصوير الأنسجة التي تم تطهيرها CUBIC و CLARITY هو هدف محدد ل CLARITY / Scale يتطابق بدقة مع معامل الانكسار للأنسجة ومحلول التصوير. إذا لم يكن هذا النوع من الأهداف متاحا ، فمن الأفضل تصوير العينات ذات الهدف الغمر بالجلسرين أو الزيت (على سبيل المثال ، LD LCI Plan-Apochromat 25 × 0.8 NA Imm Corr DIC M27 هدف الغمر المتعدد: مسافة العمل = 0.57 مم) بدلا من هدف جوي. سيؤدي ذلك إلى تقليل التشوهات البصرية الناتجة عن مؤشرات الانكسار غير المتطابقة أثناء التقاط الصورة. يمكن لأهداف 20-25x تحقيق التوازن بين الحصول على صور أكبر حجما والحصول على تفاصيل تلطيخ من الخلايا الفردية في بيئة أنسجة معقدة. الأهم من ذلك ، أن معظم المجاهر متحد البؤر تحتوي على وحدات تسمح بالتجانب ثلاثي الأبعاد لأحجام التصوير. يمكن لهذا النوع من الحصول على الصور أن ينشئ بشكل مثالي مكدسات Z ذات حجم أكبر تحتوي على معلومات خلوية فرعية.
يمكن أن يسمح تصوير LSFM بالتصور ثلاثي الأبعاد لمجموعات خلايا معينة في سياق كميات كبيرة من الأنسجة (>1 سم3) وحتى أعضاء كاملة. خلال السنوات العشر الماضية ، ركزت إزالة الأنسجة جنبا إلى جنب مع LSFM إلى حد كبير على فهم اتصال الدماغ داخل القوارض. ومع ذلك ، تشمل التطبيقات الحديثة تصور المناظر الطبيعية النقيلية للورم16 ، وتوزيع الخلايا داخل المقصورات التشريحية9،17 ، وتشتت العامل الممرض18. بالمقارنة مع الخلايا المستنبتة ، فإن معظم الأحداث البيولوجية في الأنسجة غير منتظمة ويمكن أن يكون LSFM بارعا بشكل خاص في تصور وقياس عدم تجانس الأنسجة المكانية لهذه الأحداث (على سبيل المثال ، تكاثر الفيروس ، والإشارات المناعية ، وتوزيع الخلايا ، وما إلى ذلك).
يمكن معالجة مجموعات البيانات ثلاثية الأبعاد التي تم الحصول عليها عبر متحد البؤر أو LSFM بعد ذلك باستخدام العديد من منصات تحليل الصور. يمكن استخدام مجموعة برامج Imaris لبناء الأسطح ، وتوليد الرسوم المتحركة ثلاثية الأبعاد ، والقياس الكمي للخلايا. ومع ذلك ، هناك العديد من أنظمة تحليل الصور المتاحة التي تتيح المعالجة اللاحقة للصور وتحليلها بكفاءة. يعد برنامج ImageJ / Fiji المجاني19 نظاما أساسيا بديلا جذابا لمعالجة الصور يمكن الوصول إليه من قبل معظم المختبرات ، ولكن لا يوجد برنامج تحليل واحد يناسب الجميع يتفوق في جميع أشكال تحليل الصور وتصورها. يمكن أن تكون العديد من مجموعات برامج تحليل الصور باهظة الثمن إذا لم تكن متوفرة من خلال مرافق الاستخدام المشترك. أخيرا ، أحد الجوانب الحاسمة ل LSFM أو مجموعات البيانات ثلاثية الأبعاد متحدة البؤر الكبيرة المبلطة هو إدارة البيانات. يمكن لمنصات التصوير هذه إنشاء ملفات ضخمة (>1 تيرابايت) تتطلب محطات عمل كمبيوتر متطورة لتصور البيانات وقياسها. في النهاية ، يمكن لسير عمل التصوير هذا تبسيط اكتساب وقياس مجموعات الخلايا المتميزة مكانيا داخل الأنسجة بأكملها وهو قابل للتطبيق على نطاق واسع على معظم مصادر الأنسجة والأنظمة البيولوجية.
Disclosures
ليس لدى المؤلفين تضارب في المصالح للإفصاح عنهم.
Acknowledgements
شكرا لجامعة إلينوي في المرافق الأساسية لمعهد أوربانا شامبين لبيولوجيا الجينوم لاستخدام المجاهر المضنية ثنائية البؤر والورقة الخفيفة. شكرا للأفراد الرائعين من مجموعة "The Last Gift" لعينات الأنسجة البشرية ، والتي تم تمويلها من خلال المنح التالية: I147821 و DA051915 و AI131385 و P30 AI036214. شكرا لنانسي هيجوود وآن هيسيل على عينات أنسجة NHP المصابة ب SHIV.
Materials
| Name | Company | Catalog Number | Comments |
| Acrylamide Solution (in 0.1 M PBS, 40 mL in total) | |||
| 40% Acrylamide: 4 mL | Bio-Rad | 1610144 | |
| VA-044 Thermal Initiator: 0.1g | Fujifilm | 011-19365 | |
| CLARITY Blocking solution (in 0.1 M PBS, 5 mL in total) | |||
| Fetal bovine serum (FBS): 200 µL | Atlas Biologicals | F-0500-D | |
| Rat anti-human or anti-mouse FcR: 50 µL | Miltenyi | 130-092-575(mouse)/130-059-901(human) | |
| Sodium azide (from stock solution): 5 µL | Sigma | 71289-50G | |
| Tween-20: 5 µL | Fisher Scientific | BP337-500 | |
| CLARITY wash solution (in 0.1M PBS, 50 mL in total) | |||
| Sodium azide (from stock solution): 50 µL | Sigma | 71289-50G | |
| Tween-20: 50 µL | Fisher Scientific | BP337-500 | |
| CUBIC Blocking solution (in 0.1M PBS, 5 mL in total) | |||
| Fetal bovine serum (FBS): 200 µL | Atlas Biologicals | F-0500-D | |
| Rat anti-human or anti-mouse FcR: 50 µL | Miltenyi | 130-092-575(mouse)/130-059-901(human) | |
| Sodium azide (from stock solution): 5 µL | Sigma | 71289-50G | |
| Triton X-100: 5 µL | VWR | M143-1L | |
| CUBIC Reagent-1 (in 0.1M PBS, 50 mL in total) | |||
| N, N, N’, N’-tetrakis (2-hydroxypropyl) ethylenediamine: 12.5 g | Aldrich | 122262 | |
| Triton X-100: 7.5 g | VWR | M143-1L | |
| Urea: 12.5 g | Fisher chemical | U15-500 | |
| CUBIC Reagent-2 (in 0.1M PBS, 50 mL in total) | |||
| Sucrose: 25 g | Sigma | S1888-500G | |
| Sodium azide (in powder form): 10 g | Sigma | 71289-50G | |
| Sodium azide stock solution (in DI H2O, 50 mL in total) | Sigma | 71289-50G | |
| Triethanolamine: 5 g | Sigma | 90270-500mL | |
| Triton X-100: 50 µL | VWR | M143-1L | |
| Urea: 12.5 g | Fisher chemical | U15-500 | |
| CUBIC wash solution (in 0.1M PBS, 50 mL in total) | |||
| Sodium azide (from stock solution): 50 µL | Sigma | 71289-50G | |
| Triton X-100: 50 µL | VWR | M143-1L | |
| DAPI staining solution (0.5 µg/mL) | |||
| DAPI stock solution: 1 µL | |||
| Wash solution: 10 mL | |||
| DAPI stock solution (5 mg/mL) | |||
| DAPI powder: 5 mg | Sigma-Aldrich | D9542-1MG | |
| DMSO (100%): 1 mL | ThermoFisher | D12345 | |
| Imaging Media RI-2 (in dH2O) | |||
| 90% Histodenz | Sigma | D2158-100G | |
| 0.01% Sodium azide | Sigma | 71289-50G | |
| 0.02 Sodium Phosphate Buffer, pH 7.5 | Sigma-Aldrich | S9638-250G | |
| 0.1% Tween-20 | Fisher Scientific | BP337-500 | |
| Primary antibodies (in blocking solution without rat anti-mouse FcR, 2 mL in total) | |||
| Goat anti-HIV p24: 10 µL (1:200) | Creative Diagnostics | DPATB-H81692 | |
| Mouse anti-human CD68: 10 µL(1:200) | Dako | M0876 | |
| Rabbit anti-human CD3: 10 µL (1:200) | Dako | A0452 | |
| 8% SDS Solution (in 0.1 M PBS, 50 mL in total) | |||
| SDS powder: 4 g | Sigma-Aldrich | L3771-500G | |
| Secondary antibodies (in blocking solution without rat anti-mouse FcR, 2 mL in total) | |||
| Donkey anti-goat conjugated with AlexaFluor647: 2 µL | Invitrogen | A21447 | |
| Donkey anti-mouse conjugated with AlexaFluor594: 2 µL | Invitrogen | A21203 | |
| Donkey anti-rabbit conjugated with AlexaFluor488: 2 µL | Invitrogen | A21206 |
References
- Spalteholz, W., Barker, L. F., Mall, F. P. . Hand-Atlas of Human Anatomy. , (1907).
- Jacob, T., Gray, J. W., Troxell, M., Vu, T. Q. Multiplexed imaging reveals heterogeneity of PI3K/MAPK network signaling in breast lesions of known PIK3CA genotype. Breast Cancer Research and Treatment. 159 (3), 575-583 (2016).
- Kieffer, C., Ladinsky, M. S., Ninh, A., Galimidi, R. P., Bjorkman, P. J. Longitudinal imaging of HIV-1 spread in humanized mice with parallel 3d immunofluorescence and electron tomography. eLife. 6, 23282 (2017).
- Chung, K., Deisseroth, K. CLARITY for mapping the nervous system. Nature Methods. 10 (6), 508-513 (2013).
- Compton, A. A., Schwartz, O. They might be giants: Does syncytium formation sink or spread HIV infection. PLoS Pathogens. 13 (2), 2-8 (2017).
- Symeonides, M., et al. HIV-1-induced small T cell syncytia can transfer virus particles to target cells through transient contacts. Viruses. 7 (12), 6590-6603 (2015).
- Sharova, N., Swingler, C., Sharkey, M., Stevenson, M. Macrophages archive HIV-1 virions for dissemination in trans. The EMBO Journal. 24 (13), 2481-2489 (2005).
- Colby, D. J., et al. Rapid HIV RNA rebound after antiretroviral treatment interruption in persons durably suppressed in Fiebig I acute HIV infection. Nature Medicine. 24 (7), 923-926 (2018).
- Ladinsky, M. S., et al. Mechanisms of virus dissemination in bone marrow of HIV-1-infected humanized BLT mice. eLife. 8, 46916 (2019).
- Buettner, M., Bode, U. Lymph node dissection--understanding the immunological function of lymph nodes. Clinical and Experimental Immunology. 169 (3), 205-212 (2012).
- Treweek, J. B., et al. Whole-body tissue stabilization and selective extractions via tissue-hydrogel hybrids for high-resolution intact circuit mapping and phenotyping. Nature Protocols. 10, 1860-1896 (2015).
- Tainaka, K., et al. Whole-body imaging with single-cell resolution by tissue decolorization. Cell. 159, 911-924 (2014).
- Sompuram, S. R., Vani, K., Bogen, S. A. A molecular model of antigen retrieval using a peptide array. American Journal of Clinical Pathology. 125 (1), 91-98 (2006).
- Scalia, C. R., et al. Antigen masking during fixation and embedding, dissected. The journal of histochemistry and Cytochemistry: Official Journal of the Histochemistry Society. 65 (1), 5-20 (2017).
- Jing, D., et al. Tissue clearing of both hard and soft tissue organs with the PEGASOS method. Cell Research. 28 (8), 803-818 (2018).
- Guldner, I. H., et al. An Integrative platform for three-dimensional quantitative analysis of spatially heterogeneous metastasis landscapes. Scientific Reports. 6, 24201 (2016).
- Muntifering, M., et al. Clearing for deep tissue imaging. Current Protocols in Cytometry. 86 (1), 38 (2018).
- DePas, W. H., et al. Exposing the three-dimensional biogeography and metabolic states of pathogens in cystic fibrosis sputum via hydrogel embedding, clearing, and rRNA labeling. mBio. 7 (5), 00796 (2018).
- Schindelin, J., et al. Fiji: An open-source platform for biological-image. Nature Methods. 9 (7), 676-682 (2012).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved