Method Article
HIV ile enfekte dokulardaki bağışıklık hücresi popülasyonlarının temizleme, immün boyama, konfokal ve ışık tabakası floresan mikroskobu ile 3D görselleştirilmesi
Bu Makalede
Özet
İmmünofloresan mikroskobu ile birleştirilen doku temizleme, sağlam dokular içindeki bağışıklık hücresi popülasyonlarının ve virüs proteinlerinin uzamsal olarak görüntülenmesine ve miktarının belirlenmesine izin verir. Temizlenmiş dokuların konfokal ve ışık tabakası floresan mikroskobu ile optik kesiti, karmaşık doku ortamlarının 3D modellerini oluşturabilir ve HIV enfeksiyonu sırasında sergilenen mekansal heterojenliği ortaya çıkarabilir.
Özet
Edinilmiş Bağışıklık Yetmezliği Sendromunun (AIDS) etkeni olan İnsan İmmün Yetmezlik Virüsü (HIV), dünya çapında yaklaşık 40 milyon kişinin enfekte olduğu ve yaygın olarak erişilebilir bir tedavisi olmadığı önemli bir küresel sağlık sorunudur. Yoğun çabalara rağmen, enfeksiyon sırasında ve tedaviye yanıt olarak dokulardaki virüs ve konak hücre etkileşimlerinin ayrıntılı bir şekilde anlaşılması eksik kalmıştır. Bu sınırlamaları ele almak için, su bazlı doku temizleme teknikleri CUBIC (Açık, Engelsiz Beyin / Vücut Görüntüleme Kokteylleri ve Hesaplamalı analiz) ve CLARITY (Şeffaf Lipid Değişimli Akrilamid hibritleştirilmiş Sert Görüntüleme / İmmün Boyama / yerinde hibridizasyon uyumlu Doku hYdrogel), konfokal ve ışık tabakası floresan mikroskobu kullanılarak hayvan modellerinden ve insanlardan HIV ile enfekte dokularda karmaşık virüs konak-hücre etkileşimlerini görselleştirmek için uygulanır. Sağlam dokuların optik kesitlenmesi ve görüntü analizi, tüm dokularda bulunan uzamsal bilgilerin hızlı bir şekilde yeniden yapılandırılmasına ve enfeksiyon sırasında bağışıklık hücresi popülasyonlarının nicelleştirilmesine olanak tanır. Bu yöntemler, çoğu doku kaynağına ve bulaşıcı hastalık ve kanser dahil olmak üzere çeşitli biyolojik sorulara uygulanabilir.
Giriş
Son zamanlarda biyolojik araştırmalarda kantitatif uzamsal doku görüntülemeye yönelik artan ihtiyaç, tek hücre çözünürlüğüne sahip sağlam dokuların daha büyük hacimli (mm3 cm3) görüntülerini oluşturmak için doku temizleme tekniklerinin ortaya çıkmasına neden olmuştur. Dokular, benzersiz şekilde tanımlanmış yapılara, bileşimlere ve işlevlere sahip karmaşık biyomolekül organizasyonlarını içerir. Ne yazık ki, dokularda bulunan birçok biyomolekül (örneğin, lipitler ve kromoforlar) ışık mikroskobu ile görüntülendiğinde ışığı saçar, emer veya yayar, bu da büyük hacimli görüntülemeyi zorlaştırır. Ayrıca, dokular genellikle standart görüntüleme solüsyonları ve optik lenslerle eşleşmeyen bir kırılma indisi sergiler ve bu da görüntüleme sırasında optik bozulmalara neden olur. Işık mikroskobu ile büyük hacimli dokuların görüntülenmesi için en optimal bir yaklaşım, dokuların kırılma indisini, görüntüleme solüsyonlarını ve objektifleri eşleştirmeyi ve aynı zamanda işleme sırasında sağlam dokuların biyolojik özelliklerini bozmadan ışığın dokuya derinlemesine nüfuz etmesine izin vermeyi içermelidir. Opak doku örneklerinin temizlenmesi yoluyla dokular ve görüntüleme solüsyonları arasındaki kırılma indisi farklılıklarını azaltmaya yönelik ilk girişimler, 1800'lerin sonlarında Alman anatomist Werner Spalteholz tarafından gerçekleştirildi1. Bu doku temizleme tekniği, doku örneklerine zarar verebilecek sert kimyasal çözücüleri içeriyordu, ancak yine de sağlam dokuların ilk bildirilen daha büyük hacimli görüntülemesini temsil ediyordu. Modern ışık mikroskobu yöntemleri, görüntü yakalama ve analiz için bilgi işlem gücüyle birleştiğinde, son zamanlarda büyük, sağlam doku örneklerini tek hücre çözünürlüğünde görüntülemek için bir yöntem olarak doku temizlemeyi yeniden moda haline getirdi. Son yirmi yılda, hem organik hem de su bazlı dahil olmak üzere, her biri belirli uygulamalar için güçlü ve zayıf yönleri olan düzinelerce gelişmiş doku temizleme tekniği ortaya çıktı.
3D doku görüntüleme, hücre kültüründe yeniden üretilemeyen daha karmaşık biyolojik etkileşimleri araştırabilir. Örneğin, hücre sinyal modelleri2, farklı hücre tiplerinin3 mekansal dağılımları ve beyin bağlantısı4 daha önce tüm doku / organ görüntüleme yöntemleri kullanılarak nicel bir şekilde haritalandırıldı. Burada açıklanan, aktif enfeksiyon sırasında bozulmamış HIV ile enfekte lenfoid dokular içindeki farklı HIV hedef hücre popülasyonlarını temizlemek, immünostain etmek ve görselleştirmek için su bazlı doku temizleme protokollerinin bir uygulamasıdır. Vücutta, HIV ağırlıklı olarak CD4 + T hücrelerini enfekte eder ve genomunun bir kopyasını enfekte konakçı hücrelerin genomlarına entegre eder. Virüs daha sonra enfekte olmuş konak hücre mekanizmasını kendini çoğaltmak için ele geçirir, bu da virüsün yayılmasına, konak hücre öldürmesine, bağışıklık fonksiyon bozukluğuna ve AIDS'e doğru uzun vadeli ilerlemeye neden olur. Enfekte olmuş T hücrelerinin doku ve hücre kültüründeki davranışlarının belirgin şekilde farklı olduğuna dikkat etmek önemlidir. HIV ile inkübe edilen kültürlenmiş CD4 + T hücreleri, düzinelerce çekirdek5 içerebilen masif HIV kaynaklı sinsitya üretebilirken, 3D hücre dışı matris (ECM) hidrojellerinde kültürlenen birincil CD4 + T hücreleri veya HIV ile enfekte insanlaştırılmış farelerden (hu-fareler) alınan doku örnekleri genellikle 2-5 çekirdekli sinsitiverir 6. HIV ile enfekte bireyler içinde virüsün hücreden hücreye iletimini ve sistemik yayılımını anlamak, virüsün birden fazla enfekte hücre tipi tarafından dokulardan kan damarlarına ve serbest viryonların ve virüs üreten hücrelerin çok sayıda duyarlı lenfositlere erişebildiği yeni dokulara taşınmasını içeren, muhtemelen daha da karmaşıktır7. Bu senaryoların şu anda hücre kültürü sistemlerinde özetlenmesi mümkün değildir ve hayvan modellerinden ve insanlardan elde edilen dokular, işleyen bir bağışıklık sistemine sahip karmaşık bir organizma bağlamında virüs patogenezini anlamak için önemli bir kaynak olmaya devam etmektedir.
Mevcut antiretroviral tedaviler (ART'ler), HIV replikasyonunu inhibe ederek ve hastalığın AIDS'e doğru ilerlemesini durdurarak HIV'li (PWH) kişiler için yaşam beklentisini ve kalitesini büyük ölçüde artırmaktadır. Ne yazık ki, ART, hareketsiz olan ve aktif olarak virüs üretmeyen retroviral genomun bir eklenmesini içeren son zamanlarda enfekte olmuş bağışıklık hücrelerini ortadan kaldırmaz. ART'deki çoğu bireyin kanında virüs tespit edilemese de, ART kesintiye uğradıktan ve hastalığın ilerlemesi devam ettikten sonra virüs yükleri hızla geri döner8. Enfekte hücrelerin gizli rezervuarının neden olduğu HIV enfeksiyonunun kalıcı doğası, bir HIV tedavisi oluşturmak için büyük bir engel teşkil etmektedir. HIV'in doku rezervuarları tam olarak anlaşılamamıştır ve virüs patogenezini tamamen karakterize etmek ve aktif olarak virüs üretmeyen latent enfekte hücreleri etkili bir şekilde ortadan kaldıran yeni tedavileri değerlendirmek için ART öncesinde, sırasında ve sonrasında lenfoid dokulardaki bu rezervuarların daha derin bir şekilde anlaşılması çok önemlidir.
Burada, daha önce uyarlanmış iki su bazlı doku temizleme protokolü olan CUBIC3 ve CLARITY9, insanlaştırılmış bağışıklık sistemlerine sahip HIV ile enfekte farelerden (hu-fareler), SIV / SHIV ile enfekte insan olmayan primatlardan (NHP) ve HIV ile enfekte insanlardan alınan çok sayıda sağlam lenfoid doku içindeki bağışıklık hücresi popülasyonlarını görüntülemek için uygulandı. Bu protokoller, görüntülemenin hedeflerine (daha büyük hacme karşı daha yüksek çözünürlük) ve mevcut enstrümantasyona bağlı olarak hem konfokal hem de ışık tabakası floresan mikroskobuna uyarlanabilir. Işık mikroskobu tek tek viryonları çözemese de, immünofloresan kullanımı, daha yüksek çözünürlüklü yöntemlerle daha fazla analiz edilebilen virüs ve virüs üreten hücreler içeren doku bölgelerini tanımlayabilir. Burada sunulan yöntemler, enfeksiyon sırasında farklı koşullardaki belirli hücre tipleri arasındaki mekansal ilişkileri ölçmek için vücuttaki hemen hemen her dokuyu tek hücre çözünürlüğüyle görselleştirmek için uyarlanabilir ve bulaşıcı hastalıkların veya kanserin incelenmesi için son derece ilgili insan hasta örneklerine kolayca çevrilebilir.
Protokol
Tüm hayvan deneyleri, onaylanmış kurumsal hayvan bakım protokollerine göre yürütülmüştür. Tüm insan dokuları, onaylanmış kurumsal insan araştırmaları etik yönergelerine göre elde edildi.
1. Doku hasadı ve fiksasyonu (CUBIC ve CLARITY için aynı)
- Daha önce tarif edildiği gibi lenfoid dokuları tanımlayın ve inceleyin10.
- Güvenli bir şekilde mümkün olduğunda, lenfoid dokuları ölümden birkaç dakika sonra diseksiyon makası ve cımbızla çıkarın.
- Doku örneklerini ışık mikroskobu (LM), elektron mikroskobu (EM) veya immüno-EM için yeterince korumak için doku örneklerini %8 paraformaldehit (PFA), 0,1 M sodyum kakodilat trihidrat içinde %5 sükroz içeren yeni yapılmış, buz gibi soğuk bir fiksatif tampona yerleştirin. Alternatif olarak, 0,1 M PBS'de %4 PFA ile LM numunelerini sabitleyin. Virüsün tamamen devre dışı bırakılmasını sağlamak için temizleme işlemine başlamadan önce numuneleri gece boyunca sabitleyin.
DİKKAT: Paraformaldehit, cilt teması ve soluma yoluyla toksiktir ve aynı zamanda yanıcı bir katıdır; Dikkatli bir şekilde tutun ve yanıcı bir saklama dolabında saklayın. Sodyum kakodilat trihidrat, yutulduğunda veya solunduğunda toksiktir. - Temizleme işlemine başlamadan önce dokunun referans görüntüsünü alın.
NOT: LM numuneleri bu koşullarda en az 1 yıl saklanabilir. Endojen floresan proteinleri ifade eden numunelerle çalışmak için, sonraki adımlarda numuneleri daima karanlıkta tutun.
2. KÜBİK doku temizleme
- Her tampon değişimi sırasında PFA'nın uzaklaştırılmasını sağlamak için lenfoid doku örneklerini steril 0.1 M PBS'de oda sıcaklığında 15 dakika çalkalayarak üç kez durulayın.
NOT: PFA içeren sıvıları kurumsal yönergelere göre atın. - Lenfoid doku örneğini 37 ° C'de 37 ° C'de hafifçe çalkalayarak CUBIC Reaktif-1'e ( Malzeme Tablosuna bakınız) daldırın. Zaman içindeki renk giderme sürecini izlemek için düzenli referans görüntüleri çekin.
- Reaktif-1'i 3-4 günlük ek daldırma için veya doku renk giderimi tamamlanana kadar değiştirin. Temizleme için gereken süre hem hacme hem de doku tipine bağlıdır. Doku renk giderme sürecini hızlandırmak için CUBIC Reagent-1'i günlük olarak yenileyin ve daha büyük hacimler kullanın.
- Lenfoid doku örneklerini 0.1 M PBS ile oda sıcaklığında 30 dakika boyunca hafifçe çalkalayarak üç kez yıkayın.
- Lenfoid doku örneklerini 37 ° C'de 2-7 gün boyunca veya tam şeffaflık elde edilene kadar hafifçe çalkalayarak CUBIC Reaktif-2'ye ( Malzeme Tablosuna bakınız) daldırın. Numuneler tam şeffaflık elde etmezse, temizleme artık ilerlemeyene kadar 2.2-2.5 adımlarını tekrarlayın. Zaman içindeki temizleme işlemini izlemek için düzenli referans görüntüleri alın.
- Lenfoid doku örneklerini 0.1 M PBS ile oda sıcaklığında 30 dakika boyunca hafifçe çalkalayarak üç kez yıkayın.
- Numuneleri karanlıkta %0.01 hacim/hacim (V/V) sodyum azid içeren CUBIC Reaktif-2'de saklayın (bkz. Malzeme Tablosu).
NOT: Numuneler bu yöntem kullanılarak en az 6 ay saklanabilir.
DİKKAT: Sodyum azid oldukça toksiktir ve ciddi bir soluma tehlikesi oluşturur. % 5 veya daha az sodyum azid içeren seyreltik çözeltilerin satın alınması önerilir.
3. Kübik numunelerin bloke edilmesi ve immün boyanması
- Lenfoid doku örneklerini 0.1 M PBS ile her biri 30 dakika boyunca oda sıcaklığında hafifçe çalkalayarak üç kez yıkayın.
- Konfokal bir mikroskop kullanarak görüntülemek için, bir doku dilimleyici matris kullanarak dokuyu ~ 0.5-1 mm kalınlığında dilimler halinde kesin. Işık tabakası floresan mikroskobu (LSFM) yapmak için tüm doku bölgesini bloke edin.
- Numuneleri 5 mL CUBIC blokaj çözeltisi ile gece boyunca 4 °C'de çalkalanarak bloke edin (Malzeme Tablosuna bakınız). NHP veya insan numuneleri ile çalışırken, insan karşıtı FcR kullanın. Fare örnekleriyle çalışırken, engelleme çözümünde anti-fare FcR kullanın.
- Numuneleri 5 mL primer antikorlarla (Malzeme Tablosuna bakınız) bloke edici solüsyonda (türe özgü FcR olmadan) oda sıcaklığında 3 gün boyunca çalkalayarak boyayın (İsteğe bağlı: konsantre antikor stoğunu kullanmadan önce 5 dakika boyunca 2.300 x g'da santrifüjleyin, agrega antikor ilavesini azaltmak için).
- Lekeli numuneyi oda sıcaklığında, en az beş değişim yıkama solüsyonu tamponu ile toplamda en az 5 saat çalkalayarak yıkayın (bkz. Malzeme Tablosu).
- Numuneleri ikincil antikorlarla (Malzeme Tablosuna bakınız) bloke edici solüsyonda (türe özgü FcR olmadan) oda sıcaklığında 3 gün boyunca çalkalanarak boyayın (İsteğe bağlı: antikor agregasyonunu en aza indirmek için kullanmadan önce antikorları 5 dakika boyunca 2.300 x g'da santrifüjleyin).
- Lekeli numuneyi oda sıcaklığında yıkama solüsyonu ile toplamda en az 5 saat çalkalayarak beş kez yıkayın.
- Numuneleri her doku numunesine 5 mL DAPI boyama solüsyonu ( Malzeme Tablosuna bakınız) ile boyayın ve oda sıcaklığında 10 dakika inkübe edin. Numunelerin daha sonra görüntüleme için karanlıkta 4 °C'de DAPI leke solüsyonunda kalmasına izin verin.
- Lenfoid doku örneklerini oda sıcaklığında üç kez yıkama solüsyonu ile yıkayın ve her birini 30 dakika çalkalayın.
- Numune montajından önce lekeli numuneyi gece boyunca oda sıcaklığında karanlıkta CUBIC Reaktif-2'ye daldırın.
4. CLARITY doku temizleme
- PFA'yı çıkarmak için lenfoid doku örneklerini steril 0.1 M PBS'de üç kez oda sıcaklığında her biri 15 dakika çalkalayarak durulayın.
- Doku örneklerini 15 mL taze yapılmış akrilamid çözeltisine yerleştirin ve hafif çalkalama ile gece boyunca 4 °C'de inkübe edin (bkz. Malzeme Tablosu).
DİKKAT: Polimerize edilmemiş akrilamid güçlü bir nörotoksindir ve cilt tarafından kolayca emilir. Cilt ile herhangi bir temastan kaçının ve temas olursa hemen durulayın. - Doku örneklerinin oda sıcaklığına ısınmasına izin verin.
- İSTEĞE BAĞLI: 1 dakika boyunca akrilamid çözeltisine nitrojen köpürterek doku numunelerinin gazını alın. Toksik polimerize edilmemiş akrilamidin (~1-2 kabarcık/sn) sıçramasını önleyen düşük bir akış hızı kullanmaya özen gösterin.
- Doku örneklerini polimerize olması için 1-3 saat boyunca 37 ° C su banyosuna yerleştirin ve her 15 dakikada bir ters çevirin. Viskoz bir sıvı, karıştırma sırasında Schleren çizgilerinin görünümü veya doku etrafında berrak bir kapsül oluşumu ile belirtildiği gibi, gözle görülür bir polimerizasyon tespit edilir edilmez numuneleri çıkarın.
NOT: Akrilamid çözeltisinin tam polimerizasyonu meydana gelirse, numuneden fazla hidrojeli kesin ve protokole devam edin. - Doku örneklerini steril 0.1 M PBS ile her biri oda sıcaklığında 30 dakika boyunca üç kez yıkayın ve akrilamid solüsyonunu çıkarmak için hafifçe çalkalayın.
- Doku örneklerini, temizlemeye izin vermek için 2-5+ gün boyunca hafifçe sallayarak 37 ° C'de 0.1 M PBS'de 15 mL% 8 SDS'ye yerleştirin. % 8'lik SDS çözeltisini periyodik olarak yenileyin ve gerekirse temizlemeyi hızlandırmak için 50 mL'ye kadar çözelti kullanın. Numuneler görsel olarak şeffaf olduğunda veya artık ilerlemediğinde temizleme işlemini durdurun. Zaman içindeki temizleme işlemini izlemek için düzenli referans görüntüleri alın.
- Doku örneklerini steril 0.1 M PBS ile 1 gün boyunca beş kez oda sıcaklığında hafifçe çalkalayarak yıkayın.
- Numuneleri, endojen floresan görüntülemeye hazır olana kadar karanlıkta geçici olarak 0,1 M PBS'de (artı daha uzun süreli saklama için %0,01 hacim/hacim (v/v) NaN3 ) tutun.
- Dokuyu 5 mL Görüntüleme Ortamı RI-2'ye yerleştirin (bkz. Malzeme Tablosu). İmmün boyamadan önce temizleme işleminin eksiksizliğini doğrulamak için karanlıkta oda sıcaklığında gece boyunca inkübe edin. Doku şeffaflığını izlemek için referans görüntüler çekin.
5. CLARITY numunelerinin bloke edilmesi ve immün boyanması
NOT: Bu adımlar, CUBIC temizlenmiş dokuların bloke edilmesine ve immün olarak boyanmasına benzer, ancak blokaj, yıkama ve boyama solüsyonları için farklı formülasyonlar kullanır.
- Lenfoid doku örneklerini 0.1 M PBS ile üç kez, her seferinde oda sıcaklığında 30 dakika boyunca hafifçe çalkalayarak yıkayın.
- Konfokal mikroskop kullanarak görüntülemek için, 0,5 mm'lik bir doku dilimleyici ve matris kullanarak dokuyu ~ 0,5-1 mm kalınlığında dilimler halinde kesin. LSFM gerçekleştirmek için tüm doku örneğini bloke edin.
- Numuneleri 5 mL CLARITY bloke etme solüsyonu ile ( Malzeme Tablosuna bakınız) gece boyunca 4 °C'de çalkalayarak bloke edin.
- Numuneleri 5 mL primer antikorlarla (Malzeme Tablosuna bakınız) bloke edici solüsyonda (türe özgü FcR olmadan) oda sıcaklığında 3 gün boyunca çalkalanarak boyayın (İsteğe bağlı: antikor agregasyonunu en aza indirmek için kullanmadan önce antikorları 5 dakika boyunca 2.300 x g'da santrifüjleyin).
- Lekeli numuneyi oda sıcaklığında yıkama solüsyonu ile toplamda en az 5 saat çalkalanarak beş kez yıkayın (bkz. Malzeme Tablosu).
- Numuneleri 5 mL ikincil antikorlarla (Malzeme Tablosuna bakınız) bloke edici solüsyonda (türe özgü FcR olmadan) oda sıcaklığında 3 gün boyunca çalkalanarak boyayın (İsteğe bağlı: antikor agregasyonunu en aza indirmek için kullanmadan önce antikorları 5 dakika boyunca 2.300 x g'da santrifüjleyin). Genel protokol uzunluğunu kısaltmak için, ikincil antikorlarla inkübasyon ihtiyacını ortadan kaldırmak için floroforlarla konjuge edilmiş birincil antikorlar kullanın.
- Lekeli numuneyi oda sıcaklığında yıkama solüsyonu ile toplamda en az 5 saat çalkalayarak beş kez yıkayın.
- Numuneleri her doku numunesine 5 mL DAPI boyama solüsyonu ( Malzeme Tablosuna bakınız) ile boyayın ve oda sıcaklığında 10 dakika inkübe edin. Numunelerin daha sonra görüntüleme için DAPI leke solüsyonunda karanlıkta 4 ° C'de kalmasına izin verin.
- Lenfoid doku örneklerini yıkama solüsyonu ile oda sıcaklığında üç kez yıkayın ve her seferinde 30 dakika çalkalayın.
- Dokuyu 5 mL Görüntüleme Ortamı RI-2'ye (R.I. = 1.46) yerleştirin ve numune montajından önce karanlıkta oda sıcaklığında gece boyunca inkübe edin (bkz. protokol adımı 6 ve 7).
6. Konfokal mikroskopi için temizlenmiş doku örneklerinin montajı ve görüntülenmesi
- Yapışkan bir silikon izolatörün koruyucu tabakasının bir tarafını soyun.
- Numune için sıvı geçirmez bir alan oluşturmak için silikon izolatörün soyulmuş tarafına bir mikroskop kapak camı (22 mm x 40 mm, 0.25 mm kalınlığında) yapıştırın.
- Yapışkan silikon izolatörün koruyucu tabakasının diğer tarafını soyun.
- Görüntüleme için numuneyi silikon izolatörün ortasına yerleştirin ve ardından sıvı yüzeyi izolatörün kenarı kadar yüksek olana kadar uygun şekilde CUBIC Reaktif-2 veya Görüntüleme Ortamı RI-2 ekleyin.
- Silikon izolatör içinde hava kabarcıklarının sıkışmasını en aza indirmek için, ikinci kapak camını bir EM forseps kullanarak bir taraftan hizalayın ve nazikçe katmanlayın. Fazla sıvıyı silin. Yapıştırıcıyı kapatmak için forsepsin arkasını kullanarak kapak camını numune kuyucuğunun etrafına hafifçe bastırın. Monte edilmiş numuneleri karanlıkta yatay olarak saklayın.
NOT: Numuneler, monte edildikten haftalar ila aylar sonra görüntülenebilir; Bununla birlikte, görüntüleme kalitesi genellikle zamanla azalır. - Monte edilmiş slaytı mikroskop tablasına yerleştirin ve beyaz ışık ve daha düşük bir büyütme objektifi (2-10x) kullanarak numuneyi bulun.
- Seçilen bireysel floroforlara göre floresan toplama profilini ayarlayın.
NOT: Ayrı ayrı florofor kanallarının ayrı ayrı edinilmesi önerilir. Bu, daha uzun bir alım süresi ile sonuçlanır, ancak spektral örtüşmeyi ve spesifik olmayan floresan sinyalinin edinimini azaltır. Yaygın bir florofor profili, görüntü alımı sırasında spektral örtüşmeyi en aza indirmek için DAPI (450 nm), Alexa488, Alexa594 ve Alexa647 (veya ilgili kombinasyonlar) içerebilir. - İlgilenilen bölgeleri görüntülemek için uygun bir büyütme hedefi seçin. Tek hücre çözünürlüğü ile daha büyük hacimli veya tüm doku görüntüleme için daha düşük büyütme hedefleri (2-10x) kullanın ve temizlenmiş dokudaki hücre altı detayların daha yüksek çözünürlüklü görselleştirilmesi için daha yüksek büyütme hedefleri (20-63x) kullanın. Görüntü elde etme sırasında optik bozulmaların ortaya çıkmasını en aza indirmek için objektiflerin, görüntüleme ortamının ve dokunun kırılma indisini mümkün olduğunca yakından eşleştirin.
- Z yığını alımı için bir adım boyutu seçin. Daha düşük büyütme hedefleri (2-10x) için, toplam alım süresini ve genel dosya boyutunu azaltırken 3D modelleme için birden fazla sürekli Z diliminde tek bir hücreden floresanı algılamak için ~3-5 μm'lik bir adım boyutu seçin. Daha yüksek büyütme hedefleri (20-63x) için, tek tek Z dilimleri arasındaki hücre altı bilgi kaybını en aza indirmek için ~1 μm veya daha düşük bir adım boyutu seçin.
- X ve Y boyutlarında görüntülenecek dokunun tüm bölgesini mümkün olduğunca az boş alanla görselleştirmek için görüş alanını yakınlaştırın. Görüntülenecek ilgilenilen bölgenin tamamını kapsayan üst ve alt Z aşaması alım koordinatlarını ayarlayın.
- Z yığını görüntülerini alın. Herhangi bir görüntü analiz yazılımı kullanarak son işlem için dosyayı kaydedin ve dışa aktarın. Belirli yazılım paketleri için dosyaları belirli dosya türlerine dönüştürün (örneğin, .tiff, .ome-tiff, .jpeg, vb.). Herhangi bir mikroskop görüntü elde etme yazılımı veya ücretsiz görüntü analizi yazılımı (örneğin, ImageJ/Fiji) kullanarak dönüştürmeyi gerçekleştirin.
7. Numunelerin LSFM haznesine veya küvete monte edilmesi ve görüntülenmesi
- Kullanılan özel protokole bağlı olarak görüntüleme odasını CUBIC Reaktif-2 veya RI-2 ile doldurun. Sıvıyı aktarırken kabarcık oluşumunu önleyin. Fazla baloncukları bir pipetle çıkarın.
- Numuneyi görüntüleme odasına daldırın ve numune hareketini kısıtlayın.
NOT: Kullanılan özel mikroskoba bağlı olarak, bu, numunenin agaroz içine gömülmesini, numunenin bir kanca veya kirpi adaptöründen askıya alınmasını, bir numune tutucunun 3D yazdırılmasını veya numunenin yapıştırıcı ile plastik bir kaba takılmasını içerebilir. - Hedefi, örneğe odaklanarak görüntüleme çözümüne yerleştirin. Küvetteki çözeltilerin ve dokuların tam olarak dengelenmesini sağlamak için monte edilmiş numuneyi birkaç saat veya gece boyunca görüntüleme odasında bırakın.
- İlgilenilen bölgenin Z yığınını edinin (görüntü alımı için adım 6.7-6.11'e bakın).
NOT: Bu yaklaşım, tek hücre çözünürlüğü ile 1cm3'ten büyük doku hacimlerinin görüntülenmesine izin verebilir.
8. Imaris görüntü analiz yazılımı ile yüzey rekonstrüksiyonu ve hücre ölçümü
NOT: Bu adımlar Imaris görüntü analiz yazılımına özgüdür, ancak benzer görüntü işleme adımları diğer yazılım paketleri (örneğin, ImageJ/Fiji, Aivia, Arivis, Amira, vb.) kullanılarak gerçekleştirilebilir.
- Z yığını görüntü dosyasını yerel Imaris biçimi .ims'ye dönüştürmek için Imaris Dosya Dönüştürücüsü'nü kullanın. Bu, açıldıktan sonra dönüştürme hatalarını ve olası yazılım sorunlarını en aza indirirken daha hızlı dosya dönüştürmeyi kolaylaştıracaktır.
NOT: Bazı yeni LSFM'ler, kullanıcının dosyaları doğrudan .ims biçiminde kaydetmesine izin verir. - Analiz edilecek .ims dosyasını Imaris yazılımının Arena alanına sürükleyin. Ekran Ayarlama panelinden her renk kanalının kontrastını veya yoğunluğunu ayarlayın. Sol üstteki Yeni Yüzeyler Ekle simgesine tıklayın.
- İleri'ye tıklayın: Kaynak Kanal (sağı gösteren oklu mavi simge). Oluşturulacak yüzeyin kaynak kanalını seçin. Diğer parametreleri değiştirmeyin.
- İleri: Eşik'e tıklayın (sağı gösteren oklu mavi simge).
- Eşiği (mutlak yoğunluk) ayarlamak için eşik çizgisini sola veya sağa sürükleyin. Dokunan Nesneleri Böl'ü etkinleştirin ve sistemin her bir yüzey için başlangıç noktası olarak birçok nokta vermesi için bölme standardı olarak ortalama hücre çapını mikron cinsinden girin.
- Potansiyel lekelenme veya mikroskop artefaktlarını temsil edebilecekleri için çok küçük veya çok parlak floresan sinyalleri dahil etmeyin. Ortalama hücre çapını buna göre değiştirerek yalnızca kabul edilebilir boyutlara ve floresan yoğunluklarına sahip noktaları dahil edin.
NOT: Ortalama hücre çapı, belirli dokular veya hücre tipleri için değişecektir, ancak genellikle 5-15 μm arasında olacaktır.
- Potansiyel lekelenme veya mikroskop artefaktlarını temsil edebilecekleri için çok küçük veya çok parlak floresan sinyalleri dahil etmeyin. Ortalama hücre çapını buna göre değiştirerek yalnızca kabul edilebilir boyutlara ve floresan yoğunluklarına sahip noktaları dahil edin.
- İleri'ye tıklayın: Yüzeyleri Sınıflandır (sağı gösteren bir ok etiketli mavi simge). Eşik çizgisini sola veya sağa sürükleyerek dahil edilecek yüzeyleri ayarlayın. Floresan sinyalini tek tek hücrelerden ayırırken yüzeylerin ham floresan sinyaline tam olarak yaklaştığından emin olun.
- Bitir'e tıklayın: Tüm Oluşturma Adımlarını Yürütün ve Sihirbazı Sonlandırın (sağı gösteren iki oklu yeşil simge etiketli). Yüzey resmi olarak inşa edilmiştir.
- Hücre sayısını, bu durumda analiz edilen belirli renk kanalı için yüzey sayısını görmek için sol paneldeki İstatistikler etiketli altıncı simgeye tıklayın.
- Zaman Noktası Başına Bağlantısı Kesilen Bileşen Sayısı, Zaman Noktası Başına Yüzey Sayısı, Bağlantısı Kesilen Bileşen Toplam Sayısı ve Toplam Yüzey Sayısı adlı dört değişkenin, söz konusu renk kanalının hücre sayısı olan aynı sayıya sahip olduğundan emin olun.
Sonuçlar
Doku temizleme, doku mimarisini korurken dokudan opak biyomolekülleri çıkarmak için korunmuş dokuların kimyasal kokteyllerle işlenmesini içerir. Bu doku temizleme solüsyonları, optik bozulmaları en aza indirmek, dokuların derinliklerinde sinyal-gürültü oranını artırmak ve arka plan otofloresansını en aza indirmek için dokunun kırılma indisini çevredeki görüntüleme ortamıyla eşleştirir. Optik doku temizleme için iki su bazlı protokol, CUBIC3 ve CLARITY9, immünofloresan boyama ve konfokal ve ışık tabakası floresan mikroskobu ile görüntülemeden önce korunmuş HIV / SIV ile enfekte hu-fare, insan olmayan primat ve insan doku örneklerini temizlemek için kullanıldı.
CUBIC protokolü için, sabit dokular fiksatifleri çıkarmak için PBS ile yıkandı ve hem gibi kromoforları ortaya çıkaran ve dokunun renginin giderilmesi ve delipidasyonu ile sonuçlanan temel tamponlu bir aminoalkol çözeltisi olan CUBIC Reaktif-1'e daldırıldı (Şekil 1, üstte). Daha küçük doku hacimleri (~ mm3), CUBIC Reaktif-1 ile 3 günlük tedaviden sonra renksizleştirilebilir, ancak daha büyük doku hacimleri (~cm3) veya büyük miktarda heme içeren dokular (karaciğer, dalak veya kalp gibi) daha uzun inkübasyon süreleri ve çözelti hacimleri (> 1 ay ve ~ 50 mL) ve ayrıca her 2-3 günde bir çözeltinin sık sık değiştirilmesi. Renk gidermeyi takiben, dokular yıkandı ve dokunun kırılma indisine uyan ve ışığın geçirgenliğini artıran, kırılma indisi yaklaşık 1.48-1.49 olan sakaroz içeren bir çözelti olan CUBIC Reaktif-2'ye yerleştirildi. Temizlenen dokular immün olarak boyandı ve konfokal veya ışık tabakası mikroskobu ile görüntülemeden önce bir CUBIC Reaktif-2 çözeltisine monte edildi. CUBIC temizleme prosedürünün etkileri, çeşitli boyutlarda ve konsantrasyonlarda kromofor içeren birkaç hu-mouse ve NHP dokusu için görüntülendi (Şekil 2). Optik temizleme, dokuları çıplak gözle gözle görülür şekilde şeffaf hale getirerek, ızgara çizgilerinin ve kağıt yapraklarındaki metnin doku "içinden" görülmesini sağladı. Dalak, karaciğer, kemik iliği ve kalp gibi kromofor açısından zengin dokuların rengi tamamen bozulmayabilir, ancak immün boyama ve görüntüleme için uygun kalır (Şekil 2 ve Şekil 5).
CLARITY protokolü için, sabit dokular fiksatifleri uzaklaştırmak için PBS ile yıkandı ve daha sonra numunedeki proteinler ile akrilamid monomerleri arasında kovalent bağlar oluşturmak için bir termal başlatıcı ile% 40'lık bir akrilamid çözeltisinde gece boyunca 4 ° C'de inkübe edildi (Şekil 1, alt). Ertesi gün, doku oda sıcaklığına dengelendikten ve daha sonra 37 °C'lik bir su banyosunda ısıtıldıktan sonra, akrilamid polimerizasyonu başlatıldı ve numune hızla bir hidrojel ile kaplandı. Numune, opak lipidleri uzaklaştırmak için 2-5 günlük bir süre boyunca% 8'lik bir SDS çözeltisi ile muamele edildi. Floresan boyamadan hemen önce numune, %90 noniyonik yoğunluk gradyan ortamı içeren CLARITY (Görüntüleme Ortamı RI-2) için kırılma indisi eşleştirme çözeltisine (RIMS) daldırıldı. Çok miktarda hem içeren dokular için, delipidasyon aşaması 9,11,12'nin sonuna bir renk giderme adımı eklenebilir. CUBIC ve CLARITY temizlemenin ilerlemesi, aynı insan dalak örneğinin farklı bölümlerinde karşılaştırıldı (Şekil 3). CLARITY temizleme, çözeltiyi kaplayan görünür bir poliakrilamid jel üretir ve ek bir renk giderme adımı eklenmedikçe CUBIC temizlemeye kıyasla tipik olarak daha az renk giderimi sergiler 9,12.
Daha sonra her iki protokolde de, temizlenmiş, sağlam dokular, spesifik bağışıklık hücresi popülasyonlarını tespit etmek için immün boyandı. Numuneler yıkandı, spesifik olmayan antikor bağlanmasını azaltmak için α-FcR içeren bir reaktif ile bloke edildi ve doğrudan bir florofora konjuge edilmiş bir primer antikor kullanılırken 3 gün boyunca boyandı. Alternatif olarak, numuneler 3 gün boyunca konjuge olmayan bir primer antikor ile boyandı, ardından bir florofora konjuge edilmiş ikincil bir antikor ile 3 gün daha boyandı. Dokular tekrar yıkandı ve daha sonra nükleer görselleştirme için gece boyunca 4 ° C'de DAPI boyası ile inkübe edildi. Numuneler yıkandı ve 24-36 saat boyunca CUBIC Reaktif-2 veya gece boyunca karanlıkta Görüntüleme Ortamı RI-2 (CLARITY) içinde inkübe edildi. Konfokal mikroskopi için, dokular görüntülemeden önce uygun RIMS'de bir mikroskop lamı üzerine monte edildi (Şekil 4). Hafif tabaka floresan mikroskobu (LSFM) için, numuneler, görüntülemeden önce gece boyunca bir görüntüleme küvetine tamamen RIMS ile daldırıldı.
Sağlam, berrak ve immün renklenmiş lenfoid dokuların konfokal mikroskobu, çekirdekler, immün hücre belirteçleri ve HIV/SIV CA (kapsid) proteinleri dahil olmak üzere çoklu floresan sinyallerin aynı anda görselleştirilmesine izin verdi (Şekil 5). Virüs üreten hücreler, immün hücre belirteçlerinin ve HIV proteinlerinin floresan kolokalizasyonu ile belirlendi. Temizlenmiş ve boyanmış HIV ile enfekte insan dalağı, HIV p24 ile birlikte lokalize edilmiş çoklu CD3 + T hücrelerini ortaya çıkardı, bu da sağlam doku bölgesinde virüs üreten hücrelerin varlığını gösterir (Şekil 5A-D). Temizlenmiş ve immün boyanmış SHIV ile enfekte NHP lenf nodları, çok sayıda virüs üreten hücrenin bulunduğu bölgelere ek olarak, virüs tespit edilmeyen doku bölgelerinde (Şekil 5E) CD3+ T hücrelerinin ve CD68+ makrofajlarının dağılımını ortaya çıkardı. Bu sonuçlar, çeşitli doku kaynaklarından virüs üreten hücrelerin, belirli bir görüş alanı içindeki diğer hücrelerden ayırt edilebilir olduğunu ve karmaşık bir doku ortamında nadir biyolojik olayların tespit edilmesine izin verdiğini gösterdi.
HIV enfeksiyonu sırasında sergilenen hücresel heterojenliği ortaya çıkaran Z-yığınları ve 3D yüzey modelleri oluşturmak için temizlenmiş dokuların konfokal mikroskop ile optik kesiti uygulandı (Şekil 6). Z-yığınları, Imaris yazılım paketi (Şekil 6A) kullanılarak bir Z-projeksiyon görüntüsünde yeniden birleştirildi ve CD3 + T hücrelerinin ve HIV kapsid proteini (p24) floresansının tüm doku hacimleri boyunca net bir şekilde görselleştirilmesi için DAPI nükleer kanalı çıkarıldı (Şekil 6B). Z-projeksiyon floresansı, tüm Z-yığını boyunca floresan sinyalinin uzamsal görselleştirmesi ve nicelleştirilmesi için yeniden yapılandırılmış bir 3D yüzey modeli oluşturmak üzere Imaris yazılımı ile otomatik olarak bölümlere ayrıldı (Şekil 6C). 3D yüzey modelinin analizi, 546 CD3 + T hücresi ve HIV p24 üreten 218 hücre ortaya çıkardı. Kümülatif olarak, temizlenmiş, HIV ile enfekte lenfoid dokulardan Z-yığını immünofloresan alımı, doku içinde 3D hücresel bileşim modellerinin oluşturulmasına ve doku hacimleri içinde bağışıklık hücresi popülasyonlarının otomatik olarak ölçülmesine izin verdi.
Sağlam, berrak ve immün renklenmiş lenfoid dokuların LSFM'si, lenfoid dokularda immün hücre ve virüs üreten hücre dağılımının daha büyük hacimli immünofloresan (IF) görüntülemesine izin verdi (Şekil 7). HIV ile enfekte bir hu-fareden alınan kolon dokusunun hCD3 + T hücreleri ve HIV p24 için immün boyanması, enfeksiyon kanıtı olmaksızın geniş doku bölgeleri arasında dağılmış virüs üreten hücrelerin odaklarını ortaya çıkardı (Şekil 7A). Virüs üreten hücrelerden oluşan bir odak noktasının yakınlaştırılmış bir görünümü, potansiyel hedef hücrelere yakın çok sayıda virüs üreten hücreyi ortaya çıkardı (Şekil 7B). Doku otofloresansı (kırmızı pus), otofloresandan (kırmızı ovaller) daha parlak bir şekilde boyanan doku içindeki spesifik bağışıklık hücresi popülasyonlarını ayırt ederken tüm doku mimarisini görselleştirmek için kullanıldı. Tüm LSFM Z-yığın hacminin bir 3D modeli, sağlam bir doku bölgesi içinde virüs üreten hücrelerin odaklarının uzamsal dağılımını gösterdi ve genel doku mimarisine göre virüs üretim konumlarının haritalanmasına izin verdi (Şekil 7C). Şaşırtıcı bir şekilde, virüs üreten hücrelerin odakları genellikle virüs üretimine dair hiçbir kanıt olmaksızın geniş doku bölgeleri arasına serpiştirildi. Bu sonuçlar, farklı dokularda ve farklı enfeksiyon zamanlarında veya farklı tedavilere yanıtta virüs dağılımı ve enfekte hücre yoğunluğu parametrelerinin ölçülmesine izin verebilir.
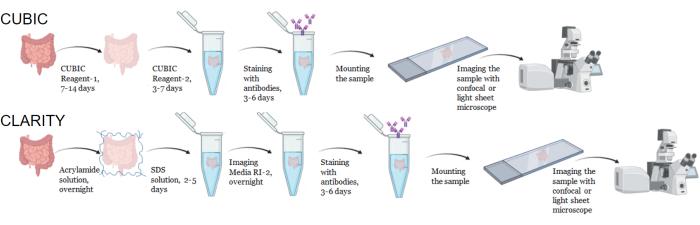
Şekil 1: Tipik CUBIC ve CLARITY doku temizleme, immün boyama ve görüntüleme iş akışı. CUBIC (üstte) ve CLARITY (altta) temizleme süreleri, dokunun boyutuna ve türüne bağlı olarak büyük ölçüde değişebilir. CLARITY temizleme için, dokunun temiz olduğunu doğrulamak için immün boyamadan önce kırılma indisi uyumlu ortam ile ek bir inkübasyon adımı gereklidir. İmmün boyama tipik olarak primer antikorlar floroforlarla konjuge edildiğinde 3 gün ve floresan sekonder antikorlar gerekiyorsa 6 gün sürer. Numuneler konfokal veya LSFM ile görüntülenebilir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
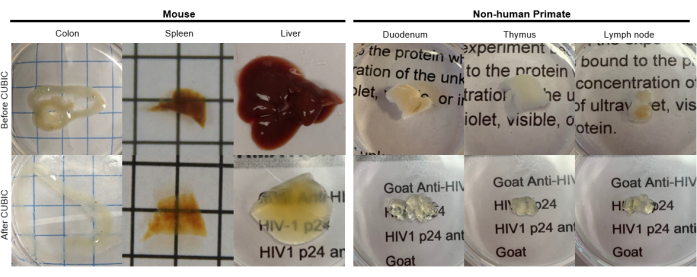
Şekil 2: Hu-mouse ve NHP doku örneklerinin KÜBİK Temizlenmesi. Doku örneklerinin farklı heme ve lipit yoğunluklarına bağlı olarak, her bir doku tipinin temizlenmesi için gereken süre değişir. Örneğin, kolon ve duodenum tipik olarak nispeten kısa süreler (~ 7 gün) gerektirirken, dalak ve karaciğerin şeffaf hale gelmesi daha uzun sürebilir (~ 30 gün). Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
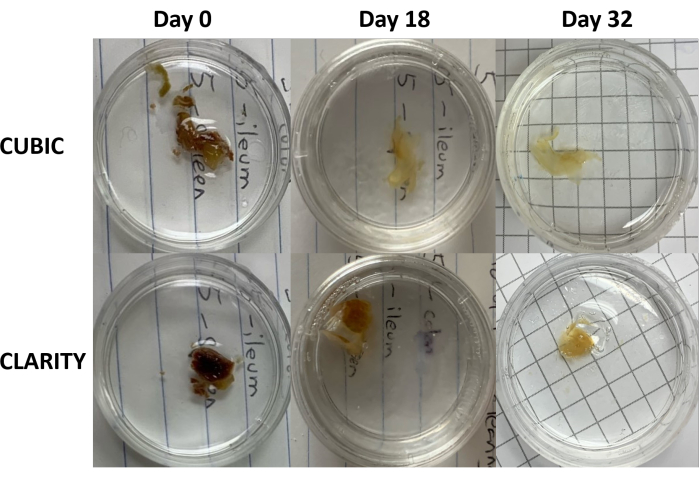
Şekil 3: İnsan numuneleri üzerinde doku temizleme yöntemlerinin boylamsal karşılaştırması. CUBIC (üst paneller) ve CLARITY (alt paneller), antiretroviral tedavi gören HIV ile enfekte olmuş bir bireyin dalağını temizledi. Her iki yöntem de immün boyama ve görüntüleme için 32. güne kadar dokuyu yeterince temizledi. CUBIC yöntemi için renk giderme adımı, dalak numunelerinde bulunan heme varlığının neden olduğu otofloresansı gözle görülür şekilde azaltır. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
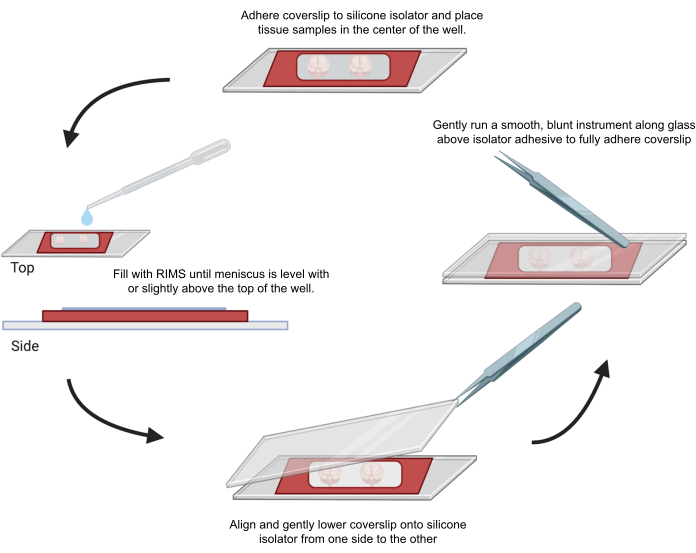
Şekil 4: Konfokal mikroskopi için numune montajı. Numuneler, yapışkanlı 0.5-1 mm silikon izolatörler ile ayrılmış lameller arasına monte edildi. İlk lamel üzerine silikon izolatörler yapıştırıldı ve kuyu ortasına (üst) doku yerleştirildi. Kuyu, menisküs kuyu üstü ile aynı hizaya gelene veya kuyunun tepesinin biraz üzerine gelene kadar (solda) RIMS ile dolduruldu. İkinci lamel dikkatlice bir taraftan diğer tarafa indirildi ve kabarcıklardan kaçınıldı (altta). Lameller, kuyu çevresinde (sağda) kör bir alet çalıştırılarak silikon izolatöre tamamen yapıştırıldı. Örnekler standart bir konfokal mikroskopta görüntülendi. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
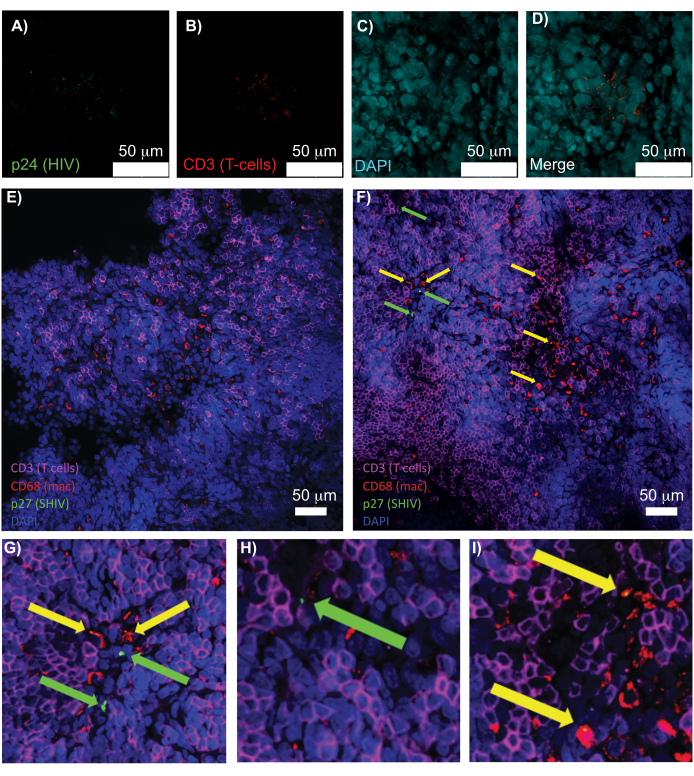
Şekil 5: Temizlenmiş, sağlam insan dalağı ve NHP lenf düğümlerinin konfokal mikroskobu. (M.S.) Temizlenmiş HIV ile enfekte insan dokusu HIV-1 p24 (yeşil), hCD3 + T hücreleri (kırmızı) ve çekirdekler (camgöbeği) için boyandı. (E) CD3 + T hücreleri (macenta), CD68 + makrofajlar (mac / kırmızı), SHIV p27 (yeşil) ve çekirdekler (mavi) için immün boyalı, enfeksiyondan 8 hafta sonra SHIV ile enfekte olmuş bir NHP'den CUBIC temizlenmiş lenf nodunun konfokal Z dilimi. Görüş alanı, T hücreleri, makrofajlar ve diğer hücre tiplerini içerir, ancak SHIV üreten hücrelere dair bir kanıt yoktur (yeşil). F) Virüs üreten CD3+ T hücreleri (yeşil oklar) ve CD68+ makrofajların (sarı oklar) varlığı ile birlikte hücre yoğunluğu ve sayısında farklılıklar gösteren aynı lenf nodunun bitişik bir bölgesinin konfokal Z dilimi. (G-I) (F)'den p27 boyamanın seçilen bölgelerinin yakınlaştırılmış görünümü. Ölçek çubukları 50 μm'dir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
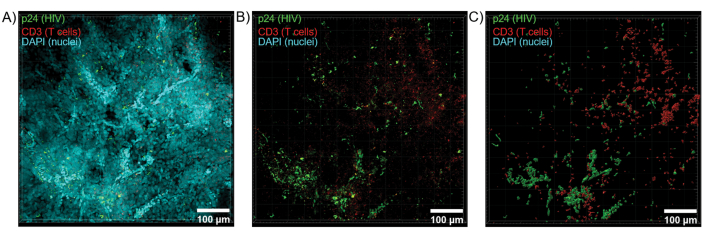
Şekil 6: HIV ile enfekte insan dalağından Z-yığın hacmi ve 3D yeniden yapılandırılmış yüzey. (A) HIV-1 p24 (yeşil), hCD3 + T hücreleri (kırmızı) ve çekirdekler (camgöbeği) için boyanmış 600 μm x 600 μm x 100 μm HIV ile enfekte insan dalak dokusunun Z yığınından Z-projeksiyon görüntüsü. (B) Nükleer DAPI boyaması olmadan aynı Z-projeksiyon görüntüsü. (C) Tüm Z-yığını hacminden CD3 (kırmızı) ve p24 (yeşil) floresan için yeniden yapılandırılmış 3B yüzey modeli. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
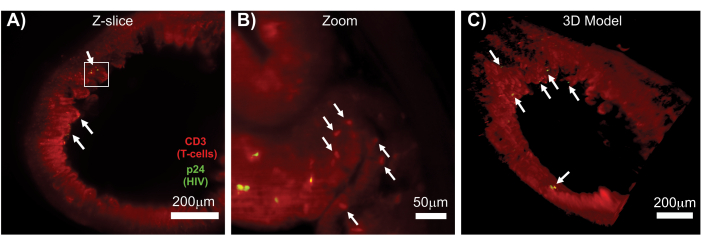
Şekil 7: HIV ile enfekte dokulardan yüzey hacimlerinin LSFM ve 3D rekonstrüksiyonu (A) CD3 + T hücreleri (kırmızı) ve HIV p24 (yeşil) için immün boyanmış HIV ile enfekte bir hu-fareden alınan kolon Z-dilimi (1.000 μm x 1.000 μm). Donuk kırmızı pus, doku otofloresansını temsil ederken, belirgin kırmızı punkta T hücrelerini gösterir. Villuslar, virüs içermeyen geniş alanlara dağılmış birkaç aktif virüs üretim odağı (beyaz oklar) ile merkezi lümene işaret eden çevre çevresinde görülebilir. Kutu, panel B için yaklaşık ilgi alanını gösterir. (B) Enfekte olmamış T hücrelerine (kırmızı) yakın hCD3 + T hücreleri (sarı) üreten bireysel virüsü gösteren yakınlaştırılmış doku bölgesi. Görüntü döndürüldü ve tek bir Z-düzleminde p24 pozitif hücrelerin odağını göstermek için yakındaki bir Z-dilimine değiştirildi. Arka plan kırmızı otofloresansı, spesifik hCD3 + T hücresi boyamasına (kırmızı punkta; beyaz oklar) ek olarak genel doku mimarisini gösterir. (C) Imaris yazılımı ile oluşturulan tam hacmin (1.000 μm x 1.000 μm x 200 μm) 3D yüzey modeli, bağırsağın farklı yerlerinde HIV enfeksiyonu odaklarını (sarı) gösterecek şekilde döndürülmüştür. Beyaz oklar, hacim içindeki tek tek odakları gösterir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Tartışmalar
İlgilenilen lenfoid dokular ölümden sonra hızla toplanmalı ve lekelenmeyi ve görüntülemeyi olumsuz etkileyebilecek doku nekrozunu (koyu veya siyah doku) önlemek için hemen önceden soğutulmuş fiksatif tamponlara yerleştirilmelidir. İstenen dokuları topladıktan sonra, dokuları sabitlemek için gece boyunca hemen buz gibi soğuk %4-8 paraformaldehit (PFA) içine batırın, bu da numunelerle ilişkili potansiyel patojenleri etkisiz hale getirir. %4 PFA, LM numunelerini sabitlemek için idealdir, oysa %8 PFA, hem LM hem de EM için dokuları yeterince koruyabilir. Bu prosedürleri takip etmek ve numuneleri karanlıkta 4 ° C'de fiksatif olarak saklamak, dokuları LM görüntüleme için birkaç yıl etkili bir şekilde koruyabilir. Bir uyarı, fiksatifte daha uzun süreli depolamanın, boyama artefaktlarının, özellikle bitişik proteinlerin ilgilenilen proteine çapraz bağlanmasından kaynaklanan antijen maskelemesinin ortaya çıkmasına yol açabilmesidir, bu da boyama antikorlarının epitop 13,14'e erişilebilirliğini engelleyebilir. Dokular endojen olarak eksprese edilen floresan proteinleri içeriyorsa, tüm protokol boyunca dokuları mümkün olduğunca ışığa maruz bırakmaktan kaçınmak için önlemler alın. Tipik olarak, endojen floresan proteinler, fiksasyondan sonra 6-12 ay boyunca floresanı koruyacaktır, ancak bireysel doku örnekleri daha uzun veya daha kısa süreler boyunca değişebilir. Protein bozunması nedeniyle endojen floresan kaybolursa, floresan proteinler genellikle ilgilenilen proteine özgü bir primer antikor kullanılarak tespit edilebilir. Perfüzyon,12'yi temizlemeden önce dokuları hızlı bir şekilde sabitlemek için başka bir seçenektir; bununla birlikte, HIV gibi patojenlerle çalışırken ortaya çıkan endişeler nedeniyle, numuneleri mümkün olduğunca güvenli bir şekilde hazırlamak için doku nekropsisi ve ardından buz gibi fiksatife daldırma yolu seçildi.
Açıklanan su bazlı temizleme protokollerinin bir avantajı, genellikle organik bazlı protokollerden daha hafif olmalarıdır, bu da bazen karaciğer gibi daha kırılgan dokulara zarar verebilir. Su bazlı temizleme protokolleri, organik bazlı temizleme protokollerine kıyasla tam numune temizleme elde etmek için genellikle daha uzun bir süre (haftalar yerine günler) gerektirecektir. CLARITY ve CUBIC protokolleri, bir kemirgen içindeki tüm organları aynı anda temizlemek için perfüzyon kullanılarak daha hızlı gerçekleştirilebilir11,12; ancak bu, NHP ve insan otopsileri için uygun bir seçenek değildi. CLARITY ile işlenen numuneler, bir miktar hacim genişlemesi gösterme eğilimindeyken, CUBIC, numune hacmi9 üzerinde azalmış bir etki ortaya koymuştur. Genellikle daha hızlı olmasına rağmen, birçok organik bazlı doku temizleme protokolü, dokuların küçülmesine15 neden olur, bu da lenf düğümleri ve dalak gibi hücre yoğun dokularda tek hücreli veya hücre altı detayların tespit edilmesini daha zor hale getirebilir. Temizlemenin neden olduğu genişleme, görüntülemenin çözünürlüğünü etkili bir şekilde artırabilir ve dokunun orijinal boyutunda gözlemlenmesi zor olan yönleri gözlemlemeyi kolaylaştırır. Alternatif olarak, doku küçülmesi, numunenin toplam boyutunu etkili bir şekilde azaltabilir ve bu da diseksiyon olmadan tüm organ görüntülemeyi mümkün kılabilir. Hem CLARITY hem de CUBIC protokolünün bir yararı, dokudaki endojen olarak eksprese edilen floresan proteinlerinden floresansı korurken, immünofloresan boyamaya uygun kalmalarıdır11,12. İmmün boyama, sulu veya organik doku temizleme yöntemleri kullanılarak gerçekleştirilebilir; Bununla birlikte, kişisel deneyim, organik bazlı protokollere kıyasla su bazlı protokoller kullanılarak daha yüksek bir antikor uyumluluğu oranı göstermiştir. Araştırmacıların, görüntülenen doku(lar)a ve ele alınan biyolojik sorulara (örneğin, tüm organ görüntülemeye karşı belirli bir ilgi alanı görüntülemesi) dayalı olarak hangi doku temizleme yöntemini kullanacaklarını düşünmeleri gerekir. Tüm büyük hacimli görüntüleme soruları için sağlam anahtar teslimi analize izin veren evrensel bir doku temizleme tekniği yoktur ve mevcut yöntemler biyolojik uygulamaya bağlı olarak belirgin avantajlar ve dezavantajlar sergiler.
Antikor boyaması yapılırken, çok sayıda hususun dikkate alınması gerekir. CLARITY numuneleri akrilamid hidrojel içine gömülü olduğundan, inkübasyon için daha uzun sürelere ihtiyaç duyma eğilimindedirler12. Antikor inkübasyonu için gereken süre ayrıca her bir numunenin hacmine ve kalınlığına da bağlıdır. Burada tarif edilen örneklerin çoğu ~ 2-3 milimetre kalınlığındaydı ve doku boyunca tam boyama için 3 gün yeterliydi. Hedef bütün bir fare beynini görüntülemekse, antikor inkübasyon süresi 1 hafta veya daha uzun sürebilir12. İmmünofloresan görüntüleme için sulu ve organik doku temizleme yönteminin seçilmesi, antikor uyumluluğuna bağlı olabilir. Genel olarak, CUBIC veya CLARITY için, kültürlenmiş hücrelerde ve dokularda çalışan antikorlar için isabet oranı ~%70'tir. İster sulu ister organik bir doku temizleme yöntemi kullanılsın, tüm antikorların kullanılan spesifik yöntemle uyumluluğunu ve etkinliğini değerlendirmek gerekir. Bu protokol bölümünde gösterildiği gibi, CUBIC ve CLARITY ile işlenmiş numuneler için immün boyama, temizleme bittikten sonra gerçekleşir. Aksine, bu adım, bazı organik bazlı protokoller için temizleme prosedüründen önce gerçekleşir ve ardından sabitleme sonrası gerçekleşir.
Dokuların, kırılma indislerine uygun bir görüntüleme ortamına tamamen daldırılması kritik derecede önemlidir. Bunun yapılmaması, görüntüleme sırasında küresel sapmalara neden olur ve görüntü alımı sırasında yakalanan ışığı bozar. Kabarcıklar numuneye gelen veya numuneden uzaklaşan ışık yolunu bozabileceğinden, hem konfokal hem de LSFM için numuneleri monte ederken görüntüleme ortamındaki tüm hava kabarcıklarının giderilmesine özen gösterilmelidir. Kabarcıklar, son numune montajından önce bir pipetle manuel olarak çıkarılabilir. Konfokal mikroskopla daha kalın numuneleri görüntülemek için, 0,5 mm'den daha kalın dokuları barındırmak için birden fazla silikon ara parça üst üste katmanlanabilir. Bir öneri, RIMS'deki tüm dokuları, ek numune hareketi olmadan mikroskop üzerine monte edilirken birkaç saat ila gece boyunca dengelemektir. Doku ve görüntüleme ortamının tam dengelenmesi, görüntüleme sırasında sapmalar oluşturabilecek uyumsuz kırılma indekslerine sahip solüsyonların karışmasını önleyecektir. Temizlenmiş doku örneklerini monte ederken, tüm örnekleri tüm mikroskoplarda görüntülemek için tek bir anahtar teslimi montaj yöntemi olmadığını hatırlamak önemlidir. Bu protokol, bir bağlamda en iyi şekilde çalışan numune montaj seçeneklerini tartışır, ancak kullanılan bireysel mikroskoba ve ele alınan biyolojik soruya bağlı olarak numune montajı için çok sayıda yaklaşım vardır. Bu yaklaşımlar, numunenin agaroz içine gömülmesini, numunenin kanca veya kırılma indisi uyumlu bir plastik hattan askıya alınmasını, kirpi adaptörü kullanılmasını, bir numune tutucunun 3D olarak yazdırılmasını veya numunenin yapıştırıcı ile plastik bir kaba takılmasını içerebilir, ancak bunlarla sınırlı değildir.
Konfokal mikroskoplar, ~ 1 mm3-1 cm3 doku hacimlerini görüntülemek için iyi çalışabilir. Konfokal mikroskoplar için, başlangıçta ilgilenilen bölgeleri bulmak ve tek hücreli çözünürlüğe sahip daha büyük hacimli veya tam doku Z-yığınları elde etmek için 2-10x'lik bir objektif kullanın. Hücre altı bilgilerle belirli ilgi bölgelerinin daha yüksek çözünürlüklü görüntülerini elde etmek için 20-63x hedeflere geçin. CUBIC ve CLARITY temizlenmiş dokuları görüntülemek için ideal amaç, dokunun ve görüntüleme solüsyonunun kırılma indisiyle doğru bir şekilde eşleşen CLARITY/Scale'e özel bir hedeftir. Bu tür bir objektif mevcut değilse, numuneleri bir hava objektifi yerine bir gliserol veya yağa daldırma objektifi (örneğin, LD LCI Plan-Apochromat 25 x 0,8 NA Imm Corr DIC M27 çoklu daldırma objektifi: çalışma mesafesi = 0,57 mm) ile görüntülemek en uygunudur. Bu, görüntü yakalama sırasında uyumsuz kırılma indisitleri nedeniyle ortaya çıkan optik bozulmaları en aza indirecektir. 20-25x objektifler, daha büyük hacimli görüntü elde etme ile karmaşık bir doku ortamındaki tek tek hücrelerden boyama ayrıntıları elde etme dengesini sağlayabilir. Daha da önemlisi, çoğu konfokal mikroskop, görüntüleme hacimlerinin 3D döşenmesine izin veren modüller içerir. Bu tür bir görüntü elde etme, ideal olarak alt hücresel bilgi içeren daha büyük hacimli Z-yığınları oluşturabilir.
LSFM görüntüleme, büyük hacimli dokular (>1cm3) ve hatta tüm organlar bağlamında belirli hücre popülasyonlarının 3D görselleştirmesine izin verebilir. Son 10 yıl boyunca, LSFM ile birleştirilen doku temizleme, büyük ölçüde kemirgenlerdeki beyin bağlantısını anlamaya odaklandı; Bununla birlikte, daha yeni uygulamalar, tümör metastatik manzaralarının16, anatomik bölmeler 9,17 içindeki hücre dağılımının ve patojen dağılımının18 görselleştirilmesini içerir. Kültürlenmiş hücrelerle karşılaştırıldığında, dokulardaki biyolojik olayların çoğu tekdüze değildir ve LSFM, bu olayların uzamsal doku heterojenliğini görselleştirmek ve ölçmek için özellikle usta olabilir (örneğin, virüs replikasyonu, bağışıklık sinyali, hücre dağılımı, vb.).
Konfokal veya LSFM yoluyla elde edilen 3D veri setleri, çok sayıda görüntü analiz platformuyla sonradan işlenebilir. Imaris yazılım paketi, yüzeylerin inşası, 3D animasyon üretimi ve hücre nicelemesi için kullanılabilir; Bununla birlikte, verimli görüntü işleme ve analizini mümkün kılan çok sayıda görüntü analiz sistemi mevcuttur. ImageJ / Fiji ücretsiz19 , çoğu laboratuvarın erişebileceği çekici bir alternatif görüntü işleme platformudur, ancak her türlü görüntü analizi ve görselleştirmede mükemmel olan, herkese uyan tek bir analiz yazılımı yoktur. Birçok görüntü analizi yazılım paketi, ortak kullanım olanakları aracılığıyla mevcut değilse, aşırı derecede pahalı olabilir. Son olarak, LSFM veya büyük döşemeli konfokal 3B veri kümelerinin kritik bir yönü veri yönetimidir. Bu görüntüleme platformları, veri görselleştirme ve niceleme için üst düzey bilgisayar iş istasyonları gerektiren devasa dosyalar (>1 Tb) oluşturabilir. Sonuç olarak, bu görüntüleme iş akışı, tüm dokular içinde uzamsal olarak farklı hücre popülasyonlarının elde edilmesini ve nicelleştirilmesini kolaylaştırabilir ve çoğu doku kaynağı ve biyolojik sistem için yaygın olarak uygulanabilir.
Açıklamalar
Yazarların açıklanacak çıkar çatışmaları yoktur.
Teşekkürler
Urbana-Champaign Genomik Biyoloji Enstitüsü'ndeki Illinois Üniversitesi'ne Konfokal ve Işık Levhası Floresan Mikroskoplarının kullanımı için Temel Tesislere teşekkür ederiz. Aşağıdaki hibelerle finanse edilen insan dokusu örnekleri için "The Last Gift" kohortundaki harika bireylere teşekkür ederiz: I147821, DA051915, AI131385 ve P30 AI036214. SHIV ile enfekte olmuş NHP doku örnekleri için Nancy Haigwood ve Ann Hessell'e teşekkür ederiz.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Acrylamide Solution (in 0.1 M PBS, 40 mL in total) | |||
| 40% Acrylamide: 4 mL | Bio-Rad | 1610144 | |
| VA-044 Thermal Initiator: 0.1g | Fujifilm | 011-19365 | |
| CLARITY Blocking solution (in 0.1 M PBS, 5 mL in total) | |||
| Fetal bovine serum (FBS): 200 µL | Atlas Biologicals | F-0500-D | |
| Rat anti-human or anti-mouse FcR: 50 µL | Miltenyi | 130-092-575(mouse)/130-059-901(human) | |
| Sodium azide (from stock solution): 5 µL | Sigma | 71289-50G | |
| Tween-20: 5 µL | Fisher Scientific | BP337-500 | |
| CLARITY wash solution (in 0.1M PBS, 50 mL in total) | |||
| Sodium azide (from stock solution): 50 µL | Sigma | 71289-50G | |
| Tween-20: 50 µL | Fisher Scientific | BP337-500 | |
| CUBIC Blocking solution (in 0.1M PBS, 5 mL in total) | |||
| Fetal bovine serum (FBS): 200 µL | Atlas Biologicals | F-0500-D | |
| Rat anti-human or anti-mouse FcR: 50 µL | Miltenyi | 130-092-575(mouse)/130-059-901(human) | |
| Sodium azide (from stock solution): 5 µL | Sigma | 71289-50G | |
| Triton X-100: 5 µL | VWR | M143-1L | |
| CUBIC Reagent-1 (in 0.1M PBS, 50 mL in total) | |||
| N, N, N’, N’-tetrakis (2-hydroxypropyl) ethylenediamine: 12.5 g | Aldrich | 122262 | |
| Triton X-100: 7.5 g | VWR | M143-1L | |
| Urea: 12.5 g | Fisher chemical | U15-500 | |
| CUBIC Reagent-2 (in 0.1M PBS, 50 mL in total) | |||
| Sucrose: 25 g | Sigma | S1888-500G | |
| Sodium azide (in powder form): 10 g | Sigma | 71289-50G | |
| Sodium azide stock solution (in DI H2O, 50 mL in total) | Sigma | 71289-50G | |
| Triethanolamine: 5 g | Sigma | 90270-500mL | |
| Triton X-100: 50 µL | VWR | M143-1L | |
| Urea: 12.5 g | Fisher chemical | U15-500 | |
| CUBIC wash solution (in 0.1M PBS, 50 mL in total) | |||
| Sodium azide (from stock solution): 50 µL | Sigma | 71289-50G | |
| Triton X-100: 50 µL | VWR | M143-1L | |
| DAPI staining solution (0.5 µg/mL) | |||
| DAPI stock solution: 1 µL | |||
| Wash solution: 10 mL | |||
| DAPI stock solution (5 mg/mL) | |||
| DAPI powder: 5 mg | Sigma-Aldrich | D9542-1MG | |
| DMSO (100%): 1 mL | ThermoFisher | D12345 | |
| Imaging Media RI-2 (in dH2O) | |||
| 90% Histodenz | Sigma | D2158-100G | |
| 0.01% Sodium azide | Sigma | 71289-50G | |
| 0.02 Sodium Phosphate Buffer, pH 7.5 | Sigma-Aldrich | S9638-250G | |
| 0.1% Tween-20 | Fisher Scientific | BP337-500 | |
| Primary antibodies (in blocking solution without rat anti-mouse FcR, 2 mL in total) | |||
| Goat anti-HIV p24: 10 µL (1:200) | Creative Diagnostics | DPATB-H81692 | |
| Mouse anti-human CD68: 10 µL(1:200) | Dako | M0876 | |
| Rabbit anti-human CD3: 10 µL (1:200) | Dako | A0452 | |
| 8% SDS Solution (in 0.1 M PBS, 50 mL in total) | |||
| SDS powder: 4 g | Sigma-Aldrich | L3771-500G | |
| Secondary antibodies (in blocking solution without rat anti-mouse FcR, 2 mL in total) | |||
| Donkey anti-goat conjugated with AlexaFluor647: 2 µL | Invitrogen | A21447 | |
| Donkey anti-mouse conjugated with AlexaFluor594: 2 µL | Invitrogen | A21203 | |
| Donkey anti-rabbit conjugated with AlexaFluor488: 2 µL | Invitrogen | A21206 |
Referanslar
- Spalteholz, W., Barker, L. F., Mall, F. P. Hand-Atlas of Human Anatomy. , J.B. Lippincott Co. Philadelphia. Second edition in English (1907).
- Jacob, T., Gray, J. W., Troxell, M., Vu, T. Q. Multiplexed imaging reveals heterogeneity of PI3K/MAPK network signaling in breast lesions of known PIK3CA genotype. Breast Cancer Research and Treatment. 159 (3), 575-583 (2016).
- Kieffer, C., Ladinsky, M. S., Ninh, A., Galimidi, R. P., Bjorkman, P. J. Longitudinal imaging of HIV-1 spread in humanized mice with parallel 3d immunofluorescence and electron tomography. eLife. 6, 23282(2017).
- Chung, K., Deisseroth, K. CLARITY for mapping the nervous system. Nature Methods. 10 (6), 508-513 (2013).
- Compton, A. A., Schwartz, O. They might be giants: Does syncytium formation sink or spread HIV infection. PLoS Pathogens. 13 (2), 2-8 (2017).
- Symeonides, M., et al. HIV-1-induced small T cell syncytia can transfer virus particles to target cells through transient contacts. Viruses. 7 (12), 6590-6603 (2015).
- Sharova, N., Swingler, C., Sharkey, M., Stevenson, M. Macrophages archive HIV-1 virions for dissemination in trans. The EMBO Journal. 24 (13), 2481-2489 (2005).
- Colby, D. J., et al. Rapid HIV RNA rebound after antiretroviral treatment interruption in persons durably suppressed in Fiebig I acute HIV infection. Nature Medicine. 24 (7), 923-926 (2018).
- Ladinsky, M. S., et al. Mechanisms of virus dissemination in bone marrow of HIV-1-infected humanized BLT mice. eLife. 8, 46916(2019).
- Buettner, M., Bode, U. Lymph node dissection--understanding the immunological function of lymph nodes. Clinical and Experimental Immunology. 169 (3), 205-212 (2012).
- Treweek, J. B., et al. Whole-body tissue stabilization and selective extractions via tissue-hydrogel hybrids for high-resolution intact circuit mapping and phenotyping. Nature Protocols. 10, 1860-1896 (2015).
- Tainaka, K., et al. Whole-body imaging with single-cell resolution by tissue decolorization. Cell. 159, 911-924 (2014).
- Sompuram, S. R., Vani, K., Bogen, S. A. A molecular model of antigen retrieval using a peptide array. American Journal of Clinical Pathology. 125 (1), 91-98 (2006).
- Scalia, C. R., et al. Antigen masking during fixation and embedding, dissected. The journal of histochemistry and Cytochemistry: Official Journal of the Histochemistry Society. 65 (1), 5-20 (2017).
- Jing, D., et al. Tissue clearing of both hard and soft tissue organs with the PEGASOS method. Cell Research. 28 (8), 803-818 (2018).
- Guldner, I. H., et al. An Integrative platform for three-dimensional quantitative analysis of spatially heterogeneous metastasis landscapes. Scientific Reports. 6, 24201(2016).
- Muntifering, M., et al. Clearing for deep tissue imaging. Current Protocols in Cytometry. 86 (1), 38(2018).
- DePas, W. H., et al. Exposing the three-dimensional biogeography and metabolic states of pathogens in cystic fibrosis sputum via hydrogel embedding, clearing, and rRNA labeling. mBio. 7 (5), 00796(2018).
- Schindelin, J., et al. Fiji: An open-source platform for biological-image. Nature Methods. 9 (7), 676-682 (2012).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır