Method Article
إطار حسابي قائم على حركة الخرزة للتحليل ثلاثي الأبعاد لعدم تجانس مادة الأغشية الحيوية
In This Article
Summary
نصف طريقة لتحليل وقياس نمط حركة حبات الكربوكسيل 1 ميكرومتر من خلال الأغشية الحيوية البكتيرية غير المتجانسة. يمكن استخدام مقارنة أنماط الحركة لتحديد الاختلافات في خصائص المواد للأغشية الحيوية.
Abstract
لوحظت اختلافات في الخصائص المادية للأغشية الحيوية البكتيرية في الأغشية الحيوية لأنواع بكتيرية مختلفة ، داخل نفس النوع في ظل ظروف نمو مختلفة وبعد المعالجة بجزيئات تعديل المصفوفة. لتحديد الخصائص المادية للأغشية الحيوية ثلاثية الأبعاد بشكل أفضل ، تم تطوير سير عمل تجريبي وحسابي وتطبيقه لفحص الاختلافات بين المكورات المعوية البرازية والنمط المصلي السالمونيلا المعوية Typhimurium والإشريكية القولونية الحيوية بالإضافة إلى دور الأميلويد في تأكيد صلابة الأغشية الحيوية Enterobacteriaceae. تم تتبع الديناميكيات المكانية والزمانية لخرز الكربوكسيل 1 ميكرومتر في الأغشية الحيوية في أغشية حيوية ثلاثية الأبعاد 20 ميكرومتر على مدار 20 دقيقة. تمت معالجة مكدسات الصور 4D باستخدام المكون الإضافي Mosaic في ImageJ لإنتاج بيانات مسار ثلاثية الأبعاد لحركة الخرزة. تم تحليل بيانات المسار هذه باستخدام صندوق أدوات Bead Evaluator المطور حديثا ، حيث تم حساب بيانات الحركة ، بما في ذلك عمر المسار ، وسرعات الخرزة ، وكثافة الخلايا على طول المسارات ، ومعلومات الصندوق المحيط وتخزينها في ملفات csv. تقدم هذه الورقة سير العمل من الإعداد التجريبي وتسجيل الصور إلى حساب مسار الخرزة وتحليلها. أدى هيكل الأغشية الحيوية المحتوية على التجعد إلى تفاعلات حبة أكثر استقرارا وحركة حبة أقل من الأغشية الحيوية المتحولة والمكورات المعوية. لم تبدو حركة الخرزة تعتمد بشدة على كثافة الخلية عند قياس سرعة الخرزة وحجم الصندوق المحيط بالمسار ، مما يدعم الفرضية القائلة بأن الخصائص المادية الأخرى للأغشية الحيوية تتحكم في ديناميكيات الخرزة. هذه التقنية قابلة للتطبيق على نطاق واسع لقياس الاختلافات في الأغشية الحيوية لتركيبات المصفوفة المختلفة وكذلك الأغشية الحيوية قبل وبعد علاجات تعديل المصفوفة.
Introduction
تنتشر الأغشية الحيوية البكتيرية في كل مكان كجزء من الكائنات الحية الدقيقة البشرية وتتفاعل باستمرار مع الجزيئات. يتراوح حجم هذه الجزيئات من المضادات الحيوية 1 نانومتر وبكتيريا 1-3 مم إلى جزيئات أكبر من الألياف في الجهاز الهضمي. يؤثر تكوين الأغشية الحيوية أحادية أو متعددة الأنواع على خصائص المواد وبالتالي نمط حركة الجسيمات من خلال الأغشيةالحيوية 1،2،3،4،5. أحد الأمثلة على ذلك هو الأميلويدات البكتيرية ، التي تحتوي على بنية صفائح ليفية متقاطعة6. يتم التعبير عن الأميلويد الكيرلي بواسطة البكتيريا المعوية مثل الإشريكية القولونية والسالمونيلا المعوية النمط المصلي Typhimurium وقد تم اكتشاف الجينات في العديد من الشعبة البكتيريةالأخرى 7. تتأثر الخصائص المادية المختلفة للأغشية الحيوية ب curli8،9. يتفاعل Curli بشكل مباشر مع المكونات الأخرى للمصفوفة مثل الحمض النووي خارج الخلية (eDNA) والسليلوز10،11. يحيط التجعد بالخلايا ويؤثر على صلابة الغشاء الخلوي12 والخصائص اللزجة المرنة الإجمالية للأغشيةالحيوية 13. يتوسط Curli زيادة قوة الشد عن طريق الارتباط ب fibronectin ، مما يؤدي إلى زيادة في التعلق القوي بالسطحالزجاجي 14. ترتبط العاثيات الواردة بالكيرلي وتحد من غزو العاثيات في الأغشيةالحيوية 15.
عند استخدام شرائح البئر المطلية متعددة الاختبارات لتحليل ما يقرب من 20 ميكرومتر المكورات المعوية البرازية ، الإشريكية القولونية ، و S. الأغشية الحيوية Typhimurium باستخدام الفحص المجهري متحد البؤر ، اختلافات واضحة بين الإشريكية القولونية ، S. يمكن ملاحظة التيفيموريوم10،16 و E. faecalis الأغشية الحيوية (الدراسة الحالية). في حين أن الأغشية الحيوية لأنواع Enterobacteriaceae تتمتع بمستوى عال من الصلابة وكان من السهل تصوير المناطق ذات الكثافة الخلوية المنخفضة ، فإن الحصول على صور واضحة عالية الدقة للإشريكية البرازية باستخدام متوسط الخط والإطار يتطلب تطبيق الضغط على الشريحة للحث على توتر سطحي كاف لاستقرار الخلية أثناء عملية التصوير. تشكل الأميلويدات البكتيرية مثل الكيرلي هياكل مرتبة للغاية ، مما يشير إلى أنها قد تكون صلبةنسبيا 17. هذا الدافع وراء الفرضية القائلة بأن الأميلويد كولي يمكن أن يسبب الصلابة في الإشريكية القولونية و S. الأغشية الحيوية Typhimurium. لم يكن هناك دليل واضح على أن بكتريا البرازية كانت تعبر عن الأميلويد في ظل الظروف المدروسة. تبين مؤخرا أن بروتين Esp ، وهو جين بيلين مرتبط بسلالات أكثر مسببة للأمراض من E. faecalis ، ينتج هياكل أميلويد18. ومع ذلك ، باستخدام عمليات البحث في Blastn و blastp ، لم يتم اكتشاف هذا الجين في E. faecalis سلالة من النوع التعايشي OG1RF المستخدمة في هذه الدراسات. يمكن أن يشكل الفرمون cOB1 ، الذي تنتجه OG1RF ، هياكل شبيهة بالأميلويد19. ومع ذلك ، مع ظروف نمو الأغشية الحيوية المحددة وطرق الكشف عن الأميلويد المستخدمة سابقا ل S. تلطيخ الأميلويد التيفيموريوم10 في بكتريا برازية ، لا يمكن اكتشاف الأميلويد OG1RF (البيانات غير معروضة). تم تطوير تقنية صور جديدة رباعية الأبعاد (4D) لمقارنة الخصائص الإجمالية للمواد بين E . faecalis اللزجة والإشريكية القولونية و S. Typhimurium وكذلك لتحديد مساهمة الأميلويد في الأغشية الحيوية للبكتيريا المعوية باستخدام طفرات الأميلويد من S. التيفيموريوم والإشريكية القولونية.
في الماضي ، تم استخدام حبات الفلورسنت بنجاح لتحليل الخصائص المادية للأغشية الحيوية في بعدين (2D) باستخدام علم الريولوجياالدقيقة 20،21،22،23،24،25. يمكن تطبيق ذلك على الأغشية الحيوية ثلاثية الأبعاد من خلال دراسة الشرائح البصرية ثنائية الأبعاد على أعماق مختلفة في الأغشيةالحيوية 26. تم تطوير التقنية الحالية لتتبع الخرز المجهري 1 ميكرومتر في 3D بمرور الوقت لاستخدامها في النمذجة 4D. كان جزء من الأساس المنطقي هو المفهوم الشامل لاستخدام النمذجة رباعية الأبعاد لفهم حركة البلازميدات من خلال مجتمعات الجراثيم المعدية المعوية. تم استخدام حبات الكربوكسيل المشحونة بالفلورسنت بقطر 1 ميكرومتر لأنها تتوافق بشكل جيد ، فيما يتعلق بالحجم والشحنة ، مع E. faecalis ، الكائن الحي النموذجي المختار لحركة البلازميد وصيانته27 ، 28. تم تطوير اختبار رباعي الأبعاد لتحديد الخصائص الفيزيائية للأغشية الحيوية (الشكل 1 أ). في المنهجية المبتكرة ، تمت إضافة الخرز إلى الأغشية الحيوية وتم تسجيل مساراتها المكانية والزمانية من خلال أغشية حيوية بسمك 10-20 ميكرومتر على مدار 10-20 دقيقة. ثم تم قياس مسارات الخرزة في 3D من حيث طول المسار ، وسرعة الخرزة ، وحجم الصندوق المحيط بالمسار (الحد الأدنى من الصندوق الذي يحتوي على المسار) ، والكثافة الخلوية للصندوق المحيط باستخدام صندوق أدوات تم تطويره حديثا. يمكن استخدام البروتوكول التالي لإنشاء بيانات صورة 4D للبكتيريا والخرزة التي تحتوي على أغشية حيوية ، والمعالجة المسبقة للبيانات باستخدام ImageJ29 والمكون الإضافي Mosaic ، ولتحليل مسارات الخرز باستخدام صندوق أدوات Bead Evaluator.
هذه التقنية لها تطبيقات متعددة لفحص خصائص المواد وكذلك تتبع حركة الجسيمات والبكتيريا في ثلاثة أبعاد. على سبيل المثال ، تم استخدام نسخة مبكرة من هذه التقنية لتوصيف تأثير الأجسام المضادة وحيدة النسيلة الموجهة ضد الكريري على السلامة الهيكلية للأغشيةالحيوية 16. تحتوي النسخة الكاملة على أدوات متعددة لتوفير تحليل أكثر تفصيلا لخصائص مادة الأغشية الحيوية ويستمر استخدامها لفحص آثار العلاج بالأجسام المضادة وحيدة النسيلة على الأغشية الحيوية. يمكن استخدام جزيئات ذات شحنات مختلفة لفحص خصائص شحنة المواد للأغشية الحيوية وحركة الجسيمات من خلال الأغشية الحيوية ذات تركيبات المصفوفة المختلفة. يمكن استخدام هذا لمقارنة النتائج من علم الريولوجيا الدقيقة ثنائي الأبعاد التي تكشف عن خصائص المواد المسؤولة عن حركة الخرز الذي لاحظناه في الأغشية الحيوية التي لم تكن قيد التدفق. يمكن أيضا استخدام هذه التقنية في الأغشية الحيوية للأنواع المختلطة مع مناطق ذات تكوين غشاء حيوي مختلف. يمكن تصوير الأغشية الحيوية مباشرة تحت التدفق في أجهزة الموائع الدقيقة وخلايا التدفق لفحص التغيرات في خصائص المواد بين الأغشية الحيوية الساكنة والتدفق بالإضافة إلى تأثير التدفق على حركة الجسيمات. يمكن أيضا تطبيق التقنيات على البكتيريا المصنفة بالفلورسنت لتوصيف حركة البكتيريا الخارجية من خلال مجتمع الأغشية الحيوية. باستخدام ثلاثة ألوان ، يمكن استخدام البكتيريا المانحة المصنفة بالفلورسنت والبكتيريا المتلقية المصنفة بالفلورسنت والبلازميدات المصنفة بالفلورسنت لتتبع حركة البلازميدات وإرساؤها ونقلها.
Protocol
1. تحضير الفيلم الحيوي
ملاحظة: يمكن زراعة الأغشية الحيوية للتحليل باستخدام أي طريقة تسمح للأغشية الحيوية بالتشكل على سطح زجاجي بصري. يجب أن تلتصق بنية الأغشية الحيوية بالسطح البصري بدرجة كافية بحيث لا يتعطل الهيكل أثناء الغسيل و / أو خطوات التركيب الخاصة بالبروتوكول. فيما يلي وصف لتقنية الألواح السفلية البصرية ذات 96 بئرا والأغطية الزجاجية 12 مم في ألواح 24 بئرا. تشمل الخيارات الأخرى لوحات سفلية بصرية مختلفة الحجم وغرف تدفق بصري مع وبدون تدفق.
- إعداد الفيلم الحيوي
- أضف وسط نمو البكتيريا إلى آبار اللوحة. لهذه الدراسة ، من أجل E. البرازي ، أضف 2 مل من Todd-Hewitt (TH) إلى صفيحة مكونة من 24 بئرا وأضف 0.4 مل من TH إلى ألواح 96 بئرا السفلية البصرية. ل S. Typhimurium و E. coli و csgAB curli mutants متساوي الجين ، يضيف 0.7 مل من مرق لوريا الخالي من الملح (LB) إلى الآبار. في حالة استخدام الغرف السفلية البصرية ، انتقل إلى الخطوة 1.2.
- ضع أغطية بصرية زجاجية مقاس 12 مم # 1.5 في طبق بتري وقم بتغطيتها بالإيثانول.
- باستخدام الملقط ، قم بإزالة الغطاء واستخدم اللهب لإشعال النار في الكحول المتبقي. دع الكحول يحترق. فقط استخدم اللهب لإشعال النار فيها. لا تمسك الغطاء في اللهب لأنه سوف يتشقق. اترك الغطاء يبرد لمدة 10-20 ثانية قبل وضعه في البئر لمنع التشقق.
- ضع الغطاء في البئر الذي يحتوي على الوسط بزاوية لمنعه من وضعه فوق الوسط. لا تضيف الغطاء إلى بئر جاف ثم أضف متوسطا لأن ذلك سيؤدي إلى التصاق الغطاء بقاع البئر.
- استخدم طرف ماصة معقمة لدفع الغطاء بعناية إلى قاع البئر الذي يحتوي على الوسط.
ملاحظة: تذكر أن تتطابق مع سمك (# 1 أو # 1.5) لغطاء الزجاج البصري أو اللوحة السفلية البصرية مع سمك بصريات المجهر متحد البؤر.
- احتضان الأغشية الحيوية في ظل ظروف مناسبة لنمو الأغشية الحيوية. في هذه الدراسات ، تنمو بكتريا البرازية الأغشية الحيوية كمزارع ثابتة عند 37 درجة مئوية وتنمو الإشريكية القولونية الأغشية الحيوية هوائية عند 30 درجة مئوية.
- في هذه الدراسات ، تنمو E. faecalis الأغشية الحيوية لمدة يومين مع مفاتيح متوسطة في الصباح والمساء الباكر. لمنع إتلاف الأغشية الحيوية أو إزااحتها ، قم بإمالة اللوحة بعناية. ضع طرف الماصة بالقرب من الحافة السفلية للبئر واسحب الوسط ببطء. أضف أول مل من الوسط الطازج بنفس الطريقة. أضف المل الثاني ببطء بالقرب من واجهة المتوسط / البئر.
- في هذه الدراسات ، استخدم ظروف النمو لإنتاج الكيرلي الأمثل. ينمو S. تم احتضان الأغشية الحيوية التيفيموريوم عند 28 درجة مئوية لمدة 6-8 أيام على ميل سمح للأغشية الحيوية بالالتصاق بحوالي 2/3 من الطريق إلى أعلى الشريحة ثم تنمو كبليلة على واجهة الهواء السائل. تم ذلك دون تغيير متوسط. لمنع الوسط من الجفاف ، ضع الطبق المكون من 24 بئرا في حجرة بها وعاء ماء.
2. التصوير 4D
- تحضير حامل الأغشية الحيوية
- تمييع قرمزي 1 ميكرومتر كربوكسيل FluoSpheres الخرز 1:50 في PBS (2 × 107 حبات في 1 مل من PBS). في حالة استخدام الغرف السفلية البصرية ، أضف Syto9 عند تخفيف 1 ميكرولتر إلى 300 ميكرولتر من تحضير الخرزة.
- (اختياري) اغسل الأغشية الحيوية لإزالة آثار وسط النمو إذا كان وسط النمو يحتوي على تألق ذاتي. في هذه التجارب ، اغسل مرتين باستخدام 1 مل من PBS ، وقم بإمالة اللوحة بعناية ، ووضع طرف الماصة بالقرب من الحافة السفلية للبئر وسحب الوسط ببطء. أضف PBS عن طريق وضع الطرف بالقرب من الحافة السفلية واملأ البئر ببطء. استخدم هذه التقنية على الآبار السفلية البصرية بالإضافة إلى الأغطية في صفيحة 24 بئرا.
- قم بإزالة الوسيط أو PBS. أضف حبات قرمزية مخففة محضرة في 2.1.1 إلى الأغشية الحيوية. في هذه الدراسات ، أضف 1 مل من الخرز (2 × 107) إلى الغطاء و 0.2 مل من الخرز (4 × 106) و Syto9 إلى 96 بئر من الألواح السفلية البصرية.
- احتضن لمدة 1 دقيقة في درجة حرارة الغرفة للسماح بارتباط الخرزة.
- قم بإزالة الخرز وغسل الأغشية الحيوية برفق مرة واحدة باستخدام PBS لإزالة الخرزات غير المرتبطة. في هذه الدراسات ، بالنسبة للغطاء ، اغسل برفق ب 1 مل من PBS ، وأعد ملء البئر ب 1 مل PBS ، وانتقل إلى 2.1.6. بالنسبة للألواح السفلية البصرية المكونة من 96 بئرا ، اغسل الأغشية الحيوية برفق باستخدام 0.2 مل من PBS وأعد ملء البئر ب 0.2 مل من PBS. الغرفة السفلية البصرية جاهزة الآن للتصوير ، لذا انتقل إلى الخطوة 2.2.
- (في حالة استخدام قسيمة غطاء) أضف 1 ميكرولتر من Syto9 (صبغة الحمض النووي الفلورية الخضراء ؛ مخففة حسب تعليمات الشركة المصنعة) في وسط البئر على شريحة متعددة الاختبارات مغلفة ب 10 آبار. هذه الأغطية المطلية لها أعماق بئر تتراوح من 23 إلى 25 ميكرومتر.
- (في حالة استخدام قسيمة غطاء) باستخدام ملقط معقم باللهب الكحولي ، قم بإزالة الغطاء بعناية من البئر واقلبها على البئر الذي يحتوي على قطرة Syto9. إن ترك الغطاء في 1 مل من PBS يجعل إزالته من البئر ويساعد على غسل الخرزات غير المرتبطة من الأغشية الحيوية.
- (في حالة استخدام قسيمة غطاء) أغلق الغطاء بعناية بطلاء الأظافر دون الانزلاق أو الضغط لأسفل على الغطاء ، مما قد يتسبب في توتر سطحي يوقف الحركة في أغشية حيوية أكثر لزوجة وأقل صلابة.
- (في حالة استخدام قسيمة غطاء) دع طلاء الأظافر حتى يجف. امسح السطح الخارجي للغطاء بعناية بنسبة 70٪ من الإيثانول. امسح دون أي ضغط على قسيمة الغطاء للأسباب المذكورة أعلاه.
- التصوير متحد البؤر
ملاحظة: في هذه الدراسات ، استخدم مجهر متحد البؤر للمسح الضوئي بالليزر للتصوير الطيفي المقلوب المجهز بنظام متحد البؤر TCS مع هدف 63x. سيتم استخدام النطاق لإنشاء فيديو 4D (الشكل 1). سيتكون الأغشية الحيوية ثلاثية الأبعاد من شرائح Z تم التقاطها في خطوات 0.5 ميكرومتر من خلال الأغشية الحيوية التي يبلغ سمكها 18-20 ميكرومتر ، وتولد 36-40 شريحة Z. سيستغرق كل فيلم حيوي ثلاثي الأبعاد 50-60 ثانية لالتقاطه. ستشكل الشرائح معا إطارا يمكن تصوره على أنه فيلم حيوي ثلاثي الأبعاد. سيتم تكرار هذه العملية 20 مرة لإنشاء فيديو الفاصل الزمني 4D لوقت تتبع إجمالي يتراوح بين 18 و 20 دقيقة.- اضبط النطاق لالتقاط الفلوروفور. في هذه الدراسات ، قم بإثارة Syto9 (تلطيخ الحمض النووي البكتيري) بليزر 488 نانومتر وقياس الانبعاث من 495 إلى 540 نانومتر (Leica Sp5 هو مجهر تصوير الطيفي). قم بإثارة الخرز القرمزي (الأحمر) بليزر 633 نانومتر وقياس الانبعاث من 650 نانومتر إلى 700 نانومتر. يمكن ضبط إعدادات الفلوروفور هذه لالتقاط أي فلوروفورات مرغوبة.
- اختر وضع التصوير xyzt.
- تحديد منطقة من الأغشية الحيوية بمزيج من المناطق ذات الكثافة العالية والمنخفضة لالتقاط الاختلافات في خصائص اللزجة المرنة في المناطق السميكة والرقيقة من الأغشية الحيوية.
- اضبط كومة Z بسمك 18-20 ميكرومتر. في الأغشية الحيوية المثبتة على الغطاء ، تجنب لمس الجزء العلوي والسفلي من الأغشية الحيوية للزجاج لتجنب القطع الأثرية التي تحبس الخرزة (يرجى الاطلاع على المناقشة).
- اضبط الكسب والإزاحة لاستخدام النطاق الديناميكي الكامل للشدة في ألمع بقعة في الأغشية الحيوية. هذا يقلل من تداخل الإشارة من الطبقات السفلية من الأغشية الحيوية.
- اضبط سمك الشريحة على 0.5 ميكرومتر. هذا يسمح بالتصوير السريع دون فقدان معلومات الخرزة.
- اضبط الدقة على 512 × 512 (0.48 ميكرومتر). يسمح هذا بالتصوير السريع ولكنه يولد صورا بدقة كافية لرؤية بنية الأغشية الحيوية وتفاصيل حركة الخرزة.
- تقليل وقت التصوير.
- اضبط لالتقاط 20 مكدسا.
- حفظ ك .lif (أو ملف متحد البؤر مشابه). يمكن إنشاء فيلم 4D في ImageJ.
3. إنشاء فيديو الفيلم الحيوي 4D باستخدام ImageJ
- افتح ملف .lif في ImageJ بالإعدادات التالية: عرض المكدس باستخدام Hyperstack ، ترتيب المكدس XYCZT ، وضع اللون: ملون ، محدد التحجيم التلقائي. ثم اضغط على موافق.
- حدد الصورة > اللون > تقسيم القنوات.
- حدد صورة > اللون > دمج القنوات > إنشاء مركب > موافق.
- حدد الإضافات > 3D viewer > Channels قم بإلغاء تحديد اللون الأزرق > موافق.
- حدد تحرير > إظهار المحتوى محددا > تحديد مربع إظهار الإحاطة.
- استخدم النقر باستمرار بالماوس لتحديد الصورة. ثم قم بتدوير الصورة مع الاستمرار في الضغط باستمرار على زر النقر. قم بتدوير الصورة بحيث يكون الجزء السفلي من الأغشية الحيوية في الأسفل وتدعم الزاوية تصور الخرز. ثم حرر الصورة.
- اضغط على زر التسجيل الأحمر في أسفل النافذة لتسجيل مقطع فيديو.
- احفظ كملف .avi باستخدام jpeg كضغط.
4. توليد بيانات المسار
- قم بتثبيت الأداة مفتوحة المصدر ImageJ (https://imagej.net/Fiji) والمكون الإضافي لتتبع الجسيمات Mosaic (https://imagej.net/MOSAICsuite).
- قم باستيراد ملف .lif الذي يحتوي على قناتين للخرز والبكتيريا. تقسيم القنوات وحفظ الملفات بشكل منفصل.
- في ImageJ، قم بتخزين حجم فوكسل الصورة (أبعاد x وy وz) وحجم الخطوة الزمنية في ملف نصي.
- في ImageJ، انتقل إلى الإضافات | فسيفساء وتشغيل Particle Tracker 2D / 3D.
- أدخل المعلمات التالية: نصف القطر: 3 ، القطع: 0.003 ، لكل / القيمة المطلقة: 0.12 ، نطاق الارتباط: 2 ، الإزاحة: 10.00 مع ضبط الديناميكيات في Brownian. يرجى الاطلاع على النتائج للأساس المنطقي وراء اختيار براونيان في هذه التجارب.
- قم بإنشاء مسارات وتصدير قائمة المسارات كملفات .csv.
5. تحليل المسارات
- تثبيت VRL Studio (https://vrl-studio.mihosoft.eu)
- قم بتنزيل مشروع Biofilm (https:// neurobox3d.github.io/Biofilm/) وتشغيله في VRL Studio
- تحميل ملف المسار في ImportData
- حدد حجم البكسل x و y و z (استخدم ImageJ لتحديد موقع هذه القيم) في ProcessTrajectories.
- حدد الفاصل الزمني للإطار في ComputeVelocity (استخدم ImageJ لتحديد موقع هذه القيمة).
- قم بتحميل ملف tiff البكتيري (انظر الخطوة 3.2) في Comdensity.
- قم بتعيين مسارات الإخراج لبيانات السرعة في SaveVelocityDataToFile وبيانات المسار في SaveTrajectoryDataToFile.
- استدعاء SaveVelocityDataToFile وSaveTrajectoryDataToFile.
- استيراد البيانات إلى Excel لتحليلها. ستشمل هذه البيانات أطوال المسار ، وعمر المسار ، وأبعاد وأحجام الصندوق المحيط بالمسار ، ومتوسط سرعات الخرزة والفروقات. يحسب التحليل المتغيرات المرجحة باستخدام قناة البكتيريا المسماة Syto9 لحساب الكثافة الخلوية المحلية (داخل المربعات المحيطة بالمسار المحدد). ينتج عن التحليل حساب متوسط السرعات والفروق المرجح بالإضافة إلى المتوسطات المرجحة والفروق في تباين المربع المحيط.
النتائج
تم استخدام هذه الطريقة لاختبار الفرضية القائلة بأن الكيرلي قد يمنح صلابة للإشريكية القولونية و S. الأغشية الحيوية Typhimurium ، مما يقلل من حركة الخرزة أثناء تجارب الفحص المجهري متحد البؤر. تم استخدام صندوق الأدوات الحالي لمقارنة الخصائص المادية للمكورات المعوية البرازية من النوع التعايشي OG1RF إلى السالمونيلا المعوية من النمط المصلي Typhimurium ، الإشريكية القولونية ، وطفرات الكيرلي متساوية الجين الخاصة بها (الشكل 1 ب والفيديو التكميلي 1 ، الفيديو التكميلي 2 ، الفيديو التكميلي 3 ، الفيديو التكميلي 4 ، الفيديو التكميلي 5 ، الفيديو التكميلي 6). يمكن أن تختلف خصائص مادة الأغشية الحيوية فيما يتعلق بالصلابة (على سبيل المثال ، الكيرلي المرتبط بالحمض النووي الإلكتروني) أو التفاعلات الكهروستاتيكية والكارهة للماء بين الخرزات سالبة الشحنة وخلايا الأغشية الحيوية ومواد المصفوفة بالإضافة إلى الكثافة الخلوية.
القابلية للتكرار
تمت برمجة صندوق أدوات Biofilm في Groovy30 و Java31 داخل VRL-Studio32 مما يتيح تصميم سير عمل معياري مع إنشاء واجهة مستخدم تلقائية (UI) لجميع المكونات الحسابية. سمح ذلك بسير عمل آلي ، وإزالة التحيز غير المقصود الناجم عن المجرب عند تحليل النتائج.
استخدام MSD لتأكيد نوع الحركة في الأغشية الحيوية
لتحليل المسارات باستخدام Particle Tracker 2D / 3D ، تتوفر إعدادات ديناميكية مختلفة لتحليل أنواع مختلفة من حركة الخرز. بالنسبة لهذه الدراسات ، تم اختيار إعداد "الحركة البراونية" (أي الحركة التي تحركها الانتشار) لأن بكتريا البرازية هي بكتيريا غير متحركة ، والإشريكية القولونية والسالمونيلا لا تعبر عن السوط في الأغشية الحيوية ، وتم إجراء التجارب في نظام مغلق في غياب التدفق. يمكن التحقق من صحة هذا الإعداد بشكل أكبر من خلال متوسط الإزاحة المربعة المحسوبة (MSD) للخرز. باستخدام التعريف 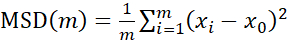 حيث m هو عدد مقاطع المسار ، يمكن حساب تغيير MSD على مدار كل مسار. تشير المسارات الخطية إلى حركة الخرزة المنتشرة (الشكل 2 أ). باستخدام تركيب المربعات الصغرى التربيعية ، تم حساب متوسط نمط الحركة لجميع الخرزات في الأغشية الحيوية ، مما يدل على الترتيب الخطي السائد والتحقق من صحة الانتشار السلبي كقوة دافعة (الشكل 2A-2F).
حيث m هو عدد مقاطع المسار ، يمكن حساب تغيير MSD على مدار كل مسار. تشير المسارات الخطية إلى حركة الخرزة المنتشرة (الشكل 2 أ). باستخدام تركيب المربعات الصغرى التربيعية ، تم حساب متوسط نمط الحركة لجميع الخرزات في الأغشية الحيوية ، مما يدل على الترتيب الخطي السائد والتحقق من صحة الانتشار السلبي كقوة دافعة (الشكل 2A-2F).
تحليل المربع المحيط.
يستخدم صندوق الأدوات ImageJ Mosaic و Particle Tracker 2D / 3D لإنشاء مسارات (الخطوة 4) ثم باستخدام خط أنابيب تحليل الأغشية الحيوية الآلي ، يولد بيانات مهمة حول مسارات الخرزة التي يمكن استخدامها لمقارنة خصائص مادة الأغشية الحيوية. تم قياس حجم الصندوق المحيط بالميكرومتر3 عن طريق إنشاء الصندوق الأدنى الذي يحتوي على مسار وقياس حجمه (الشكل 3).
E. البرازي الأغشية الحيوية لها حركة حبة أكثر بقيم مربع محيط من 1-6000 ميكرومتر3 (الشكل 3B و 3C و 3D). تؤكد النتائج أن الحركة التي شوهدت في غطاء زجاجي مثبت على شريحة مطلية ببئر مطلي بحوالي 25 ميكرومتر (الشكل 3C) مقابل الأغشية الحيوية المزروعة في قاع الآبار الزجاجية البصرية والمصورة مباشرة (الشكل 3D) تعطي نتائج مكافئة مع اختلافات قليلة. كان الاختلاف الوحيد هو أنه بالقرب من الجزء العلوي من الغطاء المركب ل E. faecalis الأغشية الحيوية المسارات المستقرة التي يزيد عمرها عن 10 دقائق ولكن في نفس الوقت يمكن تسجيل الصناديق المحيطة الصغيرة ، بينما في اللوحة السفلية البصرية يمكن تسجيل عدد محدد من الخرزات ذات الحركة الأعلى. مجتمعة ، يشير هذا إلى أن تركيب الشريحة الزجاجية ربما يكون قد غير التوتر السطحي للنظام في الجزء العلوي من الأغشية الحيوية مقابل الشريحة في الأغشية الحيوية المثبتة ، مما قلل في النهاية من حركة بعض الخرزات في مناطق الأغشية الحيوية الأقل لزوجة (الشكل 3B و 3C و 3D و 3I). تصادف أن المسارات التي تندرج في هذه الفئة كانت نسبة صغيرة جدا ، وحتى مع هذا العدد الصغير من الخرز المحاصر ، فإن متوسط MSD ل E. faecalis على غطاء مركب كان أعلى قليلا من MSD المحسوب من غشاء حيوي للوحة سفلية بصرية (الشكل 3).
س. التيفيموريوم والإشريكية القولونية كان لمسارات حبة الإشريكية أحجام أصغر من 0-10 ميكرومتر3 (الشكل 3A و 3B و 3E و 3F) ، مقارنة بطفرات الcurli متساوية الجين مع الصناديق المحيطة من 1-6000 ميكرومتر3 للإشريكية القولونية و 1-5000 ميكرومتر3 ل S. Typhimurium (الشكل 3A و 3B و 3F و 3H) ، مما يدل على حركة حبة أكبر. أشارت هذه النتائج إلى أن وجود الأميلويد يرتبط بزيادة الصلابة في الأغشية الحيوية وكان متسقا مع عدم وجود حركة غشاء حيوي ملحوظة في مقاطع الفيديو. كانت أحجام الصندوق المحيط صغيرة باستمرار (0-10 ميكرومتر3) حتى في المناطق منخفضة الكثافة من الأغشية الحيوية. تتوافق هذه الملاحظة مع الملاحظات السابقة التي تفيد بأن الكيرلي يمكن أن يكون موجودا في مناطق منخفضة الكثافة الخلوية في الأغشيةالحيوية 10.
لم يكن من الممكن مقارنة سلوك الأغشية الحيوية Enterobacteriaceae على الألواح السفلية البصرية لأنها تنمو على شكل pellicles على واجهة الهواء والسائل (الخطوة 1.2.2). عند استخدام الغطاء ، يتم توصيل الغطاء بغطاء الواجهة وعندما تمت إزالة الغطاء ، تم وضع الغطاء على الغطاء مما أدى إلى إنشاء سطح صورة واحد. في صفيحة سفلية بصرية نمت بشكل مائل ، تم التصوير بسائل لا يزال في البئر. هذا يعني أن البليكل لا يزال يطفو فوق القاع البصري ويجعل البليكل يخرج من عمق العمل لمنظار مقلوب مثل Leica Sp5. تسببت إزالة وسيط كاف لإحضار الأغشية الحيوية إلى عمق عمل المجهر في جفاف العينة خلال عملية التصوير التي استمرت 20 دقيقة.
بشكل عام ، تؤكد المؤامرات الملاحظات المرئية في الأفلام التكميلية وتتوافق مع اختلافات MSD التي لوحظت (الشكل 3I و 3J).
عمر المسار
تم قياس عمر المسار كعدد الإطارات المتتالية التي تم فيها تسجيل الخرزة (الشكل 3).
في الأغشية الحيوية الأكثر لزوجة وشبيهة بالسوائل بكتريا برازية ، كان لجميع الخرزات عمر مسار أقصر من 10 دقائق وتراوحت غالبية المسارات بين 2-5 دقائق للإشريكية البرازية الأغشية الحيوية. ومع ذلك ، يمكن تحديد موقع الخرزات ذات العمر القصير المسجل عن طريق الفحص البصري في بكتريا براوسيا البرازية الأغشية الحيوية خلال النافذة الزمنية الإجمالية للتصوير (الفيديو التكميلي 1 و 2). وبالتالي ، من الممكن أن تتحرك الخرزات على طول مسار مسجل ، وتنفصل بشكل متقطع عن الأغشية الحيوية وتنهي مسارا ، وتعيد الارتباط بالأغشية الحيوية ، وعند هذه النقطة يبدأ مسار جديد. سيؤدي هذا في النهاية إلى عمر قصير في ظل الوجود المستمر للخرز في الأغشية الحيوية. من المهم ملاحظة أنه باستخدام هذه التقنية ، يميل عمر المسار ، خاصة في الأغشية الحيوية اللزجة ، إلى التقليل من إجمالي الوقت الذي ترتبط فيه الخرزة بالأغشية الحيوية.
في S. الأغشية الحيوية Typhimurium ، التي تحتوي على أحجام صندوق محيط أصغر ، كان لغالبية الخرزات (حوالي 80٪) عمر مسار طويل يتراوح بين 16 و 20 إطارا ، وهو ما يعادل ما يقرب من 15-20 دقيقة في الوقت الفعلي (الشكل 3A و 3G و 3H). على عكس ذلك ، حملت الأغشية الحيوية المتحولة المتساوية الجين Curli المزيد من الخرز المتنقل بأحجام صندوق محيطة تتراوح بين 1-6000 ميكرومتر3 (بكتريا قولونية) و 1-5000 ميكرومتر3 (S. تيفيموريوم) (الشكل 3 أ ، 3 ب ، 3 و و 3 ح). على عكس E. faecalis الأغشية الحيوية ذات المسارات >70٪ التي تحتوي على أحجام صندوق محيطة أكبر من 10 ميكرومتر3 ، ومع ذلك ، سجلت الأغشية الحيوية لأنواع Enterobacteriaceae 30٪ فقط مسارات حبة مع أحجام صندوق محيطة أعلى من 10 ميكرومتر3. على الرغم من أن العمر الإجمالي لمسار الخرزة كان أصغر في الأغشية الحيوية المتحولة للكلف ، إلا أن بعض المسارات عكست حركة حبة كبيرة وعمر مسار طويل (الشكل 3H). يمكن أن تشير هذه الملاحظة إلى أن هذا التباين قد يتوافق مع خصائص مادة الأغشية الحيوية المختلفة ، مثل مرونة اللزوجة و / أو تغيرات كيمياء سطح الجسيمات مثل الشحنة.
تحليل أطوال مسار الخرزة وسرعاتها
طول المسار هو قياس المسافة التي تقطعها الخرزات بالميكرومتر. يتوافق هذا القياس مع سرعة حركة الخرزة بالميكرومتر / ثانية. بما يتفق مع أحجام الصندوق المحيط الأكبر ، فإن الخرزات في E. faecalis الأغشية الحيوية لها مسارات أطول بمقدار 10 أضعاف ، 5-20 ميكرومتر ، مقابل <4 ميكرومتر في الأغشية الحيوية التي تحتوي على كيرلي. بما يتفق مع المسارات الأقصر (الشكل 4 أ). بكتريا البرازية تم قياس حبات ما يصل إلى 15 مرة سرعات أعلى مع غالبية الخرزات لها سرعات في حدود 0.01-0.15 ميكرومتر / ثانية مقابل سرعات <0.006 ميكرومتر / ثانية (الشكل 4 ب). ومع ذلك ، قامت الأغشية الحيوية المتحولة الكريري بقياس السرعات المنخفضة بشكل عام والمسارات الأقصر مقارنة ب E. faecalis الأغشية الحيوية ، ولكن مسارات أطول وسرعات أعلى من السلالات الأبوية التي تحتوي على الكيرلي (الشكل 4 أ و 4 ب).
وتجدر الإشارة إلى حقيقة أن الهيكل الشبيه بالشبكة الليفية ل curli30 قد يؤثر على الحركة بطريقة متباينة الخواص ، مما يقلل من الحركة في المستوى xy ويسمح بزيادة الحركة في الاتجاه z (الشكل 2G). سيكون تجمع المسار الكبير (حوالي 800) الذي ينتمي إلى ما يقرب من 50 خرزة فريدة في أغشية حيوية تحتوي على كيرلي متسقا مع قيود تتبع جسيمات الفسيفساء ، مع احتساب كل واحدة من هذه الخرزات سريعة الحركة كحبة واحدة في x و y و z. سيكون من الضروري إجراء مزيد من البحث وتطوير البرمجيات لتأكيد هذه الملاحظة.
تحليل اعتماد حركة الخرزة على الكثافة الخلوية
تم تحديد اعتماد حركة الخرزة على الكثافة الخلوية باستخدام متوسط السرعات والفروق المرجحة ، بالإضافة إلى المتوسطات / المتوسطات المرجحة والفروق في أحجام الصندوق المحيط. تم استخدام قناة التصوير الثانية للبكتيريا المسماة Syto9 لحساب الكثافة الخلوية المحلية في حساب السرعات المرجحة. تم حساب الكثافة الخلوية عن طريق حساب متوسط بيانات Syto9 voxel عبر المربع المحيط لكل حافة مسار (الشكل 5 ، على اليمين). وبالتالي ، يمكن ترجيح سرعة الخرزة من خلال كثافة الخلايا (المحلية) على الحافة هناك أنواع متعددة من البقع التي يمكن استخدامها لتصور البكتيريا بما في ذلك بقع جدار الخلية والأغشية ومحتوى الحمض النووي. لتحديد الكثافة الخلوية ، تم اختيار Syto9 لأنه يعطي الإشارة الأكثر اتساقا بغض النظر عن شريحة Z البصرية التي يتم تصورها. ستعطي بقع المغلف (جدار الخلية والغشاء) إشارة مختلفة اعتمادا على موضع شريحة Z. إذا كانت شريحة Z تتضمن الجزء العلوي أو السفلي من الخلية ، فستكون الإشارة أقوى مما لو كانت شريحة Z عبر منتصف الخلية حيث يتم تلطيخ مخطط الخلية فقط.
تم تتبع مسارات الخرزة من القناة الحمراء ل 20 إطارا ، حيث كان عمر المسارات الفردية لا يقل عن إطارين وحد أقصى 20 إطارا مع 19 قطعة مسار تربط الإطارات (الشكل 5). لدراسة اعتماد كثافة الخلايا لحركة الخرزة ، تم تحديد شدة GFP لكل فوكسل (كل من القياسات الفردية في صورة فوكسل 512 × 512). تم حساب كثافة الخلية حول كل جزء من مسار الخرزة على أنها متوسط الكثافة محليا في المربع المحيط بالمقطع.
بالنسبة لبعض الأغشية الحيوية ، يمكن توثيق اعتماد الكثافة ذي الدلالة الإحصائية (الشكل 6) ، وأبرزها E . البرازي الأغشية الحيوية التي نمت على غطاء زجاجي وقلبها على شريحة متعددة الآبار (الشكل 6 أ). على العكس من ذلك ، فإن E. faecalis الأغشية الحيوية التي نمت في قاع صفيحة بئر 96 (الشكل 6 ب) لم تظهر أي اعتماد على الكثافة. في الختام ، يشير هذا إلى أن الأغشية الحيوية عالية السوائل E. faecalis يمكن ضغطها قليلا بسبب التركيب على شريحة متعددة الآبار ، وهو ما يتوافق مع انخفاض عدد الخرزات التي تتحرك بسرعة أكبر وتلك ذات أحجام الصندوق المحيط الصغيرة المحاصرة في الجزء العلوي من الأغشية الحيوية مقابل الشريحة الزجاجية (الشكل 3C مقابل الشكل 3D). أظهرت كل من السالمونيلا والإشريكية القولونية الأغشية الحيوية (الشكل 6C و 6D) وطفراتها المتساوية الوراثية (الشكل 6E و 6F) اعتمادا طفيفا أو معدوما على الكثافة الخلوية.
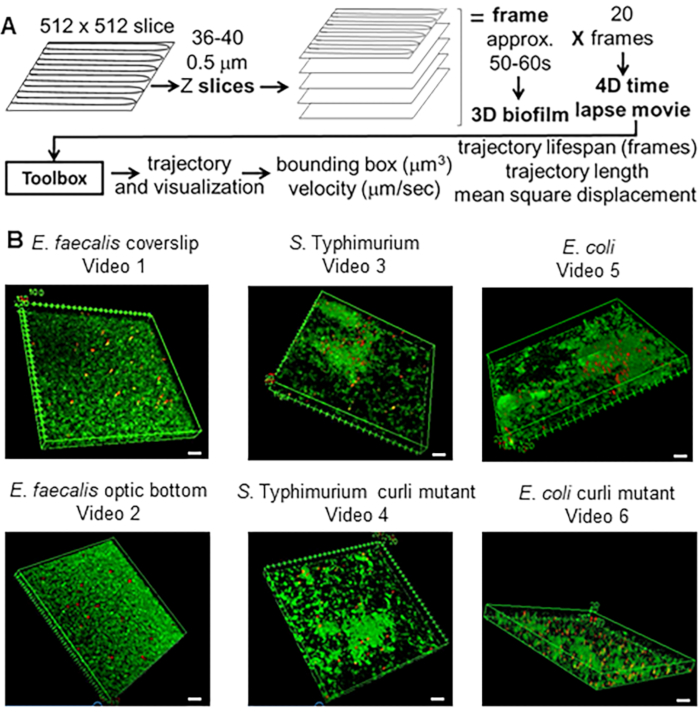
الشكل 1. خط أنابيب التصوير والتحليل (الخطوات 2-4) (أ) يتم تصوير الأغشية الحيوية كما هو موضح في 2.2. باستخدام الأغشية الحيوية المصورة (انظر 3) ، تم إنشاء مسارات الخرز كما هو موضح في 4. باستخدام المسارات ، تم حساب البيانات ذات الصلة باستخدام صندوق أدوات التحليل (انظر 5) (ب) نمت الأغشية الحيوية كما هو موضح في الخطوة 1 على الغطاء (E. faecalis ، فيديو 1) ، S. Typhimurium (فيديو 3) ، بكتريا قولونية (فيديو 5) وطفرات الكيرلي متساوية الجين (فيديو 4 ، فيديو 6) أو في صفيحة بصرية ذات 96 بئرا (E. faecalis bottom ، فيديو 2). شريط المقياس الأبيض 20 مم. هذا الشكل مستنسخ بإذن من (31). الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
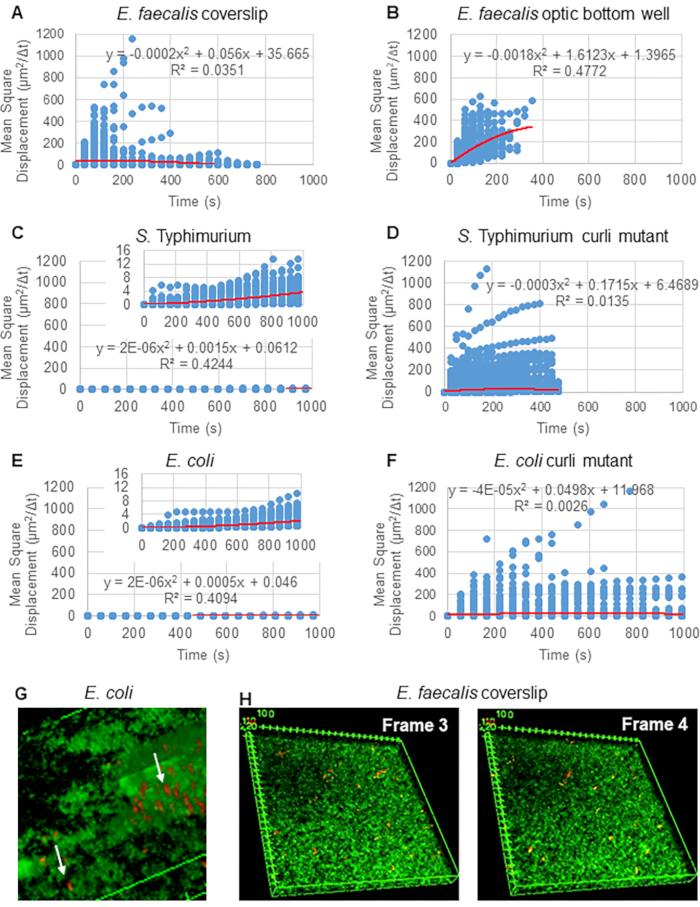
الشكل 2. تم تحديد حركة الخرزة في الأغشية الحيوية لتكون منتشرة بطبيعتها (الحركة البراونية ، انظر الخطوة 5) (A-F) تظهر بيانات MSD السلوك الخطي (الخط الأحمر) للتحقق من صحة الحركة البراونية. نمت الأغشية الحيوية وفقا للخطوة 1 (G) مثال على حركة الخرزة الإهليلجية التي لوحظت في بكتريا قولونية و S. الأغشية الحيوية Typhimurium المأخوذة من إطار واحد من بكتريا قولونية 4D مقايسة الأغشية الحيوية (H) مثال على التغييرات الكبيرة في أنماط الخرزة بين الإطار 3 و 4 مأخوذة من بكتريا براستية براز البصري قاع البئر. لاحظ أن الأغشية الحيوية نفسها تثير بعض التدفق (الفيديو 1 و 2) ، مما يجعل الأمر يبدو أن الإطارين 3 و 4 موجهان بشكل مختلف. هذا الشكل مستنسخ بإذن من (31). الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
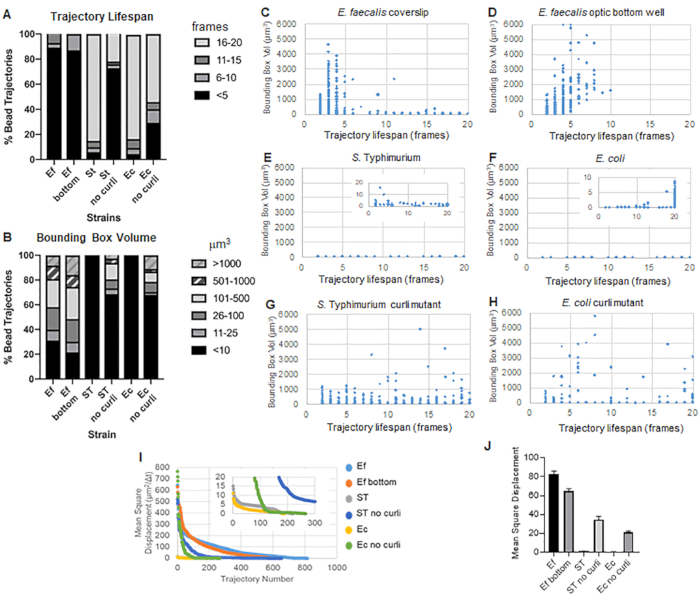
الشكل 3. تحليل الاختلافات في الصلابة باستخدام المربعات المحيطة وعمر المسار. نمت الأغشية الحيوية كما هو موضح في الخطوة 1 على الغلافة (E. faecalis ، فيديو 1) ، S. Typhimurium (فيديو 3) ، بكتريا قولونية (فيديو 5) وطفرات الكيرلي متساوية الجين (فيديو 4 ، فيديو 6) أو في صفيحة بصرية ذات 96 بئرا (E. faecalis bottom ، فيديو 2). يتم تقديم عمر المسار في ٪ من إجمالي مسارات الخرزة (A) والرسوم البيانية المبعثرة (C-H) ، جنبا إلى جنب مع أحجام الصندوق المحيط (المحسوبة في الخطوة 5) (I) مقارنة بين MSDs الخرزة في الأغشية الحيوية المختلفة (H) متوسط MSDs لكل نوع من أنواع الأغشية الحيوية. تشير الأشرطة إلى فاصل الثقة بنسبة 95٪ للبيانات. هذا الشكل مستنسخ بإذن من (31). الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
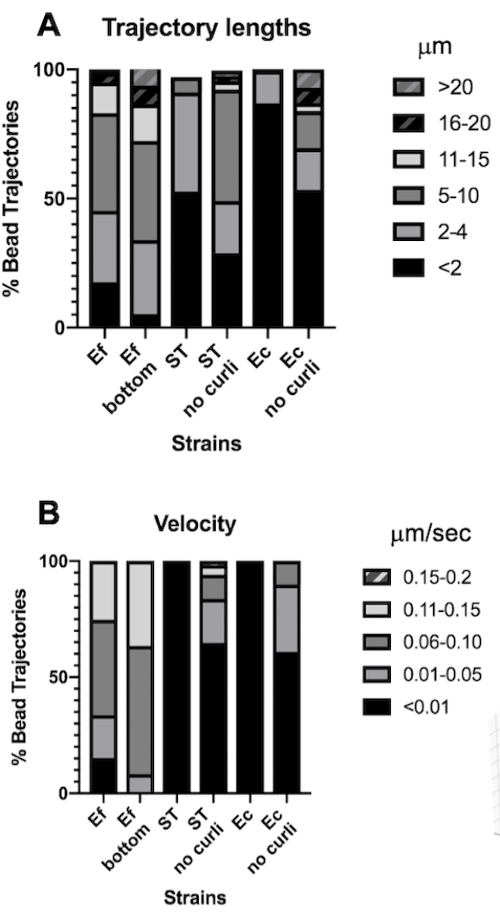
الشكل 4. تحليل الاختلافات في طول المسار وسرعة الخرزة. نمت الأغشية الحيوية كما هو موضح في الخطوة 1. تظهر أطوال المسار بالميكرومتر ويتم تقديمها كنسبة مئوية من إجمالي مسارات الخرزة (A). تظهر السرعة بالميكرومتر / ثانية ويتم تقديمها كنسبة مئوية من إجمالي مسارات الخرزة (B). تم تكييف هذا الرقم بإذن من (31). الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
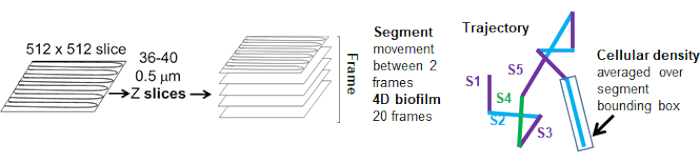
الشكل 5. مخطط تحليل مقطع المسار. تم تكييف هذا الرقم بإذن من (31). الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
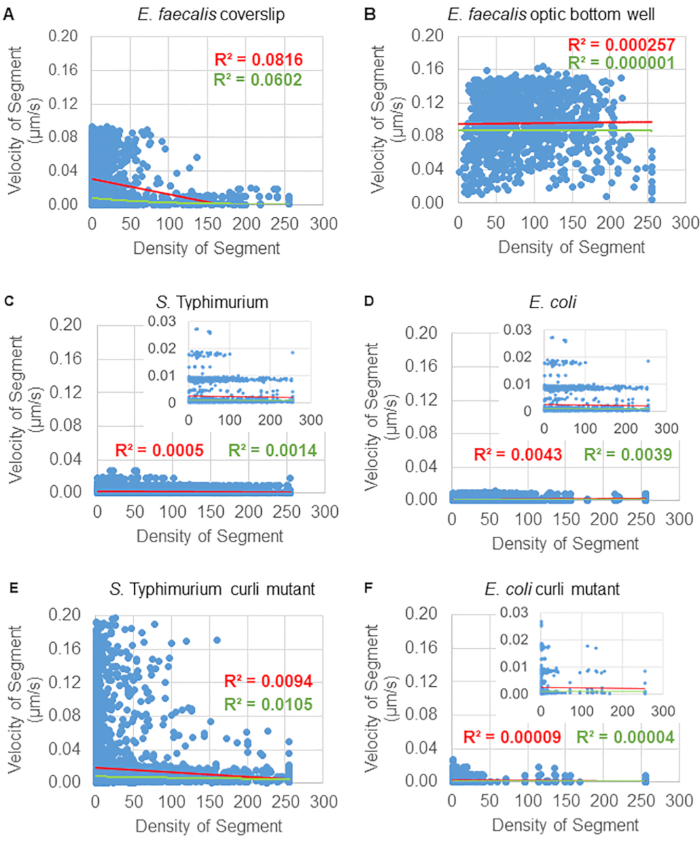
الشكل 6. دراسة تأثير كثافة الأغشية الحيوية على سرعة الخرزة باستخدام خط أنابيب تحليل الأغشية الحيوية (الخطوة 5). أشارت النتائج إلى أن سرعة الخرزة لا تعتمد حصريا على كثافة الخلية. نمت الأغشية الحيوية كما هو موضح في الخطوة 1. تم تحليل المسارات على مقياس مقاطع المسار الفردية (الشكل 5). لكل جزء ، تم رسم سرعة الخرزة بالميكرومتر / ثانية مقابل الكثافة الخلوية للصندوق المحيط (متوسط GFP لكل فوكسل داخل المربع المحيط). يظهر الخط الأحمر الانحدار الخطي ، والخط الأخضر تتبع الانحدار الأسي. هذا الشكل مستنسخ بإذن من (31). الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
فيديو تكميلي 1. فيديو 4D للغشاء الحيوي E. faecalis OG1RF على مدار 24 ساعة نمت على غطاء زجاجي بصري بسمك 1.5. تم إنشاء فيديو الفاصل الزمني 4D باستخدام مجهر بدقة 512 × 512. تم إنشاء سلسلة Z المكونة من 40 صورة عن طريق تصوير منطقة بسمك 20 ميكرومتر تقريبا من الأغشية الحيوية في خطوات 0.5 ميكرومتر. كانت كل سلسلة Z عبارة عن إطار واحد وتطلبت 50-60 ثانية لالتقاطها. تم التقاط سلسلة من 20 إطارا متجاورا لإنتاج فيديو 4D. تشغيل الفيديو بمعدل 120x تقريبا. يمثل الفيديو ما لا يقل عن 6 تجارب مستقلة. الرجاء النقر هنا لتنزيل هذا الفيديو.
فيديو تكميلي 2. فيديو 4D لغشاء حيوي E. faecalis OG1RF لمدة 24 ساعة ينمو على صفيحة سفلية بصرية ذات 96 بئرا. تم إنشاء فيديو الفاصل الزمني 4D باستخدام مجهر بدقة 512 × 512. تم إنشاء سلسلة Z المكونة من 40 صورة عن طريق تصوير منطقة بسمك 20 ميكرومتر تقريبا من الأغشية الحيوية في خطوات 0.5 ميكرومتر. كانت كل سلسلة Z عبارة عن إطار واحد وتطلبت 50-60 ثانية لالتقاطها. تم التقاط سلسلة من 20 إطارا متجاورا لإنتاج فيديو 4D. تشغيل الفيديو بمعدل 120x تقريبا. يمثل الفيديو 3 تجارب مستقلة.الرجاء الضغط هنا لتنزيل هذا فيديو.
فيديو تكميلي 3. فيديو رباعي الأبعاد للنمط المصلي من السالمونيلا المعوية Typhimurium biofilm ATCC 14028 الذي نما على 1.5 غطاء زجاجي بصري سميك لمدة 6-7 أيام. تم إنشاء فيديو الفاصل الزمني 4D باستخدام مجهر بدقة 512 × 512. تم إنشاء سلسلة Z المكونة من 40 صورة عن طريق تصوير منطقة بسمك 20 ميكرومتر تقريبا من الأغشية الحيوية في خطوات 0.5 ميكرومتر. كانت كل سلسلة Z عبارة عن إطار واحد وتطلبت 50-60 ثانية لالتقاطها. تم التقاط سلسلة من 20 إطارا متجاورا لإنتاج فيديو 4D. تشغيل الفيديو بمعدل 120x تقريبا. يمثل الفيديو 3 تجارب مستقلة.الرجاء الضغط هنا لتنزيل هذا فيديو.
فيديو تكميلي 4. فيديو 4D من النمط المصلي للسالمونيلا المعوية النمط المصلي التيفيموريوم تم نمت متحولة ATCC 14028 curli (csgBA) على 1.5 أغطية زجاجية بصرية سميكة لمدة 6-7 أيام. تم إنشاء فيديو الفاصل الزمني 4D باستخدام مجهر بدقة 512 × 512. تم إنشاء سلسلة Z المكونة من 40 صورة عن طريق تصوير منطقة بسمك 20 ميكرومتر تقريبا من الأغشية الحيوية في خطوات 0.5 ميكرومتر. كانت كل سلسلة Z عبارة عن إطار واحد وتطلبت 50-60 ثانية لالتقاطها. تم التقاط سلسلة من 20 إطارا متجاورا لإنتاج فيديو 4D. تشغيل الفيديو بمعدل 120x تقريبا. يمثل الفيديو 3 تجارب مستقلة.الرجاء الضغط هنا لتنزيل هذا فيديو.
فيديو تكميلي 5. فيديو 4D للإشريكية القولونية UTI89 ينمو على 1.5 غطاء زجاجي بصري سميك لمدة 6-7 أيام. تم إنشاء فيديو الفاصل الزمني 4D باستخدام مجهر بدقة 512 × 512. تم إنشاء سلسلة Z المكونة من 40 صورة عن طريق تصوير منطقة بسمك 20 ميكرومتر تقريبا من الأغشية الحيوية في خطوات 0.5 ميكرومتر. كانت كل سلسلة Z عبارة عن إطار واحد وتطلبت 50-60 ثانية لالتقاطها. تم التقاط سلسلة من 20 إطارا متجاورا لإنتاج فيديو 4D. تشغيل الفيديو بمعدل 120x تقريبا. يمثل الفيديو 3 تجارب مستقلة.الرجاء الضغط هنا لتنزيل هذا فيديو.
فيديو تكميلي 6. فيديو 4D E. coli UTI89 curli (csgBA) متحولة نمت على 1.5 غطاء زجاجي بصري سميك لمدة 6-7 أيام. تم إنشاء فيديو الفاصل الزمني 4D باستخدام مجهر بدقة 512 × 512. تم إنشاء سلسلة Z المكونة من 40 صورة عن طريق تصوير منطقة بسمك 20 ميكرومتر تقريبا من الأغشية الحيوية في خطوات 0.5 ميكرومتر. كانت كل سلسلة Z عبارة عن إطار واحد وتطلبت 50-60 ثانية لالتقاطها. تم التقاط سلسلة من 20 إطارا متجاورا لإنتاج فيديو 4D. تشغيل الفيديو بمعدل 120x تقريبا. يمثل الفيديو 3 تجارب مستقلة.الرجاء الضغط هنا لتنزيل هذا فيديو.
Discussion
الخطوات الهامة واستكشاف الأخطاء وإصلاحها
يتمثل التحدي الأكبر لهذه التقنية في استخدام غطاء مثبت مع غشاء حيوي لزج للغاية مثل E. faecalis. يجب وضع الغطاء بعناية ودقة على شريحة الآبار المتعددة دون تغيير موضعها. أثناء خطوة الختم ، يجب توخي الحذر لمنع الضغط على الغطاء لأسفل أو دفعه / انزلاقه عن طريق الخطأ عبر سطح الشريحة. قد تؤدي أي حركة أو ضغط إلى توتر سطحي ومنع حركة الأغشية الحيوية اللزجة. إذا كان ذلك ممكنا ، فإن مقارنة خصائص مادة الأغشية الحيوية عن طريق تصوير غشاء حيوي على قاع بصري بئر بحامل غطاء سيسمح بتقييم التقنية. عند إجراؤه بشكل صحيح ، يشبه حامل الغطاء إلى حد كبير الأغشية الحيوية في لوحة سفلية بصرية ل E. faecalis.
بالإضافة إلى ذلك ، عند استخدام غطاء مثبت ، يجب تجنب تصوير واجهات الأغشية الحيوية مع الغطاء في الأسفل أو الشريحة في الأعلى. عند استخدام منظار مقلوب ، مع وجود غطاء في الأسفل ، يمكن أن يكون هناك حبات محاصرة في قاعدة الأغشية الحيوية مقابل الغطاء. تمر هذه الخرزات عبر الأغشية الحيوية وتصبح محاصرة ضد الغطاء حتى بعد الغسيل اللطيف. لديهم إحداثيات x و y و z 0 وإحداثيات المربع المحيط 0. ومع ذلك ، بالنسبة لتطبيقات معينة ، مثل فحص سلامة الأغشية الحيوية بعد العلاج ، يمكن استخدام نقاط البيانات هذه كأداة. يمكن استخدام قدرة الخرز على اختراق منطقة سميكة من الأغشية الحيوية إلى أسفل الغطاء لتقييم سلامة الأغشية الحيوية بعد العلاج (المخطوطة قيد التحضير بالتعاون مع مختبر Tükel). في الجزء العلوي من الأغشية الحيوية ، في فيلم حيوي لزج مثل E. faecalis كان لدينا بعض الأدلة على الضغط الذي يفرضه الغطاء. أدى هذا إلى الحد من حركة بعض الخرزات في واجهة الشريحة الزجاجية وربما يكون قد أدخل بعض الاعتماد على الكثافة لتحليل حركة الخرزة.
كانت خطوات الغسيل ضرورية للأغشية الحيوية لأن وسط النمو له مضان ذاتي قوي في القناة الخضراء. نختار استخدام الخرز الزائد وإزالة الخرز غير المرتبط عن طريق الغسيل لتعظيم الخرز المرتبط للحصول على التوصيف الأكثر دقة للمناطق المرصودة.
يجب تحديد عدد الخرزات والغسلات اللازمة للحصول على مجموعات البيانات المطلوبة تجريبيا. يؤدي وجود عدد كبير جدا من الخرزات في الأغشية الحيوية إلى إنشاء مجموعات بيانات كبيرة بشكل مستحيل يصعب تحليلها. لا يؤدي وجود عدد قليل جدا من الخرز إلى أخذ عينات شاملة من بيئات الأغشية الحيوية. ومع ذلك ، فإن التحكم في عدد الخرزات المضافة (2 × 107 حبات في 1 مل من PBS) واستخدام خطوات الغسيل ، أدى إلى عدد ثابت نسبيا من الخرزات (40-140) مرتبطة بالأغشية الحيوية اعتمادا على هيكلها وترتيبها المكاني وتكوينها.
عند دراسة الأغشية الحيوية ذات المناطق اللزجة والصلبة المختلطة ، يمكن أن تصبح الخرزات محاصرة في المناطق الصلبة بمرور الوقت. في هذه الحالة ، يجب أن يبدأ التصوير فور إضافة الخرز. غالبا ما لا يمكن تحقيق ذلك باستخدام أغطية ولكنه يتطلب لوحات سفلية بصرية أو خلايا تدفق حيث يمكن إجراء التصوير فور إضافة الخرز وخطوة (خطوبات) الغسيل.
التعديلات والتطبيقات المستقبلية
استخدام أجهزة الموائع الدقيقة. في دراساتنا ، تطلبت الظروف المثلى التي تم وضعها لدراسة الأغشية الحيوية Enterobacteriaceae نمو الأغشية الحيوية كبثوة في واجهة الهواء والسائل. هذا حد من استخدام الألواح السفلية البصرية وأجهزة الموائع الدقيقة في الدراسات. ومع ذلك ، عندما تسمح ظروف تكوين الأغشية الحيوية ، يمكن زراعة الأغشية الحيوية في غرف الموائع الدقيقة أو خلايا التدفق. يمكن بعد ذلك غسل الأغشية الحيوية ، وإدخال الخرز من خلال جهاز الموائع الدقيقة مع الحد الأدنى من اضطراب الأغشية الحيوية.
إضافة الخرز أثناء نمو الأغشية الحيوية. اخترنا إضافة حبات زائدة إلى الأغشية الحيوية ، ثم إزالة الخرزات غير المرتبطة عن طريق الغسيل اللطيف لتحسين عدد الخرزات الموجودة أثناء التحليل. في الأغشية الحيوية اللزجة بكتريا البرازية ، من الممكن أن تكون الخرزات منفصلة وإعادة ربطها خلال وقت التصوير البالغ 20 دقيقة. إذا تمت إضافة عدد قليل من الخرزات في أوقات مختلفة أثناء نمو الأغشية الحيوية ، فقد يكون من الممكن حبس الخرزات في الأغشية الحيوية ، مما يسمح بتوصيف أكثر دقة لحركة الأغشية الحيوية في الأغشية الحيوية الأكثر لزوجة.
اختيار المنطقة المراد تصويرها. للدراسات حول خصائص المواد ، من الأفضل اختيار مناطق سميكة ورقيقة من الأغشية الحيوية. ومع ذلك ، عند دراسة التغيرات في الخصائص المادية للأغشية الحيوية المعالجة ، يمكن تصوير مناطق التقاء سميكة لتحديد التغيرات في الخصائص اللزجة المرنة وتغلغل الخرزة في تلك المناطق. في هذه الحالة ، يعد البحث عن الخرزات التي اخترقت الأغشية الحيوية وانتهى بها الأمر محاصرة ضد الغطاء مقياسا مفيدا لاضطراب الأغشية الحيوية.
التصوير تحت التدفق. باستخدام خلايا تدفق الزجاج البصري أو أجهزة الموائع الدقيقة ، يمكن تصوير حركة الخرز أو البكتيريا في الأغشية الحيوية تحت التدفق. يمكن القيام بذلك بطرق مختلفة. يمكن القيام بذلك عن طريق حقن الخرز في الغرفة بأكملها متبوعا بحضانة قصيرة للسماح بربط الخرزات بالأغشية الحيوية. يمكن إزالة الخرزات غير المرتبطة عن طريق الغسيل وتصوير الأغشية الحيوية مع أو بدون تدفق. على العكس من ذلك ، يمكن إدخال عدد صغير من الخرزات في جانب واحد من الغرفة ويمكن تتبع حركتها من خلال الأغشية الحيوية وداخلها تحت التدفق. عند استخدام التدفق ، يجب توخي الحذر في اختيار إعدادات تتبع حبة الفسيفساء (الخطوة 4.5). في الدراسات الحالية ، كان إعداد الديناميكيات براونيان. أكدت حسابات MSD أن الحركة من المحتمل أن تكون منتشرة ، مما يجعل البراونيان هو الإعداد المناسب.
تلطيخ المصفوفة. في الدراسات الحالية ، يفحص التلوين باستخدام Syto9 الكثافة الخلوية وليس كثافة بنية الأغشية الحيوية. على سبيل المثال ، من المحتمل أن يؤدي وجود الأميلويد إلى زيادة كثافة مادة المصفوفة للأغشية الحيوية. يمكن تحديد اعتماد الحركة على كثافة الأميلويد باستخدام بقع مصفوفة الفلورسنت بدلا من Syto9.
البكتيريا المصنفة بالفلورسنت. يمكن استخدام البكتيريا المصنفة بالفلورسنت لتتبع حركة البكتيريا الخارجية من خلال الأغشية الحيوية (مثل البكتيريا المحتوية على البلازميد). يتمثل التحدي مع البكتيريا ذات العلامات الفلورية ، مثل المكورات المعوية ، في أنها تشكل سلاسل مفردة ، ومكورات ثنائية ، وسلاسل قصيرة ، مما يعقد القدرة على تتبع البكتيريا بدقة. ستكون هذه العملية أسهل إذا كان للبكتيريا مورفولوجيا أحادية الخلية.
القيود
القيود في تصور المسار والخياطة.
أحد قيود الطريقة هو تصور المسار والخياطة. تتكون المسارات المعاد بناؤها وتحليلها من إحداثيات النقاط x و y و z ، حيث تحدد النقاط اللاحقة المسار الخطي بين هذه النقاط. يمكن تحقيق تصور مثل هذه المسارات الخطية المجزأة بواسطة أدوات مختلفة. كان أحد الطرق هو استخدام دفاتر ملاحظات Python و Jupyter جنبا إلى جنب مع مكونات Python الإضافية و Pandas و Matplotlib. في حين أنه كان من الممكن تصور المسارات الفردية الموجودة في مقالة مجلة علم الجراثيم حيث تم نشر هذه التقنية في الأصل34 ، لا تزال هناك قيود كبيرة يتم تناولها في الأبحاث المستقبلية.
حاليا ، عدد المسارات المعاد بناؤها أكبر من عدد الخرزات في الأغشية الحيوية ، مما يعني أن المسارات المتعددة قد تتوافق مع حبة واحدة. يمكن أن يحدث هذا بسبب إشارة متحد البؤر ضعيفة في إطار واحد حيث ستنهي الفسيفساء مسارا وتبدأ في إطار ثان. قد يتم تسجيل هذا كمسارات أقصر متعددة لحرزة واحدة ، خاصة في الأغشية الحيوية الأقل لزوجة. سبب آخر للعدد الكبير من المسارات هو عدم وجود خياطة المسار. خاصة في E. faecalis البصري الأغشية الحيوية للبئر السفلي ، تظل الخرزات مرتبطة بصريا بالأغشية الحيوية أثناء التصوير (الفيديو التكميلي 2). ومع ذلك ، لم تكن هناك مسارات أطول من 10 وأكثر من 90٪ من المسارات كان عمرها 5 إطارات أو أقل (الشكل 3 د). إذا تم استخدام البرنامج لتحليل المسارات التي تزيد عن طول محدد فقط (على سبيل المثال ، عند تتبع الخلايا القادرة على نقل البلازميدات) ، فيمكن إزالة المسارات الأقصر تلقائيا من مجموعة البيانات. ومع ذلك ، هناك أغراض أخرى قد تكون خياطة المسارات مهمة جدا من أجلها. أخيرا ، يمكن أن يؤدي عدم القدرة على تتبع حركة الخرزة السريعة كمسار واحد إلى المزيد من المسارات في الأغشية الحيوية Enterobacteriaceae بسبب الحركة السريعة في اتجاه Z مما يؤدي إلى حبات بيضاوية الشكل (الشكل 2G). ستكون إمكانية خياطة مسارات الاضطراب بسبب الحركة سريعة متباينة الخواص مهمة لدراسة تأثير مصفوفة الأميلويد الكريري في Enterobacteriaceae.
اهميه
تم تطوير سير عمل حسابي لدراسة مسارات الخرز لمقارنة الخصائص المادية للأغشية الحيوية ثلاثية الأبعاد. يمكن سير العمل الباحثين من تحديد المعلمات الهامة التي يمكن استخدامها في النمذجة الحسابية لديناميكيات السوائل في الأغشية الحيوية غير المتجانسة. بمساعدة مقيم الخرزة مفتوح المصدر هذا ، يمكن دراسة تأثير الأميلويد البكتيري على خصائص المواد ، مما يدل على زيادة صلابة مصفوفة الأغشية الحيوية بسبب التجعد. في سياق أكثر عمومية ، يمكن استخدام المقيم لدراسة التغيرات في بنية الأغشية الحيوية الناجمة عن معالجة الأغشية الحيوية أو الظروف البيئية المختلفة ، مثل التدفق. على سبيل المثال ، يتم استخدام الأداة لتحليل تأثير العلاج بالأجسام المضادة وحيدة النسيلة على تعطيل هياكل الأغشية الحيوية بالتعاون مع مختبر Tükel (جامعة LKSOM Temple). صندوق أدوات مقيم الخرزة قابل للتكيف بالكامل وقابل للتمديد بطريقة معيارية باستخدام VRL-Studio لتعزيز وظائفه وتوسيعه.
Disclosures
المؤلفون ليس لديهم ما يكشفون عنه.
Acknowledgements
لم يتلق العمل في مختبرات GQ و BAB أي منحة محددة من أي وكالة تمويل في القطاعات العامة أو التجارية أو غير الهادفة للربح. يعترف المؤلفون بإسحاق كلابر ، دكتوراه (قسم الرياضيات ، جامعة تمبل) للمناقشة المفيدة و Çagla Tükel (قسم علم الأحياء الدقيقة والمناعة ، جامعة تمبل) لخبرة Enterobacteriaceae في النشر الأولي لاحتواء هذه التقنية.
Materials
| Name | Company | Catalog Number | Comments |
| 96-well plates, No. 1.5 Uncoated Coverslip, 5 mm Glass Diameter | MatTek | P96G1.55F | |
| Fisherbrand Cover Glasses: Circles | Fisher Scientific | 12-293-232P | 1.5 optic glass coverslip |
| Invitrogen Syto 9 Green Fluorescent Nucleic Acid Stain | Invitrogen | S34854 | |
| Molecular Probes FluoSpheres Carboxylate-modified Microspheres, 1 um, crimson fluorescent (625/645) | Molecular Probes | F8816 |
References
- Huang, R., Li, M., Gregory, R. L. Bacterial interactions in dental biofilm. Virulence. 2, 435-444 (2011).
- Nadell, C. D., Drescher, K., Wingreen, N. S., Bassler, B. L. Extracellular matrix structure governs invasion resistance in bacterial biofilms. ISME Journal. 9, 1700-1709 (2015).
- Billings, N., Birjiniuk, A., Samad, T. S., Doyle, P. S., Ribbeck, K. Material properties of biofilms - key methods for understanding permeability and mechanics. Reports on Progress in Physics. 78, 036601 (2015).
- Araújo, G. R. d. e. S., Viana, N. B., Gómez, F., Pontes, B., Frases, S. The mechanical properties of microbial surfaces and biofilms. The Cell Surface. 5, 100028 (2019).
- Tallawi, M., Opitz, M., Lieleg, O. Modulation of the mechanical properties of bacterial biofilms in response to environmental challenges. Biomaterials Science. 5, 887-900 (2017).
- Tursi, S. A., Tükel, &. #. 1. 9. 9. ;. Curli-Containing Enteric Biofilms Inside and Out, Matrix Composition, Immune Recognition, and Disease Implications. Microbiology and Molecular Biology Reviews. 82, (2018).
- Dueholm, M. S., Albertsen, M., Otzen, D., Nielsen, P. H. Curli functional amyloid systems are phylogenetically widespread and display large diversity in operon and protein structure. PLoS One. 7 (12), 51274 (2012).
- Hung, C., et al. Escherichia coli biofilms have an organized and complex extracellular matrix structure. mBio. 4, 00645 (2013).
- Kikuchi, T., Mizunoe, Y., Takade, A., Naito, S., Yoshida, S. Curli fibers are required for development of biofilm architecture in Escherichia coli K-12 and enhance bacterial adherence to human uroepithelial cells. Microbiology and Immunology. 49, 875-884 (2005).
- Gallo, P. M., et al. Amyloid-DNA Composites of Bacterial Biofilms Stimulate Autoimmunity. Immunity. 42, 1171-1184 (2015).
- Serra, D. O., Richter, A. M., Hengge, R. Cellulose as an architectural element in spatially structured Escherichia coli biofilms. Journal of Bacteriology. 195, 5540-5554 (2013).
- Oh, Y. J. Characterization of curli A production on living bacterial surfaces by scanning probe microscopy. Biophysical Journal. 103, 1666-1671 (2012).
- Lembré, P., Di Martino, P., Vendrely, C. Amyloid peptides derived from CsgA and FapC modify the viscoelastic properties of biofilm model matrices. Biofouling. 30, 415-426 (2014).
- Oh, Y. J., et al. Curli mediate bacterial adhesion to fibronectin via tensile multiple bonds. Scientific Reports. 6, 33909 (2016).
- Vidakovic, L., Singh, P. K., Hartmann, R., Nadell, C. D., Drescher, K. Dynamic biofilm architecture confers individual and collective mechanisms of viral protection. Nature Microbiology. 3, 26-31 (2018).
- Tursi, S. A., et al. Salmonella Typhimurium biofilm disruption by a human antibody that binds a pan-amyloid epitope on curli. Nature Communications. 11, 1007 (2020).
- Perov, S., et al. Structural Insights into Curli CsgA Cross-β Fibril Architecture Inspire Repurposing of Anti-amyloid Compounds as Anti-biofilm Agents. PLOS Pathogens. 15 (8), 1007978 (2019).
- Taglialegna, A., et al. The biofilm-associated surface protein Esp of Enterococcus faecalis forms amyloid-like fibers. Npj Biofilms and Microbiomes. 6, 15 (2020).
- Gour, S., Kumar, V., Rana, M., Yadav, J. K. Pheromone peptide cOB1 from native Enterococcus faecalis forms amyloid-like structures, A new paradigm for peptide pheromones. Journal of Peptide Science. 25, 3178 (2019).
- Stoodley, P., Debeer, D., Lewandowski, Z. Liquid flow in biofilm systems. Applied and Environmental Microbiology. 60, 2711-2716 (1994).
- Birjiniuk, A., et al. Single particle tracking reveals spatial and dynamic organization of the E. coli biofilm matrix. New Journal of Physics. 16, 085014 (2014).
- Chew, S. C., et al. Dynamic remodeling of microbial biofilms by functionally distinct exopolysaccharides. mBio. 5, 01536 (2014).
- Cao, H., et al. Revealing region-specific biofilm viscoelastic properties by means of a micro-rheological approach. Npj Biofilms and Microbiomes. 2, 5 (2016).
- Galy, O., et al. Mapping of bacterial biofilm local mechanics by magnetic microparticle actuation. Biophysical Journal. 103, 1400-1408 (2012).
- Rogers, S. S., vander Walle, C., Waigh, T. A. Microrheology of bacterial biofilms in vitro, Staphylococcus aureus and Pseudomonas aeruginosa. Langmuir. 24, 13549-13555 (2008).
- Hart, J. W., Waigh, T. A., Lu, J. R., Roberts, I. S. Microrheology and Spatial Heterogeneity of Staphylococcus aureus Biofilms Modulated by Hydrodynamic Shear and Biofilm-Degrading Enzymes. Langmuir. 35 (9), 3553-3561 (2019).
- van Merode, A. E. J., van der Mei, H. C., Busscher, H. J., Krom, B. P. Influence of culture heterogeneity in cell surface charge on adhesion and biofilm formation by Enterococcus faecalis. Journal of Bacteriology. 188, 2421-2426 (2006).
- Tariq, M., Bruijs, C., Kok, J., Krom, B. P. Link between Culture Zeta Potential Homogeneity and Ebp in Enterococcus faecalis. Applied and Environmental Microbiology. 78, 2282-2288 (2012).
- Schneider, C. A., Rasband, W. S., Eliceiri, K. W. NIH Image to ImageJ, 25 years of image analysis. Nature Methods. 9, 671-675 (2012).
- . Oracle.com Available from: https://docs.oracle.com/en/java (2021)
- Hoffer, M., Poliwoda, C., Wittum, G. Visual reflection library, a framework for declarative GUI programming on the Java platform. Computing and Visualization in Science. 16, 181-192 (2013).
- Perov, S., et al. Structural Insights into Curli CsgA Cross-β Fibril Architecture Inspire Repurposing of Anti-amyloid Compounds as Anti-biofilm Agents. PLOS Pathogens. 15, 1007978 (2019).
- Malhotra, K., et al. Development of a New Bead Movement-Based Computational Framework Shows that Bacterial Amyloid Curli Reduces Bead Mobility in Biofilms. Journal of Bacteriology. 202, 00253 (2020).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved