Method Article
Вычислительная среда на основе движения бусин для трехмерного анализа неоднородности биопленочных материалов
В этой статье
Резюме
Мы описываем метод анализа и количественной оценки характера движения гранул карбоксилата размером 1 мкм через гетерогенные бактериальные биопленки. Сравнение моделей движения может быть использовано для количественной оценки различий в свойствах материала биопленок.
Аннотация
Различия в свойствах материала бактериальных биопленок наблюдались в биопленках разных видов бактерий, в пределах одного и того же вида при различных условиях роста и после обработки молекулами, модифицирующими матрикс. Чтобы лучше количественно оценить свойства материалов 3D-биопленок, был разработан и применен экспериментальный и вычислительный рабочий процесс для изучения различий между биопленками Enterococcus faecalis, Salmonella enterica серотипа Typhimurium и Escherichia coli , а также роли амилоидных завитков в подтверждении жесткости к биопленкам Enterobacteriaceae. Пространственно-временная динамика гранул карбоксилата размером 1 мкм в биопленках отслеживалась в 3D-биопленках размером 20 мкм в течение 20 минут. Стеки 4D-изображений были обработаны с помощью плагина Mosaic в ImageJ для получения 3D-данных о траектории движения бусины. Эти данные о траектории были проанализированы с помощью недавно разработанного набора инструментов Bead Evaluator, в котором данные о движении, включая продолжительность жизни траектории, скорости бусин, плотность ячеек вдоль траекторий и информацию о ограничивающем прямоугольнике, были вычислены и сохранены в csv-файлах. В данной статье представлен рабочий процесс от экспериментальной установки и записи изображения до расчета и анализа траектории шва. Структура биопленок, содержащих завитки, привела к более стабильным взаимодействиям гранул и меньшему движению бусин, чем в кудрявых и энтерококковых биопленках. Движение шариков не оказалось сильно зависимым от плотности клеток при измерении скорости шарика и объема ограничивающего прямоугольника траектории, что подтверждает гипотезу о том, что другие свойства материала биопленок контролируют динамику шариков. Этот метод широко применим для количественной оценки различий в биопленках различных матричных составов, а также биопленок до и после матрикс-модифицирующих обработок.
Введение
Бактериальные биопленки повсеместно распространены в составе микробиоты человека и постоянно взаимодействуют с молекулами. Эти молекулы варьируются по размеру от антибиотиков размером 1 нм и бактерий размером 1-3 мм до более крупных частиц клетчатки в желудочно-кишечном тракте. Состав одно- или многовидовых биопленок влияет на свойства материала и, следовательно, на характер движения частиц через биопленки 1,2,3,4,5. Одним из примеров являются бактериальные амилоиды, которые имеют консервативную фибриллярную поперечно-бета-структуру листа6. Амилоидные завитки экспрессируются кишечными бактериями, такими как кишечная палочка и Salmonella enterica серотипа Typhimurium, а гены были обнаружены во многих других типах бактерий7. На различные свойства материала биопленок влияют завитки 8,9. Завитки напрямую взаимодействуют с другими компонентами матрикса, такими как внеклеточная ДНК (эДНК) и целлюлоза10,11. Завитки окружают клетки и влияют на жесткость клеточной мембраны12 и общие вязкоупругие свойства биопленки13. Завиток опосредует повышение прочности на разрыв за счет связывания с фибронектином, что приводит к увеличению прочного прикрепления стекла к поверхности14. Поступающие бактериофаги связываются с завитками и ограничивают фаговую инвазию в биопленки15.
При использовании мультитестовых предметных стекол с покрытием для анализа Enterococcus faecalis, E. coli и S толщиной около 20 мкм. Биопленки Typhimurium с помощью конфокальной микроскопии, четкие различия между E. coli, S. Можно было наблюдать биопленки Typhimurium10,16 и E. faecalis (текущее исследование). В то время как биопленки видов Enterobacteriaceae обладали высоким уровнем жесткости и областями с низкой клеточной плотностью их было легко визуализировать, получение четких изображений биопленок E. faecalis с высоким разрешением с использованием линейного и кадрового усреднения требовало приложения давления к предметному стеклу, чтобы вызвать достаточное поверхностное натяжение для стабильности клеток в процессе визуализации. Бактериальные амилоиды, такие как завитки, образуют высокоупорядоченные структуры, предполагая, что они могут быть относительно жесткими17. Это послужило основанием для гипотезы о том, что амилоидные завитки могут вызывать ригидность у E. coli и S. Биопленки Typhimurium. Не было четких доказательств того, что E. faecalis экспрессирует амилоиды в изучаемых условиях. Недавно было показано, что белок Esp, ген пилина, связанный с более патогенными штаммами E. faecalis, продуцирует амилоидные структуры18; однако, используя поиск blastn и blastp, этот ген не был обнаружен в штамме комменсального типа E. faecalis OG1RF, использованном в этих исследованиях. Феромон cOB1, продуцируемый OG1RF, может образовывать амилоидные структуры19. Однако при данных условиях роста биопленки и методах детекции амилоида, ранее использовавшихся для S. Окрашивание амилоида Typhimurium10 у E. faecalis, OG1RF амилоидов не удалось обнаружить (данные не показаны). Был разработан новый метод получения четырехмерных (4D) изображений для сравнения общих свойств материала вязких E. faecalis, E. coli и S. typhimurium, а также для определения вклада амилоида в биопленки Enterobacteriaceae с использованием амилоидных мутантов S. Typhimurium и E. coli.
В прошлом флуоресцентные шарики успешно использовались для анализа свойств материала биопленок в двух измерениях (2D) с использованием микрореологии 20,21,22,23,24,25. Это может быть применено к трехмерной биопленке путем изучения 2D-оптических срезов на различной глубине биопленки26. Текущая методика была разработана для отслеживания микроразмерных бусин размером 1 мкм в 3D с течением времени для использования в 4D-моделировании. Отчасти это объяснялось всеобъемлющей концепцией использования 4D-моделирования для понимания перемещения плазмид через сообщества желудочно-кишечной микробиоты. Использовали флуоресцентно заряженные карбоксилатные шарики диаметром 1 мкм, поскольку они хорошо соответствуют по размеру и заряду E. faecalis, выбранному модельному организму для перемещения и поддержания плазмид27, 28. Был разработан 4D-анализ для количественной оценки физических свойств биопленок (рис. 1A). В разработанной методике к биопленкам добавляли бусины и регистрировали их пространственно-временные траектории через биопленки толщиной 10-20 мкм в течение 10-20 минут. Траектории швов в 3D были затем количественно оценены в терминах длины траектории, скорости шва, объема ограничивающего прямоугольника траектории (минимального прямоугольника, содержащего траекторию) и плотности ячеек ограничивающего прямоугольника с использованием недавно разработанного набора инструментов. Следующий протокол может быть использован для создания 4D-изображений бактерий и биопленок, содержащих бусины, для предварительной обработки данных с помощью ImageJ29 и плагина Mosaic, а также для анализа траекторий швов с помощью набора инструментов Bead Evaluator.
Этот метод имеет множество применений для изучения свойств материалов, а также для отслеживания движения частиц и бактерий в трех измерениях. Например, ранняя версия этой методики была использована для характеристики влияния моноклональных антител, направленных против кудрявых, на структурную целостностьбиопленок16. Полная версия имеет несколько инструментов для обеспечения более детального анализа свойств материала биопленки и продолжает использоваться для изучения эффектов обработки моноклональными антителами на биопленки. Частицы с различными зарядами могут быть использованы для изучения материальных зарядовых свойств биопленок и движения частиц через биопленки с различным составом матрицы. Это может быть использовано для сравнения результатов 2D-микрореологии, которые раскрывают свойства материала, ответственные за движение гранул, которые мы наблюдали в биопленках, которые не находились под потоком. Этот метод также может быть использован на биопленках смешанных видов с областями различного состава биопленки. Биопленки могут быть визуализированы в режиме реального времени под потоком в микрофлюидных устройствах и проточных ячейках для изучения изменений свойств материала между статическими и проточными биопленками, а также влияния потока на движение частиц. Эти методы также могут быть применены к флуоресцентно меченным бактериям для характеристики движения экзогенных бактерий через биопленочное сообщество. Используя три цвета, флуоресцентно меченные донорские бактерии, флуоресцентно меченные бактерии-реципиенты и флуоресцентно меченные плазмиды могут быть использованы для отслеживания перемещения, стыковки и переноса плазмид.
протокол
1. Подготовка биопленки
ПРИМЕЧАНИЕ: Биопленки для анализа могут быть выращены с использованием любого метода, позволяющего сформировать биопленку на поверхности оптического стекла. Структура биопленки должна прилегать к оптической поверхности настолько, чтобы структура не была нарушена во время промывки и/или монтажа в соответствии с протоколом. Ниже описана методика работы с 96-луночными оптическими донными планшетами и стеклянными покровными стеклами толщиной 12 мм в 24-луночных планшетах. Другие опции включают в себя оптические днища различных размеров и оптические проточные камеры с потоком и без него.
- Установка биопленки
- Добавьте в лунки пластины питательную среду для бактерий. Для данного исследования, для Е. Добавьте 2 мл Todd-Hewitt (TH) в 24-луночный планшет и добавьте 0,4 мл TH в 96-луночные планшеты с оптическим дном. Для С. Typhimurium, E. coli и изогенные мутанты csgAB curli добавляют в лунки 0,7 мл бессолевого бульона Лурия (LB). Если используются оптические донные камеры, перейдите к шагу 1.2.
- Поместите стеклянные оптические покровные стекла 12 мм #1.5 в чашку Петри и залейте их этанолом.
- С помощью щипцов снимите покровное стекло и с помощью пламени поджечь оставшийся спирт. Дайте спирту сгореть. Просто используйте пламя, чтобы поджечь их; Не держите покровное стекло в огне, так как оно треснет. Дайте покровному стекло остыть в течение 10-20 секунд, прежде чем поместить его в лунку, чтобы предотвратить растрескивание.
- Поместите покровное стекло в лунку со средой под углом, чтобы она не оседала поверх среды. Не добавляйте покровное стекло в сухую лунку, а затем добавляйте среднюю, потому что это приведет к тому, что покровная пленка прилипнет ко дну колодца.
- С помощью стерильного наконечника для пипетки осторожно приложите покровную крышку к дну лунки, содержащей среду.
ПРИМЕЧАНИЕ: Не забудьте подобрать толщину (#1 или #1.5) покровного стекла или нижней пластины оптического стекла в соответствии с толщиной оптики конфокального микроскопа.
- Инкубируйте биопленку в надлежащих условиях для роста биопленки. В этих исследованиях биопленки E. faecalis выращивали в виде статических культур при 37 °C и выращивали биопленки E. coli аэробно при 30 °C.
- В этих исследованиях выращивали биопленки E. faecalis в течение 2 дней со средними переключателями утром и ранним вечером. Чтобы предотвратить повреждение или смещение биопленки, осторожно наклоните пластину. Поместите наконечник пипетки у нижнего края лунки и медленно вытяните среду. Добавьте первый мл свежей среды таким же образом. Медленно добавляйте второй мл рядом с границей раздела среда/лунка.
- В этих исследованиях используйте условия роста для оптимального производства кудряшек. Выращивание С. Биопленки Typhimurium при 28 °C в течение 6-8 дней инкубировали на наклоне, который позволял биопленке прикрепляться примерно на 2/3 пути вверх по предметному стеклу, а затем расти в виде пленки на границе раздела воздух-жидкость. Это было сделано без смены среды. Чтобы предотвратить высыхание среды, поместите 24-луночный планшет в камеру с поддоном для воды.
2. 4D визуализация
- Подготовка крепления биопленки
- Развести карбоксилатные шарики FluoSpheres Crimson 1:50 в PBS (2 x 107 шариков в 1 мл PBS). При использовании оптических донных камер добавьте Syto9 в разведении 1 мкл на 300 мкл гранулированного препарата.
- (необязательно) Промойте биопленку, чтобы удалить следы питательной среды, если питательная среда обладает автофлуоресценцией. В этих экспериментах дважды промойте 1 мл PBS, осторожно наклоняя пластину, расположив наконечник пипетки у нижнего края лунки и медленно вытягивая среду. Добавьте PBS, поместив наконечник у нижнего края и медленно заполните лунку. Используйте этот метод на оптических придонных лунках в дополнение к покровным стеклам в 24-луночной пластине.
- Удалите среду или PBS. Добавьте в биопленку разведенные бусины Crimson, приготовленные в 2.1.1. В этих исследованиях добавьте 1 мл бусин (2x107) в покровные стекла и 0,2 мл бусин (4x106) и Syto9 в 96-луночные оптические донные пластины.
- Инкубировать в течение 1 минуты при комнатной температуре, чтобы обеспечить ассоциацию бусин.
- Удалите бусины и аккуратно промойте биопленку с помощью PBS, чтобы удалить посторонние бусины. В этих исследованиях для покровного стекла аккуратно промойте 1 мл PBS, наполните лунку 1 мл PBS и перейдите к пункту 2.1.6. Для 96-луночных оптических донных пластин аккуратно промойте биопленку 0,2 мл PBS и наполните лунку 0,2 мл PBS. Теперь оптическая нижняя камера готова к изображению, поэтому перейдите к шагу 2.2.
- (При использовании чехлового стекла) Добавьте 1 мкл Syto9 (зеленый флуоресцентный краситель ДНК; разбавлен в соответствии с инструкциями производителя) в центр лунки на 10-луночном мультитестовом стекле с покрытием. Эти покровные стекла с покрытием имеют глубину скважин 23-25 мкм.
- (При использовании чехлового стекла) С помощью щипцов, стерилизованных спиртовым пламенем, осторожно извлеките покровное стекло из лунки и переверните на лунку, содержащую каплю Syto9. Оставление покровного стекла в 1 мл PBS облегчает его извлечение из лунки и помогает вымыть несвязанные шарики из биопленки.
- (При использовании чехлового стекла) Тщательно заклейте покровное стекло лаком для ногтей, не скользя и не нажимая на него, что может вызвать поверхностное натяжение, которое остановит движение в более вязких, менее жестких биопленках.
- (При использовании чехлового стекла) Дайте лаку высохнуть. Тщательно протрите наружную поверхность покровного стекла 70% этанолом. Протрите, не прижимая к покровному тексу, по причинам, указанным выше.
- Конфокальная визуализация
ПРИМЕЧАНИЕ: В этих исследованиях используйте лазерный сканирующий конфокальный микроскоп с инвертированной спектральной визуализацией, оснащенный конфокальной системой TCS с объективом 63x. Осциллограф будет использоваться для создания 4D-видео (рис. 1). 3D-биопленка будет состоять из Z-срезов, захваченных с шагом 0,5 мкм через биопленки толщиной 18-20 мкм, образуя 36-40 Z-срезов. На съемку каждой 3D-биопленки уйдет 50-60 секунд. Срезы вместе составят кадр, который можно визуализировать как 3D-биопленку. Этот процесс будет повторен 20 раз для создания 4D-видео с общим временем отслеживания 18-20 минут.- Установите эндоскоп для захвата флуорофоров. В этих исследованиях возбуждают Syto9 (окрашивание бактериальной ДНК) лазером с длиной волны 488 нм и измеряют излучение от 495 до 540 нм (Leica Sp5 — это спектральный микроскоп). Возбуждайте малиновые (красные) бусины с помощью лазера с длиной волны 633 нм и измеряйте излучение от 650 нм до 700 нм. Эти настройки флуорофоров можно отрегулировать для захвата любых желаемых флуорофоров.
- Выберите режим визуализации xyzt.
- Определите область биопленки со смесью областей с более высокой и низкой плотностью, чтобы уловить различия в вязкоупругих свойствах в толстых и тонких областях биопленки.
- Установите Z-стек толщиной 18-20 мкм. В биопленке, установленной на покровном стекле, избегайте соприкосновения самой верхней и самой нижней части биопленки со стеклом, чтобы избежать артефактов, захватывающих шарики (см. обсуждение).
- Отрегулируйте усиление и смещение, чтобы использовать весь динамический диапазон интенсивности в самом ярком пятне биопленки. Это сводит к минимуму перекрытие сигнала от нижних слоев биопленки.
- Установите толщину среза на 0,5 мкм. Это позволяет быстро получать изображения без потери информации о валиках.
- Установите разрешение на 512 x 512 (0,48 мкм). Это позволяет быстро получать изображения с достаточным разрешением, чтобы увидеть структуру биопленки и детали движения шариков.
- Сведите к минимуму время визуализации.
- Установите на захват 20 стеков.
- Сохраните как .lif (или аналогичный конфокальный файл). 4D-фильм может быть сгенерирован в ImageJ.
3. Создание видео из биопленки в формате 4D с помощью ImageJ
- Откройте файл .lif в ImageJ со следующими настройками: Просмотр стека с Hyperstack, Порядок стека XYCZT, цветовой режим: раскрашенный, автомасштабирование отмечено. Затем нажмите OK.
- Выберите Изображение > Цвет > Разделить каналы.
- Выберите Цвет изображения > > Объединить каналы > Создать составной > OK.
- Выберите «Плагины» > просмотрщике 3D > снимите синий флажк> «ОК».
- Выберите Изменить > Показать содержимое отмеченными > Показать ограничивающий прямоугольник отмеченным.
- Используйте щелчок мыши и удерживайте его, чтобы выбрать изображение. Затем поверните изображение, продолжая удерживать кнопку нажатия. Поверните изображение так, чтобы нижняя часть биопленки находилась внизу, а угол поддерживал визуализацию бусин. Затем отпустите изображение.
- Нажмите красную кнопку «Запись » в нижней части окна, чтобы записать видео.
- Сохраните как .avi-файл, используя jpeg в качестве сжатия.
4. Генерация данных о траектории
- Установите инструмент с открытым исходным кодом ImageJ (https://imagej.net/Fiji) и плагин для отслеживания частиц Mosaic (https://imagej.net/MOSAICsuite).
- Импортируйте файл .lif, содержащий два канала для бусин и бактерий. Разделите каналы и сохраните файлы отдельно.
- В ImageJ сохраните размер воксела изображения (размеры x, y и z) и размер временного шага в текстовом файле.
- В ImageJ перейдите в раздел Плагины | Мозаика и запустите Particle Tracker 2D/3D.
- Введите следующие параметры: Радиус: 3, Отсечка: 0.003, Пер/Абс: 0.12, Диапазон связи: 2, Смещение: 10.00 с заданной динамикой по броуновскому методу. Пожалуйста, ознакомьтесь с результатами для обоснования выбора броуновского метода в этих экспериментах.
- Генерируйте траектории и экспортируйте список траекторий в виде файлов .csv.
5. Анализ траекторий
- Установите VRL Studio (https://vrl-studio.mihosoft.eu)
- Скачать проект Biofilm (https:// neurobox3d.github.io/Biofilm/) и запустить в VRL Studio
- Загрузите файл траектории в ImportData
- Укажите размер пикселей x, y и z (используйте ImageJ для поиска этих значений) в ProcessTrajectories.
- Укажите интервал кадров в поле ComputeVelocity (используйте ImageJ для поиска этого значения).
- Загрузите бактериальный tiff-файл (см. шаг 3.2) в поле Плотность.
- Задайте выходные пути для данных о скорости в SaveVelocityDataToFile и данных траектории в SaveTrajectoryDataToFile.
- Вызовите SaveVelocityDataToFile и SaveTrajectoryDataToFile.
- Импортируйте данные в Excel для анализа. Эти данные будут включать длину траектории, продолжительность жизни траектории, размеры и объемы ограничивающего прямоугольника траектории, средние скорости и дисперсии валиков. Анализ вычисляет взвешенные переменные с использованием канала для меченых Syto9 бактерий для вычисления локальных (в пределах заданной траектории) клеточных плотностей. Результатом анализа является расчет средневзвешенных скоростей и дисперсий, а также средневзвешенных и дисперсий дисперсии ограничивающего прямоугольника.
Результаты
Этот метод был использован для проверки гипотезы о том, что завитки могут придавать жесткость E. coli и S. Биопленки Typhimurium, уменьшающие движение шариков во время экспериментов с конфокальной микроскопией. Данный инструментарий был использован для сравнения свойств материала штамма комменсального типа Enterococcus faecalis OG1RF с серотипом Salmonella enterica Typhimurium, E. coli и их соответствующими изогенными мутантами (Рисунок 1B и Дополнительное видео 1, Дополнительное видео 2, Дополнительное видео 3, Дополнительное видео 4, Дополнительное видео 5, Дополнительное видео 6). Свойства биопленочного материала потенциально могут различаться в отношении жесткости (например, завитковые связи с eDNA) или электростатических и гидрофобных взаимодействий между отрицательно заряженными шариками и биопленочными клетками и материалами матрицы, а также клеточной плотности.
Воспроизводимость
Набор инструментов Biofilm был запрограммирован на Groovy30 и Java31 в VRL-Studio32 , что позволило создать модульный рабочий процесс с автоматической генерацией пользовательского интерфейса (UI) для всех вычислительных компонентов. Это позволило автоматизировать рабочий процесс, устранив непреднамеренную систематическую ошибку, вызванную экспериментаторами, при анализе результатов.
Использование MSD для подтверждения типа движения в биопленках
Для анализа траекторий с помощью Particle Tracker 2D/3D доступны различные настройки динамики для анализа различных типов движения шариков. Для этих исследований была выбрана установка «броуновское движение» (т.е. диффузионное движение), поскольку E. faecalis является неподвижной бактерией, E. coli и сальмонеллы не экспрессируют жгутики в биопленках, и эксперименты проводились в закрытой системе при отсутствии потока. Эта настройка может быть дополнительно проверена с помощью вычисленных средних квадратичных перемещений (MSD) бусин. Используя определение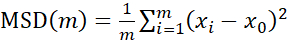 , где m — количество отрезков траектории, можно вычислить изменение MSD по ходу каждой траектории. Линейные траектории указывают на диффузионное движение шариков (рис. 2A). С помощью квадратичной аппроксимации метода наименьших квадратов был рассчитан средний характер движения всех шариков в биопленке, показывающий доминирующий линейный порядок и подтверждающий пассивную диффузию в качестве движущей силы (рис. 2A-2F).
, где m — количество отрезков траектории, можно вычислить изменение MSD по ходу каждой траектории. Линейные траектории указывают на диффузионное движение шариков (рис. 2A). С помощью квадратичной аппроксимации метода наименьших квадратов был рассчитан средний характер движения всех шариков в биопленке, показывающий доминирующий линейный порядок и подтверждающий пассивную диффузию в качестве движущей силы (рис. 2A-2F).
Анализ ограничивающего прямоугольника.
Набор инструментов использует ImageJ Mosaic и Particle Tracker 2D/3D для создания траекторий (шаг 4), а затем с помощью автоматизированного конвейера анализа биопленки генерирует важные данные о траекториях шариков, которые можно использовать для сравнения свойств материала биопленки. Объем ограничивающего прямоугольника вмкм3 измеряли путем построения минимального прямоугольника, содержащего траекторию, и измерения его объема (рис. 3).
Биопленки E. faecalis имеют большее движение гранул со значениями ограничивающего прямоугольника 1-6000мкм3 (рис. 3B, 3C и 3D). Полученные результаты подтверждают, что движение, наблюдаемое на стеклянном покровном стекле, установленном на предметном стекле с покрытием из лунки с покрытием толщиной около 25 мкм (Рисунок 3C), по сравнению с биопленками, выращенными на дне оптических стеклянных лунок и непосредственно визуализированными (Рисунок 3D), дает эквивалентные результаты с небольшими различиями. Единственное отличие заключалось в том, что вблизи верхней части установленного покровного стекла биопленок E. faecalis можно было регистрировать стабильные траектории со сроком жизни более 10 минут, но в то же время регистрировать небольшие ограничивающие рамки, в то время как в оптической нижней пластине можно было регистрировать выбранное количество бусин с более высокой подвижностью. В совокупности это позволяет предположить, что установка предметного стекла могла изменить поверхностное натяжение системы в верхней части биопленки по отношению к предметному стеклу в установленной биопленке, что в конечном итоге снизило подвижность некоторых шариков в менее вязких областях биопленки (рис. 3B, 3C, 3D и 3I). Траектории, которые попадают в эту категорию, оказались очень маленькими процентами, и даже при таком небольшом количестве захваченных шариков среднее значение MSD E. faecalis на установленном покровном стекле было немного выше, чем MSD, рассчитанное по биопленке оптической нижней пластины (рис. 3).
С. Траектории бусин Typhimurium и E. coli имели меньшие объемы ограничивающих рамок 0-10мкм3 (рис. 3A, 3B, 3E и 3F), по сравнению с изогенными мутантами curli с ограничивающими рамками 1-6000мкм3 для E. coli и 1-5000мкм3 для S. Typhimurium (рис. 3A, 3B, 3F и 3H), демонстрирующий большую подвижность борта. Эти результаты свидетельствуют о том, что присутствие амилоида коррелировало с повышенной жесткостью биопленок и согласуется с отсутствием заметного движения биопленки на видео. Объемы ограничивающей рамки были стабильно малы (0-10мкм3) даже в областях биопленки с низкой плотностью. Это наблюдение согласуется с предыдущими наблюдениями о том, что завитки могут присутствовать в областях биопленки с низкой плотностью клеток10.
Сравнить поведение биопленок Enterobacteriaceae на оптических донных пластинах не представлялось возможным, поскольку они растут в виде пленок на границе раздела воздух-жидкость (Шаг 1.2.2). При использовании покровного стекла пленка прикрепляется к покровному листу на границе раздела, а когда покровное стекло снимается, пленка накладывается на покровное покрытие, создавая единую поверхность изображения. В оптической нижней пластине, выращенной под наклоном, визуализация проводилась с жидкостью, все еще находящейся в скважине. Это означает, что пленка все еще плавает над оптическим дном и образует пленку из рабочей глубины инвертированного эндоскопа, такого как Leica Sp5. Удаление среды, достаточной для того, чтобы биопленка попала в рабочую глубину микроскопа, привело к высыханию образца в течение 20-минутного процесса визуализации.
В целом, графики подтверждают визуальные наблюдения в дополнительных видеороликах и согласуются с наблюдаемыми различиями в MSD (рис. 3I и 3J).
Продолжительность жизни траектории
Продолжительность жизни траектории измерялась как количество последовательных кадров, в которых была зарегистрирована бусина (рис. 3).
В более вязких, жидких биопленках E. faecalis продолжительность жизни всех гранул составляла менее 10 минут, а большинство траекторий варьировались от 2 до 5 минут для биопленок E. faecalis . Тем не менее, шарики с зарегистрированной короткой продолжительностью жизни траектории могут быть обнаружены при визуальном осмотре в биопленках E. faecalis в течение всего временного окна визуализации (Дополнительное видео 1 и 2). Таким образом, возможно, что шарики движутся по зарегистрированной траектории, периодически диссоциируя от биопленки и завершая траекторию, и вновь ассоциируясь с биопленкой, после чего начинается новая траектория. В конечном итоге это приведет к короткой продолжительности жизни траектории при непрерывном присутствии гранул в биопленке. Важно отметить, что при использовании этого метода продолжительность жизни траектории, особенно в вязкой биопленке, имеет тенденцию недооценивать общее время, в течение которого шарик связан с биопленкой.
В С. Биопленки Typhimurium, которые имели меньшие объемы ограничивающего прямоугольника, большинство бусин (около 80%) имели длительную продолжительность жизни по траектории 16-20 кадров, что соответствует примерно 15-20 минутам реального времени (рис. 3A, 3G и 3H). В противоположность этому, изогенные мутантные биопленки курчавых мутантов несли больше подвижных гранул с объемами ограничивающих коробок в диапазоне от 1-6000мкм3 (E. coli) до 1-5000мкм3 (S. Typhimurium) (рис. 3A, 3B, 3F и 3H). Однако, в отличие от биопленок E. faecalis с >70% траекторий с объемами ограничивающего ящика более 10мкм3, биопленки видов Enterobacteriaceae регистрировали только 30% траекторий шариков с объемами ограничивающего ящика выше 10мкм3. Несмотря на то, что общая продолжительность жизни бусин была меньше в биопленках мутантов курчавых, некоторые траектории отражали значительное движение бусин и длительную продолжительность жизни по траектории (рис. 3H). Это наблюдение может указывать на то, что эта изменчивость может соответствовать различным свойствам материала биопленки, таким как вязкоупругость, и/или изменениям химического состава поверхности частиц, таким как заряд.
Анализ длин траекторий и скоростей борта
Длина траектории — это измерение расстояния, пройденного бусинами в мкм. Это измерение согласуется со скоростью движения валика в мкм/с. В соответствии с большими объемами ограничивающей коробки, бусины в биопленках E. faecalis имели в 10 раз более длинные траектории, 5-20 мкм, по сравнению с <4 мкм в биопленках, содержащих завитки. Согласуется с более короткими траекториями (рис. 4A). Скорости бусин E. faecalis были в 15 раз выше, причем большинство бусин имели скорость в диапазоне 0,01-0,15 мкм/с против скоростей <0,006 мкм/с (рис. 4B). Тем не менее, мутантные биопленки curli показали в целом более низкие скорости и более короткие траектории по сравнению с биопленками E. faecalis , но более длинные траектории и более высокие скорости, чем родительские штаммы, содержащие curli (рис. 4A и 4B).
Следует отметить тот факт, что фибриллярная решетчатая структура curli30 может влиять на подвижность анизотропным образом, уменьшая движение в плоскости xy и обеспечивая повышенную подвижность в направлении z (рис. 2G). Большая траектория (около 800), принадлежащая примерно 50 уникальным бусинам в биопленках, содержащих завитки, согласуется с ограничениями отслеживания мозаичных частиц, считая каждую из этих быстро движущихся бусин как одну бусину в значениях x, y и z. Для подтверждения этого наблюдения потребуются дополнительные исследования и разработка программного обеспечения.
Анализ зависимости движения бусин от плотности клеток
Зависимость движения шариков от плотности клеток определяли с помощью средневзвешенных скоростей и дисперсий, а также средних/взвешенных средних и дисперсий объемов ограничивающего прямоугольника. Второй канал визуализации для меченых Syto9 бактерий был использован для вычисления локальной клеточной плотности при расчете взвешенных скоростей. Плотность клеток была рассчитана путем усреднения данных вокселов Syto9 по ограничивающему прямоугольнику каждого края траектории (рис. 5, справа). Таким образом, скорость шарика может быть взвешена по краевым (локальным) плотностям ячеек. Существует несколько типов красителей, которые можно использовать для визуализации бактерий, включая окрашивания клеточной стенки, мембран и содержимого ДНК. Для определения клеточной плотности был выбран метод Syto9, поскольку он дает наиболее стабильный сигнал независимо от того, какой оптический Z-срез визуализируется. Окрашивание оболочки (клеточной стенки и мембраны) будет давать разный сигнал в зависимости от положения Z-среза. Если Z-срез включает в себя верхнюю или нижнюю часть ячейки, сигнал будет сильнее, чем если Z-срез проходит через середину ячейки, где окрашен только контур ячейки.
Траектории бортов от красного канала отслеживались в течение 20 кадров, где отдельные траектории имели минимальный срок жизни 2 кадра и максимум 20 кадров с 19 отрезками траектории, соединяющими кадры (рис. 5). Для изучения зависимости подвижности гранул от плотности клеток была определена интенсивность GFP на воксель (каждое из отдельных измерений на изображении воксела 512x512). Плотность ячеек вокруг каждого сегмента траектории шарика рассчитывалась как локально усредненная плотность в ограничивающем прямоугольнике сегмента.
Для некоторых биопленок можно было документально зафиксировать статистически значимую зависимость от плотности (рис. 6), особенно для биопленок E. faecalis, которые были выращены на стеклянном покровном стекле и инвертированы на предметное стекло с несколькими лунками (рис. 6A). Напротив, биопленки E. faecalis, которые были выращены на дне 96-луночного планшета (рис. 6B), не показали зависимости от плотности. В заключение можно сказать, что высокотекучие биопленки E. faecalis потенциально могут быть слегка сжаты из-за установки на предметное стекло с несколькими лунками, что согласуется с уменьшением количества шариков, движущихся быстрее, и шариков с небольшими объемами ограничивающей рамки, которые удерживаются в верхней части биопленки на фоне предметного стекла (Рисунок 3C против Рисунка 3D). Как биопленки сальмонеллы и кишечной палочки (рис. 6, C и 6D), так и их изогенные мутанты (рис. 6E и 6F) показали незначительную зависимость от клеточной плотности или ее отсутствие.
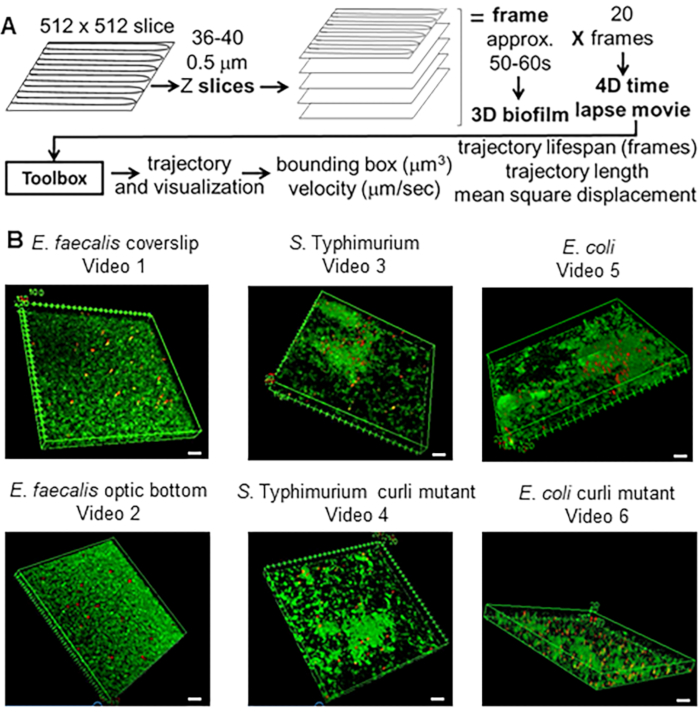
Рисунок 1. Процесс визуализации и анализа (шаги 2-4) (A) Биопленки визуализируются в соответствии с пунктом 2.2. С использованием визуализированных биопленок (см. 3) были сгенерированы траектории швов, как описано в пункте 4. Используя траектории соответствующих данных, рассчитывали с помощью инструментария анализа (см. 5) (B) Биопленки выращивали, как описано в шаге 1 на покровных стеклах (E. faecalis, Video 1), S. Typhimurium (Видео 3), E. coli (Видео 5) и изогенные мутанты curli (Видео 4, Видео 6) или в 96-луночной пластине оптического дна (E. faecalis bottom, Видео 2). Белая масштабная линейка составляет 20 мм. Этот рисунок воспроизводится с разрешения (31). Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
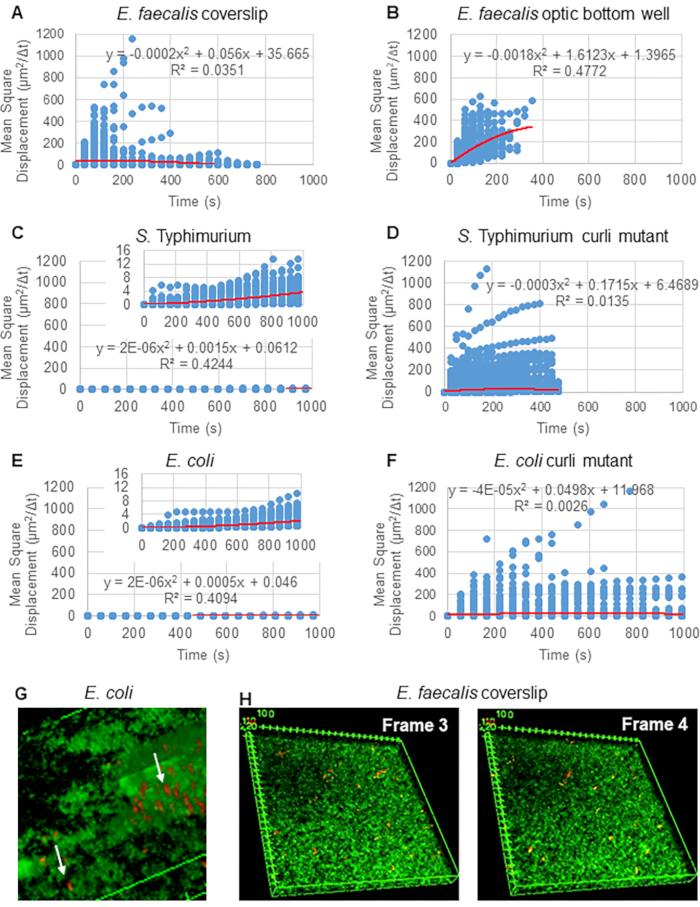
Рисунок 2. Движение шариков в биопленках было определено как диффузионное по своей природе (броуновское движение, см. шаг 5) (A-F) Данные MSD показывают линейное поведение (красная линия) для подтверждения броуновского движения. Биопленки выращивали в соответствии с этапом 1 (G) Пример эллиптического движения шариков, наблюдаемых в биопленках E. coli и S. Typhimurium, взятых из одного кадра 4D-анализа биопленки E. coli (H) Пример больших изменений в рисунках шариков между кадром 3 и 4, взятый из оптического нижнего колодца E. faecalis . Обратите внимание, что биопленка сама по себе вызывает некоторый поток (видео 1 и 2), что создает впечатление, что кадры 3 и 4 по-разному ориентированы. Этот рисунок воспроизводится с разрешения (31). Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
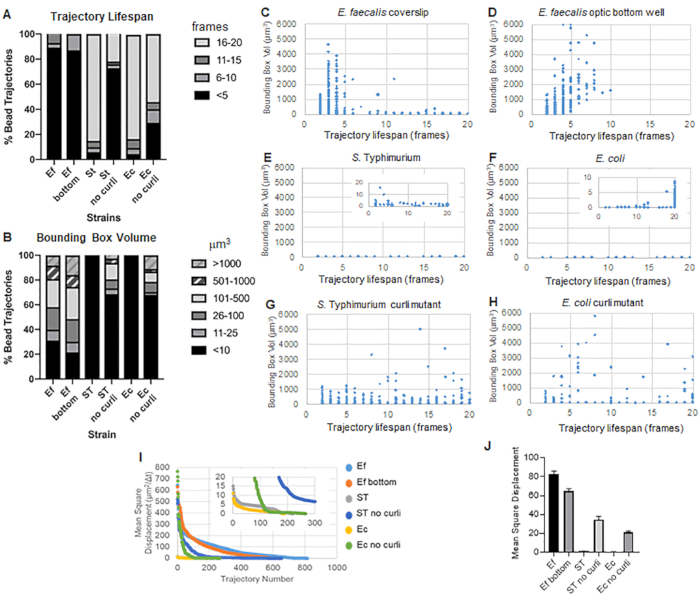
Рисунок 3. Анализ различий в жесткости с использованием ограничивающих прямоугольников и продолжительности жизни траектории. Биопленки выращивали, как описано на шаге 1 на покровных листах (E. faecalis, Video 1), S. Typhimurium (Видео 3), E. coli (Видео 5) и изогенные мутанты curli (Видео 4, Видео 6) или в 96-луночной пластине оптического дна (E. faecalis bottom, Видео 2). Продолжительность жизни траектории представлена в % от общего числа траекторий швов (A) и диаграмм рассеяния (C-H), а также объемов ограничивающего прямоугольника (вычисленных на шаге 5) (I) Сравнение MSD гранул в различных биопленках (H) Средние MSD каждого типа биопленки. Столбцы указывают на 95% доверительный интервал данных. Этот рисунок воспроизводится с разрешения (31). Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
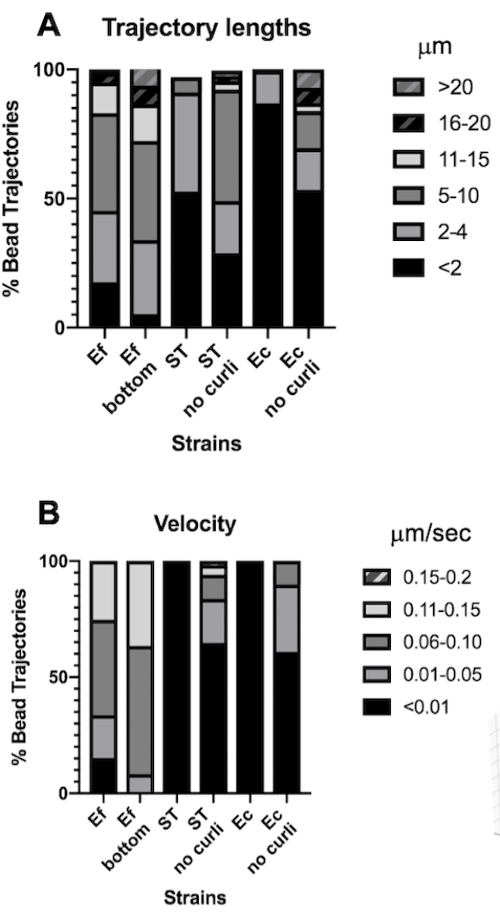
Рисунок 4. Анализ различий в длине траектории и скорости борта. Биопленки выращивали, как описано на шаге 1. Длины траекторий отображаются в μм и представляются в % от общей траектории борта (A). Скорость отображается в мкм/с и представляется в % от общей траектории шва (B). Этот рисунок адаптирован с разрешения (31). Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
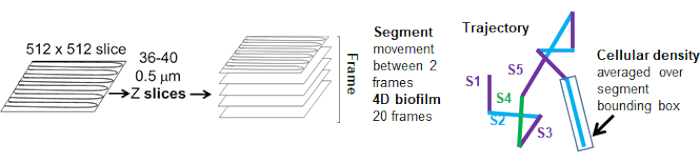
Рисунок 5. Схема анализа траекторного сегмента. Этот рисунок адаптирован с разрешения (31). Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
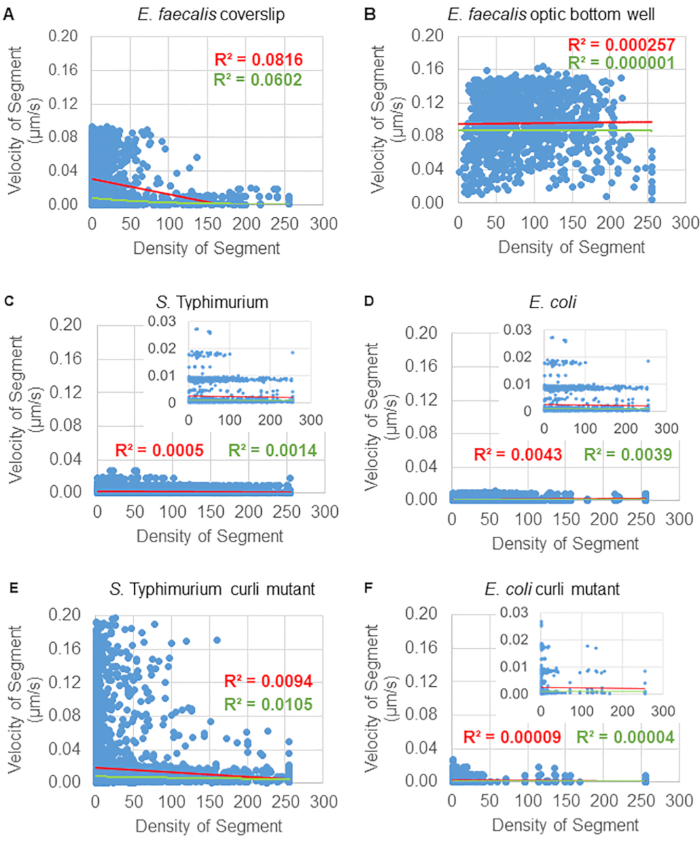
Рисунок 6. Изучение влияния плотности биопленки на скорость гранул с помощью конвейера анализа биопленки (шаг 5). Результаты показали, что скорость гранул не зависит исключительно от плотности клеток. Биопленки выращивали, как описано на шаге 1. Траектории анализировались в масштабе отдельных участков траектории (рис. 5). Для каждого сегмента скорость гранул в мкм/с была построена в зависимости от плотности ячеек ограничивающего прямоугольника (средний GFP на воксель в пределах ограничивающего прямоугольника). Красная линия показывает линейную регрессию, а зеленая — трассу экспоненциальной регрессии. Этот рисунок воспроизводится с разрешения (31). Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
Дополнительное видео 1. 4D-видео 24-часовой биопленки E. faecalis OG1RF, выращенной на покровном стекле толщиной 1,5 толщины. Таймлапс-видео в формате 4D было сгенерировано с помощью микроскопа с разрешением 512x512. Серия Z, состоящая из 40 изображений, была получена путем визуализации области биопленки толщиной около 20 мкм с шагом 0,5 мкм. Каждая серия Z состояла из одного кадра и требовала 50-60 секунд для захвата. Серия из 20 смежных кадров была снята для создания 4D-видео. Воспроизведение видео происходит примерно в 120 раз. Видео является репрезентативным как минимум для 6 независимых экспериментов. Пожалуйста, нажмите здесь, чтобы скачать это видео.
Дополнительное видео 2. 4D-видео 24-часовой биопленки E. faecalis OG1RF, выращенной на 96-луночной оптической нижней пластине. Таймлапс-видео в формате 4D было сгенерировано с помощью микроскопа с разрешением 512x512. Серия Z, состоящая из 40 изображений, была получена путем визуализации области биопленки толщиной около 20 мкм с шагом 0,5 мкм. Каждая серия Z состояла из одного кадра и требовала 50-60 секунд для захвата. Серия из 20 смежных кадров была снята для создания 4D-видео. Воспроизведение видео происходит примерно в 120 раз. Видео является репрезентативным для 3 независимых экспериментов.Пожалуйста, нажмите здесь, чтобы скачать это видео.
Дополнительное видео 3. 4D видео серотипа Salmonella enterica биопленки Typhimurium ATCC 14028, выращенной на 1,5 толстых покровных стеклах в течение 6-7 дней. Таймлапс-видео в формате 4D было сгенерировано с помощью микроскопа с разрешением 512x512. Серия Z, состоящая из 40 изображений, была получена путем визуализации области биопленки толщиной около 20 мкм с шагом 0,5 мкм. Каждая серия Z состояла из одного кадра и требовала 50-60 секунд для захвата. Серия из 20 смежных кадров была снята для создания 4D-видео. Воспроизведение видео происходит примерно в 120 раз. Видео является репрезентативным для 3 независимых экспериментов.Пожалуйста, нажмите здесь, чтобы скачать это видео.
Дополнительное видео 4. 4D видео мутанта Salmonella enterica серотипа Typhimurium biofilms ATCC 14028 curli (csgBA) выращивали на покровных стеклах толщиной 1,5 в течение 6-7 дней. Таймлапс-видео в формате 4D было сгенерировано с помощью микроскопа с разрешением 512x512. Серия Z, состоящая из 40 изображений, была получена путем визуализации области биопленки толщиной около 20 мкм с шагом 0,5 мкм. Каждая серия Z состояла из одного кадра и требовала 50-60 секунд для захвата. Серия из 20 смежных кадров была снята для создания 4D-видео. Воспроизведение видео происходит примерно в 120 раз. Видео является репрезентативным для 3 независимых экспериментов.Пожалуйста, нажмите здесь, чтобы скачать это видео.
Дополнительное видео 5. 4D видео E. coli UTI89, выращенной на покровных стеклах толщиной 1,5 в течение 6-7 дней. Таймлапс-видео в формате 4D было сгенерировано с помощью микроскопа с разрешением 512x512. Серия Z, состоящая из 40 изображений, была получена путем визуализации области биопленки толщиной около 20 мкм с шагом 0,5 мкм. Каждая серия Z состояла из одного кадра и требовала 50-60 секунд для захвата. Серия из 20 смежных кадров была снята для создания 4D-видео. Воспроизведение видео происходит примерно в 120 раз. Видео является репрезентативным для 3 независимых экспериментов.Пожалуйста, нажмите здесь, чтобы скачать это видео.
Дополнительное видео 6. 4D видео Мутант E. coli UTI89 curli (csgBA) выращивался на покровных стеклах толщиной 1,5 в течение 6-7 дней. Таймлапс-видео в формате 4D было сгенерировано с помощью микроскопа с разрешением 512x512. Серия Z, состоящая из 40 изображений, была получена путем визуализации области биопленки толщиной около 20 мкм с шагом 0,5 мкм. Каждая серия Z состояла из одного кадра и требовала 50-60 секунд для захвата. Серия из 20 смежных кадров была снята для создания 4D-видео. Воспроизведение видео происходит примерно в 120 раз. Видео является репрезентативным для 3 независимых экспериментов.Пожалуйста, нажмите здесь, чтобы скачать это видео.
Обсуждение
Критические шаги и устранение неполадок
Самая большая сложность этого метода заключается в использовании установленного покровного стекла с очень вязкой биопленкой, такой как E. faecalis. Покровное стекло необходимо аккуратно и точно разместить на предметном стекле multiwell, не перемещая его. На этапе герметизации необходимо соблюдать осторожность, чтобы не допустить нажатия на покровное стекло или случайного нажатия/скольжения его по поверхности предметного стекла. Любое движение или давление может создать поверхностное натяжение и заблокировать движение вязкой биопленки. Если это возможно, сравнение свойств материала биопленки путем визуализации биопленки на оптической нижней лунке с креплением покровного стекла позволит оценить технику. При правильном выполнении крепление покровного стекла очень напоминало биопленку в оптической нижней пластине для E. faecalis.
Кроме того, при использовании установленного покровного стекла следует избегать визуализации границ раздела биопленки с покровным стеклом внизу или предметным стеклом в самом верху. При использовании перевернутого эндоскопа, с покровным стеклом внизу, в основании биопленки могут быть застрявшие бусины против покровного стекла. Эти шарики проходят через биопленку и прилипают к покровному стеклу даже после бережной стирки. Они имеют координаты x, y и z 0 и координаты ограничивающего прямоугольника 0. Тем не менее, для определенных применений, таких как проверка целостности биопленки после обработки, эти данные могут быть использованы в качестве инструмента. Способность шариков проникать через толстый участок биопленки к нижней части покровного стекла может быть использована для оценки целостности биопленки после обработки (рукопись готовится в сотрудничестве с лабораторией Tükel). В верхней части биопленки, в вязкой биопленке, такой как E. faecalis , у нас были некоторые признаки уплотнения, вызванного покровным стеклом. Это ограничивало движение некоторых бусин на границе раздела предметного стекла и, возможно, вносило некоторую зависимость от плотности в анализ движения бусин.
Этапы промывки были необходимы для биопленок, потому что питательная среда обладает сильной автофлуоресценцией в зеленом канале. Мы выбираем использование лишних бусин и удаляем несвязанные бусины путем промывки, чтобы максимизировать связанные бусины и получить наиболее точную характеристику наблюдаемых областей.
Количество валиков и размывок, необходимых для получения желаемых наборов данных, должно быть определено опытным путем. Присутствие слишком большого количества гранул в биопленке порождает невероятно большие наборы данных, которые трудно поддаются анализу. Наличие слишком малого количества гранул не позволяет получить тщательный отбор проб биопленочных сред. Тем не менее, контроль количества добавляемых гранул (2x107 бусин в 1 мл PBS) и использование этапов промывки привели к относительно постоянному количеству бусин (40-140), связанных с биопленкой в зависимости от ее структуры, пространственного расположения и состава.
При изучении биопленок со смешанными вязкими и жесткими областями гранулы могут со временем застрять в жестких областях. В этом случае визуализацию нужно начинать сразу после добавления бусин. Это часто не может быть достигнуто с помощью покровных стекол, но для этого требуются оптические нижние пластины или проточные ячейки, где визуализация может быть выполнена сразу после добавления валиков и этапов промывки.
Модификации и будущие приложения
Использование микрофлюидных устройств. В наших исследованиях оптимальные условия, созданные для изучения биопленок Enterobacteriaceae, требовали роста биопленки в виде пленки на границе раздела воздух-жидкость. Это ограничивало использование оптических донных пластин и микрофлюидных устройств в исследованиях. Однако, когда позволяют условия образования биопленки, биопленки можно выращивать в микрофлюидных камерах или проточных ячейках. Затем биопленки могут быть промыты, а шарики введены через микрофлюидное устройство с минимальным разрушением биопленки.
Добавление гранул во время роста биопленки. Мы решили добавить лишние шарики в биопленки, а затем удалить несвязанные бусины путем бережной промывки, чтобы оптимизировать количество гранул, присутствующих во время анализа. В вязких биопленках E. faecalis возможно то, что гранулы диссоциировались и реассоциировались в течение 20-минутного времени визуализации. Если небольшое количество гранул добавляется в разное время во время роста биопленки, то может оказаться возможным захватить гранулы в биопленке, что позволит более точно охарактеризовать движение биопленки в более вязких биопленках.
Выбор региона для изображения. Для исследований свойств материала лучше всего выбирать толстые и тонкие участки биопленки. Однако при изучении изменений свойств материала обработанной биопленки могут быть визуализированы толстые сливающиеся области для определения изменений вязкоупругих свойств и проникновения гранул в эти области. В этом случае поиск шариков, которые проникли в биопленку и в конечном итоге оказались в ловушке покровного стекла, является полезным мерой разрушения биопленки.
Визуализация под потоком. С помощью проточных ячеек оптического стекла или микрофлюидных устройств можно визуализировать движение шариков или бактерий в биопленке под потоком. Сделать это можно разными способами. Это может быть сделано путем введения шариков во всю камеру с последующей короткой инкубацией, чтобы обеспечить ассоциацию шариков с биопленкой. Несвязанные шарики могут быть удалены путем промывки, а биопленка может быть визуализирована с потоком или без него. И наоборот, небольшое количество шариков может быть введено в одну сторону камеры, и их движение через биопленку и в ней можно отслеживать под действием потока. При использовании потока необходимо соблюдать осторожность при выборе настроек отслеживания бусин Mosaic (шаг 4.5). В текущих исследованиях динамика была броуновской. Расчеты MSD подтвердили, что движение, скорее всего, будет диффузионным, что делает броуновское движение подходящим параметром.
Окрашивание матрицей. В текущих исследованиях окрашивание Syto9 исследует клеточную плотность, а не плотность структуры биопленки. Например, присутствие амилоидов, вероятно, увеличивает плотность материала матрицы биопленки. Зависимость движения от плотности амилоида может быть определена с помощью флуоресцентных матричных красителей вместо Syto9.
Флуоресцентно меченые бактерии. Флуоресцентно меченые бактерии могут быть использованы для отслеживания перемещения экзогенных бактерий через биопленки (например, плазмидных бактерий). Проблема с флуоресцентно мечеными бактериями, такими как энтерококки, заключается в том, что они образуют одиночки, диплококки и короткие цепи, что усложняет возможность точного отслеживания бактерий. Этот процесс был бы проще, если бы бактерии имели одноклеточную морфологию.
Ограничения
Ограничения в визуализации траектории и сшивке.
Одним из ограничений метода является визуализация траектории и сшивка. Реконструированные и проанализированные траектории состоят из координат точек x, y, z, где последующие точки определяют линейный путь между этими точками. Визуализация таких кусочно-линейных траекторий может быть достигнута с помощью различных инструментов. Один из подходов заключался в использовании блокнотов Python и Jupyter вместе с плагинами Python, Pandas и Matplotlib. Несмотря нато, что в статье в Journal of Bacteriology, где эта методика была первоначально опубликована, стало возможным визуализировать отдельные существующие траектории, все еще существуют значительные ограничения, которые решаются в будущих исследованиях.
В настоящее время количество реконструированных траекторий больше, чем количество бусин в биопленке, а это означает, что несколько траекторий могут соответствовать одной бусине. Это может быть вызвано слабым конфокальным сигналом в одном кадре, когда Mosaic завершает траекторию и инициирует второй. Это может быть зарегистрировано в виде нескольких более коротких траекторий для одной бусины, особенно в менее вязких биопленках. Еще одной причиной большого количества траекторий является отсутствие сшивки траекторий. В частности, в биопленках оптического отверстия E. faecalis гранулы визуально остаются связанными с биопленкой во время визуализации (Дополнительное видео 2). Тем не менее, не было траекторий длиннее 10, и более 90% траекторий имели продолжительность жизни 5 кадров или меньше (Рисунок 3D). Если программное обеспечение используется для анализа только траекторий выше определенной длины (например, при трассировке клеток, способных передавать плазмиды), более короткие траектории могут быть автоматически удалены из набора данных. Однако есть и другие цели, для которых сшивание траекторий может быть очень важным. Наконец, невозможность отслеживать быстрое движение шариков по одной траектории может привести к увеличению количества траекторий в биопленках Enterobacteriaceae из-за быстрого движения в направлении Z, что приводит к образованию шариков эллиптической формы (рис. 2G). Возможность сшивания траекторий, нарушенных быстрым анизотропным движением, будет иметь важное значение для изучения влияния амилоидного матрикса завитков у энтеробактерий.
Значение
Был разработан вычислительный рабочий процесс для изучения траекторий швов для сравнения свойств материала 3D-биопленок. Рабочий процесс позволяет исследователям идентифицировать критические параметры, которые могут быть использованы при вычислительном моделировании гидродинамики в гетерогенных биопленках. С помощью этого анализатора гранул с открытым исходным кодом можно изучить влияние бактериальных амилоидных завитков на свойства материала, показав повышенную жесткость биопленочной матрицы из-за завитков. В более общем контексте оценщик может быть использован для изучения изменений в структуре биопленки, вызванных обработкой биопленки или различными условиями окружающей среды, такими как поток. Например, инструмент используется для анализа влияния лечения моноклональными антителами на разрушение биопленочных структур в сотрудничестве с лабораторией Tükel (LKSOM Temple University). Набор инструментов для оценки швов полностью адаптируется и расширяется модульным образом с помощью VRL-Studio для дальнейшего улучшения и расширения его функций.
Раскрытие информации
Авторам нечего раскрывать.
Благодарности
Работа в лабораториях GQ и BAB не получала специального гранта от какого-либо финансирующего агентства в государственном, коммерческом или некоммерческом секторах. Авторы выражают признательность Исааку Клэпперу, доктору философии (факультет математики, Университет Темпл) за полезную дискуссию, а также Чаглу Тюкель (факультет микробиологии и иммунологии, Университет Темпл) за экспертные знания в области энтеробактерий при первой публикации по этой методике.
Материалы
| Name | Company | Catalog Number | Comments |
| 96-well plates, No. 1.5 Uncoated Coverslip, 5 mm Glass Diameter | MatTek | P96G1.55F | |
| Fisherbrand Cover Glasses: Circles | Fisher Scientific | 12-293-232P | 1.5 optic glass coverslip |
| Invitrogen Syto 9 Green Fluorescent Nucleic Acid Stain | Invitrogen | S34854 | |
| Molecular Probes FluoSpheres Carboxylate-modified Microspheres, 1 um, crimson fluorescent (625/645) | Molecular Probes | F8816 |
Ссылки
- Huang, R., Li, M., Gregory, R. L. Bacterial interactions in dental biofilm. Virulence. 2, 435-444 (2011).
- Nadell, C. D., Drescher, K., Wingreen, N. S., Bassler, B. L. Extracellular matrix structure governs invasion resistance in bacterial biofilms. ISME Journal. 9, 1700-1709 (2015).
- Billings, N., Birjiniuk, A., Samad, T. S., Doyle, P. S., Ribbeck, K. Material properties of biofilms - key methods for understanding permeability and mechanics. Reports on Progress in Physics. 78, 036601 (2015).
- Araújo, G. R. d. e. S., Viana, N. B., Gómez, F., Pontes, B., Frases, S. The mechanical properties of microbial surfaces and biofilms. The Cell Surface. 5, 100028 (2019).
- Tallawi, M., Opitz, M., Lieleg, O. Modulation of the mechanical properties of bacterial biofilms in response to environmental challenges. Biomaterials Science. 5, 887-900 (2017).
- Tursi, S. A., Tükel, &. #. 1. 9. 9. ;. Curli-Containing Enteric Biofilms Inside and Out, Matrix Composition, Immune Recognition, and Disease Implications. Microbiology and Molecular Biology Reviews. 82, (2018).
- Dueholm, M. S., Albertsen, M., Otzen, D., Nielsen, P. H. Curli functional amyloid systems are phylogenetically widespread and display large diversity in operon and protein structure. PLoS One. 7 (12), 51274 (2012).
- Hung, C., et al. Escherichia coli biofilms have an organized and complex extracellular matrix structure. mBio. 4, 00645 (2013).
- Kikuchi, T., Mizunoe, Y., Takade, A., Naito, S., Yoshida, S. Curli fibers are required for development of biofilm architecture in Escherichia coli K-12 and enhance bacterial adherence to human uroepithelial cells. Microbiology and Immunology. 49, 875-884 (2005).
- Gallo, P. M., et al. Amyloid-DNA Composites of Bacterial Biofilms Stimulate Autoimmunity. Immunity. 42, 1171-1184 (2015).
- Serra, D. O., Richter, A. M., Hengge, R. Cellulose as an architectural element in spatially structured Escherichia coli biofilms. Journal of Bacteriology. 195, 5540-5554 (2013).
- Oh, Y. J. Characterization of curli A production on living bacterial surfaces by scanning probe microscopy. Biophysical Journal. 103, 1666-1671 (2012).
- Lembré, P., Di Martino, P., Vendrely, C. Amyloid peptides derived from CsgA and FapC modify the viscoelastic properties of biofilm model matrices. Biofouling. 30, 415-426 (2014).
- Oh, Y. J., et al. Curli mediate bacterial adhesion to fibronectin via tensile multiple bonds. Scientific Reports. 6, 33909 (2016).
- Vidakovic, L., Singh, P. K., Hartmann, R., Nadell, C. D., Drescher, K. Dynamic biofilm architecture confers individual and collective mechanisms of viral protection. Nature Microbiology. 3, 26-31 (2018).
- Tursi, S. A., et al. Salmonella Typhimurium biofilm disruption by a human antibody that binds a pan-amyloid epitope on curli. Nature Communications. 11, 1007 (2020).
- Perov, S., et al. Structural Insights into Curli CsgA Cross-β Fibril Architecture Inspire Repurposing of Anti-amyloid Compounds as Anti-biofilm Agents. PLOS Pathogens. 15 (8), 1007978 (2019).
- Taglialegna, A., et al. The biofilm-associated surface protein Esp of Enterococcus faecalis forms amyloid-like fibers. Npj Biofilms and Microbiomes. 6, 15 (2020).
- Gour, S., Kumar, V., Rana, M., Yadav, J. K. Pheromone peptide cOB1 from native Enterococcus faecalis forms amyloid-like structures, A new paradigm for peptide pheromones. Journal of Peptide Science. 25, 3178 (2019).
- Stoodley, P., Debeer, D., Lewandowski, Z. Liquid flow in biofilm systems. Applied and Environmental Microbiology. 60, 2711-2716 (1994).
- Birjiniuk, A., et al. Single particle tracking reveals spatial and dynamic organization of the E. coli biofilm matrix. New Journal of Physics. 16, 085014 (2014).
- Chew, S. C., et al. Dynamic remodeling of microbial biofilms by functionally distinct exopolysaccharides. mBio. 5, 01536 (2014).
- Cao, H., et al. Revealing region-specific biofilm viscoelastic properties by means of a micro-rheological approach. Npj Biofilms and Microbiomes. 2, 5 (2016).
- Galy, O., et al. Mapping of bacterial biofilm local mechanics by magnetic microparticle actuation. Biophysical Journal. 103, 1400-1408 (2012).
- Rogers, S. S., vander Walle, C., Waigh, T. A. Microrheology of bacterial biofilms in vitro, Staphylococcus aureus and Pseudomonas aeruginosa. Langmuir. 24, 13549-13555 (2008).
- Hart, J. W., Waigh, T. A., Lu, J. R., Roberts, I. S. Microrheology and Spatial Heterogeneity of Staphylococcus aureus Biofilms Modulated by Hydrodynamic Shear and Biofilm-Degrading Enzymes. Langmuir. 35 (9), 3553-3561 (2019).
- van Merode, A. E. J., van der Mei, H. C., Busscher, H. J., Krom, B. P. Influence of culture heterogeneity in cell surface charge on adhesion and biofilm formation by Enterococcus faecalis. Journal of Bacteriology. 188, 2421-2426 (2006).
- Tariq, M., Bruijs, C., Kok, J., Krom, B. P. Link between Culture Zeta Potential Homogeneity and Ebp in Enterococcus faecalis. Applied and Environmental Microbiology. 78, 2282-2288 (2012).
- Schneider, C. A., Rasband, W. S., Eliceiri, K. W. NIH Image to ImageJ, 25 years of image analysis. Nature Methods. 9, 671-675 (2012).
- . Oracle.com Available from: https://docs.oracle.com/en/java (2021)
- Hoffer, M., Poliwoda, C., Wittum, G. Visual reflection library, a framework for declarative GUI programming on the Java platform. Computing and Visualization in Science. 16, 181-192 (2013).
- Perov, S., et al. Structural Insights into Curli CsgA Cross-β Fibril Architecture Inspire Repurposing of Anti-amyloid Compounds as Anti-biofilm Agents. PLOS Pathogens. 15, 1007978 (2019).
- Malhotra, K., et al. Development of a New Bead Movement-Based Computational Framework Shows that Bacterial Amyloid Curli Reduces Bead Mobility in Biofilms. Journal of Bacteriology. 202, 00253 (2020).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены