Method Article
מסגרת חישובית מבוססת תנועת חרוזים לניתוח תלת מימדי של הטרוגניות חומר ביופילם
In This Article
Summary
אנו מתארים שיטה לניתוח וכימות דפוס התנועה של חרוזי קרבוקסילט של 1 מיקרומטר באמצעות ביופילמים חיידקיים הטרוגניים. ניתן להשתמש בהשוואה של דפוסי התנועה כדי לכמת את ההבדלים בתכונות החומר של ביופילמים.
Abstract
הבדלים בתכונות החומר של ביופילמים חיידקיים נצפו בביופילמים של מיני חיידקים שונים, בתוך אותו מין בתנאי גידול שונים ולאחר טיפול במולקולות משנות מטריצה. כדי לכמת טוב יותר את תכונות החומר של ביופילמים תלת-ממדיים, פותח ויושם תהליך עבודה ניסיוני וחישובי כדי לבחון את ההבדלים בין ביופילמים של Enterococcus faecalis, Salmonella enterica serotype Typhimurium ו-Escherichia coli , כמו גם את תפקידו של סלסול העמילואיד באישור קשיחות לביופילם של Enterobacteriaceae. הדינמיקה המרחבית-זמנית של חרוזי קרבוקסילט של 1 מיקרומטר בביופילמים נבדקה בביופילמים תלת-ממדיים של 20 מיקרומטר במשך 20 דקות. ערימות התמונות ה-4D עובדו באמצעות התוסף Mosaic ב-ImageJ כדי לייצר נתוני מסלול תלת מימדיים של תנועת חרוזים. נתוני מסלול אלה נותחו באמצעות ארגז כלים חדש שפותח על ידי Bead Evaluator, שבו נתוני תנועה, כולל תוחלת חיים של מסלול, מהירויות חרוזים, צפיפות תאים לאורך מסלולים ומידע על תיבה תוחמת חושבו ואוחסנו בקבצי csv. מאמר זה מציג את זרימת העבודה מהגדרת ניסוי והקלטת תמונה ועד לחישוב וניתוח מסלול חרוזים. המבנה של ביופילמים המכילים סלסולים הביא לאינטראקציות חרוזים יציבות יותר ופחות תנועת חרוזים מאשר בביופילמים מסולסלים ואנטרוקוקיים. תנועת החרוזים לא נראתה תלויה מאוד בצפיפות התא בעת מדידת מהירות החרוז ונפח התיבה התוחמת של המסלול, מה שתמך בהשערה שתכונות חומר אחרות של הביופילמים שולטות בדינמיקת החרוזים. טכניקה זו ישימה באופן נרחב לכימות הבדלים בביופילמים של הרכבי מטריצה שונים כמו גם ביופילמים לפני ואחרי טיפולים משני מטריצות.
Introduction
ביופילמים של חיידקים נמצאים בכל מקום כחלק מהמיקרוביוטה האנושית ומקיימים אינטראקציה רציפה עם מולקולות. המולקולות האלה נעות בגודלן מאנטיביוטיקה של 1 ננומטר וחיידקים בגודל 1-3 מ"מ ועד לחלקיקים גדולים יותר של סיבים במערכת העיכול. ההרכב של ביופילמים בודדים או רב-מינים משפיע על תכונות החומר ובכך על דפוס התנועה של חלקיקים דרך ביופילמים 1,2,3,4,5. דוגמה אחת היא עמילואידים חיידקיים, בעלי מבנה יריעות בטא צולב סיבי משומר6. תלתלי עמילואיד מתבטא על ידי חיידקי מעיים כגון Escherichia coli וסרוטיפ סלמונלה אנטריקה, טיפימוריום, וגנים זוהו במספר חיידקים אחרים7. תכונות חומר שונות של ביופילמים מושפעות מסלסול 8,9. Curli מקיים אינטראקציה ישירה עם רכיבים אחרים של המטריצה כגון DNA חוץ-תאי (eDNA) ותאית10,11. Curli מקיף את התאים ומשפיע על קשיחות קרום התא12 ועל התכונות הויסקו-אלסטיות הכוללות של הביופילם13. Curli מתווך חוזק מתיחה מוגבר על ידי קשירה לפיברונקטין, וכתוצאה מכך עלייה בהתקשרות חזקה של משטח זכוכית14. בקטריופאג'ים נכנסים נקשרים לתלתלים ומגבילים את פלישת הפאג'ים לביופילמים15.
בעת שימוש בשקופיות באר מצופות מרובות בדיקות לניתוח Enterococcus faecalis, E. coli ו-S. בעובי של כ-20 מיקרומטר. ביופילמים של טיפימוריום באמצעות מיקרוסקופיה קונפוקלית, הבדלים ברורים בין E. coli, S. ניתן היה לצפות בביופילמים של Typhimurium10,16 ו-E. faecalis (מחקר נוכחי). בעוד שלביופילמים של מיני Enterobacteriaceae הייתה רמה גבוהה של קשיחות ואזורים עם צפיפות תאית נמוכה היו קלים לצילום, השגת תמונות ברורות ברזולוציה גבוהה של ביופילמים של E. faecalis באמצעות ממוצע קו ומסגרת דרשה הפעלת לחץ על השקופית כדי לגרום למתח פנים מספיק ליציבות התא במהלך תהליך ההדמיה. עמילואידים חיידקיים כמו תלתלים יוצרים מבנים מסודרים מאוד, מה שמרמז על כך שהם עשויים להיות נוקשים יחסית17. זה הניע את ההשערה שעמילואיד תלתלים יכול לגרום לנוקשות ב-E. coli ו-S. ביופילמים של טיפימוריום. לא הייתה ראיה ברורה לכך ש-E. faecalis מבטא עמילואידים בתנאים שנחקרו. החלבון Esp, גן פילין הקשור לזנים פתוגניים יותר של E. faecalis, הוכח לאחרונה כמייצר מבני עמילואיד18; עם זאת, באמצעות חיפושי blastn ו-blastp, גן זה לא זוהה בזן E. faecalis מסוג קומנסל OG1RF ששימש במחקרים אלה. הפרומון cOB1, המיוצר על ידי OG1RF, יכול ליצור מבנים דמויי עמילואיד19. עם זאת, עם תנאי הגידול הנתונים של הביופילם ושיטות זיהוי העמילואיד ששימשו בעבר עבור S. צביעת עמילואידטיפימוריום 10 ב- E. faecalis, עמילואידים OG1RF לא ניתן היה לזהות (הנתונים לא הוצגו). טכניקת תמונה ארבע-ממדית חדשה (4D) פותחה כדי להשוות את תכונות החומר הכוללות בין E. faecalis, E. coli ו-S. Typhimurium הצמיגים, כמו גם כדי לקבוע את התרומה של עמילואיד לביופילם של Enterobacteriaceae באמצעות מוטציות עמילואיד של S. טיפימוריום ואי קולי.
בעבר, חרוזים פלואורסצנטיים שימשו בהצלחה לניתוח תכונות החומר של ביופילמים בשני מימדים (2D) באמצעות מיקרוריאולוגיה 20,21,22,23,24,25. ניתן ליישם זאת על ביופילם תלת מימדי על ידי חקר פרוסות אופטיות דו-ממדיות בעומקים שונים בביופילם26. הטכניקה הנוכחית פותחה כדי לעקוב אחר חרוזים בקנה מידה מיקרו של 1 מיקרומטר בתלת מימד לאורך זמן לשימוש במודלים 4D. חלק מהרציונל היה הרעיון הכללי של שימוש במודלים 4D כדי להבין תנועה של פלסמידים דרך קהילות מיקרוביוטה במערכת העיכול. נעשה שימוש בחרוזי קרבוקסילט טעונים פלואורסצנטיים בקוטר של 1 מיקרומטר מכיוון שאלו תואמים היטב, ביחס לגודל ולמטען, ל- E. faecalis, אורגניזם המודל הנבחר לתנועה ותחזוקה של פלסמיד27, 28. פותחה בדיקה 4D לכימות התכונות הפיזיקליות של ביופילמים (איור 1A). במתודולוגיה שהומצאה, חרוזים נוספו לביופילמים ומסלולם המרחבי-זמני נרשם באמצעות ביופילמים בעובי 10-20 מיקרומטר במהלך 10-20 דקות. מסלולי חרוזים בתלת מימד כומתו לאחר מכן במונחים של אורך מסלול, מהירות חרוז, נפח תיבה תוחמת מסלול (תיבה מינימלית המכילה את המסלול), וצפיפות תאית תיבה תוחמת באמצעות ארגז כלים שפותח לאחרונה. ניתן להשתמש בפרוטוקול הבא כדי ליצור נתוני תמונה 4D של חיידקים וחרוזים המכילים ביופילמים, לעבד מראש את הנתונים עם ImageJ29 והתוסף Mosaic, ולנתח מסלולי חרוזים עם ארגז כלים של מעריך חרוזים.
לטכניקה זו יישומים מרובים לבחינת תכונות החומר וכן למעקב אחר תנועת חלקיקים וחיידקים בתלת מימד. לדוגמה, גרסה מוקדמת של טכניקה זו שימשה כדי לאפיין את ההשפעה של נוגדנים חד-שבטיים המכוונים נגד תלתלים על השלמות המבנית של ביופילמים16. לגרסה המלאה יש כלים מרובים כדי לספק ניתוח מפורט יותר של תכונות חומר הביופילם והיא ממשיכה לשמש לבחינת ההשפעות של טיפול בנוגדנים חד שבטיים על ביופילמים. ניתן להשתמש בחלקיקים בעלי מטענים שונים כדי לבחון את תכונות המטען החומרי של הביופילמים ותנועת החלקיקים דרך ביופילמים עם הרכבי מטריצה שונים. זה יכול לשמש כדי להשוות את התוצאות ממיקרוריאולוגיה דו-ממדית שחושפות את תכונות החומר האחראיות לתנועת חרוזים שראינו בביופילמים שלא היו תחת זרימה. ניתן להשתמש בטכניקה זו גם על ביופילמים של מינים מעורבים עם אזורים בעלי הרכב ביופילם שונה. ניתן לדמות ביופילמים חיים תחת זרימה במכשירים מיקרופלואידיים ותאי זרימה כדי לבחון שינויים בתכונות החומר בין ביופילמים סטטיים לזרימה וכן את השפעת הזרימה על תנועת החלקיקים. ניתן ליישם את הטכניקות גם על חיידקים בעלי תווית פלואורסצנטית כדי לאפיין את התנועה של חיידקים אקסוגניים דרך קהילת ביופילם. באמצעות שלושה צבעים, ניתן להשתמש בחיידקי תורם המסומנים בפלואורסצנט, חיידקי נמען המסומנים בפלואורסצנט ופלסמידים המסומנים בפלואורסצנט כדי לעקוב אחר תנועה, עגינה והעברה של פלסמידים.
Protocol
1. הכנת ביופילם
הערה: ניתן לגדל ביופילמים לניתוח בכל שיטה המאפשרת לביופילם להיווצר על משטח זכוכית אופטית. מבנה הביופילם צריך להיצמד למשטח האופטי מספיק כדי שהמבנה לא יופרע במהלך שלבי הכביסה ו/או ההרכבה של הפרוטוקול. להלן מתאר את הטכניקה עבור לוחות תחתונים אופטיים של 96 בארות וכיסויי זכוכית 12 מ"מ בצלחות של 24 בארות. אפשרויות אחרות כוללות לוחות תחתונים אופטיים בגדלים שונים ותאי זרימה אופטיים עם ובלי זרימה.
- הגדרת ביופילם
- הוסף מדיום גידול חיידקים לבארות הצלחת. עבור מחקר זה, עבור E. פאקאליס, הוסף 2 מ"ל של טוד-יואיט (TH) לצלחת של 24 בארות והוסף 0.4 מ"ל של TH ללוחות 96 בארות תחתונים אופטיים. עבור ס. טיפימוריום, אי קולי והמוטציות האיזוגניות csgAB curli מוסיפים 0.7 מ"ל של מרק לוריא ללא מלח (LB) לבארות. אם אתה משתמש בתאים תחתונים אופטיים, המשך לשלב 1.2.
- מניחים כיסויים אופטיים מזכוכית 12 מ"מ #1.5 בצלחת פטרי ומכסים אותם באתנול.
- בעזרת מלקחיים, הסר את הכיסוי והשתמש בלהבה כדי להדליק את האלכוהול שנותר באש. הניחו לאלכוהול להישרף. פשוט השתמש בלהבה כדי להדליק אותם; אל תחזיק את הכיסוי בלהבה כי הוא ייסדק. הניחו לכיסוי להתקרר במשך 10-20 שניות לפני שמכניסים אותו לבאר כדי למנוע סדקים.
- הנח את הכיסויהחלקה לבאר המכילה את המדיום בזווית כדי למנוע את הנחתו על גבי המדיום. אל תוסיף את הכיסוי לבאר יבשה ולאחר מכן תוסיף בינוני כי זה יגרום לכיסוי להידבק לתחתית הבאר.
- השתמש בקצה פיפטה סטרילי כדי לדחוף בזהירות את הכיסוי לתחתית הבאר המכילה את המדיום.
הערה: זכור להתאים את העובי (#1 או #1.5) של כיסוי הזכוכית האופטית או הצלחת התחתונה האופטית לעובי האופטיקה של המיקרוסקופ הקונפוקלי.
- לדגור את הביופילם בתנאים מתאימים לצמיחת ביופילם. במחקרים אלה, גדלו ביופילמים של E. faecalis כתרביות סטטיות ב-37 מעלות צלזיוס וגידלו ביופילמים של E. coli באופן אירובי ב-30 מעלות צלזיוס.
- במחקרים אלה, גדלו ביופילמים של E. faecalis במשך יומיים עם מתגים בינוניים בבוקר ובשעות הערב המוקדמות. כדי למנוע נזק או עקירה של הביופילם, הטה בזהירות את הצלחת. הניחו את קצה הפיפטה ליד הקצה התחתון של הבאר ושלפו לאט את המדיום. הוסף את המ"ל הראשון של מדיום טרי באותו אופן. הוסף את המ"ל השני לאט ליד ממשק המדיום/באר.
- במחקרים אלה, השתמש בתנאי גידול לייצור תלתלים אופטימלי. לגדול S. ביופילמים של טיפימוריום בטמפרטורה של 28 מעלות צלזיוס במשך 6-8 ימים דגרו על שיפוע שאפשר לביופילם להיצמד כ-2/3 מהדרך במעלה המגלשה ואז לגדול כפליקל על ממשק האוויר-נוזל. זה נעשה ללא שינוי בינוני. כדי למנוע את התייבשות המדיום, הניחו את צלחת 24 הבארות בתא עם מחבת מים.
2. הדמיה 4D
- הכנת תושבת הביופילם
- חרוזי ארגמן מדולל 1 מיקרומטר קרבוקסילט FluoSpheres 1:50 ב-PBS (2 x 107 חרוזים ב-1 מ"ל של PBS). אם משתמשים בתאים תחתונים אופטיים, הוסף את Syto9 בדילול של 1 מיקרוליטר עד 300 מיקרוליטר של הכנת חרוזים.
- (אופציונלי) שטפו את הביופילם כדי להסיר עקבות של מצע הגידול אם למצע הגידול יש אוטופלואורסצנטיות. בניסויים אלה יש לשטוף פעמיים עם 1 מ"ל PBS, להטות בזהירות את הצלחת, להניח את קצה הפיפטה ליד הקצה התחתון של הבאר ולאט לאט החוצה את המדיום. הוסף PBS על ידי הנחת הקצה ליד הקצה התחתון ומלא לאט את הבאר. השתמש בטכניקה זו על בארות תחתונות אופטיות בנוסף להחלקות כיסוי בצלחת של 24 בארות.
- הסר מדיום או PBS. הוסף לביופילם חרוזי ארגמן מדוללים שהוכנו ב-2.1.1. במחקרים אלה, הוסף 1 מ"ל חרוזים (2x107) לכיסויים ו-0.2 מ"ל חרוזים (4x106) ו-Syto9 ללוחות תחתונים אופטיים של 96 בארות.
- דגירה למשך דקה אחת בטמפרטורת החדר כדי לאפשר שיוך חרוזים.
- הסר חרוזים ושטוף בעדינות את הביופילם פעם אחת עם PBS כדי להסיר חרוזים לא קשורים. במחקרים אלה, עבור הכיסוי, יש לשטוף בעדינות עם 1 מ"ל PBS, למלא את הבאר ב -1 מ"ל PBS ולהמשיך ל -2.1.6. עבור הלוחות התחתונים האופטיים של 96 בארות, שטפו בעדינות את הביופילם עם 0.2 מ"ל PBS ומלאו את הבאר ב-0.2 מ"ל PBS. החדר התחתון האופטי מוכן כעת לצילום, אז המשך לשלב 2.2.
- (אם משתמשים בכיסוי) הוסף 1 מיקרוליטר של Syto9 (כתם DNA פלואורסצנטי ירוק; מדולל לפי הוראות היצרן) למרכז באר על שקופית מרובת בדיקות מצופה של 10 בארות. לכיסויים מצופים אלה יש עומק באר של 23-25 מיקרומטר.
- (אם משתמשים בכיסוי) בעזרת מלקחיים מעוקרים להבת אלכוהול, הסר בזהירות את הכיסוי מהבאר והפוך על הבאר המכילה את טיפת Syto9. השארת הכיסוי ב-1 מ"ל של PBS מקלה על הוצאתו מהבאר ועוזרת לשטוף חרוזים לא משויכים מהביופילם.
- (אם משתמשים בכיסוי) אטום בזהירות את הכיסוי עם לק אצבע מבלי להחליק או ללחוץ כלפי מטה על הכיסוי, מה שעלול לגרום למתח פנים שיעצור את התנועה בביופילמים צמיגים יותר ופחות נוקשים.
- (אם משתמשים בכיסוי) הניחו ללק להתייבש. נגב בזהירות את המשטח החיצוני של הכיסוי עם 70% אתנול. נגב מבלי להפעיל לחץ כלשהו על הכיסוי מהסיבות שצוינו לעיל.
- הדמיה קונפוקלית
הערה: במחקרים אלה, השתמש במיקרוסקופ קונפוקלי לסריקת לייזר הדמיה ספקטרלית הפוכה המצויד במערכת קונפוקלית TCS עם המטרה 63x. ההיקף ישמש ליצירת וידאו 4D (איור 1). הביופילם התלת-ממדי יהיה מורכב מפרוסות Z שנלכדו בשלבים של 0.5 מיקרומטר דרך ביופילמים בעובי 18-20 מיקרומטר, וייצרו 36-40 פרוסות Z. כל ביופילם תלת-ממדי ייקח 50-60 שניות ללכוד. הפרוסות יחד יהוו מסגרת, שניתן לדמיין כביופילם תלת מימדי. תהליך זה יחזור על עצמו 20 פעמים כדי ליצור את סרטון ה-4D Time lapse למשך זמן מעקב כולל של 18-20 דקות.- הגדר את הטווח ללכידת פלואורופורים. במחקרים אלה, עוררו את Syto9 (צביעת DNA חיידקי) עם לייזר של 488 ננומטר ומדדו פליטה מ-495 עד 540 ננומטר (ה-Leica Sp5 הוא מיקרוסקופ הדמיה ספקטרלי). לרגש חרוזי ארגמן (אדום) עם לייזר של 633 ננומטר ולמדוד פליטה מ-650 ננומטר ל-700 ננומטר. ניתן לכוונן את הגדרות הפלואורופור הללו כדי ללכוד כל פלואורופור רצוי.
- בחר את מצב ההדמיה xyzt.
- זהה אזור של הביופילם עם תערובת של אזורים בצפיפות גבוהה ונמוכה יותר כדי ללכוד הבדלים בתכונות ויסקו-אלסטיות באזורים עבים ודקים של הביופילם.
- הגדר ערימת Z בעובי 18-20 מיקרומטר. בביופילם המותקן על כיסוי, הימנע מהחלק העליון והתחתון של הביופילם לגעת בזכוכית כדי למנוע חפצי לכידת חרוזים (ראה דיון).
- התאם את הרווח וההיסט כדי להשתמש בכל הטווח הדינמי של העוצמה בנקודה הבהירה ביותר של הביופילם. זה ממזער את חפיפת האותות משכבות נמוכות יותר של הביופילם.
- הגדר את עובי הפרוסה ל -0.5 מיקרומטר. זה מאפשר הדמיה מהירה ללא אובדן מידע על חרוזים.
- הגדר את הרזולוציה ל- 512 x 512 (0.48 μm). זה מאפשר הדמיה מהירה אך מייצר תמונות ברזולוציה מספקת כדי לראות את מבנה הביופילם ופרטי תנועת החרוזים.
- צמצם את זמן ההדמיה.
- הגדר ללכוד 20 ערימות.
- שמור כ- .lif (או קובץ קונפוקלי דומה). ניתן ליצור את סרט ה-4D ב-ImageJ.
3. יצירת סרטון הביופילם 4D עם ImageJ
- פתח את קובץ ה- .lif ב- ImageJ עם ההגדרות הבאות: הצג מחסנית עם Hyperstack, סדר מחסנית XYCZT, מצב צבע: צבעוני, קנה מידה אוטומטי מסומן. לאחר מכן לחץ על אישור.
- בחר תמונה > צבע > פיצול ערוצים.
- בחר תמונה > צבע > מיזוג ערוצים > צור הפרדות צבע > אישור.
- בחר תוספים > מציג תלת-ממד > ערוצים בטל את הסימון הכחול > אישור.
- בחר Edit > Show content marked > Show bounding box מסומנת.
- השתמש בלחיצה והחזקה של העכבר כדי לבחור את התמונה. לאחר מכן סובב את התמונה תוך כדי לחיצה ממושכת על כפתור הלחיצה. סובב את התמונה כך שתחתית הביופילם תהיה בתחתית והזווית תומכת בהדמיית החרוזים. לאחר מכן שחרר את התמונה.
- לחץ על כפתור ההקלטה האדום בתחתית החלון כדי להקליט סרטון.
- שמור כקובץ .avi באמצעות jpeg כדחיסה.
4. הפקת נתוני מסלול
- התקן את כלי הקוד הפתוח ImageJ (https://imagej.net/Fiji) ואת תוסף מעקב החלקיקים Mosaic (https://imagej.net/MOSAICsuite).
- ייבא את קובץ ה- .lif המכיל את שני הערוצים עבור חרוזים וחיידקים. פצלו את הערוצים ושמרו את הקבצים בנפרד.
- ב- ImageJ, אחסן את גודל הווקסל של התמונה (מידות x, y ו- z) ואת גודל צעד הזמן בקובץ טקסט.
- ב-ImageJ, עבור אל תוספים | פסיפס והפעל את Particle Tracker 2D/3D.
- הזן את הפרמטרים הבאים: רדיוס: 3, חתך: 0.003, פר/ABS: 0.12, טווח קישור: 2, תזוזה: 10.00 עם הדינמיקה המוגדרת ב-Brownian. אנא ראה תוצאות לרציונל מאחורי הבחירה בבראוניאן בניסויים אלה.
- צור מסלולים וייצא את רשימת המסלולים כקבצי .csv.
5. ניתוח מסלולים
- התקנת VRL Studio (https://vrl-studio.mihosoft.eu)
- הורד את פרויקט Biofilm (https:// neurobox3d.github.io/Biofilm/) והפעל ב-VRL Studio
- טען את קובץ המסלול ב- ImportData
- ציין את גודל הפיקסלים x, y ו- z (השתמש ב- ImageJ לאיתור ערכים אלה) ב- ProcessTrajectories.
- ציין את מרווח המסגרות ב- ComputeVelocity (השתמש ב- ImageJ כדי לאתר ערך זה).
- טען את קובץ ה-tiff החיידקי (ראה שלב 3.2) ב-Comdensity.
- הגדר נתיבי פלט עבור נתוני מהירות ב- SaveVelocityDataToFile ונתוני מסלול ב- SaveTrajectoryDataToFile.
- הפעל את SaveVelocityDataToFile ו- SaveTrajectoryDataToFile.
- ייבוא נתונים ל- Excel לצורך ניתוח. נתונים אלה יכללו אורכי מסלול, תוחלת חיים של מסלול, מידות ונפחים של תיבה תוחמת מסלול, מהירויות ושונות ממוצעות של חרוזים. הניתוח מחשב משתנים משוקללים באמצעות הערוץ עבור חיידקים מסומנים ב-Syto9 כדי לחשב את צפיפות התאים המקומית (בתוך תיבות תוחמות מסלול נתונות). הניתוח מביא לחישוב מהירויות ושונות ממוצעות משוקללות, כמו גם ממוצעים משוקללים ושונות של שונות תיבה תוחמת.
תוצאות
שיטה זו שימשה לבדיקת ההשערה כי תלתלים עשויים להעניק קשיחות ל-E. coli ו-S. ביופילמים של טיפימוריום, הפחתת תנועת החרוזים במהלך ניסויי מיקרוסקופיה קונפוקלית. ארגז הכלים הנוכחי שימש להשוואת תכונות החומר של זן OG1RF מסוג Enterococcus faecalis לסרוטיפ סלמונלה אנטריקה, E. coli, והמוטציות האיזוגניות שלהם (איור 1B וסרטון משלים 1, סרטון משלים 2, סרטון משלים 3, סרטון משלים 4, סרטון משלים 5, סרטון משלים 6). תכונות חומר הביופילם עשויות להיות שונות ביחס לקשיחות (למשל, סלסולים הקשורים ל-eDNA) או אינטראקציות אלקטרוסטטיות והידרופוביות בין החרוזים הטעונים שלילית לבין תאי הביופילם וחומרי המטריצה כמו גם צפיפות התאים.
יכולת שחזור
ארגז הכלים של הביופילם תוכנן ב-Groovy30 ו-Java31 בתוך VRL-Studio32 ומאפשר עיצוב זרימת עבודה מודולרי עם יצירה אוטומטית של ממשק משתמש (UI) של כל הרכיבים החישוביים. זה איפשר זרימת עבודה אוטומטית, תוך הסרת הטיה לא מכוונת הנגרמת על ידי הנסיין בעת ניתוח התוצאות.
שימוש ב-MSD לאישור סוג התנועה בביופילמים
לניתוח מסלולים באמצעות Particle Tracker 2D/3D, קיימות הגדרות דינמיקה שונות לניתוח סוגי תנועות חרוזים שונים. עבור מחקרים אלה, נבחרה ההגדרה "תנועה בראונית" (כלומר, תנועה מונעת דיפוזיה) מכיוון ש-E. faecalis הוא חיידק לא תנועתי, E. coli וסלמונלה אינם מבטאים דגלים בביופילמים, והניסויים בוצעו במערכת סגורה בהיעדר זרימה. הגדרה זו יכולה להיות מאומתת עוד יותר על ידי התזוזה הריבועית הממוצעת המחושבת (MSD) של החרוזים. באמצעות ההגדרה 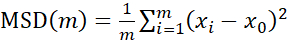 כאשר m הוא מספר מקטעי המסלול, ניתן לחשב את השינוי של ה-MSD במהלך כל מסלול. מסלולים ליניאריים מצביעים על תנועת חרוזים דיפוזית (איור 2A). באמצעות התאמת ריבועים מינימליים ריבועיים, חושב דפוס התנועה הממוצע של כל החרוזים בביופילם, המראה סדר ליניארי דומיננטי ואימות דיפוזיה פסיבית ככוח המניע (איור 2A-2F).
כאשר m הוא מספר מקטעי המסלול, ניתן לחשב את השינוי של ה-MSD במהלך כל מסלול. מסלולים ליניאריים מצביעים על תנועת חרוזים דיפוזית (איור 2A). באמצעות התאמת ריבועים מינימליים ריבועיים, חושב דפוס התנועה הממוצע של כל החרוזים בביופילם, המראה סדר ליניארי דומיננטי ואימות דיפוזיה פסיבית ככוח המניע (איור 2A-2F).
ניתוח תיבה תוחמת.
ארגז הכלים משתמש ב-ImageJ Mosaic וב-Particle Tracker 2D/3D כדי ליצור מסלולים (שלב 4) ולאחר מכן באמצעות צינור ניתוח הביופילם האוטומטי, מייצר נתונים חשובים על מסלולי החרוזים שניתן להשתמש בהם כדי להשוות את תכונות חומר הביופילם. נפח התיבה התוחמת במיקרומטר3 נמדד על ידי בניית התיבה המינימלית המכילה מסלול ומדידת נפחה (איור 3).
לביופילם של E. faecalis יש יותר תנועת חרוזים עם ערכי קופסה תוחמת של 1-6000 מיקרומטר3 (איור 3B, 3C ו-3D). התוצאות מאשרות שהתנועה הנראית בכיסוי זכוכית המותקנת על שקופית מצופה עם באר מצופה של כ-25 מיקרומטר (איור 3C) לעומת ביופילמים הגדלים בתחתית בארות זכוכית אופטיות ומצולמים ישירות (איור 3D) מניבים תוצאות שוות ערך עם מעט הבדלים. ההבדל היחיד היה שליד החלק העליון של הכיסוי המותקן של ביופילמים של E. faecalis ניתן היה לרשום מסלולים יציבים עם תוחלת חיים של יותר מ-10 דקות, אך באותו זמן ניתן היה לרשום תיבות תוחמות קטנות, בעוד שבלוח התחתון האופטי ניתן היה לרשום מספר נבחר של חרוזים בעלי ניידות גבוהה יותר. יחד, זה מצביע על כך שהרכבת מגלשת הזכוכית עשויה לשנות את מתח הפנים של המערכת בחלק העליון של הביופילם כנגד המגלשה בביופילם הכיסוי המורכב, מה שבסופו של דבר הפחית את הניידות של חלק מהחרוזים באזורי ביופילם פחות צמיגים (איור 3B, 3C, 3D ו-3I). המסלולים שנופלים לקטגוריה הזו היו במקרה אחוז קטן מאוד, ואפילו עם המספר הקטן הזה של חרוזים לכודים, ה-MSD הממוצע של E. faecalis על כיסוי רכוב היה מעט גבוה יותר מה-MSD שחושב מביופילם של לוח תחתון אופטי (איור 3).
ס. למסלולי חרוזי טיפימוריום ואי קולי היו נפחי תיבות תוחמים קטנים יותר של 0-10 מיקרומטר3 (איור 3A, 3B, 3E ו-3F), בהשוואה למוטנטים תלתלים איזוגניים עם תיבות תוחמות של 1-6000 מיקרומטר3 עבור E. coli ו-1-5000 מיקרומטר3 עבור S. טיפימוריום (איור 3A, 3B, 3F ו-3H), המדגים ניידות חרוזים גדולה יותר. תוצאות אלה הצביעו על כך שנוכחות העמילואיד הייתה בקורלציה עם קשיחות מוגברת בביופילמים והייתה עקבית עם היעדר תנועת ביופילם בולטת בסרטונים. נפחי התיבה התוחמת היו קטנים באופן עקבי (0-10 מיקרומטרמעוקב) אפילו באזורים בעלי צפיפות נמוכה של הביופילם. תצפית זו עולה בקנה אחד עם תצפיות קודמות שלפיהן תלתלים יכולים להיות נוכחים באזורים בעלי צפיפות תאים נמוכה של הביופילם10.
לא ניתן היה להשוות את ההתנהגות של ביופילמים של Enterobacteriaceae על לוחות תחתונים אופטיים מכיוון שהם גדלים כפליקלים על ממשק האוויר-נוזל (שלב 1.2.2). בעת שימוש בכיסוי, הפליקל מחובר לכיסוי בממשק וכאשר הכיסוי הוסר הפליקל מונח על הכיסוי ויוצר משטח תמונה יחיד. בצלחת תחתונה אופטית שגדלה בשיפוע, ההדמיה נעשתה עם נוזל שעדיין נמצא בבאר. משמעות הדבר היא שהפליקל עדיין צף מעל החלק התחתון האופטי ויוצר את הפליקל מעומק העבודה של היקף הפוך כמו Leica Sp5. הסרת מספיק מדיום כדי להביא את הביופילם לעומק העבודה של המיקרוסקופ גרמה לדגימה להתייבש במהלך תהליך ההדמיה של 20 דקות.
בסך הכל, התרשימים מאשרים את התצפיות החזותיות בסרטים המשלימים ועולים בקנה אחד עם ההבדלים ב-MSD שנצפו (איור 3I ו-3J).
תוחלת חיים של מסלול
תוחלת החיים של המסלול נמדדה כמספר הפריימים הרצופים שבהם נרשם חרוז (איור 3).
בביופילמים הצמיגים יותר, דמויי הנוזל, לכל החרוזים הייתה תוחלת חיים קצרה מ-10 דקות, ורוב המסלולים נעו בין 2-5 דקות עבור ביופילמים של E. faecalis . עם זאת, ניתן לאתר חרוזים עם תוחלת חיים קצרה רשומה על ידי בדיקה ויזואלית בביופילמים של E. faecalis לאורך חלון זמן ההדמיה הכולל (סרטון משלים 1 ו-2). לפיכך, ייתכן שחרוזים נעים לאורך מסלול רשום, מתנתקים לסירוגין מהביופילם ומסיימים מסלול, ומתחברים מחדש לביופילם, ואז מתחיל מסלול חדש. זה יוביל בסופו של דבר לתוחלת חיים קצרה במסלול תחת נוכחות מתמשכת של חרוזים בביופילם. חשוב לציין שבאמצעות טכניקה זו, תוחלת החיים של המסלול, במיוחד בביופילם צמיג, נוטה להמעיט בהערכת הזמן הכולל שחרוז קשור לביופילם
ב-S. ביופילמים של טיפימוריום, שהיו בעלי נפחי קופסה תוחמים קטנים יותר, לרוב החרוזים (כ-80%) היו תוחלת חיים ארוכה של 16-20 פריימים, המקבילים לכ-15-20 דקות בזמן אמת (איור 3A, 3G ו-3H). בניגוד לאלה, ביופילמים מוטנטיים איזוגניים נשאו יותר חרוזים ניידים עם נפחי קופסה תוחמים שנעו בין 1-6000 מיקרומטר3 (E. coli) ל-1-5000 מיקרומטר3 (S. טיפימוריום) (איור 3A, 3B, 3F ו-3H). בניגוד לביופילמים של E. faecalis עם מסלולים של >70% בעלי נפחי קופסה תוחמים גדולים מ-10 מיקרומטרמעוקב, ביופילמים של מיני Enterobacteriaceae רשמו רק 30% מסלולי חרוזים עם נפחי קופסה תוחמת מעל 10 מיקרומטר3. אף על פי שתוחלת החיים הכוללת של מסלול החרוזים הייתה קטנה יותר בביופילמים מוטנטיים מסולסלים, חלק מהמסלולים שיקפו תנועת חרוזים משמעותית ותוחלת חיים ארוכה (איור 3H). תצפית זו יכולה להצביע על כך ששונות זו עשויה להתאים לתכונות שונות של חומר ביופילם, כגון ויסקואלסטיות, ו/או שינויים כימיים על פני החלקיקים כגון מטען.
ניתוח אורכי מסלול חרוזים ומהירויות
אורך המסלול הוא מדידה של המרחק שעוברים חרוזים במיקרומטר. מדידה זו עולה בקנה אחד עם מהירות תנועת החרוזים במיקרומטר לשנייה. בהתאם לנפחי הקופסה התוחמת הגדולים יותר, לחרוזים בביופילמים של E. faecalis היו מסלולים ארוכים פי 10, 5-20 מיקרומטר, לעומת <4 מיקרומטר בביופילמים המכילים סלסולים. עקבי עם המסלולים הקצרים יותר (איור 4A). חרוזי E. faecalis מדדו מהירויות גבוהות עד פי 15 כאשר לרוב החרוזים יש מהירויות בטווח של 0.01-0.15 מיקרומטר לשנייה לעומת מהירויות <0.006 מיקרומטר לשנייה (איור 4B). אף על פי כן, ביופילמים מוטנטיים של curli מדדו מהירויות נמוכות יותר ומסלולים קצרים יותר בהשוואה לביופילמים של E. faecalis , אך מסלולים ארוכים יותר ומהירויות גבוהות יותר מאשר ה-curli המכיל זנים הוריים (איור 4A ו-4B).
ראויה לציון העובדה שהמבנה דמוי הסריג הסיבי של curli30 עשוי להשפיע על הניידות בצורה אנאיזוטרופית, להפחית את התנועה במישור ה-xy ולאפשר ניידות מוגברת בכיוון z (איור 2G). מאגר המסלול הגדול (כ-800) השייך לכ-50 חרוזים ייחודיים בביופילמים המכילים סלסולים יעלה בקנה אחד עם המגבלות של מעקב אחר חלקיקי פסיפס, ויספור כל אחד מהחרוזים הנעים במהירות כחרוז יחיד ב-x, y ו-z. יהיה צורך במחקר נוסף ופיתוח תוכנה כדי לאשר תצפית זו.
ניתוח התלות בתנועת החרוזים בצפיפות התאים
התלות של תנועת החרוזים בצפיפות התא נקבעה על ידי שימוש במהירויות ושונות ממוצעות משוקללות, כמו גם ממוצעים/ממוצעים משוקללים ושונות של נפחי תיבות תוחמות. ערוץ ההדמיה השני עבור חיידקים המסומנים ב-Syto9 שימש לחישוב צפיפות התאים המקומית בחישוב מהירויות משוקללות. הצפיפות התאית חושבה על ידי חישוב ממוצע נתוני הווקסל של Syto9 על פני התיבה התוחמת של כל קצה מסלול (איור 5, מימין). לפיכך, ניתן לשקלל את מהירות החרוז על ידי צפיפות התאים (המקומית). ישנם מספר סוגים של כתמים שניתן להשתמש בהם כדי להמחיש חיידקים, כולל כתמים לדופן התא, ממברנות ותכולת DNA. כדי לקבוע את צפיפות הסלולר, Syto9 נבחר מכיוון שהוא נותן את האות העקבי ביותר, לא משנה איזו פרוסת Z אופטית מוצגת. כתמי מעטפת (דופן התא והממברנה) יתנו אות שונה בהתאם למיקום פרוסת Z. אם פרוסת Z כוללת את החלק העליון או התחתון של התא, האות יהיה חזק יותר מאשר אם פרוסת Z נמצאת דרך אמצע התא שבו רק קווי המתאר של התא מוכתמים.
מסלולי החרוזים מהתעלה האדומה היו במעקב עבור 20 פריימים, כאשר למסלולים בודדים הייתה תוחלת חיים מינימלית של 2 פריימים ומקסימום 20 פריימים עם 19 מקטעי מסלול המחברים את המסגרות (איור 5). כדי לחקור את התלות בצפיפות התאים של ניידות החרוזים, נקבעה עוצמת ה-GFP לווקסל (כל אחת מהמדידות הבודדות בתמונת הווקסל 512x512). צפיפות התאים סביב כל קטע במסלול החרוז חושבה כצפיפות הממוצעת המקומית בתיבה התוחמת של הקטע.
עבור חלק מהביופילמים, ניתן לתעד תלות בצפיפות מובהקת סטטיסטית (איור 6), הבולטת ביותר עבור ביופילמים של E. faecalis שגודלו על כיסוי זכוכית והוהפכו על שקופית מרובת בארות (איור 6A). להיפך, ביופילמים של E. faecalis שגודלו על קרקעית צלחת של 96 בארות (איור 6B) לא הראו תלות בצפיפות. לסיכום, זה מצביע על כך שביופילם E. faecalis נוזלי מאוד יכול להיות דחוס מעט עקב ההרכבה על מגלשה מרובת בארות, מה שעולה בקנה אחד עם הפחתה במספר החרוזים שנעים מהר יותר ואלה עם נפחי קופסה תוחמים קטנים שנלכדים בחלק העליון של הביופילם כנגד מגלשת הזכוכית (איור 3C לעומת איור 3D). גם הביופילמים של סלמונלה וגם של E. coli (איור 6, C ו-6D) והמוטציות האיזוגניות שלהם (איור 6E ו-6F) הראו תלות מינורית עד ללא צפיפות תאית.
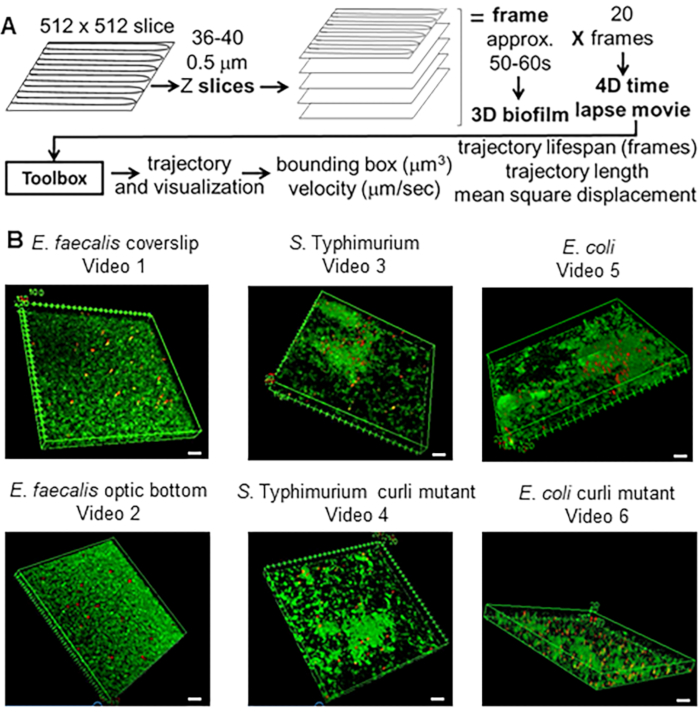
איור 1. צינור הדמיה וניתוח (שלבים 2-4) (A) ביופילמים מצולמים כמתואר ב-2.2. באמצעות הביופילמים המצולם (ראו 3) נוצרו מסלולי חרוזים כמתואר ב-4. באמצעות המסלולים חושבו נתונים רלוונטיים עם ארגז הכלים לניתוח (ראה 5) (B) ביופילמים גודלו כמתואר בשלב 1 על תלושי כיסוי (E. faecalis, וידאו 1), S. טיפימוריום (וידאו 3), E. coli (וידאו 5) ומוטציות מסולסלות איזוגניות (וידאו 4, וידאו 6) או בצלחת תחתונה אופטית של 96 בארות (E. faecalis bottom, וידאו 2). סרגל הסולם הלבן הוא 20 מ"מ. נתון זה משוכפל באישור (31). אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
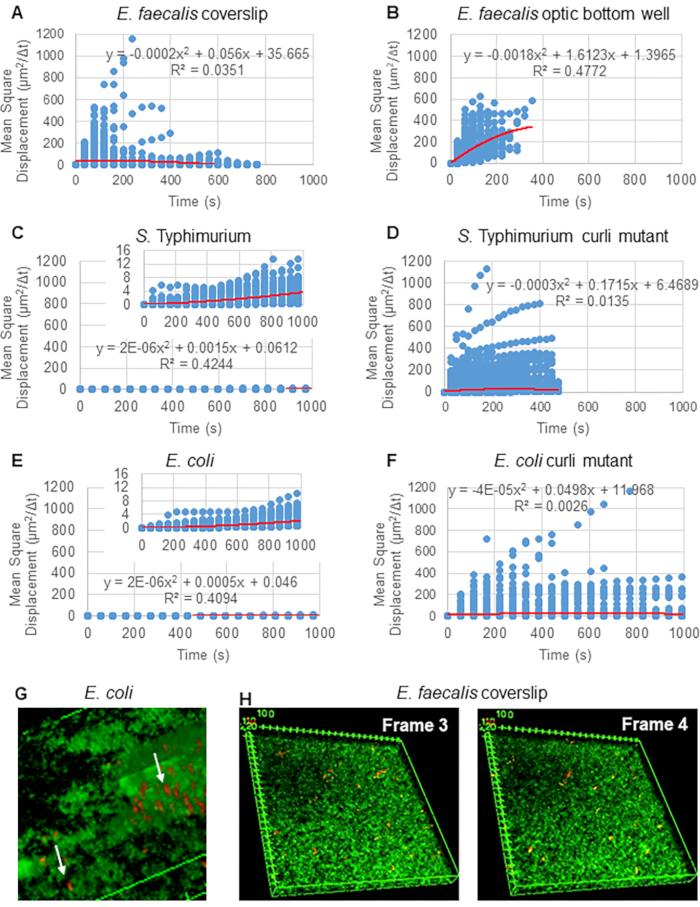
איור 2. תנועת החרוזים בביופילמים נקבעה כדיפוזית בטבעה (תנועה בראונית, ראה שלב 5) (A-F) נתוני MSD מראים התנהגות ליניארית (קו אדום) כדי לאמת תנועה בראונית. ביופילמים גודלו לפי שלב 1 (G) דוגמה לתנועת חרוזים אליפטיים שנצפתה בביופילמים של E. coli ו-S. Typhimurium שנלקחו ממסגרת אחת של בדיקת הביופילם E. coli 4D (H) דוגמה לשינויים גדולים בדפוסי החרוזים בין מסגרת 3 ל-4 שנלקחו מבאר האופטיקה E. faecalis . שימו לב שהביופילם עצמו מעורר זרימה מסוימת (וידאו 1 ו-2), מה שגורם לכך שפריים 3 ו-4 הם בעלי כיוון שונה. נתון זה משוכפל באישור (31). אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
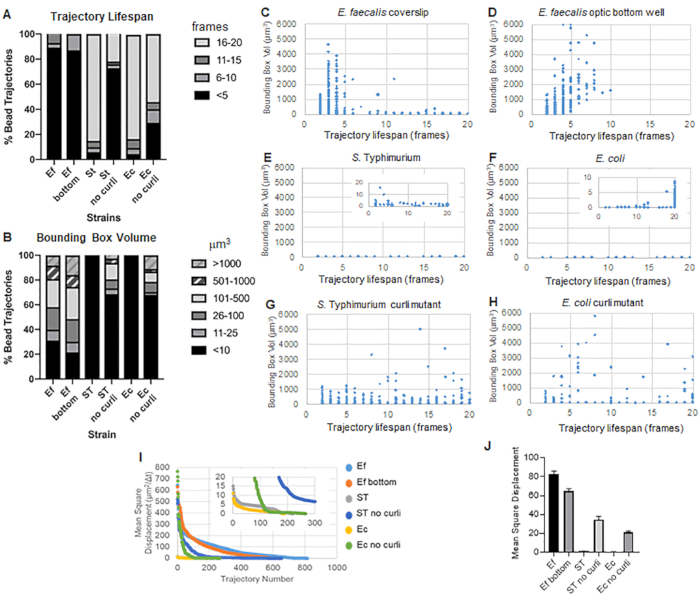
איור 3. ניתוח הבדלים בקשיחות באמצעות תיבות תוחמות ותוחלת חיים של מסלול. ביופילמים גודלו כמתואר בשלב 1 על כיסויים (E. faecalis, וידאו 1), S. טיפימוריום (וידאו 3), E. coli (וידאו 5) ומוטציות מסולסלות איזוגניות (וידאו 4, וידאו 6) או בצלחת תחתונה אופטית של 96 בארות (E. faecalis bottom, וידאו 2). תוחלת החיים של המסלול מוצגת באחוזים מסך מסלולי החרוזים (A) וגרפים של פיזור (C-H), יחד עם נפחי התיבה התוחמת (מחושבים בשלב 5) (I) השוואה בין MSDs של החרוזים בביופילמים השונים (H) MSDs ממוצעים של כל סוג של ביופילם. העמודות מציינות את רווח בר-סמך של 95% של הנתונים. נתון זה משוכפל באישור (31). אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
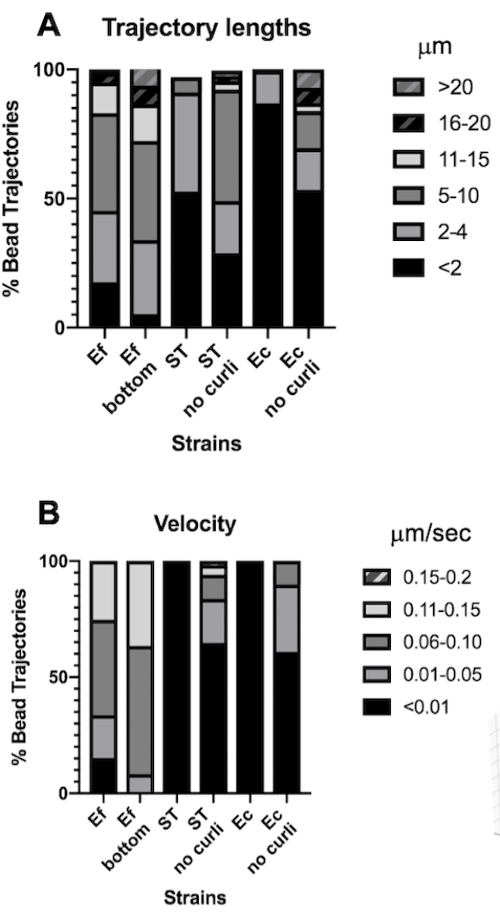
איור 4. ניתוח הבדלים באורך המסלול ובמהירות החרוז. ביופילמים גודלו כמתואר בשלב 1. אורכי המסלול מוצגים במיקרומטר ומוצגים כאחוזים מסך מסלולי החרוזים (A). המהירות מוצגת במיקרומטר לשנייה ומוצגת כאחוז מסך מסלולי החרוזים (B). נתון זה מותאם באישור (31). אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
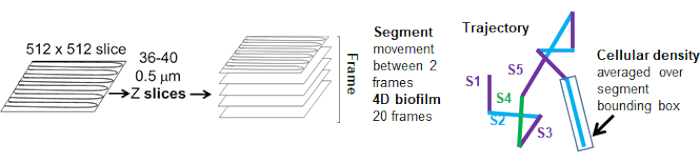
איור 5. מתווה ניתוח מקטעי מסלול. נתון זה מותאם באישור (31). אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
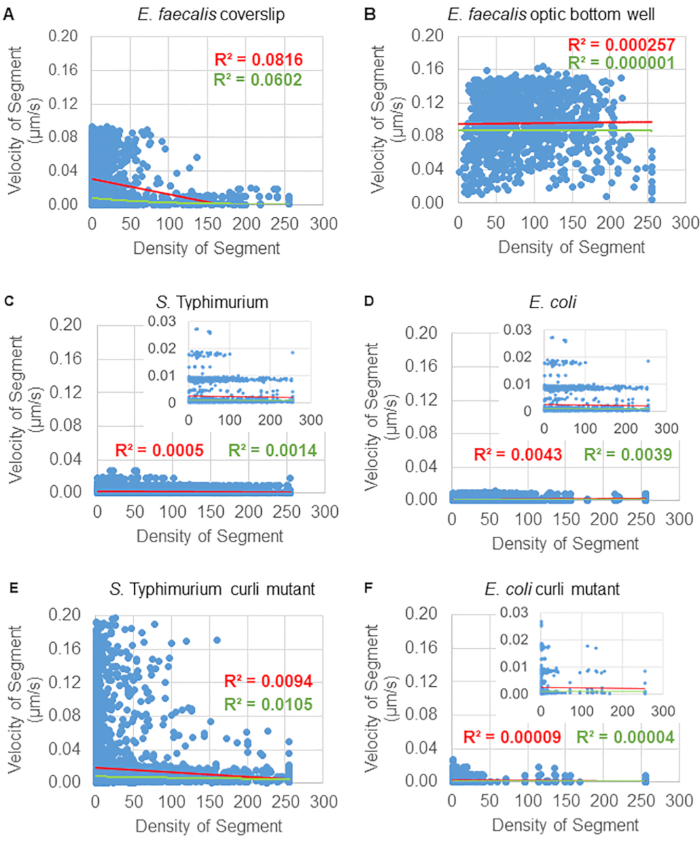
איור 6. חקר השפעת צפיפות הביופילם על מהירות החרוזים באמצעות צינור ניתוח הביופילם (שלב 5). התוצאות הצביעו על כך שמהירות החרוזים אינה תלויה אך ורק בצפיפות התאים. ביופילמים גודלו כמתואר בשלב 1. המסלולים נותחו בקנה מידה של מקטעי מסלול בודדים (איור 5). עבור כל קטע, מהירות החרוז במיקרומטר לשנייה תוארה כנגד צפיפות התאים של התיבה התוחמת (GFP ממוצע לווקסל בתוך התיבה התוחמת). הקו האדום מראה את הרגרסיה הליניארית, והקו הירוק את עקבות הרגרסיה המעריכית. נתון זה משוכפל באישור (31). אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
סרטון משלים 1. סרטון 4D של ביופילם E. faecalis OG1RF 24 שעות ביממה שגדל על כיסוי זכוכית אופטית בעובי 1.5. סרטון ה-4D time lapse נוצר באמצעות מיקרוסקופ ברזולוציה של 512x512. סדרת Z של 40 תמונות נוצרה על ידי הדמיה של אזור בעובי של כ-20 מיקרומטר של ביופילם בצעדים של 0.5 מיקרומטר. כל סדרת Z הייתה מסגרת אחת ודרשה 50-60 שניות כדי ללכוד. סדרה של 20 פריימים רציפים צולמו כדי להפיק סרטון 4D. הפעלת הווידאו היא בערך פי 120. הסרטון מייצג לפחות 6 ניסויים עצמאיים. אנא לחץ כאן להורדת סרטון זה.
סרטון משלים 2. סרטון 4D של ביופילם E. faecalis OG1RF 24 שעות ביממה שגדל על צלחת תחתונה אופטית של 96 בארות. סרטון ה-4D time lapse נוצר באמצעות מיקרוסקופ ברזולוציה של 512x512. סדרת Z של 40 תמונות נוצרה על ידי הדמיה של אזור בעובי של כ-20 מיקרומטר של ביופילם בצעדים של 0.5 מיקרומטר. כל סדרת Z הייתה מסגרת אחת ודרשה 50-60 שניות כדי ללכוד. סדרה של 20 פריימים רציפים צולמו כדי להפיק סרטון 4D. הפעלת הווידאו היא בערך פי 120. הסרטון מייצג 3 ניסויים עצמאיים.אנא לחץ כאן כדי להוריד את זה וידאו.
סרטון משלים 3. סרטון 4D של סרוטיפ סלמונלה אנטריקה, ביופילם Typhimurium ATCC 14028 שגדל על 1.5 כיסויי זכוכית אופטית בעובי במשך 6-7 ימים. סרטון ה-4D time lapse נוצר באמצעות מיקרוסקופ ברזולוציה של 512x512. סדרת Z של 40 תמונות נוצרה על ידי הדמיה של אזור בעובי של כ-20 מיקרומטר של ביופילם בצעדים של 0.5 מיקרומטר. כל סדרת Z הייתה מסגרת אחת ודרשה 50-60 שניות כדי ללכוד. סדרה של 20 פריימים רציפים צולמו כדי להפיק סרטון 4D. הפעלת הווידאו היא בערך פי 120. הסרטון מייצג 3 ניסויים עצמאיים.אנא לחץ כאן כדי להוריד את זה וידאו.
סרטון משלים 4. סרטון 4D של סלמונלה אנטריקה, ביופילמים, ATCC 14028 curli (csgBA) גודלו על 1.5 כיסויי זכוכית אופטית בעובי במשך 6-7 ימים. סרטון ה-4D time lapse נוצר באמצעות מיקרוסקופ ברזולוציה של 512x512. סדרת Z של 40 תמונות נוצרה על ידי הדמיה של אזור בעובי של כ-20 מיקרומטר של ביופילם בצעדים של 0.5 מיקרומטר. כל סדרת Z הייתה מסגרת אחת ודרשה 50-60 שניות כדי ללכוד. סדרה של 20 פריימים רציפים צולמו כדי להפיק סרטון 4D. הפעלת הווידאו היא בערך פי 120. הסרטון מייצג 3 ניסויים עצמאיים.אנא לחץ כאן כדי להוריד את זה וידאו.
סרטון משלים 5. סרטון 4D של E. coli UTI89 שגדל על 1.5 כיסויי זכוכית אופטית בעובי במשך 6-7 ימים. סרטון ה-4D time lapse נוצר באמצעות מיקרוסקופ ברזולוציה של 512x512. סדרת Z של 40 תמונות נוצרה על ידי הדמיה של אזור בעובי של כ-20 מיקרומטר של ביופילם בצעדים של 0.5 מיקרומטר. כל סדרת Z הייתה מסגרת אחת ודרשה 50-60 שניות כדי ללכוד. סדרה של 20 פריימים רציפים צולמו כדי להפיק סרטון 4D. הפעלת הווידאו היא בערך פי 120. הסרטון מייצג 3 ניסויים עצמאיים.אנא לחץ כאן כדי להוריד את זה וידאו.
סרטון משלים 6. סרטון 4D E. coli UTI89 curli (csgBA) מוטציה שגדלה על 1.5 כיסויי זכוכית אופטית בעובי במשך 6-7 ימים. סרטון ה-4D time lapse נוצר באמצעות מיקרוסקופ ברזולוציה של 512x512. סדרת Z של 40 תמונות נוצרה על ידי הדמיה של אזור בעובי של כ-20 מיקרומטר של ביופילם בצעדים של 0.5 מיקרומטר. כל סדרת Z הייתה מסגרת אחת ודרשה 50-60 שניות כדי ללכוד. סדרה של 20 פריימים רציפים צולמו כדי להפיק סרטון 4D. הפעלת הווידאו היא בערך פי 120. הסרטון מייצג 3 ניסויים עצמאיים. אנא לחץ כאן כדי להוריד את זה וידאו.
Discussion
שלבים קריטיים ופתרון בעיות
האתגר הגדול ביותר של הטכניקה הזו הוא שימוש בכיסוי רכוב עם ביופילם צמיג מאוד כמו E. faecalis. יש למקם את הכיסוי בזהירות ובדייקנות על מגלשת הרב-באר מבלי למקם אותה מחדש. במהלך שלב האיטום, יש לנקוט בזהירות כדי למנוע דחיפה כלפי מטה של החלקת הכיסוי או דחיפה/החלקה בטעות על פני משטח ההחלקה. כל תנועה או לחץ עלולים ליצור מתח פנים ולחסום תנועה של ביופילם צמיג. במידת האפשר, השוואת תכונות חומר ביופילם על ידי הדמיית ביופילם על באר תחתית אופטית לתושבת כיסוי תאפשר הערכת טכניקה. כאשר בוצע כהלכה, תושבת כיסוי דומה מאוד לביופילם בצלחת תחתונה אופטית עבור E. faecalis.
בנוסף, בעת שימוש בכיסוי רכוב, יש להימנע מהדמיה של ממשקי הביופילם עם הכיסוי בתחתית או השקופית בחלקו העליון. בעת שימוש בהיקף הפוך, עם הכיסוי בתחתית, יכולים להיות חרוזים כלואים בבסיס הביופילם כנגד הכיסוי. חרוזים אלה עוברים דרך הביופילם ונלכדים על כיסוי הכיסוי גם לאחר כביסה עדינה. יש להם קואורדינטות x, y ו-z של 0 וקואורדינטות תוחמות של 0. עם זאת, עבור יישומים מסוימים, כגון בדיקת תקינות הביופילם לאחר הטיפול, נקודות נתונים אלו יכולות לשמש ככלי. היכולת של חרוזים לחדור דרך אזור עבה של ביופילם לתחתית הכיסוי יכולה לשמש להערכת תקינות הביופילם לאחר הטיפול (כתב היד בהכנה בשיתוף עם מעבדת Tükel). בחלק העליון של הביופילם, בביופילם צמיגי כמו E. faecalis היו לנו עדויות לדחיסה שנכפתה על ידי הכיסוי. זה הגביל את התנועה של כמה חרוזים בממשק שקופיות הזכוכית וייתכן שהכניס תלות מסוימת בצפיפות לניתוח תנועת החרוזים.
שלבי הכביסה היו נחוצים עבור הביופילמים מאחר שלמדיום הגידול יש אוטופלואורסצנטיות חזקה בתעלה הירוקה. אנו בוחרים להשתמש בחרוזים עודפים ולהסיר חרוזים לא משויכים על ידי שטיפה כדי למקסם את החרוזים המשויכים כדי לקבל את האפיון המדויק ביותר של האזורים הנצפים.
יש לקבוע באופן אמפירי את מספר החרוזים והשטיפות הדרושים להשגת מערכי נתונים רצויים. נוכחותם של יותר מדי חרוזים בביופילם יוצרת מערכי נתונים גדולים באופן בלתי אפשרי שקשה לנתח. נוכחותם של מעט מדי חרוזים אינה יוצרת דגימה יסודית של סביבות הביופילם. עם זאת, שליטה במספר החרוזים שנוספו (2x107 חרוזים ב-1 מ"ל של PBS) והשימוש בשלבי שטיפה, הביאו למספר עקבי יחסית של חרוזים (40-140) הקשורים לביופילם בהתאם למבנה, לסידור המרחבי ולהרכבו.
כאשר חוקרים ביופילמים עם אזורים צמיגים וקשיחים מעורבים, חרוזים יכולים להילכד באזורים הנוקשים לאורך זמן. במקרה זה, יש להתחיל בהדמיה מיד לאחר הוספת החרוזים. לעתים קרובות לא ניתן להשיג זאת באמצעות כיסויים אלא דורש לוחות תחתונים אופטיים או תאי זרימה שבהם ניתן לבצע הדמיה מיד לאחר הוספת החרוזים ושלבי הכביסה.
שינויים ויישומים עתידיים
שימוש במכשירים מיקרופלואידיים. במחקרים שלנו, התנאים האופטימליים שנקבעו לחקר הביופילמים של Enterobacteriaceae דרשו גידול של הביופילם כפליקל בממשק אוויר-נוזל. זה הגביל את השימוש בלוחות תחתונים אופטיים ובמכשירים מיקרופלואידיים במחקרים. עם זאת, כאשר תנאי היווצרות הביופילם מאפשרים זאת, ניתן לגדל את הביופילמים בתאים מיקרופלואידיים או בתאי זרימה. לאחר מכן ניתן היה לשטוף את הביופילמים, ולהכניס חרוזים דרך המכשיר המיקרופלואידי, עם הפרעה מינימלית של הביופילם.
הוספת חרוזים במהלך גידול ביופילם. בחרנו להוסיף עודפי חרוזים לביופילמים, ואז להסיר חרוזים לא קשורים על ידי שטיפה עדינה כדי למטב את מספר החרוזים שהיו במהלך הניתוח. בביופילמים הצמיגים של E. faecalis , ייתכן שהחרוזים התנתקו ונקשרו מחדש במהלך זמן ההדמיה של 20 דקות. אם מספר נמוך של חרוזים מתווספים בזמנים שונים במהלך גדילת הביופילם, ייתכן שיהיה אפשרי ללכוד את החרוזים בביופילם, מה שמאפשר אפיון מדויק יותר של תנועת הביופילם בביופילמים צמיגים יותר.
בחירת האזור לתמונה. למחקרים על תכונות החומר, עדיף לבחור אזורים עבים ודקים של הביופילם. עם זאת, כאשר חוקרים שינויים בתכונות החומר של ביופילם מטופל, ניתן לדמות אזורי קונפלואנט עבים כדי לקבוע שינויים בתכונות הויסקו-אלסטיות וחדירת החרוזים באזורים אלה. במקרה הזה, חיפוש אחר חרוזים שחדרו לביופילם ובסופו של דבר נלכדו על הכיסוי הם מדד שימושי לשיבוש הביופילם.
הדמיה תחת זרימה. באמצעות תאי זרימת זכוכית אופטיים או התקנים מיקרופלואידיים, ניתן לדמות תנועה של חרוזים או חיידקים בביופילם תחת זרימה. ניתן לעשות זאת בדרכים שונות. זה יכול להיעשות על ידי הזרקת חרוזים לכל החדר ואחריה דגירה קצרה כדי לאפשר שיוך של החרוזים לביופילם. ניתן להסיר את החרוזים הלא משויכים על ידי כביסה ולצלם את הביופילם עם או בלי זרימה. לעומת זאת, ניתן להכניס מספר קטן של חרוזים לצד אחד של החדר ולעקוב אחר תנועתם דרך הביופילם ובתוכו תחת זרימה. בעת שימוש בזרימה, יהיה צורך לנקוט משנה זהירות בבחירת הגדרות המעקב אחר חרוזי הפסיפס (שלב 4.5). במחקרים הנוכחיים ההגדרה הדינמית הייתה בראונית. חישובי MSD אישרו כי התנועה צפויה להיות מפוזרת, מה שהופך את בראוניאן לסביבה המתאימה.
מכתים מטריקס. במחקרים הנוכחיים, צביעה עם Syto9 בוחנת את צפיפות התאים ולא את צפיפות מבנה הביופילם. לדוגמה, נוכחותם של עמילואידים ככל הנראה מגדילה את צפיפות חומר המטריצה של הביופילם. ניתן לקבוע את תלות התנועה בצפיפות העמילואיד על ידי שימוש בכתמי מטריצה פלואורסצנטיים במקום Syto9.
חיידקים עם תווית פלואורסצנטית. ניתן להשתמש בחיידקים בעלי תווית פלואורסצנטית כדי לעקוב אחר תנועה של חיידקים אקסוגניים דרך ביופילמים (למשל, חיידקים המכילים פלסמיד). האתגר עם חיידקים עם תווית פלואורסצנטית, כמו אנטרוקוקים, הוא שהם יוצרים סינגלים, דיפלוקוקים ושרשראות קצרות, מה שמסבך את היכולת לעקוב במדויק אחר החיידקים. תהליך זה יהיה קל יותר אם לחיידקים יש מורפולוגיה של תא בודד.
מגבלות
מגבלות בהדמיית מסלול ותפירה.
מגבלה אחת של השיטה היא הדמיית מסלול ותפירה. מסלולים משוחזרים ומנותחים מורכבים מקואורדינטות נקודות x, y, z, כאשר הנקודות הבאות מגדירות את הנתיב הליניארי בין הנקודות הללו. הדמיה של מסלולים ליניאריים חלקיים כאלה יכולה להיות מושגת על ידי כלים שונים. גישה אחת הייתה להשתמש במחברות Python ו-Jupyter יחד עם התוספים של Python, Pandas ו-Matplotlib. אמנם ניתן היה לדמיין מסלולים קיימים בודדים במאמר בכתב העת לבקטריולוגיה שבו טכניקה זו פורסמה במקור34, אך עדיין היו מגבלות משמעותיות שמטופלות במחקר עתידי.
כיום, מספר המסלולים המשוחזרים גדול ממספר החרוזים בביופילם, כלומר מסלולים מרובים עשויים להתאים לחרוז אחד. זה יכול להיגרם על ידי אות קונפוקלי חלש בפריים אחד שבו פסיפס יסיים מסלול וייזום שני. זה עשוי להירשם כמספר מסלולים קצרים יותר עבור חרוז אחד, במיוחד בביופילמים פחות צמיגים. סיבה נוספת למספר המסלולים הגדול היא היעדר תפירת מסלול. במיוחד בביופילמים של E . faecalis בתחתית האופטית, חרוזים נשארים קשורים חזותית לביופילם במהלך ההדמיה (סרטון משלים 2). אולם לא היו מסלולים ארוכים מ-10, ולמעלה מ-90% מהמסלולים הייתה תוחלת חיים של 5 פריימים או פחות (איור 3D). אם התוכנה משמשת לניתוח מסלולים בלבד מעל אורך מוגדר (למשל, בעת מעקב אחר תאים המסוגלים להעביר פלסמידים), ניתן להסיר אוטומטית מסלולים קצרים יותר ממערך הנתונים. עם זאת, ישנן מטרות אחרות שעבורן תפירת המסלולים עשויה להיות חשובה מאוד. לבסוף, חוסר היכולת לעקוב אחר תנועת חרוזים מהירה כמסלול יחיד יכול לגרום למסלולים נוספים בביופילמים של Enterobacteriaceae עקב התנועה המהירה בכיוון Z וכתוצאה מכך חרוזים בצורת אליפטי (איור 2G). האפשרות לתפור מסלולי תפירה המופרעים על ידי תנועה אנזוטרופית מהירה תהיה חשובה לחקר ההשפעה של מטריצת העמילואיד המסתלסל ב- Enterobacteriaceae.
משמעות
פותח תהליך עבודה חישובי כדי לחקור מסלולי חרוזים כדי להשוות את תכונות החומר של ביופילמים תלת מימדיים. זרימת העבודה מאפשרת לחוקרים לזהות פרמטרים קריטיים שניתן להשתמש בהם במודלים חישוביים של דינמיקת זורמים בביופילמים הטרוגניים. בעזרת מעריך חרוזים בקוד פתוח זה, ניתן היה לחקור את השפעת סלסול העמילואיד החיידקי על תכונות החומר, מה שמראה קשיחות מוגברת של מטריצת ביופילם עקב סלסול. בהקשר כללי יותר, ניתן להשתמש במעריך כדי לחקור שינויים במבנה הביופילם הנגרמים על ידי טיפול בביופילם או תנאים סביבתיים שונים, כגון זרימה. לדוגמה, הכלי משמש לניתוח ההשפעה של טיפול בנוגדנים חד-שבטיים על שיבוש מבני ביופילם בשיתוף עם מעבדת Tükel (אוניברסיטת LKSOM Temple). ארגז הכלים של מעריך החרוזים ניתן להתאמה מלאה וניתן להרחבה בצורה מודולרית באמצעות VRL-Studio כדי לשפר ולהרחיב עוד יותר את הפונקציות שלו.
Disclosures
למחברים אין מה לחשוף.
Acknowledgements
העבודה במעבדות GQ ו-BAB לא קיבלה מענק ספציפי מאף סוכנות מימון במגזר הציבורי, המסחרי או ללא מטרות רווח. המחברים מודים לאייזק קלאפר, Ph.D (המחלקה למתמטיקה, אוניברסיטת טמפל) על הדיון המועיל ולצ'אגלה טוקל (המחלקה למיקרוביולוגיה ואימונולוגיה, אוניברסיטת טמפל) על המומחיות ב-Enterobacteriaceae בפרסום הראשוני של הכלת טכניקה זו.
Materials
| Name | Company | Catalog Number | Comments |
| 96-well plates, No. 1.5 Uncoated Coverslip, 5 mm Glass Diameter | MatTek | P96G1.55F | |
| Fisherbrand Cover Glasses: Circles | Fisher Scientific | 12-293-232P | 1.5 optic glass coverslip |
| Invitrogen Syto 9 Green Fluorescent Nucleic Acid Stain | Invitrogen | S34854 | |
| Molecular Probes FluoSpheres Carboxylate-modified Microspheres, 1 um, crimson fluorescent (625/645) | Molecular Probes | F8816 |
References
- Huang, R., Li, M., Gregory, R. L. Bacterial interactions in dental biofilm. Virulence. 2, 435-444 (2011).
- Nadell, C. D., Drescher, K., Wingreen, N. S., Bassler, B. L. Extracellular matrix structure governs invasion resistance in bacterial biofilms. ISME Journal. 9, 1700-1709 (2015).
- Billings, N., Birjiniuk, A., Samad, T. S., Doyle, P. S., Ribbeck, K. Material properties of biofilms - key methods for understanding permeability and mechanics. Reports on Progress in Physics. 78, 036601 (2015).
- Araújo, G. R. d. e. S., Viana, N. B., Gómez, F., Pontes, B., Frases, S. The mechanical properties of microbial surfaces and biofilms. The Cell Surface. 5, 100028 (2019).
- Tallawi, M., Opitz, M., Lieleg, O. Modulation of the mechanical properties of bacterial biofilms in response to environmental challenges. Biomaterials Science. 5, 887-900 (2017).
- Tursi, S. A., Tükel, &. #. 1. 9. 9. ;. Curli-Containing Enteric Biofilms Inside and Out, Matrix Composition, Immune Recognition, and Disease Implications. Microbiology and Molecular Biology Reviews. 82, (2018).
- Dueholm, M. S., Albertsen, M., Otzen, D., Nielsen, P. H. Curli functional amyloid systems are phylogenetically widespread and display large diversity in operon and protein structure. PLoS One. 7 (12), 51274 (2012).
- Hung, C., et al. Escherichia coli biofilms have an organized and complex extracellular matrix structure. mBio. 4, 00645 (2013).
- Kikuchi, T., Mizunoe, Y., Takade, A., Naito, S., Yoshida, S. Curli fibers are required for development of biofilm architecture in Escherichia coli K-12 and enhance bacterial adherence to human uroepithelial cells. Microbiology and Immunology. 49, 875-884 (2005).
- Gallo, P. M., et al. Amyloid-DNA Composites of Bacterial Biofilms Stimulate Autoimmunity. Immunity. 42, 1171-1184 (2015).
- Serra, D. O., Richter, A. M., Hengge, R. Cellulose as an architectural element in spatially structured Escherichia coli biofilms. Journal of Bacteriology. 195, 5540-5554 (2013).
- Oh, Y. J. Characterization of curli A production on living bacterial surfaces by scanning probe microscopy. Biophysical Journal. 103, 1666-1671 (2012).
- Lembré, P., Di Martino, P., Vendrely, C. Amyloid peptides derived from CsgA and FapC modify the viscoelastic properties of biofilm model matrices. Biofouling. 30, 415-426 (2014).
- Oh, Y. J., et al. Curli mediate bacterial adhesion to fibronectin via tensile multiple bonds. Scientific Reports. 6, 33909 (2016).
- Vidakovic, L., Singh, P. K., Hartmann, R., Nadell, C. D., Drescher, K. Dynamic biofilm architecture confers individual and collective mechanisms of viral protection. Nature Microbiology. 3, 26-31 (2018).
- Tursi, S. A., et al. Salmonella Typhimurium biofilm disruption by a human antibody that binds a pan-amyloid epitope on curli. Nature Communications. 11, 1007 (2020).
- Perov, S., et al. Structural Insights into Curli CsgA Cross-β Fibril Architecture Inspire Repurposing of Anti-amyloid Compounds as Anti-biofilm Agents. PLOS Pathogens. 15 (8), 1007978 (2019).
- Taglialegna, A., et al. The biofilm-associated surface protein Esp of Enterococcus faecalis forms amyloid-like fibers. Npj Biofilms and Microbiomes. 6, 15 (2020).
- Gour, S., Kumar, V., Rana, M., Yadav, J. K. Pheromone peptide cOB1 from native Enterococcus faecalis forms amyloid-like structures, A new paradigm for peptide pheromones. Journal of Peptide Science. 25, 3178 (2019).
- Stoodley, P., Debeer, D., Lewandowski, Z. Liquid flow in biofilm systems. Applied and Environmental Microbiology. 60, 2711-2716 (1994).
- Birjiniuk, A., et al. Single particle tracking reveals spatial and dynamic organization of the E. coli biofilm matrix. New Journal of Physics. 16, 085014 (2014).
- Chew, S. C., et al. Dynamic remodeling of microbial biofilms by functionally distinct exopolysaccharides. mBio. 5, 01536 (2014).
- Cao, H., et al. Revealing region-specific biofilm viscoelastic properties by means of a micro-rheological approach. Npj Biofilms and Microbiomes. 2, 5 (2016).
- Galy, O., et al. Mapping of bacterial biofilm local mechanics by magnetic microparticle actuation. Biophysical Journal. 103, 1400-1408 (2012).
- Rogers, S. S., vander Walle, C., Waigh, T. A. Microrheology of bacterial biofilms in vitro, Staphylococcus aureus and Pseudomonas aeruginosa. Langmuir. 24, 13549-13555 (2008).
- Hart, J. W., Waigh, T. A., Lu, J. R., Roberts, I. S. Microrheology and Spatial Heterogeneity of Staphylococcus aureus Biofilms Modulated by Hydrodynamic Shear and Biofilm-Degrading Enzymes. Langmuir. 35 (9), 3553-3561 (2019).
- van Merode, A. E. J., van der Mei, H. C., Busscher, H. J., Krom, B. P. Influence of culture heterogeneity in cell surface charge on adhesion and biofilm formation by Enterococcus faecalis. Journal of Bacteriology. 188, 2421-2426 (2006).
- Tariq, M., Bruijs, C., Kok, J., Krom, B. P. Link between Culture Zeta Potential Homogeneity and Ebp in Enterococcus faecalis. Applied and Environmental Microbiology. 78, 2282-2288 (2012).
- Schneider, C. A., Rasband, W. S., Eliceiri, K. W. NIH Image to ImageJ, 25 years of image analysis. Nature Methods. 9, 671-675 (2012).
- . Oracle.com Available from: https://docs.oracle.com/en/java (2021)
- Hoffer, M., Poliwoda, C., Wittum, G. Visual reflection library, a framework for declarative GUI programming on the Java platform. Computing and Visualization in Science. 16, 181-192 (2013).
- Perov, S., et al. Structural Insights into Curli CsgA Cross-β Fibril Architecture Inspire Repurposing of Anti-amyloid Compounds as Anti-biofilm Agents. PLOS Pathogens. 15, 1007978 (2019).
- Malhotra, K., et al. Development of a New Bead Movement-Based Computational Framework Shows that Bacterial Amyloid Curli Reduces Bead Mobility in Biofilms. Journal of Bacteriology. 202, 00253 (2020).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved