Method Article
نهج الذكاء الاصطناعي لتقييم سيليا الأولية
In This Article
Summary
يظهر استخدام الذكاء الاصطناعي (Ai) لتحليل الصور كنهج قوي وأقل تحيزا وسريعا مقارنة بالطرق الشائعة الاستخدام. هنا قمنا بتدريب Ai على التعرف على العضية الخلوية ، أهداب أساسي ، وتحليل خصائص مثل الطول وكثافة التلطيخ بطريقة صارمة وقابلة للاستنساخ.
Abstract
سيليا هي الزوائد الخلوية القائمة على microtubule التي تعمل كمراكز إشارات لتنويع مسارات الإشارات في العديد من أنواع خلايا الثدييات. يتم الحفاظ على طول سيليا للغاية ، وينظم بإحكام ، ويختلف بين أنواع الخلايا المختلفة والأنسجة ، وقد تورط في التأثير المباشر على قدرتها على الإشارة. على سبيل المثال، وقد ثبت أهداب لتغيير أطوالها استجابة لتفعيل مستقبلات البروتين Ciliary G مقرونة. ومع ذلك ، فإن قياس أطوال الأهداب بشكل دقيق ومستنسخ هو إجراء يستغرق وقتا طويلا وكثيف العمالة. كما أن النهج الحالية عرضة للخطأ والتحيز. يمكن استخدام برامج الذكاء الاصطناعي (Ai) للتغلب على العديد من هذه التحديات بسبب القدرات التي تسمح بالاستيعاب والتلاعب والتحسين من مجموعات البيانات الواسعة النطاق. هنا، نثبت أنه يمكن تدريب وحدة الذكاء الاصطناعي على التعرف على أهداب في الصور من كل من عينات الجسم الحي وفي المختبر. بعد استخدام الذكاء الاصطناعي المدرب لتحديد أهداب، ونحن قادرون على تصميم والاستفادة بسرعة التطبيقات التي تحلل مئات من أهداب في عينة واحدة لطول وكثافة مضان والتوطين المشترك. هذا النهج غير المتحيز زاد من ثقتنا وصرامة عند مقارنة عينات من الإعدادية العصبية الأولية المختلفة في المختبر وكذلك عبر مناطق الدماغ المختلفة داخل الحيوان وبين الحيوانات. وعلاوة على ذلك، يمكن استخدام هذه التقنية لتحليل موثوق به ديناميات أهداب من أي نوع الخلية والأنسجة بطريقة عالية الإنتاجية عبر عينات متعددة ومجموعات العلاج. وفي نهاية المطاف، من المرجح أن تصبح النهج القائمة على الذكاء الاصطناعي قياسية مع تحرك معظم المجالات نحو نهج أقل تحيزا وأكثر قابلية للاستنساخ للحصول على الصور وتحليلها.
Introduction
أهداب الأولية هي العضيات الحسية جاحظ من معظم أنواع الخلايا الثديية1،2،3،4. هم عموما الزوائد الانفرادي حاسمة لتنسيق مسارات إشارات الخلية المتنوعة عن طريق دمج إشارات خارج الخلية5,6,7. تلعب أهداب الأولية أدوارا هامة أثناء النمو الجنيني وداء التوازن الأنسجة الكبار، ويرتبط تعطيل وظيفتها أو مورفولوجيا مع العديد من الاضطرابات الوراثية، والتي تسمى مجتمعة اعتلالات الكظر. نظرا لطبيعة شبه موجودة في كل مكان من أهداب، ترتبط اعتلالات السيليوباثية مع مجموعة واسعة من الميزات السريرية التي يمكن أن تؤثر على جميع أنظمة الجهاز8،9،10،11،12. في النماذج الحيوانية من اعتلالات الكظر، وفقدان بنية السيلاري أو قدرة الإشارات يتجلى في العديد من الأنماط الظاهرية ذات الصلة سريريا بما في ذلك السمنة المرتبطة hyperphagia3،13،14،15. في العديد من أنظمة النموذج، وقد ثبت تغييرات طول أهداب للتأثير على قدرتها على الإشارات ووظائف16،17،18،19. ومع ذلك، هناك العديد من التحديات التقنية التي تستغرق وقتا طويلا المرتبطة بدقة واستنساخ تقييم طولilia وتكوينها.
الجهاز العصبي المركزي للثدييات البالغة (CNS) هو سياق بيولوجي واحد شكل تحديا لفهم مورفولوجيا ووظيفة أهداب. في حين يبدو أن الخلايا العصبية والخلايا في جميع أنحاء CNS تمتلك أهداب, نظرا لأدوات محدودة وقدرات على مراقبة وتحليل هذه أهداب فهم وظائفها لا يزال بعيد المنال20. على سبيل المثال، فإن علامة أهداب نموذجية، أسيتيلاتيد α-توبولين، لا تسمية أهداب الخلايا العصبية20. تم حل صعوبة دراسة هذه الأهداب جزئيا مع اكتشاف العديد من مستقبلات البروتين G المقترنة (GPCR) ، مما يشير إلى الآلات والبروتينات المرتبطة بالغشاء التي يتم تخصيبها على غشاء أهداب الخلايا العصبية21،22. كل هذه الملاحظات الأساسية المباشرة تشير إلى أهمية وتنوع سيليا CNS ، والتي تبدو حتى الآن لا مثيل لها من قبل الأنسجة الأخرى. على سبيل المثال، يمكن ملاحظة الاختلاف في طول أهداب وتوطين GPCR في جميع أنحاء الدماغ، مع أطوال في بعض النوى العصبية يجري مختلفة بالمقارنة مع نواة أخرى19،23. وبالمثل، فإن محتوى GPCR ومجاملة آلات الإشارة تظهر التنوع على أساس الموقع التشريحي العصبي ونوع الخلايا العصبية2،24،25،26،27،28،29. هذه الملاحظات البسيطة تثبت أن طول الثدييات CNS أهداب وتكوينها ينظم بإحكام، تماما كما هو الحال في الكائنات الحية النموذجية، مثل الكلاميدوموناس راينهارتي،ولكن تأثير هذه الاختلافات طول على وظيفة أهداب، والإشارات والسلوك في نهاية المطاف لا يزال غير واضح16،30،31،32.
قياس بدقة طول أهداب وتكوين يثبت أن يكون تحديا تقنيا عرضة لخطأ المستخدم وعدم القابلية للإلغاء. حاليا يتم تحديد أهداب في الجسم الحي وفي المختبر في معظم الأحيان باستخدام النهج immunofluorescent التي تسمية البروتينات السيلاري أو السيليه المخصب مراسل الفلورسنت أليليس33،34،35. ثم يتم قياس أطوال هذه أهداب الموسومة فلوريا من صورة ثنائية الأبعاد (2D) باستخدام أدوات قياس الخط في برامج تحليل الصور مثل ImageJ36. هذه العملية ليست مملة وكثيفة العمالة فحسب ، بل هي أيضا عرضة للتحيز والخطأ. تنشأ هذه العقبات نفسها عند قياس كثافة أهداب ، والتي تساعد على الإشارة إلى التغيرات في هيكل أهداب37. للحد من التناقضات في هذه الأنواع من تحليلات الصور ، أصبحت برامج الذكاء الاصطناعي (Ai) أكثر انتشارا وبأسعار معقولة خيارات38.
منظمة العفو الدولية هو التقدم في أنظمة الكمبيوتر التي تستخدم ميزة خوارزميات الكمبيوتر والبرمجة لتنفيذ المهام التي تتطلب عادة الذكاء البشري39. يتم تعليم أجهزة الذكاء الاصطناعي إدراك الأنماط والمعلمات والخصائص المتكررة واتخاذ إجراءات لزيادة احتمالات تحقيق نتائج ناجحة إلى أقصى حد. الذكاء الاصطناعي متعدد الاستخدامات ويمكن تدريبه على التعرف على كائنات أو هياكل محددة ذات أهمية ، مثل أهداب ، ومن ثم برمجتها لتشغيل مجموعة متنوعة من التحليلات على الأشياء المحددة. لذلك ، يمكن إنشاء بيانات الصور المعقدة بسرعة وبصورة مستنسخة بواسطة Ai38. سوف الأتمتة وتحليل الذكاء الاصطناعي من الصور الملتقطة زيادة الفعالية والكفاءة مع الحد من أي خطأ بشري محتمل والتحيز39. إنشاء منهجية تستند إلى الذكاء الاصطناعي لتحديد أهداب يخلق طريقة متسقة لجميع مجموعات البحوث لتحليل وتفسير بيانات أهداب.
هنا نستخدم وحدة الذكاء الاصطناعي لتحديد أهداب في الجسم الحي وفي المختبر على الصور 2D. باستخدام مجموعة من الصور عينة يتم تدريب منظمة العفو الدولية لتحديد أهداب. بمجرد الانتهاء من التدريب ، يتم استخدام الذكاء الاصطناعي المعين لتطبيق قناع ثنائي على أهداب التعرف على Ai في صورة. الثنائيات التي تطبقها منظمة العفو الدولية قابلة للتعديل، إذا لزم الأمر، لضمان التعرف على جميع أهداب في الصور بشكل صحيح ويتم القضاء على تحديد الهوية غير محددة. بعد استخدام الذكاء الاصطناعي لتحديد أهداب، يتم استخدام برامج التحليل العام (GA) المصممة خصيصا لإجراء تحليلات مختلفة مثل قياس طول أهداب وكثافة الفلورسينس. يتم تصدير البيانات التي تم جمعها إلى جدول يمكن قراءته وتفسيره واستخدامه بسهولة في التحليلات الإحصائية(الشكل 1). استخدام التكنولوجيا الآلية والذكاء الاصطناعي لتحديد أهداب والحصول على قياسات محددة بين المجموعات التجريبية سوف تساعد في الدراسات المستقبلية التي تهدف إلى فهم تأثير وظيفة سيه سيز سيليا ومورفولوجيا على الاتصالات الخلوية الخلية والسلوك.
Protocol
1. الحصول على صور الخام
- إصلاح وعينات immunolabel حسب الحاجة20.
- أهداب الصورة باستخدام مجهر كونفوجال في أقصى عمق بت باستخدام نفس حجم بكسل مع قرار Nyquist.
- تصدير الصور كملفات تنسيق صورة معلمة أحادية اللون (.tif).
ملاحظة: يوضح هذا البروتوكول كيفية استخدام الوحدة النمطية Ai خصيصا ضمن برنامج NIS Elements. إذا تم الحصول على الصور كملفات.nd2، تصدير الصور كملفات .tif غير ضروري ويمكن للمستخدم المتابعة مباشرة إلى الخطوة 2.3. إذا تم الحصول على الصور على نظام مختلف، يمكن شراء ترخيص NIS Elements بشكل منفصل ويمكن تحويل ملفات .tif كما هو موضح في الخطوات التالية.
2. تدريب منظمة العفو الدولية لتحديد أهداب
- افتح مجموعة بيانات التدريب.
- حدد ما يقرب من 50 صورة عينة مع سيليوم واحد على الأقل لكل إطار لتدريب البرنامج ونسخها في مجلد واحد. يستخدم هذا المجلد لتوجيه البرنامج عند فتح الصور. افتح هذه الإطارات 50 ضمن مستند ND2 واحد مع cilium واحد على الأقل لكل إطار. حدد ملف > استيراد/تصدير > إنشاء ملف ND من تسلسل الملفات.
- حدد المجلد الذي يحتوي على مجموعة بيانات التدريب. سيؤدي ذلك إلى فتح قائمة الملفات في وسط إطار الحوار. تعريف تنظيم الملفات يدويا باستخدام خيار واحد على الأقل في القائمة المنسدلة أعلاه. الخيارات متعددة النقاط (لملفات الإسقاط القصوى المتعددة) ، سلسلة Z (لصورة z stack) ، والوقت (لصورة الفاصل الزمني) ، والطول الموجي (للملفات من قنوات متعددة).
- أدخل القيم الرقمية المطابقة ضمن كل خيار محدد. حدد بلا حيثما لم يتم تحديد الخيارات. انقر فوق تحويل لفتح المستند ND.
- معايرة الصور.
- أدخل حجم البكسل في الزاوية اليسرى السفلى من الصورة: انقر بزر الماوس الأيمن فوق غير > معايرة المستند > حجم البكسل.
- التعرف على أهداب.
- اليد تحديد أهداب عن طريق تتبع بدقة هياكل السيلاري الفردية على جميع الإطارات المفتوحة باستخدام إما AutoDetect أو رسم كائن في شريط الأدوات ثنائي. وهذا سوف يوجه أقنعة ثنائية على الكائنات ذات الأهمية. وستكون هذه الثنائيات بمثابة عينات من الكائنات لتدريب البرنامج على تحديد أهداب على الخصائص القائمة على بكسل في تحليل الصور التجريبية في المستقبل. حدد عرض عناصر تحكم تحليل > > شريط الأدوات الثنائي > رسم الكائن.
ملاحظة: إزالة أي إطار ليس لديه أي ثنائيات كما لن يبدأ البرنامج التدريب إلا إذا كان قادرا على الكشف عن الثنائيات على كافة الإطارات المفتوحة.
- اليد تحديد أهداب عن طريق تتبع بدقة هياكل السيلاري الفردية على جميع الإطارات المفتوحة باستخدام إما AutoDetect أو رسم كائن في شريط الأدوات ثنائي. وهذا سوف يوجه أقنعة ثنائية على الكائنات ذات الأهمية. وستكون هذه الثنائيات بمثابة عينات من الكائنات لتدريب البرنامج على تحديد أهداب على الخصائص القائمة على بكسل في تحليل الصور التجريبية في المستقبل. حدد عرض عناصر تحكم تحليل > > شريط الأدوات الثنائي > رسم الكائن.
- تدريب آي.
- ابدأ بتدريب البرنامج. هذا سيفتح صندوق Segment.ai القطار حدد Segment.ai قطار NIS.ai >.
- في المربع Segment.ai القطار، حدد القناة المصدر لاستخدامها للتدريب. إذا كانت الملفات من قنوات متعددة مفتوحة، فحدد قناة واحدة فقط كقناة مصدر. ثم حدد الثنائيات الحقيقة الأرض المناسبة التي لتدريب منظمة العفو الدولية. وأخيرا حدد عدد التكرارات اللازمة لتدريب Ai اعتمادا على حجم الثنائيات وتوزيعها.
ملاحظة: إذا الثنائيات يمكن الكشف عنها بسهولة من المناطق المحيطة وتوزيعها بشكل جيد في جميع أنحاء الصورة، قد تحتاج إلى البرنامج أقل من 1000 التكرار للحصول على تدريب لتحديد الصور. إذا كانت الصور ذات نسبة إشارة إلى ضوضاء منخفضة ، فمن المثالي تشغيل ما لا يقل عن 1000 تكرار أثناء التدريب لتمكين Ai من تحديد أهداب في عينات الاختبار بثقة عالية. - حدد المجلد الوجهة لحفظ الملف Ai المدرب (.sai) وانقر فوق تدريب لتدريب البرنامج. البرنامج سوف تمضي الآن لتدريب نفسها لتحديد أهداب على أساس الثنائيات تتبع. تستغرق هذه العملية عدة ساعات.
ملاحظة: عند التدريب، سيعرض البرنامج رسما بيانيا يظهر فقدان التدريب. الرسم البياني سوف تظهر في البداية ارتفاع قبل أن يتراجع إلى حوالي 1٪ من الناحية المثالية خسارة حيث الهضاب لبقية التدريب. حفظ الرسم البياني للرجوع إليها في المستقبل عن طريق تحديد مربع لحفظ الرسم البياني لقطة على مربع Segment.ai القطار ( الشكل التكميلي1). - إذا كان هناك حاجة إلى مزيد من التحسين للتدريب ، ثم مواصلة التدريب على نفس مجموعة البيانات. بدلا من ذلك، تدرب على مجموعة بيانات جديدة بنفس المعلمات بالضبط. ليس من المستحسن تدريب Ai المدرب بالفعل على مجموعة بيانات جديدة ذات معلمات مختلفة أو أشياء مختلفة ذات أهمية. حدد segment.ai > القطار مواصلة التدريب على > حدد ملف Ai المدربين.
3. التعرف على أهداب باستخدام تدريب Ai
- افتح مجموعة البيانات التجريبية.
- فتح الصور confocal التجريبية من أهداب في البرنامج عن طريق تحويل عينة .tif الملفات إلى ملفات.nd2، على غرار الخطوة 2.1. حدد ملف > استيراد/تصدير > إنشاء ملف ND من تسلسل الملفات.
ملاحظة: يجب أن تكون الصور بنفس حجم البكسل مثل تلك المستخدمة لتدريب Ai. إذا كانت الصور بتنسيق ND2 بالفعل، انتقل إلى الخطوة 3.3.
- فتح الصور confocal التجريبية من أهداب في البرنامج عن طريق تحويل عينة .tif الملفات إلى ملفات.nd2، على غرار الخطوة 2.1. حدد ملف > استيراد/تصدير > إنشاء ملف ND من تسلسل الملفات.
- معايرة الصور.
- أدخل حجم البكسل في الزاوية اليسرى السفلى من الصورة. انقر بزر الماوس الأيمن فوق غير > معايرة المستند > حجم البكسل.
- تشغيل Ai المدربين على الملفات المفتوحة.
- ابدأ في التعرف على أهداب باستخدام الذكاء الاصطناعي. سيقوم البرنامج الآن برسم الثنائيات على أهداب استنادا إلى التدريب الذي تلقاه في الخطوة السابقة. هذه العملية سوف يستغرق بضع ثوان. حدد NIS.ai > Segment.ai.
ملاحظة: سوف يطالب البرنامج بتحديد القناة إذا كانت قنوات متعددة مفتوحة. يتم سرد القنوات حسب أسماء كل منها هنا. إذا لم يكن الأمر كذلك، سيتم تحديد المربع الذي يحمل علامة "مونو" تلقائيا.
- ابدأ في التعرف على أهداب باستخدام الذكاء الاصطناعي. سيقوم البرنامج الآن برسم الثنائيات على أهداب استنادا إلى التدريب الذي تلقاه في الخطوة السابقة. هذه العملية سوف يستغرق بضع ثوان. حدد NIS.ai > Segment.ai.
- تحقق من الصور بحثا عن الثنائيات التي تم تحديدها بشكل خاطئ.
- بمجرد أن يتعرف الذكاء الاصطناعي على أهداب وازناتين مرسومتين ، تحقق من الصور بحثا عن أي كائنات تم التعرف عليها عن طريق الخطأ. إذا رغبت في ذلك، حذف يدويا أي ثنائيات تم تحديدها بشكل خاطئ. حدد عرض عناصر تحكم تحليل > > شريط الأدوات الثنائي > حذف الكائن.
4. قياس طول و كثافة أهداب
- إنشاء وصفة تحليل عام جديد 3 (GA3).
- الآن بعد أن تم تحديد أهداب ومجزئة، والمضي قدما لتحليل المعلمات المختلفة من أهداب مثل أطوال وكثافة باستخدام أداة GA3. سيؤدي ذلك إلى فتح نافذة جديدة مع مساحة فارغة في الوسط حيث سيتم تعريف التحليل. حدد صورة > GA3 وصفة جديدة.
- حدد الثنائيات المطلوب تحليلها.
- نظرا لأن الأهداب مجزأة بالفعل باستخدام Segment.ai ، فإن GA3 سيكتشف تلقائيا الثنائيات التي تم تصنيفها بشكل مناسب وفقا للذكاء الاصطناعي وتشمل العقدة. حدد 'الثنائيات > الكشف التلقائي_الذكاء الاصطناعي' أو 'الثنائيات > رسم Object_الذكاء الاصطناعي'.
- حدد القنوات المطلوبة للتحليل. كما سيقوم GA3 تلقائيا بالكشف عن القنوات في الصور وعرض علامات التبويب الخاصة بها تحت القنوات.
- إزالة الكائنات التي تلمس حدود الإطار.
- وبما أن الذكاء الاصطناعي سيقسم جميع الأهداب مثل الأجسام في الإطار ، فإنه سيكتشف أيضا أهدابا غير مكتملة على طول حواف الإطار. يمكن إزالة هذه الكائنات يدويا في الخطوة 3.4 أو يمكن إزالتها تلقائيا في GA3. حدد معالجة ثنائية > إزالة الكائنات > الحدود اللمسية.
- حدد المعلمات لقياس أهداب.
- سحب وإسقاط المعلمات لقياس مثل طول أهداب (طول) وكثافة (مجموع كثافة الكائن). قم بتوصيل العقد إلى العقدة الثنائية المناسبة (اتصال A) وعقد القناة (الاتصال B). مرر مؤشر الماوس فوق اتصال العقدة للحصول على تلميح أدوات لإظهار الاتصال الذي تنتمي إليه العقدة. حدد قياس > حجم الكائن > الطول والقياس > كثافة الكائن > Sum Obj Intensity.
ملاحظة: العقدة طول يتصل فقط إلى العقدة الثنائية، بينما يتصل Sum Obj Intensity إلى كل من العقد الثنائية والقناة.
- سحب وإسقاط المعلمات لقياس مثل طول أهداب (طول) وكثافة (مجموع كثافة الكائن). قم بتوصيل العقد إلى العقدة الثنائية المناسبة (اتصال A) وعقد القناة (الاتصال B). مرر مؤشر الماوس فوق اتصال العقدة للحصول على تلميح أدوات لإظهار الاتصال الذي تنتمي إليه العقدة. حدد قياس > حجم الكائن > الطول والقياس > كثافة الكائن > Sum Obj Intensity.
- إلحاق القياسات في جدول واحد.
- الجمع بين جميع القياسات في جدول إخراج واحد عن طريق سحب وإسقاط العقدة إلحاق العمود إلى مخطط تدفق التحليل وتوصيله إلى العقد القياس، وطول و Sum Obj Intensity. حدد عمود إلحاق > الأساسي > إدارة البيانات.
- قياس أهداب.
- قياس أهداب بالنقر فوق تشغيل. تستغرق هذه العملية بضع لحظات لقياس جميع الأهداب في الصور التجريبية. ستظهر الأطوال والكثافة في إطار نتائج تحليل جديد.
ملاحظة: يمكن أن يتضمن الجدول أحيانا بيانات من أقنعة تعرفت عليها Ai على أنها أهداب ولكنها كانت صغيرة جدا بحيث لا يمكن اكتشافها بالعين البشرية والقضاء عليها في الخطوة 3.4. يمكن إزالة هذه الكائنات من مجموعة البيانات باستخدام عامل تصفية قبل التحليل الإحصائي. هنا، تم استخدام مرشح من 1 ميكرومتر لقياسات طول أهداب المختبر في الشكل 2 و 2 ميكرومتر في سيليا الجسم الحي. ويمكن القيام بذلك قبل تصدير البيانات باستخدام المسار أدناه. حدد إطار نتائج التحليل > تعريف عامل التصفية > إدخال عامل تصفية استخدام القيمة >.
- قياس أهداب بالنقر فوق تشغيل. تستغرق هذه العملية بضع لحظات لقياس جميع الأهداب في الصور التجريبية. ستظهر الأطوال والكثافة في إطار نتائج تحليل جديد.
- تصدير البيانات للتحليل الإحصائي.
5. دراسات كولوكالات
ملاحظة: يمكن تضمين تحليل الكولوكال في نفس وصفة GA3 المستخدمة لقياس طول أهداب وتحليل الكثافة. إذا كنت تستخدم نفس الوصفة، افتح الملفات كما هو موضح أدناه و قم بقياس أطوال و كثافة القناتين مع معاملات التكون في نفس خط أنابيب التحليل.
- افتح مجموعة البيانات التجريبية.
- فتح الصور confocal التجريبية من أهداب في البرنامج عن طريق تحويل عينة .tif الملفات إلى ملفات.nd2. حدد ملف > استيراد/تصدير > إنشاء ملف ND من تسلسل الملفات.
- في النافذة المنبثقة، حدد ملفات أحادية اللون عمق 16 بت من كافة القنوات ذات الاهتمام من مستكشف الإطار الموجود في العمود الأول من النافذة المنبثقة. حدد Multipoint أو Z Series من القائمة المنسدلة الأولى وأدخل قيمة مطابقة لإجمالي عدد الصور أو المداخن، على التوالي.
- في المربع المنسدل الثاني، حدد الطول الموجي وغير القيمة إلى إجمالي عدد القنوات في المجلد. سيقوم البرنامج تلقائيا بإلغاء قفل نافذة تحديد الطول الموجي الموجودة في الطرف الأيمن السفلي من النافذة المنبثقة. استخدم القائمة المنسدلة اللون لتحديد لون كل قناة. قم بتزويد كل قناة باسم مختلف ضمن عمود الاسم. بمجرد تحديث كافة المعلومات، انقر فوق تحويل. سيقوم البرنامج تلقائيا بإنشاء ملف صورة جميع تراكب مع جميع الصور الفردية من جميع القنوات المحددة.
- معايرة الصور.
- أدخل حجم البكسل في الزاوية اليسرى السفلى من الصورة. انقر بزر الماوس الأيمن فوق غير > معايرة المستند > حجم البكسل.
- تشغيل Ai المدربين على القناة الأولى.
- البدء في تحديد أهداب على واحدة من القنوات المفتوحة (على سبيل المثال، ACIII؛ الشكل 5A) باستخدام الذكاء الاصطناعي. سيقوم البرنامج الآن برسم الثنائيات على أهداب ACIII المسمى استنادا إلى التدريب الذي تلقاه لهذه القناة. هذه العملية سوف يستغرق بضع ثوان. حدد قنوات مصدر NIS.ai > Segment.ai > > ACIII.
- تشغيل Ai المدربين على القناة الثانية.
- البدء في تحديد أهداب على قناة أخرى مفتوحة (على سبيل المثال، MCHR1; الشكل 5ب) باستخدام الذكاء الاصطناعي. سيقوم البرنامج الآن برسم الثنائيات على MCHR1 المسمى أهداب استنادا إلى التدريب الذي تلقاه لهذه القناة. وسوف تستغرق هذه العملية بضع لحظات. حدد قنوات المصدر NIS.ai > Segment.ai > > MCHR1.
- تحقق من الصور بحثا عن الثنائيات التي تم تحديدها بشكل خاطئ.
- بمجرد أن يتعرف الذكاء الاصطناعي على أهداب وازدوان مرسومة ، تحقق من الصور بحثا عن أي كائنات تم تحديدها بشكل خاطئ. حذف أي ثنائيات تم تحديدها بشكل خاطئ يدويا إذا لزم الأمر. حدد عرض عناصر تحكم تحليل > > شريط الأدوات الثنائي > حذف الكائن.
- إنشاء وصفة GA3 جديدة.
- والآن بعد أن تم تحديد أهداب وتقسيمها، انتقل إلى تحليل التكسير باستخدام أداة GA3. سيؤدي ذلك إلى فتح نافذة جديدة مع مساحة فارغة في الوسط حيث سيتم تعريف التحليل. سيتم إنشاء إطار مع كافة الثنائيات والقنوات المعرفة. تحقق من وجود كافة القنوات الثنائية المطلوبة للتحليل وتحديدها. حدد صورة > GA3 وصفة جديدة.
- إزالة الكائنات التي تلمس حدود الإطار.
- وبما أن الذكاء الاصطناعي سيقسم جميع الكائنات الشبيهة بال أهداب في الإطار، فإنه سيكتشف أيضا أهدابا غير مكتملة على طول حواف الإطار. يمكن إزالة هذه الكائنات يدويا في الخطوة 5.5 أو يمكن إزالتها تلقائيا في GA3. حدد معالجة ثنائية > إزالة الكائنات > الحدود اللمسية.
- قم بإعداد مسار التكون في GA3.
- لقياس التداخل بين القناتين داخل أهداب، استخدم ارتباط معامل Mander. اسحب وأسقط عقدة معامل Manders في المساحة الفارغة لوصفة GA3 وقم بتوصيلها بالثنائي والقنوات المناسبة. هنا، 'اتصال A' يتصل مع ثنائي ACIII، 'اتصال B' مع قناة MCHR1 و 'اتصال C' مع قناة ACIII لتحديد التداخل بين MCHR1 داخل ثنائي ACIII. حدد قياس قياس > قياس نسبة الكائن > معامل Manders.
ملاحظة: يسمح البرنامج لقياس كولوكالينج باستخدام بيرسون معامل الارتباط باستخدام نفس الخطوات كما هو موضح في هذا البروتوكول40.
- لقياس التداخل بين القناتين داخل أهداب، استخدم ارتباط معامل Mander. اسحب وأسقط عقدة معامل Manders في المساحة الفارغة لوصفة GA3 وقم بتوصيلها بالثنائي والقنوات المناسبة. هنا، 'اتصال A' يتصل مع ثنائي ACIII، 'اتصال B' مع قناة MCHR1 و 'اتصال C' مع قناة ACIII لتحديد التداخل بين MCHR1 داخل ثنائي ACIII. حدد قياس قياس > قياس نسبة الكائن > معامل Manders.
- إلحاق القياسات في جدول واحد.
- الجمع بين جميع القياسات في جدول إخراج واحد. حدد عمود إلحاق > الأساسي > إدارة البيانات.
- قياس الكولوكال.
- قياس أهداب بالنقر فوق تشغيل. تستغرق هذه العملية بضع لحظات لقياس جميع الأهداب في الصور التجريبية. ستظهر البيانات في إطار "نتائج التحليل" جديد.
- تصدير البيانات للتحليل الإحصائي.
النتائج
تدريب الذكاء الاصطناعي لتحديد الأهداب
قياس وتقييم الطول الهيكليilia وتكوين يمكن أن تكون مملة، تستغرق وقتا طويلا، وعملية عرضة للخطأ. هنا، نستخدم الذكاء الاصطناعي لتقسيم أهداب بدقة من مجموعة كبيرة من الصور وتحليل أطوالها وكثافتها باستخدام أداة تحليل(الشكل 1). تتطلب جميع نهج الذكاء الاصطناعي خطوات تدريبية لتنفيذها. أنشأنا خط أنابيب التدريب للتعرف على أهداب, الذي تم تنفيذه عن طريق تطبيق أقنعة ثنائية يدويا على الهياكل السيلاري. ثم يتم استخدام هذه المعلومات لتدريب Ai استنادا إلى خصائص البكسل تحت الثنائيات المطبقة. كمبدأ توجيهي عام ، ينطوي التدريب على البرنامج الذي يمر بعدة تكرارات ، حوالي 1000 ، ويعتبر الأمثل إذا كان معدل فقدان أو خطأ التدريب أقل من 1٪. ومع ذلك، يمكن أن يختلف عدد التكرارات والأخطاء في عملية التدريب اعتمادا على عينة الصور المستخدمة للتدريب. على سبيل المثال، بعد دورات التدريب لدينا باستخدام الصور في المختبر أهداب الخلايا العصبية، وكان معدل الخطأ 1.378٪ مقارنة مع 3.36٪ للصور في قسم الدماغ في الجسم الحي ( الشكل التكميلي1). وبمجرد الانتهاء من التدريب، يمكن استخدام الذكاء الاصطناعي لتقسيم أهداب من الصور التجريبية في غضون ثوان وتستخدم الأقنعة الثنائية الناتجة لقياس المعلمات الهيكلية. هذا يلغي الحاجة إلى تقسيم الكائنات باستخدام الطريقة التقليدية للحد الأدنى للكثافة التي قد تكون صعبة في الصور ذات الضوضاء الخلفية العالية أو عندما تكون الكائنات على مقربة من بعضها البعض. كما يقلل الذكاء الاصطناعي من احتمال الخطأ والتحيز من خلال تطبيق نفس الخوارزمية عبر جميع الصور، بغض النظر عن المستخدم.
قياس طول أهداب باستخدام GA3
يتم تنظيم طول سيليا بإحكام ويرتبط مع الآثار الوظيفية على الإشارات16ciliary ،19. هنا، قمنا بقياس أطوال أهداب باستخدام خط أنابيب تحليل داخل برنامج NIS Elements يسمى التحليل العام 3 أو GA3. تساعد GA3 في الجمع بين أدوات متعددة في سير عمل واحد لإنشاء إجراءات مخصصة لكل تجربة. بدأنا بقياس أطوال أهداب في خط الخلية. تم تسمية سيليا على قناة جمع النخاع الداخلية الماوس (IMCD-3) الخلايا المناعية مع أنبوبولين أسيتيلاتيد وصورت باستخدام المجهر confocal. قمنا بقياس أطوال أهداب باستخدام GA3 بعد تقسيم مع segment.ai (الشكل التكميلي 3A). في حين تم العثور على الأسيتيلاتيد α-توبولين بشكل تفضيلي في السيليوم الأولي، كما أنها وجدت في المناطق الغنية microtubule أخرى مثل الهيكل الخلوي، فضلا عن الجسر الخلوي. حددت منظمة العفو الدولية المدربين بشكل صحيح أهداب في الصورة ولكن ليس غيرها من الهياكل الإيجابية غير السيلية، الأنبوبية اللاذعة. وتراوحت سيليا على خلايا IMCD من 0.5 ميكرومتر إلى 4.5 ميكرومتر بمتوسط طول 1.8 ± 0.04 ميكرومتر(الشكل 2A). اختبرنا بعد ذلك قدرة الذكاء الاصطناعي على قياس أطوال الأهداب في الثقافات العصبية الأولية. نحن زراعة الخلايا العصبية من تحت المهاد والحصين من الفئران حديثي الولادة لمدة 10 أيام والمناعة لهم مع علامة أهداب الأدينيلات سيكلاسي الثالث (ACIII)21,41. عند تحليل الثقافات العصبية، وجدنا أنه من المفيد تطبيق مرشح قبل تحليل إحصائيا أطوال. وبسبب انخفاض نسبة الإشارة إلى الضوضاء، تم تحديد عدة أجسام أقل من 1 ميكرومتر لم تكن أهداب. لذلك، قمنا بتصفية البيانات للقضاء على أي كائنات يقل طولها عن 1 ميكرومتر لضمان تحليل أهداب فقط. في الخلايا العصبية تحت المهاد المستزرعة، تراوحت أطوال أهداب من 2 ميكرومتر إلى 7 ميكرومتر بمتوسط طول 3.8 ± 0.19 ميكرومتر (الشكل 2B). ومن المثير للاهتمام، مثقف فرس النهر الخلايا العصبية أهداب كانت أطول مع متوسط طول 6.73 ±0.15μm (الشكل 2C). وقد أفيد أن نواة الخلايا العصبية المختلفة داخل تحت المهاد تظهر أطوال أهداب متميزة وأن هذه الأهداب تغير أطوالها استجابة للتغيرات الفسيولوجية بطريقة نواة محددة19،23. لذلك ، قمنا أيضا بتصنيف أقسام الدماغ تحت المهاد من فئران C57BL/6J الذكور البالغين مع ACIII وصورنا نواة القوس (ARC) ونواة البطين (PVN). باستخدام GA3 لقياس أطوال أهداب، لاحظنا أن في الجسم الحي تحت المهاد أهداب ظهرت لفترة أطول من في أهداب المختبر. على وجه التحديد، تتراوح الإهداب تحت المهاد في الجسم الحي من 1 ميكرومتر إلى حوالي 15 ميكرومتر(الشكل 3). لم تكن هناك اختلافات كبيرة بين أطوال أهداب في PVN (5.54 ± 0.0.42 ميكرومتر) وتلك الموجودة في ARC (6.16 ± 0.27 ميكرومتر) (الشكل 3C)23. وبالمثل، فإن أهداب منطقة كورنو أمونيس (CA1) من قرن آمون تعرض نطاقا أضيق من 1 ميكرومتر إلى 10 ميكرومتر بمتوسط طول 5.28 ± 0.33 ميكرومتر(الشكل 3). وفقا للدراسات المنشورة سابقا، أظهر تحليلنا باستخدام أدوات Ai و GA3 أن أهداب من مناطق الدماغ المختلفة يظهر التنوع في الطول19و23. وعلاوة على ذلك، باستخدام هذا النهج منظمة العفو الدولية ونحن قادرون على تقييم سريع لعدد كبير من أهداب.
قياس تكوين أهداب باستخدام GA3
السيليوم الأولي هو محور الإشارات للعديد من المسارات التي تستخدم أنواع متنوعة من البروتينات لتنفيذ وظائف فريدة من نوعها مثل البروتينات الحركية، والبروتينات النقل داخلflagellar وGPCRs على سبيل المثال لا الحصر3،24،42،43. الحفاظ على المستويات المناسبة من هذه البروتينات داخل السيليوم مهم لحسن سير العمل وغالبا ما يبدو سياق الخلية تعتمد. الوسم الفلوري لهذه البروتينات لم يمكننا فقط من تصورها ولكن أيضا تحديد كثافتها كمقياس لكمية البروتين المسمى داخل المقصورة الصغيرة نسبيا20. لذلك، سعينا لتحديد شدة GPCR السيلاري، الميلانين مستقبلات هرمون التركيز 1 (MCHR1)، في الجسم الحي في كل من ARC وPVN من تحت المهاد من الفئران الذكور البالغين24،44. باستخدام Ai و GA3 ، قمنا بقياس أطوال أهداب MCHR1 الإيجابي جنبا إلى جنب مع الكثافات لضمان أن الكائنات التي يتم عدها هي أهداب(الشكل التكميلي 3A). قضينا على الكائنات بعد التحليل التي كانت أقل من 2 ميكرومتر في الطول وحللنا كثافة الأقنعة الثنائية المتبقية. ومن المثير للاهتمام، وجدنا أن كثافة MCHR1 ciliary في PVN أعلى بكثير من ذلك في ARC مما يدل على وجود أقوى من MCHR1 ciliary في PVN (الشكل 4). هناك حاجة إلى مزيد من الدراسات لتحديد أهمية MCHR1 السيلاري في هذه الدوائر العصبية. قمنا أيضا بقياس شدة MCHR1 السيلاري في الخلايا العصبية المستزرعة الأولية من تحت المهاد والحصين. أهداب من كلا الثقافتين عرض توزيع واسع من كثافة MCHR1 مما يشير إلى وجود مجموعات الخلايا العصبية غير متجانسة(الشكل التكميلي 2). وهكذا، فإن استخدام أدوات تحليلية متطورة مثل Ai و GA3 يسمح بتقييم عدم التجانس الإهيليا داخل نفس النسيج أو بين أنسجة متعددة. سيكون من المثير للاهتمام أن نرى ما إذا كانت GPCRs العصبية الأخرى تظهر اختلافات مماثلة في توطينها داخل الخلايا العصبية من نفس الأنسجة وإذا كان هذا يتغير استجابة للتغيرات الفسيولوجية.
الكولوكالات
في حين أن قياس كثافة الفلورسينس داخل حقل صورة كاملة يمكن أن يعطي انطباعا بالبروتين ، فإنه يفشل في توفير معلومات مثل التوزيع المكاني أو القرب من البروتينات والهياكل الخلوية القريبة الأخرى. هنا، قمنا بقياس تداخل MCHR1 مع ACIII كعلامة أهداب من خلال رسم شدة MCHR1 مقابل ذلك من ACIII لكل قناع ثنائي(الشكل 5). يظهر الرسم البياني أن غالبية أهداب إيجابية لكل من ACIII و MCHR1 ، على الرغم من أن بعض أهداب تظهر تعبيرا أقوى عن قناة واحدة على الأخرى. وعلاوة على ذلك، هناك بعض أهداب التي تظهر وجود إما ACIII أو MCHR1 كما هو واضح من النقاط التي تقع مباشرة على المحور س و ص محور على التوالي. لقياس هذا التداخل، قمنا بقياس معامل التداخل في Mander وقارنا مدى تعبير MCHR1 في أهداب الخلايا العصبية ل ARC وPVN40. ومن المثير للاهتمام أن تحليلنا كشف عن وجود زيادة كبيرة في معاملات PVN (0.6382 ± 0.0151) من تلك الموجودة في ARC (0.5430 ± 0.0181) (الشكل 5C). وهذا يتفق مع بياناتنا السابقة حيث لاحظنا شدة MCHR1 أعلى في PVN مقارنة ARC(الشكل 4). تشير هذه البيانات إلى أنه مثل طول الأهداب ، يختلف نمط التعبير عن MCHR1 في المقصورة الوسطية في مناطق مختلفة من الدماغ. باستخدام خط أنابيب التحليل نفسه، سيكون من الممكن تحديد ما إذا كانت GPCRs السيلاري الأخرى مثل Neuropeptide Y مستقبلات نوع 2 (NPY2R) وSmatostatin مستقبلات نوع 3 (SSTR3) تظهر كميات مماثلة من التنوع.
قياس الكثافة على طول السيليوم
بمجرد التعرف على أهداب باستخدام segment.ai ، يمكن تعديل وصفة GA3 للجمع بين تحليل أهداب مع تحديد الهياكل الأخرى ذات الاهتمام بالصورة. على سبيل المثال، وضع العلامات مع علامات الجسم القاعدية مفيد لتحديد قطبية أهداب. للقيام بهذا التحليل، قمنا بتصوير أقسام الدماغ تحت المهاد من فئران P0 التي تعبر عن ARL13B-mCherry وCentrin2-GFP وصورنا ARC وPVN34. هنا، تم تحديد أهداب باستخدام الذكاء الاصطناعي كما كان من قبل ولكن الآن وصفة GA3 المعدلة تشمل تحديد Centrin2-GFP، وهو بروتين سنتريولار وجدت في قاعدة أهداب (الشكل التكميلي 3B). من خلال وضع العلامات Centrin2-GFP، يمكن تمييز قاعدة أهداب من نصائح ARL13B-mCherry أهداب إيجابية (الشكل 6A). ثم، بدلا من قياس كثافة داخل أهداب كله، ونحن قادرون على قياس التغيرات في كثافة ARL13B على طول أهداب(الشكل 6B). يمكننا أيضا مقارنة الاختلافات في كثافة ARL13B بين النهايات القريبة والنهايات البعيدة للإهداب. للقيام بذلك، قسمنا طول السيليوم في صناديق 1 ميكرون بدءا من القاعدة وعيننا أول سلة ميكرون كنهاية قريبة وآخر سلة ميكرون كنهاية بعيدة. كشف تحليلنا أن هناك أكثر بكثير ARL13B موجودة أقرب إلى القاعدة من غيض من السيليوم في كل من ARC وPVN، وهذا يتفق مع الدراسات المنشورة سابقا في chondrocytes الإنسان45 (الشكل 6C). في هذا النوع من التحليل، بدلا من تطبيق مرشح طول لاستبعاد الأجسام الصغيرة غير السيلارية من التحليل، يتم تحليل أهداب فقط المرتبطة وضع العلامات Centrin2-GFP. وهذا يمكن أن يكون مفيدا في الحالات التي تجعل فيها الطفرات الوراثية أهداب قصيرة جدا، أو إذا كانت التغيرات في النطاقات الفرعية أهداب مثل المنطقة الانتقالية أو تلميح متورطة. تحديد أهداب باستخدام تحليل Ai و GA3 قابل للتكيف للغاية ويمكن تصميمه ليناسب مجموعة متنوعة من الأسئلة البحثية المعقدة.
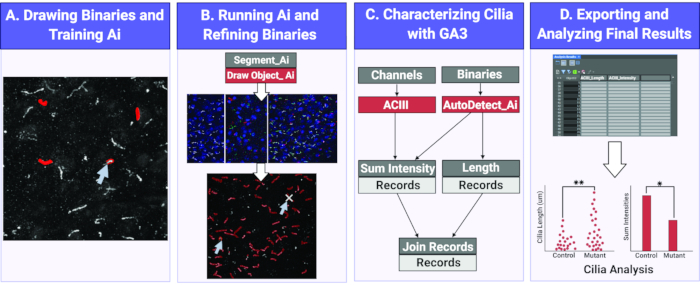
الشكل 1. سير العمل لقياس طول وكثافة الأهداب باستخدام الذكاء الاصطناعي. (أ)لتدريب Ai، يتم رسم الثنائيات حول الأشياء ذات الاهتمام (أهداب) على صور التدريب الخام. باستخدام الثنائيات المرسومة ، يتم تدريب Segment Ai على التعرف على شكل وكثافة البكسل للإهداب. (ب)بعد ذلك ، يتم تطبيق الجزء المدرب Ai على الصور التجريبية الخام. فإنه يرسم الثنائيات على الأشياء التي تعترف بها كما أهداب. يمكن صقل هذه الثنائيات للتأكد من أن جميع أهداب فقط ويجري تحليلها. (ج)تم إنشاء برنامج GA3 لتحليل كثافة وطول الأشياء التي تعترف بها منظمة العفو الدولية. (د)يتم استيراد السجلات إلى جدول في البرنامج. ويمكن بعد ذلك تصدير هذا الجدول لمزيد من التحليل. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 2. في المختبر قياسات طول أهداب. صور تمثيلية من أهداب في (أ) خلايا IMCD (الأخضر، أنبوبي أسيتيليد) (ب) الثقافات الأولية تحت المهاد (الأخضر، ACIII) و (C) ثقافات فرس النهر (الأخضر، ACIII). تم استخدام Ai المدربة للتعرف على أهداب كما هو موضح في القناع الثنائي (أرجواني) ثم تم استخدام GA3 لقياس طول أهداب. يتم رسم توزيع طول أهداب كنسبة مئوية من أهداب في صناديق 0.5 أو 1.0 ميكرون. * يشير إلى جسر السيتوكينيتي بشكل صحيح غير معترف بها من قبل منظمة العفو الدولية. n= 225 أهداب في خلايا IMCD من 3 تكرارات، و54 أهداجا في تحت المهاد و139 أهداب في ثقافات فرس النهر من 3. أشرطة مقياس 10 ميكرومتر. الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.
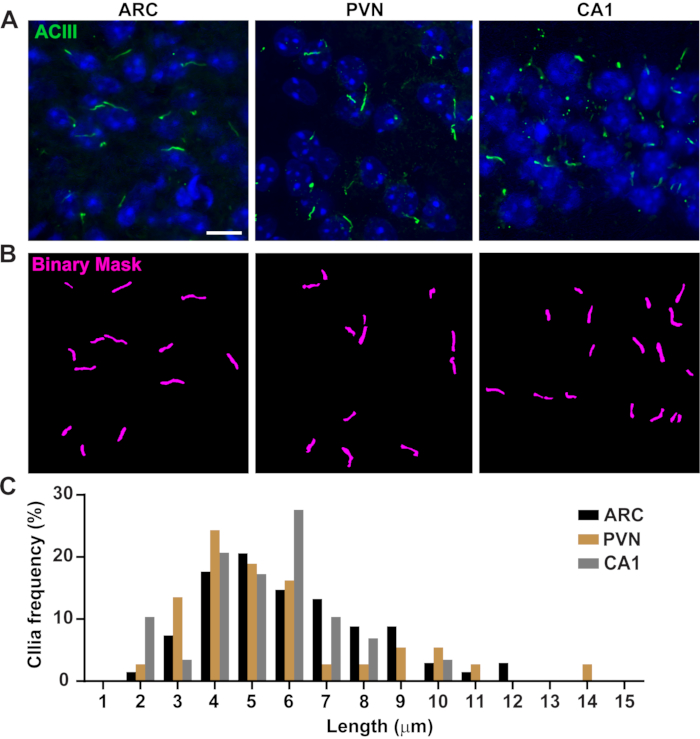
الشكل 3. في قياسات طول أهداب الجسم الحي. (أ) صور تمثيلية من أهداب (الأخضر، ACIII) في ARC، PVN، وCA1 من أقسام الدماغ الماوس الكبار. (ب)تم استخدام Ai المدرب في عناصر NIS للتعرف على أهداب كما هو موضح في القناع الثنائي (أرجواني) ثم تم استخدام GA3 لقياس طول أهداب. (ج)توزيع طول أهداب هو رسم بياني كنسبة مئوية من أهداب في صناديق ميكرون واحد. ن = 68 أهداب في ARC، 36 في PVN و 29 في CA1 من 3. أشرطة مقياس 10 ميكرومتر. الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.
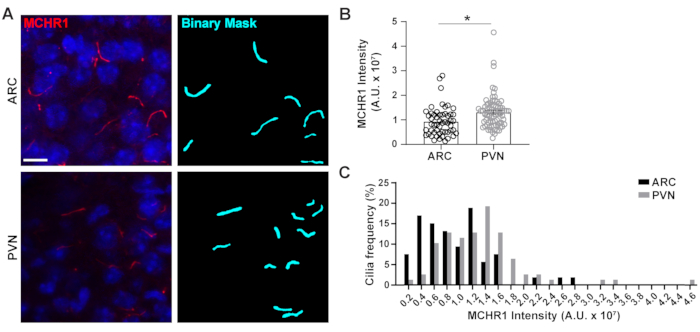
الشكل 4. ساعدت منظمة العفو الدولية أهداب تلطيخ قياسات كثافة من أهداب الخلايا العصبية تحت المهاد. (أ) صور تمثيلية من أهداب (MCHR1، أحمر) في ARC وPVN من أقسام دماغ الماوس الكبار. تم استخدام الذكاء الاصطناعي المدرب في عناصر NIS للتعرف على أهداب كما هو موضح في القناع الثنائي (سماوي) ثم تم استخدام GA3 لقياس كثافة تلطيخ MCHR1 في أهداب. (ب)يتم رسم كثافة MCHR1 كمتوسط ± S.E.M. كل نقطة تمثل سيليوم. * ع < 0.05 ، الطالب تي الاختبار. (ج)توزيع كثافة MCHR1 هو رسم بياني كنسبة مئوية من أهداب في صناديق من 0.2 × 107 وحدات التعسفي (A. U.). ن = 53 أهداب في ARC، 78 في PVN من 3. أشرطة مقياس 10 ميكرومتر. الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.
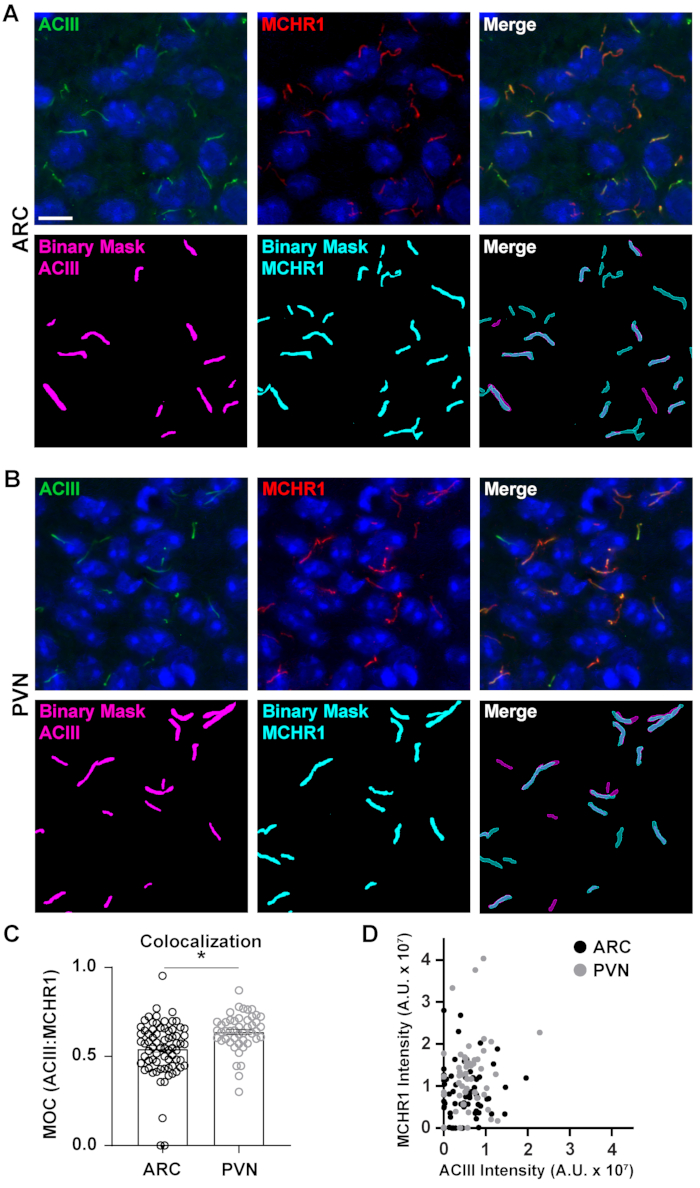
الشكل 5. ساعدت منظمة العفو الدولية تحليل الكولوكالات أهداب. (أ, ب) صور تمثيلية من أهداب في ARC وPVN على التوالي. وصفت سيليا مع ACIII (الأخضر) وMCHR1 (الأحمر). تم استخدام Ai مدرب في عناصر NIS للتعرف على أهداب كما هو موضح في القناع الثنائي (أرجواني لACIII المسمى أهداب، سماوي لMCHR1 المسمى أهداب). تم استخدام GA3 للتعرف على أهداب التي تحتوي على كل من ACIII و MCHR1. (ج)قيم معامل التداخل (MOC) المتراكبة يتم رسمها كمتوسط ± S.E.M. كل نقطة تمثل سيليوم. * ع < 0.05 ، الطالب تي الاختبار. (D) مبعثر مؤامرة من كثافة MCHR1 مقابل كثافة ACIII في ARC وPVN. كل نقطة تمثل سيليوم. ن = 72 أهداب في ARC، 47 في PVN من 3. أشرطة مقياس 10 ميكرومتر. الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.
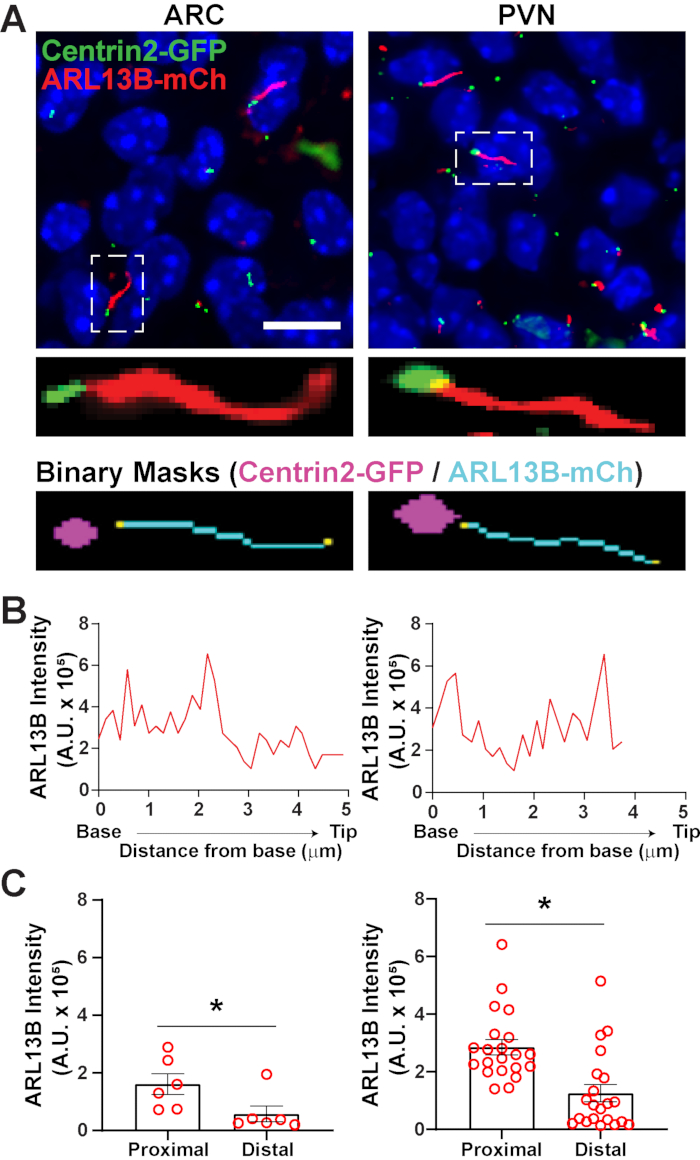
الشكل 6. سيليا وتحليل الجسم القاعدي. (أ) صور تمثيلية من أهداب (الأحمر، ARL13B-mCherry) وعلامة الجسم القاعدية (الأخضر، Centrin2-GFP) في ARC وPVN من الفئران P0. تم استخدام Ai المدرب للتعرف على أهداب كما هو موضح في القناع الثنائي (سماوي). تم رسم القناع الثنائي للجسم القاعدي (أرجواني) عن طريق العتبة في وصفة GA3. (ب) خط تمثيلي مسح كثافة سيليوم. (ج)ARL13B كثافة في نهايات قريبة وقاصية من منظمة العفو الدولية التعرف على أهداب رسمها البياني كمتوسط ± S.E.M. وتعرف النهايات القريبة والقاصية بأنها المنطقة الواقعة ضمن الطول الأول 1 ميكرومتر وطول آخر 1 ميكرومتر على التوالي من قاعدة السيليوم. كل نقطة تمثل سيليوم. * ص < 0.05. ن = 6 أهداب في ARC من 2 الحيوانات و 21 أهداب في PVN من 3. أشرطة مقياس 10 ميكرومتر. الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.
الشكل التكميلي 1 - الأرقام التكميلية 1- الأرقام التكميلية 1 منظمة العفو الدولية التدريب فقدان الرسوم البيانية. (A, B) الرسوم البيانية التي تبين فقدان التدريب من segment.ai على أهداب الخلايا العصبية في المختبر وفي الجسم الحي, على التوالي. الرجاء الضغط هنا لتحميل هذا الملف.
الشكل التكميلي 2 - الأرقام التكميلية 2- الأرقام التكميلية 2- ال منظمة العفو الدولية ساعد سيليا تلطيخ قياسات كثافة في أهداب الخلايا العصبية في المختبر . (أ, ب) صور تمثيلية من أهداب (MCHR1، أحمر) في الثقافات الأولية تحت المهاد وفرس النهر، على التوالي. تم استخدام الذكاء الاصطناعي المدرب في عناصر NIS للتعرف على أهداب كما هو موضح في القناع الثنائي (سماوي) ثم تم استخدام GA3 لقياس كثافة تلطيخ MCHR1 في أهداب. يتم رسم توزيع كثافة MCHR1 كنسبة مئوية من أهداب في 1000 صناديق الاتحاد الأوروبي لhypothalamic و 2000 A. صناديق U. لثقافات فرس النهر. ن = 30 أهداب في تحت المهاد و 106 أهداب في ثقافات فرس النهر من 3. أشرطة مقياس 10 μm. الرجاء انقر هنا لتحميل هذا الملف.
الشكل التكميلي 3 - الأرقام التكميلية 3- الأرقام التكميلية 3- ال التحليل العام 3 وصفات لتحليل أهداب. (أ)تحليل عام بسيط (GA3) وصفة لقياس طول أهداب وكثافة ومعامل ماندر. (ب) وصفة GA3 معقدة لقياس كثافة على طول السيليوم باستخدام علامة للجسم القاعدي. الرجاء الضغط هنا لتحميل هذا الملف.
Discussion
قياسات الطول والكثافة هي طرق شائعة يتم تحليل أهداب الأولية، ومع ذلك، لا توجد طريقة تقليدية موحدة المستخدمة في هذا المجال. تحديد وتكميم أهداب الأولية باستخدام برامج مثل ImageJ هو مضيعة للوقت وعرضة للتحيز المستخدم والخطأ. وهذا يجعل من الصعب تحليل مجموعات البيانات الكبيرة بدقة. هنا نظهر أن استخدام برنامج الذكاء الاصطناعي يمكن التغلب على العديد من هذه التحديات مما يجعل تحليل الإنتاجية العالية من أهداب الأولية قابلة للتحقيق. هنا نحن وصف الإجراء لتدريب تطبيق على أساس الذكاء الاصطناعي للتعرف على أهداب الأولية وتحديد الخطوات اللازمة لتحليل الطول والكثافة.
في حين أن التدريب الأولي للذكاء الاصطناعي للتعرف على أهداب يتطلب وقتا كبيرا من المستخدم، وبمجرد الانتهاء من ذلك يمكن استخدامه على أي مجموعة بيانات المكتسبة مع نفس المعلمات. القناع الثنائي الذي تم إنشاؤه بواسطة Ai قابل للتعديل بحيث يمكن تصحيح أي أخطاء. ومع ذلك ، يجب أن تشير الأخطاء في تحديد أهداب المستخدم إلى أن الذكاء الاصطناعي يحتاج إلى مزيد من التدريب مع صور إضافية. إحدى المزايا الرئيسية لهذه الطريقة هي أنه يمكن تدريب الذكاء الاصطناعي على التعرف على الأهداب في أنواع عينات مختلفة في كل من 2D و 3D. أساليب التحليل السابقة المتولدة داخل المختبرات لها قيود مختلفة بما في ذلك تتطلب العتبة اليدوية لتحديد الهوية ومشاكل في تحديد أهداب مصورة من أقسام الأنسجة حيث كثافة الخلية عالية36،46،47. هذه الأساليب متخصصة أيضا في تحليل أهداب بينما التحليل باستخدام برنامج NIS Elements يمكن أن يقيم عدة جوانب من الصور في وقت واحد. لأن منظمة العفو الدولية الموصوفة هنا هو جزء من حزمة برامج عناصر NIS ، يمكن بسهولة استمرار الصور المكتسبة باستخدام مجهر نيكون من خلال التحليل. ومع ذلك ، التصوير مع نيكون ليست مطلوبة لاستخدام هذه الطريقة. بغض النظر عن تنسيق ملف البيانات الأولية الملتقطة، يمكن فتح ملفات ".tif" بواسطة عناصر NIS لاستخدامها في Ai.
هذا التطبيق منظمة العفو الدولية ضمن عناصر NIS متاحة على نطاق واسع، وربما بالفعل جزءا من برنامج تحليل الصور المستخدمة من قبل مختبرات دراسة أهداب الأولية. مع توسع انتشار تقنية الذكاء الاصطناعي ، قد توسع برامج التصوير الأخرى خيارات التحليل الخاصة بها لتشمل وحدة Ai مماثلة. يمكن استخدام تطبيق تحليل الذكاء الاصطناعي على تعريف أهداب لعدة جوانب مختلفة من تحليل أهداب. بينما حددنا طرق لبعض التحليلات البسيطة مثل الطول (الشكل 2 و 3) ، يمكن إضافة الكثافة (الشكل 4) والتكسير(الشكل 5)إلى سير عمل تحليل GA3 كما هو الحال في الشكل 6. فعلى سبيل المثال، بدلا من قياس كثافة السيليوم الكامل، قد تكون الاختلافات في الكثافة داخل منطقة فرعية من السيليوم ذات أهمية لتقييم التعريب دون الوسطي. الاختلافات في كثافة داخل منطقة دون إقليمية من السيليوم يمكن أن تشير إلى البروتين يتراكم في طرف أو قاعدة السيليوم، مثل كيفية إثراء البروتينات غلي في غيض من أهداب48. بالإضافة إلى ذلك، يمكن استخدام تطبيق الذكاء الاصطناعي هذا لتحديد الاختلافات بسهولة بين الأنماط الجينية أو مجموعات العلاج. في حين أن مختبرنا يستخدم هذه الطريقة في المقام الأول لتحليل أهداب مصورة من أقسام الدماغ أو الثقافات العصبية ، يمكن تطبيقه على الصور المكتسبة من خطوط الخلايا المختلفة أو أنواع الأنسجة الأخرى. مرونة نوع العينة التي يمكن استخدام هذا التطبيق على يجعل هذه الطريقة من التحليل قيمة لكثير من المجموعات المختلفة دراسة أهداب الأولية أو أي العضية المنفصلة التي يجري تقييمها مثل الميتوكوندريا, نواة, أو ER.
Disclosures
المؤلف المشارك ويسلي لويس هو موظف في نيكون. لا توجد إفصاحات مالية.
Acknowledgements
تم تمويل هذا العمل من قبل المعهد الوطني للسكري وأمراض الجهاز الهضمي والكلى R01 DK114008 إلى NFB ومنحة زمالة جمعية القلب الأمريكية #18PRE34020122 إلى RB. نشكر ريتش جروسكين المدير العام لبرامج نيكون، ميليسا بنتلي، كورتني هايكرافت وتيريزا ماستراتشي على تعليقاتهم الثاقبة على المخطوطة.
Materials
| Name | Company | Catalog Number | Comments |
| Intel Xeon, 3.6 GHz, 32GB RAM | Intel Corporation | W-2123 | Processor used for running NIS Elements. |
| Nikon Elements Software | Nikon Instruments Inc. | - | Ai and GA3 software |
| Quadro RTX 4000 Graphics card | NVIDIA Corporation | Quadro RTX 4000 | |
| Windows 10 Professional 64-bit | Microsoft Inc. | - | Operating system used for running NIS Elements |
| Workstation | HP Development Company, L.P. | HP Z4G4 | Workstation used for running NIS Elements |
References
- Wang, L., et al. Ciliary gene RPGRIP1L is required for hypothalamic arcuate neuron development. JCI Insight. 4 (3), (2019).
- Siljee, J. E., et al. Subcellular localization of MC4R with ADCY3 at neuronal primary cilia underlies a common pathway for genetic predisposition to obesity. Nature Genetics. 50 (2), 180-185 (2018).
- Davenport, J. R., et al. Disruption of intraflagellar transport in adult mice leads to obesity and slow-onset cystic kidney disease. Current Biology. 17 (18), 1586-1594 (2007).
- Berbari, N. F., O'Connor, A. K., Haycraft, C. J., Yoder, B. K. The primary cilium as a complex signaling center. Current Biology. 19 (13), 526-535 (2009).
- Walz, G. Role of primary cilia in non-dividing and post-mitotic cells. Cell Tissue Research. 369 (1), 11-25 (2017).
- Nachury, M. V., Mick, D. U. Establishing and regulating the composition of cilia for signal transduction. Nature Reviews. Molecular Cell Biology. 20 (7), 389-405 (2019).
- Goetz, S. C., Anderson, K. V. The primary cilium: a signalling centre during vertebrate development. Nature Reviews Genetics. 11 (5), 331-344 (2010).
- Engle, S. E., Bansal, R., Antonellis, P. J., Berbari, N. F. Cilia signaling and obesity. Seminars in Cell and Developmental Biology. , (2020).
- Reiter, J. F., Leroux, M. R. Genes and molecular pathways underpinning ciliopathies. Nature reviews. Molecular Cell Biology. 18 (9), 533-547 (2017).
- Waters, A. M., Beales, P. L. Ciliopathies: an expanding disease spectrum. Pediatric Nephrology. 26 (7), 1039-1056 (2011).
- Hildebrandt, F., Benzing, T., Katsanis, N. Ciliopathies. New England Journal of Medicine. 364 (16), 1533-1543 (2011).
- Vaisse, C., Reiter, J. F., Berbari, N. F. Cilia and Obesity. Cold Spring Harbor Perspectives in Biology. 9 (7), (2017).
- Berbari, N. F., et al. Leptin resistance is a secondary consequence of the obesity in ciliopathy mutant mice. Proceedings of the National Academy of Sciences of the United States of America. 110 (19), 7796-7801 (2013).
- Jacobs, D. T., et al. Dysfunction of intraflagellar transport-A causes hyperphagia-induced obesity and metabolic syndrome. Disease Models & Mechanisms. 9 (7), 789-798 (2016).
- Arsov, T., et al. Fat aussie--a new Alström syndrome mouse showing a critical role for ALMS1 in obesity, diabetes, and spermatogenesis. Molecular Endocrinology. 20 (7), 1610-1622 (2006).
- Tam, L. W., Ranum, P. T., Lefebvre, P. A. CDKL5 regulates flagellar length and localizes to the base of the flagella in Chlamydomonas. Molecular Biology of the Cell. 24 (5), 588-600 (2013).
- Rajagopalan, V., Subramanian, A., Wilkes, D. E., Pennock, D. G., Asai, D. J. Dynein-2 affects the regulation of ciliary length but is not required for ciliogenesis in Tetrahymena thermophila. Molecular Biology of the Cell. 20 (2), 708-720 (2009).
- Bengs, F., Scholz, A., Kuhn, D., Wiese, M. LmxMPK9, a mitogen-activated protein kinase homologue affects flagellar length in Leishmania mexicana. Molecular Microbiology. 55 (5), 1606-1615 (2005).
- Han, Y. M., et al. Leptin-promoted cilia assembly is critical for normal energy balance. Journal of Clinical Investigation. 124 (5), 2193-2197 (2014).
- Caspary, T., Marazziti, D., Berbari, N. F., Satir, P., Tvorup Christensen, S. . Cilia: Methods and Protocols. , 203-214 (2016).
- Bishop, G. A., Berbari, N. F., Lewis, J., Mykytyn, K. Type III adenylyl cyclase localizes to primary cilia throughout the adult mouse brain. Journal of Comparative Neurology. 505 (5), 562-571 (2007).
- Domire, J. S., Mykytyn, K. Markers for neuronal cilia. Methods in Cell Biology. 91, 111-121 (2009).
- Sun, J. S., et al. Ventromedial hypothalamic primary cilia control energy and skeletal homeostasis. Journal of Clinical Investigation. 131 (1), (2021).
- Berbari, N. F., Johnson, A. D., Lewis, J. S., Askwith, C. C., Mykytyn, K. Identification of ciliary localization sequences within the third intracellular loop of G protein-coupled receptors. Molecular Biology of the Cell. 19 (4), 1540-1547 (2008).
- Brailov, I., et al. Localization of 5-HT(6) receptors at the plasma membrane of neuronal cilia in the rat brain. Brain Research. 872 (1-2), 271-275 (2000).
- Domire, J. S., et al. Dopamine receptor 1 localizes to neuronal cilia in a dynamic process that requires the Bardet-Biedl syndrome proteins. Cellular and Molecular Life Sciences. 68 (17), 2951-2960 (2011).
- Handel, M., et al. Selective targeting of somatostatin receptor 3 to neuronal cilia. Neuroscience. 89 (3), 909-926 (1999).
- Koemeter-Cox, A. I., et al. Primary cilia enhance kisspeptin receptor signaling on gonadotropin-releasing hormone neurons. Proceedings of the National Academy of Sciences of the United States of America. 111 (28), 10335-10340 (2014).
- Mukhopadhyay, S., et al. The ciliary G-protein-coupled receptor Gpr161 negatively regulates the Sonic hedgehog pathway via cAMP signaling. Cell. 152 (1-2), 210-223 (2013).
- Berman, S. A., Wilson, N. F., Haas, N. A., Lefebvre, P. A. A novel MAP kinase regulates flagellar length in Chlamydomonas. Current Biology. 13 (13), 1145-1149 (2003).
- Nguyen, R. L., Tam, L. W., Lefebvre, P. A. The LF1 gene of Chlamydomonas reinhardtii encodes a novel protein required for flagellar length control. Genetics. 169 (3), 1415-1424 (2005).
- Tam, L. W., Wilson, N. F., Lefebvre, P. A. A CDK-related kinase regulates the length and assembly of flagella in Chlamydomonas. Journal of Cell Biology. 176 (6), 819-829 (2007).
- O'Connor, A. K., et al. An inducible CiliaGFP mouse model for in vivo visualization and analysis of cilia in live tissue. Cilia. 2 (1), 8 (2013).
- Bangs, F. K., Schrode, N., Hadjantonakis, A. K., Anderson, K. V. Lineage specificity of primary cilia in the mouse embryo. Nature Cell Biology. 17 (2), 113-122 (2015).
- Delling, M., et al. Primary cilia are not calcium-responsive mechanosensors. Nature. 531 (7596), 656-660 (2016).
- Saggese, T., Young, A. A., Huang, C., Braeckmans, K., McGlashan, S. R. Development of a method for the measurement of primary cilia length in 3D. Cilia. 1 (1), 11 (2012).
- Kobayashi, Y., Hamamoto, A., Saito, Y. Analysis of ciliary status via G-protein-coupled receptors localized on primary cilia. Microscopy. 69 (5), 277-285 (2020).
- Zhou, L. Q., et al. Artificial intelligence in medical imaging of the liver. World Journal of Gastroenterology. 25 (6), 672-682 (2019).
- Naugler, C., Church, D. L. Automation and artificial intelligence in the clinical laboratory. Critical Reviews in Clinical Laboratory Sciences. 56 (2), 98-110 (2019).
- Dunn, K. W., Kamocka, M. M., McDonald, J. H. A practical guide to evaluating colocalization in biological microscopy. American Journal of Physiology-Cell Physiology. 300 (4), 723-742 (2011).
- Bansal, R., et al. Hedgehog Pathway Activation Alters Ciliary Signaling in Primary Hypothalamic Cultures. Frontiers in Cellular Neuroscience. 13, 266 (2019).
- Jin, H., et al. The conserved Bardet-Biedl syndrome proteins assemble a coat that traffics membrane proteins to cilia. Cell. 141 (7), 1208-1219 (2010).
- Liew, G. M., et al. The intraflagellar transport protein IFT27 promotes BBSome exit from cilia through the GTPase ARL6/BBS3. Developmental Cell. 31 (3), 265-278 (2014).
- Engle, S. E., et al. A CreER Mouse to Study Melanin Concentrating Hormone Signaling in the Developing Brain. Genesis. , (2018).
- Thorpe, S. D., et al. Reduced primary cilia length and altered Arl13b expression are associated with deregulated chondrocyte Hedgehog signaling in alkaptonuria. Journal of Cellular Physiology. 232 (9), 2407-2417 (2017).
- Lauring, M. C., et al. New software for automated cilia detection in cells (ACDC). Cilia. 8, 1 (2019).
- Dummer, A., Poelma, C., DeRuiter, M. C., Goumans, M. J., Hierck, B. P. Measuring the primary cilium length: improved method for unbiased high-throughput analysis. Cilia. 5, 7 (2016).
- Haycraft, C. J., et al. Gli2 and Gli3 localize to cilia and require the intraflagellar transport protein polaris for processing and function. PLoS Genetics. 1 (4), 53 (2005).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved