Method Article
Approcci di intelligenza artificiale per valutare le ciglia primarie
In questo articolo
Riepilogo
L'uso dell'intelligenza artificiale (Ai) per analizzare le immagini sta emergendo come un approccio potente, meno parziale e rapido rispetto ai metodi comunemente usati. Qui abbiamo addestrato Ai a riconoscere un organello cellulare, ciglia primarie e analizzare proprietà come la lunghezza e l'intensità della colorazione in modo rigoroso e riproducibile.
Abstract
Le ciglia sono appendici cellulari a base di microtubuli che funzionano come centri di segnalazione per una varietà di percorsi di segnalazione in molti tipi di cellule di mammifero. La lunghezza delle ciglia è altamente conservata, strettamente regolata e varia tra diversi tipi di cellule e tessuti ed è stata implicata nell'impatto diretto sulla loro capacità di segnalazione. Ad esempio, le ciglia hanno dimostrato di alterare le loro lunghezze in risposta all'attivazione dei recettori ciliari accoppiati alla proteina G. Tuttavia, misurare in modo accurato e riproducibile le lunghezze di numerose ciglia è una procedura che richiede tempo e lavoro. Gli approcci attuali sono anche soggetti a errori e pregiudizi. I programmi di intelligenza artificiale (Ai) possono essere utilizzati per superare molte di queste sfide grazie alle capacità che consentono l'assimilazione, la manipolazione e l'ottimizzazione di set di dati estesi. Qui, dimostriamo che un modulo Ai può essere addestrato a riconoscere le ciglia nelle immagini di campioni sia in vivo che in vitro. Dopo aver utilizzato l'Ai addestrato per identificare le ciglia, siamo in grado di progettare e utilizzare rapidamente applicazioni che analizzano centinaia di ciglia in un singolo campione per lunghezza, intensità di fluorescenza e co-localizzazione. Questo approccio imparziale ha aumentato la nostra fiducia e rigore quando confrontiamo campioni provenienti da diverse preparazioni neuronali primarie in vitro e in diverse regioni del cervello all'interno di un animale e tra animali. Inoltre, questa tecnica può essere utilizzata per analizzare in modo affidabile la dinamica delle ciglia da qualsiasi tipo di cellula e tessuto in modo ad alta produttività su più campioni e gruppi di trattamento. In definitiva, gli approcci basati sull'intelligenza artificiale diventeranno probabilmente standard poiché la maggior parte dei campi si sposta verso approcci meno distorti e più riproducibili per l'acquisizione e l'analisi delle immagini.
Introduzione
Le ciglia primarie sono organelli sensoriali che sporgono dalla maggior parte dei tipi di cellule di mammifero1,2,3,4. Sono generalmente appendici solitarie fondamentali per coordinare diverse vie di segnalazione cellulare integrando i segnali extracellulari5,6,7. Le ciglia primarie svolgono un ruolo importante durante lo sviluppo embrionale e l'omeostasi dei tessuti adulti e l'interruzione della loro funzione o morfologia è associata a diversi disturbi genetici, che sono collettivamente chiamati ciliopatie. A causa della natura quasi onnipresente delle ciglia, le ciliopatie sono associate a una vasta gamma di caratteristiche cliniche che possono avere un impatto su tutti i sistemi di organi8,9,10,11,12. Nei modelli animali di ciliopatie, la perdita della struttura ciliare o della capacità di segnalazione si manifesta in diversi fenotipi clinicamente rilevanti tra cui l'obesità associata all'iperfagia3,13,14,15. In molti sistemi modello, è stato dimostrato che le variazioni di lunghezza delle ciglia influiscono sulla loro capacità di segnalazione e sulle funzioni16,17,18,19. Tuttavia, ci sono diverse sfide tecniche e dispendiose in termini di tempo associate alla valutazione accurata e riproducibile della lunghezza e della composizione delle ciglia.
Il sistema nervoso centrale (SNC) dei mammiferi adulti è un contesto biologico che ha rappresentato una sfida per la comprensione della morfologia e della funzione delle ciglia. Mentre sembra che i neuroni e le cellule in tutto il SNC possiedano ciglia, a causa degli strumenti e delle capacità limitate di osservare e analizzare queste ciglia una comprensione delle loro funzioni rimane sfuggente20. Ad esempio, il marcatore prototipico delle ciglia, acetilato α-tubulina, non etichetta le ciglia neuronali20. La difficoltà di studiare queste ciglia è stata in parte risolta con la scoperta di diversi recettori accoppiati a proteine G (GPCR), macchinari di segnalazione e proteine associate alla membrana che sono arricchite sulla membrana delle ciglia neuronali21,22. Tutte queste semplici osservazioni di base suggeriscono l'importanza e la diversità delle ciglia del SNC, che finora sembrano ineguagliate da altri tessuti. Ad esempio, la variazione della lunghezza delle ciglia e la localizzazione GPCR possono essere osservate in tutto il cervello, con lunghezze in alcuni nuclei neuronali diverse rispetto ad altri nuclei19,23. Allo stesso modo, il loro contenuto GPCR e il meccanismo di segnalazione completano la diversità in base alla posizione neuroanatomica e al tipo neuronale2,24, 25,26,27,28,29. Queste semplici osservazioni dimostrano che la lunghezza e la composizione delle ciglia del SNC dei mammiferi sono strettamente regolate, proprio come negli organismi modello, come Chlamydomonas reinhardtii, ma l'impatto di queste differenze di lunghezza sulla funzione delle ciglia, sulla segnalazione e, in definitiva, sul comportamento rimane poco chiaro16,30,31,32.
Misurare con precisione la lunghezza e la composizione delle ciglia si rivela una sfida tecnica soggetta a errori e irriproducibilità da parte dell'utente. Attualmente le ciglia in vivo e in vitro sono più spesso identificate utilizzando approcci immunofluorescenti che etichettano proteine ciliari o alleli reporter fluorescenti arricchiti di ciglia33,34,35. Le lunghezze di queste ciglia con tag fluorescenti vengono quindi misurate da un'immagine bidimensionale (2D) utilizzando strumenti di misurazione di linea in programmi di analisi delle immagini come ImageJ36. Questo processo non è solo noioso e laborioso, ma anche soggetto a pregiudizi ed errori. Questi stessi ostacoli sorgono quando si misurano le intensità delle ciglia, che aiutano a indicare cambiamenti nella struttura delle ciglia37. Per ridurre al minimo le incongruenze in questi tipi di analisi delle immagini, i programmi di intelligenza artificiale (Ai) stanno diventando opzioni più diffuse e convenienti38.
Ai è il progresso dei sistemi informatici che utilizzano il vantaggio degli algoritmi informatici e della programmazione per eseguire compiti che di solito richiederebbero l'intelligenza umana39. Ai dispositivi ai viene insegnato a percepire modelli, parametri e caratteristiche ricorrenti e ad intraprendere azioni per massimizzare le probabilità di creare risultati di successo. Ai è versatile e può essere addestrato a riconoscere oggetti specifici o strutture di interesse, come le ciglia, e quindi essere programmato per eseguire una varietà di analisi sugli oggetti identificati. Pertanto, i dati di immagine complessi possono essere generati rapidamente e riproducibilmente da Ai38. L'automazione e l'analisi Ai delle immagini acquisite aumenteranno l'efficacia e l'efficienza, limitando al contempo qualsiasi potenziale errore umano e bias39. Stabilire una metodologia basata sull'intelligenza artificiale per l'identificazione delle ciglia crea un modo coerente per tutti i gruppi di ricerca di analizzare e interpretare i dati delle ciglia.
Qui utilizziamo un modulo Ai per identificare le ciglia sia in vivo che in vitro su immagini 2D. Utilizzando una serie di immagini campione, l'IA viene addestrata a identificare le ciglia. Una volta completato l'addestramento, l'IA designata viene utilizzata per applicare una maschera binaria sulle ciglia identificate da Ai in un'immagine. I binari applicati dall'Ai sono modificabili, se necessario, per garantire che tutte le ciglia nelle immagini siano correttamente identificate e che l'identificazione non specifica sia eliminata. Dopo aver utilizzato l'Ai per identificare le ciglia, vengono utilizzati programmi di analisi generale (GA) personalizzati per eseguire diverse analisi come la misurazione della lunghezza delle ciglia e dell'intensità di fluorescenza. I dati raccolti vengono esportati in una tabella che può essere facilmente letta, interpretata e utilizzata per analisi statistiche (Figura 1). L'uso della tecnologia automatizzata e dell'intelligenza artificiale per identificare le ciglia e ottenere misurazioni specifiche tra gruppi sperimentali aiuterà in studi futuri volti a comprendere l'impatto della funzione e della morfologia delle ciglia del SNC sulla comunicazione e sul comportamento cellula-cellula.
Protocollo
1. Acquisisci immagini raw
- Fissare e immunolabel campioni secondo necessità20.
- Immagini ciglia utilizzando un microscopio confocale alla massima profondità di bit utilizzando la stessa dimensione dei pixel con risoluzione Nyquist.
- Esporta le immagini come file monocromatici tagged image format (.tif).
NOTA: questo protocollo illustra come utilizzare il modulo Ai in modo specifico all'interno del software NIS Elements. Se le immagini sono state acquisite come file .nd2, l'esportazione delle immagini come file .tif non è necessaria e l'utente può procedere direttamente al passaggio 2.3. Se le immagini sono state acquisite su un sistema diverso, una licenza NIS Elements può essere acquistata separatamente e .tif file possono essere convertiti come descritto nei passaggi successivi.
2. Addestra Ai per identificare le ciglia
- Aprire il set di dati di training.
- Selezionare circa 50 immagini di esempio con almeno un cilium per fotogramma per addestrare il software e copiarle in un'unica cartella. Questa cartella viene utilizzata per indirizzare il software all'apertura delle immagini. Aprite questi 50 fotogrammi all'interno di un singolo documento ND2 con almeno un cilium per fotogramma. Selezionare File > Importa/Esporta > Crea file ND dalla sequenza di file.
- Selezionare la cartella contenente il set di dati di training. Questo aprirà l'elenco dei file al centro della finestra di dialogo. Definire manualmente l'organizzazione dei file utilizzando almeno un'opzione nel menu a discesa sopra. Le opzioni sono multipunto (per più file di proiezione massima), serie Z (per un'immagine dello stack z), tempo (per un'immagine time-lapse) e lunghezza d'onda (per i file da più canali).
- Immettere i valori numerici corrispondenti sotto ogni opzione selezionata. Selezionare Nessuno laddove le opzioni non sono selezionate. Fare clic su Converti per aprire il documento ND.
- Calibrare le immagini.
- Inserisci la dimensione in pixel nell'angolo in basso a sinistra dell'immagine: fai clic con il pulsante destro del mouse su Uncalibrated > Calibra documento > Dimensione pixel.
- Identificare le ciglia.
- Identifica a mano le ciglia tracciando con precisione le singole strutture ciliari su tutti i fotogrammi aperti utilizzando AutoDetect o Draw Object nella barra degli strumenti binaria. Questo disegnerà maschere binarie sugli oggetti di interesse. Questi binari serviranno come oggetti campione per addestrare il software a identificare le ciglia sulle caratteristiche basate su pixel nella futura analisi sperimentale delle immagini. Selezionare Visualizza > controlli di analisi > barra degli strumenti binari > Disegna oggetto.
NOTA: rimuovere qualsiasi frame che non dispone di file binari poiché il software non inizierà il training a meno che non sia in grado di rilevare i file binari su tutti i frame aperti.
- Identifica a mano le ciglia tracciando con precisione le singole strutture ciliari su tutti i fotogrammi aperti utilizzando AutoDetect o Draw Object nella barra degli strumenti binaria. Questo disegnerà maschere binarie sugli oggetti di interesse. Questi binari serviranno come oggetti campione per addestrare il software a identificare le ciglia sulle caratteristiche basate su pixel nella futura analisi sperimentale delle immagini. Selezionare Visualizza > controlli di analisi > barra degli strumenti binari > Disegna oggetto.
- Treno Ai.
- Iniziare la formazione del software. Questo aprirà la scatola di Segment.ai del treno. Selezionate NIS.ai > Segment.ai Treno.
- Nella casella Segment.ai treno selezionare il canale sorgente da utilizzare per l'allenamento. Se i file di più canali sono aperti, selezionare un solo canale come canale di origine. Quindi selezionare i binari di verità di base appropriati su cui addestrare l'Ai. Infine selezionare il numero di iterazioni necessarie per addestrare l'Ai in base alle dimensioni e alla distribuzione dei file binari.
NOTA: se i file binari sono facilmente rilevabili dall'ambiente circostante e ben distribuiti in tutta l'immagine, il software potrebbe richiedere meno di 1000 iterazioni per essere addestrato a identificare le immagini. Se le immagini hanno un basso rapporto segnale-rumore, è ideale eseguire almeno 1000 iterazioni durante l'allenamento per consentire all'Ai di identificare le ciglia nei campioni di test con elevata sicurezza. - Selezionare la cartella di destinazione per salvare il file Ai addestrato (.sai) e fare clic su Treno per addestrare il software. Il software procederà ora ad allenarsi per identificare le ciglia in base ai binari tracciati. Questo processo richiede diverse ore.
NOTA: durante l'allenamento, il software visualizzerà un grafico che mostra la perdita di allenamento. Il grafico mostrerà inizialmente un picco prima di assottigliarsi idealmente a circa l'1% di perdita dove si stabilizza per il resto dell'allenamento. Salvare il grafico per riferimento futuro selezionando la casella Salva screenshot grafico nella casella Segment.ai treno (Figura supplementare 1). - Se è necessario un ulteriore perfezionamento della formazione, continuare la formazione sullo stesso set di dati. In alternativa, eseguire il training su un nuovo set di dati con gli stessi parametri. Non è consigliabile addestrare un Ai già addestrato su un nuovo set di dati con parametri diversi o diversi oggetti di interesse. Seleziona Treno segment.ai > Continua la formazione su > Seleziona File Ai addestrato.
3. Identifica le ciglia usando l'IA addestrata
- Aprire il set di dati sperimentale.
- Aprire le immagini confocali sperimentali di ciglia nel software convertendo i file .tif di esempio in file .nd2, simile al passaggio 2.1. Selezionare File > Importa/Esporta > Crea file ND dalla sequenza di file.
NOTA: le immagini devono avere le stesse dimensioni in pixel di quelle utilizzate per l'addestramento dell'IA. Se le immagini sono già in formato ND2, andare al passaggio 3.3.
- Aprire le immagini confocali sperimentali di ciglia nel software convertendo i file .tif di esempio in file .nd2, simile al passaggio 2.1. Selezionare File > Importa/Esporta > Crea file ND dalla sequenza di file.
- Calibrare le immagini.
- Inserisci la dimensione in pixel nell'angolo in basso a sinistra dell'immagine. Fare clic con il pulsante destro del mouse su Non calibrato > Calibra documento > dimensione pixel.
- Esegui l'Ai addestrato sui file aperti.
- Inizia a identificare le ciglia usando Ai. Il software ora disegnerà binari sulle ciglia in base alla formazione ricevuta nella fase precedente. Questo processo richiederà alcuni secondi. Selezionare NIS.ai > Segment.ai.
NOTA: il software richiederà di selezionare il canale se sono aperti più canali. I canali sono elencati con i rispettivi nomi qui. In caso contrario, la casella contrassegnata come "Mono" verrà selezionata automaticamente.
- Inizia a identificare le ciglia usando Ai. Il software ora disegnerà binari sulle ciglia in base alla formazione ricevuta nella fase precedente. Questo processo richiederà alcuni secondi. Selezionare NIS.ai > Segment.ai.
- Controllare le immagini per i file binari identificati in modo errato.
- Una volta che l'Ai ha identificato le ciglia e disegnato i binari, controlla le immagini per eventuali oggetti erroneamente identificati. Se lo si desidera, eliminare manualmente tutti i file binari identificati in modo errato. Selezionate Visualizza > controlli di analisi > barra degli strumenti binari > Elimina oggetto.
4. Misurazione della lunghezza e dell'intensità delle ciglia
- Creare una nuova ricetta ga3 (General Analysis 3).
- Ora che le ciglia sono state identificate e segmentate, procedere all'analisi di diversi parametri di ciglia come lunghezze e intensità utilizzando lo strumento GA3. Si aprirà una nuova finestra con uno spazio vuoto al centro in cui verrà definita l'analisi. Seleziona Immagine > Nuova ricetta GA3.
- Selezionare i file binari da analizzare.
- Poiché le ciglia sono già segmentate utilizzando Segment.ai, GA3 rileverà automaticamente i binari opportunamente etichettati in base all'Ai e includerà il nodo. Seleziona'Binari > Detect_AI automatica' o 'Binari > Disegna Object_AI'.
- Selezionare i canali necessari per l'analisi. GA3 rileverà automaticamente anche i canali nelle immagini e visualizzerà le loro schede in Canali.
- Rimuovere gli oggetti che toccano il bordo della cornice.
- Poiché l'Ai segmenterà tutte le ciglia come oggetti nel telaio, rileverà anche le ciglia incomplete lungo i bordi del telaio. Questi oggetti possono essere rimossi manualmente nel passaggio 3.4 oppure possono essere rimossi automaticamente in GA3. Selezionare Elaborazione binaria > Rimuovi oggetti > Touching Borders.
- Selezionare i parametri per misurare le ciglia.
- Trascina e rilascia i parametri da misurare come la lunghezza delle ciglia (Lunghezza) e le intensità (Somma intensità oggetto). Collegare i nodi al nodo binario appropriato (connessione A) e ai nodi di canale (connessione B). Passare il puntatore del mouse sulla connessione del nodo per visualizzare una descrizione comando per mostrare a quale connessione appartiene il nodo. Selezionare Misurazione > Dimensione oggetto > Lunghezza e Misurazione > Intensità oggetto > Somma Intensità Obj.
NOTA: il nodo Lunghezza si connette solo al nodo binario, mentre Somma intensità Obj si connette sia al nodo binario che al nodo canale.
- Trascina e rilascia i parametri da misurare come la lunghezza delle ciglia (Lunghezza) e le intensità (Somma intensità oggetto). Collegare i nodi al nodo binario appropriato (connessione A) e ai nodi di canale (connessione B). Passare il puntatore del mouse sulla connessione del nodo per visualizzare una descrizione comando per mostrare a quale connessione appartiene il nodo. Selezionare Misurazione > Dimensione oggetto > Lunghezza e Misurazione > Intensità oggetto > Somma Intensità Obj.
- Aggiungere le misure in un'unica tabella.
- Combina tutte le misurazioni in un'unica tabella di output trascinando e rilasciando il nodo Aggiungi colonna al diagramma di flusso dell'analisi e collegalo ai nodi di misura, Lunghezza e Somma intensità Obj. Selezionare Gestione dati > Colonna di > di base.
- Misura le ciglia.
- Misurare le ciglia facendo clic su Esegui. Questo processo richiede alcuni istanti per misurare tutte le ciglia nelle immagini sperimentali. Le lunghezze e le intensità verranno visualizzate in una nuova finestra Risultati analisi.
NOTA: la tabella a volte può includere dati da maschere che Ai ha riconosciuto come ciglia ma erano troppo piccole per essere rilevate dall'occhio umano ed eliminate nel passaggio 3.4. Questi oggetti possono essere rimossi dal set di dati utilizzando un filtro prima dell'analisi statistica. Qui, un filtro di 1 μm è stato utilizzato per le misurazioni in vitro della lunghezza delle ciglia nella Figura 2 e 2 μm per le ciglia in vivo. Questo può essere fatto prima di esportare i dati utilizzando il percorso seguente. Selezionare la finestra Risultati analisi > Definisci filtro > Immetti valore > Usa filtro.
- Misurare le ciglia facendo clic su Esegui. Questo processo richiede alcuni istanti per misurare tutte le ciglia nelle immagini sperimentali. Le lunghezze e le intensità verranno visualizzate in una nuova finestra Risultati analisi.
- Esporta i dati per l'analisi statistica.
5. Studi di colocalizzazione
NOTA: L'analisi di colocalizzazione può essere inclusa nella stessa ricetta GA3 utilizzata per le misurazioni della lunghezza delle ciglia e dell'analisi dell'intensità. Se si utilizza la stessa ricetta, aprire i file come descritto di seguito e misurare le lunghezze e le intensità di entrambi i canali insieme ai coefficienti di colocalizzazione nella stessa pipeline di analisi.
- Aprire il set di dati sperimentale.
- Apri le immagini confocali sperimentali di ciglia nel software convertendo i file .tif di esempio in file .nd2. Selezionare File > Importa/Esporta > Crea file ND dalla sequenza di file.
- Nella finestra pop-up, seleziona i file monocromatici di profondità a 16 bit da tutti i canali di interesse da Esplora finestre situato nella prima colonna della finestra pop-up. Selezionare Multipoint o Z Series dal primo menu a discesa e immettere un valore corrispondente al numero totale di immagini o pile, rispettivamente.
- Nella seconda casella a discesa, selezionare Lunghezza d'onda e modificare il valore sul numero totale di canali nella cartella. Il software sbloccherà automaticamente una finestra di selezione della lunghezza d'onda situata all'estremità in basso a destra della finestra pop-up. Utilizzare il menu a discesa Colore per selezionare il colore di ciascun canale. Fornire a ciascun canale un nome diverso nella colonna Nome. Una volta aggiornate tutte le informazioni, fare clic su Converti. Il software genererà automaticamente un file Di tutte le immagini sovrapposto a tutte le singole immagini di tutti i canali selezionati.
- Calibrare le immagini.
- Inserisci la dimensione in pixel nell'angolo in basso a sinistra dell'immagine. Fare clic con il pulsante destro del mouse su Non calibrato > Calibra documento > dimensione pixel.
- Esegui l'Ai addestrato sul primo canale.
- Iniziare a identificare le ciglia su uno dei canali aperti (ad esempio, ACIII; Figura 5A) utilizzando Ai. Il software ora disegnerà binari su ciglia etichettate ACIII in base alla formazione ricevuta per questo canale. Questo processo richiederà alcuni secondi. Selezionare NIS.ai > Segment.ai > canali sorgente > ACIII.
- Esegui l'Ai addestrato sul secondo canale.
- Iniziare a identificare le ciglia sull'altro canale aperto (ad esempio, MCHR1; Figura 5B) utilizzando Ai. Il software ora disegnerà binari su ciglia etichettate MCHR1 in base alla formazione ricevuta per questo canale. Questo processo richiederà alcuni istanti. Selezionare NIS.ai > Segment.ai > canali sorgente > MCHR1.
- Controllare le immagini per i file binari identificati in modo errato.
- Una volta che l'Ai ha identificato le ciglia e disegnato i binari, controlla le immagini per eventuali oggetti identificati erroneamente. Se necessario, eliminare manualmente eventuali file binari identificati in modo errato. Selezionate Visualizza > controlli di analisi > barra degli strumenti binari > Elimina oggetto.
- Crea una nuova ricetta GA3.
- Ora che le ciglia sono state identificate e segmentate, procedere all'analisi di colocalizzazione utilizzando lo strumento GA3. Si aprirà una nuova finestra con uno spazio vuoto al centro in cui verrà definita l'analisi. Verrà generata una finestra con tutti i file binari e i canali identificati. Verificare che tutti i canali e i file binari desiderati necessari per l'analisi siano presenti e selezionati. Seleziona Immagine > Nuova ricetta GA3.
- Rimuovere gli oggetti che toccano il bordo della cornice.
- Poiché l'Ai segmenterà tutti gli oggetti simili alle ciglia nel telaio, rileverà anche le ciglia incomplete lungo i bordi del fotogramma. Questi oggetti possono essere rimossi manualmente nel passaggio 5.5 o possono essere rimossi automaticamente in GA3. Selezionare Elaborazione binaria > Rimuovi oggetti > Touching Borders.
- Impostare il percorso di colocalizzazione in GA3.
- Per misurare la sovrapposizione dei due canali all'interno delle ciglia, utilizzare la correlazione del coefficiente di Mander. Trascina e rilascia il nodo Coefficiente di Manders nello spazio vuoto della ricetta GA3 e collegalo al binario e ai canali appropriati. Qui, 'connessione A' si connette con il binario ACIII, 'connessione B' con il canale MCHR1 e 'connessione C' con il canale ACIII per determinare la sovrapposizione di MCHR1 all'interno del binario ACIII. Selezionare Misura > Rapporto di oggetti > Coefficiente di Manders.
NOTA: Il software consente di misurare la colocalizzazione utilizzando la correlazione del coefficiente di Pearson utilizzando gli stessi passaggi descritti in questo protocollo40.
- Per misurare la sovrapposizione dei due canali all'interno delle ciglia, utilizzare la correlazione del coefficiente di Mander. Trascina e rilascia il nodo Coefficiente di Manders nello spazio vuoto della ricetta GA3 e collegalo al binario e ai canali appropriati. Qui, 'connessione A' si connette con il binario ACIII, 'connessione B' con il canale MCHR1 e 'connessione C' con il canale ACIII per determinare la sovrapposizione di MCHR1 all'interno del binario ACIII. Selezionare Misura > Rapporto di oggetti > Coefficiente di Manders.
- Aggiungere le misure in un'unica tabella.
- Combina tutte le misure in un'unica tabella di output. Selezionare Gestione dati > Colonna di > di base.
- Misurare la colocalizzazione.
- Misurare le ciglia facendo clic su Esegui. Questo processo richiede alcuni istanti per misurare tutte le ciglia nelle immagini sperimentali. I dati verranno visualizzati in una nuova finestra Risultati analisi.
- Esporta i dati per l'analisi statistica.
Risultati
Addestrare Ai per identificare le ciglia
Misurare e valutare la lunghezza strutturale e la composizione delle ciglia può essere un processo noioso, dispendioso in termini di tempo e soggetto a errori. Qui, usiamo Ai per segmentare accuratamente le ciglia da un ampio pool di immagini e analizzarne lunghezze e intensità con uno strumento di analisi (Figura 1). Tutti gli approcci ai richiedono passaggi di formazione per la loro implementazione. Abbiamo stabilito una pipeline di formazione per riconoscere le ciglia, che è stata eseguita applicando manualmente maschere binarie su strutture ciliari. Queste informazioni vengono quindi utilizzate per addestrare l'IA in base alle caratteristiche dei pixel sotto i binari applicati. Come linea guida generale, la formazione coinvolge il software che passa attraverso diverse iterazioni, circa 1000, ed è considerata ottimale se il tasso di perdita o di errore dell'allenamento è inferiore all'1%. Tuttavia, il numero di iterazioni ed errori nel processo di training può variare a seconda delle immagini di esempio utilizzate per il training. Ad esempio, dopo le nostre sessioni di allenamento utilizzando immagini di ciglia neuronali in vitro, il tasso di errore è stato dell'1,378% rispetto al 3,36% per le immagini della sezione cerebrale in vivo (Figura supplementare 1). Una volta completato l'addestramento, l'Ai può quindi essere utilizzato per segmentare le ciglia dalle immagini sperimentali in pochi secondi e le maschere binarie risultanti vengono utilizzate per misurare i parametri strutturali. Ciò elimina la necessità di segmentare gli oggetti utilizzando il metodo tradizionale di soglia di intensità che può essere difficile nelle immagini con elevato rumore di fondo o quando gli oggetti sono in prossimità l'uno dell'altro. Ai riduce anche il potenziale di errore e distorsione applicando lo stesso algoritmo a tutte le immagini, indipendentemente dall'utente.
Misurazione della lunghezza delle ciglia utilizzando GA3
La lunghezza delle ciglia è strettamente regolata ed è associata a impatti funzionali sulla segnalazione ciliare16,19. Qui, abbiamo misurato le lunghezze delle ciglia utilizzando una pipeline di analisi all'interno del software NIS Elements chiamata General Analysis 3 o GA3. GA3 aiuta a combinare più strumenti in un unico flusso di lavoro per creare routine personalizzate per ogni esperimento. Abbiamo iniziato misurando le lunghezze delle ciglia in una linea cellulare. Le cellule cilia su midollo interno del dotto di raccolta del topo (IMCD-3) sono state immunoamarcate con tubulina acetilata e fotografate usando un microscopio confocale. Abbiamo misurato le lunghezze delle ciglia usando GA3 dopo la segmentazione con segment.ai (Figura supplementare 3A). Mentre la α-tubulina acetilata si trova preferenzialmente nel cilio primario, si trova anche in altre regioni ricche di microtubuli come il citoscheletro e il ponte citocinetico. L'Ai addestrato ha identificato correttamente le ciglia nell'immagine ma non altre strutture positive di tubulina acetilate non ciliari. Le ciglia sulle cellule IMCD variavano da 0,5 μm a 4,5 μm con una lunghezza media di 1,8 ± 0,04 μm (Figura 2A). Successivamente abbiamo testato la capacità dell'Ai di misurare le lunghezze delle ciglia nelle colture neuronali primarie. Abbiamo coltivato neuroni dall'ipotalamo e dall'ippocampo di topi neonatali per 10 giorni e li abbiamo immunomarcati con il marcatore delle ciglia adenilato ciclasi III (ACIII)21,41. Quando si analizzano le colture neuronali, abbiamo trovato utile applicare un filtro prima di analizzare statisticamente le lunghezze. A causa di un rapporto segnale/rumore inferiore, sono stati identificati diversi oggetti inferiori a 1 μm che non erano ciglia. Pertanto, abbiamo filtrato i dati per eliminare tutti gli oggetti che erano meno di 1 μm di lunghezza per garantire che solo le ciglia fossero analizzate. Nei neuroni ipotalamici in coltura, le lunghezze delle ciglia variavano da 2 μm a 7 μm con una lunghezza media di 3,8 ± 0,19 μm (Figura 2B). È interessante notare che le ciglia neuronali ippocampali coltivate erano più lunghe con una lunghezza media di 6,73 ± 0,15 μm (Figura 2C). È stato riportato che diversi nuclei neuronali all'interno dell'ipotalamo mostrano lunghezze di ciglia distinte e che queste ciglia alterano le loro lunghezze in risposta a cambiamenti fisiologici in un modo specifico del nucleo19,23. Pertanto, abbiamo anche etichettato sezioni cerebrali ipotalamiche da topi maschi adulti C57BL / 6J con ACIII e abbiamo ripreso il nucleo arcuato (ARC) e il nucleo paraventricolare (PVN). Usando GA3 per misurare le lunghezze delle ciglia, abbiamo osservato che le ciglia ipotalamiche in vivo apparivano più lunghe delle ciglia in vitro. Nello specifico, le ciglia ipotalamiche in vivo vanno da 1 μm a circa 15 μm (Figura 3). Non ci sono state differenze significative tra le lunghezze delle ciglia nel PVN (5,54 ± 0,0,42 μm) e quelle nell'ARC (6,16 ± 0,27 μm) (Figura 3C)23. Allo stesso modo, le ciglia nella regione del cornu ammonis (CA1) dell'ippocampo mostrano un intervallo di lunghezza più stretto da 1 μm a 10 μm con una lunghezza media di 5,28 ± 0,33 μm (Figura 3). In conformità con studi pubblicati in precedenza, la nostra analisi utilizzando strumenti Ai e GA3 ha mostrato che le ciglia di diverse regioni del cervello mostrano diversità in lunghezza19,23. Inoltre, utilizzando questo approccio Ai siamo in grado di valutare rapidamente un gran numero di ciglia.
Misurazione della composizione delle ciglia utilizzando GA3
Il cilio primario è un hub di segnalazione per molte vie che utilizzano diversi tipi di proteine per svolgere funzioni uniche come proteine motorie, proteine di trasporto intraflagellare e GPCR per citarne alcuni3,24,42,43. Mantenere i livelli appropriati di queste proteine all'interno del cilio è importante per il corretto funzionamento e spesso appare dipendente dal contesto cellulare. L'etichettatura fluorescente di queste proteine non solo ci ha permesso di visualizzarle, ma anche di quantificare le loro intensità come misura della quantità di proteina marcata all'interno del compartimento relativamente piccolo20. Pertanto, abbiamo cercato di determinare le intensità di un GPCR ciliare, Melanin Concentrating Hormone Receptor 1 (MCHR1), in vivo sia nell'ARC che nel PVN dell'ipotalamo di topi maschi adulti24,44. Usando Ai e GA3, abbiamo misurato le lunghezze delle ciglia positive MCHR1 insieme alle intensità per garantire che gli oggetti contati fossero ciglia (Figura supplementare 3A). Abbiamo eliminato gli oggetti post-analisi che erano meno di 2 μm di lunghezza e analizzato le intensità delle maschere binarie rimanenti. È interessante notare che abbiamo scoperto che l'intensità di MCHR1 ciliare in PVN è significativamente superiore a quella in ARC che indica una presenza più forte di MCHR1 ciliare in PVN (Figura 4). Sono necessari ulteriori studi per determinare il significato di MCHR1 ciliare in questi circuiti neuronali. Abbiamo anche misurato le intensità di MCHR1 ciliare nei neuroni primari in coltura di ipotalamo e ippocampo. Le ciglia di entrambe le colture mostrano un'ampia distribuzione delle intensità di MCHR1 suggerendo la presenza di popolazioni neuronali eterogenee (Figura supplementare 2). Pertanto, l'utilizzo di sofisticati strumenti analitici come Ai e GA3 consente la valutazione dell'eterogeneità delle ciglia all'interno dello stesso tessuto o tra più tessuti. Sarà interessante vedere se altri GPCR neuronali mostrano differenze simili nella loro localizzazione all'interno dei neuroni dello stesso tessuto e se questo si altera in risposta a cambiamenti fisiologici.
Colocalizzazione
Mentre misurare le intensità di fluorescenza all'interno di un campo di immagine completo può dare un'impressione di proteina, non riesce a fornire informazioni come la distribuzione spaziale o la vicinanza ad altre proteine vicine e strutture cellulari. Qui, abbiamo misurato la sovrapposizione di MCHR1 con ACIII come marcatore di ciglia tracciando le intensità di MCHR1 rispetto a quella di ACIII per ogni maschera binaria (Figura 5). Il grafico mostra che la maggior parte delle ciglia sono positive per entrambi, ACIII e MCHR1, anche se alcune ciglia mostrano un'espressione più forte di un canale rispetto all'altro. Inoltre, ci sono alcune ciglia che mostrano la presenza di ACIII o MCHR1 come è evidente dai punti che si trovano direttamente sull'asse x e sull'asse y rispettivamente. Per quantificare questa sovrapposizione, abbiamo misurato il coefficiente di sovrapposizione di Mander e confrontato l'estensione dell'espressione di MCHR1 nelle ciglia neuronali dell'ARC e PVN40. È interessante notare che la nostra analisi ha rivelato che c'è stato un aumento significativo dei coefficienti del PVN (0,6382 ± 0,0151) rispetto a quelli dell'ARC (0,5430 ± 0,0181) (Figura 5C). Ciò è coerente con i nostri dati precedenti in cui abbiamo osservato intensità MCHR1 più elevate in PVN rispetto ad ARC (Figura 4). Questi dati suggeriscono che, come la lunghezza delle ciglia, il modello di espressione di MCHR1 nel compartimento ciliare varia in diverse regioni del cervello. Utilizzando la stessa pipeline di analisi, sarà possibile determinare se altri GPCR ciliari come il recettore Neuropeptide Y di tipo 2 (NPY2R) e il recettore della somatostatina di tipo 3 (SSTR3) mostrano quantità simili di diversità.
Profilo di intensità di misurazione lungo il cilio
Una volta che le ciglia sono state identificate utilizzando segment.ai, la ricetta GA3 può essere modificata per combinare l'analisi delle ciglia con l'identificazione di altre strutture di interesse nell'immagine. Ad esempio, l'etichettatura con marcatori del corpo basale è utile per l'identificazione della polarità delle ciglia. Per fare questa analisi, abbiamo ripreso sezioni cerebrali ipotalamiche da topi P0 che esprimono ARL13B-mCherry e Centrin2-GFP e abbiamo ripreso ARC e PVN34. Qui, le ciglia sono state identificate usando Ai come prima, ma ora la ricetta GA3 modificata include l'identificazione di Centrin2-GFP, una proteina centriolare trovata alla base delle ciglia (Figura supplementare 3B). Etichettando Centrin2-GFP, la base delle ciglia può essere distinta dalle punte delle ciglia positive ARL13B-mCherry (Figura 6A). Quindi, invece di misurare l'intensità all'interno di tutte le ciglia, siamo in grado di misurare i cambiamenti nell'intensità ARL13B lungo la lunghezza delle ciglia (Figura 6B). Possiamo anche confrontare le differenze nell'intensità di ARL13B tra le estremità prossimali e le estremità distali delle ciglia. Per fare questo, abbiamo diviso la lunghezza del cilio in contenitori da 1 micron a partire dalla base e designato il primo contenitore micron come estremità prossimale e l'ultimo contenitore micron come estremità distale. La nostra analisi ha rivelato che c'è significativamente più ARL13B presente più vicino alla base rispetto alla punta del cilio sia in ARC che in PVN, e questo è coerente con studi precedentemente pubblicati sui condrociti umani45 (Figura 6C). In questo tipo di analisi, invece di applicare un filtro di lunghezza per escludere piccoli oggetti non ciliari dall'analisi, vengono analizzate solo le ciglia associate all'etichettatura Centrin2-GFP. Ciò può essere vantaggioso in situazioni in cui le mutazioni genetiche rendono le ciglia molto corte o se sono stati implicati cambiamenti nei sottodomini delle ciglia come la zona di transizione o la punta. L'identificazione delle ciglia utilizzando l'analisi Ai e GA3 è altamente adattabile e può essere adattata per adattarsi a una varietà di domande di ricerca complesse.
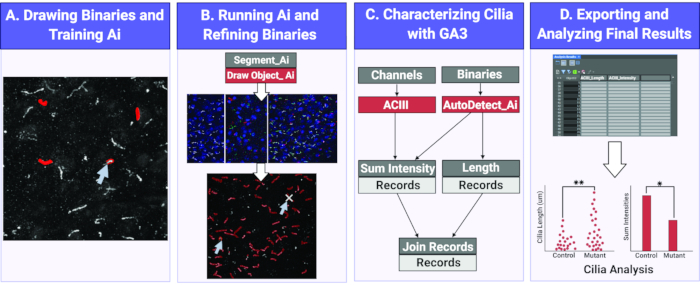
Figura 1. Flusso di lavoro per la misurazione della lunghezza e dell'intensità delle ciglia utilizzando Ai. (A) Per addestrare l'IA, i binari sono disegnati attorno agli oggetti di interesse (ciglia) sulle immagini di allenamento grezze. Utilizzando i binari disegnati, Segment Ai viene addestrato a riconoscere la forma e l'intensità dei pixel delle ciglia. (B) Successivamente, il segmento Ai addestrato viene applicato alle immagini sperimentali grezze. Disegna binari su oggetti che riconosce come ciglia. Questi binari possono essere perfezionati per assicurarsi che tutte e solo le ciglia vengano analizzate. (C) Un programma GA3 è costruito per analizzare l'intensità e la lunghezza degli oggetti riconosciuti dall'Ai. (D) I record vengono importati in una tabella del software. Questa tabella può quindi essere esportata per ulteriori analisi. Fare clic qui per visualizzare una versione più grande di questa figura.

Figura 2. Misure in vitro della lunghezza delle ciglia. Immagini rappresentative di ciglia in (A) cellule IMCD (verde, tubulina acetilata) (B) colture ipotalamiche primarie (verde, ACIII) e (C) colture ippocampali (verde, ACIII). Un Ai addestrato è stato usato per riconoscere le ciglia come mostrato nella maschera binaria (magenta) e quindi GA3 è stato usato per misurare la lunghezza delle ciglia. La distribuzione della lunghezza delle ciglia è rappresentata graficamente come percentuale di ciglia in contenitori da 0,5 o 1,0 micron. * indica il ponte citocinetico correttamente non riconosciuto dall'Ai. n=225 ciglia in cellule IMCD da 3 replicate, 54 ciglia in ipotalamo e 139 ciglia in colture ippocampali da 3 animali. Barre di scala 10 μm. Fare clic qui per visualizzare una versione più grande di questa figura.
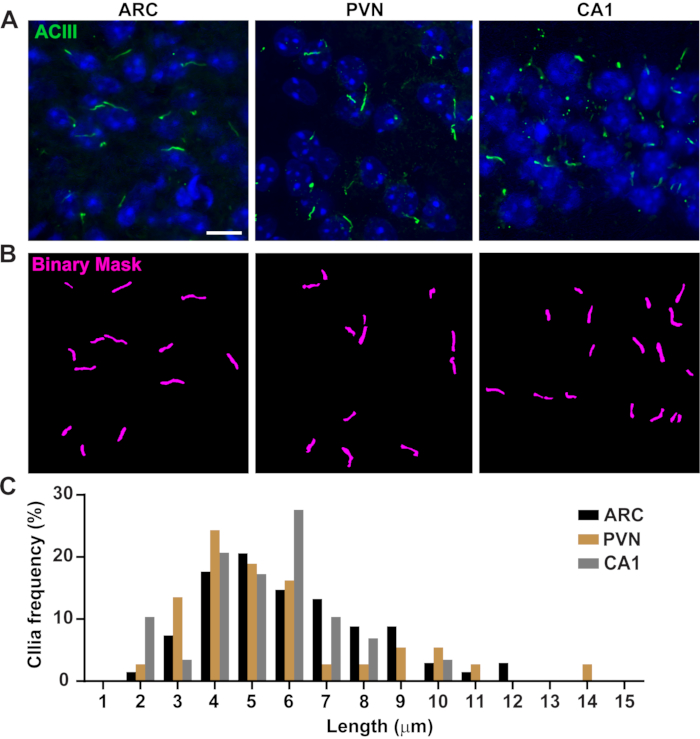
Figura 3. Misure di lunghezza delle ciglia in vivo. (A) Immagini rappresentative di ciglia (verde, ACIII) nelle sezioni ARC, PVN e CA1 di sezioni cerebrali di topi adulti. (B)Un Ai addestrato in NIS Elements è stato usato per riconoscere le ciglia come mostrato nella maschera binaria (magenta) e quindi GA3 è stato usato per misurare la lunghezza delle ciglia. (C) La distribuzione della lunghezza delle ciglia è rappresentata graficamente come percentuale delle ciglia in contenitori da un micron. n= 68 ciglia in ARC, 36 in PVN e 29 in CA1 da 3 animali. Barre di scala 10 μm. Fare clic qui per visualizzare una versione più grande di questa figura.
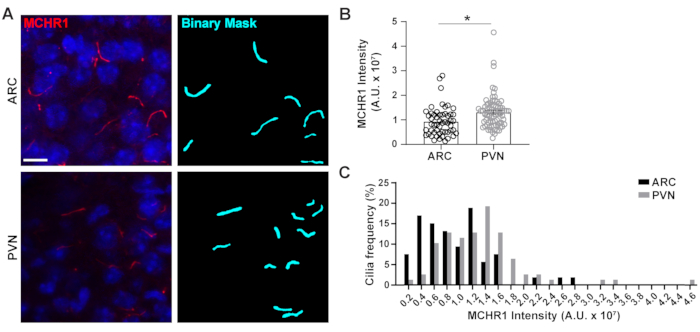
Figura 4. Ai ha assistito le misurazioni dell'intensità della colorazione delle ciglia neuronali ipotalamiche. (A) Immagini rappresentative di ciglia (MCHR1, rosso) nell'ARC e PVN delle sezioni cerebrali di topo adulto. Un Ai addestrato in NIS Elements è stato utilizzato per riconoscere le ciglia come mostrato nella maschera binaria (ciano) e quindi GA3 è stato utilizzato per misurare l'intensità della colorazione MCHR1 nelle ciglia. (B) Le intensità MCHR1 sono rappresentate come medie ± S.E.M. Ogni punto rappresenta un cilio. * p < 0.05, T-test dello studente. (C) La distribuzione dell'intensità mcHR1 è rappresentata graficamente come percentuale di ciglia in contenitori di 0,2 x10 7 unità arbitrarie (U. A.). n= 53 ciglia in ARC, 78 in PVN da 3 animali. Barre di scala 10 μm. Fare clic qui per visualizzare una versione più grande di questa figura.
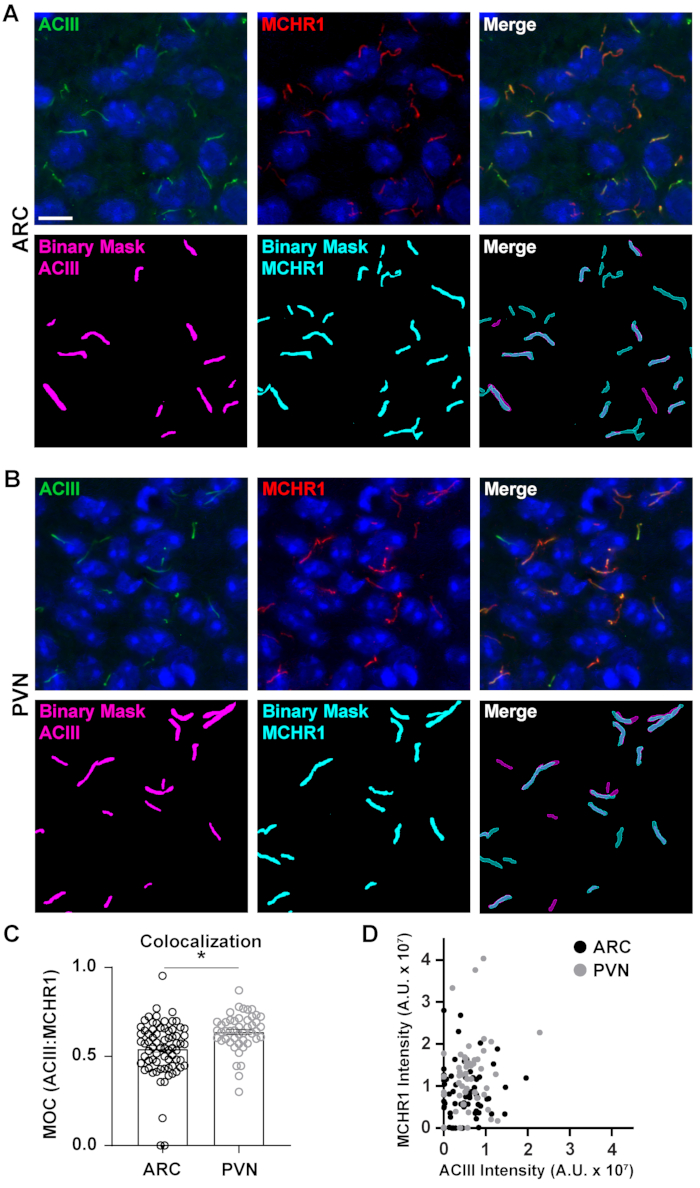
Figura 5. Ai ha assistito l'analisi della colocalizzazione delle ciglia. (A, B) Immagini rappresentative delle ciglia nell'ARC e nel PVN rispettivamente. Le ciglia sono etichettate con ACIII (verde) e MCHR1 (rosso). Un Ai addestrato in NIS Elements è stato utilizzato per riconoscere le ciglia come mostrato nella maschera binaria (magenta per le ciglia etichettate ACIII, ciano per le ciglia marcate MCHR1). GA3 è stato utilizzato per riconoscere le ciglia che contenevano sia ACIII che MCHR1. (C) I valori del coefficiente di sovrapposizione di Manders (MOC) sono rappresentati graficamente come ± S.E.M. Ogni punto rappresenta un cilio. * p < 0.05, T-test dello studente. (D) Grafico a dispersione dell'intensità MCHR1 rispetto all'intensità ACIII in ARC e PVN. Ogni punto rappresenta un cilio. n= 72 ciglia in ARC, 47 in PVN da 3 animali. Barre di scala 10 μm. Fare clic qui per visualizzare una versione più grande di questa figura.
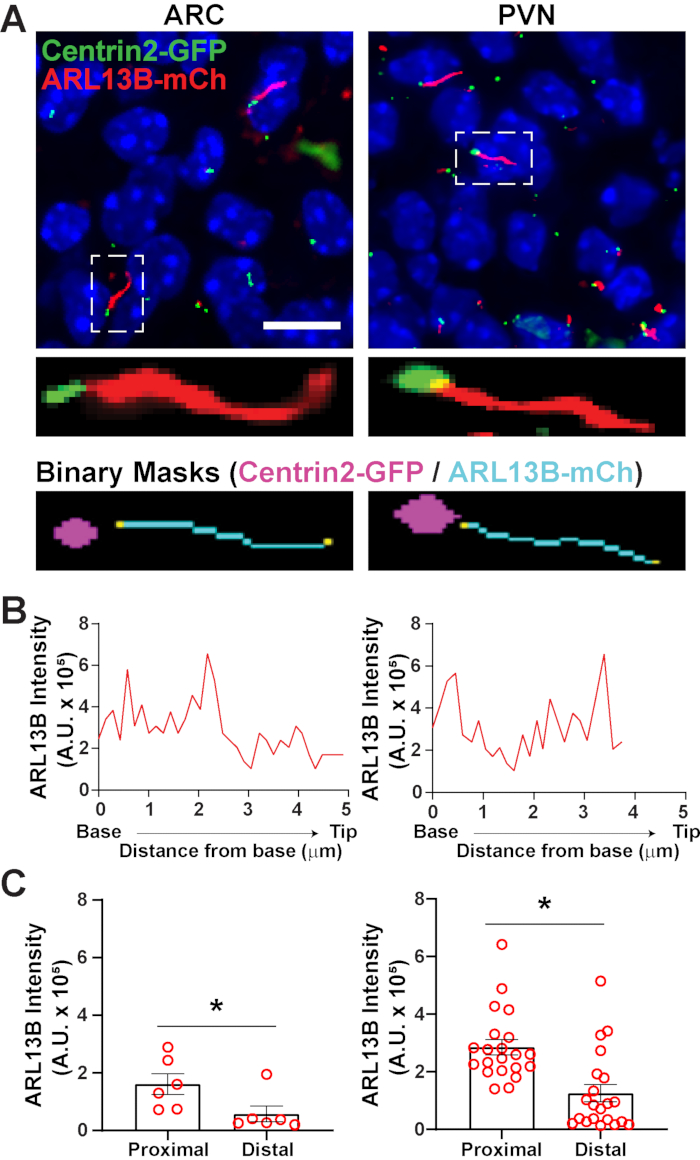
Figura 6. Analisi delle ciglia e del corpo basale. (A) Immagini rappresentative di ciglia (rosso, ARL13B-mCherry) e marcatore del corpo basale (verde, Centrin2-GFP) nell'ARC e PVN dei topi P0. Un Ai addestrato è stato usato per riconoscere le ciglia come mostrato nella maschera binaria (ciano). La maschera binaria per il corpo basale (magenta) è stata disegnata mediante soglia nella ricetta GA3. (B) Intensità di scansione di linea rappresentativa di un cilio. (C) Le intensità di ARL13B alle estremità prossimale e distale di Ai hanno identificato le ciglia rappresentate come medie ± S.E.M. Le estremità prossimale e distale sono definite come la regione all'interno della prima lunghezza di 1 μm e dell'ultima lunghezza di 1 μm rispettivamente dalla base del cilio. Ogni punto rappresenta un cilio. * p < 0,05. n = 6 ciglia in ARC da 2 animali e 21 ciglia in PVN da 3 animali. Barre di scala 10 μm. Fare clic qui per visualizzare una versione più grande di questa figura.
Figura supplementare 1. Grafici di perdita di allenamento Ai. (A, B) Grafici che mostrano la perdita di segment.ai di allenamento sulle ciglia neuronali rispettivamente in vitro e in vivo. Fare clic qui per scaricare questo file.
Figura supplementare 2. Ai Assisted Cilia misure di intensità di colorazione delle ciglia neuronali in vitro. (A, B) Immagini rappresentative di ciglia (MCHR1, rosso) rispettivamente nelle colture ipotalamiche primarie e ippocampali. Un Ai addestrato in NIS Elements è stato utilizzato per riconoscere le ciglia come mostrato nella maschera binaria (ciano) e quindi GA3 è stato utilizzato per misurare l'intensità della colorazione MCHR1 nelle ciglia. La distribuzione dell'intensità di MCHR1 è rappresentata graficamente come percentuale di ciglia in 1000 contenitori U.A. per ipotalamo e 2000 A. U. per colture ippocampali. n= 30 ciglia in ipotalamo e 106 ciglia in colture ippocampali di 3 animali. Barre di scala 10 μm. Fare clic qui per scaricare questo file.
Figura supplementare 3. Analisi generale 3 ricette per l'analisi delle ciglia. (A) Ricetta di analisi generale semplice (GA3) per la misurazione della lunghezza delle ciglia, dell'intensità e del coefficiente di Mander. (B) Ricetta GA3 complessa per la misurazione dell'intensità lungo la lunghezza del cilio utilizzando un marcatore per il corpo basale. Fare clic qui per scaricare questo file.
Discussione
Le misurazioni di lunghezza e intensità sono modi comuni in cui vengono analizzate le ciglia primarie, tuttavia, non esiste un metodo convenzionale standardizzato utilizzato sul campo. L'identificazione e la quantificazione delle ciglia primarie utilizzando software come ImageJ richiede molto tempo ed è soggetta a pregiudizi ed errori dell'utente. Ciò rende difficile analizzare con precisione set di dati di grandi dimensioni. Qui mostriamo che l'utilizzo di un programma ai può superare molte di queste sfide rendendo realizzabile un'analisi ad alto rendimento delle ciglia primarie. Qui descriviamo la procedura per addestrare un'applicazione basata sull'IA per riconoscere le ciglia primarie e delineare i passaggi necessari per analizzare la lunghezza e l'intensità.
Mentre la formazione iniziale dell'Ai per riconoscere le ciglia richiede molto tempo da parte dell'utente, una volta completata può essere utilizzata su qualsiasi set di dati acquisito con gli stessi parametri. La maschera binaria generata dall'Ai è modificabile in modo tale che eventuali errori possano essere corretti. Tuttavia, gli errori nell'identificazione delle ciglia dovrebbero segnalare all'utente che l'IA deve essere ulteriormente addestrata con immagini aggiuntive. Uno dei principali vantaggi di questo metodo è che l'Ai può essere addestrato a riconoscere le ciglia in diversi tipi di campioni sia in 2D che in 3D. I precedenti metodi di analisi generati all'interno dei laboratori hanno varie limitazioni, tra cui la richiesta di soglie manuali per l'identificazione e problemi di identificazione delle ciglia fotografate da sezioni di tessuto in cui la densità cellulare è elevata36,46,47. Questi metodi sono anche specializzati per l'analisi delle ciglia, mentre l'analisi con il software NIS Elements può valutare diversi aspetti delle immagini contemporaneamente. Poiché l'Ai qui descritta fa parte del pacchetto software NIS Elements, le immagini acquisite utilizzando un microscopio Nikon possono essere facilmente continuate fino all'analisi. Tuttavia, l'imaging con Nikon non è necessario per l'utilizzo di questo metodo. Indipendentemente dal formato di file di dati grezzi acquisito, i file ".tif" possono essere aperti da NIS Elements per l'utilizzo nell'Ai.
Questa applicazione Ai all'interno di NIS Elements è ampiamente disponibile e forse già parte del software di analisi delle immagini in uso dai laboratori che studiano le ciglia primarie. Con l'espansione della prevalenza della tecnologia Ai, altri software di imaging possono espandere le loro opzioni di analisi per includere un modulo Ai simile. L'applicazione dell'analisi Ai all'identificazione delle ciglia può essere utilizzata per diversi aspetti dell'analisi delle ciglia. Mentre abbiamo delineato i metodi per alcune semplici analisi come la lunghezza (Figura 2 e 3), l'intensità (Figura 4) e la colocalizzazione (Figura 5) è possibile aggiungere analisi più sofisticate al flusso di lavoro di analisi GA3 come nella Figura 6. Ad esempio, invece di misurare l'intensità di un cilio completo, le differenze di intensità all'interno di una sottoregione di un cilio possono essere di interesse per valutare la localizzazione sub-ciliare. Le differenze di intensità all'interno di una sottoregione di un cilio potrebbero indicare che la proteina si sta accumulando sulla punta o alla base del cilio, come ad esempio come le proteine Gli sono arricchite sulla punta delle ciglia48. Inoltre, questa applicazione Ai può essere utilizzata per identificare prontamente le differenze tra genotipi o gruppi di trattamento. Mentre il nostro laboratorio utilizza principalmente questo metodo per analizzare le ciglia riprese da sezioni cerebrali o colture neuronali, può essere applicato a immagini acquisite da varie linee cellulari o altri tipi di tessuto. La flessibilità del tipo di campione su cui questa applicazione può essere utilizzata rende questo metodo di analisi prezioso per molti gruppi diversi che studiano le ciglia primarie o qualsiasi organello discreto che viene valutato come mitocondri, nucleo o ER.
Divulgazioni
Il co-autore Wesley Lewis è un dipendente di Nikon. Non ci sono informazioni finanziarie.
Riconoscimenti
Questo lavoro è stato finanziato dal National Institute of Diabetes and Digestive and Kidney Diseases R01 DK114008 a NFB e dall'American Heart Association Fellowship Grant #18PRE34020122 a RB. Ringraziamo Rich Gruskin General Manager di Nikon Software, Melissa Bentley, Courtney Haycraft e Teresa Mastracci per i commenti approfonditi sul manoscritto.
Materiali
| Name | Company | Catalog Number | Comments |
| Intel Xeon, 3.6 GHz, 32GB RAM | Intel Corporation | W-2123 | Processor used for running NIS Elements. |
| Nikon Elements Software | Nikon Instruments Inc. | - | Ai and GA3 software |
| Quadro RTX 4000 Graphics card | NVIDIA Corporation | Quadro RTX 4000 | |
| Windows 10 Professional 64-bit | Microsoft Inc. | - | Operating system used for running NIS Elements |
| Workstation | HP Development Company, L.P. | HP Z4G4 | Workstation used for running NIS Elements |
Riferimenti
- Wang, L., et al. Ciliary gene RPGRIP1L is required for hypothalamic arcuate neuron development. JCI Insight. 4 (3), (2019).
- Siljee, J. E., et al. Subcellular localization of MC4R with ADCY3 at neuronal primary cilia underlies a common pathway for genetic predisposition to obesity. Nature Genetics. 50 (2), 180-185 (2018).
- Davenport, J. R., et al. Disruption of intraflagellar transport in adult mice leads to obesity and slow-onset cystic kidney disease. Current Biology. 17 (18), 1586-1594 (2007).
- Berbari, N. F., O'Connor, A. K., Haycraft, C. J., Yoder, B. K. The primary cilium as a complex signaling center. Current Biology. 19 (13), 526-535 (2009).
- Walz, G. Role of primary cilia in non-dividing and post-mitotic cells. Cell Tissue Research. 369 (1), 11-25 (2017).
- Nachury, M. V., Mick, D. U. Establishing and regulating the composition of cilia for signal transduction. Nature Reviews. Molecular Cell Biology. 20 (7), 389-405 (2019).
- Goetz, S. C., Anderson, K. V. The primary cilium: a signalling centre during vertebrate development. Nature Reviews Genetics. 11 (5), 331-344 (2010).
- Engle, S. E., Bansal, R., Antonellis, P. J., Berbari, N. F. Cilia signaling and obesity. Seminars in Cell and Developmental Biology. , (2020).
- Reiter, J. F., Leroux, M. R. Genes and molecular pathways underpinning ciliopathies. Nature reviews. Molecular Cell Biology. 18 (9), 533-547 (2017).
- Waters, A. M., Beales, P. L. Ciliopathies: an expanding disease spectrum. Pediatric Nephrology. 26 (7), Berlin, Germany. 1039-1056 (2011).
- Hildebrandt, F., Benzing, T., Katsanis, N. Ciliopathies. New England Journal of Medicine. 364 (16), 1533-1543 (2011).
- Vaisse, C., Reiter, J. F., Berbari, N. F. Cilia and Obesity. Cold Spring Harbor Perspectives in Biology. 9 (7), (2017).
- Berbari, N. F., et al. Leptin resistance is a secondary consequence of the obesity in ciliopathy mutant mice. Proceedings of the National Academy of Sciences of the United States of America. 110 (19), 7796-7801 (2013).
- Jacobs, D. T., et al. Dysfunction of intraflagellar transport-A causes hyperphagia-induced obesity and metabolic syndrome. Disease Models & Mechanisms. 9 (7), 789-798 (2016).
- Arsov, T., et al. Fat aussie--a new Alström syndrome mouse showing a critical role for ALMS1 in obesity, diabetes, and spermatogenesis. Molecular Endocrinology. 20 (7), 1610-1622 (2006).
- Tam, L. W., Ranum, P. T., Lefebvre, P. A. CDKL5 regulates flagellar length and localizes to the base of the flagella in Chlamydomonas. Molecular Biology of the Cell. 24 (5), 588-600 (2013).
- Rajagopalan, V., Subramanian, A., Wilkes, D. E., Pennock, D. G., Asai, D. J. Dynein-2 affects the regulation of ciliary length but is not required for ciliogenesis in Tetrahymena thermophila. Molecular Biology of the Cell. 20 (2), 708-720 (2009).
- Bengs, F., Scholz, A., Kuhn, D., Wiese, M. LmxMPK9, a mitogen-activated protein kinase homologue affects flagellar length in Leishmania mexicana. Molecular Microbiology. 55 (5), 1606-1615 (2005).
- Han, Y. M., et al. Leptin-promoted cilia assembly is critical for normal energy balance. Journal of Clinical Investigation. 124 (5), 2193-2197 (2014).
- Caspary, T., Marazziti, D., Berbari, N. F. Cilia: Methods and Protocols. Satir, P., Tvorup Christensen, S. , Springer. New York. 203-214 (2016).
- Bishop, G. A., Berbari, N. F., Lewis, J., Mykytyn, K. Type III adenylyl cyclase localizes to primary cilia throughout the adult mouse brain. Journal of Comparative Neurology. 505 (5), 562-571 (2007).
- Domire, J. S., Mykytyn, K. Markers for neuronal cilia. Methods in Cell Biology. 91, 111-121 (2009).
- Sun, J. S., et al. Ventromedial hypothalamic primary cilia control energy and skeletal homeostasis. Journal of Clinical Investigation. 131 (1), (2021).
- Berbari, N. F., Johnson, A. D., Lewis, J. S., Askwith, C. C., Mykytyn, K. Identification of ciliary localization sequences within the third intracellular loop of G protein-coupled receptors. Molecular Biology of the Cell. 19 (4), 1540-1547 (2008).
- Brailov, I., et al. Localization of 5-HT(6) receptors at the plasma membrane of neuronal cilia in the rat brain. Brain Research. 872 (1-2), 271-275 (2000).
- Domire, J. S., et al. Dopamine receptor 1 localizes to neuronal cilia in a dynamic process that requires the Bardet-Biedl syndrome proteins. Cellular and Molecular Life Sciences. 68 (17), 2951-2960 (2011).
- Handel, M., et al. Selective targeting of somatostatin receptor 3 to neuronal cilia. Neuroscience. 89 (3), 909-926 (1999).
- Koemeter-Cox, A. I., et al. Primary cilia enhance kisspeptin receptor signaling on gonadotropin-releasing hormone neurons. Proceedings of the National Academy of Sciences of the United States of America. 111 (28), 10335-10340 (2014).
- Mukhopadhyay, S., et al. The ciliary G-protein-coupled receptor Gpr161 negatively regulates the Sonic hedgehog pathway via cAMP signaling. Cell. 152 (1-2), 210-223 (2013).
- Berman, S. A., Wilson, N. F., Haas, N. A., Lefebvre, P. A. A novel MAP kinase regulates flagellar length in Chlamydomonas. Current Biology. 13 (13), 1145-1149 (2003).
- Nguyen, R. L., Tam, L. W., Lefebvre, P. A. The LF1 gene of Chlamydomonas reinhardtii encodes a novel protein required for flagellar length control. Genetics. 169 (3), 1415-1424 (2005).
- Tam, L. W., Wilson, N. F., Lefebvre, P. A. A CDK-related kinase regulates the length and assembly of flagella in Chlamydomonas. Journal of Cell Biology. 176 (6), 819-829 (2007).
- O'Connor, A. K., et al. An inducible CiliaGFP mouse model for in vivo visualization and analysis of cilia in live tissue. Cilia. 2 (1), 8(2013).
- Bangs, F. K., Schrode, N., Hadjantonakis, A. K., Anderson, K. V. Lineage specificity of primary cilia in the mouse embryo. Nature Cell Biology. 17 (2), 113-122 (2015).
- Delling, M., et al. Primary cilia are not calcium-responsive mechanosensors. Nature. 531 (7596), 656-660 (2016).
- Saggese, T., Young, A. A., Huang, C., Braeckmans, K., McGlashan, S. R. Development of a method for the measurement of primary cilia length in 3D. Cilia. 1 (1), 11(2012).
- Kobayashi, Y., Hamamoto, A., Saito, Y. Analysis of ciliary status via G-protein-coupled receptors localized on primary cilia. Microscopy. 69 (5), 277-285 (2020).
- Zhou, L. Q., et al. Artificial intelligence in medical imaging of the liver. World Journal of Gastroenterology. 25 (6), 672-682 (2019).
- Naugler, C., Church, D. L. Automation and artificial intelligence in the clinical laboratory. Critical Reviews in Clinical Laboratory Sciences. 56 (2), 98-110 (2019).
- Dunn, K. W., Kamocka, M. M., McDonald, J. H. A practical guide to evaluating colocalization in biological microscopy. American Journal of Physiology-Cell Physiology. 300 (4), 723-742 (2011).
- Bansal, R., et al. Hedgehog Pathway Activation Alters Ciliary Signaling in Primary Hypothalamic Cultures. Frontiers in Cellular Neuroscience. 13, 266(2019).
- Jin, H., et al. The conserved Bardet-Biedl syndrome proteins assemble a coat that traffics membrane proteins to cilia. Cell. 141 (7), 1208-1219 (2010).
- Liew, G. M., et al. The intraflagellar transport protein IFT27 promotes BBSome exit from cilia through the GTPase ARL6/BBS3. Developmental Cell. 31 (3), 265-278 (2014).
- Engle, S. E., et al. A CreER Mouse to Study Melanin Concentrating Hormone Signaling in the Developing Brain. Genesis. , (2018).
- Thorpe, S. D., et al. Reduced primary cilia length and altered Arl13b expression are associated with deregulated chondrocyte Hedgehog signaling in alkaptonuria. Journal of Cellular Physiology. 232 (9), 2407-2417 (2017).
- Lauring, M. C., et al. New software for automated cilia detection in cells (ACDC). Cilia. 8, 1(2019).
- Dummer, A., Poelma, C., DeRuiter, M. C., Goumans, M. J., Hierck, B. P. Measuring the primary cilium length: improved method for unbiased high-throughput analysis. Cilia. 5, 7(2016).
- Haycraft, C. J., et al. Gli2 and Gli3 localize to cilia and require the intraflagellar transport protein polaris for processing and function. PLoS Genetics. 1 (4), 53(2005).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon