Method Article
Abordagens de Inteligência Artificial para avaliar cilia primária
Neste Artigo
Resumo
O uso de inteligência artificial (IA) para analisar imagens está emergindo como uma abordagem poderosa, menos tendenciosa e rápida em comparação com métodos comumente usados. Aqui treinamos a IA para reconhecer uma organela celular, cílios primários, e analisar propriedades como comprimento e intensidade de coloração de forma rigorosa e reprodutível.
Resumo
Cília são apêndices celulares baseados em microtúbulos que funcionam como centros de sinalização para uma diversidade de vias de sinalização em muitos tipos de células de mamíferos. O comprimento de Cília é altamente conservado, fortemente regulado, e varia entre diferentes tipos de células e tecidos e tem sido implicado em impactar diretamente sua capacidade de sinalização. Por exemplo, cílios têm sido mostrados para alterar seus comprimentos em resposta à ativação de receptores ciliares de proteína G acoplado. No entanto, medir com precisão e reprodutivelmente os comprimentos de numerosos cílios é um procedimento demorado e intensivo em mão-de-obra. As abordagens atuais também são propensas a erros e viés. Programas de inteligência artificial (IA) podem ser utilizados para superar muitos desses desafios devido a capacidades que permitem assimilação, manipulação e otimização de conjuntos de dados extensos. Aqui, demonstramos que um módulo Ai pode ser treinado para reconhecer cílios em imagens tanto de amostras in vivo quanto in vitro. Depois de usar o Ai treinado para identificar cílios, somos capazes de projetar e utilizar rapidamente aplicações que analisam centenas de cílios em uma única amostra para comprimento, intensidade de fluorescência e co-localização. Essa abordagem imparcial aumentou nossa confiança e rigor ao comparar amostras de diferentes preparações neuronais primárias in vitro, bem como em diferentes regiões cerebrais dentro de um animal e entre animais. Além disso, essa técnica pode ser usada para analisar de forma confiável a dinâmica da cília de qualquer tipo de célula e tecido de forma de alto rendimento em várias amostras e grupos de tratamento. Em última análise, as abordagens baseadas em IA provavelmente se tornarão padrão à medida que a maioria dos campos se movem em direção a abordagens menos tendenciosas e mais reprodutíveis para aquisição e análise de imagens.
Introdução
Cilia primária são organelas sensoriais surgindo da maioria das células mamíferastipos 1,2,3,4. Geralmente são apêndices solitários críticos para coordenar diversas vias de sinalização celular, integrando sinais extracelulares5,6,7. A cília primária desempenha papéis importantes durante o desenvolvimento embrionário e a homeostase do tecido adulto, e a interrupção de sua função ou morfologia está associada a vários distúrbios genéticos, que são coletivamente chamados de ciliopatias. Devido à natureza quase onipresente da cília, as ciliopatias estão associadas a uma ampla gama de características clínicas que podem impactar todos os sistemas de órgãos8,9,10,11,12. Em modelos animais de ciliopatias, a perda de estrutura ciliar ou capacidade de sinalização se manifesta em diversos fenótipos clinicamente relevantes, incluindo a obesidade associada à hiperfagia3,13,14,15. Em muitos sistemas de modelos, as alterações de comprimento de cílios têm sido demonstradas para impactar sua capacidade de sinalização e funções16,17,18,19. No entanto, existem vários desafios técnicos e demorados associados à avaliação precisa e reprodutível do comprimento e da composição da Cília.
O sistema nervoso central dos mamíferos adultos (SNC) é um contexto biológico que tem colocado um desafio para a compreensão da morfologia e da função da cília. Embora pareça que neurônios e células em todo o CNS possuem cílios, devido às ferramentas e habilidades limitadas para observar e analisar essas cílias, uma compreensão de suas funções permanece evasiva20. Por exemplo, o marcador de cília prototípico, acetilado α-tubulina, não rotula cília neuronal20. A dificuldade de estudar essas cílios foi parcialmente resolvida com a descoberta de vários receptores acoplados à proteína G (GPCR), máquinas de sinalização e proteínas associadas à membrana que são enriquecidas na membrana da cília neuronal21,22. Todas essas observações básicas simples sugerem a importância e a diversidade do CNS cilia, que até agora parece incomparável por outros tecidos. Por exemplo, a variação no comprimento do cílio e na localização do GPCR pode ser observada em todo o cérebro, com os comprimentos em certos núcleos neuronais sendo diferentes quando comparados com outros núcleos19,23. Da mesma forma, seu conteúdo GPCR e máquinas de sinalização mostram diversidade baseada na localização neuroanatomológica e no tipo neuronal2,24,25,26,27,28,29. Essas observações simples demonstram que o comprimento e a composição do mamífero CNS cilia são fortemente regulados, assim como em organismos modelo, como clamídomonas reinhardtii,mas o impacto dessas diferenças de comprimento na função cília, sinalização e, finalmente, comportamento permanece incerto16,30,31,32.
Medir com precisão o comprimento e a composição da cília prova ser um desafio técnico propenso a erros e irreproducibilidade do usuário. Atualmente, cilia in vivo e in vitro são mais frequentemente identificadas usando abordagens imunofluorescentes que rotulam proteínas ciliares ou alelos fluorescentes enriquecidos com cílios33,34,35. Os comprimentos desses cílios fluorescentes são então medidos a partir de uma imagem bidimensional (2D) usando ferramentas de medição de linha em programas de análise de imagem, como ImageJ36. Este processo não é apenas tedioso e trabalhoso, mas também propenso a viés e erro. Esses mesmos obstáculos surgem ao medir as intensidades de cílios, que ajudam a indicar mudanças na estrutura cílio37. Para minimizar as inconsistências nesses tipos de análises de imagem, os programas de inteligência artificial (IA) estão se tornando opções mais prevalentes e acessíveis38.
Ai é o avanço de sistemas de computador que usam a vantagem de algoritmos de computador e programação para executar tarefas que normalmente exigiriam inteligência humana39. Os dispositivos de IA são ensinados a perceber padrões, parâmetros e características recorrentes e tomar ações para maximizar as chances de criar resultados bem-sucedidos. A IA é versátil e pode ser treinada para reconhecer objetos ou estruturas de interesse específicas, como cílios, e depois ser programada para executar uma variedade de análises sobre os objetos identificados. Portanto, dados de imagem complexos podem ser gerados de forma rápida e reprodutiva pela Ai38. A análise de automação e IA das imagens capturadas aumentará a eficácia e a eficiência, limitando qualquer erro humano potencial e viés39. Estabelecer uma metodologia baseada em IA para identificação de cílios cria uma maneira consistente para todos os grupos de pesquisa analisarem e interpretarem dados de ília.
Aqui utilizamos um módulo Ai para identificar cilia tanto in vivo quanto in vitro em imagens 2D. Usando um conjunto de imagens de amostra, o Ai é treinado para identificar cílios. Uma vez que o treinamento é concluído, o Ai designado é usado para aplicar uma máscara binária sobre Ai identificado cílio em uma imagem. Os binários aplicados pela IA são modificáveis, se necessário, para garantir que todas as cílios nas imagens sejam devidamente identificadas e a identificação não específica seja eliminada. Depois de utilizar o IA para identificar cílios, os programas de análise geral (GA) personalizados são usados para realizar diferentes análises, como medir o comprimento do cílio e a intensidade da fluorescência. Os dados coletados são exportados para uma tabela que pode ser facilmente lida, interpretada e utilizada para análises estatísticas(Figura 1). O uso de tecnologia automatizada e Ai para identificar cílios e obter medições específicas entre grupos experimentais ajudará em estudos futuros que visam compreender o impacto da função cília do CNS e da morfologia na comunicação e comportamento celular-celular.
Protocolo
1. Adquira imagens brutas
- Corrigir e immunolabel amostras conforme necessário20.
- Cilia de imagem usando um microscópio confocal em profundidade máxima de bits usando o mesmo tamanho de pixel com resolução Nyquist.
- Exportar imagens como arquivos monocromáticos do Formato de Imagem Marcada (.tif).
NOTA: Este protocolo descreve como usar o módulo Ai especificamente dentro do software NIS Elements. Se as imagens forem adquiridas como arquivos .nd2, a exportação de imagens como .tif arquivos não é necessária e o usuário pode proceder diretamente para a etapa 2.3. Se as imagens forem adquiridas em um sistema diferente, uma licença NIS Elements pode ser comprada separadamente e .tif arquivos podem ser convertidos conforme descrito nos próximos passos.
2. Treine Ai para identificar cílios
- Abra o conjunto de dados de treinamento.
- Selecione aproximadamente 50 imagens de amostra com pelo menos um círio por quadro para treinar o software e copiá-las em uma única pasta. Esta pasta é usada para direcionar o software ao abrir as imagens. Abra estes 50 quadros dentro de um único documento ND2 com pelo menos um cilium por quadro. Selecione Arquivo > > de importação/exportação criar arquivo ND a partir da sequência de arquivos.
- Selecione a pasta que contém o conjunto de dados de treinamento. Isso abrirá a lista de arquivos no centro da janela de diálogo. Defina manualmente a organização dos arquivos usando pelo menos uma opção no menu suspenso acima. As opções são multiponto (para vários arquivos de projeção máxima), série Z (para uma imagem de pilha de z), tempo (para uma imagem de lapso de tempo) e comprimento de onda (para arquivos de vários canais).
- Digite os valores numéricos correspondentes em cada opção selecionada. Selecione Nenhum onde as opções não forem selecionadas. Clique em Converter para abrir o documento ND.
- Calibrar imagens.
- Digite o tamanho do pixel no canto inferior esquerdo da imagem: Clique à direita Sem calibração > calibrar documento > tamanho do pixel.
- Identifique Cilia.
- Identifique manualmente o cílio rastreando precisamente estruturas ciliares individuais em todos os quadros abertos usando o AutoDetect ou o Draw Object na barra de ferramentas binárias. Isso atrairá máscaras binárias sobre os objetos de interesse. Esses binários servirão como objetos de exemplo para treinamento do software para identificar cílios em características baseadas em pixels em análises de imagem experimentais futuras. Selecione Exibir controles de análise > > objeto de saque de barra de ferramentas binária >.
NOTA: Remova qualquer quadro que não tenha binários, pois o software não começará a treinar a menos que seja capaz de detectar binários em todos os quadros abertos.
- Identifique manualmente o cílio rastreando precisamente estruturas ciliares individuais em todos os quadros abertos usando o AutoDetect ou o Draw Object na barra de ferramentas binárias. Isso atrairá máscaras binárias sobre os objetos de interesse. Esses binários servirão como objetos de exemplo para treinamento do software para identificar cílios em características baseadas em pixels em análises de imagem experimentais futuras. Selecione Exibir controles de análise > > objeto de saque de barra de ferramentas binária >.
- Treine Ai.
- Comece a treinar o software. Isso abrirá a caixa de Segment.ai do trem. Selecione Segment.ai de trem NIS.ai >.
- Na caixa de Segment.ai trem, selecione o canal de origem a ser usado para treinamento. Se os arquivos de vários canais estiverem abertos, selecione apenas um canal como canal de origem. Em seguida, selecione os binários apropriados para a verdade terrestre para treinar os Ai. Por fim, selecione o número de iterações necessárias para treinar o Ai dependendo do tamanho e distribuição dos binários.
NOTA: Se os binários forem facilmente detectáveis do entorno e bem distribuídos ao longo da imagem, o software pode precisar de menos de 1000 iterações para ser treinado para identificar as imagens. Se as imagens tiverem uma baixa relação sinal-ruído, o ideal é executar pelo menos 1000 iterações durante o treinamento para permitir que a IA identifique cílios em amostras de teste com alta confiança. - Selecione a pasta de destino para salvar o arquivo Ai treinado (.sai) e clique em Treinar para treinar o software. O software agora passará a treinar-se para identificar cilia com base nos binários rastreados. Esse processo leva várias horas.
NOTA: Ao treinar, o software exibirá um gráfico mostrando a perda de treinamento. O gráfico mostrará inicialmente um pico antes de afunilar para idealmente em torno de 1% de perda onde ele plana para o resto do treinamento. Guarde o gráfico para referência futura, verificando a caixa para salvar captura de tela de gráfico na caixa Segment.ai do trem(Figura Suplementar 1). - Se for necessário mais refinamento para o treinamento, continue treinando no mesmo conjunto de dados. Alternativamente, treine em um novo conjunto de dados com os mesmos parâmetros. Não é aconselhável treinar uma IA já treinada em um novo conjunto de dados com diferentes parâmetros ou diferentes objetos de interesse. Selecione Treinar segment.ai > continuar treinando em > selecionar arquivo de IA treinado.
3. Identifique cilia usando ia treinada
- Abra o conjunto de dados experimental.
- Abra as imagens confocal experimentais de cilia no software convertendo a amostra .tif arquivos para arquivos .nd2, semelhante ao passo 2.1. Selecione Arquivo > > de importação/exportação criar arquivo ND a partir da sequência de arquivos.
NOTA: As imagens devem ser do mesmo tamanho de pixels que as usadas para treinar o IA. Se as imagens já estiverem no formato ND2, pule para a etapa 3.3.
- Abra as imagens confocal experimentais de cilia no software convertendo a amostra .tif arquivos para arquivos .nd2, semelhante ao passo 2.1. Selecione Arquivo > > de importação/exportação criar arquivo ND a partir da sequência de arquivos.
- Calibrar imagens.
- Digite o tamanho do pixel no canto inferior esquerdo da imagem. Clique com o botão direito do mouse > calibrar documento > tamanho do pixel.
- Execute a Ai treinada nos arquivos abertos.
- Comece a identificar o cílio usando Ai. O software agora desenhará binários na cília com base no treinamento que recebeu na etapa anterior. Este processo levará alguns segundos. Selecione NIS.ai > Segment.ai.
NOTA: O software solicitará a seleção do canal se vários canais estiverem abertos. Os canais são listados por seus respectivos nomes aqui. Caso não, a caixa marcada como 'Mono' será automaticamente selecionada.
- Comece a identificar o cílio usando Ai. O software agora desenhará binários na cília com base no treinamento que recebeu na etapa anterior. Este processo levará alguns segundos. Selecione NIS.ai > Segment.ai.
- Verifique as imagens para binários mal identificados.
- Uma vez que o IA tenha identificado cílios e desenhado binários, verifique as imagens se há objetos identificados por engano. Se desejar, exclua manualmente quaisquer binários mal identificados. Selecione Exibir controles de análise > > barra de ferramentas binária > excluir objeto.
4. Medindo o comprimento e intensidade do cílio
- Crie uma nova receita de Análise Geral 3 (GA3).
- Agora que os cílios foram identificados e segmentados, proceder à análise de diferentes parâmetros de cílios, como comprimentos e intensidades utilizando a ferramenta GA3. Isso abrirá uma nova janela com um espaço em branco no centro onde a análise será definida. Selecione Imagem > Nova Receita GA3.
- Selecione os binários para analisar.
- Como os cílios já são segmentados usando Segment.ai, o GA3 detectará automaticamente os binários devidamente rotulados de acordo com a IA e incluirá o nó. Selecione'Binários > auto Detect_AI' ou 'Binários > Desenhar Object_AI'.
- Selecione os canais necessários para análise. O GA3 também detectará automaticamente os canais nas imagens e exibirá suas guias em Canais.
- Remova objetos que toquem na borda do quadro.
- Uma vez que o IA irá segmentar todos os cílios como objetos no quadro, ele também detectará cílios incompletos ao longo das bordas do quadro. Esses objetos podem ser removidos manualmente na etapa 3.4 ou podem ser removidos automaticamente no GA3. Selecione processamento binário > Remover objetos > bordas de toque.
- Selecione parâmetros para medir cílios.
- Arraste e solte os parâmetros para medir, como comprimento de cílio(comprimento)e intensidades(Intensidade do Objeto de Soma). Conecte os nódulos aos nódulos binários apropriados (conexão A) e aos nódulos de canal (conexão B). Passe o mouse sobre a conexão do nó para uma dica de ferramenta para mostrar a qual conexão o nó pertence. Selecione medição > tamanho do objeto > comprimento e medição > intensidade do objeto > intensidade de Obj.
NOTA: O comprimento do nó conecta-se apenas ao nó binário, enquanto a Intensidade de Sum Obj conecta-se tanto aos nós binários quanto aos nós do canal.
- Arraste e solte os parâmetros para medir, como comprimento de cílio(comprimento)e intensidades(Intensidade do Objeto de Soma). Conecte os nódulos aos nódulos binários apropriados (conexão A) e aos nódulos de canal (conexão B). Passe o mouse sobre a conexão do nó para uma dica de ferramenta para mostrar a qual conexão o nó pertence. Selecione medição > tamanho do objeto > comprimento e medição > intensidade do objeto > intensidade de Obj.
- Apfite as medidas em uma única tabela.
- Combine todas as medidas em uma única tabela de saída arrastando e soltando a Coluna de Anexação do nó ao gráfico de fluxo de análise e conecte-as aos nós de medição, Comprimento e Intensidade de Obj de Soma. Selecione a coluna de > de anexação básica de > de gerenciamento de dados.
- Medir cilia.
- Meça cilia clicando em Executar. Esse processo leva alguns momentos para medir todas as cílios nas imagens experimentais. Os comprimentos e intensidades aparecerão em uma nova janela resultados de análise.
NOTA: A tabela às vezes pode incluir dados de máscaras que Ai reconheceu como cílios, mas eram muito pequenas para serem detectadas pelo olho humano e eliminadas na etapa 3.4. Esses objetos podem ser removidos do conjunto de dados usando um filtro antes da análise estatística. Aqui, foi utilizado um filtro de 1 μm para medições in vitro de comprimento de cília na Figura 2 e 2 μm para in vivo cilia. Isso pode ser feito antes de exportar dados usando a via abaixo. Selecione a janela resultados de análise > Defina o filtro > digite o filtro de uso > valor.
- Meça cilia clicando em Executar. Esse processo leva alguns momentos para medir todas as cílios nas imagens experimentais. Os comprimentos e intensidades aparecerão em uma nova janela resultados de análise.
- Dados de exportação para análise estatística.
5. Estudos de colocalização
NOTA: A análise de colocalização pode ser incluída na mesma receita GA3 utilizada para medições de comprimento e análise de intensidade de cílios. Se usar a mesma receita, abra arquivos conforme descrito abaixo e meça os comprimentos e intensidades de ambos os canais, juntamente com os coeficientes de colocalização no mesmo pipeline de análise.
- Abra o conjunto de dados experimental.
- Abra as imagens confocais experimentais de cilia no software convertendo a amostra .tif arquivos em arquivos .nd2. Selecione Arquivo > > de importação/exportação criar arquivo ND a partir da sequência de arquivos.
- Na janela pop-up, selecione os arquivos monocromáticos de profundidade de 16 bits de todos os canais de interesse do explorador de janelas localizado na primeira coluna da janela pop-up. Selecione Multipoint ou Série Z no primeiro menu suspenso e digite um valor correspondente ao número total de imagens ou pilhas, respectivamente.
- Na segunda caixa de drop down, selecione Comprimento de onda e altere o valor para o número total de canais na pasta. O software desbloqueará automaticamente uma janela de seleção de comprimento de onda localizada na extremidade inferior direita da janela pop-up. Use o menu de queda de cores para selecionar a cor de cada canal. Forneça a cada canal um nome diferente na coluna Nome. Uma vez que todas as informações sejam atualizadas, clique em Converter. O software gerará automaticamente um arquivo de imagem All sobreposto com todas as imagens individuais de todos os canais selecionados.
- Calibrar imagens.
- Digite o tamanho do pixel no canto inferior esquerdo da imagem. Clique com o botão direito do mouse > calibrar documento > tamanho do pixel.
- Di execute a Ai treinada no primeiro canal.
- Comece a identificar o cílio em um dos canais abertos (por exemplo, ACIII; Figura 5A) usando Ai. O software agora desenhará binários em Cília rotulado a ACIII com base no treinamento recebido para este canal. Este processo levará alguns segundos. Selecione NIS.ai > Segment.ai > canais de origem > ACIII.
- Execute a Ai treinada no segundo canal.
- Comece a identificar o cílio no outro canal aberto (por exemplo, MCHR1; Figura 5B) usando Ai. O software agora desenhará binários no MCHR1 rotulados com base no treinamento que recebeu para este canal. Esse processo levará alguns momentos. Selecione NIS.ai > Segment.ai > Canais de origem > MCHR1.
- Verifique as imagens para binários mal identificados.
- Uma vez que o Ai tenha identificado cílios e desenhado binários, verifique as imagens se há objetos mal identificados. Exclua manualmente quaisquer binários mal identificados, se necessário. Selecione Exibir controles de análise > > barra de ferramentas binária > excluir objeto.
- Crie nova receita GA3.
- Agora que os cílios foram identificados e segmentados, proceder à análise de colocalização utilizando a ferramenta GA3. Isso abrirá uma nova janela com um espaço em branco no centro onde a análise será definida. Uma janela com todos os binários e canais identificados será gerada. Verifique se todos os canais e binários desejados para análise estão presentes e selecionados. Selecione Imagem > Nova Receita GA3.
- Remova objetos que toquem na borda do quadro.
- Uma vez que o IA irá segmentar todos os objetos semelhantes a cílios no quadro, ele também detectará cílios incompletos ao longo das bordas do quadro. Esses objetos podem ser removidos manualmente na etapa 5.5 ou podem ser removidos automaticamente no GA3. Selecione processamento binário > Remover objetos > bordas de toque.
- Configure a via de colocalização no GA3.
- Para medir a sobreposição dos dois canais dentro de cílios, use a Correlação de Coeficiente de Mander. Arraste e solte o nó do Coeficiente manders no espaço em branco da receita GA3 e conecte-o ao binário e canais apropriados. Aqui, 'conexão A' se conecta com o binário ACIII, 'conexão B' com o canal MCHR1 e 'conexão C' com o canal ACIII para determinar a sobreposição do MCHR1 dentro do binário ACIII. Selecione a medição > a razão da razão do objeto > coeficiente de Manders.
NOTA: O software permite medir a colocalização usando correlação de coeficiente pearson usando as mesmas etapas descritas neste protocolo40.
- Para medir a sobreposição dos dois canais dentro de cílios, use a Correlação de Coeficiente de Mander. Arraste e solte o nó do Coeficiente manders no espaço em branco da receita GA3 e conecte-o ao binário e canais apropriados. Aqui, 'conexão A' se conecta com o binário ACIII, 'conexão B' com o canal MCHR1 e 'conexão C' com o canal ACIII para determinar a sobreposição do MCHR1 dentro do binário ACIII. Selecione a medição > a razão da razão do objeto > coeficiente de Manders.
- Apfite as medidas em uma única tabela.
- Misture todas as medidas em uma única tabela de saída. Selecione a coluna de > de anexação básica de > de gerenciamento de dados.
- Medir a colocalização.
- Meça cilia clicando em Executar. Esse processo leva alguns momentos para medir todas as cílios nas imagens experimentais. Os dados aparecerão em uma nova janela resultados de análise.
- Dados de exportação para análise estatística.
Resultados
Treinamento de IA para identificar cílios
Medir e avaliar o comprimento e a composição estruturais de Cílios pode ser um processo tedioso, demorado e propenso a erros. Aqui, usamos a ia para segmentar com precisão cílios de um grande pool de imagens e analisar seus comprimentos e intensidades com uma ferramenta de análise(Figura 1). Todas as abordagens de IA requerem passos de treinamento para sua implementação. Estabelecemos um pipeline de treinamento para reconhecer a cílio, que foi realizada aplicando manualmente máscaras binárias em estruturas ciliares. Essas informações são então usadas para treinar a IA com base nas características dos pixels sob os binários aplicados. Como diretriz geral, o treinamento envolve o software passando por várias iterações, aproximadamente 1000, e é considerado ótimo se a perda de treinamento ou taxa de erro for inferior a 1%. No entanto, o número de iterações e erros no processo de treinamento pode variar dependendo das imagens amostrais utilizadas para treinamento. Por exemplo, após nossas sessões de treinamento usando imagens de cílios neuronais in vitro, a taxa de erro foi de 1,378% em comparação com 3,36% para imagens da seção cerebral in vivo (Figura Suplementar 1). Uma vez concluído o treinamento, a IA pode então ser usada para segmentar cílios a partir de imagens experimentais em segundos e as máscaras binárias resultantes são usadas para medir parâmetros estruturais. Isso elimina a necessidade de segmentar objetos usando o método tradicional de limiar de intensidade que pode ser difícil em imagens com alto ruído de fundo ou quando objetos estão próximos um do outro. A IA também reduz o potencial de erro e viés aplicando o mesmo algoritmo em todas as imagens, independentemente do usuário.
Medindo o comprimento da cília usando GA3
O comprimento da cília é fortemente regulado e está associado a impactos funcionais na sinalização ciliar16,19. Aqui, medimos os comprimentos de cilia usando um pipeline de análise dentro do software NIS Elements chamado General Analysis 3 ou GA3. O GA3 ajuda a combinar múltiplas ferramentas em um único fluxo de trabalho para construir rotinas personalizadas para cada experimento. Começamos medindo comprimentos de cílios em uma linha celular. As células do ducto coletor interno do camundongo (IMCD-3) foram imunolabelladas com tubulina acetilada e imagens usando um microscópio confocal. Medimos os comprimentos de cília utilizando GA3 após a segmentação com segment.ai (Figura Suplementar 3A). Embora acetilada α-tubulina seja preferencialmente encontrada no cílio primário, ela também é encontrada em outras regiões ricas em microtúbulos, como o citoesqueleto, bem como a ponte citocinética. O Ai treinado identificou lília na imagem, mas não outras estruturas positivas não ciliares e acetiladas. Cília em células IMCD variou de 0,5 μm a 4,5 μm com um comprimento médio de 1,8 ± 0,04 μm(Figura 2A). Em seguida, testamos a capacidade de Ai de medir comprimentos de cílios em culturas neuronais primárias. Nós cultivaram neurônios do hipotálamo e hipocampo de camundongos neonatais por 10 dias e os imunolabellamos com o marcador cília adenilato cyclase III (ACIII)21,41. Ao analisar culturas neuronais, achamos útil aplicar um filtro antes de analisar estatisticamente os comprimentos. Devido a uma menor relação sinal/ruído, vários objetos com menos de 1 μm não eram cílios. Por isso, filtramos os dados para eliminar quaisquer objetos com menos de 1 μm de comprimento para garantir que apenas lírios fossem analisados. Em neurônios hipotalâmicos cultivados, os comprimentos de cílio variaram de 2 μm a 7 μm com um comprimento médio de 3,8 ± 0,19 μm(Figura 2B). Curiosamente, a cília neuronal hipocampal cultivada foi maior com um comprimento médio de 6,73 ±0,15μm(Figura 2C). Tem sido relatado que diferentes núcleos neuronais dentro do hipotálamo apresentam comprimentos de cílios distintos e que estes cílios alteram seus comprimentos em resposta a alterações fisiológicas de forma específica do núcleo19,23. Por isso, também rotulamos seções cerebrais hipotalâmicas de camundongos adultos C57BL/6J com ACIII e imagem do núcleo arcuato (ARC) e núcleo paraventricular (PVN). Utilizando GA3 para medir comprimentos de cílio, observamos que a cália hipotalâmica in vivo apareceu mais longa do que a cília in vitro. Especificamente, cilia hipotalâmica in vivo variam de 1 μm a cerca de 15 μm(Figura 3). Não houve diferenças significativas entre os comprimentos de cílios no PVN (5,54 ± 0,0,42 μm) e os do ARC (6,16 ± 0,27 μm)(Figura 3C)23. Da mesma forma, cílios na região de cornu ammonis (CA1) do hipocampo exibem uma faixa de comprimento mais estreita de 1 μm a 10 μm com um comprimento médio de 5,28 ± 0,33 μm(Figura 3). De acordo com estudos publicados anteriormente, nossa análise utilizando ferramentas de IA e GA3 mostrou que cílios de diferentes regiões cerebrais mostram diversidade no comprimento19,23. Além disso, usando esta abordagem de IA, somos capazes de avaliar rapidamente um grande número de cílios.
Medição da composição de cílios usando GA3
O cílio primário é um centro de sinalização para muitas vias que utilizam diversos tipos de proteínas para realizar funções únicas, como proteínas motoras, proteínas de transporte intraflagellar e GPCRs para citar alguns3,24,42,43. Manter os níveis adequados dessas proteínas dentro do cílio é importante para o bom funcionamento e muitas vezes parece dependente do contexto celular. A rotulagem fluorescente dessas proteínas não só nos permitiu visualizá-las, mas também quantificar suas intensidades como medida da quantidade da proteína rotulada dentro do compartimento relativamente pequeno20. Por isso, buscamos determinar as intensidades de um GPCR ciliar, Melanin Concentrando o Receptor Hormonal 1 (MCHR1), in vivo tanto no ARC quanto no PVN do hipotálamo de camundongos machos adultos24,44. Utilizando Ai e GA3, medimos os comprimentos da cília positiva MCHR1, juntamente com as intensidades para garantir que os objetos que estão sendo contados fossem cílios (Figura Suplementar 3A). Eliminamos objetos pós-análise com menos de 2 μm de comprimento e analisamos intensidades de máscaras binárias remanescentes. Curiosamente, descobrimos que a intensidade do Ciliary MCHR1 em PVN é significativamente maior do que a do ARC indicando uma presença mais forte de mchr1 ciliar em PVN (Figura 4). Outros estudos são necessários para determinar a significância do Ciliary MCHR1 nesses circuitos neuronais. Também medimos as intensidades do Ciliary MCHR1 em neurônios cultivados primários de hipotálamo e hipocampo. Cílias de ambas as culturas apresentam uma ampla distribuição das intensidades do MCHR1 sugerindo a presença de populações neuronais heterogêneas(Figura Suplementar 2). Assim, o uso de ferramentas analíticas sofisticadas como aI e o GA3 permite a avaliação da heterogeneidade cílio dentro do mesmo tecido ou entre múltiplos tecidos. Será interessante ver se outros GPCRs neuronais apresentam diferenças semelhantes em sua localização dentro de neurônios do mesmo tecido e se isso altera em resposta a alterações fisiológicas.
Colocalização
Embora medir as intensidades de fluorescência dentro de um campo de imagem completo possa dar uma impressão de proteína, ela não fornece informações como distribuição espacial ou proximidade com outras proteínas e estruturas celulares próximas. Aqui, medimos a sobreposição de MCHR1 com ACIII como um marcador de lília, plotando as intensidades do MCHR1 contra a da ACIII para cada máscara binária(Figura 5). O gráfico mostra que a maioria dos cílios são positivos para ambos, ACIII e MCHR1, embora alguns cilias mostrem expressão mais forte de um canal sobre o outro. Além disso, existem alguns cílios que mostram a presença de ACIII ou MCHR1, como é evidente a partir dos pontos que estão diretamente no eixo x e no eixo y, respectivamente. Para quantificar essa sobreposição, medimos o coeficiente de sobreposição de Mander e comparamos a extensão da expressão MCHR1 em cólia neuronal do ARC e PVN40. Curiosamente, nossa análise revelou que houve um aumento significativo nos coeficientes do PVN (0,6382 ± 0,0151) do que os do ARC (0,5430 ± 0,0181) (Figura 5C). Isso é consistente com nossos dados anteriores, onde observamos maiores intensidades de MCHR1 em PVN em comparação com ARC (Figura 4). Esses dados sugerem que, como o comprimento da cília, o padrão de expressão do MCHR1 no compartimento ciliar varia em diferentes regiões do cérebro. Usando o mesmo pipeline de análise, será possível determinar se outros GPCRs ciliares como Neuropeptide Y Receptor Tipo 2 (NPY2R) e Somatostatin Receptor Tipo 3 (SSTR3) mostram quantidades semelhantes de diversidade.
Medindo o perfil de intensidade ao longo do cílio
Uma vez identificada a cília utilizando segment.ai, a receita GA3 pode ser modificada para combinar análise de cílios com identificação de outras estruturas de interesse na imagem. Por exemplo, rotular com marcadores corporais basais é útil para a identificação da polaridade cílio. Para fazer essa análise, nós imaginamos seções cerebrais hipotalâmicas de camundongos P0 que expressam ARL13B-mCherry e Centrin2-GFP e imagem do ARC e PVN34. Aqui, a cília foi identificada utilizando Ai como antes, mas agora a receita ga3 modificada inclui a identificação do Centrin2-GFP, uma proteína centrílar encontrada na base do cílio (Figura Suplementar 3B). Rotulando Centrin2-GFP, a base de cílios pode ser distinguida das pontas de ARL13B-mCherry positive cilia(Figura 6A). Então, em vez de medir a intensidade dentro de toda a cília, somos capazes de medir mudanças na intensidade ARL13B ao longo do comprimento da cília (Figura 6B). Também podemos comparar diferenças na intensidade do ARL13B entre as extremidades proximais e as extremidades distal das cílias. Para isso, dividimos o comprimento do círio em caixas de 1 mícnico a partir da base e designamos a primeira caixa de micron como a extremidade proximal e a última caixa de mícula como a extremidade distal. Nossa análise revelou que há significativamente mais ARL13B presente mais perto da base do que a ponta do cílio tanto no ARC quanto no PVN, e isso é consistente com estudos publicados anteriormente em condrócitos humanos45 (Figura 6C). Neste tipo de análise, em vez de aplicar um filtro de comprimento para excluir pequenos objetos não ciliares da análise, apenas cílios associados à rotulagem Centrin2-GFP são analisados. Isso pode ser vantajoso em situações onde mutações genéticas tornam cílios muito curtos, ou se mudanças em subdomínios de cílios como a zona de transição ou ponta foram implicadas. A identificação da cília utilizando a análise de IA e GA3 é altamente adaptável e pode ser adaptada para atender a uma variedade de questões complexas de pesquisa.
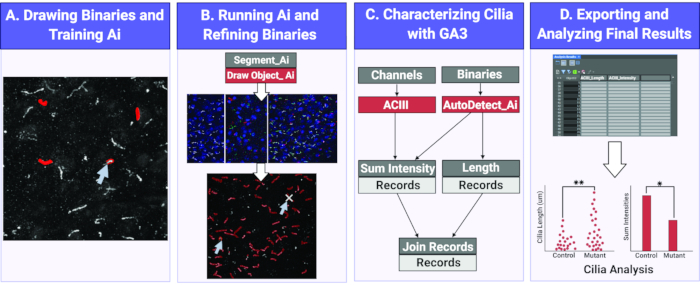
Figura 1. Fluxo de trabalho para medir o comprimento e intensidade da cília usando a IA. (A) Para treinar o IA, binários são desenhados em torno dos objetos de interesse (cílios) nas imagens de treinamento bruto. Usando os binários desenhados, o Segmento Ai é treinado para reconhecer a forma e intensidades de pixels da cília. (B) Em seguida, o segmento ai treinado é aplicado a imagens experimentais brutas. Ele atrai binários em objetos que reconhece como cílios. Esses binários podem ser refinados para garantir que todos e apenas cílios estejam sendo analisados. (C) Um programa GA3 é construído para analisar a intensidade e o comprimento dos objetos reconhecidos pela IA. (D) Os registros são importados em uma tabela no software. Esta tabela pode então ser exportada para análise posterior. Clique aqui para ver uma versão maior desta figura.

Figura 2. Medições in vitro de comprimento de cílios. Imagens representativas de células IMCD (verde, tubulina acetilada) (B)culturas hipotalâmicas primárias (verde, ACIII) e(C)culturas hipocampais (verde, ACIII). Um ia treinado foi usado para reconhecer cílios como mostrado na máscara binária (magenta) e, em seguida, GA3 foi usado para medir o comprimento da cília. A distribuição do comprimento do cílio é grafada como percentual de cílios em 0,5 ou 1,0 mícrons de lixeiras. * indica ponte citocinética devidamente não reconhecida pela IA. n=225 cílios em células IMCD de 3 réplicas, 54 cílias em hipotalâmica e 139 cílias em culturas hipocampais de 3 animais. Barras de escala 10 μm. Clique aqui para ver uma versão maior desta figura.
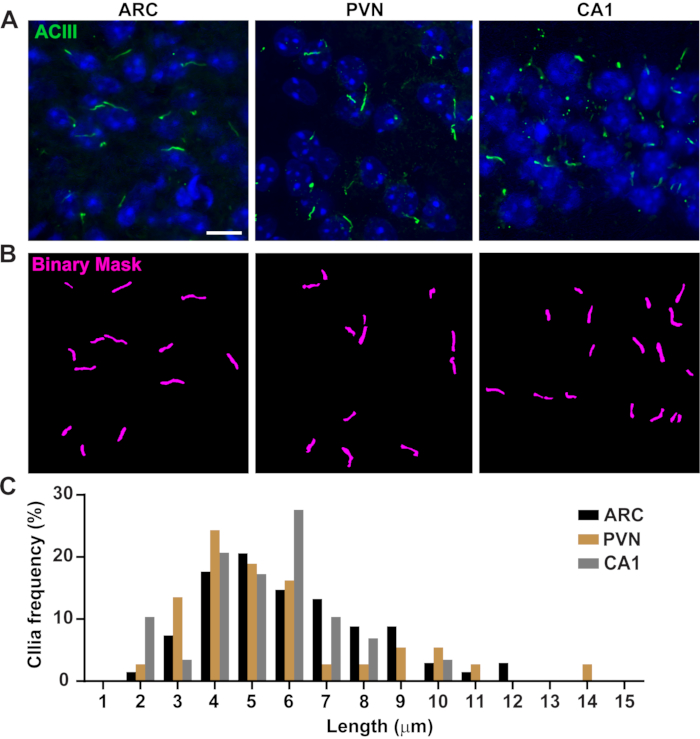
Figura 3. Medições de comprimento in vivo cilia. (A) Imagens representativas de cílios (verde, ACIII) no ARC, PVN e CA1 de seções cerebrais de camundongos adultos. (B) Um Ai treinado em NiS Elements foi usado para reconhecer cílios como mostrado na máscara binária (magenta) e, em seguida, GA3 foi usado para medir o comprimento de cílio. (C) A distribuição do comprimento da cília é grafada como porcentagem de cílios em caixas de um mícnico. n= 68 cílios em ARC, 36 em PVN e 29 em CA1 de 3 animais. Barras de escala 10 μm. Clique aqui para ver uma versão maior desta figura.
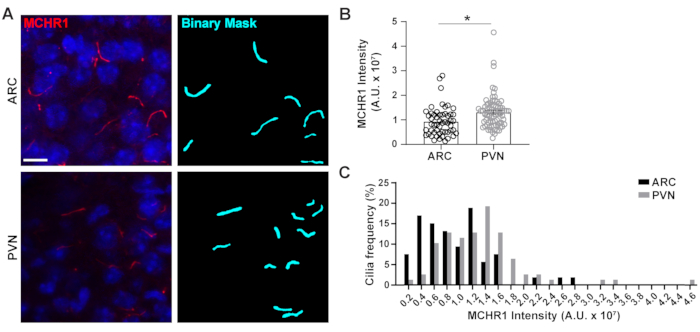
Figura 4. Ai auxiliou as medidas de intensidade de coloração de cílios de cilia neuronal hipotalâmica. (A) Imagens representativas de cílios (MCHR1, vermelho) no ARC e PVN de seções cerebrais de camundongos adultos. Um Ai treinado em NIS Elements foi usado para reconhecer cílios como mostrado na máscara binária (ciano) e, em seguida, GA3 foi usado para medir a intensidade da coloração MCHR1 em cílios. (B) As intensidades do MCHR1 são grafadas como média ± S.E.M. Cada ponto representa um cílio. * p < 0,05, teste t do aluno. (C) A distribuição da intensidade do MCHR1 é grafada como percentual de cílios em lixeiras de 0,2 x 107 Unidades Arbitrárias (A. U.). n= 53 cílios em ARC, 78 em PVN de 3 animais. Barras de escala 10 μm. Clique aqui para ver uma versão maior desta figura.
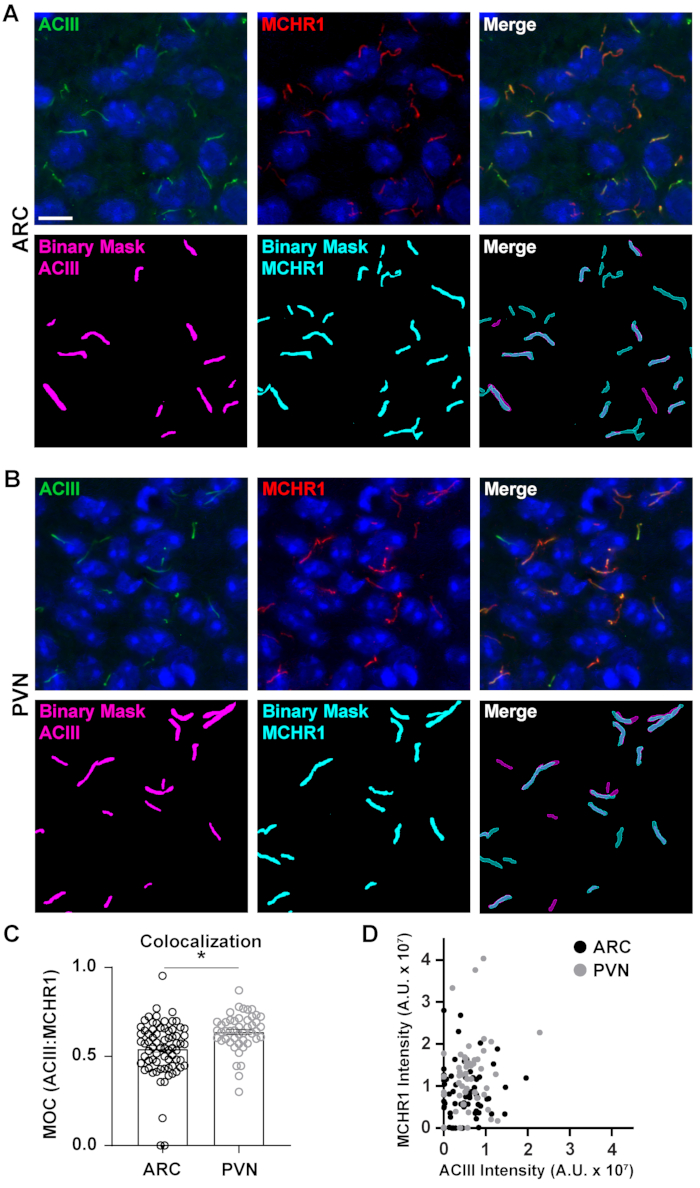
Figura 5. Ai auxiliou na análise de colocalização de cílios. (A, B) Imagens representativas de cílios no ARC e PVN, respectivamente. Cílias são rotuladas com ACIII (verde) e MCHR1 (vermelho). Um Ai treinado em NIS Elements foi usado para reconhecer cílios como mostrado na máscara binária (magenta para ACIII rotulado cilia, ciano para MCHR1 rotulado cílio). O GA3 foi usado para reconhecer cílios que continham tanto a ACIII quanto o MCHR1. (C) Os valores do coeficiente de sobreposição de manders (MOC) são gráficos como ± média S.E.M. Cada ponto representa um cílio. * p < 0,05, teste t do aluno. (D) Dispersar a intensidade de MCHR1 vs. intensidade ACIII em ARC e PVN. Cada ponto representa um cílio. n= 72 cílios em ARC, 47 em PVN de 3 animais. Barras de escala 10 μm. Clique aqui para ver uma versão maior desta figura.
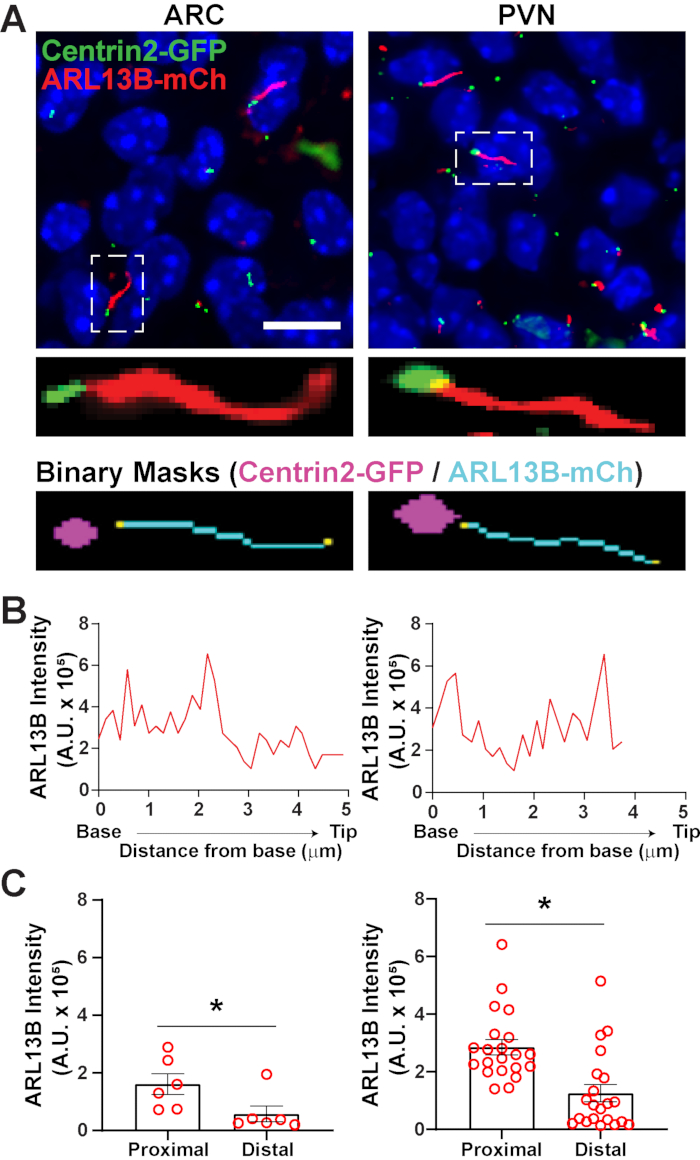
Figura 6. Análise cilia e corpo basal. (A) Imagens representativas de cílios (vermelho, ARL13B-mCherry) e marcador de corpo basal (verde, Centrin2-GFP) no ARC e PVN de ratos P0. Um ia treinado foi usado para reconhecer cílios como mostrado na máscara binária (ciano). A máscara binária para corpo basal (magenta) foi desenhada por limiar na receita GA3. (B) Intensidade de varredura da linha representativa de um cílio. (C) As intensidades de ARL13B nas extremidades proximal e distal da IA identificaram cílios gráficos como ± média S.E.M. As extremidades proximal e distal são definidas como a região dentro do primeiro comprimento de 1 μm e o último comprimento de 1 μm, respectivamente, a partir da base do círio. Cada ponto representa um cílio. * p < 0,05. n = 6 cílios em ARC de 2 animais e 21 cílios em PVN de 3 animais. Barras de escala 10 μm. Clique aqui para ver uma versão maior desta figura.
Figura suplementar 1. Gráficos de perda de treinamento de IA. (A, B) Gráficos mostrando perda de treinamento de segment.ai em cílios neuronais in vitro e in vivo, respectivamente. Clique aqui para baixar este Arquivo.
Figura suplementar 2. Ai Auxiliado Cilia medições de intensidade de intensidade de cormentação in vitro neuronal . (A, B) Imagens representativas de cílios (MCHR1, vermelho) em culturas hipotalâmicas e hipocampais primárias, respectivamente. Um Ai treinado em NIS Elements foi usado para reconhecer cílios como mostrado na máscara binária (ciano) e, em seguida, GA3 foi usado para medir a intensidade da coloração MCHR1 em cílios. A distribuição da intensidade do MCHR1 é grafada como porcentagem de cílios em 1000 caixas de 1000 U. para caixas hipotalâmicas e 2000 a. U. para culturas hipocampais. n= 30 cílios em hipotalâmica e 106 cílias em culturas hipocampais de 3 animais. Barras de escala 10 μm. Clique aqui para baixar este Arquivo.
Figura suplementar 3. Análise Geral 3 receitas para análise de cílios. (A) Receita de Análise Geral Simples (GA3) para medição do comprimento, intensidade e coeficiente de Mander. (B) Receita ga3 complexa para medição de intensidade ao longo do comprimento do cílio utilizando um marcador para o corpo basal. Clique aqui para baixar este Arquivo.
Discussão
Medidas de comprimento e intensidade são formas comuns de análise da cília primária, porém, não há um método convencional padronizado utilizado no campo. A identificação e quantificação de cílios primários usando softwares como ImageJ é demorado e propenso a viés e erro do usuário. Isso dificulta a análise precisa de grandes conjuntos de dados. Aqui mostramos que o uso de um programa de IA pode superar muitos desses desafios tornando a análise de alto rendimento do ília primário alcançável. Aqui descrevemos o procedimento para o treinamento de um aplicativo baseado em IA para reconhecer cílios primários e delinear as etapas necessárias para analisar o comprimento e a intensidade.
Embora o treinamento inicial da IA para reconhecer cilia exija tempo significativo do usuário, uma vez concluído pode ser usado em qualquer conjunto de dados adquirido com os mesmos parâmetros. A máscara binária gerada pela IA é modificável para que quaisquer erros possam ser corrigidos. No entanto, erros na identificação de cílios devem sinalizar ao usuário que o Ai precisa ser mais treinado com imagens adicionais. Uma grande vantagem deste método é que o IA pode ser treinado para reconhecer cílios em diferentes tipos de amostra em 2D e 3D. Métodos de análise anteriores gerados dentro dos laboratórios têm várias limitações, incluindo a necessidade de limiares manuais para identificação e problemas de identificação de imagens de cílios de seções teciduais onde a densidade celular é alta36,46,47. Esses métodos também são especializados para análise de cílios, enquanto a análise utilizando o software NIS Elements pode avaliar vários aspectos das imagens simultaneamente. Como o Ai descrito aqui faz parte do pacote de software NIS Elements, as imagens adquiridas usando um microscópio Nikon podem ser facilmente continuadas até a análise. No entanto, não é necessário fazer imagens com Nikon para o uso deste método. Independentemente do formato de arquivo de dados brutos capturado, os arquivos ".tif" podem ser abertos pela NIS Elements para usar na IA.
Este aplicativo de IA dentro do NIS Elements está amplamente disponível e possivelmente já faz parte do software de análise de imagem em uso por laboratórios que estudam cílios primários. Com a prevalência da expansão da tecnologia de IA, outros softwares de imagem podem expandir suas opções de análise para incluir um módulo de IA semelhante. A aplicação da análise de IA à identificação de cílios pode ser utilizada para vários aspectos diferentes da análise de cílios. Embora tenhamos delineado métodos para algumas análises simples, como comprimento (Figura 2 e 3),intensidade(Figura 4) e colocalização(Figura 5)análises mais sofisticadas podem ser adicionadas ao fluxo de trabalho de análise GA3 como na Figura 6. Por exemplo, em vez de medir a intensidade de um cílio completo, as diferenças de intensidade dentro de uma sub-região de um círio podem ser de interesse para avaliar a localização sub-ciliar. Diferenças de intensidade dentro de uma sub-região de um círio podem indicar que a proteína está se acumulando na ponta ou na base do círio, como como as proteínas Gli são enriquecidas na ponta da cília48. Além disso, esta aplicação de IA pode ser usada para identificar facilmente diferenças entre genótipos ou grupos de tratamento. Embora nosso laboratório use principalmente este método para analisar imagens de cílios de seções cerebrais ou culturas neuronais, ele pode ser aplicado a imagens adquiridas de várias linhas celulares ou outros tipos de tecidos. A flexibilidade do tipo de amostra em que esta aplicação pode ser usada torna este método de análise valioso para muitos grupos diferentes que estudam cílios primários ou qualquer organela discreta que está sendo avaliada, como mitocôndrias, núcleo ou ER.
Divulgações
O coautor Wesley Lewis é um empregado da Nikon. Não há divulgações financeiras.
Agradecimentos
Este trabalho foi financiado pelo National Institute of Diabetes and Digestive and Kidney Diseases R01 DK114008 para a NFB e o American Heart Association Fellowship Grant #18PRE34020122 à RB. Agradecemos a Rich Gruskin Gerente Geral da Nikon Software, Melissa Bentley, Courtney Haycraft e Teresa Mastracci por comentários perspicazes sobre o manuscrito.
Materiais
| Name | Company | Catalog Number | Comments |
| Intel Xeon, 3.6 GHz, 32GB RAM | Intel Corporation | W-2123 | Processor used for running NIS Elements. |
| Nikon Elements Software | Nikon Instruments Inc. | - | Ai and GA3 software |
| Quadro RTX 4000 Graphics card | NVIDIA Corporation | Quadro RTX 4000 | |
| Windows 10 Professional 64-bit | Microsoft Inc. | - | Operating system used for running NIS Elements |
| Workstation | HP Development Company, L.P. | HP Z4G4 | Workstation used for running NIS Elements |
Referências
- Wang, L., et al. Ciliary gene RPGRIP1L is required for hypothalamic arcuate neuron development. JCI Insight. 4 (3), (2019).
- Siljee, J. E., et al. Subcellular localization of MC4R with ADCY3 at neuronal primary cilia underlies a common pathway for genetic predisposition to obesity. Nature Genetics. 50 (2), 180-185 (2018).
- Davenport, J. R., et al. Disruption of intraflagellar transport in adult mice leads to obesity and slow-onset cystic kidney disease. Current Biology. 17 (18), 1586-1594 (2007).
- Berbari, N. F., O'Connor, A. K., Haycraft, C. J., Yoder, B. K. The primary cilium as a complex signaling center. Current Biology. 19 (13), 526-535 (2009).
- Walz, G. Role of primary cilia in non-dividing and post-mitotic cells. Cell Tissue Research. 369 (1), 11-25 (2017).
- Nachury, M. V., Mick, D. U. Establishing and regulating the composition of cilia for signal transduction. Nature Reviews. Molecular Cell Biology. 20 (7), 389-405 (2019).
- Goetz, S. C., Anderson, K. V. The primary cilium: a signalling centre during vertebrate development. Nature Reviews Genetics. 11 (5), 331-344 (2010).
- Engle, S. E., Bansal, R., Antonellis, P. J., Berbari, N. F. Cilia signaling and obesity. Seminars in Cell and Developmental Biology. , (2020).
- Reiter, J. F., Leroux, M. R. Genes and molecular pathways underpinning ciliopathies. Nature reviews. Molecular Cell Biology. 18 (9), 533-547 (2017).
- Waters, A. M., Beales, P. L. Ciliopathies: an expanding disease spectrum. Pediatric Nephrology. 26 (7), Berlin, Germany. 1039-1056 (2011).
- Hildebrandt, F., Benzing, T., Katsanis, N. Ciliopathies. New England Journal of Medicine. 364 (16), 1533-1543 (2011).
- Vaisse, C., Reiter, J. F., Berbari, N. F. Cilia and Obesity. Cold Spring Harbor Perspectives in Biology. 9 (7), (2017).
- Berbari, N. F., et al. Leptin resistance is a secondary consequence of the obesity in ciliopathy mutant mice. Proceedings of the National Academy of Sciences of the United States of America. 110 (19), 7796-7801 (2013).
- Jacobs, D. T., et al. Dysfunction of intraflagellar transport-A causes hyperphagia-induced obesity and metabolic syndrome. Disease Models & Mechanisms. 9 (7), 789-798 (2016).
- Arsov, T., et al. Fat aussie--a new Alström syndrome mouse showing a critical role for ALMS1 in obesity, diabetes, and spermatogenesis. Molecular Endocrinology. 20 (7), 1610-1622 (2006).
- Tam, L. W., Ranum, P. T., Lefebvre, P. A. CDKL5 regulates flagellar length and localizes to the base of the flagella in Chlamydomonas. Molecular Biology of the Cell. 24 (5), 588-600 (2013).
- Rajagopalan, V., Subramanian, A., Wilkes, D. E., Pennock, D. G., Asai, D. J. Dynein-2 affects the regulation of ciliary length but is not required for ciliogenesis in Tetrahymena thermophila. Molecular Biology of the Cell. 20 (2), 708-720 (2009).
- Bengs, F., Scholz, A., Kuhn, D., Wiese, M. LmxMPK9, a mitogen-activated protein kinase homologue affects flagellar length in Leishmania mexicana. Molecular Microbiology. 55 (5), 1606-1615 (2005).
- Han, Y. M., et al. Leptin-promoted cilia assembly is critical for normal energy balance. Journal of Clinical Investigation. 124 (5), 2193-2197 (2014).
- Caspary, T., Marazziti, D., Berbari, N. F. Cilia: Methods and Protocols. Satir, P., Tvorup Christensen, S. , Springer. New York. 203-214 (2016).
- Bishop, G. A., Berbari, N. F., Lewis, J., Mykytyn, K. Type III adenylyl cyclase localizes to primary cilia throughout the adult mouse brain. Journal of Comparative Neurology. 505 (5), 562-571 (2007).
- Domire, J. S., Mykytyn, K. Markers for neuronal cilia. Methods in Cell Biology. 91, 111-121 (2009).
- Sun, J. S., et al. Ventromedial hypothalamic primary cilia control energy and skeletal homeostasis. Journal of Clinical Investigation. 131 (1), (2021).
- Berbari, N. F., Johnson, A. D., Lewis, J. S., Askwith, C. C., Mykytyn, K. Identification of ciliary localization sequences within the third intracellular loop of G protein-coupled receptors. Molecular Biology of the Cell. 19 (4), 1540-1547 (2008).
- Brailov, I., et al. Localization of 5-HT(6) receptors at the plasma membrane of neuronal cilia in the rat brain. Brain Research. 872 (1-2), 271-275 (2000).
- Domire, J. S., et al. Dopamine receptor 1 localizes to neuronal cilia in a dynamic process that requires the Bardet-Biedl syndrome proteins. Cellular and Molecular Life Sciences. 68 (17), 2951-2960 (2011).
- Handel, M., et al. Selective targeting of somatostatin receptor 3 to neuronal cilia. Neuroscience. 89 (3), 909-926 (1999).
- Koemeter-Cox, A. I., et al. Primary cilia enhance kisspeptin receptor signaling on gonadotropin-releasing hormone neurons. Proceedings of the National Academy of Sciences of the United States of America. 111 (28), 10335-10340 (2014).
- Mukhopadhyay, S., et al. The ciliary G-protein-coupled receptor Gpr161 negatively regulates the Sonic hedgehog pathway via cAMP signaling. Cell. 152 (1-2), 210-223 (2013).
- Berman, S. A., Wilson, N. F., Haas, N. A., Lefebvre, P. A. A novel MAP kinase regulates flagellar length in Chlamydomonas. Current Biology. 13 (13), 1145-1149 (2003).
- Nguyen, R. L., Tam, L. W., Lefebvre, P. A. The LF1 gene of Chlamydomonas reinhardtii encodes a novel protein required for flagellar length control. Genetics. 169 (3), 1415-1424 (2005).
- Tam, L. W., Wilson, N. F., Lefebvre, P. A. A CDK-related kinase regulates the length and assembly of flagella in Chlamydomonas. Journal of Cell Biology. 176 (6), 819-829 (2007).
- O'Connor, A. K., et al. An inducible CiliaGFP mouse model for in vivo visualization and analysis of cilia in live tissue. Cilia. 2 (1), 8(2013).
- Bangs, F. K., Schrode, N., Hadjantonakis, A. K., Anderson, K. V. Lineage specificity of primary cilia in the mouse embryo. Nature Cell Biology. 17 (2), 113-122 (2015).
- Delling, M., et al. Primary cilia are not calcium-responsive mechanosensors. Nature. 531 (7596), 656-660 (2016).
- Saggese, T., Young, A. A., Huang, C., Braeckmans, K., McGlashan, S. R. Development of a method for the measurement of primary cilia length in 3D. Cilia. 1 (1), 11(2012).
- Kobayashi, Y., Hamamoto, A., Saito, Y. Analysis of ciliary status via G-protein-coupled receptors localized on primary cilia. Microscopy. 69 (5), 277-285 (2020).
- Zhou, L. Q., et al. Artificial intelligence in medical imaging of the liver. World Journal of Gastroenterology. 25 (6), 672-682 (2019).
- Naugler, C., Church, D. L. Automation and artificial intelligence in the clinical laboratory. Critical Reviews in Clinical Laboratory Sciences. 56 (2), 98-110 (2019).
- Dunn, K. W., Kamocka, M. M., McDonald, J. H. A practical guide to evaluating colocalization in biological microscopy. American Journal of Physiology-Cell Physiology. 300 (4), 723-742 (2011).
- Bansal, R., et al. Hedgehog Pathway Activation Alters Ciliary Signaling in Primary Hypothalamic Cultures. Frontiers in Cellular Neuroscience. 13, 266(2019).
- Jin, H., et al. The conserved Bardet-Biedl syndrome proteins assemble a coat that traffics membrane proteins to cilia. Cell. 141 (7), 1208-1219 (2010).
- Liew, G. M., et al. The intraflagellar transport protein IFT27 promotes BBSome exit from cilia through the GTPase ARL6/BBS3. Developmental Cell. 31 (3), 265-278 (2014).
- Engle, S. E., et al. A CreER Mouse to Study Melanin Concentrating Hormone Signaling in the Developing Brain. Genesis. , (2018).
- Thorpe, S. D., et al. Reduced primary cilia length and altered Arl13b expression are associated with deregulated chondrocyte Hedgehog signaling in alkaptonuria. Journal of Cellular Physiology. 232 (9), 2407-2417 (2017).
- Lauring, M. C., et al. New software for automated cilia detection in cells (ACDC). Cilia. 8, 1(2019).
- Dummer, A., Poelma, C., DeRuiter, M. C., Goumans, M. J., Hierck, B. P. Measuring the primary cilium length: improved method for unbiased high-throughput analysis. Cilia. 5, 7(2016).
- Haycraft, C. J., et al. Gli2 and Gli3 localize to cilia and require the intraflagellar transport protein polaris for processing and function. PLoS Genetics. 1 (4), 53(2005).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados