Method Article
Enfoques de inteligencia artificial para evaluar los cilios primarios
En este artículo
Resumen
El uso de la inteligencia artificial (IA) para analizar imágenes está emergiendo como un enfoque poderoso, menos sesgado y rápido en comparación con los métodos comúnmente utilizados. Aquí entrenamos a Ai para reconocer un orgánulo celular, cilios primarios y analizar propiedades como la longitud y la intensidad de la tinción de una manera rigurosa y reproducible.
Resumen
Los cilios son apéndices celulares basados en microtúbulos que funcionan como centros de señalización para una diversidad de vías de señalización en muchos tipos de células de mamíferos. La longitud de los cilios está altamente conservada, estrechamente regulada y varía entre los diferentes tipos de células y tejidos, y se ha implicado en el impacto directo de su capacidad de señalización. Por ejemplo, se ha demostrado que los cilios alteran sus longitudes en respuesta a la activación de los receptores acoplados a la proteína G ciliar. Sin embargo, medir de manera precisa y reproducible las longitudes de numerosos cilios es un procedimiento lento y laborioso. Los enfoques actuales también son propensos a errores y sesgos. Los programas de inteligencia artificial (IA) se pueden utilizar para superar muchos de estos desafíos debido a las capacidades que permiten la asimilación, manipulación y optimización de conjuntos de datos extensos. Aquí, demostramos que un módulo de Ia puede ser entrenado para reconocer cilios en imágenes de muestras in vivo e in vitro. Después de usar la Ia entrenada para identificar cilios, podemos diseñar y utilizar rápidamente aplicaciones que analizan cientos de cilios en una sola muestra para determinar la longitud, la intensidad de la fluorescencia y la colocalización. Este enfoque imparcial aumentó nuestra confianza y rigor al comparar muestras de diferentes preparaciones neuronales primarias in vitro, así como en diferentes regiones del cerebro dentro de un animal y entre animales. Además, esta técnica se puede utilizar para analizar de manera confiable la dinámica de los cilios de cualquier tipo de célula y tejido de una manera de alto rendimiento en múltiples muestras y grupos de tratamiento. En última instancia, los enfoques basados en ia probablemente se convertirán en estándar a medida que la mayoría de los campos se muevan hacia enfoques menos sesgados y más reproducibles para la adquisición y el análisis de imágenes.
Introducción
Los cilios primarios son orgánulos sensoriales que sobresalen de la mayoría de los tipos de células de mamíferos1,2,3,4. Generalmente son apéndices solitarios críticos para coordinar diversas vías de señalización celular mediante la integración de señales extracelulares5,6,7. Los cilios primarios juegan un papel importante durante el desarrollo embrionario y la homeostasis del tejido adulto, y la interrupción de su función o morfología se asocia con varios trastornos genéticos, que se denominan colectivamente ciliopatías. Debido a la naturaleza casi ubicua de los cilios, las ciliopatías se asocian con una amplia gama de características clínicas que pueden afectar a todos los sistemas de órganos8,9,10,11,12. En modelos animales de ciliopatías, la pérdida de la estructura ciliar o la capacidad de señalización se manifiesta en varios fenotipos clínicamente relevantes, incluida la obesidad asociada a la hiperfagia3,13,14,15. En muchos sistemas modelo, se ha demostrado que los cambios en la longitud de los cilios afectan su capacidad de señalización y funciones16,17,18,19. Sin embargo, hay varios desafíos técnicos y que consumen mucho tiempo asociados con la evaluación precisa y reproducible de la longitud y la composición de los cilios.
El sistema nervioso central (SNC) de los mamíferos adultos es un contexto biológico que ha planteado un desafío para comprender la morfología y la función de los cilios. Si bien parece que las neuronas y las células de todo el SNC poseen cilios, debido a las herramientas y habilidades limitadas para observar y analizar estos cilios, la comprensión de sus funciones sigue siendo difícil de alcanzar20. Por ejemplo, el marcador prototípico de cilios, acetilado α-tubulina, no etiqueta los cilios neuronales20. La dificultad de estudiar estos cilios se resolvió en parte con el descubrimiento de varios receptores acoplados a proteínas G (GPCR), maquinaria de señalización y proteínas asociadas a la membrana que se enriquecen en la membrana de los cilios neuronales21,22. Todas estas observaciones básicas directas insinúan la importancia y la diversidad de los cilios del SNC, que hasta ahora parecen incomparables con otros tejidos. Por ejemplo, la variación en la longitud de los cilios y la localización de GPCR se pueden observar en todo el cerebro, con longitudes en ciertos núcleos neuronales que son diferentes en comparación con otros núcleos19,23. Del mismo modo, su contenido GPCR y la maquinaria de señalización complementaria muestran diversidad basada en la localización neuroanatómica y neuronal tipo2,24,25,26,27,28,29. Estas simples observaciones demuestran que la longitud y la composición de los cilios del SNC de los mamíferos están estrechamente reguladas, al igual que en los organismos modelo, como Chlamydomonas reinhardtii,pero el impacto de estas diferencias de longitud en la función de los cilios, la señalización y, en última instancia, el comportamiento sigue sin estar claro16,30,31,32.
Medir con precisión la longitud y la composición de los cilios demuestra ser un desafío técnico propenso al error del usuario y la irreproducibilidad. Actualmente, los cilios in vivo e in vitro se identifican con mayor frecuencia utilizando enfoques inmunofluorescentes que etiquetan proteínas ciliares o alelos reporteros fluorescentes enriquecidos con cilios33,34,35. Las longitudes de estos cilios marcados fluorescentemente se miden a partir de una imagen en 2 dimensiones (2D) utilizando herramientas de medición de línea en programas de análisis de imágenes como ImageJ36. Este proceso no solo es tedioso y laborioso, sino que también es propenso a sesgos y errores. Estos mismos obstáculos surgen al medir las intensidades de los cilios, que ayudan a indicar cambios en la estructura delos cilios 37. Para minimizar las inconsistencias en este tipo de análisis de imágenes, los programas de inteligencia artificial (IA) son cada vez más frecuentes y las opciones asequibles38.
Ai es el avance de los sistemas informáticos que utilizan la ventaja de los algoritmos informáticos y la programación para ejecutar tareas que normalmente requerirían inteligencia humana39. A los dispositivos ai se les enseña a percibir patrones, parámetros y características recurrentes y a tomar medidas para maximizar las probabilidades de crear resultados exitosos. Ai es versátil y puede ser entrenado para reconocer objetos específicos o estructuras de interés, como cilios, y luego ser programado para ejecutar una variedad de análisis en los objetos identificados. Por lo tanto, los datos de imagen complejos pueden ser generados rápida y reproduciblemente por Ai38. La automatización y el análisis de IA de las imágenes capturadas aumentarán la eficacia y la eficiencia al tiempo que limitarán cualquier posible error y sesgo humano39. El establecimiento de una metodología basada en ia para la identificación de cilios crea una forma consistente para que todos los grupos de investigación analicen e interpreten los datos de los cilios.
Aquí utilizamos un módulo de Ia para identificar cilios tanto in vivo como in vitro en imágenes 2D. Usando un conjunto de imágenes de muestra, la Ai está entrenada para identificar cilios. Una vez que se completa el entrenamiento, la Ai designada se utiliza para aplicar una máscara binaria sobre los cilios identificados con Ai en una imagen. Los binarios aplicados por la Ai son modificables, si es necesario, para garantizar que todos los cilios en las imágenes estén correctamente identificados y se elimine la identificación no específica. Después de utilizar la Ia para identificar los cilios, se utilizan programas de análisis general (GA) personalizados para realizar diferentes análisis, como la medición de la longitud de los cilios y la intensidad de la fluorescencia. Los datos recopilados se exportan a una tabla que se puede leer, interpretar y utilizar fácilmente para análisis estadísticos(Figura 1). El uso de tecnología automatizada y Ai para identificar cilios y obtener mediciones específicas entre grupos experimentales ayudará en futuros estudios destinados a comprender el impacto de la función y la morfología de los cilios del SNC en la comunicación y el comportamiento célula-célula.
Protocolo
1. Adquirir imágenes en bruto
- Fijar e inmunoetiquetar muestras según sea necesario20.
- Cilios de imagen utilizando un microscopio confocal a máxima profundidad de bits utilizando el mismo tamaño de píxel con resolución Nyquist.
- Exporte imágenes como archivos monocromáticos de formato de imagen etiquetado (.tif).
NOTA: Este protocolo describe cómo utilizar el módulo Ai específicamente dentro del software NIS Elements. Si las imágenes se adquirieron como archivos .nd2, no es necesario exportar imágenes como archivos .tif y el usuario puede continuar directamente con el paso 2.3. Si las imágenes se adquirieron en un sistema diferente, se puede comprar una licencia de NIS Elements por separado y .tif archivos se pueden convertir como se describe en los siguientes pasos.
2. Entrena a Ai para identificar cilios
- Abra el conjunto de datos de entrenamiento.
- Seleccione aproximadamente 50 imágenes de muestra con al menos un cilio por fotograma para entrenar el software y copiarlas en una sola carpeta. Esta carpeta se utiliza para dirigir el software al abrir las imágenes. Abra estos 50 fotogramas dentro de un único documento ND2 con al menos un cilio por fotograma. Seleccione Archivo > Importar/Exportar > Crear archivo ND a partir de secuencia de archivos.
- Seleccione la carpeta que contiene el conjunto de datos de entrenamiento. Esto abrirá la lista de archivos en el centro de la ventana de diálogo. Defina manualmente la organización de los archivos utilizando al menos una opción en el menú desplegable anterior. Las opciones son multipunto (para múltiples archivos de proyección máxima), serie Z (para una imagen de pila z), tiempo (para una imagen de lapso de tiempo) y longitud de onda (para archivos de múltiples canales).
- Introduzca los valores numéricos correspondientes debajo de cada opción seleccionada. Seleccione Ninguno siempre que las opciones no estén seleccionadas. Haga clic en Convertir para abrir el documento ND.
- Calibrar imágenes.
- Introduzca el tamaño de píxel en la esquina inferior izquierda de la imagen: haga clic con el botón derecho en Sin calibrar > Calibrar documento > tamaño de píxel.
- Identificar los cilios.
- Identifique a mano los cilios trazando con precisión las estructuras ciliares individuales en todos los fotogramas abiertos utilizando AutoDetect o Draw Object en la barra de herramientas binaria. Esto dibujará máscaras binarias en los objetos de interés. Estos binarios servirán como objetos de muestra para entrenar el software para identificar cilios en características basadas en píxeles en futuros análisis experimentales de imágenes. Seleccione Ver controles de análisis > > barra de herramientas binaria > Objeto de dibujo.
NOTA: Elimine cualquier fotograma que no tenga binarios, ya que el software no comenzará a entrenar a menos que sea capaz de detectar binarios en todos los fotogramas abiertos.
- Identifique a mano los cilios trazando con precisión las estructuras ciliares individuales en todos los fotogramas abiertos utilizando AutoDetect o Draw Object en la barra de herramientas binaria. Esto dibujará máscaras binarias en los objetos de interés. Estos binarios servirán como objetos de muestra para entrenar el software para identificar cilios en características basadas en píxeles en futuros análisis experimentales de imágenes. Seleccione Ver controles de análisis > > barra de herramientas binaria > Objeto de dibujo.
- Entrena Ai.
- Comience a entrenar el software. Esto abrirá la caja de Segment.ai del tren. Seleccione NIS.ai > Segment.ai de tren.
- En el cuadro Segment.ai tren, seleccione el canal de origen que se utilizará para el entrenamiento. Si los archivos de varios canales están abiertos, seleccione solo un canal como canal de origen. Luego seleccione los binarios de verdad de tierra apropiados en los que entrenar al Ai. Finalmente seleccione el número de iteraciones necesarias para entrenar la Ai dependiendo del tamaño y la distribución de los binarios.
NOTA: Si los binarios son fácilmente detectables desde el entorno y están bien distribuidos por toda la imagen, el software puede necesitar menos de 1000 iteraciones para capacitarse para identificar las imágenes. Si las imágenes tienen una baja relación señal-ruido, es ideal ejecutar al menos 1000 iteraciones mientras se entrena para permitir que la Ia identifique los cilios en las muestras de prueba con alta confianza. - Seleccione la carpeta de destino para guardar el archivo Ai entrenado (.sai) y haga clic en Entrenar para entrenar el software. El software ahora procederá a entrenarse para identificar cilios basados en los binarios rastreados. Este proceso dura varias horas.
NOTA: Al entrenar, el software mostrará un gráfico que muestra la pérdida de entrenamiento. El gráfico mostrará inicialmente un pico antes de disminuir a una pérdida ideal de alrededor del 1% donde se estanca para el resto del entrenamiento. Guarde el gráfico para futuras referencias marcando la casilla Guardar captura de pantalla del gráfico en la casilla Segment.ai tren ( Figura suplementaria1). - Si se requiere un mayor refinamiento de la capacitación, continúe la capacitación en el mismo conjunto de datos. Alternativamente, entrene en un nuevo conjunto de datos con exactamente los mismos parámetros. No es recomendable entrenar a una Ia ya entrenada en un nuevo conjunto de datos con diferentes parámetros u diferentes objetos de interés. Seleccione Entrenar segment.ai > Continuar la capacitación en > Seleccione Archivo AI entrenado.
3. Identifica los cilios usando Ai entrenado
- Abra el conjunto de datos experimental.
- Abra las imágenes confocales experimentales de cilios en el software convirtiendo los archivos de .tif de ejemplo en archivos .nd2, similar al paso 2.1. Seleccione Archivo > Importar/Exportar > Crear archivo ND a partir de secuencia de archivos.
NOTA: Las imágenes deben ser del mismo tamaño de píxel que las utilizadas para entrenar la Ia. Si las imágenes ya están en formato ND2, vaya al paso 3.3.
- Abra las imágenes confocales experimentales de cilios en el software convirtiendo los archivos de .tif de ejemplo en archivos .nd2, similar al paso 2.1. Seleccione Archivo > Importar/Exportar > Crear archivo ND a partir de secuencia de archivos.
- Calibrar imágenes.
- Introduzca el tamaño de píxel en la esquina inferior izquierda de la imagen. Haga clic con el botón secundario en > Calibrar documento > tamaño de píxel.
- Ejecute la Ai entrenada en los archivos abiertos.
- Comience a identificar los cilios usando Ai. El software ahora dibujará binarios en los cilios en función de la capacitación que recibió en el paso anterior. Este proceso tardará unos segundos. Seleccione NIS.ai > Segment.ai.
NOTA: El software le pedirá que seleccione el canal si hay varios canales abiertos. Los canales se enumeran por sus respectivos nombres aquí. De lo contrario, la casilla marcada 'Mono' se seleccionará automáticamente.
- Comience a identificar los cilios usando Ai. El software ahora dibujará binarios en los cilios en función de la capacitación que recibió en el paso anterior. Este proceso tardará unos segundos. Seleccione NIS.ai > Segment.ai.
- Compruebe si hay imágenes en busca de binarios mal identificados.
- Una vez que el Ai haya identificado cilios y dibujado binarios, verifique las imágenes en busca de objetos identificados erróneamente. Si lo desea, elimine manualmente los archivos binarios mal identificados. Seleccione Ver controles de análisis > > barra de herramientas binaria > Eliminar objeto.
4. Medición de la longitud e intensidad de los cilios
- Cree una nueva receta de Análisis General 3 (GA3).
- Ahora que los cilios han sido identificados y segmentados, proceda a analizar diferentes parámetros de los cilios como longitudes e intensidades utilizando la herramienta GA3. Esto abrirá una nueva ventana con un espacio en blanco en el centro donde se definirá el análisis. Seleccione Imagen > nueva receta ga3.
- Seleccione los binarios que desea analizar.
- Dado que los cilios ya están segmentados utilizando Segment.ai, GA3 detectará automáticamente los binarios debidamente etiquetados de acuerdo con la Ia e incluirá el nodo. Seleccione'Binarios > Detect_AI automático' o 'Binarios > dibujar Object_AI'.
- Seleccione los canales necesarios para el análisis. GA3 también detectará automáticamente los canales en las imágenes y mostrará sus pestañas en Canales.
- Retire los objetos que tocan el borde del marco.
- Dado que la Ai segmentará todos los objetos similares a cilios en el marco, también detectará cilios incompletos a lo largo de los bordes del marco. Estos objetos se pueden quitar manualmente en el paso 3.4 o se pueden eliminar automáticamente en GA3. Seleccione Procesamiento binario > Quitar objetos > Bordes que tocan.
- Seleccione los parámetros para medir los cilios.
- Arrastre y suelte los parámetros para medir, como la longitud de los cilios(Longitud)y las intensidades(Suma de la intensidad del objeto). Conecte los nodos al nodo binario apropiado (conexión A) y a los nodos de canal (conexión B). Coloque el cursor sobre la conexión de nodo para obtener información sobre herramientas y mostrar a qué conexión pertenece el nodo. Seleccione Medición > tamaño del objeto > Longitud y medición > Intensidad del objeto > Suma intensidad Obj.
NOTA: La longitud del nodo se conecta solo al nodo binario, mientras que la intensidad de suma Obj se conecta a los nodos binario y de canal.
- Arrastre y suelte los parámetros para medir, como la longitud de los cilios(Longitud)y las intensidades(Suma de la intensidad del objeto). Conecte los nodos al nodo binario apropiado (conexión A) y a los nodos de canal (conexión B). Coloque el cursor sobre la conexión de nodo para obtener información sobre herramientas y mostrar a qué conexión pertenece el nodo. Seleccione Medición > tamaño del objeto > Longitud y medición > Intensidad del objeto > Suma intensidad Obj.
- Anexe las medidas en una sola tabla.
- Combine todas las mediciones en una sola tabla de salida arrastrando y soltando el nodo Append Column al diagrama de flujo de análisis y conéctelo a los nodos de medición, Longitud y Suma Intensidad Obj. Seleccione Administración de datos > columna Anexar > básico.
- Medir los cilios.
- Mide los cilios haciendo clic en Ejecutar. Este proceso toma unos momentos para medir todos los cilios en las imágenes experimentales. Las longitudes e intensidades aparecerán en una nueva ventana resultados del análisis.
NOTA: La tabla a veces puede incluir datos de máscaras que Ai reconoció como cilios, pero que eran demasiado pequeñas para ser detectadas por el ojo humano y eliminadas en el paso 3.4. Estos objetos se pueden eliminar del conjunto de datos mediante un filtro antes del análisis estadístico. Aquí, se utilizó un filtro de 1 μm para las mediciones in vitro de la longitud de los cilios en la Figura 2 y 2 μm para los cilios in vivo. Esto se puede hacer antes de exportar datos utilizando la ruta a continuación. Seleccione la ventana Resultados del análisis > Definir filtro > Introducir valor > Usar filtro.
- Mide los cilios haciendo clic en Ejecutar. Este proceso toma unos momentos para medir todos los cilios en las imágenes experimentales. Las longitudes e intensidades aparecerán en una nueva ventana resultados del análisis.
- Exportar datos para análisis estadístico.
5. Estudios de colocalización
NOTA: El análisis de colocalización se puede incluir en la misma receta GA3 utilizada para las mediciones de la longitud de los cilios y el análisis de intensidad. Si utiliza la misma receta, abra los archivos como se describe a continuación y mida las longitudes e intensidades de ambos canales junto con los coeficientes de colocalización en la misma tubería de análisis.
- Abra el conjunto de datos experimental.
- Abra las imágenes confocales experimentales de cilios en el software convirtiendo los archivos .tif de muestra en archivos .nd2. Seleccione Archivo > Importar/Exportar > Crear archivo ND a partir de secuencia de archivos.
- En la ventana emergente, seleccione los archivos monocromáticos de profundidad de 16 bits de todos los canales de interés en el explorador de ventanas ubicado en la primera columna de la ventana emergente. Seleccione Multipunto o Serie Z en el primer menú desplegable e introduzca un valor correspondiente al número total de imágenes o pilas, respectivamente.
- En el segundo cuadro desplegable, seleccione Longitud de onda y cambie el valor al número total de canales de la carpeta. El software desbloqueará automáticamente una ventana de selección de longitud de onda ubicada en el extremo inferior derecho de la ventana emergente. Utilice el menú desplegable Color para seleccionar el color de cada canal. Proporcione a cada canal un nombre diferente en la columna Nombre. Una vez que se haya actualizado toda la información, haga clic en Convertir. El software generará automáticamente un archivo de todas las imágenes superpuestas con todas las imágenes individuales de todos los canales seleccionados.
- Calibrar imágenes.
- Introduzca el tamaño de píxel en la esquina inferior izquierda de la imagen. Haga clic con el botón secundario en > Calibrar documento > tamaño de píxel.
- Ejecute la Ia entrenada en el primer canal.
- Comience a identificar los cilios en uno de los canales abiertos (por ejemplo, ACIII; Figura 5A) usando Ai. El software ahora dibujará binarios en cilios etiquetados ACIII en función de la capacitación que recibió para este canal. Este proceso tardará unos segundos. Seleccione NIS.ai > Segment.ai > canales de origen > ACIII.
- Ejecute la Ia entrenada en el segundo canal.
- Comience a identificar los cilios en el otro canal abierto (por ejemplo, MCHR1; Figura 5B) usando Ai. El software ahora dibujará binarios en cilios etiquetados MCHR1 en función de la capacitación que recibió para este canal. Este proceso tomará unos momentos. Seleccione NIS.ai > Segment.ai > canales de origen > MCHR1.
- Compruebe si hay imágenes en busca de binarios mal identificados.
- Una vez que el Ai haya identificado cilios y dibujado binarios, verifique las imágenes en busca de objetos mal identificados. Elimine manualmente los archivos binarios mal identificados si es necesario. Seleccione Ver controles de análisis > > barra de herramientas binaria > Eliminar objeto.
- Crea una nueva receta de GA3.
- Ahora que los cilios han sido identificados y segmentados, proceda al análisis de colocalización utilizando la herramienta GA3. Esto abrirá una nueva ventana con un espacio en blanco en el centro donde se definirá el análisis. Se generará una ventana con todos los binarios y canales identificados. Verifique que todos los canales y binarios deseados necesarios para el análisis estén presentes y seleccionados. Seleccione Imagen > nueva receta GA3.
- Retire los objetos que tocan el borde del marco.
- Dado que la Ai segmentará todos los objetos similares a cilios en el marco, también detectará cilios incompletos a lo largo de los bordes del marco. Estos objetos se pueden quitar manualmente en el paso 5.5 o se pueden eliminar automáticamente en GA3. Seleccione Procesamiento binario > Quitar objetos > Bordes que se tocan.
- Configure la vía de colocalización en GA3.
- Para medir la superposición de los dos canales dentro de los cilios, use la correlación de coeficientes de Mander. Arrastre y suelte el nodo Coeficiente de Manders en el espacio en blanco de la receta GA3 y conéctelo al binario y los canales apropiados. Aquí, la 'conexión A' se conecta con el binario ACIII, la 'conexión B' con el canal MCHR1 y la 'conexión C' con el canal ACIII para determinar la superposición de MCHR1 dentro del binario ACIII. Seleccione Medición > relación de objetos > Coeficiente de Manders.
NOTA: El software permite medir la colocalización utilizando pearson Coefficient Correlation utilizando los mismos pasos que se describen en este protocolo40.
- Para medir la superposición de los dos canales dentro de los cilios, use la correlación de coeficientes de Mander. Arrastre y suelte el nodo Coeficiente de Manders en el espacio en blanco de la receta GA3 y conéctelo al binario y los canales apropiados. Aquí, la 'conexión A' se conecta con el binario ACIII, la 'conexión B' con el canal MCHR1 y la 'conexión C' con el canal ACIII para determinar la superposición de MCHR1 dentro del binario ACIII. Seleccione Medición > relación de objetos > Coeficiente de Manders.
- Anexe las medidas en una sola tabla.
- Combine todas las mediciones en una sola tabla de salida. Seleccione Administración de datos > columna Anexar > básico.
- Medir la colocalización.
- Mide los cilios haciendo clic en Ejecutar. Este proceso toma unos momentos para medir todos los cilios en las imágenes experimentales. Los datos aparecerán en una nueva ventana resultados del análisis.
- Exportar datos para análisis estadístico.
Resultados
Entrenamiento de Ai para identificar cilios
Medir y evaluar la longitud y composición estructural de los cilios puede ser un proceso tedioso, lento y propenso a errores. Aquí, utilizamos Ai para segmentar con precisión los cilios de un gran grupo de imágenes y analizar sus longitudes e intensidades con una herramienta de análisis(Figura 1). Todos los enfoques de IA requieren pasos de capacitación para su implementación. Establecimos una línea de entrenamiento para reconocer los cilios, que se realizó mediante la aplicación manual de máscaras binarias en estructuras ciliares. Esta información se utiliza para entrenar la Ia en función de las características de los píxeles bajo los binarios aplicados. Como pauta general, el entrenamiento implica que el software pase por varias iteraciones, aproximadamente 1000, y se considera óptimo si la pérdida de entrenamiento o la tasa de error es inferior al 1%. Sin embargo, el número de iteraciones y errores en el proceso de entrenamiento puede variar dependiendo de las imágenes de muestra utilizadas para el entrenamiento. Por ejemplo, después de nuestras sesiones de entrenamiento con imágenes de cilios neuronales in vitro, la tasa de error fue del 1,378% en comparación con el 3,36% para las imágenes de la sección cerebral in vivo (Figura suplementaria 1). Una vez que se completa el entrenamiento, Ai se puede usar para segmentar cilios de imágenes experimentales en cuestión de segundos y las máscaras binarias resultantes se utilizan para medir parámetros estructurales. Esto elimina la necesidad de segmentar objetos utilizando el método tradicional de umbral de intensidad, que puede ser difícil en imágenes con alto ruido de fondo o cuando los objetos están muy cerca unos de otros. Ai también reduce el potencial de error y sesgo al aplicar el mismo algoritmo en todas las imágenes, independientemente del usuario.
Medición de la longitud de los cilios con GA3
La longitud de los cilios está estrechamente regulada y se asocia con impactos funcionales en la señalización ciliar16,19. Aquí, medimos las longitudes de los cilios utilizando una tubería de análisis dentro del software NIS Elements llamado Análisis General 3 o GA3. GA3 ayuda a combinar múltiples herramientas en un solo flujo de trabajo para crear rutinas personalizadas para cada experimento. Comenzamos midiendo la longitud de los cilios en una línea celular. Los cilios en las células del conducto colector medular interno del ratón (IMCD-3) fueron inmunomarcados con tubulina acetilada y fotografiados usando un microscopio confocal. Se midieron las longitudes de los cilios utilizando GA3 después de segmentar con segment.ai (Figura suplementaria 3A). Mientras que la α-tubulina acetilada se encuentra preferentemente en el cilio primario, también se encuentra en otras regiones ricas en microtúbulos, como el citoesqueleto y el puente citocinético. La Ai entrenada identificó adecuadamente los cilios en la imagen, pero no otras estructuras positivas de tubulina acetilada no ciliar. Los cilios en células IMCD variaron de 0,5 μm a 4,5 μm con una longitud media de 1,8 ± 0,04 μm(Figura 2A). A continuación, probamos la capacidad de ai para medir la longitud de los cilios en cultivos neuronales primarios. Cultivamos neuronas del hipotálamo y el hipocampo de ratones neonatales durante 10 días y las inmunomarcamos con el marcador de cilios adenilato ciclasa III (ACIII)21,41. Al analizar los cultivos neuronales, nos pareció útil aplicar un filtro antes de analizar estadísticamente las longitudes. Debido a una menor relación señal/ruido, se identificaron varios objetos de menos de 1 μm que no eran cilios. Por lo tanto, filtramos los datos para eliminar cualquier objeto que tuviera menos de 1 μm de longitud para garantizar que solo se analizaran los cilios. En neuronas hipotalámicas cultivadas, las longitudes de los cilios variaron de 2 μm a 7 μm con una longitud promedio de 3,8 ± 0,19 μm(Figura 2B). Curiosamente, los cilios neuronales del hipocampo cultivados fueron más largos con una longitud media de 6,73 ±0,15 μm(Figura 2C). Se ha reportado que diferentes núcleos neuronales dentro del hipotálamo muestran distintas longitudes de cilios y que estos cilios alteran sus longitudes en respuesta a cambios fisiológicos de una manera específica del núcleo19,23. Por lo tanto, también etiquetamos secciones cerebrales hipotalámicas de ratones machos adultos C57BL / 6J con ACIII y obtuvimos imágenes del núcleo arqueado (ARC) y el núcleo paraventricular (PVN). Usando GA3 para medir la longitud de los cilios, observamos que los cilios hipotalámicos in vivo parecían más largos que los cilios in vitro. Específicamente, los cilios hipotalámicos in vivo varían de 1 μm a aproximadamente 15 μm (Figura 3). No hubo diferencias significativas entre las longitudes de los cilios en el PVN (5,54 ± 0,0,42 μm) y las del ARC (6,16 ± 0,27 μm) (Figura 3C)23. Del mismo modo, los cilios en la región cornu ammonis (CA1) del hipocampo muestran un rango de longitud más estrecho de 1 μm a 10 μm con una longitud promedio de 5,28 ± 0,33 μm (Figura 3). De acuerdo con estudios publicados anteriormente, nuestro análisis utilizando herramientas Ai y GA3 mostró que los cilios de diferentes regiones del cerebro muestran diversidad en longitud19,23. Además, utilizando este enfoque de Ia, podemos evaluar rápidamente un gran número de cilios.
Medición de la composición de los cilios utilizando GA3
El cilio primario es un centro de señalización para muchas vías que utilizan diversos tipos de proteínas para llevar a cabo funciones únicas, como proteínas motoras, proteínas de transporte intraflagelar yGPCR,por nombrar algunas3,24,42,43. Mantener los niveles apropiados de estas proteínas dentro del cilio es importante para el correcto funcionamiento y a menudo parece depender del contexto celular. El etiquetado fluorescente de estas proteínas no solo nos ha permitido visualizarlas, sino también cuantificar sus intensidades como medida de la cantidad de proteína marcada dentro del compartimento relativamente pequeño20. Por lo tanto, se buscó determinar las intensidades de un GPCR ciliar, Melanina Concentrating Hormone Receptor 1 (MCHR1), in vivo tanto en el ARC como en pvN del hipotálamo de ratones machos adultos24,44. Usando Ai y GA3, medimos las longitudes de los cilios positivos mcHR1 junto con las intensidades para asegurar que los objetos que se estaban contando fuerancilios (Figura suplementaria 3A). Eliminamos los objetos posteriores al análisis que tenían menos de 2 μm de longitud y analizamos las intensidades de las máscaras binarias restantes. Curiosamente, encontramos que la intensidad de MCHR1 ciliar en PVN es significativamente mayor que la de ARC, lo que indica una presencia más fuerte de MCHR1 ciliar en PVN(Figura 4). Se necesitan estudios adicionales para determinar la importancia de la MCHR1 ciliar en estos circuitos neuronales. También medimos las intensidades de MCHR1 ciliar en neuronas cultivadas primarias de hipotálamo e hipocampo. Los cilios de ambas culturas muestran una amplia distribución de intensidades MCHR1 que sugieren la presencia de poblaciones neuronales heterogéneas(Figura suplementaria 2). Por lo tanto, el uso de herramientas analíticas sofisticadas como Ai y GA3 permite la evaluación de la heterogeneidad de los cilios dentro del mismo tejido o entre múltiples tejidos. Será interesante ver si otros GPCR neuronales muestran diferencias similares en su localización dentro de las neuronas del mismo tejido y si esto se altera en respuesta a cambios fisiológicos.
Colocalización
Si bien medir las intensidades de fluorescencia dentro de un campo de imagen completo puede dar una impresión de proteína, no proporciona información como la distribución espacial o la proximidad a otras proteínas y estructuras celulares cercanas. Aquí, medimos la superposición de MCHR1 con ACIII como marcador de cilios trazando las intensidades de MCHR1 contra las de ACIII para cada máscara binaria(Figura 5). El gráfico muestra que la mayoría de los cilios son positivos para ambos, ACIII y MCHR1, aunque algunos cilios muestran una expresión más fuerte de un canal sobre el otro. Además, hay algunos cilios que muestran la presencia de ACIII o MCHR1, como es evidente en los puntos que se encuentran directamente en el eje x y el eje y respectivamente. Para cuantificar esta superposición, medimos el coeficiente de superposición de Mander y comparamos el grado de expresión de MCHR1 en los cilios neuronales del ARC y PVN40. Curiosamente, nuestro análisis reveló que hubo un aumento significativo en los coeficientes del PVN (0.6382 ± 0.0151) que en los del ARC (0.5430 ± 0.0181) (Figura 5C). Esto es consistente con nuestros datos anteriores donde observamos intensidades más altas de MCHR1 en PVN en comparación con ARC(Figura 4). Estos datos sugieren que, al igual que la longitud de los cilios, el patrón de expresión de MCHR1 en el compartimento ciliar varía en diferentes regiones del cerebro. Utilizando la misma línea de análisis, será posible determinar si otros GPCR ciliares como el receptor de neuropéptido Y tipo 2 (NPY2R) y el receptor de somatostatina tipo 3 (SSTR3) muestran cantidades similares de diversidad.
Medición del perfil de intensidad a lo largo del cilio
Una vez que se han identificado los cilios utilizando segment.ai, la receta GA3 se puede modificar para combinar el análisis de cilios con la identificación de otras estructuras de interés en la imagen. Por ejemplo, el etiquetado con marcadores corporales basales es útil para la identificación de la polaridad de los cilios. Para hacer este análisis, obtuvimos imágenes de secciones cerebrales hipotalámicas de ratones P0 que expresan ARL13B-mCherry y Centrin2-GFP y obtuvimos imágenes del ARC y PVN34. Aquí, los cilios se identificaron usando Ai como antes, pero ahora la receta modificada de GA3 incluye la identificación de Centrin2-GFP, una proteína centriolar que se encuentra en la base de loscilios (Figura suplementaria 3B). Al etiquetar Centrin2-GFP, la base de los cilios se puede distinguir de las puntas de los cilios positivos ARL13B-mCherry (Figura 6A). Luego, en lugar de medir la intensidad dentro de todos los cilios, podemos medir los cambios en la intensidad de ARL13B a lo largo de la longitud de loscilios (Figura 6B). También podemos comparar diferencias en la intensidad de ARL13B entre los extremos proximales y distales de los cilios. Para hacer esto, dividimos la longitud del cilio en contenedores de 1 micra a partir de la base y designamos el primer contenedor de micras como el extremo proximal y el último contenedor de micras como el extremo distal. Nuestro análisis reveló que hay significativamente más ARL13B presente más cerca de la base que la punta del cilio tanto en ARC como en PVN, y esto es consistente con estudios publicados previamente en condrocitos humanos45 (Figura 6C). En este tipo de análisis, en lugar de aplicar un filtro de longitud para excluir del análisis pequeños objetos no ciliares, solo se analizan los cilios asociados con el etiquetado Centrin2-GFP. Esto puede ser ventajoso en situaciones en las que las mutaciones genéticas producen cilios muy cortos, o si se han implicado cambios en los subdominios de los cilios como la zona de transición o la punta. La identificación de cilios mediante análisis ai y GA3 es altamente adaptable y se puede adaptar para adaptarse a una variedad de preguntas de investigación complejas.
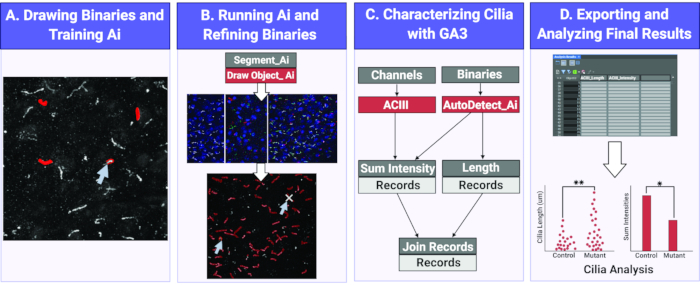
Figura 1. Flujo de trabajo para medir la longitud e intensidad de los cilios utilizando Ai. (A) Para entrenar a la Ai, se dibujan binarios alrededor de los objetos de interés (cilios) en las imágenes de entrenamiento en bruto. Usando los binarios dibujados, Segment Ai está entrenado para reconocer la forma y las intensidades de píxeles de los cilios. (B) A continuación, el Segmento Ai entrenado se aplica a imágenes experimentales en bruto. Dibuja binarios en objetos que reconoce como cilios. Estos binarios se pueden refinar para asegurarse de que todos y solo los cilios estén siendo analizados. (C) Se construye un programa GA3 para analizar la intensidad y longitud de los objetos reconocidos por la Ia. (D) Los registros se importan a una tabla en el software. Esta tabla se puede exportar para su posterior análisis. Haga clic aquí para ver una versión más grande de esta figura.

Figura 2. Mediciones in vitro de la longitud de los cilios. Imágenes representativas de cilios en (A) células IMCD (verde, tubulina acetilada) (B) cultivos hipotalámicos primarios (verde, ACIII) y (C) cultivos de hipocampo (verde, ACIII). Se utilizó una Ai entrenada para reconocer los cilios como se muestra en la máscara binaria (magenta) y luego se utilizó GA3 para medir la longitud de los cilios. La distribución de la longitud de los cilios se grafica como porcentaje de cilios en contenedores de 0,5 o 1,0 micras. * indica puente citocinético correctamente no reconocido por Ai. n=225 cilios en células IMCD de 3 réplicas, 54 cilios en hipotalámicos y 139 cilios en cultivos de hipocampo de 3 animales. Barras de escala 10 μm. Haga clic aquí para ver una versión más grande de esta figura.
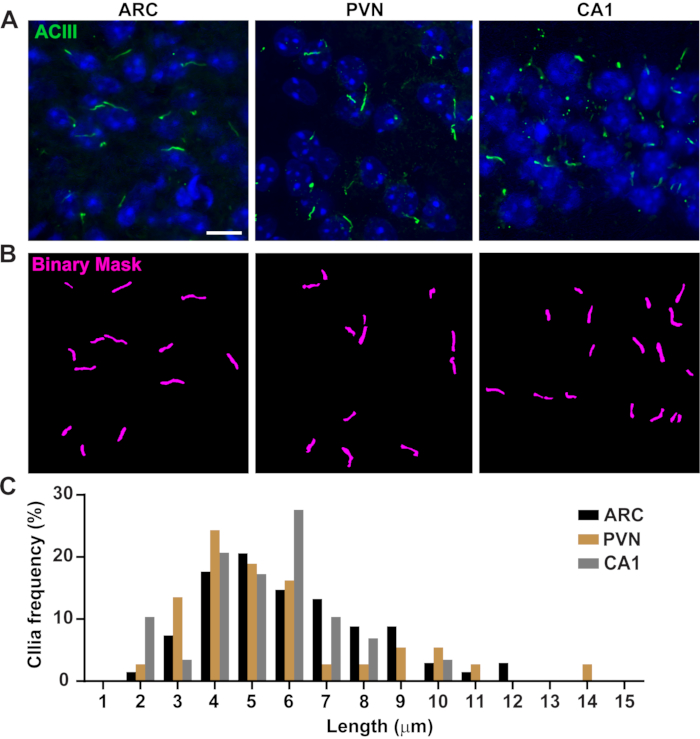
Figura 3. Mediciones in vivo de la longitud de los cilios. (A) Imágenes representativas de cilios (verde, ACIII) en las secciones ARC, PVN y CA1 del cerebro de ratones adultos. (B)Se utilizó una Ai entrenada en ELEMENTOS NIS para reconocer los cilios como se muestra en la máscara binaria (magenta) y luego se utilizó GA3 para medir la longitud de los cilios. (C) La distribución de la longitud de los cilios se grafica como porcentaje de cilios en contenedores de una micra. n= 68 cilios en ARC, 36 en PVN y 29 en CA1 de 3 animales. Barras de escala 10 μm. Haga clic aquí para ver una versión más grande de esta figura.
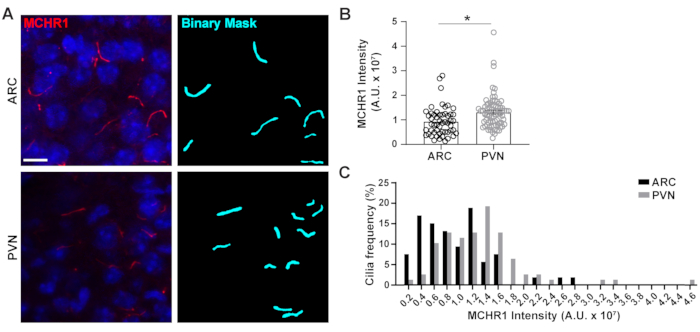
Figura 4. Mediciones de la intensidad de tinción de cilios asistida por Ai de cilios hipotalámicos. (A) Imágenes representativas de cilios (MCHR1, rojo) en las secciones ARC y PVN del cerebro de ratones adultos. Se utilizó una Ai entrenada en ELEMENTOS NIS para reconocer los cilios como se muestra en la máscara binaria (cian) y luego se utilizó GA3 para medir la intensidad de la tinción MCHR1 en los cilios. (B) Las intensidades MCHR1 se grafican como promedio ± S.E.M. Cada punto representa un cilio. * p < 0.05, Prueba t de Student. (C) La distribución de la intensidad de MCHR1 se grafica como porcentaje de cilios en contenedores de 0,2 x 107 Unidades Arbitrarias (A. U.). n= 53 cilios en ARC, 78 en PVN de 3 animales. Barras de escala 10 μm. Haga clic aquí para ver una versión más grande de esta figura.
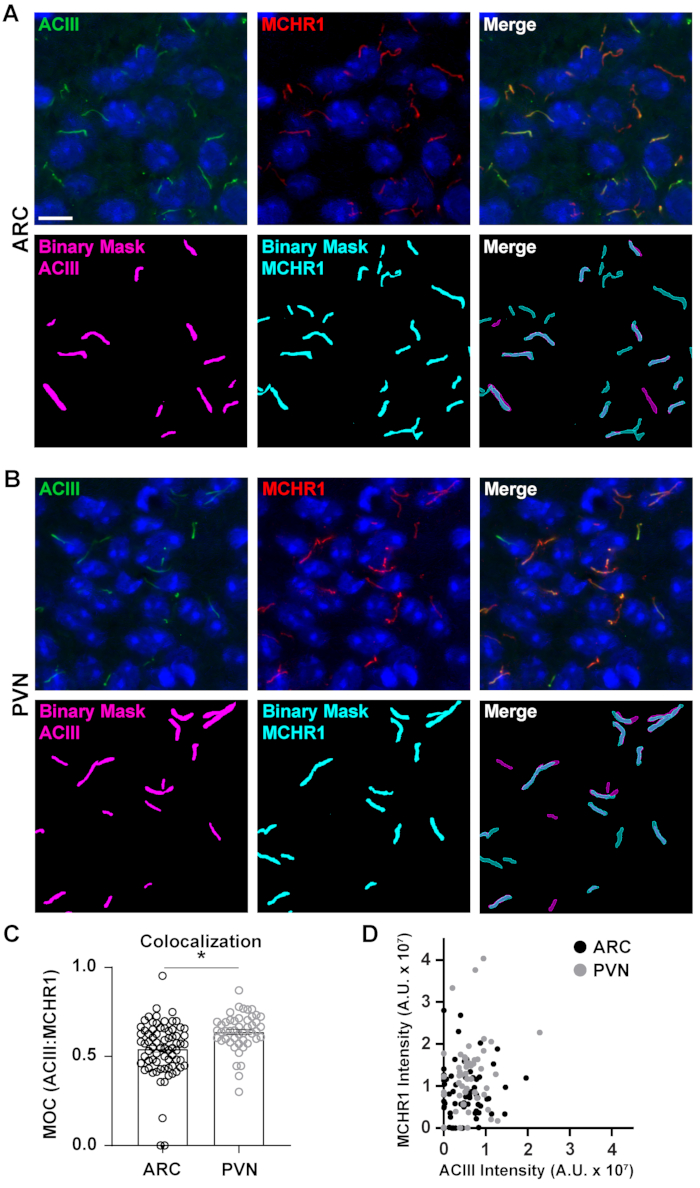
Figura 5. Análisis de colocalización de cilios asistido por Ai. (A, B) Imágenes representativas de cilios en el ARC y PVN respectivamente. Los cilios están etiquetados con ACIII (verde) y MCHR1 (rojo). Se utilizó una Ai entrenada en elementos NIS para reconocer los cilios como se muestra en la máscara binaria (magenta para los cilios marcados con ACIII, cian para los cilios marcados con MCHR1). GA3 se utilizó para reconocer cilios que contenían tanto ACIII como MCHR1. (C) Los valores del coeficiente de superposición de Manders (MOC) se grafican como promedio ± S.E.M. Cada punto representa un cilio. * p < 0.05, Prueba t de Student. (D) Diagrama de dispersión de intensidad MCHR1 vs. intensidad ACIII en ARC y PVN. Cada punto representa un cilio. n= 72 cilios en ARC, 47 en PVN de 3 animales. Barras de escala 10 μm. Haga clic aquí para ver una versión más grande de esta figura.
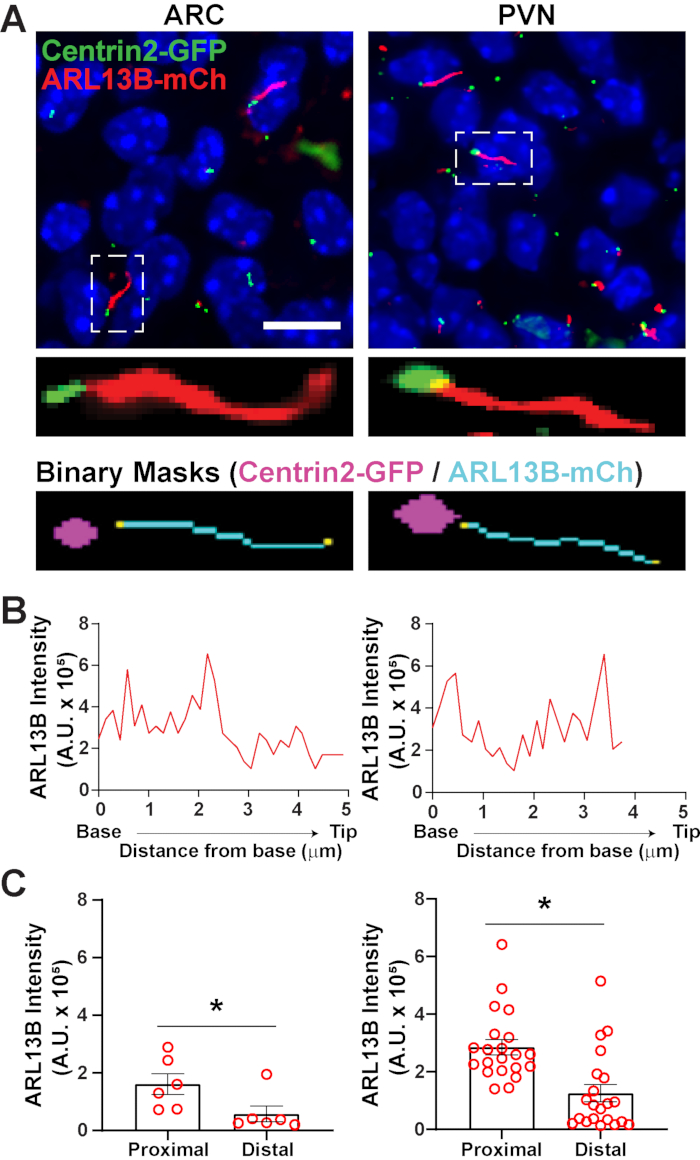
Figura 6. Análisis de cilios y cuerpo basal. (A) Imágenes representativas de cilios (rojo, ARL13B-mCherry) y marcador corporal basal (verde, Centrin2-GFP) en el ARC y PVN de ratones P0. Se utilizó una Ai entrenada para reconocer los cilios como se muestra en la máscara binaria (cian). La máscara binaria para el cuerpo basal (magenta) se dibujó por umbral en la receta GA3. (B) Intensidad de escaneo de línea representativa de un cilio. (C) Intensidades ARL13B en los extremos proximal y distal de Ai identificaron cilios graficados como promedio ± S.E.M. Los extremos proximal y distal se definen como la región dentro de la primera longitud de 1 μm y la última longitud de 1 μm respectivamente desde la base del cilio. Cada punto representa un cilio. * p < 0,05. n = 6 cilios en ARC de 2 animales y 21 cilios en PVN de 3 animales. Barras de escala 10 μm. Haga clic aquí para ver una versión más grande de esta figura.
Figura suplementaria 1. Gráficos de pérdida de entrenamiento de Ai. (A, B) Gráficos que muestran la pérdida de entrenamiento de segment.ai en cilios neuronales in vitro e in vivo, respectivamente. Haga clic aquí para descargar este archivo.
Figura suplementaria 2. Mediciones de la intensidad de tinción de cilios asistidas por Ai de cilios neuronales in vitro. (A, B) Imágenes representativas de cilios (MCHR1, rojo) en cultivos primarios hipotalámicos e hipocampales, respectivamente. Se utilizó una Ai entrenada en ELEMENTOS NIS para reconocer los cilios como se muestra en la máscara binaria (cian) y luego se utilizó GA3 para medir la intensidad de la tinción MCHR1 en los cilios. La distribución de la intensidad de MCHR1 se grafica como porcentaje de cilios en 1000 contenedores de U.A. para cultivos hipotalámicos y 2000 contenedores de A. U. para cultivos de hipocampo. n= 30 cilios en hipotalámicos y 106 cilios en cultivos de hipocampo de 3 animales. Barras de escala de 10 μm. Haga clic aquí para descargar este archivo.
Figura suplementaria 3. Análisis general 3 recetas para el análisis de cilios. (A) Receta de análisis general simple (GA3) para la medición de la longitud, la intensidad y el coeficiente de Mander de los cilios. (B) Receta compleja de GA3 para la medición de la intensidad a lo largo del cilio utilizando un marcador para el cuerpo basal. Haga clic aquí para descargar este archivo.
Discusión
Las mediciones de longitud e intensidad son formas comunes de analizar los cilios primarios, sin embargo, no existe un método convencional estandarizado utilizado en el campo. La identificación y cuantificación de los cilios primarios utilizando software como ImageJ requiere mucho tiempo y es propensa al sesgo y error del usuario. Esto dificulta el análisis preciso de grandes conjuntos de datos. Aquí mostramos que el uso de un programa de IA puede superar muchos de estos desafíos, lo que hace que el análisis de alto rendimiento de los cilios primarios sea alcanzable. A continuación describimos el procedimiento para entrenar una aplicación basada en Ia para reconocer los cilios primarios y describimos los pasos necesarios para analizar la longitud y la intensidad.
Si bien el entrenamiento inicial de la Ia para reconocer los cilios requiere un tiempo significativo por parte del usuario, una vez completado se puede utilizar en cualquier conjunto de datos adquirido con los mismos parámetros. La máscara binaria generada por el Ai es modificable de tal manera que cualquier error puede ser corregido. Sin embargo, los errores en la identificación de los cilios deben indicar al usuario que la IA necesita ser entrenada aún más con imágenes adicionales. Una ventaja importante de este método es que la Ia puede ser entrenada para reconocer cilios en diferentes tipos de muestras tanto en 2D como en 3D. Los métodos de análisis anteriores generados dentro de los laboratorios tienen varias limitaciones, incluida la exigencia de umbrales manuales para la identificación y problemas para identificar los cilios fotografiados de secciones de tejido donde la densidad celular es alta36,46,47. Estos métodos también están especializados para el análisis de cilios, mientras que el análisis utilizando el software NIS Elements puede evaluar varios aspectos de las imágenes simultáneamente. Debido a que la IA descrita aquí es parte del paquete de software NIS Elements, las imágenes adquiridas con un microscopio Nikon se pueden continuar fácilmente hasta el análisis. Sin embargo, no se requieren imágenes con Nikon para el uso de este método. Independientemente del formato de archivo de datos sin procesar capturado, NIS Elements puede abrir archivos ".tif" para usarlos en ai.
Esta aplicación ai dentro de NIS Elements está ampliamente disponible y posiblemente ya sea parte del software de análisis de imágenes en uso por los laboratorios que estudian los cilios primarios. Con la expansión de la prevalencia de la tecnología Ai, otros software de imágenes pueden ampliar sus opciones de análisis para incluir un módulo Ai similar. La aplicación del análisis de Ia a la identificación de cilios se puede utilizar para varios aspectos diferentes del análisis de cilios. Si bien describimos métodos para algunos análisis simples como la longitud(Figura 2 y 3),la intensidad(Figura 4)y la colocalización(Figura 5),se puede agregar un análisis más sofisticado al flujo de trabajo de análisis GA3 como en la Figura 6. Por ejemplo, en lugar de medir la intensidad de un cilio completo, las diferencias de intensidad dentro de una subregión de un cilio pueden ser de interés para evaluar la localización subciliar. Las diferencias de intensidad dentro de una subregión de un cilio podrían indicar que la proteína se está acumulando en la punta o la base del cilio, como la forma en que las proteínas Gli se enriquecen en la punta delos cilios 48. Además, esta aplicación de Ia se puede utilizar para identificar fácilmente las diferencias entre genotipos o grupos de tratamiento. Si bien nuestro laboratorio utiliza principalmente este método para analizar cilios fotografiados de secciones cerebrales o cultivos neuronales, se puede aplicar a imágenes adquiridas de varias líneas celulares u otros tipos de tejidos. La flexibilidad del tipo de muestra en la que se puede utilizar esta aplicación hace que este método de análisis sea valioso para muchos grupos diferentes que estudian cilios primarios o cualquier orgánulo discreto que se esté evaluando, como mitocondrias, núcleos o ER.
Divulgaciones
El coautor Wesley Lewis es empleado de Nikon. No hay divulgaciones financieras.
Agradecimientos
Este trabajo fue financiado por el Instituto Nacional de Diabetes y Enfermedades Digestivas y Renales R01 DK114008 a NFB y la Beca de la Asociación Americana del Corazón #18PRE34020122 a RB. Agradecemos a Rich Gruskin, Gerente General de Nikon Software, Melissa Bentley, Courtney Haycraft y Teresa Mastracci por sus perspicaces comentarios sobre el manuscrito.
Materiales
| Name | Company | Catalog Number | Comments |
| Intel Xeon, 3.6 GHz, 32GB RAM | Intel Corporation | W-2123 | Processor used for running NIS Elements. |
| Nikon Elements Software | Nikon Instruments Inc. | - | Ai and GA3 software |
| Quadro RTX 4000 Graphics card | NVIDIA Corporation | Quadro RTX 4000 | |
| Windows 10 Professional 64-bit | Microsoft Inc. | - | Operating system used for running NIS Elements |
| Workstation | HP Development Company, L.P. | HP Z4G4 | Workstation used for running NIS Elements |
Referencias
- Wang, L., et al. Ciliary gene RPGRIP1L is required for hypothalamic arcuate neuron development. JCI Insight. 4 (3), (2019).
- Siljee, J. E., et al. Subcellular localization of MC4R with ADCY3 at neuronal primary cilia underlies a common pathway for genetic predisposition to obesity. Nature Genetics. 50 (2), 180-185 (2018).
- Davenport, J. R., et al. Disruption of intraflagellar transport in adult mice leads to obesity and slow-onset cystic kidney disease. Current Biology. 17 (18), 1586-1594 (2007).
- Berbari, N. F., O'Connor, A. K., Haycraft, C. J., Yoder, B. K. The primary cilium as a complex signaling center. Current Biology. 19 (13), 526-535 (2009).
- Walz, G. Role of primary cilia in non-dividing and post-mitotic cells. Cell Tissue Research. 369 (1), 11-25 (2017).
- Nachury, M. V., Mick, D. U. Establishing and regulating the composition of cilia for signal transduction. Nature Reviews. Molecular Cell Biology. 20 (7), 389-405 (2019).
- Goetz, S. C., Anderson, K. V. The primary cilium: a signalling centre during vertebrate development. Nature Reviews Genetics. 11 (5), 331-344 (2010).
- Engle, S. E., Bansal, R., Antonellis, P. J., Berbari, N. F. Cilia signaling and obesity. Seminars in Cell and Developmental Biology. , (2020).
- Reiter, J. F., Leroux, M. R. Genes and molecular pathways underpinning ciliopathies. Nature reviews. Molecular Cell Biology. 18 (9), 533-547 (2017).
- Waters, A. M., Beales, P. L. Ciliopathies: an expanding disease spectrum. Pediatric Nephrology. 26 (7), Berlin, Germany. 1039-1056 (2011).
- Hildebrandt, F., Benzing, T., Katsanis, N. Ciliopathies. New England Journal of Medicine. 364 (16), 1533-1543 (2011).
- Vaisse, C., Reiter, J. F., Berbari, N. F. Cilia and Obesity. Cold Spring Harbor Perspectives in Biology. 9 (7), (2017).
- Berbari, N. F., et al. Leptin resistance is a secondary consequence of the obesity in ciliopathy mutant mice. Proceedings of the National Academy of Sciences of the United States of America. 110 (19), 7796-7801 (2013).
- Jacobs, D. T., et al. Dysfunction of intraflagellar transport-A causes hyperphagia-induced obesity and metabolic syndrome. Disease Models & Mechanisms. 9 (7), 789-798 (2016).
- Arsov, T., et al. Fat aussie--a new Alström syndrome mouse showing a critical role for ALMS1 in obesity, diabetes, and spermatogenesis. Molecular Endocrinology. 20 (7), 1610-1622 (2006).
- Tam, L. W., Ranum, P. T., Lefebvre, P. A. CDKL5 regulates flagellar length and localizes to the base of the flagella in Chlamydomonas. Molecular Biology of the Cell. 24 (5), 588-600 (2013).
- Rajagopalan, V., Subramanian, A., Wilkes, D. E., Pennock, D. G., Asai, D. J. Dynein-2 affects the regulation of ciliary length but is not required for ciliogenesis in Tetrahymena thermophila. Molecular Biology of the Cell. 20 (2), 708-720 (2009).
- Bengs, F., Scholz, A., Kuhn, D., Wiese, M. LmxMPK9, a mitogen-activated protein kinase homologue affects flagellar length in Leishmania mexicana. Molecular Microbiology. 55 (5), 1606-1615 (2005).
- Han, Y. M., et al. Leptin-promoted cilia assembly is critical for normal energy balance. Journal of Clinical Investigation. 124 (5), 2193-2197 (2014).
- Caspary, T., Marazziti, D., Berbari, N. F. Cilia: Methods and Protocols. Satir, P., Tvorup Christensen, S. , Springer. New York. 203-214 (2016).
- Bishop, G. A., Berbari, N. F., Lewis, J., Mykytyn, K. Type III adenylyl cyclase localizes to primary cilia throughout the adult mouse brain. Journal of Comparative Neurology. 505 (5), 562-571 (2007).
- Domire, J. S., Mykytyn, K. Markers for neuronal cilia. Methods in Cell Biology. 91, 111-121 (2009).
- Sun, J. S., et al. Ventromedial hypothalamic primary cilia control energy and skeletal homeostasis. Journal of Clinical Investigation. 131 (1), (2021).
- Berbari, N. F., Johnson, A. D., Lewis, J. S., Askwith, C. C., Mykytyn, K. Identification of ciliary localization sequences within the third intracellular loop of G protein-coupled receptors. Molecular Biology of the Cell. 19 (4), 1540-1547 (2008).
- Brailov, I., et al. Localization of 5-HT(6) receptors at the plasma membrane of neuronal cilia in the rat brain. Brain Research. 872 (1-2), 271-275 (2000).
- Domire, J. S., et al. Dopamine receptor 1 localizes to neuronal cilia in a dynamic process that requires the Bardet-Biedl syndrome proteins. Cellular and Molecular Life Sciences. 68 (17), 2951-2960 (2011).
- Handel, M., et al. Selective targeting of somatostatin receptor 3 to neuronal cilia. Neuroscience. 89 (3), 909-926 (1999).
- Koemeter-Cox, A. I., et al. Primary cilia enhance kisspeptin receptor signaling on gonadotropin-releasing hormone neurons. Proceedings of the National Academy of Sciences of the United States of America. 111 (28), 10335-10340 (2014).
- Mukhopadhyay, S., et al. The ciliary G-protein-coupled receptor Gpr161 negatively regulates the Sonic hedgehog pathway via cAMP signaling. Cell. 152 (1-2), 210-223 (2013).
- Berman, S. A., Wilson, N. F., Haas, N. A., Lefebvre, P. A. A novel MAP kinase regulates flagellar length in Chlamydomonas. Current Biology. 13 (13), 1145-1149 (2003).
- Nguyen, R. L., Tam, L. W., Lefebvre, P. A. The LF1 gene of Chlamydomonas reinhardtii encodes a novel protein required for flagellar length control. Genetics. 169 (3), 1415-1424 (2005).
- Tam, L. W., Wilson, N. F., Lefebvre, P. A. A CDK-related kinase regulates the length and assembly of flagella in Chlamydomonas. Journal of Cell Biology. 176 (6), 819-829 (2007).
- O'Connor, A. K., et al. An inducible CiliaGFP mouse model for in vivo visualization and analysis of cilia in live tissue. Cilia. 2 (1), 8(2013).
- Bangs, F. K., Schrode, N., Hadjantonakis, A. K., Anderson, K. V. Lineage specificity of primary cilia in the mouse embryo. Nature Cell Biology. 17 (2), 113-122 (2015).
- Delling, M., et al. Primary cilia are not calcium-responsive mechanosensors. Nature. 531 (7596), 656-660 (2016).
- Saggese, T., Young, A. A., Huang, C., Braeckmans, K., McGlashan, S. R. Development of a method for the measurement of primary cilia length in 3D. Cilia. 1 (1), 11(2012).
- Kobayashi, Y., Hamamoto, A., Saito, Y. Analysis of ciliary status via G-protein-coupled receptors localized on primary cilia. Microscopy. 69 (5), 277-285 (2020).
- Zhou, L. Q., et al. Artificial intelligence in medical imaging of the liver. World Journal of Gastroenterology. 25 (6), 672-682 (2019).
- Naugler, C., Church, D. L. Automation and artificial intelligence in the clinical laboratory. Critical Reviews in Clinical Laboratory Sciences. 56 (2), 98-110 (2019).
- Dunn, K. W., Kamocka, M. M., McDonald, J. H. A practical guide to evaluating colocalization in biological microscopy. American Journal of Physiology-Cell Physiology. 300 (4), 723-742 (2011).
- Bansal, R., et al. Hedgehog Pathway Activation Alters Ciliary Signaling in Primary Hypothalamic Cultures. Frontiers in Cellular Neuroscience. 13, 266(2019).
- Jin, H., et al. The conserved Bardet-Biedl syndrome proteins assemble a coat that traffics membrane proteins to cilia. Cell. 141 (7), 1208-1219 (2010).
- Liew, G. M., et al. The intraflagellar transport protein IFT27 promotes BBSome exit from cilia through the GTPase ARL6/BBS3. Developmental Cell. 31 (3), 265-278 (2014).
- Engle, S. E., et al. A CreER Mouse to Study Melanin Concentrating Hormone Signaling in the Developing Brain. Genesis. , (2018).
- Thorpe, S. D., et al. Reduced primary cilia length and altered Arl13b expression are associated with deregulated chondrocyte Hedgehog signaling in alkaptonuria. Journal of Cellular Physiology. 232 (9), 2407-2417 (2017).
- Lauring, M. C., et al. New software for automated cilia detection in cells (ACDC). Cilia. 8, 1(2019).
- Dummer, A., Poelma, C., DeRuiter, M. C., Goumans, M. J., Hierck, B. P. Measuring the primary cilium length: improved method for unbiased high-throughput analysis. Cilia. 5, 7(2016).
- Haycraft, C. J., et al. Gli2 and Gli3 localize to cilia and require the intraflagellar transport protein polaris for processing and function. PLoS Genetics. 1 (4), 53(2005).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados