Method Article
1차 섬모 평가에 대한 인공 지능 접근 방식
요약
이미지를 분석하기 위해 인공 지능(Ai)을 사용하는 것은 일반적으로 사용되는 방법에 비해 강력하고 편향이 적으며 빠른 접근 으로 부상하고 있습니다. 여기서 우리는 Ai가 세포 세포, 1차 섬모를 인식하고 길이 및 염색 강도와 같은 특성을 엄격하고 재현 가능한 방식으로 분석하도록 훈련했습니다.
초록
Cilia는 많은 포유류 세포 모형에 있는 신호 통로의 다양성을 위한 신호 센터로 작동하는 microtubule 기지를 둔 세포 부속물입니다. Cilia 길이는 매우 보존되고 엄격하게 조절되며 다른 세포 유형과 조직마다 다르며 신호 용량에 직접 적으로 영향을 미칩니다. 예를 들어, 섬모 G 단백질 결합 수용 체의 활성화에 대 한 응답으로 그들의 길이 변경 표시 되었습니다. 그러나 수많은 섬모의 길이를 정확하고 재현적으로 측정하는 것은 시간이 많이 걸리고 노동 집약적인 절차입니다. 현재 접근 방식도 오류및 편향이 발생하기 쉽습니다. 인공 지능(Ai) 프로그램은 광범위한 데이터 세트의 동화, 조작 및 최적화를 허용하는 기능으로 인해 이러한 많은 과제를 극복하기 위해 활용할 수 있습니다. 여기서는 생체 내 및 체외 샘플 모두에서 이미지에서 Cilia를 인식하도록 Ai 모듈을 학습할 수 있음을 입증합니다. 훈련된 Ai를 사용하여 섬모를 식별한 후, 길이, 형광 강도 및 공동 지역화를 위해 단일 샘플에서 수백 개의 섬모를 분석하는 응용 프로그램을 설계하고 신속하게 활용할 수 있습니다. 이 편견없는 접근은 동물 내의 다른 두뇌 지구와 동물 사이뿐만 아니라 시험관내의 다른 1 차적인 신경 준비에서 견본을 비교할 때 우리의 신뢰그리고 엄격을 증가했습니다. 더욱이, 이 기술은 여러 샘플 및 치료 단에 걸쳐 고처리량 방식으로 임의의 세포 유형 및 조직에서 섬모 역학을 안정적으로 분석하는 데 사용될 수 있다. 궁극적으로 대부분의 필드가 이미지 수집 및 분석을 위해 편향적이고 재현 가능한 접근 법으로 이동함에 따라 Ai 기반 접근 방식이 표준화될 수 있습니다.
서문
1차 섬모는 대부분의 포유류 세포 유형1,2,3,4로부터튀어나온 감각 세포입니다. 그(것)들은 일반적으로 세포외신호5,6,7를통합하여 다양한 세포 신호 통로를 조정하기 위한 중요한 고독한 부속체입니다. 1 차 적인 cilia 는 배아 발달 과 성인 조직 항상성 도중 중요한 역할을 하고, 그들의 기능 또는 형태학의 중단은 통칭하게 ciliopathies에게 불린 몇몇 유전 무질서와 연관됩니다. 섬모의 근해 특성으로 인해, 섬광병증은 모든 장기 시스템에 영향을 미칠 수있는 광범위한 임상 기능과 연관되어8,9,10,11,12. 섬광증의 동물 모델에서, 섬모 구조 또는 신호 용량의 손실은 과식증 관련 비만3,13,14,15를포함하는 몇몇 임상적으로 관련표현형에서 나타난다. 많은 모델 시스템에서, 섬모 길이 변화는 신호 용량 및 기능에 영향을 미치는 것으로 나타났다16,17,18,19. 그러나 섬모 길이와 구성을 정확하고 재현적으로 평가하는 데 는 몇 가지 시간이 걸리고 기술적 인 문제가 있습니다.
성인 포유류 중추 신경계 (CNS)는 섬모와 기능을 이해하는 데 어려움을 제기 한 생물학적 맥락입니다. CNS 를 통해 뉴런과 세포가 섬모를 소유하고 있는 것처럼 보이지만, 이러한 섬모를 관찰하고 분석하는 제한된 도구와 능력으로 인해 이러한 기능에 대한 이해는20으로여전히 애매합니다. 예를 들어, 프로토타입 섬모 마커, 아세틸화된 α-튜룰린은 뉴런섬모(20)에라벨을 붙이지 않는다. 이러한 섬모를 연구하는 어려움은 부분적으로 여러 G 단백질 결합 수용체 (GPCR), 신경 섬모의 막에 농축되는 기계 및 막 관련 단백질의 발견과 함께 해결되었다21,22. 이러한 간단한 기본 관찰의 모든 지금까지 다른 조직에 의해 비교할 수없는 나타납니다 CNS 섬모의 중요성과 다양성을 암시한다. 예를 들어, 섬모 길이 및 GPCR 국소화의 변화는 다른핵(19,23)과비교할 때 특정 뉴런 핵의 길이가 다른 뇌 전체에서 관찰될 수 있다. 유사하게, 그들의 GPCR 함량 및 신호 기계 칭찬은 신경 해부학 적위치와 신경 형2,24,25,26,27,28,29에기초한 다양성을 보여줍니다. 이러한 간단한 관측은 포유류 CNS 섬모 길이와 조성이 클라미도모나스 레인하르트티이와같은 모델 유기체와 마찬가지로 엄격하게 조절되어 있지만, 이러한 길이 차이가 섬모 기능에 미치는 영향, 신호 및 궁극적으로 동작은16,30,31,32로불분명하다는 것을 보여준다.
섬모 길이와 구성을 정확하게 측정하는 것은 사용자 오류 및 불굴의 성에 취약한 기술적 과제임을 입증합니다. 현재 생체 내 및 체외에서 섬모는 모분 단백질 또는 섬모가 풍부한 형광 기자 알레임33,34,35에라벨을 붙이는 면역 형광 접근법을 사용하여 가장 자주 확인된다. 이러한 형광 태그 된 섬모의 길이는 ImageJ36과같은 이미지 분석 프로그램에서 라인 측정 도구를 사용하여 2 차원 (2D) 이미지에서 측정됩니다. 이 과정은 지루하고 노동 집약적일 뿐만 아니라 편견과 오류가 발생하기 쉽습니다. 이러한 동일한 장애물은 섬모구조(37)의변화를 나타내는 데 도움이 되는 섬모 강도를 측정할 때 발생합니다. 이러한 유형의 이미지 분석에서 불일치를 최소화하기 위해 인공 지능(Ai) 프로그램이 점점 더 널리 퍼지고 저렴한옵션(38)이되고 있다.
Ai는 컴퓨터 알고리즘과 프로그래밍의 이점을 사용하여 일반적으로 인간의지능(39)이필요한 작업을 실행하는 컴퓨터 시스템의 발전입니다. Ai 장치는 반복되는 패턴, 매개 변수 및 특성을 인식하고 성공적인 결과를 창출할 확률을 극대화하기 위한 조치를 취하는 방법을 가르칩니다. Ai는 다재다능하며 섬모와 같은 특정 개체 또는 관심 구조를 인식한 다음 식별된 개체에 대한 다양한 분석을 실행하도록 프로그래밍할 수 있습니다. 따라서 Ai38에의해 복잡한 이미지 데이터를 신속하고 재현적으로 생성할 수 있다. 캡처된 이미지의 자동화 및 Ai 분석은 잠재적인 인간의 오류와편견(39)을제한하면서 효능과 효율성을 높일 것이다. Cilia 식별을 위한 Ai 기반 방법론을 구축하면 모든 연구 그룹이 cilia 데이터를 분석하고 해석할 수 있는 일관된 방법이 만들어집니다.
여기서 우리는 Ai 모듈을 사용하여 생체 내 및 2D 이미지의 시험관 내 섬모를 식별합니다. Ai는 샘플 이미지 세트를 사용하여 섬모를 식별하는 데 훈련됩니다. 훈련이 완료되면 지정된 Ai는 이미지에서 Ai 식별 된 섬모 위에 바이너리 마스크를 적용하는 데 사용됩니다. Ai가 적용한 바이너리는 필요한 경우 이미지의 모든 섬모가 제대로 식별되고 비특이적 식별이 제거되도록 수정할 수 있습니다. Ai를 활용하여 섬모를 식별한 후, 맞춤형 일반 분석(GA) 프로그램은 섬모 길이 및 형광 강도 측정과 같은 다양한 분석을 수행하는 데 사용됩니다. 수집된 데이터는 쉽게 읽고 해석하며 통계 분석에 사용할 수 있는 테이블로 내보내지며(그림1). 자동화 된 기술과 Ai를 사용하여 섬모를 식별하고 실험 그룹 간의 특정 측정을 얻는 것은 CNS 섬모 기능과 세포 통신 및 행동에 대한 형태학의 영향을 이해하는 것을 목표로하는 향후 연구에 도움이 될 것입니다.
프로토콜
1. 원시 이미지 획득
- 필요에 따라 수정 및 면역 라벨 샘플20.
- Nyquist 해상도와 동일한 픽셀 크기를 사용하여 최대 비트 깊이에서 공초점 현미경을 사용하는 이미지 섬모.
- 이미지를 흑백 태그 이미지 형식(.tif) 파일로 내보냅니다.
참고: 이 프로토콜은 NIS Elements 소프트웨어 내에서 특히 Ai 모듈을 사용하는 방법을 간략하게 설명합니다. 이미지를 .nd2 파일로 획득한 경우 이미지를 .tif 파일로 내보낼 필요가 없으며 사용자는 2.3단계로 직접 진행할 수 있습니다. 다른 시스템에서 이미지를 획득한 경우 NIS Elements 라이선스를 별도로 구매할 수 있으며 다음 단계에서 설명된 대로 파일을 변환할 .tif 수 있습니다.
2. 섬모를 식별하기 위해 Ai를 훈련
- 교육 데이터 집합을 엽니다.
- 프레임당 최소 하나의 실슘이 있는 약 50개의 샘플 이미지를 선택하여 소프트웨어를 학습하고 단일 폴더에 복사합니다. 이 폴더는 이미지를 열 때 소프트웨어를 지시하는 데 사용됩니다. 프레임당 하나 이상의 실슘이 있는 단일 ND2 문서 내에서 이 50프레임을 엽니다. 파일 > 가져오기/내보내기 > 파일 시퀀스에서 ND 파일 만들기를 선택합니다.
- 교육 데이터 집합이 포함된 폴더를 선택합니다. 이렇게 하면 대화 창 중앙에 있는 파일 목록이 열립니다. 위의 드롭다운 메뉴에서 하나 이상의 옵션을 사용하여 파일 구성을 수동으로 정의합니다. 옵션은 멀티포인트(여러 최대 투영 파일의 경우), Z 시리즈(z 스택 이미지의 경우), 시간(시간 경과 이미지용), 파장(여러 채널의 파일)입니다.
- 선택한 각 옵션 아래에 해당 숫자 값을 입력합니다. 옵션을 선택하지 않는 경우 없음을 선택합니다. 변환을 클릭하여 ND 문서를 엽니다.
- 이미지를 보정합니다.
- 이미지의 왼쪽 아래 모서리에 있는 픽셀 크기를 입력 > >합니다.
- 섬모를 식별합니다.
- 이진 도구 모음에서자동 감지 또는 그리기 오브젝트를 사용하여 열린 모든 프레임에서 개별 섬모 구조를 정확하게 추적하여 섬모를 손으로 식별합니다. 이렇게 하면 관심 있는 개체에 이진 마스크를 그립니다. 이러한 바이너리는 향후 실험 이미지 분석에서 픽셀 기반 특성에 대한 섬모를 식별하도록 소프트웨어를 학습하기 위한 샘플 개체역할을 합니다. > 분석 컨트롤 보기 > 이진 도구 모음 > 그리기 개체를 선택합니다.
참고: 열린 모든 프레임에서 바이너리를 감지하지 않는 한 소프트웨어가 교육을 시작하지 않으므로 바이너리가 없는 프레임을 제거합니다.
- 이진 도구 모음에서자동 감지 또는 그리기 오브젝트를 사용하여 열린 모든 프레임에서 개별 섬모 구조를 정확하게 추적하여 섬모를 손으로 식별합니다. 이렇게 하면 관심 있는 개체에 이진 마스크를 그립니다. 이러한 바이너리는 향후 실험 이미지 분석에서 픽셀 기반 특성에 대한 섬모를 식별하도록 소프트웨어를 학습하기 위한 샘플 개체역할을 합니다. > 분석 컨트롤 보기 > 이진 도구 모음 > 그리기 개체를 선택합니다.
- Ai 를 훈련하십시오.
- 소프트웨어 교육을 시작합니다. 이 Segment.ai 기차를 엽니 다. NIS.ai > 기차 Segment.ai선택합니다.
- 기차 Segment.ai 상자에서 훈련에 사용할 소스 채널을 선택합니다. 여러 채널의 파일이 열려 있는 경우 하나의 채널만 소스 채널로 선택합니다. 그런 다음 Ai를 훈련할 적절한 지상 진실 바이너리를 선택하십시오. 마지막으로 바이너리의 크기와 분포에 따라 Ai를 훈련하는 데 필요한 반복 수를 선택합니다.
참고: 바이너리를 주변에서 쉽게 감지하고 이미지 전체에 잘 분산되어 있는 경우 이미지를 식별하기 위해 교육을 받으려면 1,000회 미만의 반복이 필요할 수 있습니다. 이미지에 신호 대 잡음 비율이 낮은 경우 Ai가 높은 확신을 가지고 테스트 샘플에서 섬모를 식별할 수 있도록 훈련하는 동안 최소 1,000회 반복을 실행하는 것이 이상적입니다. - 대상 폴더를 선택하여 숙련된 Ai 파일(.sai)을 저장하고 Train을 클릭하여 소프트웨어를 학습합니다. 이 소프트웨어는 이제 추적 된 바이너리에 따라 섬모를 식별하기 위해 자신을 훈련하기 위해 진행됩니다. 이 프로세스는 몇 시간이 걸립니다.
참고: 교육을 받을 때 소프트웨어에는 교육 손실을 보여주는 그래프가 표시됩니다. 그래프는 처음에 이상적으로 약 1 % 손실로 가시화하기 전에 스파이크를 표시합니다 어디 그것은 훈련의 나머지 부분에 대한 고원. 기차 Segment.ai 상자(보충 도 1)에서 그래프 화면 저장 상자에 대한 상자를 선택하여 향후 참조를 위해 그래프를저장합니다. - 교육에 대한 추가 개선이 필요한 경우 동일한 데이터 집합에 대한 교육을 계속합니다. 또는 동일한 매개 변수를 사용하여 새 데이터 집합을 학습합니다. 이미 훈련된 Ai를 서로 다른 매개 변수 또는 다양한 관심 있는 개체가 있는 새 데이터 집합에 교육하는 것은 바람직하지 않습니다. 훈련된 ai 파일을 선택하기 > 훈련을 계속하기 segment.ai > 선택합니다.
3. 숙련된 Ai를 사용하여 섬모를 식별
- 실험 데이터 집합을 엽니다.
- 샘플 .tif 파일을 2.1 단계와 유사한 .nd2 파일로 변환하여 소프트웨어에서 섬모의 실험적 공초점 이미지를 엽니다. 파일 > 가져오기/내보내기 > 파일 시퀀스에서 ND 파일 만들기를 선택합니다.
참고: 이미지는 Ai 교육에 사용되는 이미지와 동일한 픽셀 크기여야 합니다. 이미지가 이미 ND2 형식인 경우 3.3단계로 건너뜁니다.
- 샘플 .tif 파일을 2.1 단계와 유사한 .nd2 파일로 변환하여 소프트웨어에서 섬모의 실험적 공초점 이미지를 엽니다. 파일 > 가져오기/내보내기 > 파일 시퀀스에서 ND 파일 만들기를 선택합니다.
- 이미지를 보정합니다.
- 이미지의 왼쪽 아래 모서리에 픽셀 크기를 입력합니다. 픽셀 크기를 > 문서를 보정할 > 보정해제를클릭하려면 마우스 오른쪽 단추를 클릭합니다.
- 열린 파일에서 학습된 Ai를 실행합니다.
- Ai를 사용하여 섬모를 식별하기 시작합니다. 이 소프트웨어는 이제 이전 단계에서 받은 교육에 따라 섬모에 바이너리를 그립니다. 이 프로세스는 몇 초 정도 걸릴 것입니다. NIS.ai > Segment.ai선택합니다.
참고: 여러 채널이 열려 있으면 소프트웨어가 채널을 선택하라는 메시지가 표시됩니다. 채널은 해당 이름으로 나열됩니다. 그렇지 않은 경우 'Mono'로 표시된 상자가 자동으로 선택됩니다.
- Ai를 사용하여 섬모를 식별하기 시작합니다. 이 소프트웨어는 이제 이전 단계에서 받은 교육에 따라 섬모에 바이너리를 그립니다. 이 프로세스는 몇 초 정도 걸릴 것입니다. NIS.ai > Segment.ai선택합니다.
- 잘못 식별된 바이너리에 대한 이미지를 확인합니다.
- Ai가 섬모와 그려진 바이너리를 확인하면 실수로 식별된 개체가 이미지를 확인합니다. 원하는 경우 잘못 식별된 바이너리를 수동으로 삭제합니다. 개체 삭제 > 이진 도구 모음> > 분석 컨트롤 보기 를 선택합니다.
4. 섬모 길이와 강도 측정
- 새로운 일반 분석 3(GA3) 레시피를 만듭니다.
- 이제 섬모가 식별되고 세분화되었으므로 GA3 도구를 사용하여 길이 및 강도와 같은 섬모의 다양한 매개 변수를 분석합니다. 이렇게 하면 분석이 정의될 중앙에 빈 공간이 있는 새 창이 열립니다. 새로운 GA3 레시피> 이미지를선택합니다.
- 분석할 바이너리를 선택합니다.
- 섬모는 이미 Segment.ai 사용하여 분할되어 있기 때문에 GA3는 Ai에 따라 적절하게 표시된 바이너리를 자동으로 감지하고 노드를 포함합니다. '바이너리 > 자동 Detect_AI' 또는 '바이너리 > Object_AI 그리기'를선택합니다.
- 분석에 필요한 채널을 선택합니다. GA3는 또한 이미지의 채널을 자동으로 감지하고 채널아래에 탭을 표시합니다.
- 프레임 의 테두리에 닿는 오브젝트를 제거합니다.
- Ai는 프레임의 오브젝트처럼 모든 섬모를 분할하므로 프레임 가장자리를 따라 불완전한 섬모를 감지합니다. 이러한 개체는 3.4 단계에서 수동으로 제거하거나 GA3에서 자동으로 제거할 수 있습니다. 터치 테두리> 개체를 제거할 > 바이너리 처리를 선택합니다.
- 섬모를 측정하기 위해 매개 변수를 선택합니다.
- 항문길이(길이)및강도(합계 개체 강도)와같은 측정매개변수를 드래그앤드롭한다. 노드를 적절한 이진 노드(연결 A) 및 채널 노드(연결 B)에 연결합니다. 도구 설명에 대한 노드 연결 위로 마우스를 가져가노드에 속한 연결을 표시합니다. 개체 크기 > 길이 및 측정 > 개체 강도 > 합계 Obj 강도를 > 측정을 선택합니다.
참고: 노드 길이는 이진 노드에만 연결되지만 Sum Obj Intensity는 바이너리 노드와 채널 노드 모두에 연결됩니다.
- 항문길이(길이)및강도(합계 개체 강도)와같은 측정매개변수를 드래그앤드롭한다. 노드를 적절한 이진 노드(연결 A) 및 채널 노드(연결 B)에 연결합니다. 도구 설명에 대한 노드 연결 위로 마우스를 가져가노드에 속한 연결을 표시합니다. 개체 크기 > 길이 및 측정 > 개체 강도 > 합계 Obj 강도를 > 측정을 선택합니다.
- 단일 테이블에 측정값을 더합니다.
- 노드 부록 열을 분석 흐름 차트에 드래그하고 떨어뜨려 단일 출력 테이블에 모든 측정값을 결합하고 측정 노드, 길이 및 Sum Obj 강도에연결합니다. 기본 > 부록 을 > 데이터 관리선택
- 섬모를 측정합니다.
- 실행을 클릭하여 섬모를 측정합니다. 이 프로세스는 실험 이미지의 모든 섬모를 측정하는 데 몇 분 정도 걸립니다. 길이와 강도는 새 분석 결과 창에 나타납니다.
참고: 테이블에는 Ai가 섬모로 인식되었지만 인간의 눈에 의해 감지되지 않고 3.4 단계에서 제거하기에는 너무 작아진 마스크의 데이터가 포함될 수 있습니다. 이러한 개체는 통계 분석 전에 필터를 사용하여 데이터 집합에서 제거할 수 있습니다. 여기서, 생체 내 실리아용 도 2 및 2 μm에서 체외 실리아 길이 측정에 1 μm의 필터가 사용되었다. 이 작업은 아래 경로를 사용하여 데이터를 내보내기 전에 수행할 수 있습니다. 분석 결과 창을 선택하고 > 필터를 정의> 필터 를 입력 > 필터를 사용합니다.
- 실행을 클릭하여 섬모를 측정합니다. 이 프로세스는 실험 이미지의 모든 섬모를 측정하는 데 몇 분 정도 걸립니다. 길이와 강도는 새 분석 결과 창에 나타납니다.
- 통계 분석을 위해 데이터를 내보냅니다.
5. 지역화 연구
참고: 지역화 분석은 섬모 길이 및 강도 분석 의 측정에 사용되는 동일한 GA3 레시피에 포함될 수 있습니다. 아래에 설명된 것과 동일한 레시피를 사용하는 경우 파일을 열고 동일한 분석 파이프라인의 지역화 계수와 함께 두 채널의 길이와 강도를 측정합니다.
- 실험 데이터 집합을 엽니다.
- 샘플 .tif 파일을 .nd2 파일로 변환하여 소프트웨어에서 섬모의 실험적 공초점 이미지를 엽니다. 파일 > 가져오기/내보내기 > 파일 시퀀스에서 ND 파일 만들기를 선택합니다.
- 팝업 창에서 팝업 창의 첫 번째 열에 있는 창 탐색기의 모든 관심 채널에서 16비트 깊이 흑백 파일을 선택합니다. 첫 번째 드롭다운 메뉴에서 멀티포인트 또는 Z 시리즈를 선택하고 총 이미지 또는 스택 수에 해당하는 값을 각각 입력합니다.
- 두 번째 드롭다운 상자에서 파장을 선택하고 값을 폴더의 총 채널 수로 변경합니다. 이 소프트웨어는 자동으로 팝업 창의 오른쪽 하단에있는 파장 선택 창의 잠금을 해제합니다. 색상 드롭 다운 메뉴를 사용하여 각 채널의 색상을 선택합니다. 각 채널에 이름 열 아래에 다른 이름을 제공합니다. 모든 정보가 업데이트되면 변환을클릭합니다. 이 소프트웨어는 선택한 모든 채널의 모든 개별 이미지와 오버레이된 모든 이미지 파일을 자동으로 생성합니다.
- 이미지를 보정합니다.
- 이미지의 왼쪽 아래 모서리에 픽셀 크기를 입력합니다. 픽셀 크기를 > 문서를 보정할 > 보정해제를클릭하려면 마우스 오른쪽 단추를 클릭합니다.
- 첫 번째 채널에서 숙련된 Ai를 실행합니다.
- 열린 채널 중 하나에서 섬모 를 식별하기 시작하십시오 (예 : ACIII; 그림 5A) Ai를 사용하더라. 이 소프트웨어는 이제이 채널에 대해 받은 교육을 기반으로 ACIII 라벨 섬모에 바이너리를 그릴 것입니다. 이 프로세스는 몇 초 정도 걸릴 것입니다. NIS.AI > SEGMENT.AI > 원본 채널을 > ACIII를 선택합니다.
- 두 번째 채널에서 숙련된 Ai를 실행합니다.
- 다른 열린 채널(예: MCHR1)에서 섬모 식별을 시작합니다. 그림 5B) Ai를 사용하더라. 이 소프트웨어는 이제이 채널에 대해 받은 교육을 기반으로 MCHR1 라벨 섬모에 바이너리를 그릴 것입니다. 이 프로세스는 잠시 걸릴 것입니다. MCHR1> NIS.ai > Segment.ai > 소스 채널을 선택합니다.
- 잘못 식별된 바이너리에 대한 이미지를 확인합니다.
- Ai가 섬모와 그려진 바이너리를 확인하면 이미지가 잘못 식별된 개체에 대해 확인합니다. 필요한 경우 잘못 식별된 바이너리를 수동으로 삭제합니다. 개체 를 삭제하기 > 바이너리 도구 모음> > 분석 컨트롤 보기를 선택합니다.
- 새로운 GA3 레시피를 만듭니다.
- 이제 섬모가 식별되고 세분화되었으므로 GA3 도구를 사용하여 공동 지역화 분석을 진행합니다. 이렇게 하면 분석이 정의될 중앙에 빈 공간이 있는 새 창이 열립니다. 식별된 모든 바이너리 및 채널이 있는 창이 생성됩니다. 분석에 필요한 모든 원하는 채널과 바이너리가 존재하고 선택되었는지 확인합니다. 새로운 GA3 레시피> 이미지를선택합니다.
- 프레임 의 테두리에 닿는 오브젝트를 제거합니다.
- Ai는 프레임의 모든 섬모와 같은 오브젝트를 분할하므로 프레임 가장자리를 따라 불완전한 섬모를 감지합니다. 이러한 개체는 5.5 단계에서 수동으로 제거하거나 GA3에서 자동으로 제거할 수 있습니다. 접기 테두리를 > 개체를 제거할 > 바이너리 처리를 선택합니다.
- GA3에 지역화 경로를 설정합니다.
- 섬모 내의 두 채널의 중복을 측정하려면 Mander의 계수 상관 관계를 사용합니다. Manders 계수 노드를 GA3 레시피의 빈 공간으로 드래그하고 놓고 적절한 바이너리 및 채널에 연결합니다. 여기서 '연결 A'는 ACIII 바이너리, MCHR1 채널과 '연결 B', ACIII 채널과 '연결 C'를 연결하여 ACIII 바이너리 내에서 MCHR1의 중복을 결정합니다. 측정 > 오브젝트 비율 측정 > 만더계수를 선택합니다.
참고: 이 소프트웨어는 이프로토콜(40)에설명된 것과 동일한 단계를 사용하여 Pearson 계수 상관관계를 사용하여 지역화를 측정할 수 있습니다.
- 섬모 내의 두 채널의 중복을 측정하려면 Mander의 계수 상관 관계를 사용합니다. Manders 계수 노드를 GA3 레시피의 빈 공간으로 드래그하고 놓고 적절한 바이너리 및 채널에 연결합니다. 여기서 '연결 A'는 ACIII 바이너리, MCHR1 채널과 '연결 B', ACIII 채널과 '연결 C'를 연결하여 ACIII 바이너리 내에서 MCHR1의 중복을 결정합니다. 측정 > 오브젝트 비율 측정 > 만더계수를 선택합니다.
- 단일 테이블에 측정값을 더합니다.
- 모든 측정값을 단일 출력 테이블에 결합합니다. 기본 > 부록 을 > 데이터 관리선택
- 공동 지역화를 측정합니다.
- 실행을 클릭하여 섬모를 측정합니다. 이 프로세스는 실험 이미지의 모든 섬모를 측정하는 데 몇 분 정도 걸립니다. 데이터는 새 분석 결과 창에 나타납니다.
- 통계 분석을 위해 데이터를 내보냅니다.
결과
섬모를 식별하기 위해 Ai 교육
섬모 구조 길이및 조성물을 측정하고 평가하는 것은 지루하고 시간이 많이 걸리며 오류가 발생하기 쉬운 과정이 될 수 있습니다. 여기서는 Ai를 사용하여 큰 이미지 풀에서 섬모를 정확하게 분할하고 분석도구(그림 1)로길이와 강도를 분석합니다. 모든 Ai 접근 방식에는 구현을 위한 교육 단계가 필요합니다. 우리는 섬모 구조에 이진 마스크를 수동으로 적용하여 수행 된 섬모를 인식하는 교육 파이프 라인을 설립했습니다. 그런 다음 이 정보는 적용된 바이너리 아래의 픽셀 특성에 따라 Ai를 학습하는 데 사용됩니다. 일반적인 지침으로, 교육은 몇 가지 반복을 통해 가는 소프트웨어를 포함, 약 1000, 교육 손실 또는 오류 비율이 미만 경우 최적의 것으로 간주됩니다 1% 미만. 그러나 교육 프로세스의 반복 및 오류 수는 학습에 사용되는 샘플 이미지에 따라 달라질 수 있습니다. 예를 들어, 시험관 내 신경 섬모 이미지를 사용하여 훈련 세션 후, 오차율은 생체 내 뇌 단면 이미지(보충도 1)의경우 3.36%와 비교하여 1.378%였다. 교육이 완료되면 Ai를 사용하여 실험 이미지에서 섬모를 몇 초 이내에 분할할 수 있으며, 그 결과 이진 마스크는 구조적 파라미터를 측정하는 데 사용됩니다. 이렇게 하면 배경 노이즈가 높거나 개체가 서로 가까이 있는 이미지에서 어려울 수 있는 기존의 강도 임계값을 사용하여 객체를 분할할 필요가 없습니다. 또한 Ai는 사용자에 관계없이 모든 이미지에 동일한 알고리즘을 적용하여 오류 및 바이어스 가능성을 줄입니다.
GA3를 사용하여 섬모 길이 측정
섬모 길이는 엄격하게 조절되며 섬모 신호16,19에기능적 영향과 관련이 있다. 여기서는 일반 분석 3 또는 GA3라는 NIS Elements 소프트웨어 내의 분석 파이프라인을 사용하여 섬모 길이를 측정했습니다. GA3는 단일 워크플로우에 여러 도구를 결합하여 각 실험에 맞게 사용자 지정된 루틴을 빌드하는 데 도움이 됩니다. 우리는 세포주에서 섬모 길이를 측정하여 시작했습니다. 마우스 내부 수질 수집 덕트(IMCD-3) 세포에 대한 섬모는 아세틸화된 튜불린으로 면역 라벨을 부착하고 공초점 현미경을 사용하여 이미지화하였다. segment.ai(보충도 3A)로분할한 후 GA3를 사용하여 섬모 길이를 측정했습니다. 아세틸화된 α-튜룰린이 1차 실륨에서 우선적으로 발견되는 반면, 사이토칼레스톤과 사이토카네틱 브리지와 같은 다른 미세조절이 풍부한 지역에서도 발견된다. 훈련된 Ai는 이미지에서 섬모를 제대로 식별했지만 다른 비 섬모, 아세틸화된 튜룰린 양성 구조는 식별하지 못했습니다. IMCD 세포의 섬모는 0.5 μm에서 4.5 μm까지, 평균 길이는 1.8± 0.04 μm(그림2A)이었다. 우리는 다음 1 차적인 신경 배양에 있는 섬모 길이를 측정하는 Ai의 기능을 시험했습니다. 우리는 10 일 동안 신생아 마우스의 시상 하부 및 해마에서 뉴런을 배양하고 cilia 마커 adenylate cyclase III (ACIII) III (ACIII)21, 41로그들을 면역 라벨. 신경 배양을 분석할 때, 우리는 통계적으로 길이를 분석하기 전에 필터를 적용하는 것이 유용한다는 것을 것을을 발견했습니다. 신호 대 노이즈 비율이 낮기 때문에 1 μm 미만의 여러 물체가 섬모가 아닌 것으로 확인되었습니다. 따라서 데이터를 필터링하여 길이가 1μm 미만인 물체를 제거하여 섬모만 분석되도록 했습니다. 배양 시상 하 부 뉴런에서, 섬모 길이는 3.8 ± 0.19 μm(그림 2B)의평균 길이와 2 μm에서 7 μm에 구역 수색했다. 흥미롭게도, 배양 해마 뉴런 섬모는 평균 길이 6.73 ±0.15μm(도2C)로더 길어졌다. 시상 하부 내의 다른 뉴런 핵은 별개의 섬모 길이를 나타내며 이러한 섬모가 핵 특이적방식(19,23)의생리적 변화에 대응하여 길이를 변경하는 것으로 보고되었다. 따라서, 우리는 또한 ACIII를 가진 성인 남성 C57BL/6J 마우스에서 시상하부 뇌 단면을 표시하고 아크추아테 핵 (ARC) 및 심방 핵 (PVN)을 심화시켰다. CI3를 사용하여 섬모 길이를 측정하기 위해 생체 내 시상 하 부 섬혈이 체외 섬모보다 더 오래 나타났다는 것을 관찰했습니다. 구체적으로, 생체 내의 시상하액 섬모는 1 μm에서 약 15 μm(그림3)까지다양합니다. PVN(5.54 ± 0.0.42 μm)과 ARC(6.16 ± 0.27 μm)의 섬모 길이와ARC(그림 3C)23의섬모 길이 사이에는 큰 차이가 없었다. 유사하게, 해마의 각막 암모니(CA1) 부위내 의 섬모는 평균 길이 5.28± 0.33 μm(그림3)을가진 1 μm에서 10 μm까지 의 좁은 길이 범위를 나타낸다. 이전에 발표된 연구에 따르면 Ai 및 GA3 도구를 사용한 당사의 분석에 따르면 다양한 뇌 영역의 섬모가길이 19,23의다양성을 보이는 것으로 나타났습니다. 또한,이 Ai 접근 방식을 사용하여 우리는 신속하게 섬모의 큰 숫자를 평가 할 수 있습니다.
GA3를 사용하여 섬모 조성 측정
1차 실륨은 모터 단백질, 인트라티글러 수송 단백질 및 GPCR과 같은 독특한 기능을 수행하기 위해 다양한 유형의 단백질을 활용하는 많은 통로를 위한 신호 허브로, 몇 가지3,24,42,43의이름을 지정합니다. 실륨 내에서 이러한 단백질의 적절 한 수준을 유지 하는 것은 적절 한 기능에 대 한 중요 하 고 종종 세포 컨텍스트 의존 나타납니다. 이러한 단백질의 형광 라벨링은 우리가 그(것)들을 시각화하는 것을 가능하게 할 뿐 아니라 또한 상대적으로 작은 구획20내의 표지된 단백질의 양을 측정하기 때문에 그들의 강도를 정량화하는 가능하게 했습니다. 따라서, 우리는 성인 남성 마우스의 시상 하부(24)및44의ARC 와 PVN 모두에서 생체 내에서 섬모 GPCR, 멜라닌 농축 호르몬 수용체 1 (MCHR1)의 강도를 결정하기 위해 노력했다. Ai 와 GA3를 사용하여, 우리는 계산되는 개체가 섬모(보충 도 3A)인지확인하기 위해 강도와 함께 MCHR1 양성 섬모의 길이를 측정했다. 우리는 길이가 2 μm 미만인 분석 후 물체를 제거하고 남은 이진 마스크의 강도를 분석했습니다. 흥미롭게도, PVN에서 섬모 MCHR1의 강도가 PVN에서 섬모 MCHR1의 강한 존재를 나타내는 ARC에서보다 훨씬 높다는 것을 발견했습니다(그림 4). 추가 연구는 이러한 신경 회로에서 섬모 MCHR1의 중요성을 결정 하는 데 필요한. 우리는 또한 시상 하 부와 해 마의 기본 배양 뉴런에서 섬모 MCHR1의 강도를 측정. 두 배양으로부터의 섬모는 이종성 뉴런 집단의 존재를 암시하는 MCHR1 강도의 광범위한 분포를 나타내고있다(보충도 2). 따라서 Ai 및 GA3와 같은 정교한 분석 도구를 사용하면 동일한 조직 내 또는 다중 조직 간의 섬모 이질성을 평가할 수 있습니다. 다른 신경 GPCRs 같은 조직의 뉴런 내에서 그들의 국소화에 비슷한 차이 표시 하는 경우 보고 재미 있을 것입니다 그리고이 생리적 변화에 대 한 응답으로 변경 하는 경우.
지역화
완전한 화상 필드 내에서 형광 강도를 측정하는 것은 단백질의 인상을 줄 수 있지만, 공간 분포 또는 다른 인근 단백질 및 세포 구조에 근접과 같은 정보를 제공하지 못합니다. 여기서, 각 이진 마스크에 대한 ACIII의 강도에 대하여 MCHR1의 강도를 플로팅하여 ACIII와 ACIII와 MCHR1의 중첩을 측정하였다(도5). 그래프는 대부분의 섬모가 ACIII와 MCHR1 모두에 대해 긍정적이라는 것을 보여 주지만 일부 섬모는 한 채널의 더 강한 표현을 서로 보여줍니다. 또한 각각 x축과 y축에 직접 있는 지점에서 알 수 있듯이 ACIII 또는 MCHR1의 존재를 보여주는 일부 섬모가 있습니다. 이러한 중첩을 정량화하기 위해, 우리는 Mander의 중첩 계수를 측정하고 ARC 및 PVN40의신경 섬모에서 MCHR1 발현의 정도를 비교했습니다. 흥미롭게도, 우리의 분석은 ARC (0.5430 ± 0.0181)(그림 5C)에있는 것보다 PVN (0.6382 ± 0.0151)의 계수에 있는 중요한 증가가 있었다는 것을 밝혔습니다. 이는ARC(그림 4)에비해 PVN에서 MCHR1 강도가 높은 것을 관찰한 이전 데이터와 일치합니다. 이 데이터는 섬모 길이같이, 섬모 구획에 있는 MCHR1의 발현 패턴이 두뇌의 다른 지구에 변화한다는 것을 건의합니다. 동일한 분석 파이프라인을 사용하여, 신경펩타이드 Y 수용체 유형 2(NPY2R) 및 소마토스타틴 수용체 유형 3(SSTR3)와 같은 다른 섬모GPC가 비슷한 양의 다양성을 보이는지 여부를 결정할 수 있을 것이다.
실륨을 따라 강도 프로파일 측정
segment.ai 사용하여 섬모가 확인되면 GA3 레시피를 수정하여 섬모 분석을 이미지에 대한 다른 관심 구조를 식별하도록 수정할 수 있습니다. 예를 들어, 기초 바디 마커로 라벨링은 섬모 극성을 식별하는 데 유용합니다. 이러한 분석을 수행하기 위해, 우리는 ARL13B-mCherry및 Centrin2-GFP를 발현하는 P0 마우스의 시상 하부 뇌 섹션을 이미지화하고 ARC 및 PVN34를이미지화하였다. 여기서, 섬모는 Ai를 이전과 같이 확인했지만, 지금 수정된 GA3 레시피는 섬모의 기지에서 발견되는 센트리올라 단백질인 Centrin2-GFP의 식별을포함한다(보충 도 3B). Centrin2-GFP를 표시함으로써, 섬모의 기초는 ARL13B-mCherry 양성 섬리아(그림 6A)의끝과 구별 될 수있다. 그런 다음, 전체 섬모 내에서 강도를 측정하는 대신, 우리는 섬모의 길이를 따라 ARL13B 강도의 변화를 측정 할 수 있습니다(그림 6B). 우리는 또한 Cilia의 근위 끝과 말단 끝 사이의 ARL13B의 강도의 차이를 비교할 수 있습니다. 이를 위해, 우리는 베이스에서 시작하여 1 미칸 쓰레기통으로 실륨 길이를 분할하고 첫 번째 미크로른 빈을 근위 말단으로 지정하고 마지막 미크로른 빈을 말단 끝으로 지정했습니다. 우리의 분석은 ARC와 PVN 둘 다에 있는 cilium의 끝 보다는 기지에 훨씬 더 많은 ARL13B가 존재한다는 것을 밝혔습니다, 이것은 인간 연골세포(그림 6C)에이전에 간행된 연구 결과와 일치한다는 것을 제시했습니다. 이러한 유형의 분석에서는 작은 비섬모개체를 분석에서 제외하기 위해 길이 필터를 적용하는 대신 Centrin2-GFP 라벨링과 관련된 섬모만 분석됩니다. 이것은 유전 돌연변이가 아주 짧은 섬모를 렌더링하는 상황에서 유리할 수 있습니다, 또는 전환 영역 또는 팁 같이 섬모 하위 도메인에 있는 변경이 연루된 경우에. Ai 및 GA3 분석을 사용하여 섬모를 식별하는 것은 적응력이 뛰어나며 다양한 복잡한 연구 질문에 맞게 조정할 수 있습니다.
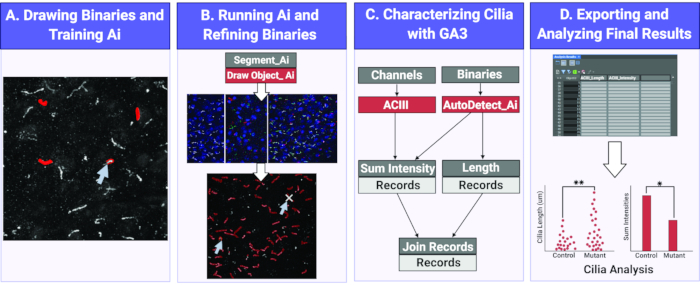
그림 1. Ai를 사용하여 섬모 길이와 강도를 측정하기위한 워크플로우. (A)Ai를 훈련시키기 위해, 원시 훈련 이미지에 관심있는 개체 (섬모)주위에 바이너리가 그려집니다. 분할 Ai는 그려진 바이너리를 사용하여 섬모의 모양과 픽셀 강도를 인식하도록 훈련됩니다. (B)다음으로, 훈련된 세그먼트 Ai가 원시 실험 이미지에 적용됩니다. 그것은 섬모로 인식 개체에 바이너리를 그립니다. 이 바이너리는 모든 섬모만 분석되고 있는지 확인하기 위해 정제 될 수 있습니다. (C)GA3 프로그램은 Ai에서 인식하는 물체의 강도와 길이를 분석하기 위해 제작된다. (D)레코드는 소프트웨어의 테이블로 가져옵니다. 그런 다음 이 테이블을 내보내 추가 분석을 할 수 있습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 2. 체외 실리아 길이 측정. 섬모의 대표적인 이미지 (A)IMCD 세포 (녹색, 아세틸레이션 튜룰린)(B)1 차 시상 하 계 배양 (녹색, ACIII) 및(C)해마 배양 (녹색, ACIII). 훈련된 Ai는 이진 마스크(magenta)에 도시된 바와 같이 섬모를 인식하는 데 사용되었고 GA3는 섬모 길이를 측정하는 데 사용되었다. 섬모 길이의 분포는 0.5 또는 1.0 미크론 쓰레기통에서 섬모의 백분율로 그래프로 표시됩니다. * Ai가 제대로 인식하지 못하는 사이토카네틱 다리를 나타냅니다. 3개의 복제에서 IMCD 세포에 있는 n=225 섬모, 시상 하부에서 54개의 섬모및 3마리동물에서 해마 배양에 있는 139개의 섬모. 10 μm 의 배율 막대. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
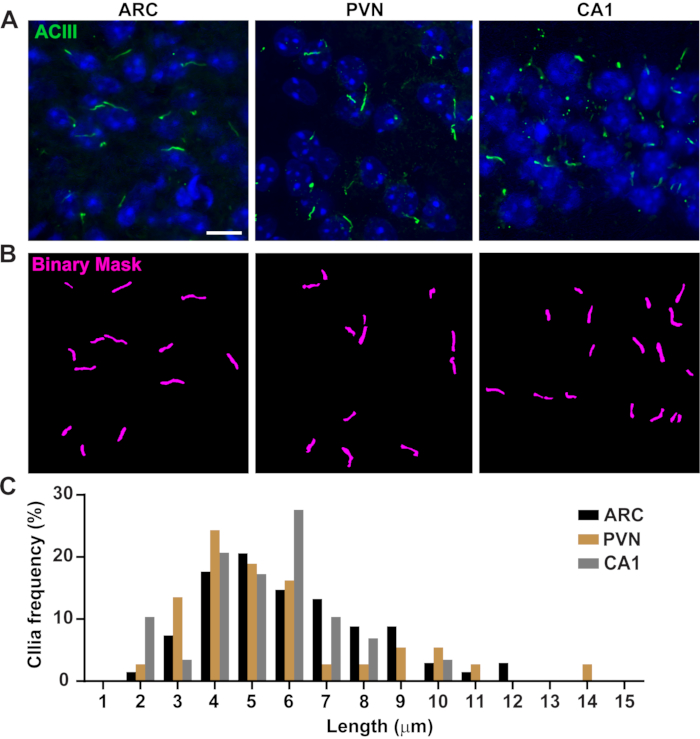
그림 3. 생체 내 섬모 길이 측정. (A)성인 마우스 뇌 섹션의 ARC, PVN 및 CA1에서 섬모(녹색, ACIII)의 대표적인 이미지. (B)NIS 엘리먼트에서 훈련된 Ai는 이진 마스크(magenta)에 도시된 바와 같이 섬모를 인식하는 데 사용되었고, 그 후 GA3는 섬모 길이를 측정하는 데 사용되었다. (C)섬모 길이의 분포는 1미크론 쓰레기통에서 섬모의 백분율로 그래프로 표시됩니다. 아크에서 68개의 섬모, PVN에서 36개, CA1에서 29마리가 3마리의 동물입니다. 10 μm 의 배율 막대. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
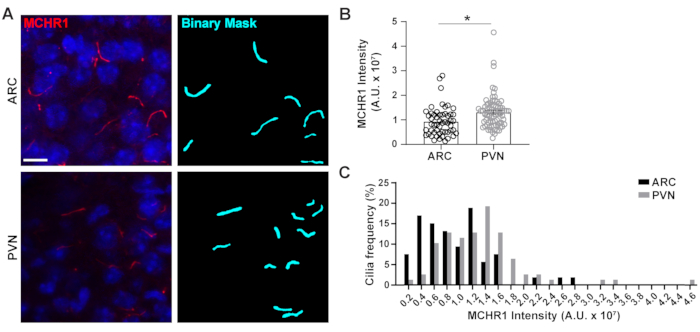
그림 4. Ai는 시상 하 부 신경 섬모의 섬모 염색 강도 측정을 지원. (A)성인 마우스 뇌 섹션의 ARC 및 PVN에서 섬모(MCHR1, red)의 대표적인 이미지. NIS 엘리먼트의 숙련된 Ai는 이진 마스크(시안)에 도시된 바와 같이 섬모를 인식하는 데 사용되었고 GA3는 CIlia에서 염색하는 MCHR1의 강도를 측정하는 데 사용되었습니다. (B)MCHR1 강도는 평균 ± S.E..M 그래프로 표시됩니다. 각 점은 실륨을 나타냅니다. * p < 0.05, 학생의 t 테스트. (C)MCHR1 강도의 분포는 0.2 x 107 임의 단위(A.U.)의 쓰레기통에서 섬모의 백분율로 그래프화됩니다. 아크에서 n = 53 섬모, 3 동물에서 PVN에서 78. 10 μm 의 배율 막대. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
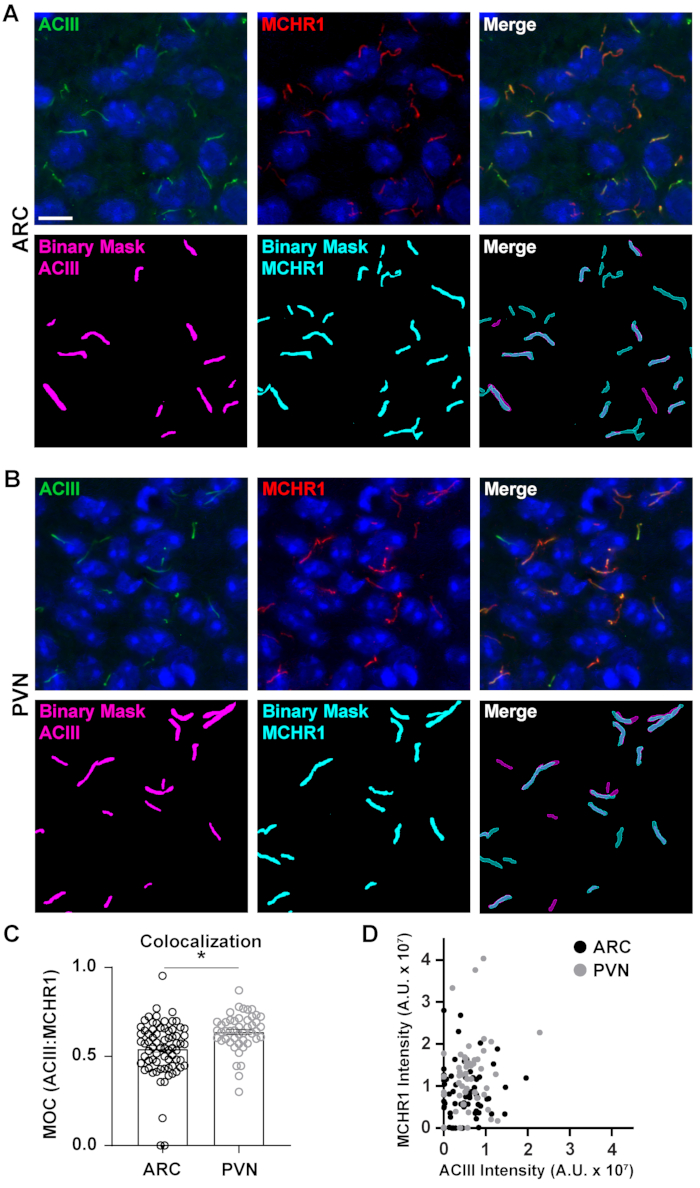
그림 5. Ai는 섬모 공동 분석 분석을 지원했습니다. (A, B) 각각 ARC 및 PVN에서 섬모의 대표적인 이미지. Cilia는 ACIII(녹색) 및 MCHR1(빨간색)으로 표시됩니다. NIS 엘리먼트의 훈련된 Ai는 이진 마스크(ACIII 라벨에 표시된 섬모의 마젠타, MCHR1 라벨이 붙은 섬모용 시안)에 표시된 것처럼 섬모를 인식하는 데 사용되었습니다. GA3는 ACIII와 MCHR1을 모두 포함하는 섬모를 인식하는 데 사용되었습니다. (C)Manders 중첩 계수 (MOC) 값은 평균 ± S.E.M 로 그래프화됩니다. 각 점은 실륨을 나타냅니다. * p < 0.05, 학생의 t 테스트. (D)ARC 및 PVN에서 MCHR1 강도 대 ACIII 강도의 분산 플롯. 각 점은 실륨을 나타냅니다. 아크에서 72 개의 섬모, 3 마리의 동물에서 PVN에서 47. 10 μm 의 배율 막대. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
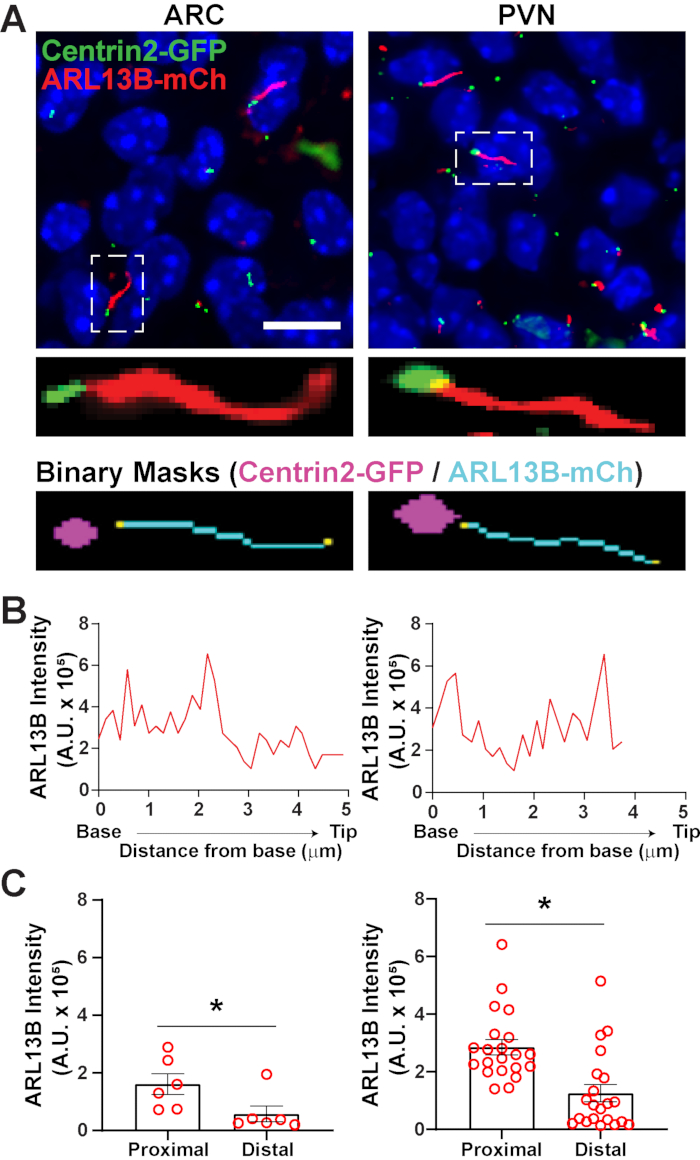
그림 6. 섬모와 기초 신체 분석. (A)P0 마우스의 ARC 및 PVN에서 섬모(빨간색, ARL13B-mCherry) 및 기초 체체 마커(녹색, Centrin2-GFP)의 대표적인 이미지. 훈련된 Ai는 이진 마스크(시안)에 도시된 바와 같이 섬모를 인식하는 데 사용되었다. 기초 체체 (마젠타)에 대한 바이너리 마스크는 GA3 레시피의 임계값에 의해 그려졌습니다. (B)주실의 대표 라인 스캔 강도. (C)Ai의 근해 및 단부 끝에서 ARL13B 강도는 평균 ± S.E.M로 그래프를 식별하였다. 근위 및 단부 단말은 실륨의 기저로부터 각각 첫 1 μm 길이 및 마지막 1 μm 길이 내의 영역으로 정의된다. 각 점은 실륨을 나타냅니다. * p < 0.05. n = 3 마리동물로부터 2마리의 동물과 21마리의 섬모에서 ARC에서 6개의 섬모. 10 μm 의 배율 막대. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
보충 도 1. Ai 훈련 손실 그래프. (A, B)시험관 내 및 생체 내 뉴런 섬모에 대한 segment.ai 훈련 손실을 각각 보여주는 그래프. 이 파일을 다운로드하려면 여기를 클릭하십시오.
보충 도 2. Ai 는 체외 신경 섬모의진도 측정을 염색하는 것을 지원했습니다. (A, B) 1 차시 상하 및 해마 배양에서 섬모 (MCHR1, 빨간색)의 대표적인 이미지, 각각. NIS 엘리먼트의 숙련된 Ai는 이진 마스크(시안)에 도시된 바와 같이 섬모를 인식하는 데 사용되었고 GA3는 CIlia에서 염색하는 MCHR1의 강도를 측정하는 데 사용되었습니다. MCHR1 강도의 분포는 시상 하 증에 대 한 1000 A.U. 쓰레기통에 섬모의 백분율로 그래프와 2000 해 마 문화에 대 한 A. U. 쓰레기통. n= 시상 하 증에 있는 30 개의 섬모와 3 마리의 동물로부터 해마 배양에서 106 개의 섬모. 10 μm 의 척도 막대. 이 파일을 다운로드하려면 여기를 클릭하십시오.
보충 도 3. 일반 분석 3 섬모 분석을위한 조리법. (A)섬모 길이, 강도 및 맨더계수의 측정을 위한 간단한 일반 분석(GA3) 레시피. (B)기초 체체에 대한 마커를 사용하여 실륨의 길이를 따라 강도를 측정하기 위한 복잡한 GA3 레시피. 이 파일을 다운로드하려면 여기를 클릭하십시오.
토론
길이 및 강도 측정은 1차 섬모를 분석하는 일반적인 방법이지만, 현장에서 사용되는 표준화된 종래의 방법은 없다. ImageJ와 같은 소프트웨어를 사용하여 기본 섬모를 식별하고 정량화하는 것은 시간이 많이 걸리며 사용자 편향및 오류가 발생하기 쉽습니다. 따라서 대규모 데이터 집합을 정확하게 분석하기가 어렵습니다. 여기서 우리는 Ai 프로그램을 사용하면 1 차 섬모의 높은 처리량 분석을 달성 할 수있는 이러한 도전의 대부분을 극복 할 수 있음을 보여줍니다. 여기서 우리는 기본 섬모를 인식하고 길이와 강도를 분석하는 데 필요한 단계를 설명하기 위해 Ai 기반 응용 프로그램을 교육하는 절차를 설명합니다.
Cilia를 인식하는 Ai의 초기 교육은 사용자의 상당한 시간이 필요하지만 완료되면 동일한 매개 변수로 획득한 모든 데이터 집합에 사용할 수 있습니다. Ai에 의해 생성된 이진 마스크는 수정할 수 있도록 모든 오류를 수정할 수 있습니다. 그러나 cilia 식별오류는 Ai가 추가 이미지로 더 자세히 교육되어야 한다는 신호를 사용자에게 표시해야 합니다. 이 방법의 한 가지 주요 장점은 Ai가 2D 및 3D 모두에서 다른 샘플 유형에서 섬모를 인식하도록 훈련될 수 있다는 것입니다. 실험실 내에서 생성된 이전 분석 방법은 세포 밀도가 높은 조직 섹션에서 이미지된 섬모를 식별하는 식별 및 식별을 위한 수동 임계값을 요구하는 것을 포함하여 다양한 한계를 갖는다36,46,47. 이러한 방법은 CIlia 분석을 전문으로 하는 반면 NIS Elements 소프트웨어를 사용한 분석은 이미지의 여러 측면을 동시에 평가할 수 있습니다. 여기에 설명된 Ai는 NIS Elements 소프트웨어 패키지의 일부이기 때문에 니콘 현미경을 사용하여 획득한 이미지는 분석을 통해 쉽게 계속될 수 있습니다. 그러나, Nikon와 화상 진찰은 이 방법의 사용을 위해 필요하지 않습니다. 캡처된 원시 데이터 파일 형식에 관계없이 NIS Elements에서 ".tif" 파일을 열어 Ai에서 사용할 수 있습니다.
NIS Elements 내의 이 Ai 응용 프로그램은 기본 섬모를 연구하는 실험실에서 사용할 수 있는 이미지 분석 소프트웨어의 일부로 널리 사용되고 있습니다. Ai 기술의 보급이 확대되면서 다른 이미징 소프트웨어는 유사한 Ai 모듈을 포함하도록 분석 옵션을 확장할 수 있습니다. 섬모 식별에 Ai 분석을 적용하는 것은 섬모 분석의 여러 가지 측면에 사용할 수 있습니다. 길이(도 2 및 3),강도(도4)및 지역화(도5)와같은 몇 가지 간단한 분석을 위한 방법을 설명했지만, 도 6에서와 같이 GA3 분석 워크플로우에 보다 정교한 분석을 추가할 수 있다. 예를 들어 완전한 실륨의 강도를 측정하는 대신, 실륨의 하위 영역 내의 강도 차이는 하위 섬 지역화를 평가하는 데 관심이 있을 수 있습니다. 실륨의 하위 영역 내의 강도 차이는 글리단백질이섬모(48)의끝에서 어떻게 농축되는지 와 같은, 질륨의 끝 또는 기저에 단백질이 축적되고 있음을 나타낼 수 있다. 또한, 본 Ai 응용 프로그램은 유전자형 또는 치료 단 간의 차이를 쉽게 식별하는 데 사용할 수 있습니다. 우리의 실험실은 주로 뇌 섹션 또는 신경 배양에서 이미지 된 섬모를 분석하기 위해이 방법을 사용하는 동안, 그것은 다양한 세포주 또는 다른 조직 유형에서 획득 된 이미지에 적용 할 수 있습니다. 이 응용 프로그램에서 사용할 수 있는 샘플 유형의 유연성은 미토콘드리아, 핵 또는 ER와 같이 평가되는 1 차적인 섬모 또는 임의의 개별 기관을 공부하는 많은 다른 단에 대한 분석의 이 방법을 가치 있게 만듭니다.
공개
공동 저자 웨슬리 루이스는 니콘의 직원입니다. 재정 적 공개는 없습니다.
감사의 말
이 작품은 NFB에 당뇨병과 소화 및 신장 질환 R01 DK114008및 RB에 #18PRE34020122 미국 심장 협회 펠로우십 보조금의 국립 연구소에 의해 투자되었다. 니콘 소프트웨어, 멜리사 벤틀리, 코트니 헤이크래프트, 테레사 마스트라치의 리치 그루스킨 총괄 매니저에게 원고에 대한 통찰력 있는 의견을 감사드립니다.
자료
| Name | Company | Catalog Number | Comments |
| Intel Xeon, 3.6 GHz, 32GB RAM | Intel Corporation | W-2123 | Processor used for running NIS Elements. |
| Nikon Elements Software | Nikon Instruments Inc. | - | Ai and GA3 software |
| Quadro RTX 4000 Graphics card | NVIDIA Corporation | Quadro RTX 4000 | |
| Windows 10 Professional 64-bit | Microsoft Inc. | - | Operating system used for running NIS Elements |
| Workstation | HP Development Company, L.P. | HP Z4G4 | Workstation used for running NIS Elements |
참고문헌
- Wang, L., et al. Ciliary gene RPGRIP1L is required for hypothalamic arcuate neuron development. JCI Insight. 4 (3), (2019).
- Siljee, J. E., et al. Subcellular localization of MC4R with ADCY3 at neuronal primary cilia underlies a common pathway for genetic predisposition to obesity. Nature Genetics. 50 (2), 180-185 (2018).
- Davenport, J. R., et al. Disruption of intraflagellar transport in adult mice leads to obesity and slow-onset cystic kidney disease. Current Biology. 17 (18), 1586-1594 (2007).
- Berbari, N. F., O'Connor, A. K., Haycraft, C. J., Yoder, B. K. The primary cilium as a complex signaling center. Current Biology. 19 (13), 526-535 (2009).
- Walz, G. Role of primary cilia in non-dividing and post-mitotic cells. Cell Tissue Research. 369 (1), 11-25 (2017).
- Nachury, M. V., Mick, D. U. Establishing and regulating the composition of cilia for signal transduction. Nature Reviews. Molecular Cell Biology. 20 (7), 389-405 (2019).
- Goetz, S. C., Anderson, K. V. The primary cilium: a signalling centre during vertebrate development. Nature Reviews Genetics. 11 (5), 331-344 (2010).
- Engle, S. E., Bansal, R., Antonellis, P. J., Berbari, N. F. Cilia signaling and obesity. Seminars in Cell and Developmental Biology. , (2020).
- Reiter, J. F., Leroux, M. R. Genes and molecular pathways underpinning ciliopathies. Nature reviews. Molecular Cell Biology. 18 (9), 533-547 (2017).
- Waters, A. M., Beales, P. L. Ciliopathies: an expanding disease spectrum. Pediatric Nephrology. 26 (7), Berlin, Germany. 1039-1056 (2011).
- Hildebrandt, F., Benzing, T., Katsanis, N. Ciliopathies. New England Journal of Medicine. 364 (16), 1533-1543 (2011).
- Vaisse, C., Reiter, J. F., Berbari, N. F. Cilia and Obesity. Cold Spring Harbor Perspectives in Biology. 9 (7), (2017).
- Berbari, N. F., et al. Leptin resistance is a secondary consequence of the obesity in ciliopathy mutant mice. Proceedings of the National Academy of Sciences of the United States of America. 110 (19), 7796-7801 (2013).
- Jacobs, D. T., et al. Dysfunction of intraflagellar transport-A causes hyperphagia-induced obesity and metabolic syndrome. Disease Models & Mechanisms. 9 (7), 789-798 (2016).
- Arsov, T., et al. Fat aussie--a new Alström syndrome mouse showing a critical role for ALMS1 in obesity, diabetes, and spermatogenesis. Molecular Endocrinology. 20 (7), 1610-1622 (2006).
- Tam, L. W., Ranum, P. T., Lefebvre, P. A. CDKL5 regulates flagellar length and localizes to the base of the flagella in Chlamydomonas. Molecular Biology of the Cell. 24 (5), 588-600 (2013).
- Rajagopalan, V., Subramanian, A., Wilkes, D. E., Pennock, D. G., Asai, D. J. Dynein-2 affects the regulation of ciliary length but is not required for ciliogenesis in Tetrahymena thermophila. Molecular Biology of the Cell. 20 (2), 708-720 (2009).
- Bengs, F., Scholz, A., Kuhn, D., Wiese, M. LmxMPK9, a mitogen-activated protein kinase homologue affects flagellar length in Leishmania mexicana. Molecular Microbiology. 55 (5), 1606-1615 (2005).
- Han, Y. M., et al. Leptin-promoted cilia assembly is critical for normal energy balance. Journal of Clinical Investigation. 124 (5), 2193-2197 (2014).
- Caspary, T., Marazziti, D., Berbari, N. F. Cilia: Methods and Protocols. Satir, P., Tvorup Christensen, S. , Springer. New York. 203-214 (2016).
- Bishop, G. A., Berbari, N. F., Lewis, J., Mykytyn, K. Type III adenylyl cyclase localizes to primary cilia throughout the adult mouse brain. Journal of Comparative Neurology. 505 (5), 562-571 (2007).
- Domire, J. S., Mykytyn, K. Markers for neuronal cilia. Methods in Cell Biology. 91, 111-121 (2009).
- Sun, J. S., et al. Ventromedial hypothalamic primary cilia control energy and skeletal homeostasis. Journal of Clinical Investigation. 131 (1), (2021).
- Berbari, N. F., Johnson, A. D., Lewis, J. S., Askwith, C. C., Mykytyn, K. Identification of ciliary localization sequences within the third intracellular loop of G protein-coupled receptors. Molecular Biology of the Cell. 19 (4), 1540-1547 (2008).
- Brailov, I., et al. Localization of 5-HT(6) receptors at the plasma membrane of neuronal cilia in the rat brain. Brain Research. 872 (1-2), 271-275 (2000).
- Domire, J. S., et al. Dopamine receptor 1 localizes to neuronal cilia in a dynamic process that requires the Bardet-Biedl syndrome proteins. Cellular and Molecular Life Sciences. 68 (17), 2951-2960 (2011).
- Handel, M., et al. Selective targeting of somatostatin receptor 3 to neuronal cilia. Neuroscience. 89 (3), 909-926 (1999).
- Koemeter-Cox, A. I., et al. Primary cilia enhance kisspeptin receptor signaling on gonadotropin-releasing hormone neurons. Proceedings of the National Academy of Sciences of the United States of America. 111 (28), 10335-10340 (2014).
- Mukhopadhyay, S., et al. The ciliary G-protein-coupled receptor Gpr161 negatively regulates the Sonic hedgehog pathway via cAMP signaling. Cell. 152 (1-2), 210-223 (2013).
- Berman, S. A., Wilson, N. F., Haas, N. A., Lefebvre, P. A. A novel MAP kinase regulates flagellar length in Chlamydomonas. Current Biology. 13 (13), 1145-1149 (2003).
- Nguyen, R. L., Tam, L. W., Lefebvre, P. A. The LF1 gene of Chlamydomonas reinhardtii encodes a novel protein required for flagellar length control. Genetics. 169 (3), 1415-1424 (2005).
- Tam, L. W., Wilson, N. F., Lefebvre, P. A. A CDK-related kinase regulates the length and assembly of flagella in Chlamydomonas. Journal of Cell Biology. 176 (6), 819-829 (2007).
- O'Connor, A. K., et al. An inducible CiliaGFP mouse model for in vivo visualization and analysis of cilia in live tissue. Cilia. 2 (1), 8(2013).
- Bangs, F. K., Schrode, N., Hadjantonakis, A. K., Anderson, K. V. Lineage specificity of primary cilia in the mouse embryo. Nature Cell Biology. 17 (2), 113-122 (2015).
- Delling, M., et al. Primary cilia are not calcium-responsive mechanosensors. Nature. 531 (7596), 656-660 (2016).
- Saggese, T., Young, A. A., Huang, C., Braeckmans, K., McGlashan, S. R. Development of a method for the measurement of primary cilia length in 3D. Cilia. 1 (1), 11(2012).
- Kobayashi, Y., Hamamoto, A., Saito, Y. Analysis of ciliary status via G-protein-coupled receptors localized on primary cilia. Microscopy. 69 (5), 277-285 (2020).
- Zhou, L. Q., et al. Artificial intelligence in medical imaging of the liver. World Journal of Gastroenterology. 25 (6), 672-682 (2019).
- Naugler, C., Church, D. L. Automation and artificial intelligence in the clinical laboratory. Critical Reviews in Clinical Laboratory Sciences. 56 (2), 98-110 (2019).
- Dunn, K. W., Kamocka, M. M., McDonald, J. H. A practical guide to evaluating colocalization in biological microscopy. American Journal of Physiology-Cell Physiology. 300 (4), 723-742 (2011).
- Bansal, R., et al. Hedgehog Pathway Activation Alters Ciliary Signaling in Primary Hypothalamic Cultures. Frontiers in Cellular Neuroscience. 13, 266(2019).
- Jin, H., et al. The conserved Bardet-Biedl syndrome proteins assemble a coat that traffics membrane proteins to cilia. Cell. 141 (7), 1208-1219 (2010).
- Liew, G. M., et al. The intraflagellar transport protein IFT27 promotes BBSome exit from cilia through the GTPase ARL6/BBS3. Developmental Cell. 31 (3), 265-278 (2014).
- Engle, S. E., et al. A CreER Mouse to Study Melanin Concentrating Hormone Signaling in the Developing Brain. Genesis. , (2018).
- Thorpe, S. D., et al. Reduced primary cilia length and altered Arl13b expression are associated with deregulated chondrocyte Hedgehog signaling in alkaptonuria. Journal of Cellular Physiology. 232 (9), 2407-2417 (2017).
- Lauring, M. C., et al. New software for automated cilia detection in cells (ACDC). Cilia. 8, 1(2019).
- Dummer, A., Poelma, C., DeRuiter, M. C., Goumans, M. J., Hierck, B. P. Measuring the primary cilium length: improved method for unbiased high-throughput analysis. Cilia. 5, 7(2016).
- Haycraft, C. J., et al. Gli2 and Gli3 localize to cilia and require the intraflagellar transport protein polaris for processing and function. PLoS Genetics. 1 (4), 53(2005).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유