Method Article
حقن ناقلات AAV لعلم البصريات الوراثي في الدماغ الرئيسيات غير البشرية المخدر والمستيقظ
In This Article
Summary
وكما هو مطبق حاليا، فإن علم البصريات الوراثي في الرئيسيات غير البشرية يتطلب حقن النواقل الفيروسية في الدماغ. يجب أن تكون طريقة الحقن المثلى موثوقة ، وبالنسبة للعديد من التطبيقات ، قادرة على استهداف المواقع الفردية ذات العمق التعسفي التي يتم تحديدها بسهولة وبشكل لا لبس فيه في علم الأنسجة بعد الوفاة. يتم تقديم طريقة حقن مع هذه الخصائص.
Abstract
أحدثت التقنيات البصرية الجينية ثورة في أبحاث علم الأعصاب وهي على وشك أن تفعل الشيء نفسه في العلاج الجيني العصبي. ومع ذلك ، فإن الاستخدام السريري لعلم البصريات الوراثي يتطلب إثبات السلامة والفعالية في النماذج الحيوانية ، ومن الناحية المثالية في الرئيسيات غير البشرية (NHPs) ، بسبب تشابهها العصبي مع البشر. عدد المتجهات المرشحة التي يحتمل أن تكون مفيدة لعلم الأعصاب والطب هائل ، ولا توجد حتى الآن وسائل عالية الإنتاجية لاختبار هذه النواقل. وبالتالي ، هناك حاجة إلى تقنيات لإجراء حقن متعددة دقيقة مكانيا وحجميا للناقلات الفيروسية في دماغ NHP والتي يمكن تحديدها بشكل لا لبس فيه من خلال علم الأنسجة بعد الوفاة. الموصوفة هنا هي مثل هذه الطريقة. يتم تصنيع قنيات الحقن من أنابيب البولي تترافلورو إيثيلين وأنابيب الفولاذ المقاوم للصدأ. هذه القنيبات قابلة للتعقيم ، ويمكن التخلص منها ، ولها أحجام تحميل منخفضة ، مما يجعلها مثالية لحقن محاليل ناقلات فيروسية باهظة الثمن وعالية التركيز. يملأ الزيت المعدني الخامل المصبوغ باللون الأحمر المساحة الميتة ويشكل غضروفا مفصليا مرئيا بمحلول متجه ، مما يسمح بقياس فوري ودقيق لمعدلات الحقن وأحجامه. يتم تحميل الزيت في الجزء الخلفي من القنية ، مما يقلل من خطر الحقن المشترك مع الناقل. يمكن تحميل Cannulas في 10 دقائق ، ويمكن إجراء الحقن في 20 دقيقة. هذا الإجراء مناسب تماما للحقن في الحيوانات المستيقظة أو المخدرة. عند استخدامه لتقديم ناقلات فيروسية عالية الجودة ، يمكن أن ينتج هذا الإجراء تعبيرا قويا عن البروتينات البصرية الجينية ، مما يسمح بالتحكم البصري في النشاط العصبي والسلوك في NHPs.
Introduction
عادة ما ينطوي علم البصريات الوراثي في الرئيسيات غير البشرية (NHPs) على حقن الناقل الفيروسي مباشرة في الدماغ. تعتمد فئة واحدة من النواقل المناسبة تماما لهذا التطبيق على الفيروس المرتبط بالغدي (AAV). تتكون هذه النواقل من قفيصة بروتين تحيط بجينوم الحمض النووي أحادي الخيط الذي يتكون بدوره من مروج ، وجين أوبسين ، واختياريا ، عناصر أخرى لترميز البروتين وتنظيم الجينات. وقد يسر التقدم المحرز في الاستنساخ الجزيئي التلاعب بهذه المكونات والجمع بينها من أجل تطوير ناقلات جديدة. وبالتالي ، فإن مجموعة ناقلات AAV التي يحتمل أن تكون مفيدة ل NHP البصريات الوراثية كبيرة وتنمو بسرعة.
في الوقت الحاضر ، تتطلب فائدة ناقل AAV لعلم البصريات الوراثي NHP الاختبار في الجسم الحي. وتشكل هذه الحقيقة عائقا كبيرا أمام التقدم. يجب استخدام الحيوانات بشكل مقتصد ، ويتطلب اختبار ناقلات متعددة في واحد وضع مواقع الحقن بحكمة بالنسبة للبنية العصبية وفصلها جيدا بالنسبة لانتشار الفيروس. يتطلب التقييم النسيجي الدقيق أن تكون الحقن دقيقة مكانيا وحجميا. تم تكييف تقنية الحقن المستخدمة سابقا للتوصيل البؤري للعوامل الدوائية1،2،3،4 وتبسيطها لإجراء مثل هذه الحقن. تقنية الحقن هذه غير مكلفة ، وتستخدم مكونات يمكن التخلص منها وتعقيمها ، ويمكن استخدامها في القرود المخدرة أو المستيقظة ، ويمكن استخدامها لاستهداف مناطق الدماغ المتنوعة من أي عمق. يصف البروتوكول التالي الإجراءات خطوة بخطوة لتصنيع المكونات التي يمكن التخلص منها وإجراء الحقن في دماغ NHP. تتم مناقشة مزايا وعيوب هذه التقنية.
Protocol
أجريت جميع التجارب وفقا لدليل رعاية واستخدام المختبر وتجاوزت الحد الأدنى من المتطلبات الموصى بها من قبل معهد الموارد الحيوانية المختبرية وجمعية تقييم واعتماد المنظمة الدولية لرعاية المختبرات. تم تقييم جميع الإجراءات والموافقة عليها من قبل لجنة رعاية واستخدام الحيوانات بجامعة واشنطن (UW IACUC protocol #4167-01). شارك في هذه الدراسة خمسة من المكاك الصحية (2 المكاكا مولاتا ، 3 المكاكا نيميسترينا ؛ الذكور 4-11 سنة). تم استخدام الأدوات والتقنيات المعقمة في جميع العمليات الجراحية.
1. صنع قنية (الشكل 1 أ)
- إعداد كل جزء
- قم بفك طرف إبرة تحت الجلد (30 جم ، طول 13 مم) باستخدام مطحنة قرص.
- قطع أنبوب من الفولاذ المقاوم للصدأ (30 جم ، القطر الداخلي = 0.16 مم ، القطر الخارجي = 0.31 مم) إلى طول مصمم خصيصا لعمق منطقة الدماغ المستهدفة (25 مم مناسب تماما لحقن السطح الظهري للقشرة الدماغية). باستخدام مطحنة القرص ، قم بشطب أحد طرفي الأنبوب المقطوع وقم بتنعيم الطرف الآخر. Deburr داخل الأنبوب مع بروش.
- اقطع أنابيب البولي تترافلورو إيثيلين (PFTE) (القطر الداخلي = 0.23 مم ± 0.02 مم ، الجدار = 0.23 مم ± 0.02 مم ، 1 مم يتوافق مع 42 nL ± 7 nL من السائل) إلى طول مناسب لكمية المحلول المتجه المراد تحميله (1 ميكرولتر من محلول المتجه يشغل 24 مم من الأنابيب). توهج طرفي أنبوب PTFE عن طريق إدخال إبرة تحت الجلد المخففة.
- أدخل الإبرة تحت الجلد المخففة حوالي 5 مم في أحد طرفي أنبوب PTFE. أدخل الطرف غير المشطوف من الأنبوب المصنوع من الفولاذ المقاوم للصدأ حوالي 5 مم في الطرف الآخر (الشكل 1A).
- قم بإجراء اختبار ما قبل الحقن. حقن المياه المصفاة من خلال محور الإبرة تحت الجلد من قنية. تأكد من خروج الماء من أنبوب الفولاذ المقاوم للصدأ المشطوف من الطرف وأن الماء لا يتسرب من أي من التقاطعين.
2. إجراء الحقن للحيوانات المخدرة
- التحضير للجراحة
- تعقيم الأدوات واللوازم الجراحية باستخدام الإجراءات الواردة في جدول المواد.
- إذا لزم الأمر، خذ التصوير بالرنين المغناطيسي للرأس لاستهداف هياكل الدماغ العميقة (الشكل 2A).
- مباشرة قبل الجراحة ، قم بتخدير الحيوانات بالكيتامين (10-15 مجم / كجم) وإعطاء المضادات الحيوية (سيفازولين) والمسكنات (البوبرينورفين المستدام والميلوكسيكام) في العضل. ثم، قم بتوصيل البروبوفول عن طريق القسطرة الوريدية (IV) في الأوردة الصافية أو الرأسية.
- تنبيب الحيوان ونقله إلى غاز الايزوفلوران. تأكد من التخدير المناسب عن طريق استقرار معدل ضربات القلب وضغط الدم ومعدل التنفس واسترخاء العضلات الهيكلية وعدم وجود ردود فعل جحوب أو انسحاب.
- حلق رأس الحيوان. ضع مرهم مسيل للدموع الاصطناعي على القرنيات لمنع التجفيف.
- إعداد منطقة الحقن
- ضع رأس الحيوان في الإطار المجسم. ضع محلول فرك جراحي على الجلد الحليق باستخدام إسفنج الشاش ، وقم بتطبيق ضغط لطيف لإطلاق أي حطام ، وشطفه بكحول الأيزوبروبيل. كرر هذه العملية ثلاث مرات. تغطية الحيوان مع ستارة معقمة fenested. شق الجلد وتعكس العضلات. ضع المتلاعب على الذراع المجسمة ، وضعه لاستهداف منطقة الدماغ المستهدفة ، ووضع علامة على موضع بضع القحف على الجمجمة بقلم معقم.
- قم بإزالة المتلاعب المجسمة وقم بإجراء بضع القحف. شق الجافية إذا رغبت في ذلك (على سبيل المثال ، لتصور المعالم الكبريتية). أعد المتلاعب إلى الذراع المجسمة.
- تحميل محلول المتجه (الشكل 1C)
- انقل المحلول المتجه برفق إلى أنبوب PCR معقم باستخدام ماصة P20 ، وتجنب الفقاعات.
- قم بإرفاق قنية ، مع توجيه الطرف المشطوف لأسفل ، بحامل ستيريوتاكسي موجه رأسيا. قم بتوصيل حقنة Luer-lock سعة 1 مل بمحور الإبرة تحت الجلد في الكانيولا.
- اغمر الطرف المشطوف من القنية في محلول المتجه.
ملاحظة: يجب إرفاق المحقنة بالفعل ؛ إن إرفاقه في هذه المرحلة من شأنه أن يدخل فقاعات في محلول المتجهات. - قم بتحميل المحلول في القنية عن طريق تطبيق ضغط سلبي لطيف باستخدام حقنة 1 مل. تتبع بصريا الغضروف المفصلي بين الحل والهواء.
- بمجرد تحميل محلول المتجه ، استمر في الضغط السلبي اللطيف حتى يصل المحلول إلى محور الإبرة. قم بإزالة حقنة 1 مل وحقن الزيت المعدني الملون في محور الإبرة تحت الجلد.
ملاحظة: يجب حقن الزيت ببطء على طول الجدار الداخلي لمحور الإبرة لتشكيل غضروف مفصلي واضح مع محلول المتجه ولتجنب فقاعات الهواء. - قم بتوصيل محور الإبرة تحت الجلد بأحد المنفذين المفتوحين لجهاز إيقاف Luer-lock في 3 اتجاهات.
ملاحظة: سيؤدي ربط الإبرة تحت الجلد بالمنفذ المغلق إلى ضغط هواء غير مرغوب فيه خلف الزيت. - أغلق المنفذ المتصل بمحور الإبرة تحت الجلد ، واملأ حقنة 1 مل بالهواء ، وقم بتوصيلها بأي من المنفذين الآخرين. أخيرا ، أغلق المنفذ المتبقي من السدادة لتوصيل المحقنة بالقنية.
- ادفع الهواء ببطء إلى الكانيولا. بمجرد ظهور الزيت الملون عند طرف الإبرة الحادة في أنبوب PTFE ، تحقق من وجود هواء بين المحلول والزيت الملون.
- في حالة وجود الهواء ، ضع ضغطا سلبيا على المحقنة لإعادة الزيت الملون إلى محور الإبرة. قم بإزالة الفقاعة وتطبيق ضغط إيجابي حتى تظهر قطرة من محلول المتجه عند طرف القنية المشطوف.
- قم بإزالة حقنة 1 مل لإطلاق ضغط الهواء غير المرغوب فيه خلف الزيت وأغلق السدادة لمنع المتجه من الخروج من القنية عن طريق الجاذبية.
- قم بلصق مسطرة بلاستيكية بأنبوب PTFE لقياس حركة الغضروف المفصلي أثناء الحقن (الشكل 1B و D و F).
- إدخال قنية في منطقة الدماغ المستهدفة (الشكل 1B)
- قم بلصق القنية على المتلاعب المجسم.
- انقل أنبوب المضخة يدويا (الذي ينتهي في موصل Luer-lock) من المساعد غير المعقم إلى الجراح. يجب على الجراح الإمساك بموصل Luer-lock من خلال جدار الأكمام المعقمة ، وتثبيت سدادة معقمة ثانية على الموصل ، وربط الأكمام بإحكام حوله ، ثم إسقاط طوق الأكمام ، مما يسمح له بالتمدد على طول الأنبوب عن طريق الجاذبية.
- قم بتوصيل السدادة المرفقة بأنبوب القنية ب stopcock المتصل بمضخة الهواء. اضبط مضخة الهواء على الضغط المنخفض ، وقم بتشغيلها ، وقم بزيادة الضغط حتى يتقدم الزيت عبر القنية وتظهر قطرة من محلول المتجه عند طرف الكانيولا.
- اضبط موضع المسطرة البلاستيكية على أنبوب PTFE لقياس حركة الغضروف المفصلي أثناء الحقن.
- قم بدفع القنية لأسفل باستخدام المتلاعب المجسمة وسجل العمق الذي يصل إليه الطرف على السطح (dura أو pia mater).
- قم بقيادة القنية إلى أعمق موقع ليتم حقنه على طول المسار. سوف يغمر السطح. في حالة حقن القشرة السطحية، تأكد بصريا من أن القنية قد اخترقت السطح، باستخدام المجهر الجراحي أو اللوب المكبرة إن وجدت.
- لتقليل سوء الاستهداف بسبب ضغط الأنسجة ، قم بقيادة القنية ببطء (1 مم / دقيقة) ، أو بسرعة (0.5 مم / ثانية) مع انتظار لمدة 1-5 دقائق في الأسفل ، أو تجاوز أعمق موقع حقن بمقدار 500 ميكرومتر ثم تراجع.
- حقن
- حقن 0.5 ميكرولتر من محلول المتجه باستخدام مضخة الهواء الكهربائية التي تزيد عن 10-30 ثانية. تأكد من تدفق الحقن عن طريق تتبع الغضروف المفصلي بين الزيت الملون والمحلول المتجه في أنبوب PTFE.
- انتظر لمدة 1 دقيقة وتراجع القنية إلى موقع الحقن التالي على طول المسار.
- بعد الحقن النهائي ، اترك القنية في مكانها لمدة 10 دقائق لتجنب التدفق المتجه.
- سحب القنية والتخلص منها في حاوية حادة المخاطر البيولوجية.
- اختياريا، حقن كمية صغيرة (≤1 ميكرولتر) من الميكروبيدات الفلورية بالقرب من موقع حقن النواقل لتسهيل تحديد موقع الحقن بعد الوفاة.
- كرر هذا الإجراء حسب الرغبة لحلول المتجهات الأخرى في مواقع أخرى (الشكل 2B).
- إغلاق الجراحة
- خياطة الجافية، والعضلات، والجلد.
- قم بإزالة القرد من الإطار المجسم، وقم بإزالة جميع كابلات الشاشة.
- إزالة القرد من تخدير الايزوفلوران و extubate بعد عودة منعكس البلع.
- توفير العلاج بعد الجراحة (3-5 أيام من الميلوكسيكام و 7-10 أيام من سيفاليكسين). راقب الحيوان مرة واحدة على الأقل كل 10 دقائق حتى يتمكن من الحفاظ على وضع جلوس مستقيم مستقر.
3. الجراحة وحقن ناقلات AAV للحيوانات التي تتصرف مستيقظة (الشكل 1D)
ملاحظة: يمكن استخدام نوع مختلف من هذه التقنية لإجراء الحقن في أدمغة القرود المستيقظة ، التي تتصرف ، كما هو موضح أدناه.
- الحقن المتزامن مع التسجيل
- لتسجيل النشاط الكهربائي في موقع الحقن ، قم بتغطية الجزء الخارجي من القنية بالإيبوكسي (أسفل ~ 15 مم) وأنابيب البوليميد (الطول المتبقي). اكشف عن المعدن عند الطرف عن طريق كشط الإيبوكسي منه (Injectrode، الشكل 1F)2. بدلا من ذلك ، أدخل القنية وقطب كهربائي منفصل خارج الخلية ، جنبا إلى جنب ، في أنبوب توجيه مزدوج البرميل (أنبوب توجيه مزدوج البرميل ، الشكل 1E).
- إدخال قنية في منطقة الدماغ المستهدفة.
- ضع القرد في المقصورة التجريبية ، وتقييد حركة الرأس ، وتنظيف غرفة التسجيل المثبتة على الجمجمة باستخدام التقنيات القياسية.
- قم بتأمين أنبوب توجيه إلى محرك الأقراص الصغير. أدخل قنية الحقن في أنبوب التوجيه.
- تقدم القنية حتى يبرز الطرف من أنبوب التوجيه.
- قم بتوصيل السدادة بمضخة الهواء الكهربائية. لتأكيد وظيفة النظام المناسبة ، ادفع قطرة من محلول المتجه من الطرف باستخدام مضخة الهواء وتأكد من حركة الغضروف المفصلي لمحلول ناقلات النفط.
- اسحب القنية ~ 5 مم إلى أنبوب التوجيه لحمايتها من التلف أثناء إدخال الأنبوب في الدماغ. أدخل أنبوب التوجيه في الدماغ.
- قم بدفع القنية إلى الموقع ليتم حقنها باستخدام محرك الأقراص الصغير. تحديد الموقع المستهدف إما عن طريق التسجيل الكهربائي (الشكل 2C) أو التحفيز.
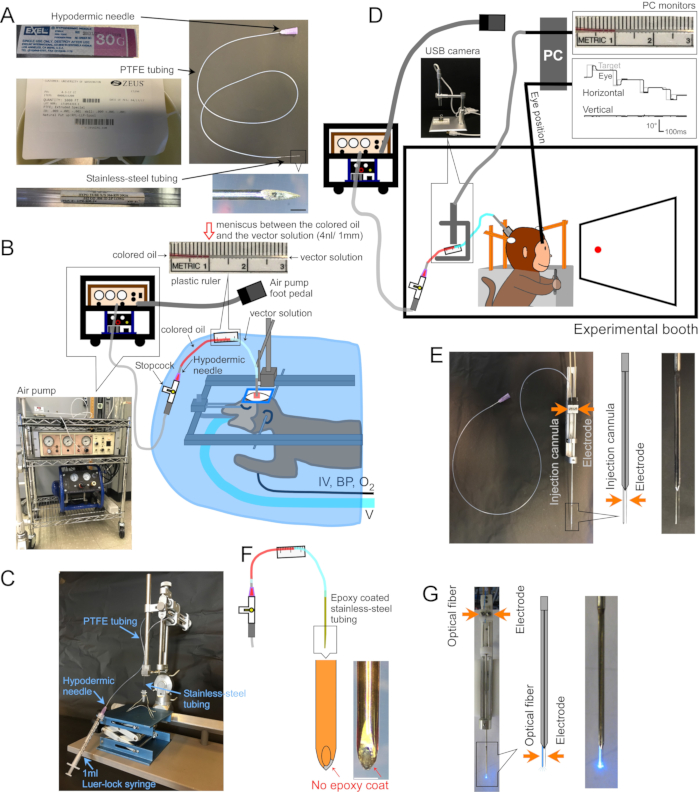
الشكل 1: إعداد الجراحة والجهاز . (أ) قنية الحقن. يشار إلى كل جزء من الكانيولا. مضمن في أسفل اليمين: صورة مكبرة لطرف القنية، شريط مقياس: 500 ميكرومتر. (ب) إعداد الجراحة للقرود المخدرة. يتم وضع القرد في إطار مجسمة تحت ستارة جراحية. يتم توصيل جهاز التنفس الصناعي (V) والخط الوريدي (IV) وجهاز مراقبة ضغط الدم (BP) وجهاز مراقبة تشبع الأكسجين (O2) بالقرد. يتم إدخال قنية الحقن في المنطقة المستهدفة باستخدام جهاز مناور مجسم. يتم حقن المحلول المتجه بواسطة مضخة هواء كهربائية (داخلية من أسفل اليسار ، بني) مقترنة بضاغط هواء (داخلي أسفل يسار ، أزرق). يتم لصق مسطرة بلاستيكية (الجزء الداخلي العلوي) على أنبوب PTFE لقياس حركة الغضروف المفصلي بين الزيت الملون (الجزء الداخلي العلوي ، الأحمر) والمحلول المتجه (الجزء الداخلي العلوي ، الواضح) أثناء الحقن. (ج) الإعداد لتحميل الحل المتجه في قنية. (د) أثناء حقن محلول ناقل في كشك تجريبي. يتم تثبيت رأس الحيوان في مكانه بواسطة ثلاث وظائف تثبيت ، ويتم تسجيل موضع العين بواسطة نظام ملف البحث الصلب. يتم تثبيت قنية الحقن ودفعها إلى العمق المستهدف باستخدام حامل / سائق قطب كهربائي صغير. يتم التحكم في الحقن عن طريق مراقبة الغضروف المفصلي بين الزيت الملون ومحلول المتجه من خلال كاميرا USB (صورة مضمنة). (ه) حقن أنبوب التوجيه مزدوج البرميل. حامل / سائق أنبوب توجيه مزدوج البرميل يحمل قنية حقن وقطب كهربائي دقيق (انظر المضمن). (و) الحقن. المعدن الموجود في طرف القنية ، المكشوف عن طريق كشط معطف الإيبوكسي ، يوفر الوصول الكهربائي إلى الخلايا العصبية (مدمج ، شريط مقياس: 500 ميكرومتر). (ز) إعداد التحفيز بالليزر. يحمل حامل/سائق أنبوب التوجيه مزدوج الأسطوانة كلا من الألياف البصرية والقطب الكهربائي الدقيق (انظر المضمن). يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
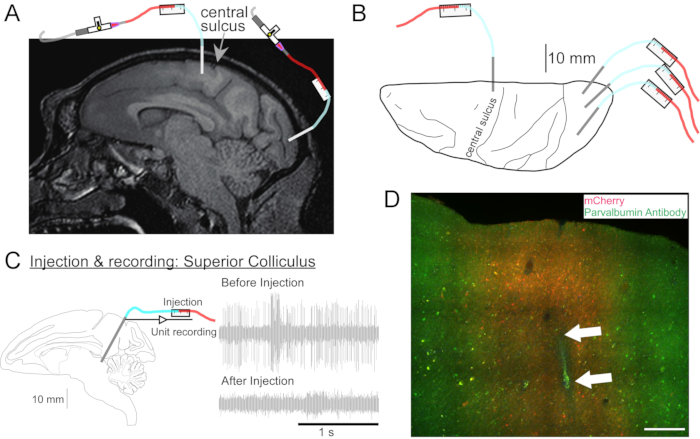
الشكل 2: رسم تخطيطي لمواقع حقن AAV . (أ) قسم القوس من صورة التصوير بالرنين المغناطيسي للدماغ يظهر مواقع الحقن في القشرة الحركية الأولية والقشرة البصرية الأولية ل Macaca nemestrina. (ب) منظر من السطح الظهري على صفيحة أطلس المقابلة يظهر موضع القنية بالنسبة إلى التلم المركزي (القشرة الحركية الأولية) والقشرة البصرية الأولية. (ج) وحدة التسجيل عن طريق الحقن في كوليكولوس العليا. اختفت الوحدة التي تم عزلها قبل الحقن (الجزء العلوي الأيمن) بعد الحقن (الجزء السفلي الأيمن). (د) مسار الحقن (الأسهم البيضاء). شريط المقياس: 500 ميكرومتر. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
4. معالجة أنسجة المخ لعلم الأنسجة
- انتظر 6-8 أسابيع بعد الحقن لتحقيق أقصى قدر من التعبير الجيني المتغير.
ملاحظة: تعتمد المدة المثلى على الناقل الفيروسي الدقيق المستخدم في التجربة. - معالجة الدماغ باستخدام التقنيات النسيجية التقليدية لتقييم كفاءة النقل والانتقائية5،6،7.
النتائج
لإثبات التعبير الجيني المحور عن طريق الحقن المجسمة في الجسم الحي في دماغ NHP باستخدام طريقة الحقن الجراحية الموضحة هنا ، تم اختيار اثنين من النواقل التي تحتوي على معززات تقود التعبير عن بروتين الفلورسنت الأصفر الفائق -2 (SYFP2) في أنواع الخلايا العصبية المتميزة 8,9. تم تعبئة النواقل الفيروسية في قفيصة PHP.eB10 ، التي تم تنقيتها بواسطة الطرد المركزي لليوديكسانول ، ثم تركزت إلى عيار عال (>1E13 الجينوم الفيروسي / مل) كما تم قياسه بواسطة qPCR. تم حقن حجم 0.5 ميكرولتر في كل من الأعماق العشرة على طول عشرة مسارات عبر القشرة الدماغية لحجم حقن إجمالي قدره 5 ميكرولتر / مسار. يوضح الشكل 3A-C تعبير SYFP2 عن طريق التلطيخ المناعي المضاد ل GFP بعد 113 يوما من حقن متجه AAV الخاص بالفئة الفرعية PVALB ، CN2045 ، في القشرة البصرية الأولية لذكر بالغ من المكاكا نيميسترينا. تم الكشف عن الجين المتحول SYFP2 بقوة في العديد من الخلايا العصبية غير الهرمية المنتشرة عبر العمق القشري ، وكانت معظم الخلايا العصبية المعبرة عن SYFP2 أيضا مناعية ل PVALB7. يوضح الشكل 3D تعبير SYFP2 الأصلي في القشرة الحركية الأولية بعد 64 يوما من حقن متجه AAV الخاص بالفئة الفرعية للخلايا العصبية L5 ، CN2251. تحتوي جميع الخلايا العصبية التي تحمل علامة SYFP2 على مورفولوجيا هرمية واضحة مع سوماتا تقتصر على الطبقة 5 والتشعبات القمية السميكة المميزة. تظهر هذه البيانات بشكل لا لبس فيه التحكم الدقيق في التعبير الجيني المحور في مجموعات مختارة من الخلايا العصبية القشرية الجديدة في دماغ NHP عن طريق الحقن المجسمة لنوع الخلايا التي تستهدف ناقلات AAV.
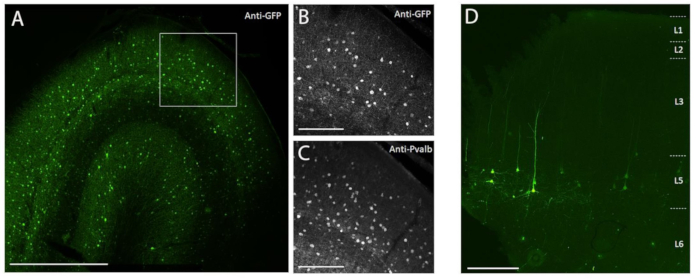
الشكل 3: مثال على تعبير SYFP2 الخاص بنوع الخلية بوساطة متجهات AAV التي يتم حقنها في دماغ NHP . (A) التصوير المجهري الضوئي اللامع لمقطع ثابت من قشرة المكاك البصرية الأولية بعد 113 يوما من حقن متجه AAV خاص بفئة PVALB. شريط الميزان: 1 مم. (ب، ج) صورة تكبير أعلى للمنطقة المربعة تظهر في A. (ب) إشارة مضادة ل GFP. (ج) إشارة مضادة ل PVALB. أشرطة المقياس: 250 ميكرومتر (D) التصوير المجهري الضوئي Epifluororescence من التألق الأصلي SYFP2 في قسم ثابت من قشرة المكاك الحركية الأولية بعد 64 يوما من حقن متجه AAV خاص بالطبقة 5 خارج الدماغ. شريط المقياس: 500 ميكرومتر. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
لإثبات فائدة تقنية الحقن هذه للتلاعبات البصرية الفسيولوجية العصبية والسلوكية ، تم إجراء ثلاث تجارب ، كل منها على مختلف (Macaca mulatta). في التجربة الأولى (الشكل 4A-D) ، تم حقن ناقلات AAV التي تحمل الجين المحوري channelrhodopsin-2 (AAV1-hSyn1-ChR2-mCherry) في كوليكولوس العلوي الأيسر (SC). تم حقن المتجه كل 250 ميكرومتر على عمق 19 لما مجموعه 12 ميكرولتر. في التجربة الثانية (الشكل 4E-G) ، تم حقن 3 ميكرولتر من محلول AAV1-hSyn-ArchT-EYFP في النواة الشبكية tegmenti pontis (NRTP). في التجربة الثالثة (الشكل 4H-K) ، تم حقن 24 ميكرولتر من محلول AAV9-L7-ChR2-mCherry في قشرة المخيخ 6. بعد ستة إلى ثمانية أسابيع من كل حقنة ، تم إدخال ألياف بصرية وقطب التنغستن في الدماغ عبر أنبوب توجيه مزدوج البرميل (الشكل 1G).
يوضح الشكل 4B استجابة خلية عصبية SC للضوء الأزرق (450 نانومتر). أنتج الضوء المستمر (1.2 ثانية) عند 40 ميجاوات سلسلة من إمكانات الحركة المتتالية (الشكل 4B ، الأعلى). فشلت نبضات الضوء التي تبلغ مدتها 1 مللي ثانية في استحضار إمكانات الفعل عند 40 ميجاوات (الشكل 4B ، الوسط) ولكنها استحضرت إمكانات الحركة بشكل موثوق عند 160 mW ، وهو مستوى الطاقة الآخر الوحيد الذي تم اختباره ، مع زمن انتقال يبلغ 2.7 ± 0.6 مللي ثانية (الشكل 4B ، أسفل). أثار قطار النبض (160 ميجاوات، التردد: 300 هرتز، دورة العمل: 15٪، المدة: 300 مللي ثانية) السكاديس بشكل متسق بمتوسط زمن انتقال يبلغ 97 ± 32 مللي ثانية، ومتوسط سعة 10.4 درجة ومتوسط زاوية 47 درجة (صعودا ويمينا؛ ومتوسط سعة يبلغ 10.4 درجة، ومتوسط زاوية 47 درجة (صعودا ويمينا؛ ومتوسط سعة يبلغ 10.4 درجة، ومتوسط زاوية 47 درجة (صعودا ويمينا؛ ومتوسط سعة يبلغ 10.4 درجة، ومتوسط زاوية 47 درجة (صعودا وهبوطا؛ ومتوسط سعة؛ ومتوسط زمن انتقال يبلغ 47 درجة؛ ومتوسط زمن انتقال يبلغ 97 و32 مللي ثانية، ومتوسط سعة يبلغ 10.4 درجة، ومتوسط زاوية يبلغ 47 درجة (صعودا ويمينا؛ ومتوسط سعة دوران يبلغ 10.4 درجة، ومتوسط زاوية 47 درجة (صعودا ويمينا؛ ومتوسط سعة 10.4 درجة، ومتوسط زاوية 47 درجة (صعودا الشكل 4 جيم).
وتمشيا مع الدراسات التي عدلت كسب الساكيد باستخدام التحفيز الكهربائي دون العتبة ل SC 11,12 ، فإن التحفيز البصري ل SC بعد 15 ° و18 ° و 20 ° يسارا وهبوطا (225 °) يقلل تدريجيا من اكتساب الساكيد (الشكل 4D). تطلب هذا الانخفاض في الكسب حوالي 250 تجربة (دوائر خضراء) للعودة إلى كسب ما قبل التكيف (الدوائر السوداء) ، مما يؤكد أساسه في اللدونة على المدى الطويل.
في التجربة الثانية (الشكل 4E) ، تم قمع إسقاط الألياف الطحلبية من NRTP إلى الفيرميس الحركي العيني (OMV) للقشرة المخيخية (الفصيصات VIc و VII) بصريا. يوضح الشكل 4F الألياف الطحلبية والورود ذات العلامات الفلورية في OMV (داخلي). تم تسليم ضوء الليزر الأصفر (589 نانومتر) إلى OMV عبر الألياف البصرية ، وتم استخدام قطب التنغستن القريب لتسجيل نشاط خلية Purkinje. يوضح الشكل 4G نشاط الارتفاع البسيط قبل (رمادي) وبعد (برتقالي) التعطيل البصري الجيني لإسقاطات NRTP (الشكل 4G ، الأعلى). قبل التعطيل ، أظهرت خلية Purkinje نمط انفجار مزدوج ل 12 درجة من السكادات اليمنى (الشكل 4G ، الوسط ، الرمادي). أثناء التعطيل ، انخفض معدل إطلاق النار وتغير إلى نمط توقف مفاجئ (الشكل 4G ، الوسط ، البرتقالي). تشير مقارنة هذين النمطين من الاستجابة إلى أن مدخلات الألياف الطحلبية إلى خلايا Purkinje تؤثر على مرحلة تباطؤ الساكيد عن طريق قيادة الانفجار الثاني (الشكل 4G ، الوسط ، الأخضر). تم تقليل تباين السكاديس إلى اليمين أثناء التعطيل البصري الوراثي ، بما يتفق مع فكرة أن بعض التباين من تجربة إلى تجربة في مقاييس الساكيد يرجع إلى التباين في الإشارات التي تحملها الألياف الطحلبية (الشكل 4G ، القاع ، البرتقالي).
في التجربة الثالثة (الشكل 4H) ، تم تحفيز خلايا Purkinje من OMV بصريا (الشكل 4I). زاد قطار من نبضات الضوء القصيرة (نبضات 1.5 مللي ثانية ، 65 ميجاوات ، 50 هرتز) من نشاط الارتفاع البسيط لخلية Purkinje معزولة (الشكل 4J ، الأعلى). غالبا ما تثير نبضات الضوء الفردية التي تبلغ 1.5 مللي ثانية >1 ارتفاع بسيط (الشكل 4J ، الأسفل). تنشيط السنبلة البسيطة البصرية الجينية ، الذي تم توقيته ليحدث أثناء الساكيد (نبضة ضوئية 10 مللي ثانية ، 60 ميجاوات) ، وزيادة سعة الساكيد (الشكل 4K) ، مما يؤكد الدور المثبط لخلايا Purkinje على مولد الانفجار الحركي العيني.
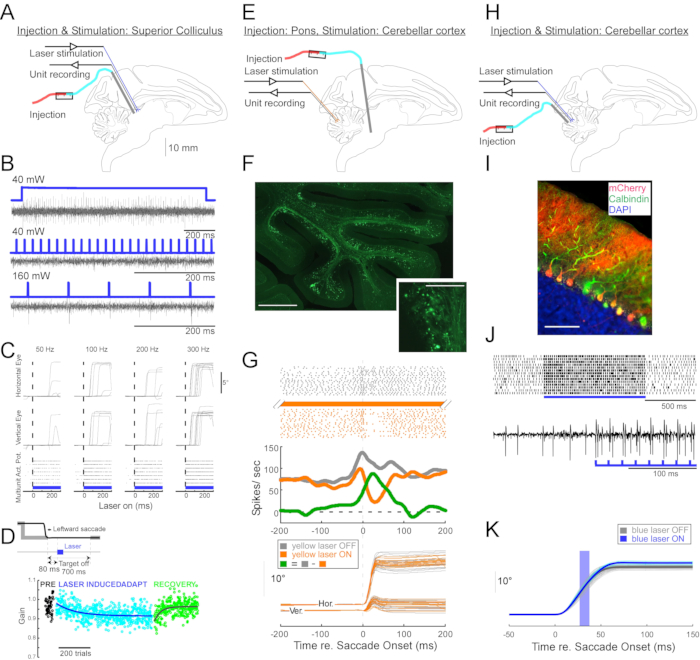
الشكل 4: ملخص ثلاث تجارب بصرية جينية أجريت على القرود المستيقظة. (A-D) أجريت التجربة 1 ، الإثارة العصبية الشاملة: الحقن الفيروسي ، والتحفيز بالليزر ، وتسجيل الوحدة في كوليكولوس العليا (A). (ب) نشاط الوحدة التمثيلية الناجم عن التحفيز بالليزر. (C) ، المكونات الأفقية (العليا) والرأسية (الوسطى) لحركات العين والمخطط النقطي لنشاط الوحدة (أسفل) التي يثيرها التحفيز بالليزر. (د) جلسة تمثيلية للتكيف مع الساكيد الناجم عن التحفيز بالليزر. تم تسليم التحفيز (100 نبضة ليزر 0.5 مللي ثانية) 80 مللي ثانية بعد كل ساكيد (مضمن). انخفض كسب Saccade (سعة الساكيد / سعة الهدف) تدريجيا عبر التجارب. (ه-ز) التجربة 2 ، تثبيط المسار المحدد: تم حقن ناقل فيروسي في النواة الشبكية tegmenti pontis ، وتم إجراء التحفيز بالليزر وتسجيل الوحدة في فيرميس حركي العين (E). (و) القسم النسيجي من الفيرميس الحركي العيني الذي يظهر ألياف الطحالب المصنفة (شريط الميزان: 1 مم) وورداتها (مضمن، شريط مقياس: 100 ميكرومتر). (ز) نشاط خلية بوركينجي (أعلى: نقطي، وسط: متوسط معدل إطلاق النار) ومسارات السكاديس الموجهة بصريا (أسفل) مع وبدون تحفيز الليزر. الرمادي: تجارب إيقاف تشغيل الليزر، البرتقالي: الليزر في التجارب، الأخضر: الفرق بين الرمادي والبرتقالي. (H-K) التجربة 3 ، التنشيط الخاص بنوع الخلية: تم إجراء الحقن الفيروسي ، والتحفيز بالليزر ، وتسجيل الوحدة في فيرميس حركي العين (H). (I) القسم النسيجي من الفيرميس الحركي العيني الذي يظهر خلايا Purkinje المسماة. شريط المقياس: 100 ميكرومتر (J) نشاط ارتفاع بسيط لخلية Purkinje يثيره التحفيز بالليزر. الجزء العلوي: مخطط نقطي من 14 تجربة. أسفل: تتبع الجهد من تجربة تمثيلية واحدة. (ك) مسارات السكاديس الموجهة بصريا مع وبدون التحفيز بالليزر. زادت نبضة الضوء التي تبلغ 10 مللي ثانية أثناء السكاديس من سعات الساكيد. مسارات الساكيد الفردية (سماوية) ومتوسطها (أزرق) في تجارب الليزر. مسارات الساكيد الفردية (الرمادي الفاتح) ومتوسطها (الرمادي الداكن) في تجارب إيقاف الليزر. كان الطول الموجي للضوء 450 نانومتر في التجربتين 1 و 3 وكان 589 نانومتر في التجربة 2. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
Discussion
وقد أدى التقدم في علم البصريات الوراثي NHP إلى خلق حاجة إلى طرق حقن دقيقة وموثوقة داخل الجمجمة. مزايا الطريقة الموصوفة في هذا التقرير هي أنها غير مكلفة ، وتستخدم مكونات معقمة ويمكن التخلص منها ، ولديها القدرة على استهداف مناطق الدماغ المتنوعة من أي عمق. كما يسمح بالتحكم في سرعة الحقن وحجمه بحكم السرعة التي يمكن بها التحكم في صمام الهواء. يمكن زيادة ضغط الهواء بشكل عابر لإزاحة انسداد ثم تقليله بسرعة لتجنب الإفراط في الحقن اللاحق الذي قد ينتج عن الضغط المستمر. تقلل المكونات التي تستخدم لمرة واحدة من خطر التلوث المتبادل بين مواقع الحقن.
تشمل الخطوات الحاسمة في بروتوكول الحقن هذا بناء قنيات عالية الجودة ، وتحميلها دون إدخال فقاعات ، واختيار مواقع الحقن التي ليست قريبة جدا من بعضها البعض. عادة ما تؤدي الحقن التي ≥1 سم إلى نقل مناطق غير متداخلة ، ولكن هذا الاستدلال يعتمد على النمط المصلي الفيروسي ، والعيار ، والمروج ، والحجم ، والهدف ، وطريقة الكشف. إن اختيار مواقع الحقن غير المتصلة مباشرة يتجنب الارتباكات المحتملة الناتجة عن الاتجار بالأوبسين على طول المحاور العصبية وميل بعض الأنماط المصلية AAV للنقل الرجعي.
يمكن استخدام هذه الطريقة لحقن NHPs أثناء التخدير وفي إطار مجسمة (الشكل 3) أو تنبيه وتثبيت الرأس (الشكل 4). الأول لديه ميزة السماح باستهداف الحقن في إحداثيات مجسمة ، ويسمح بتأكيد بصري لاختراق القنية من خلال استئصال القرنية الحاد (شق الجافية في مستيقظ ، من خلال بضع القحف المزمن ، يزيد من خطر العدوى). يتميز النهج الأخير بمزايا تقليل عدد جراحات البقاء على قيد الحياة وبالتالي الضغط على الحيوان ، كونه متوافقا مع التسجيلات الكهروفسيولوجية أثناء السلوك ، واستخدام نفس الإطار الإحداثي والأجهزة المستخدمة لإدخال الألياف البصرية لتجارب ما بعد الحقن. يمكن تحسين تقنية الحقن في القرود المستيقظة عن طريق إجراء الحقن من خلال الجافية الاصطناعية13،14،15. وهذا من شأنه أن يمنح مزايا إضافية للتصور المباشر لمواقع الحقن وتألق الأنسجة الذي يشير إلى النقل الناجح.
تم استخدام العديد من تقنيات حقن AAV الأخرى في NHPs. في الآونة الأخيرة ، تم تطوير جهاز حقن متعدد القنوات لتوصيل ناقلات AAV بشكل موحد إلى المناطق القشرية NHP الكبيرة16. يمكن الحصول على نتائج مماثلة باستخدام التسليم المعزز بالحمل الحراري17,18. تهدف هذه الطرق إلى زيادة انتشار النقل إلى أقصى حد ، وهو هدف مهم ولكنه يختلف عن الدقة المكانية التي تهدف طريقتنا إلى تحقيقها.
طريقة بديلة أخرى هي حقن ناقلات AAV من خلال أنابيب البورسليكات التي يتم شطبها إلى طرف حاد على أحد طرفيها وربطها بحقنة هاميلتون علىالطرف الآخر 5,6. هذه الطريقة لديها الكثير من القواسم المشتركة مع الطريقة الموضحة في هذه الورقة. يتم الاحتفاظ بالناقل الفيروسي في طول الأنابيب ، ويتم ملء المساحة الموجودة في الأنابيب خلف الفيروس بالزيت المصبوغ ، ويتم رصد تدفق الناقل عن طريق حركة الغضروف المفصلي الناقل للنفط. تتطلب هذه التقنية البديلة معدات وتحضيرا أقل ، ولكنها تتطلب سحب الزيت إلى أنابيب البورسليكات من خلال الطرف المشطوف عن طريق الضغط السلبي وتحميل الناقل عبر نفس الطريق لاحقا. هذا يؤدي حتما إلى آثار النفط التي يتم تسليمها إلى الدماغ. بالإضافة إلى ذلك ، في تجربتنا ، يجب أن يكون قطر أنابيب البورسليكات ~ 350 ميكرومتر لاختراق الجافية حتى عندما تكون مشطوفة ، وبالتالي تسبب أضرارا ميكانيكية أكبر من القنية المعدنية الأرق الموصوفة في هذه الورقة (الشكل 2D). تم استخدام أنابيب 30 جم لأن حمل الإبزيم الحرج مرتفع بما يكفي للتوسط في اختراق الجافية على الرغم من طوله 1-10 سم ، لأنه يناسب أنبوب PTFE بإحكام ، ولأنه نادرا ما يصبح مسدودا. أنابيب 33 G تسد وتنحني بسهولة أكبر وأكثر صعوبة للتزاوج مع أنابيب PTFE. أنابيب 36 G ليست قاسية بما فيه الكفاية لاختراق NHP الأم الجافية.
تقنية حقن بديلة أخرى هي تزاوج خرج مضخة الهواء إلى الجزء الخلفي من ماصة زجاجية محملة بالمتجه ومسحوبة19. يتم إجبار المتجه من طرف الماصة عن طريق ضغط الهواء المباشر والمتقطع من المضخة ، مما يلغي الحاجة إلى الزيت. على غرار طريقة الأنبوب الواحد الموضحة أعلاه ، فإن عدم وجود أي تقاطعات مادية بين الغضروف المفصلي وطرف القنية يقلل من خطر التسرب. ومع ذلك ، فإن المستدق الحاد والنصائح الدقيقة للماصات الزجاجية تمنعها من اختراق NHP dura أو استهداف الهياكل العميقة.
Disclosures
ليس لدى المؤلفين ما يكشفون عنه.
Acknowledgements
تم دعم هذه الدراسة من قبل WaNPRC / ITHS P51OD010425 (JTT) ، ومنح المعهد الوطني للصحة (NIH) EY023277 (R01 ل YK) ، و EY030441 (R01 ل GH) ، و MH114126 (RF1 إلى JTT ، و Boaz Levi ، و Ed Lein) ، و MH120095 (UG3 ل JTT و GH) ، و EY028902 (R01 ل RS) ، وأصبحت ممكنة بفضل منح المعاهد الوطنية للصحة OD010425 (P51 ل WaNPRC) وصندوق أبحاث الملوك بجامعة واشنطن A148416. يود المؤلفون أن يشكروا ياسمين الشمايلة وفيكتوريا أومستيد على علم الأنسجة ، وريفوجيو مارتينيز على استنساخ النواقل الفيروسية ، وجون ميشيل على المساعدة في معالجة أنسجة المخ NHP.
Materials
| Name | Company | Catalog Number | Comments |
| Equipment: Stereotaxic set | |||
| Item | |||
| Allen keys | BONDHUS | 10936 | STERRAD |
| Cannula holder | KOPF | 1770 | STERRAD |
| Carrier (manipulator) | KOPF | 1404 | STERRAD |
| Carrier platform | KOPF | 1430 | NA |
| Carrier stand | KOPF | 1449 | STERRAD |
| Eye, ear, mouth bars | KOPF | 1430 | NA |
| Stereotaxic base | KOPF | 1210 | NA |
| Equipment: Cannula | |||
| Item | |||
| 1 mL Luer-lock syringes | BD | 309628 | NA (sterilized package) |
| Cannulas* | (homemade - see below) | NA | steam (autoclave) |
| Colored oil** | (homemade - see below) | NA | NA |
| Elevator (for tube rack) | Cole-Parmer | UX-08057-10 | STERRAD |
| Filter tip | Genesee Scientific | 23-404 | NA (sterilized package) |
| Fluorescent microbeads | Lumafluor | R170 | NA |
| P20 pipetman | Gilson | FA10003M | NA |
| PCR tubes | Olympus Plastics | 22-161 | STERRAD |
| Stopcock | Cole-Parmer | 3060004 | STERRAD |
| Tube rack | homemade | NA | STERRAD |
| Vector solution | (homemade) | NA | NA |
| Equipment: Electric air pump set | |||
| Item | |||
| Electric air pump | World Precision Instruments | PV830 | NA |
| Foot pedal | World Precision Instruments | 3260 | NA |
| Tube cover | EZ Drape | A400-1000 | NA (sterilized package) |
| Equipment: General surgery tools | |||
| Item | |||
| Beaker | MEDLINE | azlon | STERRAD |
| Burrs | STRYKER | 277-10-235 | STERRAD |
| Double pronged tissue pick | Fine Science Tools | 18067-11 | STERRAD |
| Drapes | MEDLINE | DYNJP3004 | NA (sterilized package) |
| Dressing forceps | Miltex | 6-118 | STERRAD |
| Drill | STRYKER | Q9R-5400 | NA |
| Drill bits | STRYKER | 277-82-87 | STERRAD |
| Gauze | MEDLINE | NON26334 | NA (sterilized package) |
| Hemostatic mosquito forceps | Miltex | 7-2, 7-4 | STERRAD |
| Light handles | SKYTRON | Stellar XL | STERRAD |
| Needle hodler | Miltex | 8-2 | STERRAD |
| Periosteal elevator | Miltex | 18-1968 | STERRAD |
| Rongeurs | Miltex | 17-4800 | STERRAD |
| Saline | BAXTER | 2F7122 | STERRAD |
| Scalpel | Bard-Parker | 372610 | STERRAD |
| Scissors | Miltex | 5-12, 5-114 | STERRAD |
| Senn retractors | Miltex | 28065 | STERRAD |
| Sterile gloves | MEDLINE | Triumph Micro | NA (sterilized package) |
| Suction | medela | 200-4869 | NA |
| Suction tip | MEDLINE | DYNDFR12S | NA (sterilized package) |
| Suction tube | COVIDEN | 8888301614 | NA (sterilized package) |
| Surgical gowns | MEDLINE | DYNJP2002S | NA (sterilized package) |
| Surgical pens & ruler | MEDLINE | DYNJSM03 | NA (sterilized package) |
| Suture | COVIDEN | SL-635 | NA (sterilized package) |
| Tissue forceps | Miltex | 6-114 | STERRAD |
| Towel clamps | Miltex | 7-504 | STERRAD |
| Wood swabs | MEDLINE | MDS202095 | NA (sterilized package) |
| Equipment: *cannulas | |||
| Item | |||
| Hypodermic needle | EXELINT INTERNATIONAL | 26437 | NA (sterilized package) |
| Stainless steel tube | K-TUBE | K30R | NA |
| PTFE tube | ZEUS | 216200 | NA |
| Equipment: **colored oil | |||
| Item | |||
| Liquid Candle Dye Concentrate | PremiumCraft | Red/Pink | NA |
| Mineral oil | Vi-Jon | S0883 | NA |
| STERRAD: low-temperature hydrogen peroxide gas plasma |
References
- Kojima, Y., Robinson, F. R., Soetedjo, R. Cerebellar fastigial nucleus influence on ipsilateral abducens activity during saccades. Journal of Neurophysiology. 111 (8), 1553-1563 (2014).
- Kojima, Y., Soetedjo, R. Elimination of the error signal in the superior colliculus impairs saccade motor learning. Proceedings of the National Academy of Sciences of the United States of America. 115 (38), 8987-8995 (2018).
- Kojima, Y., Soetedjo, R., Fuchs, A. F. Effects of GABA agonist and antagonist injections into the oculomotor vermis on horizontal saccades. Brain Research. 1366, 93-100 (2010).
- Kojima, Y., Soetedjo, R., Fuchs, A. F. Effect of inactivation and disinhibition of the oculomotor vermis on saccade adaptation. Brain Research. 1401, 30-39 (2011).
- De, A., El-Shamayleh, Y., Horwitz, G. D. Fast and reversible neural inactivation in macaque cortex by optogenetic stimulation of GABAergic neurons. eLife. 9, 52658 (2020).
- El-Shamayleh, Y., Kojima, Y., Soetedjo, R., Horwitz, G. D. Selective optogenetic control of Purkinje cells in monkey cerebellum. Neuron. 95 (1), 51-62 (2017).
- Mich, J. K., et al. Functional enhancer elements drive subclass-selective expression from mouse to primate neocortex. Cell Reports. 34 (13), 108754 (2021).
- Graybuck, L. T., et al. Enhancer viruses for combinatorial cell subclass-specific labeling. Neuron. (21), 00159 (2020).
- Michel, J., Benninger, D., Dietz, V., van Hedel, H. J. Obstacle stepping in patients with Parkinson's disease. Complexity does influence performance. Journal of Neurology. 256 (3), 457-463 (2009).
- Chan, K. Y., et al. Engineered AAVs for efficient noninvasive gene delivery to the central and peripheral nervous systems. Nature Neuroscience. 20 (8), 1172-1179 (2017).
- Kaku, Y., Yoshida, K., Iwamoto, Y. Learning signals from the superior colliculus for adaptation of saccadic eye movements in the monkey. Journal of Neuroscience. 29 (16), 5266-5275 (2009).
- Soetedjo, R., Fuchs, A. F., Kojima, Y. Subthreshold activation of the superior colliculus drives saccade motor learning. Journal of Neuroscience. 29 (48), 15213-15222 (2009).
- Kleinbart, J. E., et al. A modular implant system for multimodal recording and manipulation of the primate brain. Annual International Conference of the IEEE Engineering in Medicine and Biology Society. IEEE Engineering in Medicine and Biology Society. Annual International Conference. 2018, 3362-3365 (2018).
- Arieli, A., Grinvald, A., Slovin, H. Dural substitute for long-term imaging of cortical activity in behaving monkeys and its clinical implications. Journal of Neuroscience Methods. 114 (2), 119-133 (2002).
- Ruiz, O., et al. Optogenetics through windows on the brain in the nonhuman primate. Journal of Neurophysiology. 110 (6), 1455-1467 (2013).
- Fredericks, J. M., et al. Methods for mechanical delivery of viral vectors into rhesus monkey brain. Journal of Neuroscience Methods. 339, 108730 (2020).
- Bankiewicz, K. S., et al. Convection-enhanced delivery of AAV vector in parkinsonian monkeys; in vivo detection of gene expression and restoration of dopaminergic function using pro-drug approach. Experimental Neurology. 164 (1), 2-14 (2000).
- Yazdan-Shahmorad, A., et al. Widespread optogenetic expression in macaque cortex obtained with MR-guided, convection enhanced delivery (CED) of AAV vector to the thalamus. Journal of Neuroscience Methods. 293, 347-358 (2018).
- Nathanson, J. L., Yanagawa, Y., Obata, K., Callaway, E. M. Preferential labeling of inhibitory and excitatory cortical neurons by endogenous tropism of adeno-associated virus and lentivirus vectors. Neuroscience. 161 (2), 441-450 (2009).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved